Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157versão On-line ISSN 2590-7379
Biomédica v.28 n.2 Bogotá abr./jun. 2008
ARTÍCULO ORIGINAL
1 Grupo Salud y Comunidad, Universidad de Antioquia, Medellín, Colombia
2 Grupo Malaria, Universidad de Antioquia, Medellín, Colombia
Recibido: 10/08/07; aceptado: 14/11/07
Introducción. Las relaciones de la gametocitemia de Plasmodium falciparum con el tratamiento antipalúdico han sido poco estudiadas en América.
Objetivo. Describir relaciones de la gametocitemia falciparum con el tratamiento con amodiaquina-sulfadoxina-pirimetamina, artesunato-sulfadoxina-pirimetamina o amodiaquina-artesunato.
Materiales y métodos. Se usó un diseño experimental, aleatorio, no balanceado, no ciego. El seguimiento fue de 21 a 28 días. La eficacia terapéutica se clasificó según el protocolo de la Organización Mundial de la Salud, 1998.
Resultados.
Se evaluaron 241 pacientes en Turbo, El Bagre y Zaragoza (Antioquia, Colombia). El esquema de amodiaquina-sulfadoxina-pirimetamina tuvo igual eficacia que el de artesunato-sulfadoxina-pirimetamina y amodiaquina-artesunato para controlar las fallas terapéuticas el día 21. Hubo cuatro fallas (1,66%). El esquema de amodiaquina-sulfadoxina-pirimetamina fue menos eficaz que los tratamientos con artesunato para reducir la presencia de gametocitos. Al séptimo día, ninguno de los tres tratamientos había eliminado totalmente los gametocitos. La mayoría (56%) de nuestros pacientes no tenía gametocitos antes del tratamiento y nunca los desarrolló. El tiempo para eliminar los gametocitos que se tenían al iniciar el tratamiento no fue mayor cuando la gametocitemia inicial era mayor.
Conclusión.Los tres tratamientos fueron iguales en cuanto a eficacia terapéutica e incapacidad de eliminar los gametocitos en siete días.
Palabras clave: malaria/ terapia, malaria falciparum, Plasmodium falciparum, antipalúdicos, amodiaquina, sulfadoxina, pirimetamina, Artemisia annua.
Gametocytemia in falciparum malaria treated with amodiaquine or artesunate
Introduction. Antimalarial treatment effects on Plasmodium falciparum gametocytemia has been the focus of few studies in the Americas.
Objective. Relationships are described that occur between falciparum gametocytemia and the treatment with amodiaquine-sulfadoxine-pyrimethamine, artesunate-sulfadoxine-pyrimethamine or amodiaquine-artesunate.
Materials and methods. The experimental design consisted of a randomized selection of patients not balanced or blinded. A total of 241 patients were evaluated, residents of Turbo, El Bagre and Zaragoza (Antioquia, Colombia).The follow up occurred 21-28 days after antimalarial treatment. The World Health Organization (1998) protocol was used.
Results. The therapeutic efficacy of amodiaquine-sulfadoxine-pyrimethamine, artesunate-sulfadoxine-pyrimethamine and amodiaquine-artesunate were equal at day 21 of the follow up. Four cases (1.7%) were therapeutic failures. Amodiaquine-sulfadoxine-pyrimethamine was less effective than the artesunate treatments in reducing the gametocyte load. On day 7, none of the three traetments had eliminated completely the gametocytes. Most patients (56.0%) were observed not to have circulating gametocytes pre-treatment and did not develop them later.
Conclusion. The three treatment schemes were similar in their therapeutic efficacy and in their incapacity to eliminate gametocytes at day seven.
Key words: malaria/ therapy; malaria, falciparum; Plasmodium falciparum; antimalarials; amodiaquine; sulfadoxine; pyrimethamine; Artemisia annua.
La gametocitemia es la presencia de gametocitos en sangre periférica y para Plasmodium falciparum aparece 7 a 15 días después de la primera generación de parásitos asexuales (1,2), mientras que en otros plasmodios de humanos aparece en 1 a 3 días (3). La gametocitogénesis de este parásito produce cinco estadios celulares (I a V), de los cuales, únicamente el V corresponde a gametocitos maduros (4,5).
En la malaria por P. falciparum, el examen de sangre periférica generalmente revela sólo trofozoítos inmaduros (anillos) y gametocitos maduros V; todos los otros estadios están secuestrados en el lecho vascular profundo de órganos como el hígado y el bazo (6). En los cultivo in vitro de P. falciparum, los gametocitos V iniciales aparecen >8 a 10 días después de emerger de los esquizontes padre (7,8), lo que sugiere que, in vivo, los estadios I a IV pasan un mínimo de siete días secuestrados en los órganos (6). La vida media de los gametocitos maduros de P. falciparum en la sangre es de 2,4 días (9), pero hay datos de 6,4 días (2) y algunos gametocitos tienen una vida de hasta cuatro semanas en la sangre (9). Los estimativos de cuánto tiempo portan los pacientes infectados a los gametocitos son escasos (10).
La conversión de célula asexual a gametocito es afectada por factores del ambiente parasitario (11,12) y, entre ellos, están los medicamentos antipalúdicos, algunos de los cuales quizás la aumentan (cloroquina, sulfadoxina-pirimetamina) y otros la reducen (derivados de la artemisinina) (13-17).
Las tasas de portadores de gametocitos se deben vigilar cuando se ejecutan nuevas intervenciones antipalúdicas porque cualquier disminución en la intensidad de la transmisión puede afectar no sólo la cantidad o carga de la enfermedad, sino también, el patrón de la capacidad de producir infección (10). Hay pruebas nuevas que sugieren que las tasas de gametocitos son útiles para vigilar la intervención y son formas de alerta precoz y sensible de la emergencia de resistencia a los medicamentos (18). La comprensión de los mecanismos subyacentes de la gametocito-génesis y la respuesta inmune contra los gametocitos suministrará estrategias adicionales para una inhibición más efectiva o bloqueo de la transmisión (19).
Antipalúdicos y gametocitos de P. falciparum
La primaquina tiene amplio espectro de acción contra los plasmodios (20-22), tanto esporonticida como, sobre todo, gametocitocida y contra las formas asexuales hepáticas activas (trofozoítos) y latentes (hipnozoítos) (21,22). La actividad esporonticida, aunque todavía controvertida, parece ser clara y potente (23-29) y algo similar sucede con los efectos sobre gametocitos de Plasmodium vivax y, sobre todo, de P. falciparum (24,30-35). El efecto de la primaquina sobre la viabilidad de los gametocitos inmaduros es desconocido, pero reduce intensamente la viabilidad de los maduros; el efecto neto de la primaquina sobre la capacidad de los gametocitos de P. falciparum para causar infección a los mosquitos es muy elevado (+++/+++) (36). De acuerdo con Kshirsagar, 45 mg de primaquina reducen en 50% la prevalencia de gametocitos de P. falciparum y 60 mg la bajan 90% (valor similar a lo que hacen 75 mg de bulaquina) (37).
El actuar contra los esporozoítos es una clara forma de prevención primaria o causal del paludismo y también lo es actuar sobre los gametocitos, en el sentido de que se bloquea la cadena de transmisión y se evita que otros mosquitos y humanos se infecten. Estas dos formas de prevención primaria son diferentes de lo que algunos llaman profilaxis terminal o profilaxis posterior a la exposición o tratamiento presuntivo antirrecaídas, para describir el suministro de medicamentos antipalúdicos a personas que han estado expuestas a paludismo por cualquier especie.
Con el enfoque de quimioprofilaxis antipalúdica primaria con primaquina hemos hecho recientemente dos revisiones (20,38) y con el enfoque anterior más la profilaxis terminal conocemos otra (39).
Las 4-aminoquinolinas, como la cloroquina y la amodiaquina, tienen potente actividad contra los esquizontes sanguíneos de P. falciparum y P. vivax; la cloroquina reduce la viabilidad de los gametocitos jóvenes de P. falciparum secuestrados y tiene actividad elevada sobre los de P. vivax; no actúa sobre la viabilidad de los gametocitos maduros de P. falciparum y aumenta la capacidad de generar infección de los gametocitos para los anofelinos; en resumen, la cloroquina ejerce un moderado efecto (+/+++) sobre la supresión de la capacidad de producir infección, es decir, sobre los gametocitos (21,36).
Los derivados de la artemisinina, como el artesunato, son esquizonticidas y tienen actividad sobre los gametocitos de P. falciparum (40-45), reducen de forma importante la viabilidad de esos gametocitos jóvenes, tienen poco o nulo efecto sobre los gametocitos maduros y no se sabe cómo afectan la potencialidad infecciosa de los gametocitos para los anofelinos; en resumen, tienen un gran efecto sobre los gametocitos (36,46).
La mefloquina tampoco elimina los gametocitos maduros de P. falciparum, sino que evita el desarrollo posterior de esas células por su actividad contra sus precursores (46).
La sulfadoxina-pirimetamina es un potente esquizonticida sanguíneo y se sospecha que estimula la producción de gametocitos de P. falciparum (47-53) o eleva la viabilidad de los maduros (36); la sulfadoxina-pirimetamina suprime la capacidad de los gametocitos para infectar los anofelinos (36) y altera las razones de sexo de los gametocitos, lo que influye en la capacidad de causar infección a los mosquitos y la transmisión del paludismo (54); se considera que el efecto neto o global de la sulfadoxina-pirimetamina sobre la supresión de la capacidad de infectar es nulo (36).
Un informe sistemático reciente comparó la eficacia de la combinación amodiaquina-sulfadoxina-pirimetamina con artesunato-sulfadoxina-pirimetamina en cuanto a su capacidad para tratar el paludismo por P. falciparum no complicado y concluyó que los datos disponibles (cuatro estudios clínicos aleatorios en África) indicaban que la combinación amodiaquina-sulfadoxina-pirimetamina era más eficaz que la de artesunato-sulfadoxina-pirimetamina para controlar las fallas del tratamiento en el día 28, pero menos eficaz que la de artesunato-sulfadoxina-pirimetamina para reducir la presencia de gametocitos el séptimo día (55), pero, también fue claro que la de amodiaquina-sulfadoxina-pirimetamina demostraba actividad contra los gametocitos.
Hay estudios epidemiológicos que sugieren que la presión medicamentosa posterior al uso de antipalúdicos sin actividad gametocitocida inmediata también puede aumentar la producción de esas células sexuales y la transmisión de P. falciparum (56-59), pero no es claro si la elevada prevalencia de gametocitos observada después del uso de antipalúdicos contra P. falciparum se debe a la inducción de la gametocitogénesis por el fármaco o si es consecuencia de la supervi-vencia y maduración posterior al tratamiento de la células ya existentes (60).
En los pacientes tratados con cloroquina o con sulfadoxina-pirimetamina hubo un aumento significativo del estado de portador de gametocitos posterior a la terapia, que alcanzó el máximo entre los días 7 y 14, según lo reveló la microscopía, pero no hubo diferencia significativa entre la medición antes del tratamiento y otras en los días 7 o 14 según la reacción en cadena de la polimerasa en tiempo real; los autores concluyeron que las infecciones con parásitos resistentes al medicamento tienden a producir mayor gametocitemia que aquéllas debidas a parásitos sensibles (60).
Es muy poco lo que se ha investigado en América y, específicamente, en Colombia sobre la relación de la gametocitemia con el tratamiento antipalúdico recibido; una revisión en Pubmed (1 mayo de 2007) con la palabra gametocyte y el nombre de cada país de la cuenca amazónica sólo produjo resultados positivos para Colombia (61-63), a lo que nosotros adicionamos una tercera referencia (64). En Lilacs-Bireme no hallamos ninguna referencia en la misma fecha con el término gametocito.
Nosotros evaluamos, entre 2000 y 2006, la eficacia de varios esquemas terapéuticos en paludismo por P. vivax (65-67) y en paludismo por P. falciparum (68,69), no complicados, en pacientes mayores de un año de edad, residentes en Turbo (zona de Urabá) y en El Bagre o en Zaragoza (zona del Bajo Cauca), en el departamento de Antioquia, Colombia.
El objetivo del presente informe es describir el comportamiento y algunas relaciones de la gametocitemia de P. falciparum en tres de los tratamientos evaluados: amodiaquina-sulfadoxina-pirimetamina, amodiaquina-artesunato y artesunato-sulfadoxina-pirimetamina.
Materiales y métodos
Clase de estudio
La eficacia de los medicamentos antipalúdicos se midió del 2000 al 2006. El macroproyecto tiene diseño experimental, con asignación aleatoria, con grupos desiguales, no ciego (68,69). El factor de exposición lo constituía cada tratamiento y el efecto correspondía a la respuesta al tratamiento, medida según varios desenlaces: falla (clínica, parasitaria, ambas) del tratamiento a los 21 o a los 28 días, tiempo de eliminación de la fiebre, tiempo de eliminación de la parasitemia asexual (en adelante, referida como parasitemia), tiempo de eliminación de la parasitemia sexual o gametocitemia (en adelante, referida como gametocitemia) y estado de portador de gametocitos durante el seguimiento.
La captación de los pacientes se hizo en forma consecutiva y se aceptaron todos los que cumplieron los criterios de inclusión. La asignación del paciente a un tratamiento se hizo en forma aleatoria (balotas marcadas con el nombre del tratamiento). Se evaluaron nueve tratamientos (grupos), pero no los nueve en operación simultánea; siempre hubo, al menos, dos grupos simultáneos de tratamiento. El esquema amodiaquina-sulfadoxina-pirimetamina se evaluó primero (junto con cloroquina-sulfadoxina-pirimetamina, no incluido en este artículo); los de artesunato-sulfadoxina-pirimetamina y artesunato-amodiaquina se evaluaron en forma paralela.
Diseño de la muestra
En varios artículos recientes hemos descrito las características sociales y epidemiológicas de las poblaciones en donde se adelanta el macro-proyecto, que compromete a los municipios de Turbo (zona de Urabá) y El Bagre y Zaragoza (área del Bajo Cauca) en el departamento de Antioquia, Colombia (69-72).
El tamaño de las muestras calculadas fue mínimo de 42 personas en cada uno de los lugares en donde se trabajó, según el protocolo de 1998 de la Organización Mundial de la Salud (OMS) (73). Los criterios de inclusión y exclusión se han informado anteriormente (68,69). El análisis de la eficacia de los tratamientos se hizo según el protocolo (68,69): el número de recurrencias al final del seguimiento con respecto al total de sujetos que llegaron al final del seguimiento.
Diagnóstico y tratamiento del paludismo y clasificación de la respuesta terapéutica
El diagnóstico de paludismo se hizo con la gota gruesa y el extendido delgado según el procedimiento indicado por la OMS (68,69,74). Los medicamentos se administraron con agua (75) y se suministraron en forma supervisada por los investigadores. El último día de seguimiento se administró primaquina a todos los pacientes, como gametocitocida, en dosis única (0,75 mg/kg, máximo, 45 mg; lote C091200).
Para la amodiaquina: dosis total de 25 mg/kg de peso corporal, fraccionada así: día 1, 10 mg/kg; días 2 y 3, 7,5 mg/kg cada uno; dosis total máxima: 1.500 mg; tabletas de 150 mg, Laboratorio Alkem, lote 3001-ET.
Para la sulfadoxina: 25 mg/kg de peso corporal, en dosis única, dada el día 1; dosis total máxima: 1.500 mg, lote RJ0002, Laboratorio Roche.
Para la pirimetamina: 1,25 mg/kg de peso corporal, en dosis única, dada el día 1; dosis total máxima: 75 mg, lote RJ0002 Laboratorio Roche.
Para el artesunato: 4 mg/kg/día por tres días, lote 0450777, Laboratorios Mepha Ltda.
El seguimiento fue de 28 días en el esquema de artesunato-sulfadoxina-pirimetamina y amodiaquina-artesunato y de 21 días en el de amodiaquina-sulfadoxina-pirimetamina. Los tratamientos se evaluaron en años diferentes. Avanzado el trabajo de evaluación de eficacia de los tratamientos antipalúdicos, se optó por hacer seguimiento de 28 días para tener mayores posibilidades de comparar nuestros resultados con los de otros países.
La respuesta terapéutica se clasificó según el protocolo OMS-1998 (73).
Procesamiento y análisis de los datos
Se usaron los programas Epiinfo 6.04 y SPSS 10.0. El objetivo del artículo es describir las relaciones de la gametocitemia de P. falciparum con el tratamiento con artesunato-sulfadoxina-pirimetamina, artesunato-sulfadoxina-pirimetamina o amodiaquina-artesunato. Para ello, el análisis fundamental consistió en comparar los tres grupos (tratamientos) según la evolución de la parasitemia asexual, la gametocitemia y la temperatura axilar. Esta comparación se hizo en función de la descripción de las medidas estadísticas de resumen (promedio o mediana y desviación estándar de cada grupo), las cuales se contrastaron con las prueba de Wilcoxon o la de Kruskal-Wallis, en el caso de grupos independientes. La comparación de las distribuciones de frecuencias entre grupos independientes se hizo con la prueba de ji al cuadrado, como aconteció al comparar la frecuencia diaria de pacientes sin gametocitos.
La comparación de las medidas estadísticas entre uno y otro día de evolución para un mismo tratamiento implica una comparación de datos pareados, que se hizo con la prueba de McNemar, con un grado de libertad. La prueba se considera de una cola porque la hipótesis plantea que cualquier día posterior al tratamiento debe haber menos positivos que antes de la terapia. Con 1 grado de libertad y p=0,025 (una cola), McNemar (teórico)=3,84; entonces, todo valor McNemar (calculado) menor de 3,84 será significativo.
Siempre se aplicó un nivel de probabilidad menor de 5% (p<0,05) para la toma de decisiones.
Se usan las siguientes abreviaturas y expresiones: n, número de pacientes; media o promedio, media aritmética; DE, desviación estándar; P25, percentil 25; P75, percentil 75; min, mínimo; max, máximo; IC95%, intervalo de confianza del 95% para una determinada medida, como la media o promedio aritmético; LI y LS, límites inferior y superior del IC95%; p, probabilidad; X ± DE, promedio ± DE; c2, ji al cuadrado; K-W, Kruskal-Wallis; r, coeficiente de correlación lineal; p(r); probabilidad asociada al coeficiente r; F, estadístico F; b, coeficiente de regresión; a, coeficiente de intersección.
Aspectos éticos
Cada paciente o tutor de un menor de edad aceptó la participación voluntaria, mediante consentimiento informado y escrito. El estudio se consideró de riesgo mínimo para los pacientes. El proyecto fue aprobado por el Comité de Ética del Centro de Investigaciones Médicas de la Universidad de Antioquia.
Resultados
Características generales
Se captaron 255 pacientes y se evaluó el desenlace del tratamiento en 241 sujetos; hubo 14 pérdidas (5,5%); en todas, los pacientes dejaron de venir al último control y no fue posible hallarlos, a pesar de la búsqueda activa emprendida. Hubo cuatro fallas terapéuticas (4/241: 1,66%): una precoz y tres tardías. Las fallas estuvieron en los grupos con amodiaquina-sulfadoxina-pirimetamina (dos fallas: una precoz, una tardía) y con artesunato-sulfadoxina-pirimetamina (dos fallas tardías). No hubo asociación significativa entre el tratamiento y la respuesta (falla, no falla) (p(c2)=0,569).
Las características de los cuatro pacientes con falla terapéutica no revelaron ningún perfil especial; se trató de dos hombres (17 y 23 años) y dos mujeres (2 y 14 años); tres residentes de la zona urbana y uno de la rural; tres sin anteceden-tes de paludismo en el último año; con uno a ocho días de evolución de la enfermedad (promedio=4); con parasitemia inicial entre 920 y 13.080 (promedio=7.055 anillos/µl), todos sin gametocitos antes del tratamiento, con temperatura axilar entre 37,0 y 39,4 °C (promedio=38,5 °C).
Antes del tratamiento, los grupos eran compa-rables según las variables de parasitemia asexual, gametocitemia y temperatura axilar (cuadro 1). La falla terapéutica no se asoció con la presencia de gametocitos antes del tratamiento (χ2 exacta de Fisher de 2 colas p=1,000) ni con su densidad pretratamiento (p=0,390011).
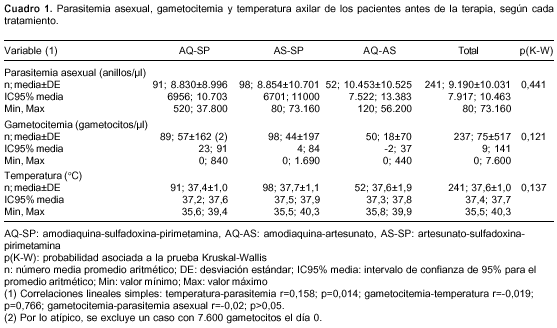
Los efectos adversos observados en los tres grupos fueron similares en clase, frecuencia, intensidad (en general, leve) y duración (corta: hacia el día 14 habían desaparecido).
Evolución temporal de la parasitemia y la gametocitemia
El promedio de la temperatura axilar fue normal en cualquier día y en todos los grupos. Todos los pacientes con artesunato estaban sin parásitos asexuales el día 3 (al completar 72 horas de trata-miento), y en el grupo de amodiaquina-sulfadoxina-pirimetamina un paciente entre 90 tenía parásitos, que no se hallaron el día 7 (cuadro 2).
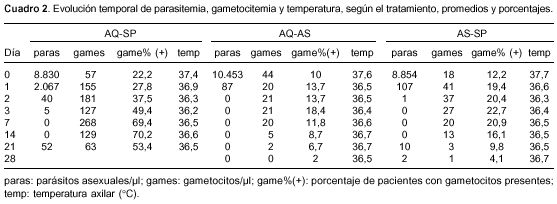
A las 24 horas de tratamiento con la combinación de amodiaquina-sulfadoxina-pirimetamina bajó la parasitemia 76% y la de artesunato-sulfadoxina-pirimetamina la redujo 99% (cuadro 2); a las 48 horas de terapia, la combinación de amodiaquina-sulfadoxina-pirimetamina disminuyó la parasitemia 99,5% frente al momento cero y la de artesunato-sulfadoxina-pirimetamina casi eliminó la parasitemia. A las 72 horas de tratamiento (24 horas después de terminar la administración de amodiaquina y de artesunato): la combinación de amodiaquina-sulfadoxina-pirimetamina redujo los anillos 99,9% en relación con el momento cero, pero hubo dos pacientes con 40 y 80 anillos/µl, ambos sin fiebre; la de artesunato-sulfadoxina-pirimetamina y amodiaquina-artesunato eliminó totalmente la parasitemia.
La evolución temporal de la gametocitemia es similar en el conjunto de pacientes (n=241) y en aquéllos con respuesta terapéutica exitosa (n=237):
a) combinación de amodiaquina-sulfadoxina-pirimetamina: en cualquier día de evaluación, dejó aumentar la gametocitemia con respecto al momento antes del tratamiento y al final (día 21) todavía había pacientes con gametocitos (cuadro 2, figura 1).
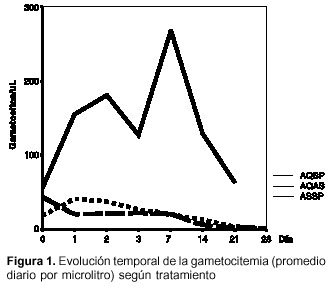
b) combinación de artesunato-sulfadoxina-pirimetamina: en todo día de evaluación y hasta el día 7, dejó aumentar la gametocitemia; desde el día 14 y hasta el día 28, redujo los gametocitos, pero todavía ese último día había pacientes con tales células.
c) combinación de amodiaquina-artesunato: a las 24 horas de tratamiento produjo reducción de 54% en la densidad de gametocitos, y entre ese día 1 y el día 7 la gametocitemia estuvo estable en alrededor de 52% a 54% en relación con antes del tratamiento; a partir del día 14 redujo los gametocitos y el día 28 los eliminó totalmente.
La densidad de gametocitos y la parasitemia presentaron correlación estadísticamente significativa (p(r)=0,000) únicamente en el grupo de amodiaquina-sulfadoxina-pirimetamina y sólo los días 1 y 2, es decir, a las 24 y 48 de iniciado el tratamiento; esa relación fue positiva: al aumentar la parasitemia, la gametocitemia se incrementó.
Antes del tratamiento, 84% de los enfermos estaba sin gametocitos: 78% en el grupo de amodiaquina-sulfadoxina-pirimetamina, 88% en el de artesunato-sulfadoxina-pirimetamina y 90% en el de amodiaquina-sulfadoxina-pirimetamina (c2=5,04; gl= 2; p=0,080456) (cuadro 3); los respectivos porcentajes complementarios corresponden a los pacientes con gametocitos antes del tratamiento (figura 2) y la densidad de gametocitos fue de 57, 44 y 18 gametocitos/µl, en los mismos grupos (p(K-W)=0,121).
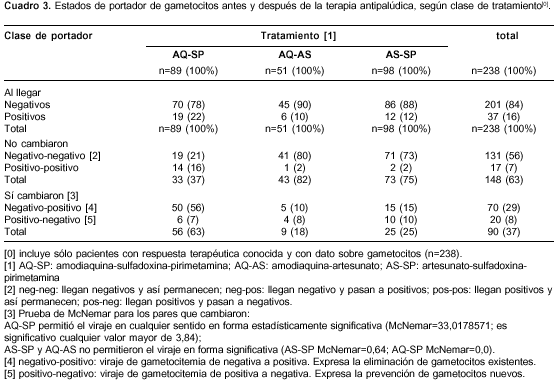
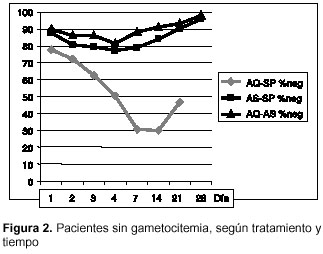
La combinación amodiaquina-artesunato fue la más eficaz para mantener a los pacientes libres de gametocitos, tanto por la cantidad de enfermos sin las células como por la velocidad para lograrlo; la diferencia es particularmente notoria frente a la de amodiaquina-sulfadoxina-pirimetamina. La máxima frecuencia de portadores de gametocitos se alcanzó el día 7, cuando 37% (84/227) de los pacientes los tuvieron, con notoria diferencia según el tratamiento: amodiaquina-sulfadoxina-pirimetamina el día 14 con 70% (59/84), artesunato-sulfadoxina-pirimetamina el día 3 con 23% (22/97) y amodiaquina-sulfadoxina-pirimetamina el día 3 con 18% (9/49). El día 3 (a las 24 horas de haber terminado de tomar amodiaquina o artesunato), había 159 de 238 pacientes sin gametocitos: 51% con amodiaquina-sulfadoxina-pirimetamina, 77% con artesunato-sulfadoxina-pirimetamina y 82% con amodiaquina-artesunato.
Cambio del estado de gametocitemia
Antes de la terapia antipalúdica, 56% estaba sin gametocitos y siguió así hasta el último día de control; 7% estaba positivo y permaneció de igual forma; 29% estaba negativo y viró a positivo en algún momento; 8% estaba positivo y pasó a negativo algún día (cuadro 4). En total, 63% (56% + 7%) de los pacientes no varió su estado de portador de gametocitos: con amodiaquina-sulfadoxina-pirimetamina 37% fue estable, con artesunato-sulfadoxina-pirimetamina 75% fue estable y con amodiaquina-artesunato 82% fue estable. Otro 37% de los enfermos sí modificó su estado de portador de gametocitos y, por supuesto, la mayor frecuencia de quienes lo modificaron se presentó con amodiaquina-sulfadoxina-pirimetamina y la menor con amodiaquina-artesunato. Se demostró que la combinación de amodiaquina-sulfadoxina-pirimetamina permitió el viraje en cualquier sentido en forma estadísticamente significativa, y los otros dos tratamientos no lo permitieron en forma significativa.
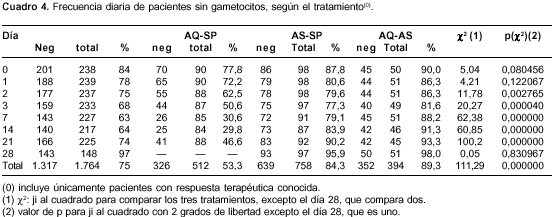
Tiempo necesario para el cambio del estado de portador de gametocitos
El promedio de días que tardó el viraje de positivo a negativo fue estadísticamente similar entre los tratamientos, es decir, que ellos no difirieron en su capacidad de eliminar gametocitos.
Por otra parte, el promedio de días que tardó el viraje de negativo a positivo fue estadísticamente diferente entre los tres tratamientos, con valores para amodiaquina-sulfadoxina-pirimetamina que son más de 2,5 veces los presentados por los otros dos tratamientos, es decir, la combinación de amodiaquina-sulfadoxina-pirimetamina fue más eficaz para prevenir la aparición de gametocitos (se supone maduros) en quienes no los tenían (cuadro 5). Lo anterior significa que los tratamientos con artesunato fueron más eficaces para reducir el viraje de negativo a positivo (10% a 15% Vs. 56%), pero lo permitieron más pronto que la combinación de amodiaquina-sulfadoxina-pirimetamina.

En resumen, nuestros pacientes se caracterizaron porque:
a) la mayoría no tenía gametocitos antes del tratamiento y nunca los desarrolló;
b) quienes llegaron sin esas células y luego las presentaron, tardaron en hacerlo entre 1 y 14 días: 63% demoraron 1 a 3 días, 29% se hallaron positivos el día 7 y el resto (8%), el día 14;
c) entre quienes llegaron positivos y perdieron los gametocitos, 13% tardó hasta 2 días para hacerse negativo, otro 25% requirió 14 días, 19% adicional necesitó 21 días y otro 44% demoró 28 días para estar negativo; por consiguiente, a los 14 días de haber iniciado el tratamiento, sólo 38% había eliminado los gametocitos. Resulta claro que el tiempo para pasar de negativo a positivo fue mucho más corto que para el proceso contrario (en máximo 2 días, 42% pasaron de negativo a positivo y 13% hicieron lo contrario).
Días de enfermedad y gametocitemia
El tiempo de evolución de la enfermedad (desde el comienzo de los síntomas hasta la llegada a la consulta) varió mucho en los 241 pacientes (1 a 34 días; promedio=5,1 y desviación estándar=4,4), sin diferencia entre los grupos (p=0,150651). Ese tiempo de enfermedad no se asoció estadísticamente con ninguna de las variables de municipio, etnia, sexo, edad o respuesta terapéutica (adecuada, falla), pero sí poderosamente con la gametocitemia.
A continuación describimos los resultados del análisis de las relaciones entre días de enfermedad y estas cuatro variables: prevalencia de gametocitos antes del tratamiento, densidad de gametocitos, cambio del estado de portador de gametocitos y tiempo requerido para pasar de no portador a portador de gametocitos.
a) Días de enfermedad y prevalencia pre-tratamiento de gametocitos: hubo una poderosa asociación entre las dos variables (K-W=43,651; gl=1; p=0,000000): cuando el tiempo de enfermedad aumentó, la presencia de gametocitos también se incrementó. Quienes llegaron con gametocitos tenían 9,7±6,6 días de enfermedad y quienes llegaron sin ellos poseían 4,2±3,3 días (p=0,000000). Entre quienes llegaron con 1 a 8 días de enfermedad, 11% mostró gametocitos antes del tratamiento (día 0), pero entre quienes tenían 9 a 34 días de enfermedad, hubo 67% con tales células.
b) Días de enfermedad y densidad de gametocitos: el promedio de gametocitos pretratamiento según los días de enfermedad cambió de manera muy significativa (KW=89,011; gl=16; p=0,000000). En los 195 pacientes con 1 a 7 días de enfermedad hubo 582±773 gametocitos/µl y en aquéllos 43 con 8 a 34 días se encontraron 1.379±2.978 células/ìl. Además, la correlación entre las dos variables antes del tratamiento fue baja (r=0,128) pero significativa (p=0,024; ANOVA: F=3,960; p=0,048).
c) Días de enfermedad y cambio del estado de portador de gametocitos: hubo intensa asociación de las dos variables, de tal manera que entre quienes tuvieron 1 a 8 días de enfermedad hubo 59% que llegaron y salieron sin las células sexuales y 30% que pasaron de carentes de ellas a poseedores de las mismas; al contrario, entre quienes presentaron más de 8 días de enfermedad hubo sólo 9% que llegaron y salieron sin gametocitos, 24% que pasaron de negativos a positivos, 38% que llegaron positivos y las conservaron, y 29% que aparecieron con ellas y las perdieron.
Un corto tiempo de enfermedad (menos de 8 días) antes de iniciar el tratamiento favoreció la carencia de gametocitos antes del tratamiento y que no aparecieran durante el tiempo de observación, mientras un período largo de enfermedad llevó a lo contrario: tenerlos y conservarlos. Este patrón se debió esencialmente a la influencia de los tratamientos con artesunato, porque el tratamiento con amodiaquina-sulfadoxina-pirimetamina presentó un modelo diferente: entre quienes tuvieron 1 a 8 días de enfermedad, 23% llegaron y estuvieron siempre sin gametocitos, 58% llegaron negativos y pasaron a positivos, 17% llegaron positivos y así siguieron, y 1% llegaron positivos y viraron a negativos.
d) Tiempo requerido para pasar de no portador a portador de gametocitos según los días de enfermedad: entre 70 sujetos, en los tres tratamientos, que llegaron sin gametocitos, el tiempo necesario para mostrar estas células en su sangre varió en forma inversamente proporcional a la cantidad de días de enfermedad: 40% de quienes tenían 1 a 2 días con el paludismo mostraron los gametocitos en 14 a 28 días, 41% de aquéllos con 3 a 4 días de estar enfermos los presentaron a los 7 días, 57% de los pacientes con 5 a 6 días de paludismo tardaron 2 a 3 días para tener gametocitos en la gota gruesa, y 43% de quienes tenían 7 a 8 días demoraron 1 día para demostrar esas células. El 40% de los pacientes con 9 a 34 días de evolución demoró un día para exhibir sus gametocitos, después de que llegó sin ellos.
En los 241 pacientes, los días de enfermedad tuvieron estas correlaciones: con la parasitemia pretratamiento r=-0,183 y p=0,004, con la temperatura corporal antes del tratamiento r=-0,115 y p=0,075 y con la gametocitemia r=0,128 y p=0,048.
Tiempo de eliminación de los gametocitos según su densidad inicial
Como ya se sabía que la gametocitemia antes del tratamiento dependía de los días de evolución de la enfermedad, se hizo un análisis estratificado en el conjunto de pacientes (con gametocitos antes del tratamiento y sin ellos). No parece que el tiempo de eliminación de gametocitos hubiese sido mayor cuando la gametocitemia inicial era mayor, pues el día 28 se llegó a un nivel similar (0,2 y 5 gametocitos/µl, que significan reducciones en esos 28 días de 99,7% y 97,5%), independiente-mente de haber empezado con 63 o con 202 gametocitos/µl, valores que tienen una relación de 1 a 3,2. Es difícil sostener la validez del anterior análisis para cada tratamiento por los pocos pacientes.
El anterior análisis sobre el giro de la presencia a la ausencia de gametocitos no puede hacerse si se trabaja sólo con los pacientes que llegaron con gametocitos y los perdieron durante el segui-miento, porque son sólo 16 sujetos; esos datos, aunque limitados, indican que la adición de artesunato a sulfadoxina-pirimetamina o a amodiaquina tampoco fue capaz de eliminar los gametocitos en forma rápida en quienes aparecieron con ellos antes del pretratamiento.
Discusión
El porcentaje de pacientes perdidos durante el seguimiento fue bajo (5,5%), debido a la búsqueda activa de ellos. Únicamente hubo 4 (1,7%) fallas entre los 241 pacientes en quienes se evalúo la respuesta terapéutica: la mitad con amodiaquina-sulfadoxina-pirimetamina y la otra con artesunato-sulfadoxina-pirimetamina; los tres tratamientos tuvieron la misma eficacia (eliminación de síntomas y signos y parásitos asexuales sanguíneos). Los pacientes con falla no presentaron un perfil específico, seguramente por su escaso número (cuatro personas).
La capacidad para eliminar la fiebre fue igual para los tres tratamientos. La velocidad de eliminación de la parasitemia fue superior con amodiaquina-artesunato seguido de artesunato-sulfadoxina-pirimetamina, sin diferencia entre ellos pero sí con respecto a amodiaquina-sulfadoxina-pirimetamina.
La frecuencia de fallas fue muy baja y similar en los tres grupos. La eliminación de la parasitemia y la gametocitemia fue muy notable desde las 24 horas de terapia con artesunato (artesunato-sulfadoxina-pirimetamina y amodiaquina-artesunato), sobre todo amodiaquina-artesunato; al contrario, amodiaquina-sulfadoxina-pirimetamina dejó duplicar y triplicar la cantidad de gametocitos presentes antes del tratamiento.
Bukirwa y Critchley informaron en 2006 que la combinación de amodiaquina-sulfadoxina-pirimetamina era más eficaz que la de artesunato-sulfadoxina-pirimetamina para controlar las fallas del tratamiento en el día 28, pero menos eficaz que la de artesunato-sulfadoxina-pirimetamina para reducir la prevalencia de gametocitos el séptimo día (55); este último asunto concuerda con nuestros hallazgos, pero debe enfatizarse que el porcentaje de portadores de gametocitos el día 7 es alto también en quienes usaron artesunato-sulfadoxina-pirimetamina (21%) o amodiaquina-sulfadoxina-pirimetamina (12%), lo que obliga a recomendar que se use siempre primaquina, inclusive si se aplica artesunato.
No hay razón para permitir que los gametocitos persistan más allá de 2 a 3 días a partir del inicio del tratamiento si se tiene un medicamento como la primaquina que es eficaz para ese fin, que tiene costos muy bajos, muy escasa toxicidad y, en general, efectos adversos pasajeros y leves.
Desde hace dos años iniciamos una investigación sobre paludismo por P. vivax y administramos dosis diarias elevadas de primaquina (la dosis total de 0,25 mg/kg por 14 días pero dada en tres o cinco días) sin haber tenido ningún problema grave en más de un centenar de pacientes; esos pacientes tenían actividad normal de glucosa 6-fosfato deshidrogenasa (G6PD), estaban sin embarazo y tomaron el medicamento con algún alimento, es decir, eran candidatos adecuados para recibir primaquina (20,38,76).
En un estudio previo con cloroquina, sulfadoxina-pirimetamina y cloroquina-sulfadoxina-pirimetamina (61), hallamos que la gametocitemia variaba en función de los días de enfermedad palúdica actual; no hallamos diferencias estadísticamente significativas en la prevalencia ni en la densidad de la gametocitemia según el tratamiento y la respuesta terapéutica (adecuada, falla), aunque los niveles de gametocitos fueron mayores en los pacientes tratados con sulfadoxina-pirimetamina, respecto a cloroquina-sulfadoxina-pirimetamina. Tampoco hubo diferencias en la gametocitemia según el sexo ni la edad de los pacientes, ni se halló correlación de ella con la parasitemia asexual. La diferencia en el grado de gameto-citemia encontrada entre los municipios de Turbo y Zaragoza parece estar influida por los días de enfermedad palúdica. En el presente estudio, los días de enfermedad palúdica influyeron fuertemente la prevalencia de gametocitos pretratamiento (día 0): a más días de enfermedad, más prevalencia de ellas.
En los pacientes de Quibdó (Chocó) con paludismo por P. falciparum se encontró una proporción de portadores de gametocitos antes del tratamiento de 25% y 5,9 días como promedio de evolución de la enfermedad; la duración de la enfermedad antes del tratamiento no se asoció con el estado de portador pretratamiento; la mayoría de los pacientes desarrollaron gametocitos durante los 14 días del seguimiento y la máxima proporción de portadores se alcanzó el día 7, con 85,7% en el grupo tratado con cloroquina y 86% en el grupo con sulfadoxina-pirimetamina; el riesgo de tener las células el día 14 fue mayor entre quienes presentaron falla del tratamiento que entre quienes respondieron adecuadamente (63).
Nuestros datos sobre portadores de gametocitos antes del tratamiento indican 16%, que es apenas 64% de 25% hallado en Quibdó, a pesar de que la evolución de la enfermedad era similar en ambos estudios (5,9 días en Quibdó y 5,1 en nuestros datos). Tampoco hay concordancia en cuanto a la asociación entre portadores de gametocitos antes del tratamiento y días de evolución de la enfermedad (sin asociación en Quibdó Vs. asociación en nuestros datos) ni en relación con el desarrollo de las células durante el seguimiento (85% las presentaron en Quibdó, el día 7 Vs. 37% en nuestros pacientes, el día 7). La muy escasa frecuencia de falla terapéutica en nuestros pacientes no permite comparar los resultados con el estudio de Quibdó.
En Buenaventura (Colombia), aunque el trata-miento con sulfadoxina-pirimetamina fue muy eficaz (97% de curación), la presencia simultánea de mutaciones en los codones 108 y 51 del gen dhfr de P. falciparum se asoció con: a) un tiempo de eliminación parasitaria significativamente más prolongado, comparado con la presencia única de mutación en 108; b) un tiempo de eliminación de los gametocitos más prolongado (persistían significativamente en los días 14 y 21); los autores concluyeron que las mutaciones en ese gen, que son insuficientes para causar falla terapéutica, pueden, sin embargo, aumentar la transmisión palúdica al asociarse a tiempos más prolongados de eliminación de las parasitemias asexual y sexual (64).
Nuestro grupo no halló relación entre la presencia de las mutaciones Asn108 e Ile51 en el gen dhfr y la falla porque 100% de los aislamientos tuvo mutaciones; la mutación Gly437 en el gen dhps se halló en 100% de quienes mostraron falla y en 77% u 84% (según el municipio) de quienes respondieron exitosamente a sulfadoxina-pirimetamina; el número de mutaciones en los genes dhfr y dhps no se relacionó con el grado de falla in vivo a sulfadoxina-pirimetamina (77); no evaluamos el papel de los gametocitos.
Un informe de 2007 sobre el tratamiento de paludismo por P. falciparum no complicado, en Chocó (Colombia), encontró igual eficacia terapéutica (eliminación de síntomas y parasitemia asexual) de amodiaquina-placebo que de amodiaquina-artesunato y mayor eficacia de amodiaquina-artesunato para controlar la gametocitemia el día 4 (62), pero sin ser capaz de eliminarla en todos los pacientes. Con este último tratamiento, el número de portadores de gametocitos aumentó hasta el día 7 y únicamente el día 21 todos estaban sin tales células (62), mientras que nuestros datos indicaron que la eliminación total de los gametocitos sucedió el día 28, pero lo fundamental para resaltar es que ambos estudios hallaron incapacidad del artesunato para eliminar totalmente los gametocitos en forma rápida (3 a 4 días máximo) y, por ello, se hace necesario usar primaquina.
No se sabe si la elevada prevalencia de gametocitos posterior al uso de antipalúdicos contra P. falciparum se debe a la inducción de la gametocitogénesis por el medicamento o si es consecuencia de la supervivencia y maduración posterior al tratamiento de las células ya existentes (60). Además, los datos sobre el estado de portador de gametocitos posterior a la terapia no concuerdan entre la microscopía y la reacción en cadena de la polimerasa en tiempo real; esta última ha indicado que las mediciones de gametocitos antes y después del tratamiento no tienen diferencia, mientras que la microscopía ha revelado mayor frecuencia posterior al tratamiento (47). Hay que recordar que la posibilidad de trans-misión de paludismo permanece alta inclusive después del tratamiento con derivados de la artemisinina, aunque la prevalencia y la densidad de los gametocitos sean relativamente bajas (76), y que la aparición de gametocitemia en los pacientes tratados está directamente relacionada con la eficacia del tratamiento contra las formas asexuales de P. falciparum (78).
En nuestros datos, el tiempo de la enfermedad de los pacientes influyó poderosamente en la presencia de gametocitos en el momento antes del tratamiento y con el estado de portador de esas células durante el lapso de observación. Seguramente esta situación se explica, en lo fundamental, por el ciclo de gametocitogénesis de P. falciparum, cuya gametocitemia aparece 7 a 15 días después de la primera generación de parásitos asexuales (1,2) y cuyos estadios I a IV pasan un mínimo de 7 días secuestrados en los órganos (6). Los datos nuestros concuerdan con estas bases, pues los pacientes con 1 a 8 días de evolución de su ataque palúdico no tenían gametocitos el día 0 (89% sin ellos), mientras que aquéllos con 9 a 34 días de enfermedad sí los presentaron (67% fue positivo el día 0).
Nuestros resultados concuerdan con los de la revisión sistemática de Bukirwa y Critchley en cuanto a la menor eficacia de la combinación de amodiaquina-sulfadoxina-pirimetamina sobre la de artesunato-sulfadoxina-pirimetamina para reducir la prevalencia de gametocitos el día 7 y en la incapacidad de los dos tratamientos de eliminar totalmente las células en ese día (55), pero difieren de ellos en la capacidad de controlar las fallas, que fue superior con la combinación de amodiaquina-sulfadoxina-pirimetamina, mientras que en nuestros datos son iguales.
Los hallazgos nuestros también concuerdan con los de cuatro informes que evaluaron el control de la gametocitemia el día 7 por parte de artesunato-mefloquina (78-81), el tratamiento de primera línea adoptado en septiembre 2006 por las autoridades sanitarias de Colombia para paludismo por P. falciparum en varias regiones del país. El esquema de artesunato-mefloquina no eliminó totalmente los gametocitos en ese día, que en nuestra opinión es, además, un plazo muy prolongado.
En resumen, la combinación de amodiaquina-sulfadoxina-pirimetamina tuvo igual eficacia que los tratamientos con artesunato (artesunato-sulfadoxina-pirimetamina y artesunato- amodiaquina) para controlar las fallas del tratamiento en el día 21, pero fue más eficaz para reducir la temperatura axilar a las 24 horas de finalizado el tratamiento (p=0,004). El esquema de amodiaquina-sulfadoxina-pirimetamina fue menos eficaz que los tratamientos con artesunato para reducir la presencia de gametocitos el día 3, pero ese día el porcentaje de portadores de gametocitos también fue alto en quienes usaron la combinación de artesunato-sulfadoxina-pirimetamina (23%) o la de amodiaquina-sulfadoxina-pirimetamina (12%). También otros han hallado que el potencial de transmisión palúdico permanece alto después de usar artesunato-sulfadoxina-pirimetamina (47).
Nuestros pacientes se caracterizaron porque la mayoría no tenía gametocitos antes del tratamiento y nunca los desarrolló (56%), porque quienes llegaron sin tales células y las adquirieron (29%) tardaron, generalmente, 1 a 3 días (63%) para presentarlas, y porque quienes llegaron con gametocitos y los perdieron (8%) demoraron más de 14 días para eliminarlos (62%). No parece que el tiempo para eliminar los gametocitos que se tienen al iniciar el tratamiento sea mayor cuando la gametocitemia inicial es más alta.
Una revisión sistémica de 2005 (nueve estudios, 4.547 participantes), que comparó un esquema de seis dosis de artemeter-lumefantrina con otros esquemas para paludismo por P. falciparum, encontró que las fallas terapéuticas el día 28 eran menores con artemeter-lumefantrina que con amodiaquina-sulfadoxina-pirimetamina, pero mayores que con cloroquina-sulfadoxina-pirimetamina; además, artemeter-lumefantrina fue mejor que artesunato-amodiaquina y peor que artesunato-mefloquina (82).
Otro informe de 2006 comparó artemeter-lumefantrina con amodiaquina-sulfadoxina-pirimetamina, en Angola, y concluyó que los dos tratamientos tuvieron alta eficacia, con fallas el día 28 de 3,2% con artemeter-lumefantrina y 6,2% con amodiaquina -sulfadoxina-pirimetamina (p=0,72), y que sólo un paciente presentó game-tocitos el día 28 en el grupo de amodiaquina -sulfadoxina-pirimetamina, contra cinco en el grupo con artemeter-lumefantrina (83).
Sobre la utilidad de la primaquina para controlar la gametocitemia de P. falciparum hay pocas dudas (24,30-37). La costumbre es darla en dosis única (0,75 mg/kg) al día siguiente de terminar el tratamiento esquizonticida, pero es poco claro el por qué de este tiempo, cuando podría y debería darse desde el primer día si lo que se quiere es controlar eficaz y rápidamente la gametocitemia.
Se ha señalado que la combinación de esquizon-ticidas sanguíneos con 8-aminoquinolinas, como la primaquina, protege a los primeros de la selección de clones resistentes y que, además, las segundas reducen la transmisión (84). Un informe reciente de Indonesia narró que la primaquina en dosis única (0,75 mg/kg), dada con cloroquina o con cloroquina-sulfadoxina-pirimetamina, no tuvo efecto en el curso de la parasitemia asexual de P. falciparum, pero sí aceleró significativamente la eliminación de los gametocitos (85).
Fue interesante el hallazgo según el cual el momento en que se aplicó la primaquina influyó en la evolución de los gametocitos: 7% de quienes la recibieron desde el comienzo, junto con cloroquina-sulfadoxina-pirimetamina, tenían gametocitos el día 7, contra cero de quienes la tomaron el día 2, aunque la diferencia no fue significativa. El día 4 la situación era la contraria: 11% de quienes la tomaron desde el primer momento tenían gametocitos, contra 14% de la tomaron el día 2 (diferencia no significativa) (85).
Se ha dicho que la eficacia de la primaquina contra los gametocitos se obtiene con varios esquemas de uso (86), pero la información es insuficiente, sobre todo en América. Está comprobada la capacidad de la primaquina para eliminar los gameto-citos submiscroscópicos de P. falciparum dejados por los tratamientos con artesunato (artesunato-sulfadoxina-pirimetamina), cuando la primaquina se aplica en la dosis usual de 0,75 mg/kg, lo cual es un importante paso para reducir la transmisión palúdica posterior al tratamiento (87).
En conclusión, los tres tratamientos fueron iguales en cuanto a eficacia terapéutica (eliminación de síntomas, signos y parásitos asexuales sanguíneos) y los dos esquemas con artesunato fueron mejores que el que careció de él, tanto en cuanto a la cantidad de gametocitos como al porcentaje de sujetos sin estas células, según las medidas del día 7, pero todos los tres tratamientos fueron incapaces de eliminar los gametocitos en 7 días.
El tratamiento estándar incluye siempre primaquina; estos tres tratamientos se evaluaron sin primaquina y no fueron capaces de eliminar totalmente los gametocitos el día 7, por lo que la conclusión es forzosa: hay que dar primaquina, cualquiera que sea el esquizonticida aplicado. Además, debe estudiarse el momento de aplicación de la primaquina, con la hipótesis de que es conveniente darla desde el primer momento, junto con los esquizonticidas sanguíneos. También deben efectuarse otros estudios que midan el efecto de la primaquina asociada a las artemisininas en diferentes momentos (desde el inicio de la terapia Vs. momentos posteriores, como a las 24 y 48 horas después).
Agradecimientos
A los directivos, empleados y pacientes de los hos-pitales de Turbo, El Bagre y Zaragoza por su indispensable ayuda. A los médicos, laboratoristas clínicos y demás personas del Grupo Malaria que participaron en la planeación y ejecución del proyecto.
Financiación
OPS-Ravreda-Ministerio de la Protección Social de Colombia, Dirección Seccional de Salud de Antioquia y Universidad de Antioquia.
Conflicto de intereses
Ninguno para declarar en relación con el proyecto y el informe.
Correspondencia:
Jaime Carmona-Fonseca, Grupo Salud y Comunidad, Universidad de Antioquia, Carrera 51D Nº 62-29 (Medicina), Medellín, Colombia.
Telefax: (574) (574) 219 60 50
jaimecarmonaf@hotmail.com
Referencias
1. Day KP, Hayward RE, Dyer M. The biology of Plasmodium falciparum transmission stages. Parasitology. 1998; 116 ( Suppl.): S95-109. [ Links ]
2. Eichner M, Diebner HH, Molineaux L, Collins WE, Jeffery GM, Dietz K. Genesis, sequestration and survival of Plasmodium falciparum gametocytes: parameter estimates from fitting a model to malariatherapy data. Trans R Soc Trop Med Hyg. 2001; 95: 497-501. [ Links ]
3. Robert V, Boudin C. Biologie de la transmission homme-moustique du Plasmodium. Bull Soc Pathol Exot. 2003; 96: 6-20. [ Links ]
4. Field JW, Shute PG. The microscopic diagnostic of human malaria. In: A morphological study of the erythrocytic parasites. Kuala Lumpur: Government Press; 1956. p. 142. [ Links ]
5. Talman AM, Domarle O, McKenzie FE, Ariey F, Robert V. Gametocytogenesis: the puberty of Plasmodium falciparum. Malar J. 2004; 3: 24. [ Links ]
6. Rogers NJ, Hall BS, Obiero J, Targett GA, Sutherland CJ. A model for sequestration of the transmission stages of Plasmodium falciparum: adhesion of gametocyte-infected erythrocytes to human bone marrow cells. Infect Immun. 2000; 68: 3455-62. [ Links ]
7. Lensen A, Bril A, van de Vegte M, van Gemert GJ, Eling W, Sauerwein R. Plasmodium falciparum: infectivity of cultured, synchronized gametocytes to mosquitoes. Exp Parasitol. 1999; 91: 101-3. [ Links ]
8. Sinden RE, Smalley ME. Gametocytogenesis of Plasmodium falciparum in vitro: the cell-cycle. Parasitology. 1979; 79: 277-96. [ Links ]
9. Smalley ME, Sinden RE. Plasmodium falciparum gametocytes their longevity and infectivity. Parasitology. 1977; 74: 1-8. [ Links ]
10. Drakeley C, Sutherland C, Bousema JT, Sauerwein RW, Targett GA. The epidemiology of Plasmodium falciparum gametocytes: weapons of mass dispersion. Trends Parasitol. 2006; 22: 424-30. [ Links ]
11. Carter R, Miller LH. Evidence for environmental modulation of gametocytogenesis in Plasmodium falciparum in continuous culture. Bull World Health Organ. 1979; 57 ( Suppl.1): 37-52. [ Links ]
12. Dyer M, Day KP. Commitment to gametocytogenesis in Plasmodium falciparum. Parasitol Today. 2000; 16: 102-7. [ Links ]
13. Targett G, Drakeley C, Jawara M, von Seidlein L, Coleman R, Deen J, et al. Artesunate reduces but does not prevent posttreatment transmission of Plasmodium falciparum to Anopheles gambiae. J Infect Dis. 2001; 83: 1254-9. [ Links ]
14. Sowunmi A, Fateye BA. Plasmodium falciparum gametocytaemia in Nigerian children: before, during and after treatment with antimalarial drugs. Trop Med Int Health. 2003; 8: 783-92. [ Links ]
15. von Seidlein L, Drakeley C, Greenwood B, Walraven G, Targett G. Risk factors for gametocyte carriage in Gambian children. Am J Trop Med Hyg. 2001; 65: 523-7. [ Links ]
16. von Seidlein L, Jawara M, Coleman R, Doherty T, Walraven G, Targett G. Parasitaemia and gametocytaemia after treatment with chloroquine, pyrimethamine/sulfadoxine, and pyrimethamine/sulfadoxine combined with artesunate in young Gambians with uncomplicated malaria. Trop Med Int Health. 2001; 6: 92-8. [ Links ]
17. Sutherland CJ, Ord R, Dunyo S, Jawara M, Drakeley CJ, Alexander N, et al. Reduction of malaria transmission to Anopheles mosquitoes with a six-dose regimen of co-artemether. PLoS Med. 2005; 2: e92. [ Links ]
18. Hallett RL, Dunyo S, Ord R, Jawara M, Pinder M, Randall A, et al. Chloroquine-sulphadoxine-pyrimethamine for uncomplicated malaria in Gambian children: enhanced transmission to mosquitoes of multi-drug-resistant Plasmodium falciparum. PloS Clin Trials. 2006; 1: e15. [ Links ]
19. Contreras-Ochoa C, Ramsey JM. Gametocitos de Plasmodium vivax y Plasmodium falciparum: estadios olvidados en el desarrollo de vacunas. Salud Pública Mex. 2004; 46: 64-70. [ Links ]
20. Carmona-Fonseca J. Profilaxis primaria con primaquina para el paludismo. Revisión. Anuario Enfermedades Infecciosas (Medellín). 2004; 2: 51-84. [ Links ]
21. Litter M. Compendio de farmacología. Cuarta edición. Buenos Aires: El Ateneo; 1988. p. 794-805. [ Links ]
22. Grewal RS. Pharmacology of 8-aminoquinolines. Bull World Health Organ. 1981; 59: 397-406. [ Links ]
23. Ponsa N, Sattabongkot J, Kittayapong P, Eikarat N, Coleman RE. Transmission-blocking activity of tafenoquine (WR-238605) and artelinic acid against naturally circulating strains of Plasmodium vivax in Thailand. Am J Trop Med Hyg. 2003; 69: 542-7. [ Links ]
24. López-Antuñano FJ. Is primaquine useful and safe as true exo-erythrocytic meronticidal, hyponociticial and gametocidal antimalarial drugs? Salud Pública Mex. 1999; 41: 410-9. [ Links ]
25. Portela MJ, Moreira R, Valente E, Constantino L, Iley J, Pinto J, et al. Dipeptide derivatives of primaquine as transmission-blocking antimalarials: effect of aliphatic side-chain acylation on the gametocytocidal activity and on the formation of carboxyprimaquine in rat liver homogenates. Pharm Res. 1999; 16: 949-55. [ Links ]
26. Coleman RE, Nath AK, Schneider I, Song GH, Klein TA, Milhous WK. Prevention of sporogony of Plasmodium falciparum and P. berghei in Anopheles stephensi mosquitoes by transmission-blocking antimalarials. Am J Trop Med Hyg. 1994; 50: 646-53. [ Links ]
27. Shao BR, Ye XY. Tissue schizontocidal effect of trifluoroacetyl primaquine in Plasmodium yoelii infected mice and Plasmodium cynomolgi infected monkeys. Southeast Asian J Trop Med Public Health. 1991; 22: 81-3. [ Links ]
28. Rastogi M, Pal NL, Sen AB. Gametocytocidal and sporontocidal activity of some standard antimalarials on P. berghei (NK 65) infection M. natalensis. Indian J Malariol. 1989; 26: 9-18. [ Links ]
29. Teklehaimanot A, Nguyen-Dinh P, Collins WE, Barber AM, Campbell CC. Evaluation of sporontocidal compounds using Plasmodium falciparum gametocytes produced in vitro. Am J Trop Med Hyg. 1985; 34: 429-34. [ Links ]
30. Gotay NJ, Kamtekar KD, Dalvi SS, Mehta SS, Chogle AR, Aigal U, et al. A randomized, parallel study of the safety and efficacy of 45 mg primaquine versus 75 mg bulaquine as gametocytocidal agents in adults with blood schizonticide-responsive uncomplicated falciparum malaria ISCRTN50134587. BMC Infect Dis. 2006; 6: 16. [ Links ]
31. Pukrittayakamee S, Chotivanich K, Chantra A, Clemens R, Looareesuwan S, White NJ. Activities of artesunate and primaquine against asexual- and sexual-stage parasites in falciparum malaria. Antimicrob Agents Chemother. 2004; 48: 1329-34. [ Links ]
32. Kamtekar KD, Gogtay NJ, Dalvi SS, Karnad DR, Chogle AR, Aigal U, et al. A prospective study evaluating the efficacy of a single, 45-mg dose of primaquine, as a gametocytocidal agent, in patients with Plasmodium falciparum malaria in Mumbai, India. Ann Trop Med Parasitol. 2004; 98: 453-8. [ Links ]
33. Gogtay NJ, Chogle AR, Sorabjee JS, Marathe SN, Kshirsagar NA. Poor gametocytocidal activity of 45 mg primaquine in chloroquine-treated patients with acute, uncomplicated, P. falciparum malaria in Mumbai (Bombay): an issue of public-health importance. Ann Trop Med Parasitol. 1999; 93: 813-6. [ Links ]
34. Kaneko A, Kamei K, Suzuki T, Ishii A, Siagian R, Panjaitan W. Gametocytocidal effect of primaquine in a chemotherapeutic malaria control trial in North Sumatra, Indonesia. Southeast Asian J Trop Med Public Health. 1989; 20: 351-9. [ Links ]
35. Chomcharn Y, Surathin K, Bunnag D, Sucharit S, Harinasuta T. Effect of a single dose of primaquine on a Thai strain of Plasmodium falciparum. Southeast Asian J Trop Med Public Health. 1980; 11: 408-12. [ Links ]
36. World Health Organization. Guidelines for the treatment of malaria. WHO/HTM/MAL/2006.1108. Geneva: WHO; 2006. [ Links ]
37. Kshirsagar NA. Malaria: anti malarial resistance and policy ramifications and challenges. J Postgrad Med. 2006; 52: 291-3. [ Links ]
38. Carmona-Fonseca J. La primaquina tiene alta eficacia en la quimioprofilaxis primaria simple antipalúdica. Metanálisis. Iatreia. 2006; 19: 244-60. [ Links ]
39. Hill DR, Baird JK, Parise ME, Lewis LS, Ryan ET, Magill AL. Primaquine: report from CDC expert meeting on malaria chemoprophylaxis. I Am J Trop Med Hyg 2006; 75: 402-15. [ Links ]
40. Marquiño W, Ylquimiche L, Hermenegildo Y, Palacios AM, Falconi E, Cabezas C, et al. Efficacy and tolerability of artesunate plus sulfadoxine-pyrimethamine and sulfadoxine-pyrimethamine alone for the treatment of uncomplicated Plasmodium falciparum malaria in Peru. Am J Trop Med Hyg. 2005; 72: 568-72. [ Links ]
41. Mockenhaupt FP, Ehrhardt S, Dzisi SY, Teun Bousema J, Wassilew N, Schreiber J, et al. A randomized, placebo-controlled, double-blind trial on sulfadoxine-pyrimethamine alone or combined with artesunate or amodiaquine in uncomplicated malaria. Trop Med Int Health. 2005; 10: 512-20. [ Links ]
42. Adjuik M, Babiker A, Garner P, Olliaro P, Taylor W, White N. International Artemisinin Study Group. Artesunate combinations for treatment of malaria: meta-analysis. Lancet. 2004; 363: 9-17. [ Links ]
43. Nacher M, Silachamroon U, Singhasivanon P, Wilairatana P, Phumratanaprapin W, Fontanet A, et al. Comparison of artesunate and chloroquine activities against Plasmodium vivax gametocytes. Antimicrob Agents Chemother. 2004; 48: 2751-2. [ Links ]
44. Abacassamo F, Enosse S, Aponte JJ, Gomez-Olive FX, Quinto L, Mabunda S, et al. Efficacy of chloroquine, amodiaquine, sulphadoxine-pyrimethamine and combination therapy with artesunate in Mozambican children with non-complicated malaria. Trop Med Int Health. 2004; 9: 200-8. [ Links ]
45. Chen PQ, Li GQ, Guo XB, He KR, Fu YX, Fu LC, et al. The infectivity of gametocytes of Plasmodium falciparum from patients treated with artemisinin. Chin Med J (Engl). 1994; 107: 709-11. [ Links ]
46. White NJ. Antimalarial drug resistance and combination chemotherapy. Philos Trans R Soc Lond B Biol Sci. 1999; 354: 739-49. [ Links ]
47. Schneider P, Bousema T, Omar S, Gouagna L, Sawa P, Schallig H, et al. (Sub)microscopic Plasmodium falciparum gametocytaemia in Kenyan children after treatment with sulphadoxine-pyrimethamine monotherapy or in combination with artesunate. Int J Parasitol. 2006; 36: 403-8. [ Links ]
48. Sowunmi A, Fateye BA, Adedeji AA, Fehintola FA, Bamgboye AE, Babalola CP, et al. Effects of antifolates-co-trimoxazole and pyrimethamine-sulfadoxine-on gametocytes in children with acute, symptomatic, uncomplicated, Plasmodium falciparum malaria. Mem Inst Oswaldo Cruz. 2005; 100: 451-5. [ Links ]
49. Sowunmi A, Fateye BA, Happi TC, Gbotosho GO, Oduola AM. Plasmodium falciparum gametocytaemia in Nigerian children: Peripheral immature gametocytaemia as an indicator of a poor response to chloroquine treatment, and its relationship to molecular determinants of chloroquine resistance. Ann Trop Med Parasitol. 2003; 97: 453-68. [ Links ]
50. Sowunmi A, Fateye BA. Gametocyte sex ratios in children with asymptomatic, recrudescent, pyrimethamine- sulfadoxine-resistant, Plasmodium falciparum malaria. Ann Trop Med Parasitol. 2003; 97: 671-82. [ Links ]
51. Sokhna CS, Trape JF, Robert V. Gametocytaemia in Senegalese children with uncomplicated falciparum malaria treated with chloroquine, amodiaquine or sulfadoxine + pyrimethamine. Parasite. 2003; 8: 243-50. [ Links ]
52. Puta C, Manyando C. Enhanced gametocyte production in Fansidar-treated Plasmodium falciparum malaria patients: implications for malaria transmission control programmes. Trop Med Int Health. 1997; 2: 227-9. [ Links ]
53. Tin F, Nyunt- Hlaing. Comparative drug trial of a sulfadoxine/pyrimethamine and a sulfalene/pyrimethamine combination against Plasmodium falciparum infections in semi-immune populations of Burma. Southeast Asian J Trop Med Public Health. 1984; 15: 238-48. [ Links ]
54. Robert V, Read AF, Essong J, Tchuinkam T, Mulder B, Verhave JP, et al. Effect of gametocyte sex ratio on infectivity of Plasmodium falciparum to Anopheles gambiae. Trans R Soc Trop Med Hyg. 1996; 90: 621-4. [ Links ]
55. Bukirwa H, Critchley J. Sulfadoxine-pyrimethamine plus artesunate versus sulfadoxine-pyrimethamine plus amodiaquine for treating uncomplicated malaria. Cochrane Database Sys Rev. 2006; 25: CD004966. [ Links ]
56. Ali E, Mackinnon MJ, Abdel-Muhsin AM, Ahmed S, Walliker D, Babiker HA. Increased density but not prevalence of gametocytes following drug treatment of Plasmodium falciparum. Trans R Soc Trop Med Hyg. 2006; 100: 176-83. [ Links ]
57. Robert V, Awono-Ambene HP, Le Hesran JY, Trape JF. Gametocytemia and infectivity to mosquitoes of patients with uncomplicated Plasmodium falciparum malaria attacks treated with chloroquine or sulfadoxine plus pyrimethamine. Am J Trop Med Hyg. 2000; 62: 210-6. [ Links ]
58. Handunnetti SM, Gunewardena DM, Pathirana PP, Ekanayake K, Weerasinghe S, Mendis KN. Features of recrudescent chloroquine-resistant Plasmodium falciparum infections confer a survival advantage on parasites and have implications for disease control. Trans R Soc Trop Med Hyg. 1996; 90: 563-7. [ Links ]
59. Hogh B, Gamage-Mendis A, Butcher GA, Thompson R, Begtrup K, Mendis C, et al. The differing impact of chloroquine and pyrimethamine/sulfadoxine upon the infectivity of malaria species to the mosquito vector. Am J Trop Med Hyg. 1998; 58: 176-82. [ Links ]
60. Schneider P, Schoone G, Schallig H, Verhage D, Telgt D, Eling W, et al. Quantification of Plasmodium falciparum gametocytes in differential stages of development by quantitative nucleic acid sequence-based amplification. Mol Biochem Parasitol. 2004; 137: 35-41. [ Links ]
61. Arango E, Álvarez T, Carmona J, Blair S. Gametocitemia de Plasmodium falciparum según la respuesta terapéutica a sulfadoxina-pirimetamina y cloroquina en dos municipios de Antioquia, Colombia. Biomédica. 2004; 24: 79-88. [ Links ]
62. Osorio L, González I, Olliaro P, Taylor WR. Artemisinin-based combination therapy for uncomplicated Plasmodium falciparum malaria in Colombia. Malar J. 2007; 286: 25. [ Links ]
63. Osorio L, Ferro BE, Castillo CM. Effects of chloroquine and sulfadoxine/pyrimethamine on gametocytes in patients with uncomplicated Plasmodium falciparum malaria in Colombia. Mem Inst Oswaldo Cruz. 2002; 97: 1221-3. [ Links ]
64. Méndez F, Muñoz A, Carrasquilla G, Jurado D, Arévalo-Herrera M, Cortese JF, et al. Determinants of treatment response to sulfadoxine-pyrimethamine and subsequent transmission potential in falciparum malaria. Am J Trop Med Hyg. 2002; 156: 230-8. [ Links ]
65. Carmona-Fonseca J, Álvarez G, Blair S. Malaria por Plasmodium vivax: curación del ataque agudo con tres dosis diferentes de primaquina y dosis fija de cloroquina; Antioquia (Colombia), 2003-2004. Biomédica. 2006; 26: 353-65. [ Links ]
66. Blair S, Tobón A, Echeverri M, Álvarez G, Carmona-Fonseca J. Adecuada respuesta clínica y parasitológica de Plasmodium vivax a la cloroquina en Colombia (Turbo, Antioquia), 2001. Infectio. 2002; 6: 21-6. [ Links ]
67. Lacharme L, Carmona-Fonseca J, Tobón A, Blair S. Respuesta de P. vivax al esquema terapéutico cloroquina-primaquina en Zaragoza y Turbo, Colombia, 1998. Infectio. 1998; 2: 90-4. [ Links ]
68. Blair S, Carmona-Fonseca J, Piñeros JG, Ríos A, Álvarez T, Álvarez G, et al. Therapeutic efficacy test in malaria falciparum in Antioquia, Colombia. Malar J. 2006; 5: 14. [ Links ]
69. Carmona-Fonseca J, Tobón A, Álvarez G, Blair S. El tratamiento amodiaquina-sulfadoxina-pirimetamina tiene eficacia del 98% para la malaria falciparum no complicada (Antioquia, Colombia; 2003). Iatreia. 2005; 18: 5-27. [ Links ]
70. Carmona-Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la falla terapéutica antimalárica Parte 1.. Iatreia. 2003; 16: 299-318. [ Links ]
71. Carmona-Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la falla terapéutica antimalárica. Parte 2. Iatreia. 2004; 17: 34-53. [ Links ]
72.Carmona-Fonseca J. Malaria, desnutrición y parasitosis intestinal en los niños colombianos: interrelaciones. Iatreia. 2004; 17: 354-69. [ Links ]
73. Organización Mundial de la Salud, Organización Panamericana de la Salud. Evaluación de la eficacia terapéutica de los medicamentos para el tratamiento del paludismo por Plasmodium falciparum sin complicaciones en las Américas. Documento OPS/HCP/HCT/113/98. Washington: OPS; 1998. [ Links ]
74. López-Antuñano FJ, Schmunis G. Diagnótico de malaria. Publicación científica No. 512. Washington DC: OPS; 1988. [ Links ]
75. Ministerio de Salud. Guía de atención clínica para el diagnóstico y tratamiento de la malaria. Bogotá: Instituto Nacional de Salud; 1999. [ Links ]
76. Baird JK, Fryauff DJ, Hoffmann SL. Primaquine for prevention of malaria in travelers. Clin Infect Dis. 2003; 37: 1659-67. [ Links ]
77. Villa-Restrepo AF. Mutaciones puntuales en los genes dhps y dhfr de Plasmodium falciparum asociadas con la respuesta terapéutica a sulfadoxina-pirimetamina en Antioquia-Colombia. (Tesis). Medellín: Grupo Malaria, Corporación de Ciencias Básicas Biomédicas, Universidad de Antioquia; 2005. [ Links ]
78. Suputtamongkol Y, Chindarat S, Silpasakorn S, Chaikachonpatd S, Lim K, Chanthapakajee K, et al. The efficacy of combined mefloquine-artesunate versus mefloquine-primaquine on subsequent development of Plasmodium falciparum gametocytemia. Am J Trop Med Hyg. 2003; 68: 620-3. [ Links ]
79. van den Broek IV, Maung UA, Peters A, Liem L, Kamal M, Rahman M, et al. Efficacy of chloroquine+sulfadoxine-pyrimethamine, mefloquine+artesunate and artemether+lumefantrine combination therapies to treat Plasmodium falciparum malaria in the Chittagong Hill Tracts, Bangladesh. Trans R Soc Trop Med Hyg. 2005; 99: 727-35. [ Links ]
80. Ávila JC, Villaroel R, Marquino W, Zegarra J, Mollinedo R, Ruebush TK. Efficacy of mefloquine and mefloquine-artesunate for the treatment of uncomplicated Plasmodium falciparum malaria in the Amazon region of Bolivia. Trop Med Int Health. 2004; 9: 217-22. [ Links ]
81. Marquiño W, Huilca M, Calampa C, Falconi E, Cabezas C, Naupay R, et al. Efficacy of mefloquine and a mefloquine-artesunate combination therapy for the treatment of uncomplicated Plasmodium falciparum malaria in the Amazon Basin of Peru. Am J Trop Med Hyg. 2003; 68: 608-12. [ Links ]
82. Omari AA, Gamble C, Garner P. Artemether-lumefantrine (six-dose regimen) for treating uncomplicated falciparum malaria. Cochrane Database Sys Rev. 2005; 19: CD005564. [ Links ]
83. Guthmann JP, Cohuet S, Rigutto C, Fortes F, Saraiva N, Kiguli J, et al. High efficacy of two artemisinin-based combinations (artesunate + amodiaquine and artemether + lumefantrine) in Caala, Central Angola. Am J Trop Med Hyg. 2006; 75: 143-5. [ Links ]
84. Peters W, Stewart LB, Robinson BL. The chemotherapy of rodent malaria. LXI. Drug combinations to impede the selection of drug resistance, part 4: the potential role of 8-aminoquinolines. Ann Trop Med Parasitol. 2003; 97: 221-36. [ Links ]
85. Lederman ER, Maguire JD, Sumawinata IW, Chand K, Elyazar I, Estiana L, et al. Combined chloroquine, sulfadoxine/pyrimethamine and primaquine against Plasmodium falciparum in Central Java, Indonesia. Malar J. 2006; 5: 108. [ Links ]
86. Bunnag D, Harinasuta T, Pinichpongse S, Suntharasami P. Effect of primaquine on gametocytes of Plasmodium falciparum in Thailand. Lancet. 1980; 2: 91. [ Links ]
87. Shekalaghe S, Drakeley C, Gosling R, Ndaro A, van Meegeren M, Enevold A, et al. Primaquine clears submicroscopic Plasmodium falciparum gametocytes that persist after treatment with sulphadoxine-pyrimethamine and artesunate. PLoS ONE. 2007; 2: e1023. [ Links ]














