Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Biomédica
versión impresa ISSN 0120-4157versión On-line ISSN 2590-7379
Biomédica v.28 n.3 Bogotá jul./sep. 2008
1 Grupo Interdisciplinario para el Estudio de las Parasitosis Intestinales - GIEPI; Corporación para el Estudio de las Patologías Tropicales - CAEPT, Universidad de Antioquia, Medellín, Colombia
2 Departamento de Microbiología y Parasitología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
3 Escuela de Microbiología, Universidad de Antioquia, Medellín, Colombia
Recibido: 26/02/08; aceptado:29/04/08
Introducción. Los microsporidios son agentes de infecciones oportunistas en pacientes con sida y con trasplantes, principalmente. Enterocytozoon bieneusi y Encephalitozoon intestinalis son los más frecuentes, asociados con infecciones entéricas. Los cultivos celulares han contribuido al conocimiento de los microsporidios. En Colombia no se han obtenido aislamientos provenientes de pacientes con microsporidiosis y, por consiguiente, no existen cepas autóctonas de los mismos.
Objetivo. Establecer el cultivo celular de microsporidios intestinales a partir de materia fecal de pacientes parasitados.
Materiales y métodos. Se realizó concentración agua-éter de la materia fecal positiva para microsporidios y el sedimento resultante se trató con una mezcla de antibióticos y antimicóticos durante 18 horas a 37 oC. Se inocularon células Vero previamente cultivadas en placas de 24 pozos y en medio RPMI con suplemento de suero bovino fetal al 10% y antibióticos, con las esporas concentradas. Los cultivos se mantuvieron a 37 oC al 5% de CO2. Se cambió de medio cada dos días y se evaluó la presencia de esporas en los sobrenadantes mediante Gram-cromótropo rápido en caliente.
Resultados. En la segunda semana después de la infección, se encontraron esporas de microsporidios con morfología y coloración características. Mediante PCR se determinó que el microsporidio encontrado correspondía a la especie E. intestinalis.
Conclusión. Se estableció el cultivo in vitro de microsporidios de materia fecal. Este protocolo es importante para la obtención y el mantenimiento de cepas autóctonas en Colombia, y contribuirá a las investigaciones de aspectos bioquímicos, inmunológicos y epidemiológicos de dichas cepas.
Palabras clave: Encephalitozoon, microsporidiosis, síndrome de inmunodeficiencia adquirida, aislamiento de pacientes, células cultivadas, heces.
Introduction. Microsporidia are obligate intracellular parasites that are recognized as important opportunistic pathogens of immunocompromised and transplanted patients. Enterocytozoon bieneusi and, less frequently, Encephalitozoon intestinalis are the most prevalent species in humans; both of them are associated with enteric infections. Cell cultures have been useful in the study of microsporidia biology. In Colombia, however, no isolates of microsporidia from patients with AIDS have been obtained.
Objective. A cell culture of intestinal microsporidia was established from stools of positive patients in order to isolate a native strain.
Materials and methods. Stool from a single AIDS patient was concentrated with the water-ether technique, and the sediment was treated with a mixture of antibiotics and antifungal agents for 18 hours at 37o C. Vero cells were cultivated in 24-well plates with Gibco® RPMI medium supplemented with 10% bovine fetal serum and antibiotics. The culture was subsequently inoculated with previously concentrated spores. The medium was changed every second day and the presence of spores was evaluated with the Quick Hot Gram chromotrope stain.
Results. Two weeks post-infection, microsporidial spores were identified with characteristic morphology and staining properties. PCR results showed that Encephalitozoon intestinalis was the isolated species.
Conclusions. A cell culture of microsporidia was established from a stool sample. This protocol is important to isolate and maintain additional native Colombian strains and it will contribute to biochemical, immunological and epidemiological studies of the currently established strain.
Key words. Acquired immunodeficiency sindrome; microsporidiosis; patient isolate; diarrhea; cell cultures; feces.
Los microsporidios son parásitos intracelulares obligados causantes de infecciones oportunistas, principalmente en pacientes con sida. Estos microorganismos pertenecen al filo Microsporidia (1) compuesto por 150 géneros y 1.200 especies. Sin embargo, sólo siete géneros son causantes de infecciones en humanos: Encephalitozoon, Enterocytozoon, Pleistophora, Trachipleistophora, Vittaforma, Brachiola y Nosema (2). Enterocytozoon bieneusi y Encephalitozoon intestinalis son las especies que con mayor frecuencia causan infección intestinal en el humano, la cual se manifiesta con diarrea acuosa, mala absorción, dolor abdominal, pérdida de peso y náuseas (3,4).
El número de infecciones causadas por estos agentes ha aumentado con la aparición de la pandemia del sida y ha comprometido seriamente la salud de estos pacientes, debido a que algunos microsporidios se pueden diseminar a otros órganos a partir del intestino y causar infecciones en riñón, cerebro y pulmón, entre otros (5).
Los reportes de la literatura mundial sobre la prevalencia de la microsporidiosis son variables y, como se mencionó anteriormente, la microsporidiosis intestinal es la presentación más común, encontrándose en los cinco continentes. Se han reportado casos de infección por E. bieneusi en individuos con sida en 5% a 50% (6). Kotler y colaboradores estudiaron 141 pacientes con sida y diarrea y encontraron que 39% de los pacientes tenía microsporidios, y era el patógeno más frecuente en estos individuos (7).
En Latinoamérica se han realizado pocos estudios sobre la prevalencia de la infección por microspori-dios. En una investigación realizada en México, Gamboa Domínguez y colaboradores determinaron una prevalencia de microsporidios de 31% en pacientes con sida y diarrea crónica concomitante (8). Brasil y colaboradores determinaron una prevalencia de 27,5% de infección intestinal por microsporidios en una cohorte de 40 pacientes sintomáticos positivos para VIH (9). En Colombia se han diagnosticado casos aislados; sin embargo, no se conoce su prevalencia real. Un estudio realizado en Bogotá en el 2003 por Flórez y colaboradores, informó una prevalencia de 3,5% mediante la evaluación por la coloración del blanco de calcoflúor y Gram cromótropo (10). En una investigación sistemática realizada por el Grupo Interdisciplinario para el Estudio de las Parasitosis Intestinales, GIEPI, de la Facultad de Medicina de la Universidad de Antioquia, en el 2004, se estudiaron 103 pacientes positivos para VIH, con edades comprendidas entre 2 y 74 años, en un período de un año y se determinó una frecuencia de microsporidiosis de 3,9%; fue la tercera parasitosis en orden de frecuencia, superada solamente por la criptosporidiosis y la amebiasis (11).
Se han realizado varios estudios encaminados hacia la diferenciación de especies y el desarrollo de nuevas alternativas terapéuticas, utilizando técnicas moleculares que incluyen la reacción en cadena de la polimerasa (PCR) y los cultivos celulares (4).
El primer cultivo celular de microsporidios se logró en 1934 con el aislamiento de Nosema bombycis a partir de insectos y varios años después se estableció el cultivo de E. cuniculi a partir de ratones. Desde entonces, se ha observado un incremento en el desarrollo de cultivos in vitro para microsporidios, aplicando varios protocolos que permiten el aislamiento de este parásito de una gran variedad de muestras clínicas. Hasta la fecha se ha logrado el cultivo de Vittaforma corneae, Trachipleistophora hominis, Encephalitozoon cuniculi, Encephalitozoon hellem y E. intestinalis a partir de muestras clínicas, y esta última ha sido la especie más estudiada (12). En la actualidad, se han realizado cultivos celulares de E. intestinalis en muestras de materia fecal, esputo, mucosa nasal, lavado broncoalveolar, aspirado y biopsia duodenal, entre otros (12-15). El aislamiento de E. intestinalis de materia fecal fue obtenido por van Gool en 1994, quien utilizó un nuevo método de cultivo que incluía un tratamiento de la materia fecal por medio del método de sedimentación agua-éter antes de su inoculación con el fin de aumentar el número de esporas en el sedimento y, posteriormente, la mezcla de la muestra con antimicrobianos para eliminar los contaminantes que pudieran afectar el cultivo celular. Además, utilizó la microscopía electrónica para el seguimiento de los cultivos (14).
A pesar del gran aporte de los cultivos celulares en el conocimiento de los microsporidios con respecto a la biología del parásito, metabolismo y respuesta inmune, entre otros, en Colombia no se han realizado cultivos in vitro de estos parásitos a partir de muestras clínicas, razón por la cual no se han estudiado las cepas autóctonas en los aspectos antes mencionados. Por lo tanto, este trabajo tuvo como propósito realizar el cultivo celular de E. intestinalis proveniente de un aislamiento clínico de materia fecal de un paciente colombiano.
Materiales y métodos
Procedencia de la muestra y diferenciación de especie
Se obtuvo una muestra de materia fecal de un paciente de 56 años con sida sin sintomatología intestinal, residente en zona urbana, con un recuento absoluto de CD4 de 396 células/mm3 y una carga viral de 20.400 copias de ARN viral/mm3. A la muestra de materia fecal se le practicó el examen coprológico directo y la concentración formol-éter para el diagnóstico de parásitos intestinales. Además, se tiñeron con las coloraciones de Ziehl Neelsen y Gram cromótropo rápido en caliente para la determinación de coccidias y microsporidios, respectivamente. Para la confirmación de la presencia de microsporidios en la muestra de materia fecal y la diferenciación de especie se realizó una PCR para la cual se utilizaron los iniciadores SINTF1/SINTR y EBIEF1/EBIER15 para E. intestinalis y E. bieneusi, respectivamente, siguiendo el protocolo planteado por Da Silva et al. (16).
Procesamiento de la muestra y obtención de esporas
Una vez se estableció la positividad para E. intestinalis mediante la PCR, la muestra de materia fecal fue concentrada mediante el método agua-éter de la siguiente manera: la materia fecal se homogenizó en 8 ml de agua destilada y se realizó un prefiltrado con papel de filtro corrugado y un equipo para filtrado (Milipore SX 00 025, Cat. 2001/2002, MFS, Inc.). Posteriormente, se filtró tres veces con filtros Whatman No. 1 (Cat. 2001/2002, MFS, Inc.) y un equipo para filtrado Milipore (SX 00 013, Cat. 2001/2002, MFS, Inc.). Después se adicionaron 3 ml de éter y la mezcla agua-éter se agitó durante un minuto y, luego, se centrifugó durante 10 minutos a 2.500g. Se descartó el sobrenadante y el sedimento se resuspendió en 1 ml de agua destilada. Esta suspensión se mezcló con los siguientes antimicrobianos: gentamicina (100 mg/ml), penicilina-estreptomicina (100 mg/ml) y anfotericina B (50 mg/ml); se incubó en agitación durante 18 horas a 37 °C y después se centrifugó a 2.500g durante 20 minutos; se descartó el sobrenadante y el sedimento se centrifugó dos veces a 2.500g durante 30 minutos en PBS pH 7,2 y se resuspendió en 1 ml de medio RPMI-1640 (Sigma-Aldrich, Ref. R4130). Se realizó evaluación microscópica y recuento de esporas de esta suspensión.
Cultivo celular
Las esporas obtenidas en el procedimiento anterior fueron cultivadas en monocapas de células Vero, en proporción de 10 esporas por cada célula Vero, y mantenidas en placas de 24 pozos con medio RPMI con suplemento de suero bovino fetal al 10% y gentamicina, 60 µg/ml. Las placas se incubaron durante dos semanas a 37 °C con una atmósfera de CO2 al 5%. Los cultivos se evaluaron diariamente mediante un microscopio invertido y dos veces por semana utilizando la coloración Gram cromótropo rápido en caliente para identificar la presencia de esporas o de cualquier contaminación con otros microorganismos. Después de la segunda semana, se realizó el repique del cultivo a botellas de 25 cm2 con el fin de aumentar la producción de esporas, y dicho cultivo se mantuvo en las condiciones descritas anteriormente.
Consideraciones éticas
Estos resultados provienen del proyecto Efecto de la clorinación sobre la viabilidad e infectividad (sic.) de esporas de microsporidios intestinales de un aislamiento clínico, el cual fue clasificado como proyecto de riesgo mínimo para humanos por el Comité Central de Bioética de la Facultad de Medicina de la Universidad de Antioquia, y aprobado mediante Acta CB 8700-03-01.
Resultados
muestra de materia fecal fue positiva para quistes y trofozoitos de Endolimax nana mediante el coprológico directo y por concentración, y negativa para microsporidios intestinales por medio de la coloración Gram cromótropo rápido en caliente. Sin embargo, al realizar la PCR se encontró que la muestra era positiva para E. intestinalis (figura 1), por lo cual se continuó con el procesamiento de la muestra de materia fecal para realizar el cultivo in vitro de las esporas.
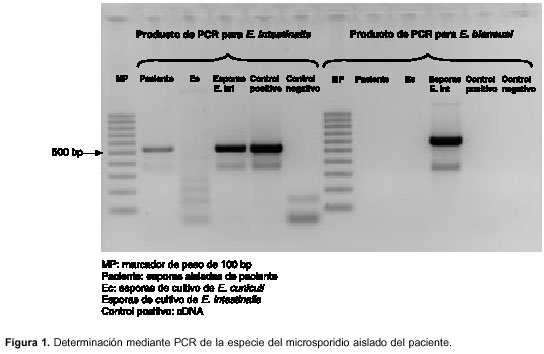
No se observó contaminación con hongos ni bacterias durante la revisión de los cultivos y después de la segunda semana de infección se realizó el repique del cultivo a botellas de 25 cm2 con el fin de aumentar la producción de esporas.
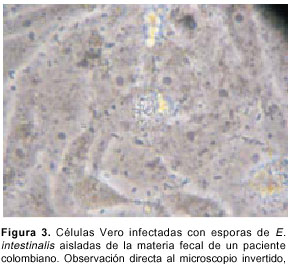
Entre la cuarta y la quinta semana, por medio de la coloración Gram cromótropo rápido en caliente, se observaron esporas de un microsporidio (figura 2) en el sobrenadante del cultivo, por lo que se continuó con su mantenimiento hasta obtener grandes cantidades de esporas (figura 3). Posteriormente, se realizó una PCR para confirmar que la especie del parásito aislada era, efectivamente, E. intestinalis.
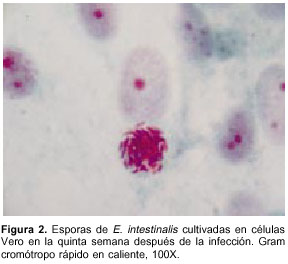
A la quinta semana después del repique del cultivo se observó un aumento en el número de esporas en el citoplasma de las células (figura 2) y no se encontró contaminación, por lo que se comenzaron a recolectar los sobrenadantes y a almacenarlos a 4 °C para su posterior purificación y uso de las esporas en nuevos estudios.
Discusión
En orden de frecuencia, E. intestinalis es el segundo microsporidio que más afecta a los humanos después de E. bieneusi. Sin embargo, este microsporidio puede causar enfermedades graves, debido a su capacidad de diseminarse a otros órganos a partir del intestino; por lo tanto, puede ocasionar enfermedades como queratitis, bronquiolotis, sinusitis y cistitis, entre otras (3,5,6). Se han descrito varios aislamientos de E. intestinalis a partir de muestras clínicas, entre las que se incluyen orina, esputo, materia fecal y aspirado duodenal (12-15). En 1994, van Gool (14) logró establecer el primer cultivo in vitro de E. intestinalis a partir de materia fecal, para lo cual estableció un protocolo que incluye un método de concentración de la materia fecal y su tratamiento con antimicrobianos.
Los resultados en este estudio son similares a los obtenidos por van Gool (14), quien observó la producción de esporas entre la tercera y la quinta semanas después de la infección, mientras que en este trabajo se observó un aumento en dicha producción en la quinta semana. Otros autores también describen que, usualmente, el foco de infección de las monocapas inoculadas con las esporas de E. intestinalis provenientes de las muestras clínicas aparece después de dos semanas de la inoculación, y luego de unas pocas semanas de la infección más del 85% de las células se encuentran infectadas (12).
El método de concentración agua-éter es adecuado para la concentración de esporas y su posterior cultivo debido a que las filtraciones sucesivas permiten retirar los restos de la materia fecal que pueden afectar el cultivo.
A diferencia de lo reportado por van Gool (14), en nuestro estudio no utilizamos soportes permeables de policarbonato para el establecimiento de la monocapa de la línea celular, sino que sembramos directamente las células Vero en placas de 24 pozos, lo cual no afectó el crecimiento de las esporas del paciente. Posiblemente, van Gool utilizó esta metodología con el fin de realizar las evaluaciones de su cultivo mediante microscopía electrónica, técnica que no fue utilizada en este trabajo.
Este estudio reviste gran importancia puesto que reporta el primer aislamiento de microsporidios en Colombia a partir de materia fecal y, además, con el establecimiento exitoso de esta cepa autóctona se podrían realizar estudios relacionados con el entendimiento de la biología y relación huésped-parásito, el desarrollo de reactivos inmunológicos y moleculares para el uso en el diagnóstico clínico, la elaboración de marcadores antigénicos y moleculares para aislamientos que pueden ser de utilidad en estudios de epidemiología molecular, particularmente en la búsqueda de las fuentes del agente causal en enfermedades entéricas y, finalmente, puede ser útil para determinar la eficacia de agentes antimicrobianos a diferentes microsporidios y la formulación de nuevas estrategias preventivas.
Agradecimientos
Al Comité para el Desarrollo de la Investigación-CODI de la Universidad de Antioquia (Código CPT 0328) por su apoyo financiero. A la Corporación Académica para el Estudio de las Patologías Tropicales-CAEPT.
Conflictos de intereses
Informamos que durante el desarrollo del trabajo titulado Primer aislamiento de Encephalitozoon intestinalis a partir de muestra de materia fecal de un paciente colombiano con sida ni los autores ni la institución que representamos incurrimos en ningún tipo de conflicto de intereses.
Financiación
Este proyecto fue financiado por el Comité para el Desarrollo de la Investigación-CODI de la Universidad de Antioquia, proyecto Efecto de la clorinación sobre la viabilidad e infectividad (sic.) de esporas de microsporidios intestinales de un aislamiento clínico, código CAEPT-0328.
Correspondencia:
Ana Luz Galván, Grupo GIEPI, Departamento de Microbiología y Parasitología, Facultad de Medicina, Universidad de Antioquia, carrera 51 D No. 62-29, Medellín, Colombia Teléfono: (574) 210 5487 y 210 6055; fax: 210 6050 agalvandiaz@yahoo.com
Referencias
1. Sprague VV, Becnel JJ. Note on the name-author-date combination for the taxon Microsporidies Balbiani, 1882, when ranked as Phylum. J Invertebr Pathol. 1998;71:91-4. [ Links ]
2. Franzen C, Müller A. Microsporidiosis: human diseases and diagnosis. Microbes Infect. 2001;3:389-400. [ Links ]
3. Mathis A, Weber R, Deplazes P. Zoonotic potential of the microsporidia. Clin Microbiol Rev. 2005;18:423-45. [ Links ]
4. Franzen C, Müller A. Molecular techniques for detection, species differentiation, and phylogenetic analysis of microsporidia. Clin Microbiol Rev. 1999;12:243-85. [ Links ]
5. Wasson K, Peper RL. Mammalian microsporidiosis. Vet Pathol. 2000;37:113-28. [ Links ]
6. Didier S. Microsporidiosis: An emerging and opportunistic infection in humans and animals. Acta Trop. 2005;94:61-76. [ Links ]
7. Kotler DP, Orenstein JM. Prevalence of intestinal microsporidiosis in HIV-infected individuals referred for gastroenterological evaluation. Am J Gastroenterol. 1994;8:1998-2002. [ Links ]
8. Gamboa Domínguez A, Bencosme Vinas C, Kato Maeda M. Microsporidiasis in AIDS patients with chronic diarrhea. Experiences at the National Institute of Nutrition Salvador Zubriran. Rev Gastroenterol Mex. 1999;64: 70-4. [ Links ]
9. Brasil P, de Lima DB, de Paiva DD, Lobo MS, Sodre FC, Silva SP, et al. Clinical and diagnostic aspects of intestinal microsporidiosis in HIV-infected patients with chronic diarrhea in Rio de Janeiro, Brazil. Rev Inst Med Trop Sao Paulo. 2000;42:299-304. [ Links ]
10. Flórez AC, García DA, Moncada LI, Beltrán M. Prevalencia de microsporidios y otros parásitos intestinales en pacientes con infección por VIH, Bogotá, 2001. Biomédica. 2003;23:274-82. [ Links ]
11. Botero J, Montoya MN, Agudelo S, Vanegas AL, Diaz A, Bornay FJ, et al. Frecuencia de microsporidiosis intestinal en pacientes VIH positivos determinada mediante las técnicas de quick-hot gram chromotropo y PCR. Biomédica. 2004;24:375-84. [ Links ]
12. Visvesvara GS. Microsporidia: in vitro cultivation of microsporidia of clinical importance. Clin Microbiol Rev. 2002;15:401-13. [ Links ]
13. Del Aguila C, Croppo GP, Moura H, da silva AJ, Leitch GJ, Moss DM, et al. Ultrastructure, immunofluorescence, western blot, and PCR analysis of eight isolates of Encephalitozoon (septata) intestinalis established in culture from sputum and urine samples and duodenal aspirates of five patients with AIDS. J Clin Microbiol. 1998;36:1201-8. [ Links ]
14. van Gool T, Canning EU, Gilis H, van den Bergh Weerman MA, Eeftinck Schattenkerk JK, Dankert J. Septata intestinalis frequently isolated from stool of AIDS patients with a new cultivation method. Parasitology. 1994;109:281-9. [ Links ]
15. Visvesvara GS, da Silva AJ, Croppo GP, Pieniazek NJ, Leitch GJ, Ferguson D, et al. In vitro culture and serologic and molecular identification of Septata intestinalis isolated from urine of a patient with AIDS. J Clin Microbiol. 1995;33:930-6. [ Links ]
16. da Silva AJ, Schwartz DA, Visvesvara GS, de Moura H, Slemenda SB, Pieniazek NJ. Sensitive PCR diagnosis of infections by Enterocytozoon bieneusi (microsporidia) using primers based on the region coding for small-subunit rRNA. J Clin Microbiol. 1996;34:986-7. [ Links ]














