Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Biomédica
versión impresa ISSN 0120-4157versión On-line ISSN 2590-7379
Biomédica v.28 n.4 Bogotá oct./dic. 2008
1 Laboratorio de Parasitología Molecular, Departamento de Microbiología, Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
2 Grupo de Parasitología, Subdirección de Investigación, Instituto Nacional de Salud, Bogotá, D.C., Colombia
3 Laboratorio de Patología, Subdirección Red Nacional de Laboratorios, Instituto Nacional de Salud, Bogotá, D.C., Colombia.
* Igual participación en el estudio
Recibido: 02/04/08; aceptado:28/08/08
Introducción. El trasplante es una opción terapéutica en la cardiomiopatía chagásica. Para la detección temprana de una posible reactivación de la infección, se propone el uso de pruebas de reacción en cadena de la polimerasa (PCR) a partir de biopsias endomiocárdicas; el modelo de ratón es una aproximación preliminar para evaluar la aplicación de éstas.
Objetivo. Evaluar la aplicación de las pruebas de PCR basadas en los iniciadores TcH2AF-R y S35-S36 para la detección de T. cruzi en tejido cardiaco de ratones infectados con el parásito.
Materiales y métodos. Se infectaron por vía intraperitoneal dos grupos de ratones ICR de 15 y 10 individuos con 0,3 ml de PBS que contenían 1x106 tripomastigotes de la cepa MHOM/CO/2001/D.A. (T. cruzi I) o 1x104 tripomastigotes de la cepa MHOM/BR/00/Y (T. cruzi II), respectivamente. El seguimiento de la parasitemia se realizó mediante microhematocrito y presencia de parásitos en el corazón a los 30, 60 (modelo agudo), 100 y 150 (modelo crónico) días por medio de histopatología y de las PCR TcH2AF-R y S35-S36.
Resultados. La histopatología mostró alteraciones en el miocardio y presencia de amastigotes en los modelos agudo y crónico. En contraste al microhematocrito y al análisis histopatológico, la PCR S35-S36 permitió la detección de ambas cepas del parásito. La PCR TcH2AF-R detectó la cepa T. cruzi I con un desempeño superior al microhematocrito y al análisis histopatológico.
Conclusiones. El uso de ambas pruebas de PCR puede ser útil en la confirmación de la reactivación de la infección postrasplante.
Palabras clave: Trypanosoma cruzi, enfermedad de Chagas, cardiomiopatía chagásica, reacción en cadena de la polimerasa.
Introduction. Heart transplant is a therapeutic option in the treatment of chagasic cardiomyopathy. For early detection of Chagas reactivation cases, the use of PCR tests using endomyocardial biopsies has been proposed. Development of an animal model will be the first step in evaluating the applicability of this approach.
Objective. PCR tests based on the TcH2AF-R and S35-S36 primers were evaluated for the detection of T. cruzi in heart tissue of mice experimentally infected with the parasite.
Materials and methods. Two groups of ICR mice of 15 and 10 individuals were infected by intraperitoneal injection with 0.3 ml of PBS containing 1x106 trypomastigotes of the MHOM/CO/2001/D.A. (T. cruzi I) strain or 1x104 trypomastigotes of MHOM/BR/00/Y (T. cruzi II) strain. Parasitemia and cardiac parasitic infection were determined at 30, 60 (acute model), 100 and 150 (chronic model) days by means of histopathological examination and by PCR, using the TcH2AF-R and S35-S36 primers.
Results. The histopathological findings revealed alterations in the heart and the presence of intracellular amastigotes in acute and chronic models. In contrast to parasitemia levels and histopathological analyses, S35-S36 PCR detected infections in mice that were infected with either parasite strain. TcH2AF-R PCR detected T. cruzi I-infected mice earlier and more frequently than inspection for parasitemia or histopathological examination.
Conclusions. Applying PCR tests with both primers proved superior for Chagas disease confirmation over currently standard detection methods.
Key words: Trypanosoma cruzi, Chagas disease, Chagas cardiomyopathy, polymerase chain reaction.
La enfermedad de Chagas, causada por el protozoo flagelado Trypanosoma cruzi, es una de las princi-pales causas de cardiopatía en América Latina. Según la Organización Mundial de la Salud, aproximadamente, 10% a 30% de las personas con serología positiva pueden presentar cambios electrocardiográficos 10 a 20 años después de la primoinfección (1).
La cardiopatía chagásica se caracteriza por presentar alteraciones en el miocardio asociadas al proceso inflamatorio localizado, observándose cambios histológicos relacionados con la presencia de infiltrados de células mononucleares. Este proceso inflamatorio conlleva a la destrucción de las células musculares cardíacas y del tejido de conducción, con fibrosis difusa e infiltrado inflamatorio importante, responsables de las manifestaciones clínicas graves como la insuficiencia cardiaca y, eventualmente, la muerte súbita (2).
Debido a que el daño tisular en esta fase de la enfermedad es irreversible, el único tratamiento posible para estos pacientes es el trasplante de corazón. Sin embargo, existe riesgo de reacti-vación de la enfermedad por las condiciones de inmunosupresión a que se ven sometidos los pacientes para tal procedimiento. Por este motivo, se hace necesario establecer un método de seguimiento que permita detectar una posible reactivación de manera temprana y establecer una vigilancia óptima con el fin ofrecer una mejor calidad y una mayor expectativa de vida a estos pacientes (3).
El seguimiento de los pacientes en fase crónica exige técnicas muy sensibles y específicas, ya que el número de formas tripomastigotes presentes en sangre es muy reducido debido al tropismo que tienen los parásitos hacia el tejido cardíaco, por esta razón los métodos convencionales de diagnóstico son de poca utilidad, ya sea porque requieren de altas concentraciones de parásitos circulantes en sangre (extendido de sangre periférica y método Strout) o por ser técnicas que requieren de mucho tiempo para realizar el diagnóstico (xenodiagnóstico y hemocultivo) (4,5). Por otra parte, las técnicas serológicas no permiten distinguir adecuadamente la reinfección y, además, pueden presentar poca especificidad debido a la posibilidad de reacciones cruzadas (6).
Otra técnica muy significativa en el diagnóstico de la enfermedad de Chagas es el estudio histopatológico que permite identificar al parásito en lesiones en el tejido cardíaco y las vías digestivas (7). Sin embargo, no siempre se observan formas amastigotes de T. cruzi en el tejido cardiaco durante la fase crónica de la enfermedad (8).
Por los anteriores motivos, actualmente se requiere de técnicas complementarias como la reacción en cadena de la polimerasa (PCR), empleada como herramienta diagnóstica en varias enfermedades infecciosas, dadas sus ventajas en términos de sensibilidad y especificidad, que permiten un diagnóstico rápido y fidedigno. Es así como la prueba de PCR puede constituir una herramienta importante para llegar al diagnóstico oportuno y vigilancia de esta parasitosis en sus etapas, indeterminada y crónica (9).
Teniendo en cuenta lo anterior, en este trabajo se propuso la aplicación de dos pruebas de PCR basadas en los iniciadores TcH2AF-R y S35-S36, los cuales amplifican un fragmento de 230 pares de bases (pb) a partir de los genes de la histona H2A y el elemento SIRE (short interpersed repetitive element) del parásito (10-12) y un fragmento de 330 pb (13) a partir del ADN del cinetoplasto (ADNk), para la detección de T. cruzi en tejido cardíaco de ratón, con miras a su posterior aplicación en el seguimiento de la reactivación y vigilancia del tratamiento en pacientes chagásicos después del trasplante.
Materiales y métodos
Animales
Se utilizó un grupo de 33 ratones machos de especie ICR de 15 días de edad mantenidos en el bioterio del Instituto Nacional de Salud.
Parásitos
Se trabajó con las cepas MHOM/CO/2001/D.A. (T. cruzi I) y MHOM/BR/00/Y (T. cruzi II); dichas cepas fueron cedidas por el Laboratorio de Parasitología del Instituto Nacional de Salud, caracterizadas por isoenzimas y PCR (14,15). La obtención en masa de los parásitos se realizó en medio LIT con suplemento de 2% de suero fetal bovino (SFB) y 100 mg/ml de gentamicìna, luego de su pase cíclico por ratón e insecto.
Infección de los animales
Se inocularon 15 ratones por vía intraperitoneal con 1x106 tripomastigotes de la cepa T. cruzi I en 0,3 ml de PBS y 10 ratones con un inóculo menor, 1x104 tripomastigotas, de la cepa T. cruzi II, debido a su letalidad. Con cada grupo infectado se trabajó un grupo control conformado por cuatro ratones inoculados con medio LIT. Se determinó la parasitemia de los ratones a partir de los 15 días después de la infección mediante el método de microhematocrito (16) y se extrajeron el corazón, el hígado, el bazo, músculo esquelético, el riñón, el intestino delgado y el pulmón a los ratones infectados y a un ejemplar del grupo control a los 30, 60 (modelo agudo), 100 y 150 días (modelo crónico) después de la infección (17).
Se hicieron dos cortes de tejido fresco cardiaco de las regiones apical, derecha e izquierda del corazón, uno para estudio histopatológico (3 x 3 x 2, 6 x 4 x 2, 6 x 4 x 2 mm, respectivamente) y otro para PCR (5 x 2 x 2, 8 x 4 x 2, 8 x 5 x 2 mm, respectivamente). El análisis histopatológico se hizo en el Laboratorio de Patología del Instituto Nacional de Salud, mediante la técnica convencional de eosina hematoxilina.
La extracción de ADN se realizó por el método de lisis alcalina modificada (18) y el ADN extraído fue analizado mediante electroforesis en geles de agarosa al 1% y determinación de la absorbancia a 260 y 280 nm por espectometría (19). Los otros órganos, hígado, bazo, músculo esquelético, riñón, intestino delgado y pulmón, se analizaron mediante histopatología. Cabe mencionar que los animales que se murieron debido a la infección, fueron inme-diatamente incinerados de acuerdo con el protocolo de manejo del Instituto Nacional de Salud.
Análisis por reacción en cadena de polimerasa
Se utilizaron los iniciadores TcH2AF (5-GAGAGTGATCGTGGGAGAGC-3) y TcH2AR (5-AGTGGCAGACTTTGGGGTC-3), los cuales permiten la amplificación de una banda de 230 pb de la región 3 no codificante de la unidad de 1,2 kb perteneciente al gen que codifica para la histona H2A y a los nucleótidos 16 a 246 del elemento SIRE (10-12). La reacción de amplificación se llevó a cabo en un volumen final de 25 µl conteniendo: solución tampón de reacción 1X (Tris-HCl 10 mM, pH 9,0, KCl 50 mM), dNTP 200 mM, cebadores 20 pmoles, MgCl2 1,5 mM, Taq DNA polimerasa 0,5 U y 5 µl de ADN (diluido 1/5, 1/10, 1/20, 1/40 o sin diluir); llevándose a cabo en un termociclador MJ Research PT-100, usando el siguiente programa: 95 °C por 5 minutos, 15 ciclos de 95 °C por 30 s y 72 °C por 1 minuto, seguidos de 20 ciclos con hibridación a 63 °C por 30 s y extensión a 72 °C por 30 s, más extensión final a 72 °C por 5 minutos (11). También se utilizaron los iniciadores denominados S35 (5- AAATAATGTACGGG(T/G)GAGATGCATGA-3) y S36 (5-GGGTTCGATTGGGGTTGGTGT-3), los cuales amplifican un fragmento de 330 pb derivado de la región variable de los minicirculos de T. cruzi (13,20). La reacción de amplificación se realizó usando las condiciones anteriores con excepción de la cantidad de cebadores (25 pmoles) y concentración de MgCl2 (3,5 mM), en un termociclador MJ Research PT-100 programado de la siguiente manera: 95 °C por 5 minutos, 30 ciclos de 95 °C por 1 minuto, 60 °C por 1 minuto y 72 °C por 1 minuto, seguidos de extensión final a 72 °C por 5 min.
Como control de reacción en ambas reacciones de PCR, se adicionó agua en lugar de ADN; como control positivo, muestras de ADN de T. cruzi extraídas de cultivos y como control negativo se adicionó ADN de ratones no infectados. Los productos de amplificación se analizaron mediante electroforesis en geles de agarosa al 1,5% teñidos con bromuro de etidio (19). Para descartar la presencia de inhibidores de la PCR en las muestras, a aquéllas con resultados de ampli-ficación negativo, les fue adicionado ADN del parásito, previa nueva reacción de PCR.
Determinación de la concordancia entre las pruebas de PCR TcH2AF-R y S35-S36
A partir de los 21 ratones disecados que sobre-vivieron a la infección (ocho controles negativos, ocho animales infectados con la cepa T. cruzi I y cinco con T. cruzi II), se consideraron positivos aquellos animales en los cuales se observó el parásito en cualquiera de las fracciones cardíacas estudiadas (apical, derecha o izquierda). Los análisis se realizaron usando tablas de contingencia de 2 x 2. Se determinaron los índices kappa de concor-dancia, con sus intervalos de confianza de 95%, de las pruebas de PCR evaluadas.
Aspectos éticos
Este estudio se realizó de acuerdo con las disposiciones de la Resolución No. 08430 del Ministerio de Salud de Colombia, cumplió con las disposiciones nacionales e internacionales acerca del uso de animales de experimentación y fue aprobado por el Comité Técnico de Investiga-ciones y el Comité de Ética del Instituto Nacional de Salud.
Resultados
Comportamiento de las cepas del parásito
Se encontró que, en el mismo tipo de ratones (ICR machos), la cepa colombiana T. cruzi I (MHOM/CO/2001/D.A.) y la cepa de Brasil T. cruzi II (MHOM/BR/00/Y) se comportaron de forma diferente en cuanto al porcentaje de capacidad de infección, pico de parasitemia, tropismo tisular y mortalidad de los animales (cuadro 1).

El comportamiento de la cepa T. cruzi I mostró importante parasitemia con valores máximos de 936,8 parásitos/µl y una persistencia prolongada hasta los 74 días después de la infección con parasitemias de 0,89 parásitos/µl, (promedio de tres ratones); se observó reaparición de parasitemia en un ratón desde los 132 días después de la infección y, en otro, a los 150 días después de la infección, con valores de parasitemia de 1,14-0,45 y 0,18 parásitos/µl, respectivamente. Se estableció invasión temprana hacia el corazón y el músculo estriado, evidenciándose cardio-megalia especialmente en la fase aguda de la infección, desarrollo de miocarditis y mortalidad de 26% (cuadro 1).
En cuanto al comportamiento de la cepa T. cruzi II, se desarrollaron niveles bajos y heterogéneos de parasitemia en la fase aguda de la enfermedad, con valores máximos de 6,27 parásitos/µl al día 15 después de la infección, evidenciándose parasitemia hasta el día 21 solamente en uno de los ratones infectados (0,09 parásitos/µl). Se presentaron porcentajes de mortalidad de 50%, mayores con respecto al grupo infectado con la cepa T. cruzi I (cuadro 1). Se evidenció afinidad de la cepa hacia las células del músculo cardiaco hacia los 30 días después de la infección y no se observó tropismo hacia otros órganos como pulmón, hígado, riñón, bazo e intestino delgado, ni cambios morfológicos en los mismos. Durante la fase crónica de la infección, no se observó parasitemia, ni tropismo hacia órganos.
Análisis histopatológicos
En los ratones infectados con la cepa T. cruzi I se observó desarrollo de miocarditis caracterizada por infiltrados linfomonocitarios con diferentes grados de gravedad, acompañada de una activa destrucción de miocitos y miofibrillas, así como también de presencia de pseudoquistes de amastigotes de T. cruzi en el tejido cardiaco (figura 1A). También se reconocieron amastigotes en cortes de músculo esquelético desde los 30 hasta los 100 días después de la infección, en donde se observaron ocasionales nidos o pseudoquistes intracelulares de estas formas parasitarias (figura 1B). Los demás órganos (pulmón, hígado, riñón, bazo e intestino delgado) revelaron cambios histológicos con presencia de infiltrado inflamatorio linfomonocitario, tanto en el modelo agudo (30 y 60 días después de la infección) como en el modelo crónico de la enfermedad (100 y 150 días después de la infección), en ausencia de parásitos.
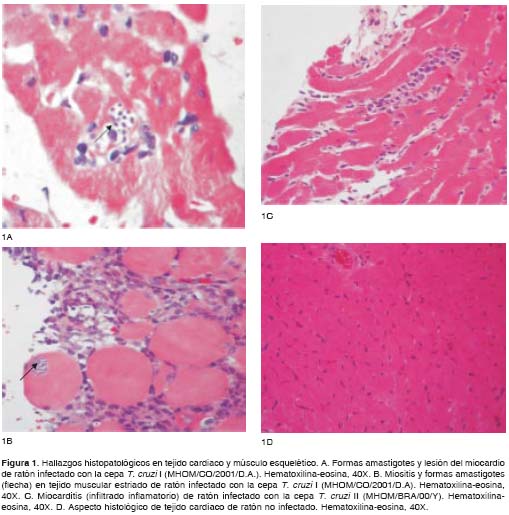
Los hallazgos histopatológicos en los ratones infectados con la cepa T. cruzi II a los 30 días después de la infección evidenciaron presencia de inflamación de tipo linfomonocitario, acompañada ocasionalmente por formas intracelulares del parásito (figura 1C). Los estudios histopatológicos en las demás fechas (60, 100 y 150 días después de la infección), no revelaron ningún cambio en el miocardio, al igual de lo ocurrido en los tejidos de los ratones no infectados (figura 1D), ni en los demás órganos analizados (pulmón, hígado, riñón, bazo e intestino delgado).
Análisis del comportamiento de las pruebas de PCR TcH2AF-R y S35-S36 en tejido cardiaco de ratones
Los resultados obtenidos en las muestras de los ratones infectados con la cepa T. cruzi I muestran que, utilizando ambas parejas de iniciadores, fue posible detectar el parásito presente en el tejido de los ratones con gran eficiencia durante la etapa aguda (30 y 60 días después de la infección) y crónica (100 y 150 días después de la infección) de la infección, observándose la amplificación de los fragmentos de amplificación esperados de 230 y 330 pb (figura 2 y figura 3) (cuadro 2).
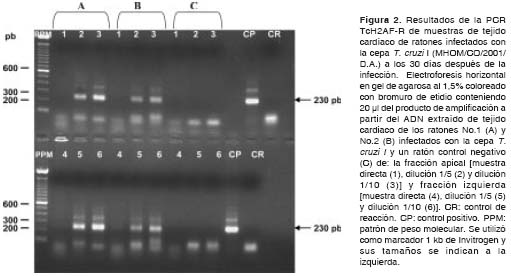
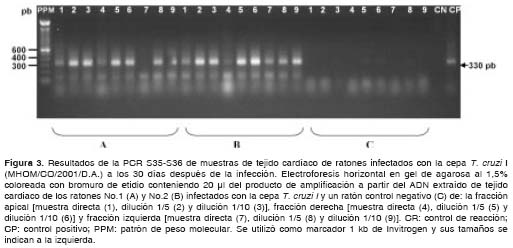
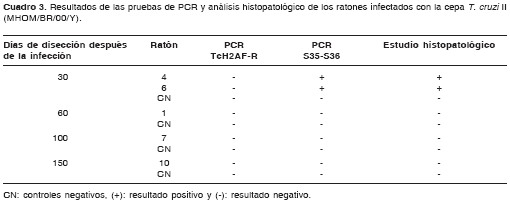
En cuanto a las muestras de los ratones infecta-dos con la cepa T. cruzi II, con los iniciadores S35-S36 se detectó la presencia del parásito únicamente a los 30 días después de la infección, mientras que, utilizando los iniciadores TcH2AF-R, no fue posible detectar el parásito en el tejido en ninguna de las etapas de la infección (cuadro 3).
Comparación de los resultados de parasitemia, histopatología y PCR
El análisis comparativo del desempeño de todas las pruebas usadas para detectar la infección en los ratones mostró que ambas pruebas de PCR fueron capaces de detectar la infección por la cepa T. cruzi I en ambas fases de la enfermedad en todos los animales (cuadro 2). Se destaca que en la fase crónica a los 100 días no hubo parasitemia y a los 150 días ambas pruebas de PCR fueron las únicas capaces de detectar la infección en todos los ratones positivos. Por su parte, la infección con la cepa T. cruzi II sólo fue detectada durante la fase aguda por el análisis histo-patológico en dos de cinco animales y, por la PCR S35-S36, en todos los animales (cuadro 3).
Discusión
Dada la dificultad de trabajar con muestras de tejido humano, se escogió un modelo animal como primera aproximación para evaluar el uso de las técnicas de PCR mencionadas.
En primer lugar se desarrollaron en forma exitosa los modelos de infección aguda y crónica en los animales tanto con la cepa T. cruzi I, como la de T. cruzi II, en ambos casos con presencia del parásito en los tejidos y aparición de lesiones inflamatorias típicas de la miocarditis chagásica en modelos de ratón (21). Vale la pena mencionar cómo, a diferencia de las infecciones crónicas humanas, en los ratones los amastigotes fueron fácilmente detectados en el miocardio por la técnica convencional de eosina-hematoxilina, razón por la cual no fue necesario recurrir a técnicas más sensibles como la inmunohistoquímica.
En segundo lugar, se encontraron diferencias impor-tantes en el comportamiento de cada una de las cepas del parásito según el grupo del mismo.
Las bajas parasitemias y la corta persistencia del parásito en sangre en los ratones infectados con la cepa T. cruzi II, sumadas al hecho de que se usaron cantidades diferentes de parásitos para infectar los animales con cada cepa, sugieren que la cepa T. cruzi II usada en este estudio, MHOM/BRA/00/Y, muestra un cuadro más agresivo y agudo (detección del parásito hasta 30 días después de la infección) que la cepa T. cruzi I, MHOM/CO/2001/D.A., la cual presenta menor virulencia pero mayor cronicidad (detección del parásito hasta 150 días después de la infección). Estos resultados concuerdan con lo anteriormente descrito por Marinho y colaboradores (22) quienes, usando una cepa de T. cruzi I (clon Sylvio X10/4), encontraron que estos animales desarrollaron la fase crónica de la infección con lesiones comparables a las encontradas en la cardiopatía chagásica humana.
En cuanto al tropismo hacia los diferentes tejidos por la cepa T. cruzi I en este modelo de ratón, los resultados de patología demostraron una importante afinidad por el tejido muscular, principalmente por el miocardio, siendo este órgano el más intensamente parasitado. La invasión a este tejido se estableció de manera temprana, observándose la presencia de miocarditis y miositis aguda grave linfomono-citaria, similar a lo encontrado en estudios previos con otras cepas de T. cruzi y de ratón (21-23). Además, se encontró presencia de focos inflamatorios en otros órganos como bazo, hígado, pulmón, intestino delgado y músculo esquelético; además, en este último se observaron amasti-gotes, resultados que concuerdan con los hallazgos de Cummins y Tarleton (24).
En cuanto al comportamiento de la cepa T. cruzi II, se detectó afinidad de la cepa hacia las células del músculo cardíaco únicamente en la etapa aguda de la enfermedad (30 días después de la infección), sin evidencia de tropismo hacia otros órganos. Estos resultados contrastan con los obtenidos por otros autores con esta misma cepa y otras del grupo T. cruzi II (25,26), los que demuestran tropismo de este parásito por diferentes órganos. Estos resultados pueden explicarse por una o varias de las siguientes suposiciones: (i) aunque la cepa T. cruzi II utilizada en los ensayos de infección, MHOM/BR/00/Y, fue previamente sometida a pase por ratón, es posible que el mantenimiento in vitro previo de la misma con múltiples pases en el laboratorio influyera de manera importante en su patogenicidad; (ii) la cepa de ratón utilizada es diferente a la utilizada por otros autores, por lo que el desarrollo de la infección puede variar (27), y (iii) no puede descartarse la presencia del parásito en los otros órganos no analizados por PCR, como hígado, intestino grueso y cerebro.
Por otra parte, las técnicas moleculares han tenido un gran auge en el campo de la parasitología debido a su alta sensibilidad y especificidad. En el diagnóstico de la enfermedad de Chagas se ha utilizado la reacción en cadena de la polimerasa usando diferentes cebadores para evidenciar la presencia del parásito tanto en sangre periférica de pacientes en diferentes fases de la enfermedad como en tejido cardiaco, realizándose incluso estudios de hibridización in situ (28-31).
Analizando el desempeño de las pruebas de PCR TcH2AF-R y S35-S36, en primer lugar se confirmó la especificidad de ambas pruebas (10-13), ya que no se obtuvieron bandas de amplificación en los tejidos de los animales no infectados. También, se encontró una correlación muy buena entre ellas, independientemente del tiempo de infección, del ratón o de la fracción de tejido cardiaco analizada, para el caso de las muestras de los animales infectados con la cepa T. cruzi I. En contraste, tan sólo la PCR S35-S36 fue capaz de detectar la presencia del parásito en el tejido de los ratones infectados con la cepa T. cruzi II. Así mismo, en cuanto a la comparación de las pruebas de PCR con el análisis histopatológico, llama la atención que, para el caso de la infección con la cepa T. cruzi I, ambas PCR se comportan de forma superior al análisis histopatológico. Sin embargo, en el modelo agudo de la cepa T. cruzi II, mientras el análisis histopatológico detectó dos (2/5) muestras positivas, la PCR TcH2AF-R permaneció negativa en todos los casos. Estos resultados pueden explicarse teniendo en cuenta la mayor carga parasitaria observada en los ratones infectados con la cepa T. cruzi I, la mayor sensibilidad reportada para la PCR S35-S36 (13) y al mayor número de moléculas blanco, es decir, de moléculas de ADN a las cuales se anillan los cebadores, en el genoma de las cepas T. cruzi I que en T. cruzi II (32). En este sentido, es importante tener en cuenta que en Colombia la mayoría de cepas circulantes del parásito son T. cruzi I (33,34) y, por lo tanto, se esperaría un buen desempeño de ambas pruebas de PCR en muestras infectadas con cepas colombianas.
Se ha reportado que el ADN de los minicírculos del parásito puede insertarse en las células del huésped de forma que podría existir amplificación en ausencia del parásito vivo (35). Por lo anterior, se recomienda el uso de ambas pruebas de PCR, puesto que al estar amplificando blancos diferentes, productos del ADN del minicírculo y ADN nuclear, estas pruebas pueden evidenciar la presencia real de la infección. Además, al tener sensibilidades diferentes, el uso de la PCR TcH2AF-R en conjunto con la PCR S35-S36 permitiría detectar un aumento en la carga parasitaria, el cual indicaría sospecha de reactivación de la enfermedad en receptores chagásicos (mediante pruebas de PCR en sangre y tejido) y en receptores no infectados con trasplante de órganos de donante chagásico como riñón e hígado (mediante pruebas de PCR en tejido).
Por otra parte, es importante anotar la falta de concordancia entre las parasitemias y las pruebas realizadas directamente en los tejidos, especialmente en la fase crónica del modelo T. cruzi I y la infección en ambas fases en el modelo de T. cruzi II. Para el caso de la cepa T .cruzi II, es muy notoria esta diferencia por cuanto hay presencia del parásito en tejido a los 30 días después de la infección (PCR S35-S36 y estudio histopatológico), pero ausencia en sangre desde los 13 días después de la infección. Incluso, uno de los animales no presentó parasitemias detectables, pero sí se observó la presencia del parásito en tejido cardiaco.
Lo anterior tiene implicaciones prácticas importantes en el sentido de que la detección de las parasitemias por métodos tradicionales, como la de técnica de microstrout utilizada en este trabajo, no puede usarse para el seguimiento de la reactivación en pacientes chagásicos con trasplante. Diferentes autores han propuesto el uso de la PCR en muestras de sangre para este propósito (36,37), siendo importante la utilización de dos PCR que difieran en dos órdenes de magnitud logarítmica en su poder de detección del parásito, para evidenciar con el resultado positivo de la prueba menos sensible, el aumento en la carga parasitaria de los tejidos debido a la reactivación de la infección, así como la disminución de la misma, después del tratamiento con benznidazol. Esto podría lograrse con el uso en conjunto de las pruebas TcH2AF-R y S35-S36.
Por otra parte, la detección del parásito directamente en la biopsia endomiocárdica reviste importancia, no sólo para la apropiada distinción entre la reactivación de la enfermedad y el rechazo agudo del trasplante (38), sino también para el seguimiento del tratamiento de la misma y el estudio de muestras de archivo. En este sentido, el uso de pruebas de PCR, convencional y en tiempo real, en el tejido afectado, se presenta como una de las opciones teniendo en cuenta que, por ejemplo, la PCR S35-S36 ya ha sido escalada a tiempo real con óptimos resultados (24).
Agradecimientos
Los autores expresan su agradecimiento a Ivonne Balzer y Nubia Roa del Departamento de Microbiología y del Hospital Universitario San Ignacio de la Pontificia Universidad Javeriana, por sus valiosos aportes y comentarios al trabajo.
Conflicto de interés
Los autores manifestamos expresamente que durante la realización del presente trabajo no existió conflicto de interés alguno que pudiera afectar los resultados obtenidos.
Financiación
Este estudio fue financiado por la Vicerrectoría Académica de la Pontificia Universidad Javeriana, registro de proyecto ID 00000609.
Correspondencia:
Concepción Judith Puerta, Laboratorio de Parasitología Molecular, Departamento de Microbiología, Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia. Teléfono:(571) 3208320, extensión 4024; fax (571) 3208320, extensión 4021 cpuerta@javeriana.edu.coReferencias
1. World Health Organization. Control of Chagas disease. Second report of the WHO Expert Committee. Technical report 2002, series 905. Geneva: WHO; 2002. p. 39-40. [ Links ]
2. Moncayo A, Ortiz MI. An update on Chagas disease (Human American trypanosomiasis). Ann Trop Med Parasitol. 2006;100:663-77. [ Links ]
3. Urinovsky FM, Salomone OA, Córdoba R, Zazu AJ, Martínez A, Zlocowsky JC, et al. Morbimortalidad de los pacientes con cardiomiopatía chagásica y trasplante cardiaco. Experiencia inicial. Rev Arg Cardiol. 2003;71:325-31. [ Links ]
4. Castro AM, Luquetti AO, Rassi A, Rassi GG, Chiari E, Galvao LM. Blood culture and polymerase chain reaction for the diagnosis of the chronic phase of human infection with Trypanosoma cruzi. Parasitol Res. 2002;88:894-900. [ Links ]
5. Teixeira AR, Nitz N, Guimaro MC, Gomes C, Santos-Buch CA. Chagas disease. Postgrad Med J. 2006;82:788-98. [ Links ]
6. Bértoli M, Andó MH, De Ornelas Toledo MJ, De Araújo SM, Gomes ML. Infectivity for mice of Trypanosoma cruzi I and II strains isolated from different hosts. Parasitol Res. 2006;99:7-13. [ Links ]
7. Schijman AG, Vigliano CA, Viotti RJ, Burgos JM, Brandariz S, Lococo BE, et al. Trypanosoma cruzi DNA in cardiac lesions of Argentinian patients with end-stage chronic Chagas heart disease. Am J Trop Med Hyg. 2004;70:210-20. [ Links ]
8. Andrade Z, Andrade S. Chagas disease, pathology and pathogenesis. En: Gilles HM, editor. Protozoal diseases. New York, USA: Arnold Publishers; 1999. p. 323-35. [ Links ]
9. Kirchhoff LV, Votava JR, Ochs DE, Moser DR. Comparison of PCR and microscopic methods for detecting Trypanosoma cruzi. J Clin Microbiol. 1996;34:1171-5. [ Links ]
10. Pavía P, Cuervo C, Montilla M, Nicholls S, Puerta C. Estandarización de una prueba de PCR específica para la detección de Trypanosoma cruzi. Infectio. 2003;7:129-35. [ Links ]
11. Pavia PX, Vallejo GA, Montilla M, Nicholls RS, Puerta CJ. Detection of Trypanosoma cruzi and Trypanosoma rangeli infection in triatomine vectors by amplification of the histone H2A/SIRE and the sno-RNA-C11 genes. Rev Inst Med Trop Sao Paulo. 2007;49:23-30. [ Links ]
12. Gil J, Pavía P, Montilla M, Florez AC, Quintero C, Mercado M, et al. Comparación de una prueba de PCR basada en los genes codificantes para la histona H2A/SIRE con pruebas serológicas convencionales para el diagnóstico de la enfermedad de Chagas crónica en pacientes colombianos. Biomédica. 2007;27(Suppl.1):83-91. [ Links ]
13. Sturm NR, Degrave W, Morel C, Simpson L. Sensitive detection and schizodeme classification of Trypanosoma cruzi cells by amplification of kinetoplast minicircle DNA sequences: use in diagnosis of Chagas disease. Mol Biochem Parasitol. 1989;33:205-14. [ Links ]
14. Montilla MM, Guhl F, Jaramillo C, Nicholls S, Barnabe C, Bosseno MF, et al. Isoenzyme clustering of Trypanosomatidae Colombian populations. Am J Trop Med Hyg. 2002;66:394-400. [ Links ]
15. Vallejo GA, Guhl F, Chiari E, Macedo AM. Species specific detection of Trypanosoma cruzi and Trypanosoma rangeli in vector and mammalian hosts by polymerase chain reaction amplification of kinetoplast minicircle DNA. Acta Trop. 1999;72:203-12. [ Links ]
16. de Arias AR, Ferro EA. Quantification of Trypanosoma cruzi parasitemia by direct micromethod. Trans R Soc Trop Med Hyg. 1988;82:248. [ Links ]
17. Martin DL, Postan M, Lucas P, Gress R, Tarleton RL. TGF-beta regulates pathology but not tissue CD8+ T cell dysfunction during experimental Trypanosoma cruzi infection. Eur J Immunol. 2007;37:2764-71. [ Links ]
18. Freitas JM, Lages-Silva E, Crema E, Pena SD, Macedo AM. Real time PCR strategy for the identification of major lineages of Trypanosoma cruzi directly in chronically infected human tissues. Int J Parasitol. 2005;35:411-7. [ Links ]
19. Puerta C, Urueña C. Electroforesis en geles de agarosa. En: Puerta CJ, editor. Prácticas de biología molecular. Colección Biblioteca del Profesional. Bogotá D.C.: Editorial Pontificia Universidad Javeriana; 2005. p. 24-30. [ Links ]
20. Vallejo GA. Estudios comparativos entre las secuencias de kDNA de Trypanosoma cruzi y Trypanosoma rangeli y su aplicación en el diagnóstico molecular de la tripanosomiasis americana. Actual Biol. 1998;20:43-56. [ Links ]
21. Guarner J, Bartlett J, Zaki SR, Colley DG, Grijalva MJ, Powell MR. Mouse model for Chagas disease: inmunohistochemical distribution of different stages of Trypanosoma cruzi in tissues throughout infection. Am J Trop Med Hyg. 2001;65:152-8. [ Links ]
22. Marinho CR, Bucci DZ, Dagli ML, Bastos KR, Grisotto MG, Sardinha LR, et al. Pathology affects different organs in two mouse strains chronically infected by a Trypanosoma cruzi clone: a model for genetic studies of Chagas disease. Infect Immun. 2004;72:2350-7. [ Links ]
23. Andersson J, Orn A, Sunnemark D. Chronic murine Chagas disease: the impact of host and parasite genotypes. Immunol Lett. 2003;86:207-12. [ Links ]
24. Cummings KL, Tarleton RL. Rapid quantitation of Trypanosoma cruzi in host tissue by real-time PCR. Mol Biochem Parasitol. 2003;129:53-9. [ Links ]
25. Melo RC, Brener Z. Tissue tropism of different Trypanosoma cruzi strains. J Parasitol. 1978;64:475-82. [ Links ]
26. Pinto PL, Takami R, Nunes EV, Guilherme CS, Oliveira OC Jr, Gama-Rodrigues J, et al. Life cycle of Trypanosoma cruzi (Y strain) in mice. Rev Hosp Clin Fac Med Sao Paulo. 1999;54:141-6. [ Links ]
27. Soares MB, Pontes-De-Carvalho L, Ribeiro-Dos-Santos R. The pathogenesis of Chagas disease: when autoimmune and parasite-specific immune responses meet. An Acad Bras Cienc. 2001;73:547-59. [ Links ]
28. Lane JE, Olivares-Villagomez D, Vnencak-Jones CL, Mccurley TL, Carter CE. Detection of Trypanosoma cruzi with the polymerase chain reaction and in situ hybridization in infected murine cardiac tissue. Am J Trop Med Hyg. 1997;56:588-95. [ Links ]
29. Añez N, Carrasco HA, Parada H, Crisante G, Rojas A, Fuenmayor C, et al. Myocardial parasite persistence in chronic chagasic patients. Am J Trop Med Hyg. 1999;60:726-32. [ Links ]
30. Lane JE, Ribeiro-Rodrigues R, Olivares-Villagomez D, Vnencak-Jones CL, McCurley TL, Carter CE. Detection of Trypanosoma cruzi DNA within murine cardiac tissue sections by in situ polymerase chain reaction. Mem Inst Oswaldo Cruz. 2003;98:373-6. [ Links ]
31. Elias FE, Vigliano CA, Laguens RP, Levin MJ, Berek C. Analysis of the presence of Trypanosoma cruzi in the heart tissue of three patients with chronic Chagas heart disease. Am J Trop Med Hyg. 2003;68:242-7. [ Links ]
32. Thomas MC, Olivares M, Escalante M, Marañón C, Montilla M, Nicholls S, et al. Plasticity of the histone H2A genes in a Brazilian and six Colombian strains of Trypanosoma cruzi. Acta Trop. 2000;75:203-10. [ Links ]
33. Saravia NG, Holguín AF, Cibulskis RE, D Alessandro A. Divergent isoenzyme profiles of sylvatic and domiciliary Trypanosoma cruzi in the eastern plains, piedmont, and highlands of Colombia. Am J Trop Med Hyg. 1987;36:59-69. [ Links ]
34. Triana O, Jaramillo N, Moreno J. Genetic variability of Colombian populations of Trypanosoma cruzi and Trypanosoma rangeli. Biol Res. 1999; 32:1-10. [ Links ]
35. Nitz N, Gomes C, de Cássia Rosa A, Dsouza-Ault MR, Moreno F, Lauria-Pires L, et al. Heritable integration of kDNA minicircle sequences from Trypanosoma cruzi into the avian genome: insights into human Chagas disease. Cell. 2004;118:175-86. [ Links ]
36. Diez M, Favaloro L, Bertolotti A, Burgos JM, Vigliano C, Lastra MP, et al. Usefulness of PCR strategies for early diagnosis of Chagas disease reactivation and treatment follow-up in heart transplantation. Am J Transplant. 2007;7:1633-40. [ Links ]
37. Maldonado C, Albano S, Vettorazzi L, Salomone O, Zlocowski JC, Abiega C, et al. Using polymerase chain reaction in early diagnosis of re-activated Trypanosoma cruzi infection after heart transplantation. J Heart Lung Transplant. 2004;23:1345-8. [ Links ]
38. Benvenuti LA, Roggério A, Sambiase NV, Fiorelli A, Higuchi M. Polymerase chain reaction in endomyocardial biopsies for monitoring reactivation of Chagas disease in heart transplantation: a case report and review of the literature. Cardiovasc Pathol. 2005;14:265-8. [ Links ]














