Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.29 no.4 Bogotá Oct./Dec. 2009
ARTÍCULO ORIGINAL
1 Fundación Ecuatoriana para el Estudio de Mamíferos Marinos, Guayaquil, Ecuador
2 Investigación y Diagnóstico Microbiológico, Laboratorio de Parasitología, Instituto Nacional de Higiene y Medicina Tropical Leopoldo Izquieta Pérez, Guayaquil, Ecuador
Recibido: 24/02/09; aceptado:20/05/09Introducción. La gnathostomiasis humana fue reportada en Ecuador en 1981 a partir del hallazgo del tercer estadio larvario de Gnathostoma en Hoplias microlepis. Debido a que esta zoonosis es transmisible a humanos, su vigilancia y estudio ecoepidemiológico en sus huéspedes silvestres son de particular importancia en salud pública y control sanitario en Ecuador.
Objetivo. Contribuir con la evidencia más reciente de infección natural por Gnathostoma en el pez dulceacuícola Hoplias microlepis y su ciclo biológico en sistemas acuáticos de la provincia del Guayas, Ecuador.
Materiales y métodos. Se examinaron 74 peces obtenidos en dos localidades (campo de arrozales y mercado de peces) del Cantón Samborondón, provincia del Guayas. La presencia de Gnathostoma fue investigada en músculos de Hoplias microlepis. Se estimaron la abundancia y la prevalencia parasitarias, así como la comparación estadística de la intensidad parasitaria en los dos sitios estudiados y correlaciones de la carga parasitaria versus la talla de los peces.
Resultados. La prevalencia total de Gnathostoma fue de 69%, con una abundancia media de 1,70 larvas por pez. La prevalencia parasitaria fue relativamente mayor en los campos de cultivo de arroz (77%) en relación con el mercado local (62%). No se observaron diferencias significativas en las abundancias media de larvas y en las prevalencia entre los dos sitios de estudios (p>0,05). Se encontró una relación directa y significativa entre la carga parasitaria y la longitud del pez (Spearman p<0,05).
Conclusiones. La gnathostomiasis sigue siendo prevalente en la zona costera de Ecuador y el agente patógeno es aún encontrado en el huésped intermediario. Diversos mamíferos neotropicales estarían actuando como huésped reservorio definitivo en el ciclo biológico de Gnathostoma en Ecuador.
Palabras clave: Gnathostoma, larva migrans, interacciones huésped-parásitos, salud pública, Ecuador.
Gnathostoma (Spirurida: Gnathostomatidae) infection in the tigerfish Hoplias microlepis: prevalence, correlation with fish size, hosts, and public health implications
Introduction. Human gnathostomiasis has been reported in Ecuador since the early 1980s, when natural infections by Gnathostoma third larval stages were found in muscles of the second intermediary host, Hoplias microlepis (tigerfish). In Ecuador, this zoonotic disease is occasionally detected in humans, and its monitoring and eco-epidemiological assessment is of particular interest for its detection and control.
Objective. The most recent evidence is provided with respect to natural infections by Gnathostoma as it occurs in the tigerfish (Hoplias microlepis), including insights into its biological cycle.
Materials and methods. A total of 74 fish were collected from two localities (rice fields-wetlands and local fish market) of Samborondón County (Guayas Province). Each was examined for the presence of Gnathostoma in muscle of Hoplias microlepis. The abundance intensity and prevalence of parasites was estimated. Statistical comparisons between the two sites and correlations of parasite load versus fish size were conducted.
Results. The infection prevalence by Gnathostoma was 69% (95% CI: 57-78%). The overall abundance intensity of parasites averaging the 2 sites was 1.7 larvae per fish. The proportion of infected fish was higher in rice fields (77%) when compared to those from the local fish market (62%). No statistically significant differences between the abundance intensity and prevalence were found between the sites (p>0.05). Parasite load and fish length were significantly correlated (Spearman p<0.05).
Conclusions. Gnathostomiasis is a prevalent zoonosis in coastal Ecuador, and its etiologic agent is commonly found in the second intermediary host. Several Neotropical mammals are candidates as definitive reservoir hosts in the Gnathostoma biological cycle.
Key words: Gnathostoma, larva migrans, host-parasite interactions, public health, Ecuador.
Los nematodos Spirurida del género Gnathostoma comprenden alrededor de 11 a 12 especies, geográficamente distribuidas en todo el mundo, principalmente en Asia y en la región de las Américas (1-3). Gnathostoma requiere un ciclo biológico con tres tipos de huéspedes, el cual se inicia con la expulsión de huevos de Gnathostoma en la materia fecal, provenientes del huésped final u huéspedes definitivos, incluyendo mamíferos, como felinos, cánidos, prociónidos, mustélidos, suidos y múridos, así como marsupiales, en los cuales el parásito adulto se reproduce sexualmente en la pared del estómago (2,4-6).
Luego, a partir de los huevos eclosiona una larva rabditoidea, que necesita para su desarrollo completo dos huéspedes intermediarios, lo cual se describe como sigue: 1) la embriogénesis y la evolución del primer estadio larvario (L1) ocurren en el huevo, a partir del cual se libera L1 al medio acuático; 2) L1 invade al primer huésped intermediario, el cual es un crustáceo copépodo (Cyclops) en donde, por lo general, completa su desarrollo, transformándose posteriormente en el hemocele del copépodo, la fase temprana del segundo estadio larvario (L2); 3) el segundo huésped intermediario corresponde a peces plantívoros y carnívoros, ictiófagos, los cuales ingieren copépodos que contienen L2, la cual evoluciona al tercer estadio larvario (L3=4 mm) con su subsiguiente enquistamiento en la musculatura del pez; ésta es la fase infectante para los huéspedes definitivos que se alimentan de peces.
Existen, además, huéspedes paraténicos en los cuales la larva se vuelve a enquistar, como es el caso de ciertas aves acuáticas-ictiófagas, anfibios y reptiles, y huéspedes accidentales como los humanos, en donde no ocurre reproducción sexual del parásito (2,4-8).
Este nematodo causa en el hombre gnatostomiasis, una enfermedad globalmente presente en las zonas tropicales y templadas, y originalmente considerada como endémica en Japón, Tailandia y los países del sudeste de Asia (1,2,9). Sin embargo, desde hace más de tres décadas el agente etiológico y la enfermedad han sido encontrados y reportados en países latinoamericanos como México (3,7,10), Ecuador (4,11-13) y Colombia (14). Sólo en México, la enfermedad tiene una considerable incidencia y se han presentado más de 1.500 casos (15-17).
En Ecuador, la enfermedad conocida como paniculitis nodular migratoria eosinofílica es la descripción de la infección por Gnathostoma spinigerum en el humano (11,12,14), en personas provenientes de comunidades rurales ribereñas y pesqueras localizadas cerca de llanuras de inundación y arrozales en la cuenca del río Guayas, incluyendo el río Babahoyo y Vinces (provincia del Guayas), al suroeste del Ecuador.
La paniculitis nodular migratoria eosinofílica también se ha descrito y diagnosticado como tal en México (14). En Tailandia, este helminto parásito ha sido ligado a casos clínicos de mieloencefalitis eosinofílica (18,19). De acuerdo con un estudio de secuenciación molecular con ADN ribosómico (ADNr), se demostró que la infección humana en México y en Ecuador es causada por la especie G. binocleatum, y no por G. spinigerum, como lo consideraron inicialmente otros investigadores (3). Recientemente, se confirmó que la especie G. binocleatum infecta especies de peces tales como Petenia splendida, Cichlasoma managuense y Gobiomorus dormitor en México, con prevalencias que oscilan entre 8% y 22% (20).
A pesar de que algunos estudios sobre helmintos parásitos en peces dulceacuícolas, de estuarios y marinos, han sido conducidos en la biorregión del estuario del golfo de Guayaquil, incluyendo la cuenca del río Guayas y sus afluentes (21-25), ninguno reporta el hallazgo de Gnathostoma. Sin embargo, en 1984 se reportaron, por primera vez, en Ecuador la presencia e infección natural por este parásito en peces dulceacuícolas, como el guanchiche (Hoplias microlepis) y la corvina de río (Isostisthus remiser) (4,13).
Además, la infección experimental por este parásito fue desarrollada y comprobada en gatos domésticos (Felis silvestris catus= F. domesticus) alimentados con el tercer estadio larvario avanzado (L3A o AdvL3, por sus siglas en inglés) de Gnathostoma (26). En las últimas décadas ha existido una notoria escasez de investigación médica y biológica en parasitología y helmintología de nematodos endoparásitos en especies bioacuáticas de aguas continentales y marinas del Ecuador. Por tal motivo, es una prioridad en salud pública/animal y medicina tropical comprender y elucidar el ciclo biológico, los eslabones y la historia natural de los helmintos parásitos causantes de enfermedades, tanto en el hombre como en animales vertebrados, para establecer medidas de eliminación y erradicación del agente causante y la enfermedad en los trópicos.
En este estudio contribuimos con nuevos hallazgos sobre la prevalencia y frecuencia de infección natural por Gnathostoma en el guanchiche (H. microlepis) y su asociación biométrica con la talla del pez en otra área no previamente estudiada en la región del golfo de Guayaquil. De igual manera, actualizamos información sobre su ciclo biológico y potenciales huéspedes naturales, así como sus implicaciones para la salud pública en Ecuador.
Materiales y métodos
Área de estudio y recolección de peces
El estudio fue realizado en el Cantón Samborondón (1° 57,56S y 79° 43,19O), provincia del Guayas, en donde se seleccionaron dos zonas para la obtención de muestras de peces durante los años 1995 y 1996. La primera zona (zona 1) correspondió a zonas inundadas o llanuras fluviales de inundación, en donde tradicionalmente se cultiva arroz, constituyendo humedales y hábitat para invertebrados acuáticos, peces, aves y mamíferos.
El lugar específico de recolección estaba localizado cerca de una hacienda (La Sequita) adyacente a las faldas de una elevación natural conocida como el cerro Santa Ana (1° 56.35 S y 79° 45.38O). En esta zona, los peces fueron atrapados usando trampas colocadas con redes y palos de bambú o madera anclados en el fondo o sedimento del cuerpo de agua (conocida localmente como red de estacada). Debido a la turbidez del agua y la oscuridad durante la noche, los peces quedan enredados en la red y son retirados según el nivel de agua.
La segunda zona (zona 2) de recolección correspondió al mercado local de peces de Samborondón, los cuales son pescados directamente de un ramal del río Babahoyo del sistema fluvial del río Guayas.
La profundidad del agua varió en el momento de extracción de los peces, oscilando entre 0,5 y 1,5 m como máximo nivel de marea para zona 1, y mayor de 1,5 m en la zona 2. Es importante anotar que el nivel de agua en las llanuras de inundación y afluentes varía de acuerdo con la estaciones climáticas y la precipitación, mostrando niveles bajos durante la estación seca (junio-noviembre) y altos durante la estación lluviosa (diciembre-mayo).
La especie de pez recolectado corresponde a H. microlepis (Günther, 1864), pez perteneciente a la familia Erythrinidae (órden: Characiformes) y consumidor carnívoro (ictiófago) de tercer orden trófico, que alcanza longitudes entre 20 cm y 43,5 cm (27). El criterio para recolectar e invertir esfuerzos de investigación sólo en este tipo de pez, se basó en el hecho de que esta especie presenta la mayor incidencia de parasitismo por Gnathostoma, alcanzando un porcentaje de infección cercano a 92% (4).
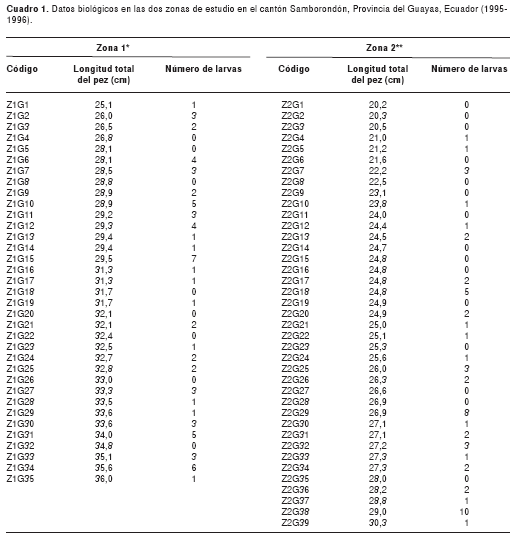
Se recolectaron 74 individuos de H. microlepis, 35 de los cuales fueron obtenidos en la zona 1 y 39 individuos en la zona 2. Los peces fueron transportados a la ciudad de Guayaquil y trasladados ya fuera al domicilio del primer autor o al Laboratorio de Parasitología del Instituto Nacional de Higiene y Medicina Tropical Leopoldo Izquieta Pérez, para la disección de los especímenes. La longitud total de los peces fue medida con un ictiómetro de madera (50 cm de longitud) para ver el efecto de la talla del pez en la cantidad de parásitos presentes.
Disección y obtención de parásitos
Esta parte del estudio fue llevada cabo siguiendo el protocolo de trabajo indicado por Ollague et al. (4,13). Cada pez fue disecado realizando una incisión en la región dorsal en dirección antero-posterior a lo largo del espina dorsal, usando escalpelos (Nº 3, 4 y 8) y, en algunas ocasiones, dagas afiladas. Toda la musculatura costal o lateral fue extraída (filetes), removiendo cuidadosamente la piel. Los filetes fueron cortados con tijeras quirúrgicas y divididos en submuestras de músculos para facilitar la búsqueda macroscópica de quistes-larvas.
La búsqueda de parásitos se realizó colocando cada submuestra entre placas-láminas de vidrio (10 cm x 6 cm x 3 mm de espesor) y presionando para comprimir y expandir los submuestras y, de esta manera, facilitar el examen del tejido con la ayuda de luz artificial. Este método de visualización directa es factible debido a la transparencia del tejido muscular del pez, así como por la coloración rojiza de los quistes y la forma característica en C que la larva presenta dentro del quiste (4). La coloración rojiza se debe a la presencia de oxihemoglobina (hemoglobina oxigenada, Hb02).
Además, se usó un estereomicroscopio (Olympus®) con aumento 4X, lupas del mismo aumento, agujas y pinzas quirúrgicas para extraer y aislar las larvas de los quistes e identificar el nematodo (figura 1). Las larvas, una vez extraídas, se colocaron en viales con solución salina y se guardaron para futura referencia. Algunos individuos fueron fijados en etanol absoluto por 24 horas y, luego, se montaron en portaobjetos usando bálsamo de Canadá.
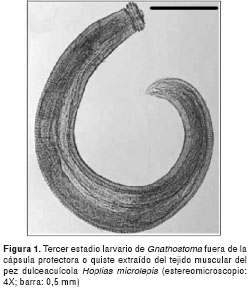
Los datos del número de larvas aisladas por pez analizado y longitud total de los peces, se encuentran señalados en el cuadro 1. Los especímenes para referencia fueron depositados en el Laboratorio de Parasitología del Instituto Nacional de Higiene y Medicina Tropical Leopoldo Izquieta Pérez.
Análisis estadísticos
El porcentaje total de infección (prevalencia) entre las dos zonas de estudio, así como la prevalencia individual por cada zona, se calcularon con sus respectivos intervalos de confianza con un nivel de confidencia del 95% (IC 95%). La abundancia media y la intensidad media de parásitos ± desviación estándar (DE), con intervalos de confianza, también fueron calculadas respectivamente, de acuerdo con la biometría en ecología parasitaria señalada por Rózsa et al. (28).
Las prevalencias entre ambas zonas de estudio se compararon por medio de una tabla de contingencia (2X2), usando la prueba exacta de Fisher para determinar si hubo diferencias significativas entre los porcentajes de infección. La comparación estadística de las abundancia y la intensidad medias de larvas en las muestras de peces entre las dos zonas de estudio, así como la comparación entre la talla de los peces entre ambas zonas, se llevaron a cabo usando la prueba no paramétrica de Wilcoxon-Mann-Whitney.
Se condujeron regresiones y correlaciones estadísticas entre la longitud de peces y la carga parasitaria, para examinar si existía alguna asociación entra estas dos variables, usando la prueba o coeficiente de correlación de Spearman (Spearmans rank order correlation, rs). El programa estadístico SAS (SAS, Institute Inc., Cary, NC) se utilizó para ejecutar las pruebas estadísticas mencionadas arriba.
Resultados
Incidencia parasitaria y comparaciones
En las dos zonas de estudio, en 51 peces se encontraron positivos con el tercer estadio larvario de Gnathostoma (figura 1), mientras que 23 individuos (31%) resultaron negativos (cuadro 2). Esto representa cerca de 69% (IC 95% 57,61-78,30%) (cuadro 2) de infección, con 129 larvas extraídas de los músculos de H. microlepis en estas áreas de estudio en el Cantón Samborondón.
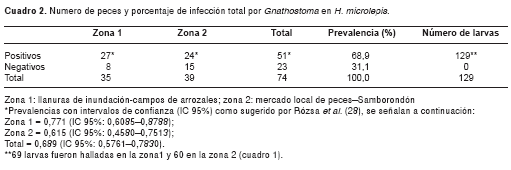
En la zona 1 se encontró la mayor proporción de peces infectados, con un 77,1% (27/35) (IC 95% 60,85-87,88%), mientras que en la zona 2 el porcentaje de infección fue 61,5% (24/39) (IC 95% 45,80-75,13%) (cuadro 2). Sin embargo, no se encontró una diferencia significativa entre las prevalencias halladas en las dos zonas de estudio (c2 exacta de Fisher p=0,2090). Se hallaron 69 larvas en la zona 1, lo que corresponde a 53,5% del total (69/129), mientras que en la zona 2 se encontraron 60 especímenes, que representan 46,5% del total (60/129) (cuadro 1 y cuadro 2).
La abundancia media de larvas por pez ±DE en la zona 1 fue de 1,97±1,84 (IC 95% 1,36-2,58; rango de 0 a 7) y 1,46±2,13 (IC 95% 0,79-2,13; rango de 0 a 10) en la zona 2 (cuadro 3). La longitud promedio de H. microlepis recolectados en la zona 1 (media ±DE: 31,02 ± 2,86; rango de 25,1 a 36,0) fue mayor a la encontrada en peces provenientes de la zona 2 (media ±DE: 25,05 ± 2,53; rango de 20,2 a 30,3) (Wilcoxon-Mann-Whitney, Z=6,5242; p<0,0001).
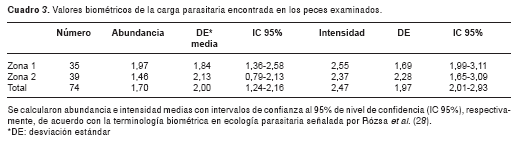
Aunque la talla de los peces presentó diferencias estadísticamente significativas, la abundancia media de larvas por pez fue similar entre las dos zonas de estudio y no se halló una diferencia estadísticamente significativa entres estas zonas (Wilcoxon-Mann-Whitney, Z=1,7354; p=0,0869). La intensidad media fue de 2,55 larvas por pez (IC 95% 1,99-3,11; rango de 1 a 7) en la zona 1, y de 2, 37 (IC 95% 1,65-3,09; rango de 1 a 10) en la zona 2 (cuadro 3).
De igual manera, no se encontraron diferencias significativas en la intensidad media de larvas entre los peces muestreados en ambas zonas (Wilcoxon-Mann-Whitney, Z=-0,9684; p= 0,3328). Esto indica que las cargas parasitarias en estas dos zonas de estudio en particular son similares con: aproximadamente dos larvas/pez [abundancia media total=1,70 (IC 95% 1,2366-2,1634); intensidad media total=2,47 (IC 95% 2,0136-2,9264) (cuadro 3) en H. microlepis, el mismo que presentó longitudes que oscilan entre 20,2 y 36,0 cm (cuadro 1), con una longitud promedio ± DE total de 27,9 ± 4,02 cm en las dos zonas de estudio.
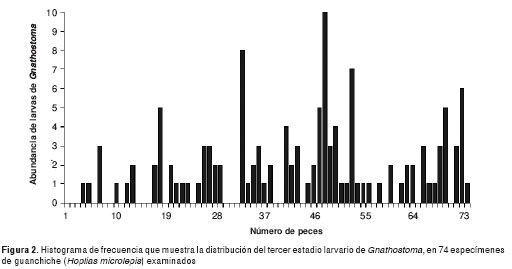
La frecuencia de distribución del número de larvas versus el número total de peces muestreados, se encuentran representados en la figura 2. Este histograma muestra un patrón de distribución agregado de las larvas y sesgada hacia la derecha, lo que indica una tendencia alejada de una distribución normal.
Correlaciones carga parasitaria versus talla del pez
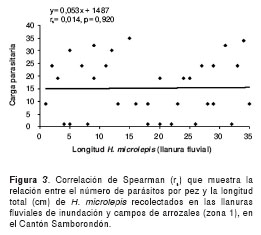
Para la zona 1 no se encontró ninguna correlación entre el número de larvas y la talla del pez, siendo esta asociación no estadísticamente significativa (Spearman rs=0,01; p=0,920) (figura 3). Sin embargo, se encontró una regresión linear con una notoria tendencia positiva estadísticamente significativa, entre la carga parasitaria de larvas y la talla del pez en la zona 2 (Spearman rs=0,38; p<0,05) (figura 4), lo que sugiere una fuerte asociación entre estas dos variables (número de larvas y longitud de los peces).
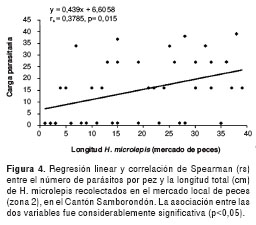
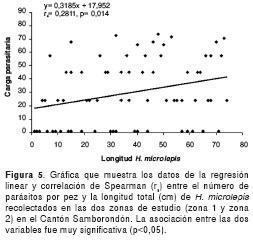
En otras palabras, esta relación biométrica sustenta el hecho de que, a medida que la talla del pez se incrementa, la carga parasitaria es mayor. La correlación indica que 38% de la cantidad de larvas encontrada por pez es explicada por la variación en la longitud total de H. microlepis. Cuando se combinaron los datos de estas variables provenientes de ambas zonas, se encontró también una regresión linear positiva, con una baja correlación, pero con una asociación muy significativa entre el número de parásitos y la longitud del pez (Spearman rs=0,28; p=0,014) (figura 5).
Discusión
En este estudio contribuimos con nueva información, relacionando el grado de infección y la distribución del tercer estadio larvario de Gnathostoma en H. microlepis en zonas no estudiadas previamente, así como su relación directa de abundancia a medida que la talla de los peces aumenta (figuras 4 y 5).
Después de 20 años del primer hallazgo de este nematodo parásito evidenciado en la cuenca del río Guayas, encontramos que el nivel de infestación es cercano al 70%, el cual es relativamente menor al 91,6% de incidencia parasitaria hallada por Ollague et al. en 1984 (4,13), pero resalta el hecho de que Gnathostoma aún es una parasitosis con alta prevalencia en peces de esta región.
El porcentaje de infección en H. microlepis hallado en este estudio es mayor al reportado en el chame o chalaco (Dormitator latifrons) en México, en donde se encontró una prevalencia de 6,2% con una abundancia promedio de 0,1 en 48 ejemplares examinados (29), y sobrepasa las prevalencias de infección y abundancias medias por G. binucleatum en tres especies de peces de Tabasco, México: Cichlasoma managuense (prevalencia 8,6%; abundancia promedio 0,08 larvas por huésped revisado), Petenia splendida (15,5%; 0,15) y Gobiomorus dormitor (22,2%; 0,3) reportadas por Kifune et al. (20).
Estas diferencias podrían explicarse desde el punto de vista de la ecología alimentaria y el nivel trófico; por ejemplo, el chame es un pez detritívoro-iliófago que se alimenta de materia orgánica y filtra sedimentos, a diferencia de H. microlepis, el cual es un eminente carnívoro-consumidor de tercer orden (27). Además, el porcentaje de infección encontrado por nosotros es mayor a las prevalencias halladas en 34 especies de peces (rango, 2% a 26%; n=2.047 peces examinados) reportados en México (30).
Algunas de las especies de peces investigadas en ese estudio fueron: tilapias (Oreochromis niloticus, O. mossambicus), chames (D. latifrons), viejas (Cichlasoma spp.) bagres o peces gatos (Ictalurus spp. Ariopsis spp.), róbalos (Centro-pomus nigrescens, C. undecimalis) y guabinas (Eleotris picta). Por ejemplo, en 45 especímenes de tilapia del Nilo la prevalencia fue del 2%, mientras que en 38 ejemplares de tilapia de Mozambique fue de 26%. De igual manera, en 26 individuos de chame la prevalencia fue de 4% (30).
De particular interés es el hecho de que la mayoría de estos géneros de peces y sus especies están también presentes en los ecosistemas fluviales y de estuarios de la región costera del Ecuador, en donde forman parte de la dieta de las comunidades locales y habitantes de las ciudades cercanas (por ejemplo, Guayaquil).
Obviamente, el tamaño de la muestra y la frecuencia de abundancias de la distribución de larvas en los peces son factores biométricos para considerar en dichas comparaciones, como es el caso de nuestro estudio que refleja una alta prevalencia y frecuencia de Gnathostoma en H. microlepis (cuadro 1 y cuadro 2) (figura 2).
El tamaño y el tipo de pez son un importante factor en el mercado local, nacional e internacional, y desde el punto de vista del consumidor, tallas mayores son generalmente más atractivas para el consumo humano, lo cual en el caso de H. microlepis aumenta el riesgo de infección por esta especie de nematodo, debido a que los individuos de mayor longitud (28 a 36cm) (cuadro 1) (figuras 3 y 4) en esta especie contienen un número relativamente mayor de larvas de Gnathostoma, como hemos demostrado en este estudio. Sin embargo, longitudes menores de peces (<28 cm) (cuadro 1) (figuras 2 y 3) infectados también en cierto grado por las larvas, obviamente son adquiridas regularmente en los mercados. En Ecuador, es muy necesaria más investigación concerniente a parásitos de peces, principalmente de importancia comercial, para determinar nuevas especies ictiológicas huéspedes, no sólo de Gnathostoma, sino también de otros helmintos parásitos.
Aunque la abundancia media de parásitos por pez fue similar entre ambas zonas de estudio, lo que indica cargas parasitarias similares en la población de H. microlepis, la prevalencia de infección en peces fue mayor en las llanuras de inundación o arrozales y sugiere que hay un considerable número de peces que contienen larvas de Gnathostoma en esta zona, en relación con los peces obtenidos en el mercado y capturados en el río Babahoyo, uno de los principales afluentes en la cuenca del río Guayas.
Ciertos factores ecológicos e hidrológicos pueden incidir en esta diferencia concerniente al porcentaje de infección o prevalencia entre las dos zonas. En primer lugar, en las zonas de arrozales y llanuras fluviales de inundación estaría ocurriendo una contaminación intensiva por escorrentías y acumulación de material fecal proveniente de abundancia de huéspedes reservorios definitivos (por ejemplo, mapaches, zarigüeyas, cerdos, perros y gatos). Las llanuras de inundación y arrozales son extensos humedales que contienen aguas represadas naturalmente (sistemas lacustres), con mínimo o ningún recambio de agua, en donde el tiempo de residencia de la materia orgánica (sólidos suspendidos), y, por ende, de excretas que contienen huevos de Gnathostoma, es mayor en la columna de agua, con su posterior depósito en el fondo o sedimentos en comparación con sistemas lóticos (ríos).
Como una cuestión de hecho, en afluentes tributarios o ríos (por ejemplo, el río Babahoyo, en donde lo peces fueron capturados y llevados al mercado de Samborondón) existe mayor hidrodinámica y recambio de los flujos de agua, en donde el tiempo de residencia de sólidos suspendidos y partículas orgánicas es de corta duración, seguido por el transporte y sedimentación de la materia orgánica, y, por ende, excretas, aguas abajo en zonas de estuarios o costeras.
Este escenario tiene que ser interpretado con mucho cuidado desde el punto de vista de salud pública, debido a que la mayor parte de la población humana adquiere los peces regularmente en los mercados y, por lo tanto, la infección accidental estaría siendo adquirida principalmente en estos lugares públicos y, secundariamente, de los peces pescados en los humedales de inundación o arrozales.
En parasitología tropical todos los factores mencionados previamente son de vital importancia desde el punto de vista de la dinámica de transmisión y bioecología de esta zoonosis, por varias razones.
Primero, la gnatostomiasis humana ya ha sido reportada en el Ecuador, tanto en el pasado como en el presente, y ha sido diagnosticada clínicamente como paniculitis nodular migratoria eosinofílica por su característica de larva migrans cutánea y confirmación microscópica de su agente etiológico (11,12,31).
Esta zoonosis también se ha diagnosticado en el Ecuador mediante estudios de inmunodiagnóstico por medio de pruebas cutáneas (skin test) y ELISA (enzyme linked immunosorbent assay) usando antígenos de Gnathostoma doloresi (32), lo cual demuestra que existe infección humana por Gnathostoma en este país.
En segundo lugar, una gran población de comunidades humanas ribereñas adyacentes a los ríos Guayas y Babahoyo y sus afluentes, depende de la pesca ya sea en aguas continentales (agua dulce) o de estuarios (aguas salobres), lo que refleja el riesgo de infección por este nematodo en humanos al consumir carne semicruda de pescado o mariscos crudos a manera de cebiche o ceviche, el cual es una plato costeño muy popular y tradicional, nativo no sólo en Ecuador sino de otros países latinoamericanos, como México y Perú.
Más recientemente, los primeros casos de paniculitis nodular migratoria eosinofílica por consumo de mariscos o cebiche también se han diagnosticado y descrito en Perú (33,34), lo cual sugiere que esta parasitosis zoonótica está presente y diseminándose a lo largo de la costa suramericana del Pacífico y, probablemente, algunos casos no han sido diagnosticados correctamente o se han confundido con otras dolencias similares.
Finalmente, es importante recalcar que interna-cionalmente la enfermedad se ha diagnosticado en viajeros o turistas extranjeros que visitan países de Asia, Centroamérica y Suramérica, como fue el caso reciente de 16 pacientes entre 23 y 57 años, positivos para infección por Gnathostoma en el Hospital de Enfermedades Tropicales de Londres, entre abril 2000 y marzo 2001 (35).
El hallazgo de la infección natural por el estadio infeccioso de Gnathostoma ha sido reportado en algunos huéspedes definitivos en diferentes locali-dades de México, principalmente, en zarigüeyas o tlacuaches (Didelphis virginiana, D. marsupialis y Philander opossum), así como en mapaches del norte (Procyon lotor hernandezii) y en el perro doméstico (Canis familiaris) (30,36-39).
Por consiguiente, proponemos que algunas especies de marsupiales y mamíferos salvajes similares a las mencionadas arriba y presentes en la zonas de estudio, tales como zarigüeyas (D. marsupialis), guanchaca (Philander opossum), tigrillo u ocelote (Leopardus pardalis), mapache cangrejero o suramericano (P. cancrivorus) y nutria neotropical (Lontra longicaudis), podrían estar cumpliendo el papel de huéspedes reservorios definitivos en el ciclo selvático del parásito. Estos vertebrados son especies nativas oficialmente registradas dentro de la fauna neotropical del litoral ecuatoriano y sudamericano (40,41).
De igual manera, especies cimarronas y domésticas, tales como cerdos (Sus scrofa), gatos (F. domesticus) y perros domésticos (Canis familiaris), estarían cumpliendo un papel importante como reservorios definitivos en la diseminación y distribución de esta zoonosis en las comunidades locales aledañas a los sistemas fluviales de la cuenca del río Guayas. Además, la infección por Gnathostoma en F. domesticus fue comprobada experimentalmente en Ecuador (26), lo cual indica la potencial contribución de este felino en el ciclo biológico y la dispersión de Gnathostoma en zonas rurales y semiurbanas.
Alternativamente, ciertos huéspedes paraténicos, como las aves acuáticas e ictiófagas, estarían distribuyendo la larva enquistada en diferentes áreas al ser depredadas por huéspedes definitivos. Por ejemplo, se han encontrado larvas de Gnathostoma en garzas de la familia Ardeidae, como la garza blanca (Ardea alba), la garza nívea (Egretta thula) y la garza tigre (Tigrisoma lineatum), así como en el cormorán neotropical o pato cuervo (Phalacrocorax olivaceus = P. brasilianus; familia: Phalacrocoraxidae) en México (8,30). Una considerable biodiversidad de aves acuáticas, incluyendo las nombradas aquí (familia Ardeidae y Phalacrocoraxidae), son habitantes permanentes y comunes de los humedales costeros (llanuras fluviales de inundación, campos de arrozales, lagunas costeras, manglares y pantanos) y zonas ribereñas a lo largo de la región costera del Ecuador (42).
La confirmación de la infección en estas especies se debe realizar mediante futuros estudios de campo enfocados en la búsqueda de los parásitos adultos en la cavidad y la pared gástricas de los reservorios y de las larvas enquistadas en los músculos de los huéspedes paraténicos.
La dispersión de esta zoonosis en la región de las Américas puede deberse en parte al desplazamiento y movimiento de ciertas especies de huéspedes de este parásito, como copépodos planctónicos (primeros huéspedes intermediarios), peces nativos del Pacífico sudamericano (por ejemplo, chame-chalaco, D. latifrons, el cual se distribuye desde el golfo de California hasta el norte de Perú en Tumbes), así como peces introducidos (tilapias, Oreochromis spp.) y ciertas aves acuáticas y migratorias. Estas especies estarían actuando, respectivamente, como huéspedes biológicos y paraténicos, contribuyendo con la presencia de esta zoonosis en otras regiones, principalmente durante anomalías térmicas océano-atmosféricas cuando existe escasez de alimento a lo largo del Pacífico ecuatorial y sureste (por ejemplo, presentación del fenómeno del Niño en las costas de Ecuador y Perú).
Las medidas de prevención y seguridad alimenticia deben estar enfocadas en educación sanitaria dirigida al consumo de peces suficientemente cocidos y evitar la ingestión de peces crudos o insuficientemente cocidos (por ejemplo, cebiche, sushi, sashimi) provenientes de aguas continentales o de estuario, así como el control de animales de hábitos alimenticios oportunista y generalistas (zarigüeyas y cerdos), así como la erradicación de animales vagabundos, cimarronas o mascotas abandonadas (perros y gatos) que deambulan en humedales, zonas pesqueras y sistemas ribereños, para evitar la contaminación del agua por material fecal (2,5,6).
Los autores agradecen las valiosas sugerencias y el asesoramiento científico-académico de Eduardo Gómez Landires, así como por su valiosa ayuda con material de laboratorio para la puesta en marcha de este estudio. Agradecemos al Comité Editorial y a los evaluadores de la revista Biomédica por los comentarios y sugerencias realizados a nuestro artículo. Similarmente, nosotros agradecemos a nuestro codirector de proyecto de investigación, Leonardo Maridueña por la dirección, revisión y corrección del manuscrito original durante la cátedra de Redacción Técnica en la Escuela de Biología, Facultad de Ciencias Naturales, Universidad de Guayaquil en el periodo 1995-1996. Estamos en deuda por la valiosa colaboración de María Fernanda Guizardo durante el trabajo de campo y laboratorio. Finalmente, agradecemos notablemente la ayuda de Pedro Jiménez Gómez por el apoyo logístico de campo y obtención de peces en la Hacienda La Sequita del Cantón Samborondón, así como la cooperación de los pescadores locales.
Los autores declaramos que no existen conflictos de intereses en el desarrollo y publicación de este trabajo.
Esta investigación fue autofinanciada por los autores de este estudio.
Correspondencia:
Juan José Alava, Environmental Toxicology Research Group, Faculty of Environment, Simon Fraser University, 8888 University Drive, Burnaby, British Columbia V5A 1S6, Canada.
Office phone: (778) 782-7375, lab phone: (778) 782-5776; fax: (778)782-4968. jalavasa@sfu.ca
1. Miyazaki I. On the genus Gnathostoma and human gnathostomiasis, with special reference to Japan. Exp Parasitol. 1960;9:338-70. [ Links ]
2. Miyazaki I. An illustrated book of helminthic zoonoses. Fukuoka, Japan: International Medical Foundation of Japan; 1991. p. 494. [ Links ]
3. Almeyda-Artigas RJ, Dolores M, Mas-Coma S. ITS-2 rDNA sequencing of Gnathostoma species (Nematoda) and elucidation of the species causing human Gnathostomiasis in the Americas. J Parasitol. 2000;86:537-44. [ Links ]
4. Ollague W, Gómez E, Briones M. Infección natural de peces de agua dulce con el tercer estado larvario de Gnathostoma, y su dinámica de transmisión al hombre; primer reporte en el Ecuador. Rev Ecuat Hig Med Trop. 1985;35:33-48. [ Links ]
5. Acha PN, Szyfres B. Zoonosis y enfermedades transmitidas comunes al hombre y a los animales. Segunda edición. Publicación No. 503. Washington, D.C.: Organización Panamericana de la Salud, Organización Mundial de la Salud; 1988. p. 989. [ Links ]
6. Diaz-Camacho SP, Cruz M, Manning KW. Gnathostomosis. Rev Fac Med Univ Nac Auton Méx. 2000;43:192-201. [ Links ]
7. Almeyda-Artigas RJ. Hallazgo de Gnathostoma binucleatum n. sp. (Nematoda: Spirurida) en felinos silvestres y el papel de peces dulceacuícolas y oligohalinos como vectores de la gnatostomiasis humana en la cuenca baja del Río Papaloapan, Oaxaca-Veracruz, México. Anales del Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. 1991;18:137-55. [ Links ]
8. García Márquez LJ, Díaz-Camacho SP, Osorio-Sarabia D. Reacción inflamatoria causada por larvas de Gnathostoma sp. (Nematoda: Gnathostomidae) en músculos de aves ictiófagas en México. Vet Méx. 2001;32:265-70. [ Links ]
9. Ogata K, Imai J, Nawa Y. Three confirmed and five suspected human cases of Gnathostoma doloresi infection found in Miyazaki prefecture, Kyushu. Jpn J Parasitol. 1988;37:358-64. [ Links ]
10. Peláez D, Pérez-Reyes R. Gnathostomiasis humana en América. Rev Latinoam Microbiol. 1970;12:83-91. [ Links ]
11. Ollage W, Ollague J, Guevara de Veliz A, Peñaherrera S, von Buchwald C, Mancheno J, et al. Paniculitis nodular migratoria eosinofílica (gnathostomiasis profunda y superficial). Primer hallazgo del parásito en América del Sur. Nuestra Medicina. 1981;7:9-23. [ Links ]
12. Ollage W, Ollague J, Guevara de Veliz A, Peñaherrera S. Human gnathostomiasis in Ecuador (nodular migratory eosinophilic panniculitis). First finding of the parasite in South America. Int J Dermatol. 1984;23:647-51. [ Links ]
13. Ollague W, Gómez E, Briones M. Infección natural de peces de agua dulce con el tercer estado larvario de Gnathostoma spinigerum y su dinámica de transmisión al hombre. Primer reporte en Ecuador y América. Med Cután Iber Lat Am. 1988;16:291-4. [ Links ]
14. Zuluaga AI, Restrepo M, Restrepo M, Mesa A. Paniculitis migratoria con eosinofilia: primer caso de Gnathostomiasis en Colombia ? Acta Médica Colombiana. 1988;13:148-50. [ Links ]
15. Ruiz-Maldonado R. Successful treatment of nodular migratory eosinophilic panniculitis (human gnathostomiasis) with phenylbutazone. Int J Dermatol. 1991;30:522. [ Links ]
16. Lamothe-Argumedo R, Osorio-Sarabia D. Estado actual de la gnatostomiasis en México. Anales del Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. 1998;69:23-37. [ Links ]
17. Vargas-Ocampo F, Alarcón-Rivera E, Alvarado-Alemán FJ. Human gnathostomiasis in Mexico. Int J Dermatol. 1998;37:441-4. [ Links ]
18. Bunnag T, Comer DS, Punyagupta S. Eosinophilic myeloencephalitis caused by Gnathostoma spinigerum: Neuropathology of nine cases. J Neurol Sci. 1970;10:419-34. [ Links ]
19. Punyagupta S, Bunnag T, Juttijudata P. Eosinophilic meningitis in Thailand Clinical and epidemiological characteristics of 162 patients with myeloencephalitis probably caused by Gnathostoma spinigerum J Neurol Sci. 1990;96:241-56. [ Links ]
20. Kifune T, Lamothe-Argumedo R, García-Prieto L, Oceguera-Figueroa A, León-Règagnon V. Gnathostoma binucleatum (Spirurida: Gnathostomatidae) en peces dulceacuícolas de Tabasco, México. Rev Biol Trop. 2004;52:371-6. [ Links ]
21. Les BB, López E. Estudio sobre la biología de los peces del río Vinces. Boletín Científico y Técnico 3 (1). Guayaquil, Ecuador: Instituto Nacional de Pesca; 1974. p. 40. [ Links ]
22. León NH, Wong A. Endoparásitos del guanchiche (Manuscrito-reporte de redacción técnica). Guayaquil: Universidad de Guayaquil; 1990. [ Links ]
23. De Álvarez GC. Infestación por nematodos de los peces de la laguna Abras de Mantequilla, Vinces–Ecuador. Rev Cien Mar Limnol. 1993;3:193-7. [ Links ]
24. Guisamano JP, Zambrano V. Ecto y endoparásitos de peces del Río Vinces (Manuscrito–reporte de redacción técnica). Guayaquil: Universidad de Guayaquil; 1994. [ Links ]
25. Alava JJ, Aguirre W. Scanning electron microscopy of Neoechinorhynchus sp. (Acanthocephala: Neoechinorhynchidae), a possible new species of intestinal parasite of the Tallfin croaker Micropogonias altipinnis (Günther, 1864). Parasitol Latinoam. 2005;60:48-53. [ Links ]
26. Ollague W, Goméz E, Briones M. Infección experimental de un gato doméstico adulto con el tercer estado larvario de Gnathostoma spinigerum procedente de un pez de agua dulce. Med Cután Iber Lat Am. 1988;16:295-7. [ Links ]
27. Florencio AM, Cadena M, Moya O, Villamar F. bioecología de los peces del Río Babahoyo y perspectivas de su cultivo. En: Instituto Nacional de Pesca (INP), editores. Comportamiento temporal y espacial de las características físicas, químicas y biológicas del Golfo de Guayaquil y sus afluentes Daule y Babahoyo entre 1994-1996. Guayaquil, Ecuador: Ministerio de Comercio Exterior, Industrialización y Pesca; Subsecretaría de Recursos Pesqueros-INP-Programa de Cooperación Técnica para la Pesca-UE-VECEP; 1998. p. 61–177 [ Links ]
28. Rózsa L, Reiczigel J, Majoros G. Quantifying parasites in samples of hosts. J Parasitol. 2000;86:228-32. [ Links ]
29. Garrido-Olvera L,García-Prieto L, Mendoza-Garfias B. Helminth parasites of the Pacific Fat Sleeper, Dormitator latifrons (Richardson, 1844) (Osteichthyes: Eleotridae) from Tres Palos Lagoon, Guerrero, México. Am Midl Nat. 2004;151:165-9. [ Links ]
30. León-Régagnon V, Osorio-Sarabia D, García-Prieto L, Lamothe-Argumedo R, Bertoni-Ruiz F, Oceguera-Figueroa A. New host records of the nematode Gnathostoma sp. in Mexico. Parasitol Int. 2005;54:51-3. [ Links ]
31. Perero A, Mancheno J. Larva migrans cutánea producida por Gnathostoma. Revista Sociedad Ecuatoriana de Dermatología. 2006;3. Fecha de consulta: 4 de agosto 2006. Disponible en: http://www.medicosecuador.com/
32. Mimori T, Tada I, Kawabata M, Ollague WL, Calero GH, De Chong YF. Immunodiagnosis of human Gnathostomiasis in Ecuador by skin test and ELISA using Gnathostoma doloresi antigen. Jpn J Trop Med Hyg. 1987;15:191-6. [ Links ]
33. Costa AH, Bravo PF, Valdez L, Levy SY, Sordo C, Magill F, et al. Paniculitis nodular migratoria eosinofílica en el Perú. (Gnathostomiasis humana). Informe de once casos, posibles causas y revisión de la literatura. Folia Dermatol Perú. 2001;12:21-35. [ Links ]
34. Cipriano E. paniculitis migratoria eosinofílica en el Perú. Gnathostoma como agente causal. Rev Perú Med Exp Salud Pública. 2003;20:220-2. [ Links ]
35. Moore DAJ, McCroddan J, Dekumyoy P, Chiodini PL. Gnathostomiasis: An emerging imported disease. Emerg Infect Dis. 2003;9:647-50. [ Links ]
36. Lamothe-Argumedo R. Hospederos definitivos, intermediarios y paraténicos de Gnathostoma en Veracruz y Oaxaca. Cuad Mex Zool. 1997;3:22-8. [ Links ]
37. Lamothe-Argumedo R, García L, Osorio D, Pérez-Ponce G. Catálogo de la Colección Nacional de Helmintos. 1ª edición. Ciudad de México, D.F.: Instituto de Biología, Universidad Nacional Autónoma de México, Comisión Nacional para el Conocimiento y Uso de la Biodiversidad; 1997. p. 211. [ Links ]
38. Lamothe-Argumedo R, Akahane H, Osorio D, García L. Hallazgo de Gnathostoma turgidum en Didelphis virginiana de Temascal, Oaxaca, México. Anales del Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. 1998;69:225-9. [ Links ]
39. Bertoni-Ruiz F, García-Prieto L, Osorio-Sarabia D, León-Régagnon V. A new species of Gnathostoma (Nematoda: Gnathostomatidae) in Procyon lotor hernandezii from Mexico. J Parasitol. 2005;91:1143-9. [ Links ]
40. Emmons LH, Free F. Neotropical rainforests mammals, a field guide. Second edition. Chicago-Londres: The University of Chicago; 1997. p. 307. [ Links ]
41. Tirira D. Mamíferos del Ecuador. Publicación especial 2. Quito, Museo de Zoología, Centro de Biodiversidad y Ambiente, Pontificia Universidad Católica del Ecuador: SIMBIOE; 1999. p. 392. [ Links ]
42. Ridgely RS, Greenfield PJ. The birds of Ecuador, status, distribution and taxonomy. Ithaca: Cornell University Press; 2001. p. 848. [ Links ]














