Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157versão On-line ISSN 2590-7379
Biomédica v.30 n.2 Bogotá abr./jun. 2010
ARTÍCULO ORIGINAL
Laboratorio de Polio/EV/entéricos, Grupo de Virología, Instituto Nacional de Salud, Bogotá D.C., Colombia.
Recibido: 23/09/09; aceptado:20/03/10
Introducción. Los virus entéricos se han visto implicados en brotes de enfermedad diarreica aguda, enfermedades transmitidas por alimentos, hepatitis A y meningitis aséptica, en los que el vehículo de transmisión del agente ha sido el agua.
Objetivo. Estandarizar un método de concentración para la detección de virus entéricos en aguas de consumo.
Materiales y métodos. Se concentraron 20 litros de agua a un volumen de 6 ml mediante filtración y ultrafiltración tangencial. Como controles positivos se prepararon soluciones de 20 litros a concentraciones virales de 1, 10, 50 y 100 TCID50 (Tissue Culture Infectious Dose 50%) de Poliovirus Sabin de tipo 1. Las partículas virales fueron recuperadas por cultivo en células sensibles a la infección e identificadas por amplificación del genoma viral mediante reacción en cadena de la polimerasa, siguiendo los estándares internacionales de los Centers for Disease Control and Prevention (CDC) de Atlanta.
Resultados. Todos los controles positivos causaron efecto citopático en células de rabdomiosarcoma y L20B y fueron detectados por RT- PCR (Real Time- PCR) convencional, directamente de las muestras. Los controles negativos no mostraron efecto citopático ni amplificación viral por RT-PCR.
Conclusiones. La ultrafiltración tangencial mostró ser un método rápido y eficaz al recuperar virus desde una TCID50, además de ser reproducible y sencillo. Tiene la ventaja de permitir la detección de su capacidad de contagiosidad viral por el cultivo celular, y la identificación por RT-PCR.
Palabras clave: Poliovirus, enterovirus, efecto citopático viral, reacción en cadena de la polimerasa de transcriptasa inversa, calidad del agua.
Standardization of a method for concentration and detection of enteric viruses from drinking water
Introduction. Enteric viruses have been implicated in acute diarrheal disease, food-borne disease, hepatitis A and meningitis outbreaks, in which water was the vehicle of transmission.
Objective. A concentration method was standardized for the detection of enteric viruses in drinking water.
Materials and methods. Twenty liters of water were concentrated to 6 ml by filtration and tangential ultrafiltration. Viral solutions of 20 L each were prepared at 1, 10, 50 and 100 TCID50 of Sabin poliovirus type 1 as positive controls. Viral particles were recovered by tissue culture and detected by conventional polymerase chain reaction (PCR), according to the international standards recommended by the Enterovirus Laboratory at the Centers for Disease Control and Prevention, Atlanta, GA.
Results. All positive controls showed cytopathic effect on L20B and RD cells and were amplified by conventional PCR directly from samples. Negative controls did not show any amplification or viral cytopathic effect.
Conclusions. Tangential ultrafiltration for concentrating viruses proved to be a fast, efficient recovery and reproducible. It has the advantage of allowing the detection (at the 1 TCID50 level) and identification of viruses by RT-PCR and the demonstration of viral infectivity by tissue culture.
Key words: poliovirus; enterovirus, cytopathogenic effect, viral; reverse transcriptase polymerase chain reaction, water quality.
Los enterovirus humanos son excretados en las heces de humanos y animales infectados, que contaminan directa o indirectamente el agua destinada al consumo humano o a diferentes actividades que implican el riesgo de ingerir agentes infecciosos contenidos en ella. Se considera que más de 140 tipos de virus diferentes, como Enterovirus, virus de la hepatitis A y E, Adenovirus humanos, Norovirus y Astrovirus humanos, aparentemente no son eliminados del agua con los tratamientos masivos de purificación y son causantes de brotes de gastroenteritis, hepatitis infecciosa, meningitis y conjuntivitis, entre otras enfermedades. En cerca del 50% de las infecciones gastrointestinales transmitidas por el agua, no se identifica el agente causal por falta de métodos sensibles y quedan descritas como de origen desconocido (1-3).
Además de las implicaciones epidemiológicas, el agua y el saneamiento adecuado afectan también la calidad de vida de todos los organismos vivos. Las deficiencias sanitarias, así como la contaminación fecal del agua y de los alimentos, son los mayores riesgos para millones de niños y adultos de los países latinoamericanos y del Caribe (4-6).
Desde el punto de vista de salud pública, los virus entéricos son el grupo de organismos patógenos más críticos, debido a que la dosis infecciosa es muy baja y a que son, además, muy resistentes a los sistemas de desinfección y a que el control en el laboratorio es difícil y costoso (7).
Desde el punto de vista virológico, su detección es más compleja que la de otros microorganismos por la necesidad de concentrarlos a partir de volúmenes de agua mayores que los utilizados en la detección de bacterias y parásitos (8-10).
La calidad microbiológica del agua se evalúa actualmente por indicadores de contaminación fecal, principalmente, bacterianos, pero que no brindan información sobre los virus, particularmente, su concentración e identificación en el agua, así como su resistencia a diferentes tratamientos (11-13).
A nivel mundial, diversos países se encuentran trabajando diferentes metodologías para la concentración y la identificación de virus en agua; algunos de ellos han avanzado bastante en varios años de trabajo, así: en España, Francia e Inglaterra se busca, principalmente, virus de la hepatitis A y E, y norovirus; mientras que en Estados Unidos, se hace la búsqueda de Enterovirus, Norovirus y virus de la hepatitis A. En Latinoamérica, Argentina, Brasil, México y Venezuela son los pioneros en esta área y adelantan estudios en búsqueda de Enterovirus (Poliovirus), Rotavirus, virus de la hepatitis A y Norovirus como agentes prioritarios (46). El método mas frecuentemente utilizado por la mayoría de los investigadores es el de adsorción-"elución"; sin embargo, es funcional para la concentración de virus a partir de volúmenes de agua relativamente pequeños, no mayores a 2 litros.
La revisión de la literatura científica y la estimación de los costos para la adquisición de los elementos y reactivos para la implementación de los diferentes ensayos, nos permitieron escoger uno de los métodos que presentaba excelentes resultados de recuperación viral tanto en cultivo celular como por técnicas moleculares y que, además, podía ser utilizado para la concentración de virus a partir de volúmenes de agua mayores de 5 litros, como la requerida para la búsqueda de virus en aguas tratadas para consumo (14-16).
En Colombia se han expedido normas respecto a la calidad del agua, entre las cuales está el Decreto 1575 de 2007 por el cual se establece el sistema para la protección y el control de la calidad del agua para consumo humano; este decreto le otorga al Instituto Nacional de Salud varias funciones, entre las cuales están: coordinar la Red Nacional de Laboratorios para el control y la vigilancia de la calidad del agua para consumo humano, y brindar orientaciones y directrices en esta área a los laboratorios que realicen o presten el servicio de los análisis físicos, químicos y microbiológicos, establecidos en el decreto; y coordinar y registrar el Programa Interlaboratorio de Control de Calidad del Agua Potable (PICCAP) y establecer los requisitos necesarios para la realización de la validación o revalidación de los métodos analíticos que se comercialicen en el mercado o nuevas tecnologías introducidas, solicitados por las entidades que así lo requieran (17).
Dados los lineamientos del Decreto 1575 del 2007 y la prioridad nacional y mundial de garantizar la calidad del agua, surgió la necesidad de estanda-rizar una metodología de concentración de virus en el agua para consumo humano en el país y, hacia el futuro próximo, establecer la vigilancia de los virus entéricos en el agua para consumo humano.
Materiales y métodos
La estandarización del método se realizó con muestras positivas y negativas preparadas en el Laboratorio de Polio/EV del Instituto Nacional de Salud.
Estandarización del método de concentración
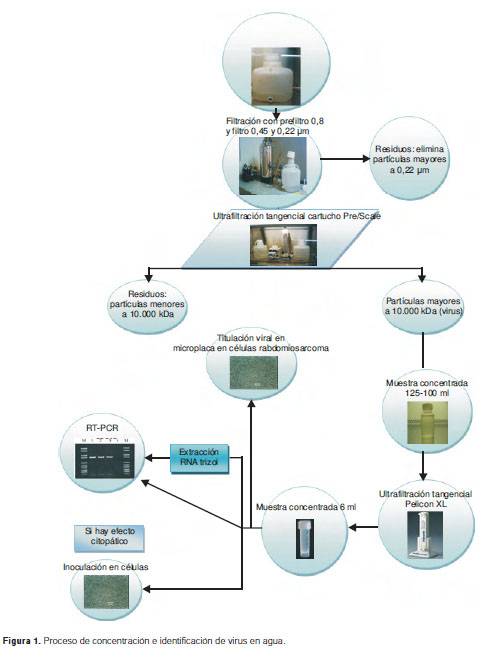
El método seleccionado de concentración viral fue el de filtración y ultrafiltración tangencial que consta de dos pasos:
filtración por membranas millipore de 0,8, 0,45 y 0,22 nm (catálogo AP1514250 y GVWP14250, respectivamente), y
ultrafiltración tangencial en cartucho Pre/Scale-TFF 6 ft2, >10.000 kDa seguido de ultrafiltración tangencial en cartucho Pellicon XL50 para ultrafiltración, >10.000 kDa.
Los controles positivos y negativos se prepararon en el laboratorio, utilizando 20 litros de agua destilada y esterilizada por autoclave en el caso de los controles negativos y 20 litros de agua destilada, esterilizada por autoclave y, posteriormente, contaminada con diferentes concentraciones de virus de vacuna de poliomielitis en el caso de los controles positivos. Una vez preparadas las muestras, se filtraron a través de membranas millipore de 0,8, 0,45 y 0,22 nm, respectivamente; este paso de filtración eliminó los sólidos y los microorganismos que pudieran estar presentes en las muestras, sin que hubiera disminución del volumen inicial.
Luego, se llevó a cabo el proceso de ultrafiltración tangencial, que permitió la concentración de partículas de tamaño superior a 10.000 kDa. Para esto, se utilizó una bomba peristáltica de alta presión, con el fin de dirigir la muestra prefiltrada hacia el filtro de flujo tangencial, y se producían dos fracciones: una, con las partículas excluidas por el filtro (llamada "fracción retenida", que contenía los virus), y la otra, que correspondía al volumen filtrado. La recirculación del agua se repitió hasta que en el envase original quedaba un volumen de 100 a 130 ml, aproximadamente (18).
Luego de este proceso se realizó una nueva ultrafiltración (cartucho Pellicon XL50), para reducir el volumen a 6 ml, que incluía el volumen muerto dentro del filtro. Una vez se obtuvo el volumen final de la muestra, se prepararon alícuotas de 2 ml que se conservaron a -20°C. La figura 1 muestra el esquema del proceso.
Control del proceso
Se escogió como control positivo una cepa de Poliovirus Sabin de tipo 1, referencia OMS-1528, cultivado en células de rabdomiosarcoma humano y cuyo título era de 1 x 108, que correspondía a 100000.000 de TCID50 en 50 µl. La TCID50 se expresaba como el logaritmo de la dilución del virus que produce efecto citopático en el 50% de los cultivos celulares (19).
Se prepararon cuatro controles positivos a diferentes concentraciones de virus, de la siguiente manera: a 20 litros de agua destilada/bidestilada y esterilizada por autoclave se le adicionó una cantidad definida de cultivo de virus que daba una TCID50, 10 TCID50, 50 TCID50 y 100TCID50, respectivamente.
Como control negativo se emplearon 20 litros de agua destilada/bidestilada y esterilizada por autoclave.
Luego de concentrar cada control positivo, se llevó a cabo el proceso de desinfección del equipo de filtración y de ultrafiltración tangencial, es decir, se limpió el equipo por completo: tanque, mangueras y cartuchos con NaOH 0,1N, 0,1 N a 40°C. El trípode para la filtración se esterilizó por autoclave. Posteriormente, se concentraron los controles negativos para comprobar la eficiencia del saneamiento y garantizar la ausencia de contaminación cruzada.
Una vez terminado el proceso de concentración por ultrafiltración tangencial, se llevó a cabo la extracción de ARN, la titulación directa del virus y el aislamiento viral en células.
Titulación de virus y aislamiento viral en células
El título de virus se determinó en microplaca de 96 pozos, utilizando diluciones de 10-1 a 10-9 en células de rabdomiosarcoma, pase 5 (Nº 243) y la lectura del título viral se hizo en el día 5 de cultivo a 37°C; la contagiosidad viral por cultivo en células de rabdomiosarcoma y L20B, pase 8 (Nº 44), se evidenció por inoculación de 0,3 ml de agua concentrada, directamente en las monocapas celulares de 24 horas de crecimiento.
Las células utilizadas en este proceso se produjeron por ATCC (Tissue Culture-adapted Influenza Viruses), donadas a la red global de laboratorios de poliomielitis/Enterovirus por la Organización Panamericana de la Salud/Organización Mundial de la Salud (OPS/OMS) y los Centers for Disease Control and Prevention (CDC) de Atlanta. Las muestras se incubaron a 37°C en atmósfera de CO2 al 5%, hasta la aparición de efecto citopático. A las muestras que no lo presentaban, se les realizó en el quinto día un segundo pase en células jóvenes por 5 días más.
Extracción de ARN
Se extrajo el ARN de las muestras concentradas que no habían sido inoculadas en células y a las muestras inoculadas, independientemente de la presencia de efecto citopático. Para la fase de lisis y de homogeneización, se utilizaron, 750 µl de Trizol LS® y 250 µl de muestra y se dejaron en reposo por 5 minutos a temperatura ambiente.
En la fase de separación, se le agregaron 200 µl de cloroformo a cada muestra, se agitaron vigorosamente por 15 segundos, y se mantuvieron de 2 a 5 minutos en reposo a temperatura ambiente; posteriormente, se centrifugaron a 11.000g por 15 minutos a 4°C.
En la fase de precipitación y utilizando otro tubo Eppendorf de 1,5 ml, se mezclaron 750 µl de la fase acuosa (ARN) con 500 µl de alcohol isopropílico. Se dejaron en reposo durante 10 minutos a temperatura ambiente y, luego, se centrifugaron a 11.000g por 10 minutos a 4°C.
La fase de lavado de ARN se hizo por duplicado con 500 µl de etanol al 75%, se centrifugó a 7.400g por 5 minutos a 4°C, y se almacenó a -70°C por 12 a 24 horas; la fase de resuspensión de ARN se realizó con 50 µl de H2O dietil-pirocarbonato.
El ARN obtenido se separó en alícuotas de 10 µl y se conservó a -20°C (Trizol LS®, catálogo Invitrogen Nº 10296-028).
RT-PCR
La amplificación por RT-PCR del Poliovirus Sabin de tipo 1, se realizó siguiendo la metodología estandarizada por los CDC de Atlanta (20). El fragmento amplificado corresponde a un segmento de la región VP1 del Poliovirus Sabin de tipo 1, ubicado entre los nucleótidos 2.584 y 2.601 del genoma viral.
Brevemente, la metodología seguida fue: para un volumen final de reacción de 25 µl, en cada vial se agregaron 19 µl de la solución tampón A más los iniciadores correspondientes (cuadro 1) y 1 µl de ARN; se programó el termociclador para la desnaturalización así: 95°C por 5 minutos; luego, se enfriaba rápidamente sobre hielo y se agregaban 5 µl de la solución tampón B más las enzimas; la solución tampón B contenía: solución tampón de la PCR 10X, dNTP 10 mM, MgCl2 25 mM, H2O con dietil-pirocarbonato, DTT 1M, inhibidor de RNasa de 40 U/µl, AMV RT 25 U/µlL y Taq polimerasa 5U/µl. Se programó el termociclador a 42°C por 30 minutos seguido de un ciclo de inactivación de la RT a 95°C por 3 minutos. Se continuó con 30 ciclos de PCR, así: 95°C por 45 segundos, 55°C por 45 segundos y 70°C por 45 segundos.
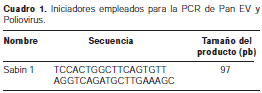
Las bandas de ADN se visualizaron en gel de poliacrilamida al 10%; la electroforesis se corrió a 90 voltios por 45 minutos y el gel se tiñó con bromuro de etidio a 0,05 µg/ml. Se utilizó un patrón molecular de 50 pb para la comparación del tamaño de los fragmentos amplificados.
Resultados
Todos los controles positivos presentaron efecto citopático entre las 24 y las 36 horas de incubación, luego de ser inoculados en las líneas celulares de rabdomiosarcoma y L20B.
La titulación viral en microplaca a partir de la muestra de agua concentrada sin ampliación en cultivo celular (21), se hizo por duplicado. La variación logarítmica de las pruebas correspondientes a la misma muestra, no fue significativa (>0,5 log) y se evidenció ampliación viral mayor de tres logaritmos en todos los controles positivos, con respecto a la cantidad de TCID50 puesta originalmente a los 20 litros de agua (cuadro 2).

Las pruebas de RT-PCR tanto de la muestra directa como a partir del cultivo, mostraron bandas de ADN de 97 bp correspondientes a Poliovirus Sabin de tipo 1 (figura 2). Ningún control negativo mostró efecto citopático indicativo de infección viral, como tampoco se observaron bandas de amplificación genómica viral por la RT-PCR.
Discusión
La filtración y la ultrafiltración tangencial es un método rápido, sencillo y eficiente para la concentración viral a partir de cualquier tipo de agua. Nos permite reducir el volumen de 20 litros a 6 ml en 5 horas, aproximadamente, y la recuperación viral es hasta de una TCID50 (0,69 unidades formadoras de placas (UFP)/µl), según lo observado con los controles positivos preparados con Poliovirus Sabin de tipo 1. La mayoría de los métodos descritos son capaces de determinar virus en volúmenes limitados de agua que no superan los 5 litros, lo cual significa que sólo es posible procesar aguas crudas, no tratadas, que contienen gran cantidad de material orgánico y microbiológico.
En este trabajo se formula una metodología aplicable a volúmenes mayores, que permite buscar virus en aguas tratadas, con bajas dosis de virus. La mayoría de los virus entéricos son excretados en grandes cantidades por los individuos infectados, en un rango de 105 a 1011 partículas virales por gramo de materia fecal; sin embargo, la probabilidad de que un individuo se enferme a causa de una infección por virus entéricos requiere una ingestión de baja concentración de partículas virales, entre 1 y 10 TCID50, aproximadamente (1,19,22).
El método de filtración y de ultrafiltración tangencial tiene la gran ventaja de permitir la detección e identificación viral por medio de técnicas de biología molecular (RT-PCR, PCR), y conserva la capacidad infecciosa del virus, que se puede evidenciar por el aislamiento viral en líneas celulares sensibles a ello.
La filtración y la ultrafiltración tangencial es un método altamente reproducible; la titulación viral en TCID50 en microplaca de la muestra de agua concentrada que no se había inoculado en células, se hizo por duplicado y se evidenció ampliación viral mayor de dos logaritmos en todos los controles positivos, como se puede observar en el cuadro 2.
Por otro lado, es un método altamente confiable ya que no presenta contaminación cruzada entre las muestras, lo cual se demostró con los controles negativos luego de pasar los controles positivos de una TCID50, 10 TCID50, 50 TCID50 y 100 TCID50 y de realizar el saneamiento del equipo con pruebas negativas de aislamiento viral y sin indicios de bandas de ADN a partir del producto de la RT-PCR.
Cabe resaltar que dadas las carencias de los sistemas para hacer potable las aguas en los municipios colombianos, no se puede garantizar que la ausencia de agentes bacterianos sea sinónimo de ausencia de agentes virales de importancia epidemiológica, responsables de los brotes mencionados anteriormente (23).
Los brotes de enfermedad diarreica aguda, meningitis viral, hepatitis A y enfermedades trasmitidas por alimentos, entre otros, no son exclusivos de los países en desarrollo; anualmente, los países desarrollados notifican a los diferentes sistemas de vigilancia numerosos brotes de enfermedades asociados a los virus transmitidos por el agua (15,24-26), lo cual pone de manifiesto la necesidad de implementar un sistema de vigilancia de la calidad del agua potable, que incluya la detección de virus entéricos, y que permita la toma de decisiones oportunas y adelantar acciones tendientes a mejorar los procesos de agua potable, y los sistemas de distribución y prácticas de buen uso del agua por parte de la comunidad.
Los autores del presente estudio desean agradecer de manera especial al personal de apoyo del Laboratorio de Polio/EV/Entéricos.
Los autores del artículo hacen constar que no existe, de manera directa o indirecta, ningún tipo e conflicto de intereses financieros, académicos personales que puedan poner en peligro la validez de la investigación.
Los recursos económicos necesarios para el desarrollo de este trabajo en el laboratorio fueron aportados por el Instituto Nacional de Salud de Colombia, el Ministerio de la Protección Social y el CONPES 3375 para el fortalecimeinto de las medidas sanitarias y fitosanitarias.
Correspondencia: Dioselina Peláez, Laboratorio de Polio/EV/entéricos, Grupo de Virología, Instituto Nacional de Salud, Avenida calle 26 N° 51-20, CAN, Bogotá, D.C., Colombia. Telefax: 220 0770, extensión 439 dpelaez@ins.gov.co
1. Fong TT, Lipp EK. Enteric viruses of human and animals in aquatic environments: health risks, detection and potential water quality assessment tools. Microbiol Mol Biol Rev. 2005;69:357-71. [ Links ]
2. Gantzer C, Maul A, Audic JM, Schwartzbrod L. Detection of infectious enterovirus, enterovirus genomes, somatic coliphages and Bacteroides fragilis phages in treated wastewater. Appl Environ Microbiol. 1998; 64:4307-12. [ Links ]
3. Universidad Federal de Santa Catarina, Fundação Oswaldo Cruz (Fio Cruz). Curso teórico-práctico "Virología ambiental". Florianóplolis, Brasil: Universidad Federal de Santa Catarina, Fiocruz; 2006. p. 1-40. [ Links ]
4. World Health Organization. The United Nations Climate Change Conference, Poznan, Polland, December 1-12, 2008. Geneva: WHO; 2008. [ Links ]
5. Organización para la Educación Científica y Cultural de las Naciones Unidas - UNESCO. El agua, una responsabilidad compartida. Segundo informe de las Naciones Unidas sobre el desarrollo de los recursos hídricos en el Mundo. Zaragoza: Ediciones UNESCO; 2006. [ Links ]
6. Organización Mundial de la Salud. 10 datos sobre la escasez de agua. Ginebra: OMS; 2007. [ Links ]
7. Chandramouli V, Neelakantan TR, Brion GM, Lingireddy S. Predicting enteric virus presence in surface waters using artificial neural network models. Environ Eng Sci. 2008;25:53-62. [ Links ]
8. Casas N, Suñen E. Detection of enterovirus and hepatitis A virus RNA in mussels (Mytilus spp.) by reverse transcriptase-polymerase chain reaction. J Appl Microbiol. 2001;90:89-95. [ Links ]
9. Traore O, Arnal C, Mignotte B, Maul A, Laveran H, Billaudel S, et al. Reverse transcriptase PCR detection of astrovirus, hepatitis A virus, and poliovirus in experimentally contaminated mussels: comparison of several extraction and concentration methods. Appl Environ Microbiol. 1998;64:3118-22. [ Links ]
10. Borrego J, Moriño M, De Vicente A, Córnax R, Romero P. Coliphages as an indicator of faecal pollution in water. Its relationship with indicator and pathogenic microorganisms. Water Res. 1987;21:1473-80. [ Links ]
11. Soler M, Lobos S, Lorca M, Navarrete E. Enterovirus en aguas naturales de Valparaíso: una propuesta metodológica para su análisis. Rev Biol Mar Oceanogr. 2009; 44:511-6. [ Links ]
12. Arcos Pulido MP, Ávila de Navia SL, Estupiñán Torres SM, Gómez Prieto AC. Indicadores microbiológicos de contaminación de las fuentes de agua. Nova. 2005;3:69-79. [ Links ]
13. Campos-Pinilla C, Cárdenas-Guzmán M, Guerrero-Cañizares A. Comportamiento de los indicadores de contaminación fecal en diferentes tipos de aguas de la Sabana de Bogotá (Colombia). Universitas Scientiarum. 2008;13:103-8. [ Links ]
14. Ramírez V. Filtros electropositivos y reacción de PCR para la concentración y detección simultánea de virus y bacterias en aguas. Jiutepec, Morelos: Instituto Mexicano de Tecnología del Agua. Fecha de consulta: 15 de agosto de 2009. Disponible en: http://www.bvsde.paho.org/bvsaidis/impactos/mexicona/R-0213.pdf. [ Links ]
15. Del Puerto Rodríguez AM, Rojas MC, Iglesias AM. Calidad del agua y enfermedades de transmisión digestiva. Rev Cubana Med Gen Integr. 1999;15:495-502. [ Links ]
16. Chamorro C, Espinoza JC, Soto K, Kuznar J. Concentración de virus de la necrosis pancreática infecciosa mediante ultrafiltración de flujo tangencial combinado con filtración de exclusión. Arch Med Vet. 2006;38:77-82. [ Links ]
17. Ministerio de la Protección Social. Sistema para la protección y control de la calidad del agua para consumo humano. Decreto 1575 del 2007. Bogotá, D. C.: Ministerio de la Protección Social; 2007. [ Links ]
18. Millipore. Prep/Scale-TFF Cartridge holder. Instructions for installation and use (P34404). Bedford, MA: Millipore Corporation; 1995. p. 3-38. [ Links ]
19. Espigares M. Virus en aguas de consumo humano. Hig Sanid Ambient. 2006;6:173-89. [ Links ]
20. World Health Organization. PCR method for intratypic differentiation. En: Polio laboratory manual. Fourth edition. Geneva: WHO; 2004. p. 112-8. [ Links ]
21. Payment P, Trude M. Methods and techniques in virology. New York: Marcel Dekker; 1993. p. 25-40. [ Links ]
22. Abbaszadegan M, Stewart P, LeChevallier M. A strategy for detection of virus in Groundwater by PCR. Appl Environ Microbiol. 1999;65:444-9. [ Links ]
23. Federación Colombiana de Municipios. Informe de gestión de 2006. Fecha de consulta: 18 de octubre de 2007. Disponible en: http://www.fcm.org.co/index.php?id=37. [ Links ]
24. Katayama H, Shimasaki A, Ohgaki S. Development of concentration method and its application to detection of Enterovirus and Norwalk virus coastal seawater. Appl Environ Microbiol. 2002;68:1033-9. [ Links ]
25. Shay G, Martinson B, Moyer M, Dahling D. A multiplex reverse transcription –PCR method for detection of human enteric viruses in groundwater. Appl Environ Microbiol. 2003;69:3158-64. [ Links ]
26. Casares C, Albiñana P, Maluquer N, Motes M, Hundesa C, Girones A, et al. Efectos sobre la salud de la contaminación de agua y alimentos por virus emergentes humanos. Rev Esp Salud Pública. 2005;79:253-69. [ Links ]














