Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.31 no.1 Bogotá Jan./Mar. 2011
REVISIÓN DE TEMA
1 Instituto de Investigaciones Clínicas, Facultad de Medicina, Universidad del Zulia, Maracaibo, Venezuela
2 Departamento de Microbiología, Facultad de Odontología, Universidad del Zulia, Maracaibo, Venezuela
Recibido: 31/05/10; aceptado:26/08/10
Cyclospora cayetanensis es un protozoo apicomplexa que ha emergido como un patógeno importante causante de diarrea endémica y epidémica en el mundo. En los países industrializados, el parásito se ha reconocido como agente causal de diversas epidemias asociadas, principalmente, con alimentos importados de áreas endémicas. En los países en vías de desarrollo, la ciclosporosis humana está ampliamente distribuida y, en la población general, se han descrito tasas de infección que varían de 0 % a 41,6 %. Sin embargo, la epidemiologia, biología y ecología de C. cayetanensis permanecen poco conocidas. Su ciclo de vida no está totalmente caracterizado y parece requerir un huésped único, el humano, para completarse. El papel que los animales puedan desempeñar como reservorios naturales del parásito permanece sin determinar.
Se tiene poca información sobre la distribución ambiental de C. cayetanensis y los vehículos de transmisión del ambiente a los humanos. El agua, los alimentos y los suelos contaminados pueden actuar como vehículos de diseminación del coccidio. Permanecen incertidumbres significativas sobre el parásito, que reflejan la necesidad de continuar los esfuerzos de investigación en diversas áreas, incluyendo su biología básica y distribución ambiental.
Palabras clave: Cyclospora, ciclosporosis, biología, ecología, revisión.
Cyclospora cayetanensis: biology, environmental distribution and transfer
Cyclospora cayetanensis is an apicomplexan protozoan that has emerged as an important pathogen causing endemic or epidemic diarrheal disease worldwide. In industrialized countries, the parasite has been recognized as the causative agent of several outbreaks of diarrheal illness mostly associated with produce imported from endemic areas. In developing countries, human cyclosporosis is widely distributed. Infection rates from 0% to 41.6% have been described in the general population. However, the epidemiology, biology, and ecology of C. cayetanensis are not fully understood. The life cycle is not completely characterized, although it appears to require a single human host to be accomplished. The role of animals as natural reservoirs of the parasite remains to be determined.
Little information is available concerning the environmental distribution and vehicles of transmission of C. cayetanensis. Contaminated water, foods or soil can be vehicles of spread of the parasite. The significant uncertainties that remain in the knowledge of C. cayetanensis highlight the need for continuing research in several areas, including its basic biology and environmental distribution.
Key words: Cyclospora, cyclosporosis, biology, ecology, review.
Cyclospora cayetanensis es un patógeno emergente que representa un problema de salud pública. Es una causa importante de diarrea endémica y epidémica en el mundo (1,2). La infección humana está ampliamente distribuida, se ha reportado en las Américas, el Caribe, Europa, Australia, Asia y áfrica (1-3).
En los países industrializados, el coccidio se ha asociado con casos de diarrea del viajero (4-7). Sin embargo, el parásito se identificó como un patógeno significativo a finales del siglo pasado, cuando se reconoció como un agente causal de numerosas epidemias de diarrea asociadas principalmente a productos alimenticios frescos, como frutas suaves y vegetales verdes, importados de áreas endémicas (8-13). También se han observado epidemias relacionadas con el agua, pero en menor cuantía (13-15). En Europa y Australia, la mayoría de los casos de ciclosporosis se han relacionado con viajes internacionales hacia áreas endémicas (1,5-7).
En los países en vías de desarrollo, la infección por C. cayetanensis está ampliamente distribuida. En estudios realizados en comunidades, las tasas de infección han variado de 0 % a 41,6 % (16-23). La infección es común en niños y el mayor riesgo a la infección sintomática ocurre en los primeros cinco años de vida (3,20,24-26). Los estudios basados en la población general indican altos porcentajes de infecciones asintomáticas (17,20-22,27-29), lo cual sugiere inmunidad al desarrollo de la enfermedad por exposición persistente al coccidio (20,25,29). En estas áreas se han descrito también algunas epidemias (5,7,30-38). Sin embargo, la estacionalidad de la infección, los factores de riesgo y otros rasgos epidemiológicos del parásito permanecen poco conocidos. Se tiene poca información de la biología, la distribución ambiental del parásito y sus vehículos de transmisión del ambiente a los humanos.
El presente trabajo revisa el estado actual del conocimiento de la biología, distribución ambiental y transferencia de C. cayetanensis, haciendo énfasis en las regiones en vías de desarrollo. Otros aspectos del parásito han sido descritos en detalle en previas revisiones (1-3,39-41).
Biología
Para comprender la epidemiología compleja de la ciclosporosis humana y poder tomar medidas de prevención y control de la infección, es de suma importancia el conocimiento de los rasgos biológicos de C. cayetanensis.
Taxonomía y filogenia
La clasificación taxonómica de C. cayetanensis, de acuerdo con la nueva propuesta de la International Society of Protistologists(42), se presenta en el cuadro 1. En el rango Apicomplexa existen varios géneros muy relacionados que se denominan colectivamente como coccidios, incluyendo cinco que se han descrito en humanos: Sarcocystis, Toxoplasma, Isospora, Cryptosporidium y Cyclospora (43).
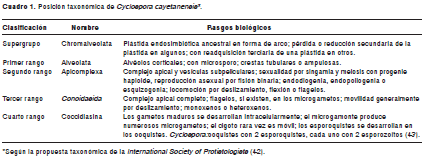
La organización del genoma o la secuencia de los genes de C. cayetanensis se conocen poco. Sin embargo, la secuencia de la subunidad pequeña del ARN ribosómico (SSU-ARNr) se obtuvo mediante la amplificación por la reacción en cadena de la polimerasa (PCR), usando iniciadores basados en las regiones altamente conservadoras de la SSU-ARNr. El análisis de esta secuencia reveló que C. cayetanensis está estrechamente relacionada con Eimeria spp. y sustenta la conclusión de que ambos géneros pertenecen a la misma familia de parásitos coccidios (44).
Un estudio posterior confirmó la relación filogenética entre C. cayetanensis y Eimeria spp. y consideró que aquélla es un miembro del género Eimeria (45). Se ha considerado que la inclusión de una secuencia SSU-ARNr adicional de Eimeria falciformis, un parásito de ratones, en el árbol filogenético aclararía la resolución del árbol en tres grupos diferentes: Eimeria de mamíferos, Eimeria de aves y Cyclospora.
Con la inclusión de datos moleculares de más especies, especialmente las especies de Cyclospora descritas en mamíferos diferentes a los primates, es lógico considerar la reclasificación de Cyclospora de primates, incluyendo a los humanos y Eimeria de aves o mamíferos en un nuevo género (46). Se ha sugerido que la secuencia SSU-ARNr de Isospora debería ser comparada con las de Cyclospora para clarificar la posición taxonómica de este parásito (41).
Cyclospora cayetanensis difiere en forma significativa de las otras especies de Cyclospora descritas, no sólo en su huésped específico, sino también en la morfología de sus ooquistes, que son más pequeños y esféricos en lugar de la forma subesférica que tienen los ooquistes de las otras especies conocidas (46). La descripción de otras especies de Cyclospora (C. cercopitheci, C. colobi y C. papionis) en primates inferiores, que producen también ooquistes pequeños y esféricos como C. cayetanensis, parece sugerir dos grupos diferentes de Cyclospora: las especies que infectan insectívoros y roedores, que producen ooquistes grandes y subesféricos, y las que infectan los primates, incluyendo los humanos, que producen ooquistes pequeños y esféricos. C. cayetanensis, C. cercopitheci, C. colobi y C. papionis se agrupan homogéneamente en una rama única del árbol filogenético intermediaria entre las especies de Eimeria que parasitan los mamíferos y las aves (46).
Las técnicas moleculares desempeñan un papel invaluable en el establecimiento de la validez de las especies y los grupos taxonómicos. Para lograr dilucidar la taxonomía de la especie de Cyclospora asociada a los humanos, es necesario realizar estudios moleculares de aislamientos adicionales de especies de Cyclospora y Eimeria, principalmente en otras especies de mamíferos. Hasta el presente, no se sabe si todos los aislamientos de Cyclospora de humanos pertenecen a la misma especie y si las especies descritas en primates inferiores infectan a los humanos.
Ciclo de vida
Cyclospora cayetanensis es un parásito intracelular obligatorio, cuyo ciclo de vida no está completamente caracterizado. El ciclo parece ser monoxeno, requiriendo un huésped único, el humano, para cumplirse a cabalidad (2). El ciclo vital es complejo y sigue el modelo de desarrollo de otros coccidios entéricos, el cual involucra un ciclo merogónico con dos generaciones de merontes, un ciclo gametogónico con macrogametos, microgametos y cigotos, y un ciclo esporogónico (47).
La figura 1 presenta el esquema del ciclo vital de C. cayetanensis, de acuerdo con los Centers for Disease Control and Prevention (CDC), de Estados Unidos (48). éste comienza con la ingestión del estado infeccioso, transmisible, el ooquiste esporulado, que se desenquista en el intestino y libera cuatro esporozoítos. éstos invaden las células epiteliales del intestino delgado (29,49). Los esporozoítos y subsiguientes fases de desarrollo, se ubican dentro del citoplasma celular en una posición supranuclear, rodeados por una vacuola parasitófora (49). Los esporozoítos se transforman en trofozoítos, los cuales, mediante división nuclear asexual por merogonia, forman los merontes que contienen los merozoítos. Se originan dos tipos de merontes. El de tipo I, que contiene de 8 a 12 merozoítos, los cuales penetran las células epiteliales y forman los merontes de tipo II, que contienen cuatro merozoítos. Una vez liberados, estos penetran otras células y comienza la fase sexual mediante la diferenciación en estados masculinos (microgametocitos) o femeninos (macrogametocitos). El primero forma numerosos microgametos flagelados. El macrogametocito fertilizado se transforma en cigoto, el cual desarrolla una pared gruesa y resistente, y se convierte en un ooquiste que contiene el esporonte. Los ooquistes inmaduros, no esporulados, salen con las heces al exterior, donde el esporonte, bajo condiciones adecuadas, se divide en dos esporoquistes, cada uno de los cuales contiene dos esporozoítos (43).
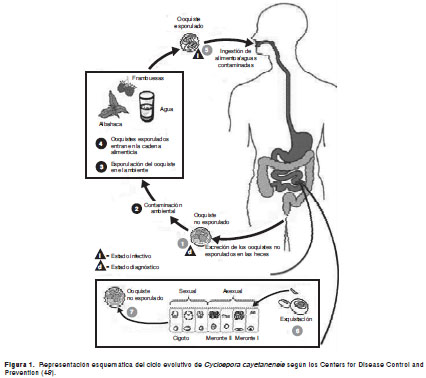
Las condiciones ambientales necesarias y óptimas para la esporulación de los ooquistes, no son del todo conocidas. Dependiendo de las condiciones climáticas, requieren de pocos días a semanas para madurar y transformarse en ooquistes esporulados (3). Bajo condiciones experimentales, se ha logrado la esporulación de los ooquistes en dicromato de potasio al 2,5 % (17) y ocurre en 7 a 13 días, a temperaturas de 22 a 32 (3). Los estudios de ooquistes procedentes de humanos y monos sugieren que la esporulación óptima ocurre a 20-22 en 14 días (50).
Morfología de los ooquistes
Los ooquistes esporulados son esféricos y pequeños, con un diámetro de 7,7 a 9,9µm. Con la tinción de ácido-alcohol resistencia, los ooquistes se tiñen en forma variada. Algunos se tiñen de un color rojo intenso y tienen un número variable de cuerpos de inclusión oscuros, mientras que otros no se tiñen y aparecen como esferas transparentes (39).
En el microscopio de fluorescencia, presentan autofluorescencia azul o verde bajo un disco dicromático de 365 nm o 450-490 nm (17,41). Al microscopio electrónico, el ooquiste esporulado posee una doble pared con 63 y 50 nm de grosor rodeando dos esporoquistes; cada uno tiene una pared de 62 nm de grosor que rodea la membrana plasmática, un residuo con glóbulos y cuerpos de Stieda y substieda. Estos últimos son organelos ultraestructurales que ocluyen una abertura en la región polar del esporoquiste de algunos coccidios; su rotura permite la ruptura del quiste y la salida de los esporozoítos. Cada esporoquiste contiene dos esporozoítos (17,43).
Resistencia de los ooquistes
Los ooquistes de los coccidios pueden persistir por largos períodos en el ambiente, manteniendo su capacidad infecciosa aun bajo condiciones ambientales rigurosas (2,51). La acentuada estacionalidad de la ciclosporosis en las áreas endémicas, sugiere que los ooquistes de C. cayetanensis pueden sobrevivir en el ambiente por largos períodos (11).
Los ooquistes son muy sensibles a la desecación, sus paredes se rompen a partir de los 15 minutos (52). Son muy resistentes a los desinfectantes, incluyendo el cloro a las concentraciones usadas para el tratamiento del agua (30,53). Pueden sobrevivir en el agua a 4 por dos meses y a 37 por 7 días (3,50). Los ooquistes no pueden ser inducidos a esporular después de la congelación a -18°C durante 24 horas y al calentamiento a 60 durante una hora (41). Los ooquistes necesitan humedad, temperatura moderada y suficiente tiempo en el ambiente, para hacerse infectivos. El agua facilita el desarrollo y transmisión de los ooquistes de los coccidios (2).
Eimeria acervulina, un coccidio de pollos con semejanzas a C. cayetanensis, ha sido usada como un sustituto para desarrollar tratamientos de descontaminación para alimentos frescos contaminados importados de países endémicos. Los tratamientos de congelación y calentamiento e irradiación gamma a una dosis de 1,0 kGy o mayor, fueron efectivos contra el parásito (54).
Se ha estudiado la esporulación de los ooquistes de C. cayetanensis, como un indicador de viabilidad en los alimentos. Ooquistes inmaduros, no esporulados fueron sometidos a condiciones de congelación y calentamiento en substratos lácteos y albahaca, y luego fueron colocados en dicromato de potasio al 2,5 %. La esporulación ocurrió cuando los ooquistes fueron resuspendidos en substratos lácteos a -15, por no más de 24 horas, y cuando se colocaron en agua o albahaca a 20 hasta por dos días y a 37 hasta por cuatro días. Pocos ooquistes esporularon a 50 durante una hora y la esporulación no ocurrió a -70, 70 y 100 en agua u hojas de albahaca (55). Se ha sugerido el tratamiento mediante presión hidrostática alta y radiación con rayos ultravioleta, para disminuir el riesgo a la ciclosporosis asociada a los alimentos (56). La esporulación de C. cayetanensis no se afectó después del calentamiento por microondas hasta por 45 segundos (57) y del uso de dióxido de cloro gaseoso a 4,1 mg/litro durante 20 minutos (58).
Capacidad infecciosa
La dosis infecciosa de ooquistes de C. cayetanensis no se conoce. Sin embargo, con base en los datos obtenidos de estudios de epidemias de la infección y a extrapolaciones a otros coccidios, se cree que es relativamente baja (41,59), probablemente entre 10 y 100 ooquistes (60). No se conocen del todo los factores ambientales que intervienen en la transformación del ooquiste inmaduro en esporulado e infectivo. Este conocimiento ha sido limitado por el hecho de que el parásito no ha podido ser cultivado in vitro ni se ha podido establecer en una gran variedad de animales modelo (61) y en humanos (62).
La virulencia de un agente infeccioso, la sensibilidad del huésped y los factores de riesgo, son variables que afectan la respuesta de un huésped a la exposición de un patógeno. La virulencia y las características del coccidio para infectar a los humanos se desconocen. Se ha observado variabilidad de la secuencia de nucleótidos en las regiones de transcripción interna de C. cayetanensis procedentes de diversas áreas geográficas, lo cual sugiere la existencia de múltiples razas (63,64); es probable que muchas infecciones humanas por C. cayetanensis se deban a múltiples clones del coccidio. En conclusión, no se conocen a cabalidad las condiciones necesarias y las causas desencadenantes para que los ooquistes de Cyclospora se transformen en infecciosos en el medio ambiente.
Distribución ambiental y transmisión
Se tiene muy poca información sobre la distribución ambiental de C. cayetanensis y los vehículos de transmisión del coccidio del ambiente a los humanos. El agua, los alimentos y los suelos pueden actuar como vehículos de transporte de este parásito.
Agua
En relación con el ecosistema acuático, se ha detectado el coccidio en varias regiones. En áreas rurales de Guatemala, se investigó la presencia de C. cayetanensis en varias fuentes de agua usadas para el consumo público. En tres de cinco muestras de agua, se confirmó la presencia del parásito mediante la técnica de la PCR (65). En Perú, el coccidio se identificó en aguas servidas (66). En Nepal, Asia, se observaron ooquistes de Cyclospora spp. en agua de consumo, lo cual se asoció a una epidemia de la infección en soldados extranjeros (30). En Vietnam, el parásito se describió en agua de consumo y en 63,6 % de muestras de ríos y lagos estudiadas (67). En Egipto, áfrica, el coccidio fue aislado, en cinco áreas residenciales, de varias fuentes de agua usadas para el consumo, tales como un drenaje, un canal de irrigación, aguas subterráneas y agua almacenada en toneles. Las altas densidades de los ooquistes en las aguas indicaron contaminación por aguas servidas y reflejan la alta contaminación ambiental por C. cayetanensis en el área (68). En otro estudio, el parásito se identificó en 0,24 % de 840 muestras de agua potable de siete distritos (69). En Alejandría, el coccidio se identificó en diferentes fuentes de agua, incluyendo piscinas (70). Los papeles que desempeñan el ecosistema marino y las aguas provenientes de la tierra en la presencia y el mantenimiento de este parásito en huéspedes marinos (71), no se conocen. Sin embargo, la presencia del coccidio en bivalvos sugiere que el uso del mar para fines recreativos es un factor de riesgo potencial para la ciclosporosis.
Se han señalado diversas variables relacionadas con el agua como factores de riesgo para la ciclosporosis. En Perú, la infección estuvo relacionada con el consumo de agua no clorada (72). En un estudio controlado de Guatemala, consumir agua no tratada, fuentes de agua de alto riesgo (tanque público, pozo, manantial, camión cisterna) y nadar en ríos y manantiales, estuvieron asociados a la ciclosporosis (18). En Haití, el único factor relacionado con C. cayetanensis fue el consumo de agua de un pozo artesanal (19). En Nepal, Asia, la ciclosporosis fue relacionada con el consumo de agua no tratada (31). En otro estudio, el agua de consumo y las aguas servidas se identificaron como posibles fuentes de la infección (73). En el mundo industrializado, se han reportado algunas epidemias de la infección asociadas con el agua (13-15). C. cayetanensis ha sido el agente causal de 1,8 % (6/325) de las epidemias en el mundo ocasionadas por protozoarios (15).
Alimentos
En el mundo en desarrollo, C. cayetanensis se ha descrito en frutas y alimentos frescos; en 1,8 % de las muestras de vegetales estudiadas de mercados en Perú (74), en lechugas de mercados de productos agrícolas de Costa Rica (75) y Venezuela (76), y de vegetales verdes en Nepal (73). En este estudio y otro de Jordania (77), la ciclosporosis se relacionó con la ingestión de vegetales. En Egipto, C. cayetanensis se aisló de lechugas (78) y bivalvos (71) obtenidos de mercados de Alejandría. En un estudio de viajeros a áreas endémicas, afectados de diarrea, las fresas, la leche de búfala y el seviche se identificaron como factores de riesgo para la infección en cuatro casos (79). En Indonesia (32), México (34), Colombia (36), Guatemala (7) y Perú (37,38), se han descrito epidemias de ciclosporosis relacionadas con el consumo de frutas, vegetales, jugos de frambuesas y salsas de vegetales.
La creciente globalización de productos alimenticios frescos y de los viajes internacionales y la tendencia a comer fuera del hogar, han contribuido a la diseminación del parásito de regiones endémicas a las no endémicas. En los Estados Unidos y Canadá, han ocurrido numerosas epidemias de ciclosporosis de alto perfil, debidas al consumo de frambuesas contaminadas importadas de Guatemala (1,11-13,80). Otras epidemias en estos países y en Europa se han relacionado con el consumo de lechugas, albahaca, vegetales verdes y guisantes (12,81-87). En los Estados Unidos, 90 % de los casos de ciclosporosis se han asociado con el consumo de alimentos (87).
Suelos
No se han realizado estudios para determinar la presencia de C. cayetanensis en los suelos. Sin embargo, el contacto con éstos se ha señalado como un factor de riesgo para la infección, tanto en los países industrializados como en aquéllos en desarrollo. En los primeros, en un estudio de una epidemia de ciclosporosis en Florida, Estados Unidos, los trabajos de jardinería se asociaron con la infección, lo cual sugiere el contacto con la tierra como un factor de riesgo (88). En Alemania, una epidemia se relacionó con lechugas provenientes de granjas francesas e italianas. Se consideró que los ooquistes pudieron haber sido transmitidos por trabajadores oriundos de áreas endémicas, por medio del contacto con el suelo local o con el agua (84).
En el mundo en desarrollo, el contacto con la tierra ha sido una importante fuente de infección para los niños en Perú (20), Guatemala (18), Venezuela (22) y Egipto (68). En áreas endémicas, el notorio aumento de la densidad de la población y la migración masiva de áreas rurales a urbanas en las últimas décadas, han significado la construcción de centros urbanos sin ninguna planificación, lo cual ha traído como consecuencia el hacinamiento, falta de saneamiento ambiental, disposición inadecuada de basuras y poca educación sanitaria. En estos ambientes, la contaminación de los suelos por prácticas inadecuadas de defecación podría ser un factor determinante para la infección, como fue el caso en una comunidad isleña venezolana (22). En este estudio diseñado para determinar las fuentes de infección de C. cayetanensis en la isla de San Carlos, estado Zulia, el modelo de regresión logística multivariable implicó significativamente varios factores: vivir en áreas de extrema pobreza, residir en ranchos, defecar en un área del patio de la residencia y tener contacto con suelos contaminados con heces humanas (p<0,01). El hallazgo más importante de este estudio fue la alta correlación de la ciclosporosis con ambientes conducentes a la contaminación ambiental con heces humanas (p<0,01), lo cual sugiere que los suelos contaminados son un importante vehículo de diseminación de la infección en esta área, que la tierra puede ser una fuente significativa de ooquistes de C. cayetanensis en comunidades paupérrimas y que la ciclosporosis, como las otras infecciones transmisibles, afecta principalmente a las familias que viven en residencias con características por debajo del estándar.
En un estudio reciente de una comunidad de bajas condiciones socioeconómicas del estado Falcón, Venezuela, el contacto con el suelo fue también un factor de riesgo para la infección (Chacin-Bonilla L, datos sin publicarse). En Anhui, China, la infección fue significativamente mayor en áreas rurales donde la contaminación ambiental con heces humanas era frecuente (89).
Aire
La presencia de ooquistes de C. cayetanensis en el aire y la posibilidad de su diseminación por medio de este vehículo se desconoce. Sin embargo, la identificación de los ooquistes en el esputo de dos pacientes con síntomas respiratorios, uno con antecedentes de tuberculosis (90) y otro con la enfermedad (91), sugiere la probabilidad de que el aire pudiera actuar como transporte del coccidio. Habría que determinar con qué frecuencia y bajo cuáles circunstancias ocurre.
No se conoce si C. cayetanensis está ampliamente distribuida en el ecosistema mundial. Sin embargo, todos estos hallazgos sugieren que el parásito tiene una amplia diseminación ambiental en el mundo en desarrollo, contaminando con frecuencia el agua, los alimentos y los suelos, y que posee el potencial de transmitirse por medio de la tierra y del consumo de alimentos frescos y agua, incluyendo la clorada, las aguas de recreación y las aguas servidas.
Distribución estacional
En diversos países, se ha descrito una variación acentuada en la prevalencia de la infección de acuerdo con la época del año. Sin embargo, esta variación no es similar en las diferentes regiones y es difícil de explicar (12). En la mayoría de las naciones, la prevalencia de la infección se incrementa durante la estación lluviosa y caliente. Tal es el caso de Guatemala (18), Honduras (92), Jordania (77), Nepal (26,31,73,93), e Indonesia (32). En Venezuela, en una comunidad del estado Falcón, se observó una mayor frecuencia de la infección durante la época de lluvias (Chacin-Bonilla L, datos sin publicarse). En Canadá y en los Estados Unidos, casi todas las epidemias por consumo de alimentos, que se han relacionado principalmente con frambuesas guatemaltecas, han ocurrido durante la primavera y comienzos del verano, que es una temporada lluviosa y caliente (1,12). Por el contrario, la infección ha sido más prevalente durante los meses del año más fríos y secos en Haití (27) y Perú (17,25). En ambos países, parece ser que las fluctuaciones de la temperatura, y no las variaciones de la pluviometría, son el moderador de la estacionalidad de la infección (27). Sin embargo, en Turquía, la mayor frecuencia de la ciclosporosis ocurre durante el período seco y caliente (94). No se sabe cuáles son los factores que determinan la variación estacional de la infección y por qué no es igual en las diferentes regiones. Sin embargo, estos hallazgos hacen pensar que los factores ambientales son de suma importancia en el ciclo vital del parásito y que los ooquistes, al igual que los de otros coccidios, son muy resistentes y sobreviven por largos periodos en el ambiente.
Distribución en animales
No se conoce el papel que los animales puedan desempeñar como reservorios naturales de C. cayetanensis. Este parásito no se ha podido establecer en animales modelo (61), ni se ha confirmado un animal reservorio (95). Estos hechos sugieren la estricta especificidad de huésped del parásito y que los humanos son los únicos huéspedes naturales de C. cayetanensis. Sin embargo, en estudios epidemiológicos del parásito realizados en varios países, como Guatemala (18), Perú (25), Jordania (77), Nepal (73) y Egipto (68), los animales domésticos han sido factores de riesgo significativos para la ciclosporosis y se han descrito ooquistes similares a los de C. cayetanenesis en diferentes tipos de animales, como patos (72), pollos (96,97), ratas y ratones (73), perros (98) monos y primates (99-101). Sin embargo, como la identificación del coccidio se ha hecho con las técnicas convencionales, que son de baja sensibilidad y especificidad, y los hallazgos han sido controversiales, la presencia del parásito en animales ha sido recibida con escepticismo. En contraste con estos estudios, en Haití, el parásito no se observó en 327 animales domésticos, incluyendo vacas, caballos, cabras, cerdos, gatos, cobayos, patos, pavos, pollos y palomas (102). En Brasil, se identificó el parásito en dos perros (98), pero no se identificó en 140 perros de la misma región (103).
En monos (100) y primates (99,101) se observaron ooquistes similares a los de Cyclospora. Este hallazgo sugirió la existencia de otro huésped y reservorio, diferente a los humanos, para C. cayetanensis. Pero, posteriormente, estos aislamientos se identificaron con técnicas moleculares, como tres especies diferentes de Cyclospora: C. cercopitheci, C. colobi y C. papionis (46).
Recientemente, se demostró la presencia de C. cayetanensis, mediante la técnica de PCR, en un mono, dos perros y un pollo (95). Este hallazgo es probablemente el más importante, hasta el presente, desde la perspectiva de las zoonosis. Sin embargo, no es posible saber si la presencia del parásito en estos animales significa que son huéspedes de transmisión o verdaderos huéspedes naturales del coccidio. Para saberlo, es necesario realizar estudios histológicos para determinar la presencia o ausencia de las fases del ciclo de vida del parásito dentro de las células epiteliales intestinales de estos animales.
Los rasgos biológicos de C. cayetanensis son relevantes para su epidemiología y transmisión, y determinan su importancia médica y en salud pública:
1) si el parásito tiene especificidad de huésped, siendo los humanos los únicos huéspedes, carece de potencial zoonótico;
2) los ooquistes son eliminados con las heces al exterior en forma inmadura, no esporulada, lo que significa que la transmisión directa de persona a persona es muy improbable;
3) los ooquistes necesitan esporular en el medio ambiente para hacerse infectivos, por lo que requieren de un vehículo de transmisión;
4) la dispersión ambiental de estos organismos puede contaminar el ecosistema acuático, los cultivos de alimentos y los suelos, lo cual conduciría a su diseminación amplia y su transmisión a los humanos por medio de estos vehículos;
5) al parecer, la dosis infecciosa es baja, lo cual implica que la infección se adquiere con facilidad,
6) los ooquistes son pequeños y resistentes al cloro, a las dosis usadas para el tratamiento del agua, lo que implica que son difíciles de filtrar y que se pueden transmitir en el agua clorada de consumo y en las piscinas; y
7) la notoria estacionalidad de la ciclosporosis sugiere que los ooquistes son muy resistentes y que pueden sobrevivir por largos períodos en el ambiente.
Perspectivas futuras
Actualmente, existen muchas incertidumbres y preguntas sin responder sobre la biología de C. cayetanensis, que ameritan continuar las investigaciones para conocer los rasgos biológicos del coccidio y establecer medidas preventivas y de control para contrarrestar el impacto médico y en salud pública de la ciclosporosis.
Los estudios moleculares han sugerido que C. cayetanensis es un miembro del género Eimeria (45). Para dilucidar la posición taxonómica y las afinidades filogenéticas del parásito, es necesaria la evaluación molecular de aislamientos adicionales de C. cayetanensis y de Eimeria spp. Las técnicas moleculares deben ser utilizadas para el diagnóstico del coccidio en muestras clínicas y ambientales. Recientemente, se han desarrollado técnicas biológicas moleculares para detectar y diferenciar Cyclospora a nivel de especie, pero no son ampliamente usadas en el diagnóstico de rutina.
Existe poca vigilancia o control de C. cayetanensis en el ambiente, por lo que se desconoce si está ampliamente distribuida. Para el aislamiento del parásito en muestras ambientales de agua y alimentos, se usan métodos complejos. No existen perlas paramagnéticas cubiertas con anticuerpos o anticuerpos rotulados para la detección de Cyclospora por separación inmunomagnética y citometría de flujo (59). El mejoramiento de los métodos de diagnóstico del parásito permitirá una mejor evaluación de su presencia y distribución en el ambiente, y de los riesgos que representa, lo que conducirá a mejores estrategias de prevención y control. Las técnicas moleculares de diagnóstico deben ser aplicables a las muestras ambientales para la identificación a nivel de especie. La caracterización molecular de los aislamientos en las matrices ambientales y el rastreo de las fuentes del parásito, mejorarán mucho el conocimiento de las fuentes y las rutas de contaminación. Los métodos moleculares para la identificación del coccidio en las muestras ambientales deben tener mayor sensibilidad, especificidad y discriminación.
Hasta el presente se han estudiado muestras de agua y alimentos. Los estudios ambientales deben incluir el examen de muestras de suelos, ya que existen pruebas de que ellos constituyen fuentes de infección (18,20,22). Debe estudiarse la asociación entre la infección y el contacto con la tierra.
Se conoce muy poco sobre la ecología del parásito. Muchos otros coccidios son capaces de resistir y esporular después de la exposición a condiciones ambientales estresantes (2,51). Es necesario estudiar si los ooquistes de C. cayetanensis son también tan resistentes como los de otros coccidios.
La carencia de un medio de cultivo in vitro para C. cayetanensis y de animales experimentales, han limitado los estudios de laboratorio. Se necesita un método para cultivar los ooquistes de Cyclospora in vitro para la realización de investigaciones en el laboratorio. Los estudios del parásito en primates, como animales modelo, han aportado conocimientos de la infección, pero también nuevas preguntas acerca de la biología de C. cayetanensis.
Se requieren estudios moleculares para dilucidar si las especies de Cyclospora descritas en primates inferiores acontecen en humanos y confirmar si C. cayetanensis afecta a los monos. Se necesitan investigaciones para determinar el papel que puedan desempeñar los animales en el desarrollo del ciclo de vida del parásito.
A pesar de los nuevos conocimientos adquiridos de C. cayetanensis en los últimos años, persisten incertidumbres significativas acerca de los factores que influencian su capacidad infecciosa, estacionalidad, modos de contaminación de los alimentos, papel que desempeñan los animales y suelos como fuentes de infección, y la distribución geográfica, y reflejan la necesidad de continuar los estudios de este coccidio en diversas áreas, incluyendo su biología básica.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de interés.
Financiación
La presente investigación fue subvencionada por la Universidad del Zulia.
Correspondencia: Leonor Chacín-Bonilla, Instituto de Investigaciones Clínicas, Facultad de Medicina, Universidad del Zulia, Calle 65 con avenida 18A, Maracaibo, Venezuela.
Teléfono: (58-261) 793 3564; fax: (58-261) 759 7247 leonorbonilla42@yahoo.com
Referencias
1. Shields JM, Olson BH. Cyclospora cayetanensis: A review an emerging parasitic coccidian. Int J Parasitol. 2003;33:371-91. [ Links ]
2. Mansfield LS, Gajadhar AA. Cyclospora cayetanensis a food-and waterborne coccidian parasite. Vet Parasitol. 2004;126:73-90. [ Links ]
3. Ortega YR, Sterling CR, Gilman RH. Cyclospora cayetanensis. Adv Parasitol. 1998;40:339-418. [ Links ]
4. Long EG, Ebrahimzadeh A, White EH, Swisher B, Callaway CS. Alga associated with diarrhea in patients with acquired immunodeficiency syndrome and in travellers. Clin Microbiol. 1990;28:1101-4. [ Links ]
5. Shlim DR, Cohen MT, Eaton M, Rajah R, Long EG, Ungar BL. An alga-like organism associated with an outbreak of prolonged diarrhea among foreigners in Nepal. Am J Trop Med Hyg. 1991;45:383-9. [ Links ]
6. Bourée P, Lancon A, Bisaro F, Bonnot G. Six human cyclosporiasis: With general review. J Egypt Soc Parasitol. 2007;37:349-60. [ Links ]
7. Puente S, Morente A, García-Benayas T, Subirats M, Gascón J, González-Lahoz JM. Cyclosporiasis: A point source outbreak acquired in Guatemala. J. Travel Med. 2006;13:334-7. [ Links ]
8. Chambers J, Somerfeldt S, Mackey L, Nichols S, Ball R, Roberts D, et al. Outbreaks of Cyclospora cayetanensis infection-United States. MMWR Morb Mortal Wkly Rep.1996;45:549-51. [ Links ]
9. Anonymous. Update: Outbreaks of cyclosporiasis-United States and Canadá. Can Comm Dis Rept. 1997;23:143-4. [ Links ]
10. Herwaldt BL, Ackers ML. An outbreak in 1996 of cyclosporiasis associated with imported raspberries. N Engl J Med. 1997;336:1548-56. [ Links ]
11. Herwaldt BL, Beach MJ. The return of Cyclospora in 1997: Another outbreak of cyclosporiasis in North America associated with imported raspberries. Ann Intern Med. 1999;130:210-20. [ Links ]
12. Herwaldt BL. Cyclospora cayetanensis: A review, focusing on the outbreaks of cyclosporiasis in the 1990s. Clin Infect Dis. 2000;31:1040-57. [ Links ]
13. Dawson D. Foodborne protozoan parasites. Int J Food Microbiol. 2005;103:207-27. [ Links ]
14. Huang P, Weber JT, Sosin DM, Griffin PM, Long EG, Murphy JJ, et al. The first reported outbreak of diarrheal illness associated with Cyclospora in the United States. Ann Intern Med. 1995;123:409-14. [ Links ]
15. Karanis P, Kourenti C, Smith H. Waterborne transmission of protozoan parasites: A worldwide review of outbreaks and lessons learnt. J Water Health. 2007;5:1-38. [ Links ]
16. Pratdesaba RA, González M, Piedrasanta E, Mérida C, Contreras K, Vela C, et al. Cyclospora cayetanensis in three populations at risk in Guatemala. J Clin Microbiol. 2001;39:2951-3. [ Links ]
17. Ortega YR, Sterling CR, Gilman RH, Cama VA, Díaz F. Cyclospora species- a new protozoan pathogen of humans. N Engl J Med. 1993;328:1308-12. [ Links ]
18. Bern C, Hernández B, López MB, Arrowood MJ, álvarez M, de Mérida AM, et al. Epidemiologic studies of Cyclospora cayetanensis in Guatemala. Emerg Infect Dis. 1999;5:766-74. [ Links ]
19. López AS, Bendik JM, Alliance JY, Roberts JM, da Silva AJ, Moura IN, et al. Epidemiology of Cyclospora cayetanensis and other intestinal parasites in a community in Haiti. J Clin Microbiol. 2003;41:2047-54. [ Links ]
20. Madico G, McDonald J, Gilman RH, Cabrera L, Sterling CR. Epidemiology and treatment of Cyclospora cayetanensis infection in Peruvian children. Clin Infect Dis. 1997;24:977-81. [ Links ]
21. Chacín-Bonilla L, Mejía M, Estévez J. Prevalence and pathogenic role of Cyclospora cayetanensis in a Venezuelan community. Am J Trop Med Hyg. 2003;68:304-6. [ Links ]
22. Chacín-Bonilla L, Barrios F, Sánchez Y. Epidemiology of Cyclospora cayetanensis infection in San Carlos Island, Venezuela: Strong association between socio-economic status and infection. Trans R Soc Trop Med Hyg. 2007;101:1018-24. [ Links ]
23. Burstein S. Ciclosporosis: una parasitosis emergente (1). Aspectos clínicos y epidemiológicos. Rev Gastroenterol Perú. 2005;25:328-35. [ Links ]
24. Chacín-Bonilla L, Estévez J, Monsalve F, Quijada L. Cyclospora cayetanensis infections among diarrheal patients from Venezuela. Am J Trop Med Hyg. 2001;65:351-4. [ Links ]
25. Bern C, Ortega YR, Checkley W, Roberts JM, Lescano AG, Cabrera L, et al. Epidemiologic differences between cyclosporiasis and cryptosporidiosis in Peruvian children. Emerg Infect Dis. 2002;8:581-5. [ Links ]
26. Hoge CW, Echeverría R, Jacobs J, Matthouse S, Chapman E, Jiménez LM, et al. Prevalence of Cyclospora species and other enteric pathogens among children less than 5 years of age in Nepal. J Clin Microbiol. 1995;33:3058-60. [ Links ]
27. Eberhard ML, Nace EK, Freeman AR, Streit TG, Da Silva AJ, Lammie PJ. Cyclospora cayetanensis infections in Haiti: A common occurrence in the absence of watery diarrhea. Am J Trop Med Hyg. 1999;60:584-6. [ Links ]
28. Devera R, Blanco Y, Cabello E. Elevada prevalencia de Cyclospora cayetanensis en indígenas del estado Bolívar, Venezuela. Cad Saúde Pública. 2005;21:1778-84. [ Links ]
29. Ortega YR, Nagle R, Gilman RH, Watanabe J, Miyagui J, Quispe H, et al. Pathologic and clinical findings in patients with cyclosporiasis and a description of intracellular parasite life-cycle stages. J Infect Dis. 1997;176:1584-9. [ Links ]
30. Rabold G, Hoge CW, Shlim DR, Kefford C, Rajah R, Echeverría P. Cyclospora outbreak associated with chlorinated drinking water. Lancet. 1994;344:1360-1. [ Links ]
31. Hoge CW, Shlim DR, Rajah R, Triplett J, Shear M, Rabold JG, et al. Epidemiology of diarrhoeal illness associated with coccidian-like organism among travellers and foreign residents in Nepal. Lancet. 1993;341:1175-9. [ Links ]
32. Fryauff DJ, Krippner R, Prodjodipuro P, Ewald C, Kawengian S, Pagelow K, et al. Cyclospora cayetanensis among expatriate and indigenous populations of West Java, Indonesia. Emerg Infect Dis. 1999;5:585-8. [ Links ]
33. Blans MC, Ridwan BU, Verweij JJ, Rozenberg-Aroka M, Verhoef J. Cyclosporiasis outbreak, Indonesia. Emerg Infect Dis. 2005;11:1453-5. [ Links ]
34. Ayala-Gaytán JJ, Díaz-Olachea C, Riojas-Montalvo P, Palacios-Martínez C. Cyclosporidiosis: Clinical and diagnostic characteristics of an epidemic outbreak. Rev Gastroenterol Mex. 2004;69:226-9. [ Links ]
35. Zini RM, Santos CC, Almeida I, Aparecida ZC, Peresi JT, Marques CC. Atuacao do Laboratório de Saúde Pública na elucidacao do surto de diarréia causado por Cyclospora cayetanensis no município de General Salgado-SP. Rev Inst Adolfo Lutz. 2006;63:116-21. [ Links ]
36. Botero-Garcés J, Montoya-Palacio MN, Barguil JI, Castaño-González A. Brote epidémico por Cyclospora cayetanensis en Medellín, Colombia. Rev Salud Pública. 2006;8:258-68. [ Links ]
37. Torres-Slimming PA, Mundaca CC, Morán M, Quispe J, Colina O, Bacon DJ, et al. Outbreak of cyclosporiasis at a naval base in Lima, Perú. Am J Trop Med Hyg. 2006;75:546-8. [ Links ]
38. Mundaca CC, Torres-Slimming PA, Araujo-Castillo RV, Morán M, Bacon DJ, Ortega Y, et al. Use of PCR to improve diagnostic yield in an outbreak of cyclosporiasis in Lima, Perú. Trans R Soc Trop Med Hyg. 2008;102:712-7. [ Links ]
39. Eberhard ML, Pieniazek NJ, Arrowood MJ. Laboratory diagnosis of Cyclospora infections. Arch Pathol Lab Med. 1997;121:792-7. [ Links ]
40. Almirall P, Escobedo A, Cimerman S. Cyclospora cayetanensis: un protozoo intestinal emergente. Rev Panam Infectol. 2008;10:24-9. [ Links ]
41. Sterling CR, Ortega YR. Cyclospora: An enigma worth unraveling. Emerg Infect Dis. 1999;5:48-53. [ Links ]
42. Adl SM, Simpson AGB, Farmer MA, Andersen RA, Anderson OR, Barta JR, et al. The new higher level classification of eukaryotes with emphasis on the taxonomy of protists. J Eukaryot Microbiol. 2005;52:399-451. [ Links ]
43. Ortega YR, Gilman RH, Sterling CR. A new coccidian parasite Apicomplexa: Eimeriidae from humans. J Parasitol. 1994;80:625-9. [ Links ]
44. Relman DA, Schmidt TM, Gajadhar A, Sogin M, Cross J, Yoder K, et al. Molecular phylogenetic analysis of Cyclospora, the human intestinal pathogen, suggests that it is closely related to Eimeria species. J Infect Dis. 1996;173 440-5. [ Links ]
45. Pieniazek NJ, Herwaldt BL. Reevaluating the molecular taxonomy: is human-associated Cyclospora a mammalian Eimeria species. Emerg Infect Dis. 1997;3:381-3. [ Links ]
46. Eberhard ML, Da Silva AJ, Lilley BG, Pieniazek NJ. Morphologic and molecular characterization of new Cyclospora species from Ethiopian monkeys: C. cercopitheci sp.n., C. colobi sp.n, and C. papionis sp.n. Emerg Infect Dis. 1999;5:651-8. [ Links ]
47. Schaudinn F. Studien uber krankheitserregende Protozoen I. Cyclospora caryolytica Shaud. der perniciosen Enteritis des Maulwurfs. Arb K Gesundheitsamte. 1902;18:378-416. [ Links ]
48. Centers for Disease Control and Prevention. Cyclosporiasis. Fecha de consulta: 25 de julio de 2010. Disponible en: www.dpd.cdc.gov/dpdx/HTML/Cyclosporiasis.htm. [ Links ]
49. Sun T, Ilardi CF, Asnis D, Bresciani AR, Goldenberg S, Roberts B, et al. Light and electron microscopic identification of Cyclospora species in the small intestine. Evidence of the presence of asexual life cycle in human host. Am J Clin Pathol. 1996;105:216-20. [ Links ]
50. Smith HV, Paton CA, Mtambo MM, Girdwood RW. Sporulation of Cyclospora sp. oocysts. Appl Environ Microbiol. 1997;63:1631-2. [ Links ]
51. Sinski E, Behnke JM. Apicomplexan parasites: Environmental contamination and transmission. Pol J Microbiol. 2004; 3 (Suppl.): 67-73. [ Links ]
52. Long EG, White EH, Carmichael WW, Quinlisk PM, Raja R, Swisher BL, et al. Morphological and staining characteristics of a Cyanobacterium-like organism associated with diarrhea. J Infect Dis. 1991;164:199-202. [ Links ]
53. Soave R, Herwaldt BL, Relman DA. Cyclospora. Infect Dis Clin North Am. 1998;12:1-12. [ Links ]
54. Lee MB, Lee E H. Coccidial contamination of raspberries: Mock contamination with Eimeria acervulina as a model for decontamination treatment studies. J Food Prot. 2001;64:1854-7. [ Links ]
55. Sathyanarayanan L, Ortega YR. Effects of temperature and different food matrices on Cyclospora cayetanensis oocyst sporulation. J Parasitol. 2006;92:218-22. [ Links ]
56. Kniel KE, Shearer AE, Cascarino JL, Wilkins GC, Jenkins MC. High hydrostatic pressure and UV light treatment of produce contaminated with Eimeria acervulina as a Cyclospora cayetanensis surrogate. J Food Prot. 2007;70:2837-42. [ Links ]
57. Ortega YR, Liao J. Microwave inactivation of Cyclospora cayetanensis sporulation and viability of Cryptosporidium parvum. J Food Prot. 2006;69:1957-60. [ Links ]
58. Ortega YR, Mann A, Torres MP, Cama V. Efficacy of gaseous chlorine dioxide as a sanitizer against Cryptosporidium parvum, Cyclospora cayetanensis, and Encephalitozoon intestinalis on produce. J Food Prot. 2008;71:2410-4. [ Links ]
59. Dixon BR, Bussey JM, Parrington LJ, Parenteau M. Detection of Cyclospora cayetanensis oocysts in human fecal specimens by flow cytometry. J Clin Microbiol. 2005;43:2375-9. [ Links ]
60. Adam A, Ortega YR. Cyclospora. En: Robinson RK, Batt CA, Patel PD, editors. Encyclopaedia of food microbiology. London, UK: Academic Press Limited; 1999. p. 502-13. [ Links ]
61. Eberhard ML, Ortega YR, Hanes DE, Nace EK, Do RQ, Robl MG, et al. Attempts to establish experimental Cyclospora cayetanensis infection in laboratory animals. J Parasitol. 2000;86:577-82. [ Links ]
62. Alfano-Sobsey EM, Eberhard ML, Seed JR, Weber DJ, Won KY, Nace EK, et al. Human challenge pilot study with Cyclospora cayetanensis. Emerg Infect Dis. 2004;10:726-8. [ Links ]
63. Adam RD, Ortega YR, Gilman RH, Sterling CR. Intervening transcribed spacer region 1. Variability in Cyclospora cayetanensis. J Clin Microbiol. 2000;38:2339-43. [ Links ]
64. Olivier C, van de Pas S, Lepp PW, Yoder K, Relman DA. Sequence variability in the first internal transcribed spacer region within and among Cyclospora species is consistent with polyparasitism. Int J Parasitol. 2001;31:1475-87. [ Links ]
65. Dowd SE, John D, Eliopolus J, Gerba C P, Naranjo J, Klein R, et al. Confirmed detection of Cyclospora cayetanensis, Encephalitozoon intestinalis and Cryptosporidium parvum in water used for drinking. J Water Health. 2003;1:117-23. [ Links ]
66. Sturbaum GD, Ortega YR, Gilman RH, Cabrera C, Klein DA. Detection of Cyclospora cayetanensis in wastewater. Appl Environ Microbiol. 1998;64:2284-6. [ Links ]
67. Miegeville M, Koubi V, Dan LC, Barbier JP, Cam PD. Cyclospora cayetanensis et sa presénce en milieu hydrique á Hanoi (Vietnam). Etude dans l'environnement (eaux de forage, lacs et riviéres). Bull Soc Pathol Exot. 2003;96:149-52. [ Links ]
68. El-Karamany EM, Zaher TI, el-Bahnasawy MM. Role of water in the transmission of cyclosporiasis in Sharkia Governorate, Egypt. J Egypt Soc Parasitol. 2005;35:953-62. [ Links ]
69. Elshazly AM, Elsheikha HM, Soltan DM, Mohammad KA, Morsy TA. Protozoal pollution of surface water sources in Dakahlia Governorate, Egypt. J Egypt Soc Parasitol. 2007;37:51-64. [ Links ]
70. Youseff MY, Khalifa AM, el Azzouni MZ. Detection of Cryptosporidia in different water sources in Alexandria by monoclonal antibody test and modified Ziehl-Neelsen stain. J Egypt Soc Parasitol. 1998;28:487-96. [ Links ]
71. Negm AY. Human pathogenic protozoa in bivalves collected from local markets in Alexandria. J Egypt Soc Parasitol. 2003;33:991-8. [ Links ]
72. Zerpa R, Uchima N, Huicho L. Cyclospora cayetanensis associated with watery diarrhoea in Peruvian patients. J Trop Med Hyg. 1995;98:325-9. [ Links ]
73. Sherchand JB, Cross JH. Emerging pathogen Cyclospora cayetanensis infection in Nepal. Southeast Asian. J Trop Med Public Health. 2001;32(Suppl.):143-50. [ Links ]
74. Ortega YR, Roxas CR, Gilman RH, Miller NJ, Cabrera L, Taquiri C, et al. Isolation of Cryptosporidium parvum and Cyclospora cayetanensis from vegetables collected in markets of an endemic region in Perú. Am J Trop Med Hyg. 1997;57:683-6. [ Links ]
75. Calvo M, Carazo M, Arias ML, Chaves C, Monges R, Chinchilla M. Prevalencia de Cyclospora sp., Cryptosporidium sp., microsporidios y determinación de coliformes fecales en frutas y vegetales frescos de consumo crudo en Costa Rica. Arch Latinoam Nutr. 2004;54:428-32. [ Links ]
76. Devera R, Blanco Y, González H, García L. Parásitos intestinales en lechugas comercializadas en mercados populares y supermercados de Ciudad Bolívar, estado Bolívar, Venezuela. Rev Soc Ven Microbiol. 2006;26:100-7. [ Links ]
77. Nimri LF. Cyclospora cayetanensis and other intestinal parasites associated with diarrhea in a rural area of Jordan. Int Microbiol. 2003;6:131-5. [ Links ]
78. Abou el Naga IF. Studies on a newly emerging protozoal pathogen: Cyclospora cayetanensis. J Egypt Soc Parasitol. 1999;29:575-86. [ Links ]
79. Gascón J, álvarez M, Valls EM, Bordas MJ, Jiménez TM, Corachan M. Cyclosporiasis: A clinical and epidemiological study in travelers with imported Cyclospora cayetanensis infection. Med Clin (Barc). 2001;116:451-64. [ Links ]
80. Centers for Disease Control and Prevention. Update: Outbreaks of cyclosporiasis-United States and Canadá. MMWR Morb Mortal Wkly Rep. 1997;46:521-3. [ Links ]
81. Centers for Disease Control and Prevention. Outbreak of cyclosporiasis associated with snow peas-Pennsylvania, 2004. MMWR Morb Mortal Wkly Rep. 2004;53:876-8. [ Links ]
82. Brockmann S, Dietrich K, Doller PC, Dreweck C, Filipp N, Wagner-Wiening C, et al. Cyclosporiasis in Germany. Eurosurveillance Weekly. 2001;5:22. [ Links ]
83. López AS, Dodson DR, Arrowood MJ, Orlandi PA Jr, Da Silva AJ, Bier JW, et al. Outbreak of cyclosporiosis associated with basil in Missouri in 1999. Clin Infect Dis. 2001;32:1010-7. [ Links ]
84. Doller PC, Dietrich K, Filipp N, Brockmann S, Dreweck C, Vonthein R, et al. Cyclosporiasis outbreak in Germany associated with the consumption of salad. Emerg Infect Dis. 2002;8:922-94. [ Links ]
85. Anonymous. Salad implicated in US Cyclospora outbreak. Food Safety and Security. 2004. p. 7. Fecha de consulta: 15 de febrero de 2010. Disponible en: www.pjbames.co.uk/fss/foodsafety.htm. [ Links ]
86. Hoang LM, Fyfe M, Ong C, Harb J, Champagne S, Dixon B, et al. Outbreak of cyclosporiasis in British Columbia associated to imported Thai basil. Epidemiol Infect. 2005;133:23-37. [ Links ]
87. Mead PS, Slutsker L, Dietz V, McCaig LF, Bresee JS, Shapiro C, et al. Food-related illness and death in the United States. Emerg Infect Dis. 1999;5:607-25. [ Links ]
88. Koumans EH, Katz DJ, Malecki JM, Kumar S, Wahlquist SP, Arrowood MJ, et al. An outbreak of cyclosporiasis in Florida in 1995: A harbinger of multistate outbreaks in 1996 and 1997. Am J Trop Med Hyg. 1998;59:235-42. [ Links ]
89. Wang K-X, Li CP, Wang J, Tian Y. Cyclospora cayetanensis in Anhui, China. World J Gastroenterol. 2002;15:1144-8. [ Links ]
90. Di Gliullo AB, Cribari MS, Bava AJ, Cicconetti JS, Collazos R. Cyclospora cayetanensis in sputum and stool samples. Rev Inst Med Trop Sao Paulo. 2000;42:115-7. [ Links ]
91. Hussein EM, Abdul-Manaem AH, el-Attary SL. Cyclospora cayetanensis oocysts in sputum of a patient with active pulmonary tuberculosis, case report in Ismailia, Egypt. J Egypt Soc Parasitol. 2005;35:787-93. [ Links ]
92. Kaminsky RG. Comparación epidemiológica entre apicomplexa intestinales en población hospitalaria en Honduras. Rev Med Hondur. 2002;70:164-72. [ Links ]
93. Kimura K, Rai SK, Rai G, Insisiengmay S, Kawabata M, Karanis P, et al. Study on Cyclospora cayetanensis, associated with diarrheal disease in Nepal and Lao PDR. Southeast Asian J Trop Med Public Health. 2005;36:1371-6. [ Links ]
94. Turgay N, Yolasigmaz A, Erdogan DD, Zeyrek FY, Uner A. Incidence of cyclosporiasis in patients with gastrointestinal symptoms in western Turkey. Med Sci Monit. 2007;13:34-39. [ Links ]
95. Chu DMT, Sherchand JB, Cross JH, Orlandi PA. Detection of Cyclospora cayetanensis in animal fecal isolates from Nepal using an FTA filter-base polymerase chain reaction method. Am J Trop Med Hyg. 2004;71:373-9. [ Links ]
96. García-López HL, Rodríguez-Tovar LE, Medina-De la Garza CE. Identification of Cyclospora in poultry. Emerg Infect Dis. 1996;2:356-7. [ Links ]
97. Sherchand JB, Cross JH, Jimba M, Sherchand S, Shrestha MP. Study of Cyclospora cayetanensis in health care facilities, sewage water and green leafy vegetables in Nepal. Southeast Asian J Trop Med Public Health. 1999;30:58-63. [ Links ]
98. Yai LEO, Bauab AR, Hirschfeld MPM, de Oliveira ML, Damaceno JT. The first two cases of Cyclospora in dogs, Sao Paulo, Brazil. Rev Inst Med Trop Sao Paulo. 1997;39:177-9. [ Links ]
99. Smith HV, Paton CA, Girdwood RW, Mtambo MM. Cyclospora in non-human primates in Gombe, Tanzania (letter). Vet Rec. 1996;138:528. [ Links ]
100. López FA, Manglicmot J, Schimdt TM, Yeh C, Smith HV, Relman DA. Molecular characterization of Cyclospora-like organisms from baboons. J Infect Dis. 1999;179:670-6. [ Links ]
101. Eberhard ML, Njenga MN, da Silva AJ, Owino D, Nace EK, Won KY, et al. A survey for Cyclospora spp. in Kenyan primates, with some notes on its biology. J Parasitol. 2001;87:1394-7. [ Links ]
102. Eberhard ML, Nace EK, Freeman AR. Survey for Cyclospora cayetanensis in domestic animals in an endemic area in Haiti. J Parasitol. 1999;85:562-3. [ Links ]
103. Carollo MC, Amato Neto V, Braz LM, Dowoong K. Pesquisa de oocistos de Cyclospora sp., em fezes de caes da Grande Sao Paulo, Estado de Sao Paulo, Brasil. Rev Soc Bras Med Trop. 2001;34:597-8. [ Links ]














