Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.31 no.1 Bogotá Jan./Mar. 2011
REVISIÓN DE TEMA
Grupo de Investigación Bioingenium, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, D.C., Colombia
Recibido: 08/03/10; aceptado:16/09/10
Desde finales del siglo XX la microscopía se ha venido transformando, incluyendo nuevos recursos que mejoran y perfeccionan su práctica. Entre ellos se destaca el microscopio virtual, la sinergia entre disciplinas como la patología, la histología, la informática médica y el análisis de imágenes. Esta tecnología ha cambiado muchos paradigmas en la investigación, el diagnóstico, la educación y el entrenamiento médico. Los sistemas de microscopía virtual requieren de la digitalización de una placa con el uso de microscopios robotizados, antes del procesamiento de la imagen y después de él, compresión, transmisión por la red y visualización. En este artículo se hace un análisis extenso de cada uno de estos procesos, y se presentan las principales características de los microscopios virtuales, junto con el impacto de estos sistemas en actividades de interpretación y diagnóstico.
Palabras clave: microscopía, ingeniería biomédica; patología, interfaz usuario-computador, procesamiento de imagen asistida por computador, educación médica, informática médica.
Virtual microscopy systems: Analysis and perspectives
Microscopy has been constantly evolving since the end of the Twentieth Century, with the introduction of new resources which have improved its practice. For example, the use of the virtual microscope has reached a high level of maturity; it is a synergy among disciplines such as pathology, histology, medical informatics and image analysis. This technology has moved forward many paradigms in research, diagnosis, education and medical training. The virtual microscopy systems require the digitalization of a physical slide, using motorized microscopes, pre and post image processing, compression, transmission and visualization. This article provides an extensive analysis of each of these processes. The main characteristics of virtual microscopy are presented as well as the impact of these systems in image interpretation and in diagnostic activities.
Key words: Microscopy, biomedical engineering, pathology, user-computer interface; image processing, computer-assisted; education, medical; medical informatics.
Un microscopio virtual es un sistema que emula un microscopio óptico convencional, cuyo objetivo es la visualización y el despliegue de diferentes regiones de una placa virtual comprimida en un computador o dispositivo de visualización. Los microscopios virtuales han comenzado a ser parte del flujo de trabajo en los laboratorios clínicos y son de gran ayuda en la enseñanza de la microscopía, posicionándose como una herramienta fundamental en educación, investigación y diagnóstico (1). Esta clase de sistemas se debe adaptar a las condiciones de uso de múltiples usuarios e imágenes, a las necesidades particulares de cada especialidad y a un manejo tan intuitivo del microscopio virtual, que su uso resulte amigable para diferentes tipos de usuarios (2).
El almacenamiento físico de cualquier tipo de información tiene grandes limitaciones. En particular, las preparaciones de histología convencionales (placas de vidrio) presentan inconvenientes como su capacidad de uso y el no ser portátiles: sólo un usuario puede observar la muestra, el transporte de las placas es tedioso, las preparaciones convencionales son frágiles y no son permanentes (aparecen burbujas y la coloración se destiñe muy rápidamente). Algunas técnicas (inmunofluorescencia) sólo permiten evaluar la preparación un breve periodo tras su realización, y algunos tejidos o sustancias, como los cristales en el líquido articular, no se conservan (3).
Por el contrario, la muestra almacenada virtualmente resuelve la mayor parte de estas dificultades. La información virtual siempre está disponible para ser utilizada por múltiples usuarios, se transporta fácilmente, la exploración se puede estandarizar y es flexible. Otra ventaja de tener las placas digitalizadas, es la posibilidad de hacer anotaciones, marcar regiones de interés, utilizar técnicas de segmentación de imágenes y reconocimiento de patrones, así como hacer posible el análisis, la comparación y las medidas entre las imágenes para ayuda en el diagnóstico (4), con lo cual se puede inferir nuevo conocimiento médico.
Hasta ahora los microscopios virtuales se han utilizado principalmente, en actividades de enseñanza, como complemento de los cursos de histopatología y de los seminarios de patología para los estudiantes de medicina. El impacto de estos sistemas en la educación ha ido creciendo rápidamente, y hasta el momento hay disponible una gran cantidad de implementaciones (3,5-11).
Una de las ventajas del microscopio virtual es que permite a los futuros médicos adquirir la práctica necesaria en las técnicas relacionadas con microscopía, en cualquier momento del día y desde cualquier lugar: los registros muestran que los microscopios virtuales son utilizados más intensamente a las 4 a.m., con un intervalo de uso entre las 4 a.m. y la 1 p.m. (7).
En estudios recientes se ha calculado el impacto de la microscopía virtual en el aprendizaje, resaltando que los microscopios virtuales son una herramienta eficiente para la exploración de las placas de histología, y alcanzan 78 % de preferencia frente a 5,7 % de los microscopios convencionales (3). La ventaja de los microscopios virtuales, según los estudiantes, es la libertad para explorar y estudiar las placas, lo cual mejora significativamente el proceso de aprendizaje.
Otra ventaja del uso de los sistemas de microscopía virtual es la posibilidad de ubicar a varios usuarios en lugares remotos, para observar en tiempo real la información de la placa virtual, con lo cual se ofrece un ambiente adecuado para la participación de múltiples expertos en investigaciones científicas o segundas opiniones en actividades de diagnóstico.
Microscopio virtual
Un microscopio es un sistema óptico que transforma un objeto en una imagen y amplifica (to magnify) sus detalles característicos. Cuando se habla de microscopía virtual, se introducen nuevos procesos, como la construcción de placas virtuales, su almacenamiento y el diseño de herramientas flexibles que permiten visualizar interactivamente dichas placas virtuales en diferentes ampliaciones. Estos procesos se ilustran en la figura 1.
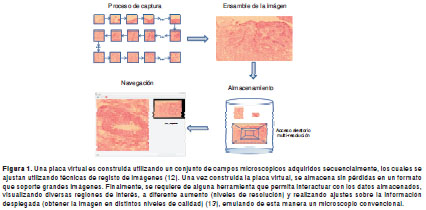
En las siguientes secciones se ilustran y analizan cada uno de estos procesos -adquisición, ensamble, almacenamiento y visualización-, se mencionan sus dificultades y se proponen soluciones para mejorar la práctica de la microscopía virtual.
Adquisición de la muestra
La información de una lámina o preparación se adquiere en imágenes con gran aumento (40X-100X), realizando múltiples tomas secuenciales adyacentes hasta barrer toda la preparación. Para realizar esta tarea, se hace uso de un microscopio robotizado, el cual es un sistema automático conectado de alguna manera al microscopio y cuyo objetivo es la adquisición de campos microscópicos mediante una cámara acoplada. La cámara con la cual se toman las imágenes es uno de los factores críticos en la calidad y velocidad del proceso de adquisición de la muestra; por lo tanto, es fundamental hacer un análisis de las necesidades de cada aplicación en particular. El microscopio robotizado controla los movimientos de la platina de un microscopio óptico convencional y automatiza la adquisición y almacenamiento de un patrón predeterminado de campos microscópicos, generalmente, con la ayuda de un computador (figura 2). Cuanto mayor aumento se utilice, más pequeño será el campo visible y será, entonces, necesario un mayor número de tomas.
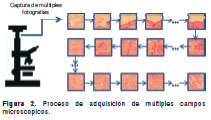
Con el fin de obtener placas virtuales adecuadas para la práctica médica, es necesario tener en cuenta varios aspectos en el proceso de adquisición: la velocidad de digitalización, el tamaño máximo de la muestra, la calidad de enfoque y el método de barrido.
La velocidad de digitalización o tiempo total de escaneada es uno de los factores más relevantes, pues hay que considerar aspectos como: el tamaño del área que se desea escanear, una grilla de 64 x 64 campos de vista microscópicos -752 x 560 pixeles- representa un área efectiva de 13,114 x 9,641 mm2; el objetivo empleado (20X, 40X, 100X); la resolución de la cámara digital, la cual está limitada por el sensor CCD (Charged-Coupled Devices) de la cámara, por ejemplo, el modelo DC300 de la Leica de 3,3 megapixeles; el modelo empleado de platina motorizada, el cual deber ser de excelente precisión, 1 a 3µm y alta velocidad, 42 mm/s; el número necesario de enfoques, las preparaciones de superficie irregular requieren establecer un gran número de puntos de enfoque, lo cual disminuye la velocidad de la escaneada; y la velocidad de adquisición de los datos, de cámara a computador.
Por otra parte, como el proceso de adquisición de imágenes microscópicas es complejo, es fundamental encontrar los parámetros adecuados para cada circunstancia, al menos de los factores que pueden controlarse. La resolución adecuada para la adquisición de imágenes debe tener en cuenta la máxima resolución de un microscopio, la cual es donde l representa la longitud de onda de la luz y A.N. es la apertura numérica del objetivo del microscopio o del condensador (14).
Por ejemplo, con un microscopio de epifluorescencia, en el cual el objetivo también actúa como condensador, la resolución máxima para una longitud de onda de 500 nm y objetivo de inmersión de 1,4 de apertura numérica, es de alrededor de 0,22µm. Cuando el ojo humano es el detector, el uso máximo de la amplificación (objetivo x aumento del ocular) debe estar en el intervalo entre 600 y 1.200 veces el objetivo de la apertura numérica. (14).
Esta limitación se basa en la consideración de dos variables biofísicas:
a) la agudeza visual de una persona normal está entre 0,5 y 1 arc-minuto;
b) el 50% de las células de la retina están localizadas en la fóvea, las cuales cubren sólo 10 grados del campo visual
Cuando se usa una cámara digital como detector, una regla básica de resolución consiste en que, al menos, dos pixeles representen, sin ambiguedad, una característica en la imagen, lo cual por supuesto debe seguir la regla de Nyquist-Shanon (15).
Para el diagnóstico, el entrenamiento y la valoración de la calidad de la imagen, es importante que los dispositivos digitales de visualización permitan observar la imagen, como si se estuviera haciendo en un microscopio convencional. Sin embargo, existen limitaciones en cuanto a la resolución de los dispositivos de visualización y la distancia del observador a la pantalla.
La visualización de una imagen en un monitor de computador depende de la agudeza visual humana; por ejemplo, la capacidad del ser humano para discriminar 1 arc-minuto corresponde a la habilidad para encontrar detalles con diámetros de 0,07 mm (70µm) a una distancia óptima de 25 cm(14). Debido a la forma como el ojo integra la información de líneas, la mayoría de las personas fácilmente pueden observar en un bloque de 25 cm, 20 pares de líneas por milímetro, lo que corresponde aproximadamente a 1.000 puntos por pulgada (dots per inch, DPI) y, en un monitor, a 500 pixeles por pulgada (pixels per inch, PPI). Actualmente, se encuentran pantallas de visualización con resoluciones de 1.000 PPI, los cuales reproducen satisfactoriamente las placas virtuales.
En el cuadro 1 se muestran algunas características de algunos sistemas de captura disponibles en el mercado, tales como Aperio®, LifeSpan®, Carl Zeiss®, Nikon Eclipse® y Olympus SIS®.
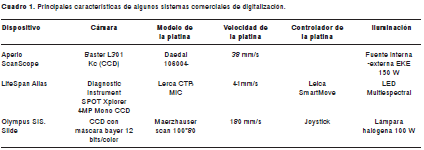
La resolución de las imágenes adquiridas con cámaras digitales está determinada por el número de células fotoeléctricas del dispositivo de cargas eléctricas acopladas (CCD). Las cámaras utilizadas en dispositivos comerciales de captura son de alta resolución, con tamaños de pixel desde 4,65 x 4,65µm2 hasta 14 x 14µm2. Las platinas deben ser de excelente precisión y alta velocidad, con velocidades desde 30 mm/s hasta 180 mm/s y precisión de 1 a 3 micrómetros. Algunos dispositivos (LifeSpan Alias®, Olympus SIS.Slide®) consiguen precisiones o distancias mínimas de 0,002 a 0,015µm para el eje Z y 0,25µm en los ejes X y Y. El microscopio Nikon Eclipse® adquiere las capturas en formato JPEG (Joint Photographic Experts Group) y las almacena en una carpeta, junto con un archivo “info” que permite reconstruir la preparación; este sistema es lento y la calidad de las imágenes es intermedia. El Aperio® captura tiras de imágenes tiff (Tagged Image File Format) con superposición, sistema rápido y de alta resolución.
Todas las características descritas permiten obtener placas virtuales de excelente calidad, adecuadas para diagnóstico. Estos sistemas comerciales tienen altos costos (entre ⬠35.000 y ⬠180.000) y son poco adaptables al flujo de trabajo de un laboratorio de patología, debido a que los fabricantes venden estos productos para una única aplicación inmodificable.
Con el objetivo de ilustrar el proceso de adquisición de placas virtuales, en la figura 3 se muestra el microscopio robotizado (Romero E, Vargas C. Low cost and efficient prototype of a motorized microscope. Electronics, Robotics and Automotive Mechanics Conference. Cuernavaca, 26 a 29 de septiembre de 2006. p. 83-4) desarrollado en el Grupo de Investigación Bioingenium (www.bioingenium.unal.edu.co. Expediente de la patente 8 35991 Secu even.0), con el cual se ha construido una base de datos de placas virtuales, utilizada en trabajos de investigación del grupo (16-18).

Este sistema en particular, a diferencia de muchos sistemas disponibles en el mercado, es adaptable a muchos microscopios pues es completamente externo. El sistema está compuesto por dos etapas: adquisición y almacenamiento. La fase de adquisición consiste de un sistema mecánico, adaptado a la platina de un microscopio convencional, y de una cámara digital JVC KY-F58® (Victor Company of Japan, Japan Ltd.) acoplada al sistema óptico triocular del microscopio, disponible en el comercio.
El diseño mecánico está compuesto por una base y dos “actuadores” (sic.) lineales controlados por un circuito electrónico que se comunica con el computador por el puerto USB. Los “actuadores” (sic.) son dos motores de paso con un transductor mecánico y un electroimán. Este último mueve el mecanismo del “actuador” (sic.) por medio de una pieza en hierro integrada con la platina del microscopio. La etapa de adquisición y la de almacenamiento se realizan mediante un software que permite visualizar y almacenar desde el computador las imágenes provenientes de una cámara montada sobre el triocular del microscopio. La base permite montar el microscopio dentro del sistema y sirve de soporte para los “actuadores” (sic.) lineales.
La precisión de este sistema es de 1µm en los ejes X y Y, y su error de precisión es menor de 5%, valor calculado tras escalar la imagen capturada y estimar el número de pixeles entre marcas antes del movimiento de la platina y después de él.
Este diseño en particular automatiza la adquisición de la muestra desde cualquier microscopio, en contraste con las soluciones comerciales que tienen incorporado todo el equipamiento físico en un solo dispositivo de adquisición, en el cual no se pueden modificar sus parámetros según las necesidades del usuario.
En el proceso de adquisición de la muestra, es frecuente que se presenten varias fuentes de error, tales como condiciones de iluminación variables entre diferentes campos de vista, deformaciones geométricas por distorsión radial de la cámara, errores de alineamiento en los bordes de la imagen adquirida o fluctuaciones por movimientos del motor (12). Estos artefactos visuales siempre se pueden mejorar aplicando técnicas de restauración de imágenes. Por ejemplo, para compensar los problemas de iluminación, se puede obtener el promedio de zonas comunes alrededor de una imagen específica.
Proceso de ensamblaje de las placas virtuales
El proceso de ensamblaje en la construcción de imágenes de histopatología puede ser visto como un rompecabezas, en el cual pequeñas piezas se deben ensamblar de manera precisa, con mínimo error. Para este proceso se deben tomar imágenes adyacentes con una ligera superposición entre sus bordes (entre 5% y 10% del campo microscópico capturado), hasta hacer el barrido en toda la preparación.
Al finalizar el proceso de captura, se continúa con el montaje, con el cual cada fotografía adquirida se fusiona con sus vecinos espaciales por medio de técnicas de registro de imágenes. El registro de imágenes es el proceso de superponer información común de dos o más imágenes sobre una sola imagen (19). En el caso específico de la microscopía virtual, permite encontrar la superposición entre imágenes adyacentes para fusionarlas en una sola, generando una gran imagen correspondiente a toda la preparación (4).
Se hace un algoritmo de registro entre dos imágenes, la plantilla y la referencia, por medio de tres procesos complementarios: una transformación geométrica de la imagen de referencia con la intención de superponerla con la imagen plantilla, una medida de similitud que mida objetivamente el nivel de emparejamiento logrado en la transformación y un algoritmo de optimización que permita ajustar de manera precisa las dos imágenes.
Entre las múltiples técnicas de optimización utilizadas en aplicaciones de microscopía virtual, se encuentra el método “avaro” que hace una búsqueda local de la mejor solución. Las medidas de similitud más usadas en registro son la correlación cruzada normalizada, la correlación por fase o la información mutua.
En el cuadro 2 se presenta una medida de precisión de las diferentes medidas de similitud utilizadas en sistemas de microscopía virtual.

La precisión fue medida como la diferencia entre la superposición del microscopio en el proceso de captura y la obtenida con los tres diferentes métodos. La experimentación se llevó a cabo con un conjunto de 270 imágenes.
El método de optimización “avaro” se ha utilizado con la correlación cruzada normalizada como medida de similitud, la cual es especialmente sólida ante la diferencia de intensidad entre imágenes.
Este método estima el mejor registro para cada imagen, ajustándola a las imágenes que ya se han ubicado previamente (figura 4). Este procedimiento sigue un orden de paso por escáner de izquierda a derecha y de arriba abajo (20). Otro método de optimización (21) estima simultáneamente la localización de una fila de imágenes, usando un algoritmo de programación dinámica que tiene en cuenta la contribución de la fila inmediatamente anterior. Existen otras medidas de similitud, como el corrimiento en el espectro de fase de Fourier (22), o medidas estadísticas, como la información mutua (23).
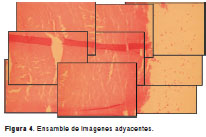
La correlación cruzada ha sido la más usada porque mide el grado funcional de dependencia estadística entre dos imágenes, lo cual permite que esta medida sea indiferente a las variaciones de intensidad producidas entre adquisiciones adyacentes, por los movimientos de la platina o por irregularidades en los cortes histológicos.
Almacenamiento
Cuando se ha construido la placa virtual, se debe escoger una estrategia de almacenamiento que tenga en cuenta el flujo de trabajo de un laboratorio virtual de microscopía: imágenes de gran volumen, de alrededor de 4 a 10 gigabytes, las cuales se deben guardar de forma íntegra y sin ninguna alteración de la información almacenada. Para esto, el formato de almacenamiento se debe ajustar a las siguientes características.
•Buenas tasas de compresión. El almacenamiento en bruto de las imágenes digitalizadas puede traer problemas por el gran tamaño que ocupan en disco. La situación empeora si se tiene en cuenta que en un laboratorio de patología se genera una gran cantidad de muestras semanalmente, con lo cual se requiere de cientos de gigabytes disponibles en ese periodo. Un hospital especializado produce entre 100.000 y 500.000 placas histológicas cada año; el almacenamiento digital de 10% de las imágenes supondría unos 50 petabytes al año, todo un reto para poder almacenar y consultar de forma efectiva esta cantidad de información (18).
Otro elemento que beneficia la utilización de formatos con buenas tasas de compresión es la posibilidad de enviar porciones de la imagen o la imagen comprimida a través de una red, debido a que el envío de los datos en bruto es irrealizable usando el ancho de banda de los canales de comunicación actuales.
• Compresión sin pérdidas. Este requisito resulta fundamental debido a que las imágenes son la base del diagnóstico y las pérdidas en su calidad pueden generar diagnósticos incorrectos (23,24).
•Acceso eficiente a los datos de la imagen. La resolución de la imagen reconstruida supera ampliamente la resolución de los actuales dispositivos de despliegue (2). Por esta razón, es necesario hacer despliegues progresivos de la información contenida en la imagen.
El término despliegue progresivo se refiere a la capacidad de un formato de compresión de descomprimir la imagen de manera progresiva según la necesidad del usuario, es decir que sea posible recuperar cualquier porción de la imagen en cualquier instante, utilizando solamente los datos necesarios para reconstruir la información requerida.
Para el caso de la microscopía virtual, son interesantes tres tipos de progresividad:
§Â una versión de bajo aumento de la imagen que se puede ir incrementando, utilizando los datos de las ampliaciones anteriores.
§ Progresividad espacial: extracción de porciones específicas y aleatorias de la imagen (ventanas de interés), sin necesidad de procesar todos los datos.
§ Progresividad por nivel de aumento (magnification): despliega versiones de la imagen a bajo aumento, utilizando una pequeña cantidad de bytes. Se logran mejores niveles de aumento utilizando una mayor cantidad de bytes, que se puede ir incrementando, utilizando los datos de los aumentos anteriores. Esto permite una transferencia más rápida de la información a través de la red de internet y un nivel más alto de interacción.
En la figura 5 se observan los tipos de progresividad descritos.

Se han empleado diferentes estrategias para almacenar datos en microscopía virtual, que ofrecen diversas opciones en esta clase de sistemas. Entre los métodos de almacenamiento de placas virtuales utilizados por aplicaciones comerciales, encontramos diferentes formatos de compresión: TIFF, JPEG2000 (J2K) y, el más utilizado, JPEG. A menudo se almacenan múltiples archivos, en una o varias carpetas, y se asigna una carpeta para cada aumento (SlidePath®, Bacus Bliss®). También, es posible encontrar archivos de mapas de bits sin comprimir (LifeSpan Alias®). El método empleado por Zeiss Mirax Scan® y por el visor Zoomifye® almacena varios archivos con una o múltiples resoluciones (a menudo JPEG) (Gálvez J, Munn RJ, Garbutt AW, Cardiff RD. The development of the MMHCC image archives. Seventh Annual Conference for Advancing Pathology Informatics, Imaging and the Internet. Pittsburgh, 2002).
En general, el mayor inconveniente con estas soluciones es el uso subóptimo de los recursos. Estas soluciones almacenan información redundante, lo cual hace que se necesiten dispositivos de mayor capacidad de almacenamiento y que el manejo del volumen de información requerido en microscopia virtual sea mucho más difícil.
También, es posible tener un único archivo comprimido (JPEG) o, mejor aún, un archivo único con resolución múltiple. La estructura de estos archivos es a menudo piramidal (25) y pueden ser TIFF (Aperio ScanScope®), J2K, Flashpix (MicroBrightField Virtual Slice®) u otra (VSI en Olympus SIS.slide®). Los formatos de almacenamiento con resolución múltiple permiten obtener la imagen en diferentes aumentos, sin redundancia en la información.
En los últimos años, nuevos formatos, como J2K, introducen variables que resultan útiles en el marco de aplicaciones como la microscopía virtual. Entre las ventajas adicionales del formato de compresión J2K, tenemos acceso a regiones particulares de la imagen sin necesidad de descomprimir toda la información de la imagen, es decir, acceso progresivo a la información en diferentes regiones, con el aumento requerido y con la calidad deseada; además, permite el almacenamiento de la imagen sin pérdidas y con buenas tasas de compresión (26).
El estándar J2K fue desarrollado por el Joint Photographic Expert Group (JPEG) como respuesta a las necesidades generadas por el aumento en el uso del internet y la necesidad de transferir un gran volumen de imágenes, ofreciendo con el uso de este estándar un número de funcionalidades que no están disponibles en otros formatos, como eficiencia, flexibilidad y representación interactiva de los datos. El J2K ofrece la posibilidad de acceder de manera rápida y flexible a la información de la imagen, debido a las diferentes representaciones que permite el codificador y a la posibilidad de escalamiento de los datos comprimidos (27). El estándar J2K se ha convertido en un formato de compresión ampliamente utilizado en aplicaciones médicas (1,16,27-29).
Visualización y navegación
El fin último de la microscopía virtual es la visualización interactiva de las placas virtuales para consulta, interpretación y diagnóstico. Es necesario que estos sistemas garanticen el envío de la información de manera eficiente a través de canales de comunicación existentes y que respondan a los requisitos de los estándares de telemedicina. Los sistemas de microscopía virtual se basan principalmente en una arquitectura cliente/servidor, con la cual un servidor conectado a la red (internet o red local) almacena la información de las placas virtuales. El usuario remoto accede a la información requerida mediante el uso de una interfaz gráfica de usuario.
El éxito de un microscopio virtual depende de la habilidad del sistema para satisfacer las expectativas del usuario, de manera que estos sistemas deben estar diseñados y adaptados a las diferentes necesidades de los expertos. Esto se hace más fácil si se tiene una interfaz gráfica de usuario que le facilite al experto la visualización y exploración de la información contenida en la placa virtual y le permita ejecutar una rutina clínica.
El diseño de la interfaz gráfica de usuario debe tener en cuenta la importancia de los bajos aumentos, para exploración, y los mayores aumentos, para observar con mayor detalle las regiones de interés encontradas en la exploración a bajo aumento. La gran mayoría de estas interfaces en sistemas de microscopía virtual, le permiten al usuario tener en cada instante de la navegación una imagen con bajo aumento, a modo de mapa orientador de la preparación, y una región de interés en un alto nivel de amplificación.
Estrategias para mejorar los tiempos de navegación en sistemas de microscopía virtual
Uno de los principales problemas de los sistemas de microscopía virtual es la carga y descarga continua de una gran cantidad de información. Como consecuencia, al desplazarse por una preparación virtual, es frecuente apreciar cómo las porciones de cada región de la preparación van cargándose lentamente, efecto que dificulta la integración de estos sistemas con el flujo de trabajo de un laboratorio de patología. Una manera de solucionar este problema y mejorar los tiempos de navegación, es diseñar estrategias caché, prefetching o ambas, e implementarlas en el sistema de microscopía virtual.
El caché corresponde a un espacio de memoria intermedia, que almacena porciones de la imagen que ya han sido recorridas y a las cuales es muy probable que el usuario retorne. El problema caché en microscopía virtual necesita, por supuesto, de granularidad y flexibilidad en la representación de los datos (16,30). La política de reemplazo debe, además, especificar los datos que deben reemplazarse cuando se accede a una nueva porción de la imagen. La más usada en microscopía virtual es la “última” (sic.) recientemente usada (Least Recently Used, LRU) (16,30), con la cual la preferencia del usuario es modelada como una función que decrece con la edad del elemento. Esta estrategia sigue la hipótesis de que el patólogo visitará con mayor probabilidad las zonas de la imagen que acaba de visitar, un patrón de navegación que rara vez se observa.
Otra estrategia es la “última” (sic.) frecuentemente usada (LFU) (Ortiz JP, Ruiz VG, García I. Improved JPIP protocol with proxy caching. Computación de Altas Prestaciones: actas de las XV Jornadas de Paralelismo, Almería, 15, 16 y 17 de septiembre de 2004/Grupo de Investigación Supercomputación-Algoritmos. 2004. p. 328-33) (30-32), bajo la cual la hipótesis principal consiste en que la probabilidad de que una región sea visitada nuevamente aumenta a medida que el usuario visita la misma región varias veces.
Por otra parte, las estrategias de prefetching permiten cargar anticipadadamente la información que va a ser solicitada por el usuario, es decir, esta clase de estrategias busca predecir los intereses del usuario y las regiones de la imagen que serán visitadas en un futuro próximo. Esta clase de modelos han sido utilizados en navegación de ambientes virtuales (33) y en navegación de grandes imágenes (34). No obstante, su éxito depende de la capacidad del sistema para predecir el patrón de navegación del usuario. En microscopía virtual se debe tener conocimiento de la manera como el patólogo explora una placa de histopatología, un tema que será abordado en profundidad en la siguiente sección.
Patrón de navegación de los patólogos
A primera vista, la navegación de un patólogo puede ser algo complicada, debido a la serie de movimientos, a los cambios de aumentos y a las diferentes velocidades, que dependen de la información que se está observando. Sin embargo, estos patrones no son movimientos aleatorios, como se ha demostrado en múltiples estudios (35-38), sino que son movimientos guiados por largos periodos de entrenamiento (35).
Los patólogos realizan la exploración de una placa utilizando dos operaciones complementarias: paso de la imagen por el escáner, con el fin de encontrar información que pueda ser relevante, y aumento o disminución del aumento (zoom-in/out), para refinar la calidad de la información (36-39). Estos dos patrones de navegación siguen los cuatro pasos clásicos en el manejo de información: mirar, observar, reconocer y entender (36).
En conclusión, cada patólogo sigue una metodología estándar. Primero, el examen de la muestra se lleva a cabo a baja aumento, con el fin de localizar la información relevante, mediante la organización espacial de la muestra de histopatología. Una vez existe un interés sobre alguna región particular, se realiza un examen más minucioso (9,35,37). En un reciente estudio (32), se demostró que los patólogos usan sólo uno o dos aumentos y se mueven a través de la placa sistemáticamente en varias direcciones, lo cual genera linealidad en peticiones consecutivas de la imagen (37). Otros trabajos han demostrado, no sólo que los movimientos son lineales, sino que los patrones de velocidad son isotónicos (17). Varios trabajos recientes (17,18) indican que las estrategias de caché y prefetching implementados en los sistemas de microscopía virtual e inspirados en el patrón de navegación de los patólogos, mejoran los tiempos de exploración de las placas, al menos, en 30%, eliminando retrasos indeseados en la práctica de la microscopía virtual.
Algunas implementaciones de sistemas de microscopía virtual
Fontelo propone un sistema de microscopía virtual con almacenamiento en formato JPEG con pérdidas (Fontelo P, DiNino E, Johanssen K, Khan A, Ackerman M. Virtual Microscopy: Potential Applications in Medical Education and Telemedicine in Countries with Developing Economies. Proceedings of the 38th Annual Hawaii International Conference on System Sciences (HICSS38) 2005, p. 153c). Aunque logra buenas tasas de compresión, no cuantifica los errores por utilizar este tipo de almacenamiento; además, esta clase de archivo no permite progresividad, es decir, hay que descomprimir la imagen completa; estos factores hacen ineficiente la navegación en escenarios reales.
Zhang (40,41) propone un sistema para microscopía virtual que utiliza Wavelets de Haar como transformación que genera múltiples escalas. Para la codificación, utiliza un codificador de Huffman basado en bloques. Cuando se solicita una imagen, el servidor busca la información requerida para reconstruir la porción de la imagen específica, en el nivel de resolución deseado por el usuario. La imagen construida es convertida en JPEG y transmitida por la web.
En la actualidad, se reportan más de 31 aplicaciones comerciales en microscopía virtual (25). Entre éstas se encuentra el Virtual Microscope (42) desarrollado por la National Aeronautics and Space Administration (NASA) de los Estados Unidos y Saint Leo University, que permite visualizar una base de datos de 90 muestras disponibles; es una aplicación desarrollada en java y cuyo código se encuentra disponible. Actualmente, sólo soporta datos adquiridos desde el Philips Environmental Scanning Electron Microscope (ESEM) y el Fluorescence Light Microscope, los cuales tienen costos muy elevados, pero el sistema pude ser adaptado a dispositivos de captura de alta resolución. Este sistema permite ajuste de los parámetro de la imagen (contraste y brillo), cambio de foco, análisis de la composición de los elementos, medidas y representación (to render) de los datos en tres dimensiones. La interfaz de usuario permite hacer anotaciones o cargar anotaciones creadas previamente.
Neuroinfo® (43) es un software desarrollado por MicroBrightField, que soporta grandes imágenes almacenadas en un formato piramidal. Cada nivel de resolución de la imagen se divide en pequeñas regiones rectangulares (baldosas), las cuales se transmiten según las necesidades del usuario. Esta aplicación permite la anotación de las imágenes y cambiar o agregar descripciones a las placas virtuales.
También, está disponible el MicroScape Virtual Laboratory (44), que está incluido dentro del proyecto LabSpace, el cual busca promover y mejorar la colaboración entre investigadores y científicos. El PathXLO (45) es una aplicación desarrollada por la Universidad de Iowa (46) que permite hacer anotaciones, e incluir etiquetas con flechas, círculos y textos en las imágenes. Todas estas aplicaciones muestran la importancia y potencia de los sistemas de microscopía virtual.
En Colombia, la aplicación stand alone para microscopía virtual utiliza imágenes comprimidas en J2K (16). Esta aplicación permite un acceso progresivo espacial, por aumento y por calidad, a la información de la imagen. Además, usa estrategias de caché y prefetching para acelerar la navegación. Algunas soluciones comerciales (47) permiten el almacenamiento en J2K, pero no aprovechan las características de progresividad que provee el estándar. Moshfeghi (48) y Taubman (Taubman D. Remote browsing of JPEG2000 images. Proceedings. 2002 International Conference on Image Processing. 2002. 2002;1:229-32) diseñaron dos sistemas experimentales para navegar grandes imágenes que permiten el almacenamiento en formato J2K. Sin embargo, estos sistemas carecen de un diseño específico para la navegación de imágenes microscópicas.
También, está disponible el sistema Imagescope® (49), una aplicación que incluye educación en patología, telepatología, análisis de imágenes y Picture Archiving and Communication System (PACS) en patología. Existe también el John Hopkins VMV (13), el cual mejora la navegación usando estrategias de caché y prefetching. Estos sistemas no son de código abierto y, por lo tanto, es imposible realizar adecuaciones o modificaciones, una limitación de fondo en muchos procesos de educación o investigación.
También se encuentran aplicaciones comerciales y costosas, tales como Zeiss®, BacusLabs® y Aperio®, que permiten la visualización en tres dimensiones de las placas.
Perspectivas de los sistemas de microscopía virtual
Un patólogo interactúa con un microscopio virtual con la intención de buscar información pertinente en alguna tarea diagnóstica. Los patrones de navegación, generalmente, no son continuos, sino que el especialista usa la ventana en bajo aumento para determinar la ubicación de las posibles fuentes de información. Bajo el principio del mínimo esfuerzo, este especialista realiza una caminata por la placa virtual completa, compuesta de múltiples saltos espaciales y cambios de aumento. La trayectoria definida por estas acciones se conoce como “camino de observación”.
En las condiciones actuales, un experto se conecta a un servidor localizado en algún punto de una red de internet. La satisfacción por la calidad de la navegación, depende del ancho de banda del canal de comunicaciones, generalmente insuficiente para el gran volumen de datos que se deben transferir. Por otra parte, varios usuarios se pueden conectar al mismo servidor y solicitar la misma imagen, con lo cual el uso de los recursos disponibles es aún más limitado. Se han introducido diferentes estrategias de aceleración en la literatura (17,18,28,32), con el objetivo de optimizar el uso de estos recursos. Las estrategias de caché y prefetching han demostrado una mejora importante en los tiempos de navegación (17,18). Es importante anotar que, cuando estas estrategias están asociadas a patrones de navegación reales, los resultados son notoriamente mejores (16). Los microscopios virtuales deben, entonces, permitir la integración con estrategias de aceleración que establezcan caminos de observación asociados a cada imagen y, también, deben asociar modelos orientados a la tarea de exploración diagnóstica (17,32).
Las navegaciones deberían realizarse usando un número mínimo de ventanas de interés, una tarea que puede ser el resultado de la determinación automática de regiones de interés (50), usando mapas de probabilidad asociados a la imagen y que, además, se basen en estrategias óptimas de muestreo (51). En estas circunstancias, un patólogo debería lograr un diagnóstico usando sistemas de microscopía virtual en un tiempo mínimo, de manera que el volumen de trabajo del patólogo pueda ser acelerado, tras anticipar y precargar el camino de observación al inicio de la navegación, de tal manera que se necesite muy poca información adicional para hacer el diagnóstico.
Sin embargo, los caminos de observación dependen del contenido de la imagen, de la experiencia del patólogo y de la calidad de la imagen, y, por consiguiente, son muy variables. Estos mapas de probabilidad deberían adaptarse al tipo de navegación particular, dependiendo de las necesidades del experto. Entonces, este modelo debería ser muy flexible, para adaptarse y anticiparse al experto, en las fases de exploración: paso de la imagen por el escáner y cambios de aumento (35). Por otra parte, la calidad del examen de la imagen está directamente asociada con la calidad de la muestra histológica y las condiciones de adquisición: los diferentes niveles de estandarización a nivel de la fijación de tejidos, de los cortes, la preparación y técnica de tinción, el ajuste del microscopio y los procedimientos de adquisición. El desarrollo de nuevas aplicaciones para la navegación virtual depende de la calidad de la imagen, un concepto tradicional que puede ser retroalimentado por el conocimiento sobre cómo los expertos interactúan con las imágenes. Este conocimiento debería ser usado, por ejemplo, en aplicaciones de compresión y uso de estrategias de compresión selectiva (Anastassopoulos G, Skodras A. JPEG2000 ROI coding in medical imaging applications. En: Proceedings of the 2nd IASTED International Conference on Visualisation, Imaging and Image Processing (VIIP ‘02), pp. 783-788, Palma de Mallorca, Spain, August 2002). También, estas observaciones, o caminos de exploración, pueden conducir a nuevas estrategias de almacenamiento en sistemas de computación distribuidos (52), como por ejemplo, el uso de algoritmos distribuidos en modelos de exploración más realistas.
Finalmente, el diagnóstico en la histopatología moderna es un proceso multimedia, en el cual los hallazgos en la imagen son dictados y almacenados. En consecuencia, se debe tener en cuenta la información visual y el conocimiento semántico asociado a las imágenes (32). Las anotaciones textuales deben integrarse a estos sistemas, con el fin de constituir un puente entre el bajo nivel de información de la imagen y los conceptos semánticos (53). Hoy en día, las ontologías pueden ser fácilmente construidas desde documentos de texto, y en microscopía virtual pueden guiar la definición de regiones de interés, caminos de observación y velocidades, con el fin de determinar automáticamente caminos de observación que permitan mantener la misma calidad en el diagnóstico en un tiempo mínimo.
Conclusión
La microscopía virtual ha comenzado a utilizarse ampliamente en educación y formación médica, segundas opiniones, procesamiento y análisis de imágenes, actividades diagnósticas e investigación biomédica, y se han convertido en una herramienta potencial en telepatología.
En este artículo se presentó un estudio detallado de los procesos requeridos en esta clase de sistemas, incluyendo posibles soluciones para las dificultades técnicas y herramientas de base para su construcción. Este trabajo también provee una descripción actualizada de las aplicaciones de microscopía virtual.
Conflicto de intereses
Ninguno.
Financiación
Los autores de este manunscrito cerifican no haber recibido apoyo financiero de ninguna compañía u otra fuente comercial, para el desarrollo de este artículo de revisión.
Eduardo Romero, Centro de Telemedicina, Universidad Nacional de Colombia, Bogotá, D.C., Colombia. Teléfono: (571) 316 5000; extensiones 15025 y 15183; fax: (571) 316 5491 edromero@unal.edu.co
Referencias
1. Tuominen VJ, Isola J. The application of JPEG2000 in virtual microscopy. J Digit Imaging. 2009;22:250-8. [ Links ]
2. Romero E, Gómez F, Iregui M. Virtual microscopy in medical images: A survey. En: Méndez-Vilas A, Diaz J, editores. Microscopy Book Series. Modern research and educational topics in microscopy. Badajoz: Formatex; 2007. p. 996-11. [ Links ]
3. Kim MH, Park Y, Seo D, Lim YJ, Kim D, Kim CW, et al. Virtual microscopy as a practical alternative to conventional microscopy in pathology education. Basic Appl Pathol. 2008;1:46-8. [ Links ]
4. García M, Bueno G, Peces C, González J, Carbajo M. Digital slides in pathology departments (II). An analysis of existing solutions. Revista Española de Patología. 2005;38:207-20. [ Links ]
5. Gagnon M, Inhorn S, Hancock J. Comparison of cytology proficiency testing: Glass slides Vs. virtual slides. Acta Cytol. 2004;48:788-94. [ Links ]
6. Dee F, Donnelly A, Radio S, Leaven T, Kreiter C, Zaleski MS. Utility of 2 and 3 virtual microscopy in cervical cytology education and testing. Acta Cytol. 2007;51:523-9. [ Links ]
7. Kumar RK, Velan GM, Korell SO, Kandara M, Dee FR, Wakefield D. Virtual microscopy for learning and assessment in pathology. J Pathol. 2004;204:613-5. [ Links ]
8. Dee F, Lehman J, Consoer D, Leaven T, Cohen M. Implementation of virtual microscope slides in the annual pathobiology of cancer workshop laboratory. Hum Pathol. 2003;34:430-6. [ Links ]
9. Crowley RS, Naus GJ, Stewart III J, Friedman CP. Development of visual diagnostic expertise in pathology an information processing study. J Am Med Inform Assoc. 2003;10:39-51. [ Links ]
10. Stewart J, Bevans K, Bhattacharya A, Ye C, Miyazaki K, Kurtycz D. Virtual microscopy: An educator´s tool for the enhancement of cytotechnology studentâs locator skills. Diagn Cytopathol. 2008; 36: 363-8. [ Links ]
11. Helina H, Lundin M, Lundin J. Web-based virtual microscopy in teaching and standardizing gleason grading. Hum Pathol. 2005;36:381-6. [ Links ]
12. Appleton B, Bradley A, Wildermoth M. Towards optimal image stitching for virtual microscopy. Digital Image Computing: Techniques and Applications. 2005;1:44. [ Links ]
13. Catalyurek U, Beynon MD, Chang C, Kurc T, Sussman A, Saltz J. The virtual microscope. IEEE Trans Inf Technol Biomed. 2003;7:230-48. [ Links ]
14. Nikon. Microscopy u. the source for microscopy education. Fecha de consulta: 18 de enero de 2010. Disponible en:http://www.microscopyu.com/articles/formulas/formulasmagrange.html. [ Links ]
15. Nyquist H. Certain topics in telegraph transmission theory. American Institute of Electrical Engineers. 1928;47:617-28. [ Links ]
16. Iregui M, Gómez F, Romero E. Strategies for efficient virtual microscopy in pathological sample using JPEG2000. Micron. 2007;38:700-13. [ Links ]
17. Gómez F, Romero E. A model for predicting pathologist´s velocity profiles when navigating virtual slides. Microsc Res Tech. 2009; 73: 85-98. [ Links ]
18. Gómez F, Iregui M, Romero E. Prediction of pathologist navigation patterns in virtual microscopy based on a soft-computing approach. Int J Hum Comput Interact. 2008;611:150-6. [ Links ]
19. Zitova B, Flusser J. Image registration methods: A survey. Image Vis Comput. 2003;21:977-1000. [ Links ]
20. Wildermoth M, Bradley A, Mills P. Virtual microscopy with extended depth of field. Digital Image Computing: Techniques and Applications. 2005;1:35. [ Links ]
21. Rosenfeld A, Kak AC. Digital picture processing. Orlando: Academic Press; 1982. p. 106-6. [ Links ]
22. Bracewell R. The Fourier transform and its applications. Boston: McGraw-Hill; 1986. p. 300-1. [ Links ]
23. Viola P, Wells W. Alignment by maximization of mutual information. Int J Comput Vis. 1997;24:137-54. [ Links ]
24. Clunie D. Lossless compression of grayscale medical images ectiveness of traditional and state of the art approaches. International Society Advancing Light-Based Research. 2000;3980:74. [ Links ]
25. Clunie D, Rojo MG, García GB, Mateos CP, García JG, Vicente MC. Critical comparison of 31 commercially available digital slide systems in pathology. Int J Surg Pathol. 2006;14:285-305. [ Links ]
26. International Organization for Standardization. ISO/IEC 15444-1. JPEG2000 Image Coding System. Switzerland: ISO; 2004. p. 1-194. [ Links ]
27. Taubman D, Marcellin MW. JPEG2000 image compression, fundamentals, standards and practice. Norwell: Kluwer Academic Publishers; 2001. p. 1-773. [ Links ]
28. Krishnan K, Marcellin MW, Bilgin A, Nadar MS. Efficient transmission of compressed data for remote volume visualization. IEEE Trans Med Imaging. 2006;25:1189-99. [ Links ]
29. Sung MM, Kim HJ, Kim EK, Kwak JY, Yoo JK, Yoo HS. Clinical evaluation of JPEG2000 compression for digital mammography. IEEE Trans Nucl Sci. 2002;49:827-32. [ Links ]
30. Szot A, Jacobson FL, Munn S. Diagnostic accuracy of chest x-rays acquired using a digital camera for low-cost teleradiology. Int J Med Inform. 2004;73:65-9. [ Links ]
31. Andrade H, Kurc T, Sussman A, Saltz J. Multiple query optimization support for the virtual microscope. Arch Pathol Lab Med. 2002;126:781-802. [ Links ]
32. Wienert S, Beil M, Saeger K, Hufnagl P, Schrader T. Integration and acceleration of virtual microscopy as the key to successful implementation into the routine diagnostic process. Diagn Pathol. 2009;4:3. [ Links ]
33. Chan A, Lau R, Ng B. Motion prediction for caching and prefetching in mouse-driven DVE navigation. ACM Transactions on Internet Technology. 2005;5:70-91. [ Links ]
34. Descampe J, Vleeschouwer C, Iregui M, Macq B, Marqués F. Prefetching and caching strategies for remote and interactive browsing of JPEG2000 images. IEEE Trans Image Process. 2007;16:1339-54. [ Links ]
35. Krupinski E, Tillack A, Richter L, Henderson J, Bhattacharyya A, Scott K, et al. Eye-movement study and human performance using telepathology virtual slides. Implications for medical education and differences with experience. Hum Pathol. 2006;37:1543-56. [ Links ]
36. Bussolati G. Dissecting the pathologists brain: Mental processes that lead to pathological diagnoses. Virchows Arch. 2006;448:739-43. [ Links ]
37. Tsuchihashi Y, Mazaki T, Nakasato K, Morishima M, Nagata H, Naito K, et al. The basic diagnostic approaches used in robotic still-image telepathology. J Telemed Telecare. 1999;5:115-7. [ Links ]
38. Tiersma E, Peters A, Mooij A, Fleuren G. Visualising scanning patterns of pathologists in the grading of cervical intraepithelial neoplasia. J Clin Pathol. 2003;56:677-80. [ Links ]
39. Paniagua N. Aplicacion para visualizacion de imagenes 2d y 3d empleando vtk. IEEE Signal Processing Magazine. 2004;21:7-19. [ Links ]
40. Wang J, Nguyen J, Lo K, Law C, Regula D. Multiresolution browsing of pathology images using wavelets. Proc AMIA Symp. 1999:430-4. [ Links ]
41. Zhang Y, Wang JZ. Progressive display of very high resolution images using wavelets. Proc AMIA Symp. 2002:944-8. [ Links ]
42. NASAâs Kennedy Space Center and Learning Technologies. The virtual microscope. Fecha de consulta: 15 de enero de 2010. Disponible en: http://virtual.itg.uiuc.edu [ Links ]
43. MicroBrightField, Inc. Neuroinformática. Web enabled virtual microscopy. Fecha de consulta: 17 de enero de 2010. Disponible en: http://neuroinformatica.com [ Links ]
44. Zaluzec NJ, ANL EMCenter. The MicroScape Virtual Lab. Fecha de consulta: 18 de enero de 2010. Disponible en: http://www.microscopy.com/MicroScape/MicroScape.html [ Links ]
45. iPath Diagnostics Ltd. PathXL virtual microscopy. Fecha de consulta: 18 de enero de 2010. Disponible en: http://www.ipath.co.uk/index.php?option=com_content&view=section&id=1&Itemid=68 [ Links ]
46. Dee FR, Leaven T, University of Iowa. The virtual Slidebox. Fecha de consulta: 15 de enero de 2010. Disponible en: http://www.path.uiowa.edu/virtualslidebox [ Links ]
47. VMscope GmbH. Vmscope. Fecha de consulta: 17 de enero de 2010. Disponible en: http://vmscope.com/produkte.html [ Links ]
48. Moshfeghi M, Ta J. Efficient image browsing with JPEG2000 internet protocol. Proceedings of SPIE Medical Imaging 2004, Picture Archiving and Communication Systems (PACS) and Imaging Informatics. 2004;5371:259-67. [ Links ]
49. Eichhorn BA. Ole. System and method for viewing virtual slides, United States patent: 20040167806, 2004. [ Links ]
50. Oger M, Belhomme P, Klossa J, Michels JJ, Elmoataz A. Automated región of interest retrieval and classification using spectral analysis. Diagn Pathol. 2008;3(Suppl.1):S17. [ Links ]
51. Kayser K, Schultz H, Goldmann T, Gortler J, Kayser G, Vollmer E. Theory of sampling and its application in tissue based diagnosis. Diagn Pathol. 2010;4:6. [ Links ]
52. Gilbertson J, Yagi Y. Histology, imaging and new diagnostic work-flows in pathology. Diagn Pathol. 2008;3(Suppl.1):S14. [ Links ]
53. Schrader, T, Niepage S, Leuthold T, Saeger K, Schluns K, Hufnagl P, et al. The diagnostic path, a useful visualization tool in virtual microscopy. Diagn Pathol. 2006;1:40. [ Links ]














