Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.31 no.4 Bogotá Oct./Dec. 2011
ARTÍCULO ORIGINAL
1Biología y Control de Enfermedades Infecciosas, Instituto de Biología, Universidad de Antioquia, Medellín,Colombia
2Programa de Estudio y Control de Enfermedades Tropicales, Facultad de Medicina, Universidad de Antioquia,Medellín, Colombia
3Química Orgánica de Productos Naturales, Universidad de Antioquia, Medellín, Colombia
4Grupo de Investigación de Sustancias Bioactivas, Universidad de Antioquia, Medellín, Colombia
Contribución de los autores:
Lorena Valencia: realizó los ensayos antiparasitarios y la escritura del artículo.
Diana Lorena Muñoz: realizó los ensayos de citotoxicidad.
Sara María Robledo e Iván Darío Vélez: diseño de los experimentos y escritura del artículo.
Fernando Echeverri y Gabriel Jaime Arango: preparación de extractos, diseño de los experimentos y escritura del artículo.
Omar Triana: diseño de los experimentos, análisis de resultados y escritura del artículo.
Recibido: 06/05/11; aceptado:11/08/11
Introducción. El tratamiento de la enfermedad de Chagas está basado en sólo dos medicamentos de eficacia limitada y con importantes efectos colaterales. La gran biodiversidad de la flora colombiana hace de la bioprospección una alternativa potencial en la búsqueda de nuevos antiparasitarios.
Objetivo. Evaluar in vitro el potencial tripanocida y la citotoxicidad de extractos obtenidos de 23 plantas colombianas.
Materiales y métodos. Se obtuvieron extractos de hojas, de tallos o de la planta entera, en solventes de diferente polaridad. La actividad contra epimastigotes y la citotoxicidad se evaluaron por el micrométodo enzimático con MTT. Los extractos activos contra epimastigotes y con baja citotoxicidad se evaluaron también en tripomastigotes y amastigotes intracelulares.
Resultados. Se reporta la actividad tripanocida de 13 plantas colombianas y se confirma el efecto biológico de cuatro especies previamente evaluadas. Cuatro extractos activos en epimastigotes también fueron activos en tripomastigotes y, uno de ellos, en amastigotes. Este extracto fue aislado de la planta Hieronyma antioquensis, y presentó CI50 de 3,125, 11,48 y 2,85 µg/ml, e índices de selectividad de 25,7 y 27, para epimastigotes, tripomastigotes y amastigotes, respectivamente. Los resultados sugieren que este extracto es un candidato promisorio para el tratamiento de la enfermedad de Chagas.
Conclusión. La flora colombiana es una fuente potencial de nuevas sustancias para la quimioterapia contra la enfermedad de Chagas. El micrométodo enzimático con MTT es una herramienta útil para la tamización de la actividad biológica en epimastigotes y posterior selección para ensayos con otros estadios del parásito.
Palabras clave: Trypanosoma cruzi, enfermedad de Chagas, extractos vegetales.
Trypanocidal and cytotoxic activity of extracts of Colombian plants
Introduction. The treatment of Chagas disease is based on only two drugs with limited efficacy and significant side effects. The rich biodiversity of the Colombian flora makes bio-prospecting a potential alternative in the search for new antiparasitic drugs.
Objective. Potential trypanocidal activity and cytotoxicity was assessed in extracts from 23 Colombian plants.
Materials and methods. Extracts of leaves, stems, or of the whole plants were obtained in solvents of a range of polarities. The activity against Trypanosoma cruzi epimastigotes and the cytotoxicity were evaluated by the MTT enzymatic micro-method. Extracts active against epimastigotes and with lowcytotoxicity were also tested on trypomastigotes and intracellular amastigotes.
Results. Among the extracts, biological activity was confirmed in 4 species. The extracts were active on epimastigotes and trypomastigotes; one was active also against amastigotes. The latter extract was isolated from the plant Hieronyma antioquensis and presented IC50 of 3.1 mg/ml for epimastigotes, 11.5mg/ml for trypomastigotes and 2.9 mg/ml for amastigotes. The selectivity indexes were 25, 7, and 27 respectively.
Conclusions. The extract from H. antioquensis proved a promising candidate for Chagas disease treatment. Futhermore, the MTT enzymatic micromethod was a useful tool for screening biological activity on epimastigotes and other stages of the parasite for further extract trials.
Key words: Trypanosoma cruzi, Chagas disease, plants extracts.
La enfermedad de Chagas es una enfermedad infecciosa causada por el parásito protozoario Trypanosoma cruzi. La enfermedad se extiende por 21 países de Centroamérica y Suramérica y está asociada con la pobreza, las malas condiciones de vivienda y los desplazamientos masivos desde los ambientes rurales a las ciudades. Representa la segunda mayor carga económica en América entre las enfermedades transmitidas por vectores, y se calcula que existen 15 millones de infectados y 28 millones de personas en riesgo, con un promedio de 41.200 nuevos casos por año (1). En Colombia, entre 700.000 y 1·200.000 personas están infectadas y ocho millones están en riesgo de infección (2).
La quimioterapia para la enfermedad de Chagas se basa en dos medicamentos descubiertos hace mas de 30 años: nifurtimox (3-metil-4-(5·- nitrofurfurilideneamina) tetrahidro-4H-1,4-tiazina-1,1- dióxido) y benznidazol (2-nitroimidazol (N-benzil- 2-nitroimidazol) acetamida), que son efectivos durante la fase aguda de la enfermedad (hasta 80 % de éxito) (3), así como en la fase crónica temprana (hasta 60 % de éxito) (4,5), aunque hay reportes que discrepan de estos resultados (6,7).
El tratamiento es de larga duración (promedio de 60 días) y unos de los principales inconvenientes provienen de la resistencia observada en algunas cepas del parásito y de la alta toxicidad manifestada en efectos colaterales, como cólicos, vómito, anorexia, dermopatías alérgicas, insomnio, linfoadenopatías y dolor muscular, depresión de la médula espinal, trombocitopenia y agranulocitosis, polineuropatía, parestesia y polineuritis de nervios periféricos (8). Aproximadamente, el 16 % de los pacientes crónicos tratados con benznidazol abandonan el tratamiento por sus efectos colaterales (1). En este sentido, se hace necesario encontrar nuevas sustancias con actividad tripanocida, con menores efectos colaterales, que permitan el desarrollo de tratamientos más cortos y con efectividad en las diferentes cepas del parásito.
Desde hace más de 20 años se viene explorando la búsqueda de nuevos antiparasitarios en los productos naturales (9,10). Sin embargo, hasta ahora es poco el conocimiento sobre las potencialidades de la flora colombiana como fuente de nuevos agentes contra el parásito T. cruzi. En el presente estudio se evaluó in vitro el potencial tripanocida de extractos obtenidos de 23 especies de plantas que crecen en Colombia, pertenecientes a familias en las cuales se ha demostrado la presencia de metabolitos secundarios con actividad antiparasitaria, como son las familias Solanaceae, Annonaceae, Asteraceae, Euphorbiaceae y Ebenaceae, y otras plantas con actividad desconocida (11).
Conjuntamente, se evaluó la citotoxicidad in vitro de los extractos y se calculó el índice de selectividad o proporción entre la actividad contra el parásito y la citotoxicidad registrada. Algunos extractos activos en los bioensayos iniciales con epimastigotes se probaron en tripomastigotes y amastigotes intracelulares, y mostraron excelentes resultados. Estos extractos son candidatos promisorios para seguir estudios de bioprospección en el tratamiento de la enfermedad de Chagas.
Materiales y métodos
Material vegetal
Las familias y especies de plantas seleccionadas para este estudio se recolectaron en los departamentos de Antioquia, Risaralda y Santander. Se identificaron en los herbarios de la Universidad de Antioquia y de la Universidad Nacional de Colombia, sede Bogotá. Las plantas estudiadas fueron las siguientes: Annona muricata, Desmopsis panamensis, Ephedranthus colombianus, Guatteria cf. Tonduzii, Pseudomalmea boyacana, Rollinia exsucca, R. pittieri, Achyrocline bogotensis, Achyroclines sp., Chromolaena perglabra, Gnaphalium meridanum, Pentacalia sp., Diospyros artantifolia, Euphorbia cotinifolia, E. heterophylla, E. splendens, Hieronyma antioquensis, Acnistus arborecens, Cuatresia riparia, Larnax sachapapa, Solanum laevigatum, S. nematorhachis y S. Psychotrioides.
Preparación de extractos
Las hojas, tallos o plantas enteras se secaron a temperatura ambiente por varios días y se sometieron a percolación en frío. Para el arrastre de sustancias apolares, se utilizó éter de petróleo o hexano, para sustancias de polaridad intermedia, diclorometano o acetato de etilo, y para un perfil de sustancias más polares, metanol o etanol. Para las plantas S. nematorhachis y S. psychotrioides, el material vegetal seco se trituró con etanol al 90 % y los restos del solvente se eliminaron por rotaevaporación.
El extracto se disolvió de nuevo en la mezcla triple de hexano, diclorometano y metanol en proporción 2:1:1, y la parte insoluble en la mezcla triple se disolvió en metanol. Los extractos se llevaron a sequedad para la eliminación de los solventes. Para la planta C. riparia se obtuvo extracto acuoso. En todos los casos, los restos del solvente se eliminaron por rotaevaporación. Los extractos se disolvieron en polivinilpirrolidona (PVP) en proporción 1:4 (compuesto: PVP) para mejorar su solubilidad y se diluyeron en solución salina amortiguada con fosfatos (PBS) a pH 7,2 (12).
Actividad contra epimastigotes de Trypanosoma cruzi
Epimastigotes de la cepa HA de T. cruzi, aislada de humano en el departamento de Casanare, Colombia, y caracterizada como unidad de tipificación discreta I mediante el análisis molecular del gen miniexón, se incubaron junto a los extractos en medio LIT enriquecido con suero fetal bovino al 10 % durante 96 horas a 28°C.
La viabilidad de los parásitos se midió según la formación de cristales de formazán después de agregar bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5- difeniltetrazolio) (MTT) según la metodología descrita (13). La formación de los cristales se determinó en un lector de ELISA (BioRad) a una densidad óptica de 595 nm.
Se estimó la concentración a la cual los extractos disminuían al 50 % el crecimiento de los parásitos o concentración inhibitoria 50 (CI50). Para todos los experimentos, el medicamento benznidazol (Rochagan-Roche), el solvente PVP y el medio de cultivo, se utilizaron como controles de crecimiento.
Los niveles de actividad de los extractos se agruparon en cuatro categorías, de la siguiente manera: muy activos, para extractos con CI50 menores de 10µg/ml; activos, aquéllos con CI50 entre 10 y 50µg/ml; actividad baja, para extractos con CI50 entre 51 y 100 µg/ml; y extractos no activos, con CI50 por encima de 100 µg/ml (14,15).
Citotoxicidad en células U937
La citotoxicidad se evaluó en la línea celular de promonocitos humanos U937. Después de 96 horas de incubación en presencia de los extractos, la viabilidad de las células se determinó de acuerdo con la producción de cristales de formazán, después de la adición de MTT, como se describió previamente. Se usaron como controles células bajo las mismas condiciones, pero en ausencia de los extractos.
Los resultados se expresaron como la concentración inhibitoria 50 (CI50), que corresponde a la concentración a la cual ocurre el 50 % de muerte celular. La citotoxicidad se categorizó en los siguientes tres niveles: citotóxico, para los extractos con CI50 menores de 50 µg/ml; medianamente citotóxicos, para extractos con CI50 entre 51 y 100µg/ml, y extractos levemente citotóxicos, para aquéllos con CI50 por encima de 100 µg/ml (15).
Actividad contra tripomastigotes de T.cruzi
Los extractos con buena actividad en epimastigotes y baja citotoxicidad, fueron evaluados en tripomastigotes. Para esta prueba se seleccionaron extractos con un índice de selectividad de 3 o más En este ensayo, 2 x 106 tripomastigotes/ml se incubaron junto a los extractos o benznidazol en medio RPMI 1640 con suplemento de suero fetal bovino al 5 %, durante 24 horas, a 37°C y 5 % de CO2, en platos de 24 pozos y usando como control de viabilidad los parásitos incubados sólo con medio.
Cada ensayo se hizo por triplicado y en dos experimentos independientes. El conteo de parásitos vivos se hizo por observación directa al microscopio en cámara de Neubauer. Para medir la actividad, se calculó la concentración a la cual sobrevivían el 50 % de los tripomastigotes con respecto al control (CI50), como se mencionó anteriormente.
Actividad contra amastigotes intracelulares de T. cruzi
Para la obtención de amastigotes, se sembraron 1 x 105 células U937/ml en medio RPMI 1640 y 100 ng/ml de forbol 12-miristato 13-acetato (PMA). Para su adhesión, 1 ml de células en suspensión se incubaron durante 48 horas a 37 °C y 5 % de CO2, en placas de 24 pozos, con cambio por medio fresco sin PMA a las 24 horas. Las células adheridas se infectaron con tripomastigotes de T. cruzi en proporción célula:parásitos de 1:10. Las células se dejaron en contacto con los parásitos por 24 horas, a 37°C, con CO2 al 5 % en medio RPMI enriquecido con 5 % de suero fetal bovino. Después de la incubación, se cambió el medio, se agregaron las diferentes concentraciones de los extractos y se dejaron en incubación por 48 horas. Cada tratamiento se hizo por triplicado. Para el control de viabilidad, se utilizaron células infectadas sin tratamiento. Las células se lavaron, se fijaron con metanol y se colorearon con Giemsa.
La observación del desarrollo y el conteo de los amastigotes se hizo según la metodología descrita en trabajos anteriores (16,17). Los resultados se expresaron como CE50, entendida como la concentración a la cual la carga de amastigotes intracelulares disminuye 50 % con respecto al control. Para esta prueba, se selecciono el extracto que fue activo contra epimastigotes y tripomastigotes y mostró baja citotoxicidad.
Índice de selectividad
Para observar la relación entre la citotoxicidad y la actividad registrada, se usó como indicador el índice de selectividad, que corresponde al cociente entre la CI50 en células y la CI50 en los diferentes estadios del parásito. Entre mayor sea la relación, mayor será el valor de índice de selectividad.Para las pruebas en tripomastigotes y amastigotes, se consideraron selectivos los extractos con índice de selectividad de 3 o más, y muy selectivos, aquéllos con un índice de 10 o más.
Tratamiento de datos
Todos los bioensayos se hicieron por triplicado en dos experimentos independientes. Las CI50 se obtuvieron con el método de análisis dosis- respuesta Probit (18), usando el programa Probit 2.0®.
Resultados
Actividad contra epimastigotes y citotoxicidad
De los 64 extractos obtenidos de las plantas, 37 mostraron actividad contra epimastigotes de T. cruzi (cuadro 1). La mayoría (81 %) de los extractos activos o muy activos contra epimastigotes resultaron ser citotóxicos. Sin embargo, once extractos alcanzaron un índice de selectividad entre 3 y 10, y sólo dos extractos alcanzaron índices mayores de 10. Las CI50 menores, equivalentes a las mayores actividades, las alcanzaron los extractos de las plantas S. psychotrioides, L. sachapapa y H. antioquensis. Esta última mostró un índice de selectividad mayor de 22. Los extractos de Pentacalia sp. y C. riparia fueron activos y registraron las menores citotoxicidades, con CI50 superiores a 100µg/ml.
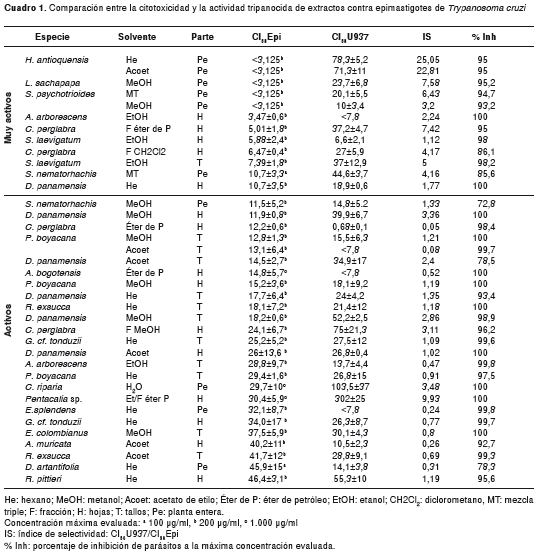
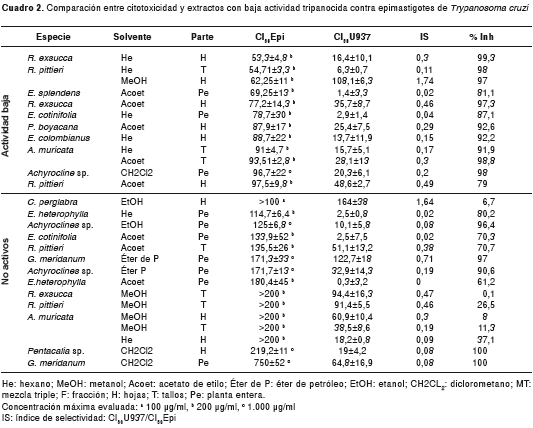
Los resultados para los extractos con actividad baja y los no activos, se presentan en el cuadro 2. Las plantas Achyroclines sp., G. meridanum, E. cotinifolia y E. heterophylla, exhibieron poca o ninguna actividad contra el parásito con los diferentes solventes usados. Además, los resultados obtenidos para el solvente PVP indicaron que, a las concentraciones usadas, no fueron tóxicos para el parásito (datos no mostrados).
Actividad contra tripomastigotes y amastigotes
Para los ensayos contra tripomastigotes se seleccionaron cinco extractos que fueron muy activos en epimastigotes. Los resultados se presentan en el cuadro 3. De los cinco extractos seleccionados, cuatro mostraron actividad contra tripomastigotes. Los extractos de H. antioquensis y L. sachapapa mostraron la mejor actividad contra tripomastigotes, con CI50 de 11,48µg/ml e índice de selectividad de 6,8, y CI50 menor de 2 µg/ml e índice de selectividad mayor de 11, respectivamente. La CI50 contra tripomastigotes para el extracto de L. sachapapa fue cercana a la CI50 en tripomastigotes registrada con benznidazol.
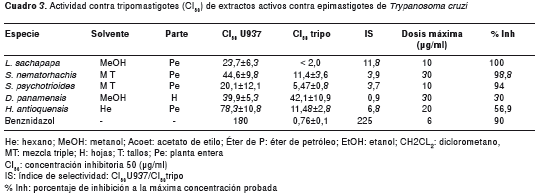
Debido a su buena actividad en epimastigotes y tripomastigotes y a su abundancia, el extracto de H. antioquensis fue elegido para probarlo en amastigotes intracelulares. Los resultados mostraron una CE50 de 2,85µg/ml y un índice de selectividad de 27,5, lo cual indica que es un candidato promisorio para el tratamiento de la enfermedad de Chagas.
Discusión
Éste es el primer estudio de bioprospección de un gran número de plantas colombianas con actividad tripanocida. En todas las familias de plantas estudiadas, se encontró alta actividad tripanocida en epimastigotes, lo que indica la posible existencia de una gama de sustancias bioactivas por determinar y que justifica la continuación de la bioprospección en la flora colombiana.
En este trabajo se reporta la actividad contra epimastigotes de las plantas de las especies C. riparia, L. sachapapa, S. laevigatum, S. nematorhachis y S. psychotrioides, y se confirma la actividad tripanocida reportada para Acnistus arborecens (19). Además, se reporta actividad contra tripomastigotes, el estado infeccioso del parásito, de S. nematorhachis, S. psycothroides y L. sachapapa. En reportes previos se encontraron lactonas esteroideas o withanolidos, denominados así por ser obtenidos de la planta whitania, en A. arborescens, los cuales se muestran como potentes inhibidores del crecimiento de epimastigotes de T. cruzi (20). De igual manera, otros compuestos como withafisalin O, M y N, obtenidos de esta planta, mostraron actividad tripanocida y menor citotoxicidad (19). Además, la presencia de sustancias de este tipo y su actividad contra parásitos, como por ejemplo Leishmania (V) panamensis, se ha confirmado en otras plantas de esta misma familia (21). Es recomendable confirmar la presencia de withanolidos en las solanáceas utilizadas en este estudio.
Por otra parte, en los estudios con diferentes plantas de la familia Annonaceae se ha demostrado la presencia de metabolitos secundarios con actividad biológica (22). Por lo tanto, no es sorprendente que las siete especies de la familia Annonaceae incluidas en este estudio mostraran actividad contra epimastigotes, destacándose por sus bajas concentraciones efectivas D. panamensis, Rollinia exsucca y Pseudomalmea boyacana. En este trabajo se estudia por primera vez la actividad de Ephedranthus colombianus y Guatteria cf. Tonduzzi contra epimastigotes, mientras que en otros trabajos se ha reportado actividad para A. muricata, R. exsucca y R. pittieri (15). Se cree que, en esta familia de plantas, las acetogeninas presentes pueden ser responsables de la actividad antiparasitaria, aunque con gran citotoxicidad (23,24).
Para las plantas de la familia Asteraceae, se reporta por primera vez la actividad contra epimastigotes de Achyroclines bogotensis, Chromolaena pergabra y Pentacalia sp., todas en el extracto crudo o en las fracciones en éter de petróleo, lo cual puede indicar la presencia de una sustancia tripanocida similar en las tres plantas. Tanto para el género Chromolaena como para el género Achyrocline, se ha reportado la presencia de flavonoides con mayor abundancia en las partes aéreas (25).
Ésta es la primera vez que se demuestra actividad tripanocida para A. bogotensis, pero existen indicios de actividad tripanocida en otra especie del género, Achyrocline satureioides, con la cual se observó lisis de tripomastigotes aunque a altas concentraciones (26). En Pentacalia sp., la baja citotoxicidad observada es interesante, ya que precisamente la gran toxicidad de los compuestos en uso para el tratamiento de la enfermedad de Chagas, es uno de los principales problemas por resolver. El determinar el potencial tripanocida en tripomastigotes y amastigotes sería el camino por seguir, así como iniciar la determinación de los metabolitos presentes.
Más de 130 especies de Diospyros se han estudiado, en las que se ha demostrado la amplia presencia de naftoquinonas (27), entre las que se destacan las O-naftoquinonas, como la α-lapachona, β-lapachona y sus análogos, y las mansononas, como sustancias citotóxicas e inhibidoras del crecimiento de tripanosomátidos (28). En este estudio se reporta por primera vez actividad tripanocida y gran citotoxicidad en el extracto en hexano de Diospyros arthantifolia.
De la familia Euphorbiaceae se estudiaron tres plantas del género Euphorbia y se observó en todas gran citotoxicidad. Sólo en E. splendens se registró acción tripanocida en epimastigotes, una actividad no reportada con anterioridad para la especie. H. antioquensis fue una planta destacada. Los resultados obtenidos en tripomastigotes y en amastigotes con esta planta, sugieren la presencia de sustancias capaces de ser absorbidas, inhibir la formación de amastigotes dentro de las células y reducir la cantidad de tripomastigotes liberados al medio, lo que supone un avance importante desde lo observado en los epimastigotes. Los resultados en amastigotes y tripomastigotes son un buen punto de partida para continuar estudios con H. antioquensis en el modelo in vivo.
En este estudio hubo concordancia entre la actividad de los extractos observada en epimastigotes y la actividad encontrada en los tripomastigotes. Esto indica que el ensayo masivo en epimastigotes es una buena prueba de tamización con miras a encontrar compuestos activos en otros estadios del parásito.Todos los extractos y fracciones activos contra T. cruzi podrían ser candidatos para continuar los estudios, ya que la gran citotoxicidad podría deberse a sustancias diferentes a las que están actuando sobre los parásitos o a un efecto sinérgico entre las sustancias presentes en el extracto crudo, y podría disminuir con la separación en fracciones o con el aislamiento de moléculas (29). También, sería importante determinar la genotocixidad de los extractos activos como una aproximación a la identificación de las causas de los efectos colaterales, como ocurre con el benznidazol, cuyo potencial genotóxico se ha demostrado (30,31).
Finalmente, los resultados indican que las plantas colombianas son una fuente potencial de sustancias con bioprospección para el tratamiento de las enfermedades consideradas como desatendidas por la Organización Mundial de la Salud. Particularmente, en esta investigación se reporta actividad tripanocida nueva para 13 plantas en epimastigotes, para cuatro de ellas en tripomastigotes y para una en amastigotes intracelulares de T. cruzi. Estos resultados abren nuevas perspectivas de investigación sobre la flora colombiana y la quimioterapia, para la enfermedad de Chagas y para otros parásitos de importancia médica.
Conflicto de intereses
Todos los autores de este trabajo declaramos que no existe conflicto de intereses.
Financiación
Este trabajo se realizó en el marco del proyecto 1115-04-1449 "Búsqueda de antiparasitarios de la flora colombiana", financiado por Colciencias.
Correspondencia: Omar Triana, Grupo BiologÃa y Control de Enfermedades Infecciosas, Laboratorio 620, Sede de Investigación Universitaria, Universidad de Antioquia, Calle 62 Nº 52-59, MedellÃn, Colombia. Teléfono: (5704) 219 6520 otriana@gmail.com
Referencias
1. Guhl F, Lazdins-Held J. Grupo de trabajo científico sobre la enfermedad de Chagas, Geneva: Special Programme for Research and Training in Tropical Diseases; 2007. p. 5-31. [ Links ]
2. Padilla JC. Situación de la enfermedad de Chagas en Colombia. Memorias. En: Guhl F, editor. Primer taller internacional sobre control de la enfermedad de Chagas. Curso de diagnóstico, manejo y tratamiento de la enfermedad de Chagas. Sexta reunión de la iniciativa andina para el control de la enfermedad de Chagas. Bogotá: Ediciones Uniandes; 2005. p. 19-24. [ Links ]
3. Cançado JR. Criteria of Chagas disease cure. Mem Inst Oswaldo Cruz. 1999;94:331-6. [ Links ]
4. de Andrade LS, Zicker F, Rassi A, Rassi AG, Oliveira RM, Silva SA, et al. Early electrocardiographic abnormalities in Trypanosoma cruzi-seropositive children. Am J Trop Med Hyg. 1998;59:530-4. [ Links ]
5. Sosa-Estani S, Segura EL. Treatment of Trypanosoma cruzi infection in the undetermined phase. Experience and current guidelines in Argentina. Mem Inst Oswaldo Cruz. 1999:94(Suppl.1):363-5. [ Links ]
6. Silveira CA, Castillo E, Castro C. Avaliação do tratamiento especifico para o Trypanosoma cruzi en criaças, na evolucion da fase indeterminada. Rev Soc Bras Med Trop. 2000;33:191-6. [ Links ]
7. Solari A, Ortiz S, Soto A, Arancibia C, Campillay R, Contreras M, et al. Treatment of Trypanosoma cruziinfected children with nifurtimox: A 3-year follow-up study. J Antimicrob Chemother. 2001;48:515-9. [ Links ]
8. Kirchhoff LV. American trypanosomiasis (Chagas´ disease). En: Rakel RE, editor. Conn´s current therapy. New York, USA: W.B. Saunders; 2000. p. 101-2. [ Links ]
9. Phillipson JD, Wright CW. Medicinal plants against protozoal diseases. Trans R Soc Trop Med Hyg.1991;85:155-65. [ Links ]
10. Kayser O, Kinderlen AF, Croft SL. Natural products as antiparasitic drugs. Parasitol Res. 2003;90:55-62. [ Links ]
11. Osorio EJ, Robledo SM, Bastida J. Alkaloids with antiprotozoal activity. Alkaloids Chem Biol. 2008;66:113-90. [ Links ]
12. D´Souza AJ, Schowen RL, Topp EM. Polyvinylpyrrolidonedrug conjugate: Synthesis and release mechanism. J Control Release. 2004;94:91-100. [ Links ]
13. Weniger B, Robledo S, Arango GJ, Deharo E, Aragon R, Muñoz V, et al. Antiprotozoal activities of Colombian plants. J Ethnopharmacol. 2001;78:193-200. [ Links ]
14. Maya JD, Cassels BK, Iturriaga-Vásquez P, Ferreira J, Faúndez M, Galanti N, et al. Mode of action of natural and synthetic drugs against Trypanosoma cruzi and their interaction with the mammalian host. Comp Biochem Physiol A Mol Integr Physiol. 2007;146:601-20. [ Links ]
15. Osorio E, Arango GJ, Jiménez N, Alzate F, Ruiz G, Gutiérrez D, et al. Antiprotozoal and cytotoxic activities in vitro of Colombian Annonaceae. J Ethnopharmacol. 2007;111:630-5. [ Links ]
16. Atienza J, Martínez RA, Gómez A, Escario JA, Herrero A, Ochoa C, et al. Activity assays of thiadiazine derivates on Trichomonas vaginalis and amastigote forms of Trypanosoma cruzi. Chemotherapy. 1992;38:441-6. [ Links ]
17. Martínez RA. Variabilidad intraespecífica en Trypanosoma cruzi y ensayo de nuevos métodos para el cribado farmacológico (tesis). Madrid: Universidad Complutense de Madrid; 1996. p. 130. [ Links ]
18. Finney JD. Statistical logic in the monitoring of reactions to therapeutic drugs. Methods Inf Med.1971;10:237-45. [ Links ]
19. Vieira NC, Espíndola LS, Santana JM, Veras ML, Pessoa OD, Pinheiro SM, et al. Trypanocidal activity of a new pterocarpan and other secundary metabolites of plants from northeastern Brazil flora. Bioorg Med Chem. 2008; 6:1676-82. [ Links ]
20. Minguzzi S, Barata LES, Shin YG, Jonas PF, Chai H, Park EJ, et al. Cytotoxic withanolides from Acnistus arborescens. Phytochemistry. 2002;59:635-41. [ Links ]
21. Cardona D, Quiñones W, Torres F, Vélez ID, Orozco CI, Garzon J, et al. Estructura y actividad leishmanicida de larnaxolida A y B, nuevos withanólidos de Larnax glabra (Standl.) Sawyer. Actual Biol. 2005;27:81-6. [ Links ]
22. Leboeuf M, Cavé A, Bhaumikk PK, Mukherjee B, Mukherjee R. The phytochemistry of the Annonaceae. Phytochemistry. 1982;21:2783-813. [ Links ]
23. Raynaud-Le Grandic S, Fourneau C, Laurens A, Bories D, Hoquemiller R, et al. In vitro antileishmanial activity of acetogenins from Annonaceae. Biomed and Pharmacother. 2004;58:388-92. [ Links ]
24. Jiménez N. Contribución al estudio de la química y la actividad biológica de Annonaceae: actividad anti-leishmania de alcaloides de Rollinia pittieri y acetogeninas de Rollinia exsucca (tesis). Medellín: Universidad de Antioquia; 2005. p. 84. [ Links ]
25. Akinmoladun AC, Obuotor EM, Farombi EO. Evaluation of antioxidant and free radical scavenging capacities of some Nigerian indigenous medicinal plants. J Med Food. 2010;13:444-51. [ Links ]
26. Rojas A, Ferro E, Inchausti A, Ascurra M, Acosta N, Rodríguez E, et al. Mutagenicity, insecticidal and trypanocidal activity of some Paraguayan Asteraceae. J Ethnopharmacol. 1995;45:35-41. [ Links ]
27. Mallavadhani U, Anita V, Panda K, Rao YR. Pharmacology and chemotaxonomy of Diospyros. Phytochemistry. 1998;49:901-51. [ Links ]
28. Croft SL, Evans AT, Neal RA. The activity of plumbagin and other electron carriers against Leishmania donovani and Leishmania mexicana. Ann Trop Med Parasitol. 1985;79:651-3. [ Links ]
29. Campos FR, Januário AH, Rosas LV, Nascimento SK, Pereira PS, França SC, et al. Trypanocidal activity of extracts and fractions of Bertholletia excelsa. Fitoterapia. 2005;76:26-9. [ Links ]
30. Melo M, Ferreira L. Screening the mutagenic activities of commonly used antiparasite drugs by the simultest, a simplified Salmonella/microsome plate incorporation assay. Rev Inst Med Trop Sao Paulo. 1990;32:269-74. [ Links ]
31. Lacava ZG, Luna H. The anticlastogenic effect of tocopherol in peritoneal macrophages of benznidazole-treated and ovariectomized mice. Mutat Res. 1994;305:145-50. [ Links ]














