Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.31 no.4 Bogotá Oct./Dec. 2011
ARTÍCULO ORIGINAL
1Laboratorio de Neurofisiología Comportamental, Departamento de Ciencias Fisiológicas, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, D.C., Colombia
2Departamento de Ciencias Fisiológicas, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, D.C., Colombia.
3Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, D.C., Colombia.
Lugar de realización del trabajo: Laboratorio de Neurofisiología Comportamental, Universidad Nacional de Colombia, sede Bogotá.
Contribución de los autores: Diana Urrego siguió la evolución de los animales experimentales y realizó el procesamiento histológico del cerebro y el análisis morfométrico de las neuronas de la corteza motora primaria de las vibrisas.
Alejandro Múnera supervisó todos los procedimientos experimentales, realizó los análisis estadísticos de los datos y participó en la redacción del manuscrito.
Julieta Troncoso diseñó el experimento, realizó las cirugías de lesión del nervio facial, coordinó el desarrollo del experimento, construyó las figuras del artículo y redactó el manuscrito.
Recibido: 26/04/11; aceptado:22/08/11
Introducción. Poco se sabe sobre las modificaciones morfológicas de las neuronas de la corteza motora tras lesiones en nervios periféricos, y de la implicancia de dichos cambios en la recuperación funcional tras la lesión.
Objetivo. Caracterizar en ratas el efecto de la lesión del nervio facial sobre la morfología de las neuronas piramidales de la capa V de la corteza motora primaria contralateral.
Materiales y métodos. Se reconstruyeron neuronas piramidales teñidas con la técnica de Golgi-Cox, de animales control (sin lesión) y animales con lesiones y sacrificados a distintos tiempos luego de la lesión. Se utilizaron cuatro grupos: sham (control), lesión 1S, lesión 3S y lesión 5S (animales con lesiones y evaluados 1, 3 y 5 semanas después de la lesión irreversible del nervio facial, respectivamente). Se evaluaron mediante el análisis de Sholl, las ramificaciones dendríticas de las células piramidales de la corteza motora contralateral a la lesión.
Resultados. Los animales con lesiones presentaron parálisis completa de las vibrisas mayores durante las cinco semanas de observación. Comparadas con neuronas de animales sin lesiones, las células piramidales córtico-faciales de los lesionados mostraron una disminución significativa de sus ramificaciones dendríticas. Esta disminución se mantuvo hasta cinco semanas después de la lesión.
Conclusiones. Las lesiones irreversibles de los axones de las motoneuronas del núcleo facial, provocan una retracción sostenida del árbol dendrítico en las neuronas piramidales córtico-faciales.
Esta reorganización morfológica cortical persistente podría ser el sustrato fisiopatológico de algunas de las secuelas funcionales que se observan en los pacientes con parálisis facial periférica.
Palabras clave: rata, nervio facial, células piramidales, corteza motora.
Peripheral facial nerve lesion induced long-term dendritic retraction in pyramidal cortico-facial neurons
Introduction. Little evidence is available concerning the morphological modifications of motor cortex neurons associated with peripheral nerve injuries, and the consequences of those injuries on post lesion functional recovery.
Objective. Dendritic branching of cortico-facial neurons was characterized with respect to the effects of irreversible facial nerve injury.
Materials and methods. Twenty-four adult male rats were distributed into four groups: sham (no lesion surgery), and dendritic assessment at 1, 3 and 5 weeks post surgery. Eighteen lesion animals underwent surgical transection of the mandibular and buccal branches of the facial nerve. Dendritic branching was examined by contralateral primary motor cortex slices stained with the Golgi-Cox technique. Layer V pyramidal (cortico-facial) neurons from sham and injured animals were reconstructed and their dendritic branching was compared using Sholl analysis.
Results. Animals with facial nerve lesions displayed persistent vibrissal paralysis throughout the fiveweek observation period. Compared with control animal neurons, cortico-facial pyramidal neurons of surgically injured animals displayed shrinkage of their dendritic branches at statistically significant levels. This shrinkage persisted for at least five weeks after facial nerve injury.
Discussion. Irreversible facial motoneuron axonal damage induced persistent dendritic arborization shrinkage in contralateral cortico-facial neurons. This morphological reorganization may be the physiological basis of functional sequelae observed in peripheral facial palsy patients.
Key words: Rats, facial nerve, pyramidal neurons, motor cortex.La recuperación funcional después de una lesión de nervio periférico depende no sólo de la regeneración de los axones en el nervio, sino también de cambios funcionales compensatorios en otros componentes del sistema sensitivo-motor comprometido (1). La evaluación de estos cambios resulta particularmente interesante en la corteza motora primaria, ya que ésta desempeña un papel importante en la integración de la información sensorial y motora durante la interpretación perceptual y la organización de los actos voluntarios. La lesión del nervio facial en roedores, en especial de las ramas que controlan el movimiento de las vibrisas, es un modelo idóneo para el estudio de los cambios funcionales y estructurales provocados en el sistema nervioso central por daño en un nervio periférico (2).
Los roedores capturan información táctil del entorno inmediato mediante el movimiento activo de sus vibrisas (3), cuyo batido es controlado por motoneuronas del núcleo facial. Estas motoneuronas reciben comandos monosinápticos de células piramidales córtico-faciales de la capa V de la corteza motora primaria de las vibrisas (4) y de otras estructuras premotoras troncoencefálicas (5). Cuando las vibrisas se baten e interaccionan con objetos, la inflexión provocada en las mismas es transformada por mecanorreceptores en patrones espacio-temporales de actividad neuronal (6), que son conducidos por la rama infraorbitaria del nervio trigémino (7,8). Esta información es analizada sucesivamente en el complejo nuclear del trigémino, el tálamo contralateral y la corteza somatosensorial primaria contralateral. El tálamo somato-sensorial y la corteza somatosensorial primaria envían proyecciones a la corteza motora primaria de las vibrisas (9), lo que permite realizar ajustes del patrón de movimiento con base en la información sensorial.
Se sabe poco sobre la respuesta de las neuronas piramidales de la lámina V de la corteza motora primaria ante la axotomía de las motoneuronas sobre las cuales proyectan. Tras la axotomía de motoneuronas del nervio facial, ocurre una desinhibición transitoria de las conexiones interhemisféricas de la corteza motora primaria, seguida por una desinhibición persistente de las conexiones córtico-corticales regionales en la corteza motora contralateral a la lesión (10, 11). Por otra parte, luego de lesiones del nervio facial, ocurre una reorganización rápida y duradera de los mapas de la corteza motora primaria contralateral (12), dada por invasión de la representación de las vibrisas por las del párpado y la pata delantera (13-15).
La supresión de información sensorial desde las vibrisas, también provoca reorganización de los mapas en la dicha corteza. En ratas, el corte de las vibrisas produce una reducción de su representación a expensas del aumento de la región que controla el movimiento de los miembros superiores; sin embargo, al crecer las vibrisas este patrón se revierte (16). Por el contrario, en un estudio más reciente se destaca que, luego de dos semanas de lesionar unilateral o bilateralmente la rama infraorbitaria del nervio trigémino, el tamaño de las representaciones en la corteza motora primaria de las vibrisas no cambia significativamente; sin embargo, sí se produce un aumento significativo del umbral para desencadenar movimientos de las vibrisas, pero no en los umbrales para desencadenar movimientos en las representaciones adyacentes de la cara o el miembro superior (17). Estos resultados sugieren que la disminución de las aferencias sensoriales provenientes de las vibrisas induce una remodelación rápida de las conexiones sinápticas extrínsecas e intrínsecas en la corteza motora primaria de las vibrisas.
La reorganización inducida por axotomía facial contralateral y el consecuente desequilibrio sensorial por pérdida de movilidad de las vibrisas, deberían reflejarse en cambios en la arquitectura dendrítica en la corteza motora primaria de las vibrisas, de modo semejante a lo que se ha descrito tras la eliminación de algunas vibrisas, en la reorientación de las dendritas basales (18) o el recambio de las espinas dendríticas apicales (19), de las neuronas piramidales de las láminas III y V en la corteza somatosensorial primaria, y en cambios en la actividad unitaria de las células piramidales de las láminas II/III y V.
Recientemente, nuestro grupo de investigación ha encontrado que, tras lesiones por compresión del nervio facial, la corteza motora primaria de las vibrisas contralateral disminuye su respuesta de población ante estímulos eléctricos en el parche de vibrisas paralizado. Dada la naturaleza incompleta de la lesión del nervio facial, esta disminución se revierte poco después de que se ha recuperado la movilidad de las vibrisas (20).
Puesto que aún no están bien entendidos los procesos por los cuales el sistema sensitivo-motor se reorganiza después de una lesión de nervio periférico, el objetivo de este trabajo fue caracterizar los cambios morfológicos en las neuronas piramidales de la capa V de la corteza motora primaria de las vibrisas en roedores, tras lesionar de manera unilateral y permanente las ramas del nervio facial contralateral que inervan la musculatura que produce el movimiento de las vibrisas.
Materiales y métodos
Sujetos
Se utilizaron como sujetos experimentales 24 ratas albinas macho (Ratus norvegicus), de la cepa Wistar, de 280 ± 30 g de peso, procedentes del Bioterio Central de la Universidad Nacional de Colombia, sede Bogotá. Los animales se alojaron en grupos de cuatro en cajas de policarbonato (38 x 32 x 18 cm), que contenían una capa de aserrín en el fondo, la que se cambiaba cada tercer día. Durante el experimento, los animales permanecieron a temperatura ambiente (20 ± 2 °C), con un ciclo de luz/oscuridad de 12 horas (luces encendidas a las 7:00 a.m.), y libre acceso a agua y comida.
Consideraciones éticas
Todos los procedimientos experimentales, las condiciones de alojamiento, y la disposición de los residuos biológicos y químicos, se hicieron observando la Ley 84 del 27 de diciembre de 1989. También, se observaron los procedimientos para el manejo y cuidado de animales de laboratorio recomendados por la normativa de la Unión Europea (8616091EU) y los National Institutes of Health de los Estados Unidos.
Los experimentos del presente trabajo recibieron aprobación de los Comités de Ética de las Facultades de Ciencias (Acta 01 del 6 de mayo de 2008) y Medicina (Acta 05 del 8 de mayo de 2008) de la Universidad Nacional de Colombia.
Diseño experimental Las ratas se asignaron al azar a uno de cuatro grupos experimentales (figura 1A): 1) control (n=6), conformados por animales a los que se les practicó una falsa cirugía de lesión (sham) y se les permitió un período de recuperación de una semana antes de ser sacrificados para el estudio histológico; 2) lesión 1S (n=6), 3) lesión 3S (n=6) y lesión 5S (n=6) conformados por animales a los que se practicó una cirugía de lesión del nervio facial derecho (ramas mandibular y bucal) y se les permitió un período de recuperación de 1, 3 o 5 semanas, respectivamente.
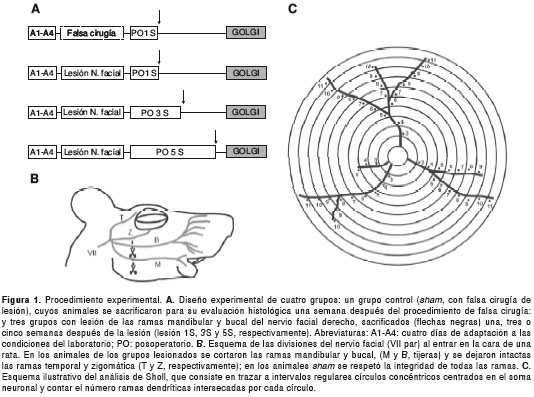
Procedimiento experimental
Lesión completa y permanente de las ramas mandibular y bucal del nervio facial derecho. Bajo anestesia general con ketamina (100 mg/kg) más xilazina (10 mg/kg), se afeitó la región preauricular del lado derecho mientras los animales estaban en decúbito lateral. En esta región se hizo una incisión y luego una disección roma por planos hasta aislar las ramas del nervio facial.
Una vez aislado el nervio facial se identificaron, mediante estimulación eléctrica, las ramas bucal y mandibular (encargadas de la inervación de la musculatura intrínseca del parche de vibrisas) y se cortaron retirando un segmento de 1,5 mm de cada una de ellas (figura 1B).
La lesión del nervio facial se corroboró mediante estimulación eléctrica de las porciones distal y proximal de cada una de las ramas lesionadas. Una correcta lesión provocaba movimiento de las vibrisas cuando se estimulaba eléctricamente la porción distal, pero no la proximal, de cada una de las ramas. Por último, se cerró la incisión con puntos separados de seda 4-0.
Falsa cirugía de lesión (sham). Bajo anestesia general con ketamina (100 mg/kg) más xilazina (10 mg/kg), se afeitó la región preauricular del lado derecho mientras los animales estaban en decúbito lateral. En esta región se hizo una incisión y luego una disección roma por planos hasta aislar las ramas del nervio facial. Finalmente, se procedió a cerrar la incisión con puntos separados de seda 4-0, manteniendo la total integridad del nervio facial.
Estudios histológicos
Tinción de Golgi-Cox. Las ratas se anestesiaron profundamente con hidrato de cloral (400 mg/ kg), se drenó completamente su sangre por vía intracardiaca con solución salina al 0,9 % y luego se perfundieron por vía intracardiaca con paraformaldehído al 4 % en PBS 0,1 M.
Los cerebros se extrajeron y cortaron siguiendo el plano coronal para obtener un bloque que contuviera la corteza motora primaria de las vibrisas desde el punto bregma 0 mm hasta el punto bregma hasta 4,5 mm por delante del mismo. Los bloques se procesaron con la tinción de Golgi-Cox (21).
Los cortes permanecieron en la oscuridad por 18 días en una solución de dicromato de potasio al 1 %, cloruro mercúrico al 1 % y cromato de potasio al 0,8 % en agua destilada. Los bloques se cortaron con vibrátomo (Vibratome 1000Plus®) en cortes seriados de 150 µm de espesor, siguiendo el plano coronal. Las secciones se dispusieron sobre láminas portaobjetos cubiertas con gelatina y se pasaron por las siguientes soluciones acuosas, para lograr un mayor contraste de la tinción: hidróxido de litio al 0,5 % y nitrato de potasio al 15 % por un minuto, tiosulfato sódico al 0,1 % por siete minutos, amoníaco al 12,5 % por 10 minutos y fijador fotográfico Kodak por 10 minutos. Finalmente, se deshidrataron con alcohol etílico en concentraciones crecientes y, posteriormente, se montaron usando un medio de resina.
Análisis de datos
Se seleccionaron las neuronas piramidales de la corteza motora primaria de las vibrisas que cumplían con los siguientes criterios:
tener su soma en la capa V de la corteza motora primaria de las vibrisas; haber sido impregnadas completamente, y tener un bajo nivel de ruido de fondo tal que permitiera el seguimiento de sus ramificaciones.
Las neuronas así seleccionadas se reconstruyeron usando fotografías tomadas con cámara digital (Canon Power Shot G10®) en un microscopio óptico (Zeiss Axioskope 40®).
Para la cuantificación de las dendritas de las células piramidales, se hizo un análisis de Sholl (22), trazando círculos concéntricos cada 4 µm a partir del soma y contando el número de ramas dendríticas intersecadas por cada círculo (figura 1C). El análisis de Sholl, tanto manual como asistido por computadora, ha sido ampliamente utilizado para los estudios morfológicos cuantitativos de células impregnadas con la técnica de Golgi (23,24).
Para la reconstrucción de cada una de las neuronas, se utilizaron fotografías seriadas y en diferentes planos de enfoque. Se formaron imágenes compuestas y apiladas, se reconstruyó su árbol dendrítico y se hizo el análisis de Sholl utilizando diferentes rutinas del software ImageJ® (figura 2).
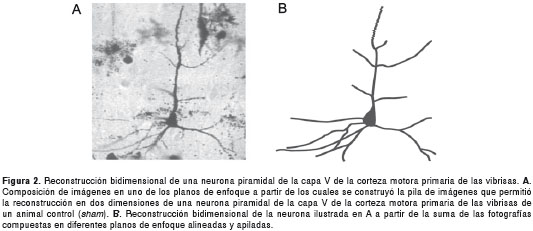
En total, se analizaron 40 neuronas: control (n=12), lesión 1S (n=9), lesión 3 S (n=10) y lesión 5 S (n=9). El número de neuronas que cumplieron los criterios para ser incluidas en el análisis podría considerarse bajo. No obstante, como los resultados obtenidos fueron significativos y dado que aumentar el número de neuronas manteniendo los exigentes criterios de inclusión hubiera requerido utilizar más animales, se decidió no hacerlo atendiendo al principio ético de reducir al máximo el número de animales experimentales.
Pruebas estadísticas
Mediante ANOVA de una vía, se comparó el área bajo la curva de la distribución del número de ramificaciones neuronales en función del radio del círculo en el análisis de Sholl, de los grupos lesionados con respecto al control. Cuando se evidenciaron diferencias significativas, se analizaron post hoc mediante el método Holm- Sidak para determinar entre cuáles grupos ocurrieron. Mediante ANOVA de dos vías de medidas repetidas, se comparó la ganancia en peso entre los animales del grupo control y de los grupos lesionados, antes y después de la lesión. El nivel de significancia estadística fue de p<0,05.
Resultados
Modificaciones en la actividad motora
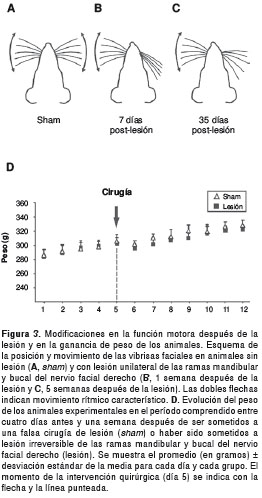
La lesión por corte de las ramas mandibular y bucal del nervio facial, produjo parálisis de la musculatura del parche de vibrisas del lado lesionado. Esto se evidenció por la ausencia de movimientos característicos de batido de vibrisas del lado lesionado, que requiere de la contracción de los músculos intrínsecos y extrínsecos de las vibrisas para producirse. Todos los animales de los grupos con lesión, presentaron ausencia de movimiento del lado lesionado durante todo el período durante el cual se observaron. Es decir, la parálisis facial no se revirtió, al menos durante las primeras cinco semanas después de la lesión.
La parálisis facial unilateral de los animales lesionados se acompañó de las siguientes características: desviación de la nariz hacia el lado no lesionado durante todo el período evaluado después de la lesión, retracción total de las vibrisas en las dos primeras semanas después de la lesión, y recuperación parcial de la tonicidad de las vibrisas durante las últimas semanas después de la lesión (figuras 3 B y C).
Por otra parte, los animales control con falsa cirugía de lesión (sham), mostraron un batido de vibrisas indistinguible de los no intervenidos quirúrgicamente y no tuvieron desviación de la nariz (figura 3A).
Ganancia de peso de los animales
Tanto antes como después del procedimiento quirúrgico, se controló el peso de los animales de todos los grupos. La figura 3D muestra la evolución en la ganancia de peso cinco días antes y siete días después de la intervención quirúrgica de los animales con falsa cirugía de lesión (sham) y los animales lesionados.
En la gráfica se observa una disminución de peso en los animales de ambos grupos, inmediatamente luego de la intervención quirúrgica. Sin embargo, el peso al día siguiente de la cirugía (figura 3D, día 6) no difirió significativamente del peso registrado inmediatamente antes de la intervención quirúrgica (figura 3D, día 5) para ninguno de los grupos (sham: t(34)= 0,730; p=0,482; lesionados: t (34)=1,591; p=0,121).
En el ANOVA de dos vías de medidas repetidas, se encontró un aumento significativo en el período comprendido entre cuatro días antes y una semana después de la cirugía, en la ganancia de peso de ambos grupos (F(11,242)=42,986; p<0,001). De igual manera, el análisis estadístico indicó ausencia de diferencias significativas en la modificación de peso entre animales lesionados y de control (sham) a lo largo del período de comparación (F(1, 242)=1,567, p=0,224). Además, los animales sacrificados tres y cinco semanas después de la lesión (3S y 5S, respectivamente) continuaron aumentando significativamente de peso (3 semanas Vs. 1 semana después la lesión: t(22)=2,031, p<0,05; 5 semanas Vs. 1 semana después de la lesión: t(10)=1,912, p< 0,05) y se mantuvieron dentro de los rangos de peso esperados para machos de su edad.
Modificaciones de las ramificaciones dendríticas
Las reconstrucciones en dos dimensiones de neuronas piramidales de proyección córtico-facial de la capa V de la corteza motora primaria de las vibrisas de cada grupo (sham y lesión 1S, 3S y 5S) evidenciaron que, tras la lesión irreversible del nervio facial, se produjo una disminución en la cantidad de ramificaciones dendríticas y en la longitud de tales ramificaciones. Esta retracción de la arborización dendrítica de las neuronas piramidales córtico-faciales, fue más aparente en las dendritas apicales una semana después de la lesión (figura 4, 1S). La arborización apical se recuperó parcialmente a partir de las tres semanas, pero se produjo una progresiva reducción en la ramificación de las dendritas basales, que fue máxima a las cinco semanas (figura 4, 3S y 5S).
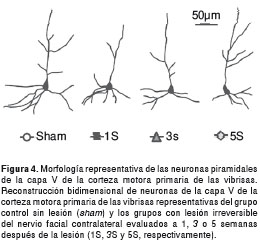
El análisis de Sholl mostró que la distribución de la media del número de ramificaciones como función de la distancia desde el soma neuronal en células piramidales córtico-faciales de la corteza motora primaria de las vibrisas de todos los grupos lesionados estuvo por debajo de la distribución observada en el grupo control (figura 5A), lo que indica una retracción del árbol dendrítico. Esta retracción se confirmó por la comparación entre grupos de la media del área bajo la curva de la distribución de ramificaciones en el análisis de Sholl.
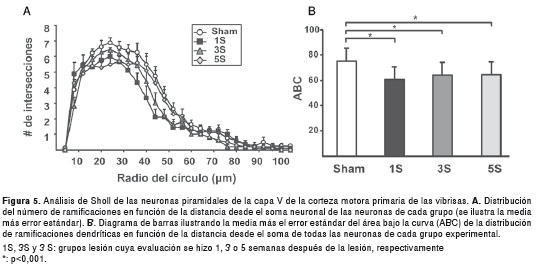
En efecto, el análisis de varianza mostró diferencias significativas entre grupos en la media del área bajo la curva (F(3,36)=8,03; p< 0,001). El análisis post hoc indicó una disminución significativa en el número de ramificaciones de las células piramidales de animales de los grupos lesión 1S, lesión 3S y lesión 5S respecto del control (p<0,001, figura 5 B), sin diferencias significativas al comparar los grupos lesionados entre sí (p>0,05), pese a observarse una tendencia hacia el aumento del área bajo la curva a las tres y cinco semanas después lesión.
Al comparar el área bajo la curva de la distribución de dendritas apicales, se encontró que era menor en todos los grupos lesionados que en el control (F(3, 36)=9.271; p<0,001; sham Vs. lesión 1S, p<0,001; sham Vs. lesión 3S, p<0,01; sham Vs. lesión 5S, p<0,05) y que la única diferencia entre grupos lesionados fue que el grupo lesión 5S tenía un área bajo la curva significativamente mayor que el grupo lesión 1S (p<0,05). Cuando se hizo la comparación de la distribución de las dendritas basales, se evidenció que era significativamente menor en todos los grupos lesionados que en el control (F(3, 36)=8.224; p<0,001; sham Vs. lesión 1S, p<0,05; sham Vs. lesión 3S, p<0,01; sham Vs. lesión 5S, p<0,001) y que no había diferencias significativas entre los grupos lesionados.
Discusión
En este estudio se encontró que, tras la lesión completa e irreversible de las ramas bucal y mandibular del nervio facial, las ratas presentan una parálisis irreversible de las vibrisas faciales del lado afectado. Sumado a la pérdida de la función motora, se observó una retracción significativa del árbol dendrítico de las células piramidales de la capa V de la corteza motora primaria de las vibrisas en el hemisferio contralateral. En el árbol apical la retracción fue pronunciada una semana después de la lesión y desde la tercera semana se evidenció aumento de la ramificación sin llegar al nivel de ramificación apical de los animales control. En contraste, en el árbol basal la retracción de las ramificaciones aumentó en función del tiempo desde la lesión irreversible del nervio facial.
Esta retracción que perduró, al menos, cinco semanas, no puede atribuirse a factores como la desnutrición de los animales lesionados por dificultades en su alimentación. En tal sentido, los animales con parálisis facial mostraron una ganancia de peso estadísticamente igual que los controles, durante el período en que se compararon. Más aun, los animales de los grupos lesión 3S y lesión 5S continuaron aumentando de peso dentro de los parámetros esperables para su edad. Tampoco se podrían atribuir los cambios observados a pérdida neuronal en la corteza motora primaria de las vibrisas, puesto que en anteriores experimentos con lesión irreversible del nervio facial y diferentes tiempos de recuperación, no hemos encontrado cambios significativos en la celularidad en cortes coronales de la corteza motora primaria de las vibrisas teñidos con violeta de cresilo (técnica de Nissl).
Si bien no se habían hecho estudios sobre la remodelación estructural de células piramidales córtico-faciales asociados a la lesión periférica del nervio facial, en estudios previos se han demostrado reestructuraciones en la morfología y fisiología de motoneuronas bulbares y medulares como consecuencia de lesiones de sus axones. Al ser privadas de sus dianas sinápticas tras lesiones de nervio periférico, las motoneuronas de animales adultos entran en un programa de regeneración que incluye retracción de sus arborizaciones dendríticas (25,26), incremento en la expresión de diversas proteínas, como BDNF (Brain Derived Neurotrophic Factor) (27), c-Fos y c-Jun (28), y cambios en las propiedades electrofisiológicas pasivas y activas (29-31).
Estas respuestas parecen facilitar la supervivencia de estas motoneuronas y la regeneración de sus axones cuando las lesiones son distales (32), pero no cuando las lesiones son muy cercanas al soma (33). No obstante, la retracción del árbol dendrítico de las motoneuronas implica que las neuronas premotoras (incluidas las neuronas piramidales de la capa V de la corteza motora primaria de las vibrisas) que proyectan sobre ellas queden parcialmente privadas de sus dianas sinápticas. Este fenómeno podría alterar el equilibrio trófico de las neuronas piramidales de la capa V de dicha corteza motora, lo cual explicaría en parte los cambios en la arborización dendrítica vistos en el presente trabajo. En estudios previos se han demostrado cambios en el fenotipo en neuronas premotoras que proyectan sobre motoneuronas lesionadas, como se ha descrito en las interneuronas internucleares del VI par craneal tras lesión tóxica de las motoneuronas del III par craneal (34).
Por otra parte, se ha demostrado que los cambios en los patrones de la actividad sensorial juegan un papel crucial en la determinación y mantenimiento de la morfología dendrítica de neuronas piramidales de las cortezas somatosensorial (18) y auditiva (23). Troncoso y Múnera (20) describieron que tras una lesión reversible de nervio facial (que permite, tras unas semanas, la recuperación funcional) se observan cambios transitorios en el procesamiento de información sensorial en la corteza motora primaria de las vibrisas contralateral durante las dos primeras semanas después de la lesión. Esta alteración en el procesamiento de información podría deberse al desequilibrio de las entradas somatosensoriales provocado por la inmovilidad de las vibrisas, lo que podría desencadenar una reorganización de las entradas sinápticas sobre las neuronas piramidales de la corteza motora primaria de las vibrisas e incidiría sobre la estructura del árbol dendrítico de tales neuronas.
El desequilibrio de las entradas sensoriales por la inmovilidad de las vibrisas y la pérdida de dianas sinápticas sobre las motoneuronas faciales, podrían explicar las modificaciones diferenciales en los árboles dendríticos apical y basal de las neuronas piramidales córtico-faciales. De esta forma, la retracción inicial de las ramificaciones apicales de las neuronas córtico-faciales podría estar relacionada con una disminución de las entradas sensoriales procedentes de la corteza somatosensorial primaria, cuyas neuronas de proyección córtico-cortical se ha demostrado que sufren modificaciones estructurales y funcionales con tratamientos que deterioran la entrada sensorial (18,19). La recuperación parcial de la ramificación apical podría estar relacionada con el fortalecimiento de las proyecciones horizontales procedentes de columnas vecinas encargadas de controlar movimientos de la extremidad anterior. En efecto, tales proyecciones son recíprocas, se distribuyen mayoritariamente en las láminas II y III de la corteza, y se reorganizan cuando se modifican los mapas de representación en la corteza motora de ratas (35).
Por otra parte, la retracción progresiva de las dendritas basales de neuronas córtico-faciales podría estar relacionada con un debilitamiento de las sinapsis excitadoras recurrentes (36). Tales entradas deberían dejar de tener sentido funcional después de la axotomía facial, ya que son importantes para la sincronización de múltiples neuronas córtico-faciales durante la generación de comandos motores para las vibrisas (37), lo que deja de ser posible tras el daño de las motoneuronas faciales.
Las modificaciones estructurales en la corteza motora primaria de las vibrisas identificadas en nuestro modelo experimental tras lesiones del nervio facial, podrían ocurrir en personas que han sufrido parálisis facial de diversa etiología. Más aún, tales cambios podrían ser el sustrato fisiopatológico de algunas de las secuelas funcionales que se observan en este tipo de pacientes (38,39).
Conflictos de interés
Los autores manifiestan que no tienen conflicto de interés con relación a la publicación de este artículo.
Financiación
Este trabajo fue realizado con el apoyo financiero de Colciencias (Código de proyecto: 1101-452- 21092) y la Fundación para la Promoción de la Investigación y la Tecnología, FPIT â 911 (Código de proyecto: 2425).
Correspondencia: Julieta Troncoso, Departamento de Biología, Universidad Nacional de Colombia, Ciudad Universitaria, Carrera 30 N° 45- 03, edificio 425, oficina 225, Bogotá, D.C., Colombia.
Teléfono: (571) 316-5000, extensión 15114 jtroncoso@unal.edu.co
Referencias
1. Laskawi R, Rohlmann A, Landgrebe M, Wolff JR. Rapid astroglial reactions in the motor cortex of adult rats following peripheral facial nerve lesions. Eur Arch Otorhinolaryngol. 1997;254:81-5. [ Links ]
2. Moran LB, Graeber MB. The facial nerve axotomy model. Brain Res Brain Res Rev. 2004;44:154-78. [ Links ]
3. Carvell GE, Simons DJ. Biometric analyses of vibrissal tactile discrimination in the rat. J Neurosci. 1990;10:2638-48. [ Links ]
4. Grinevich V, Brecht M, Osten P. Monosynaptic pathway from rat vibrissa motor cortex to facial motor neurons revealed by lentivirus-based axonal tracing. J Neurosci. 2005;25:8250-8. [ Links ]
5. Hattox AM, Priest CA, Keller A. Functional circuitry involved in the regulation of whisker movements. J Comp Neurol. 2002;442:266-76. [ Links ]
6. Wineski LE. Facial morphology and vibrissal movement in the golden hamster. J Morphol. 1985;183:199-217. [ Links ]
7. Dörfl J. The innervation of the mystacial region of the white mouse. A topographical study. J Anat. 1985;142:173-84. [ Links ]
8. Rice FL, Mance A, Munger BL. A comparative light microscopic analysis of the sensory innervation of the mystacial pad: Innervation of vibrissal follicle-sinus complexes. J Comp Neurol. 1986;252:154-74. [ Links ]
9. Izraeli R, Porter LL. Vibrissal motor cortex in the rat: Connections with the barrel field. Exp Brain Res. 1995;104:41-54. [ Links ]
10. Farkas T, Perge J, Kis Z, Wolff JR, Toldi J. Facial nerve injury-induced disinhibition in the primary motor cortices of both hemispheres. Eur J Neurosci. 2000;12:2190-4. [ Links ]
11. Landgrebe M, Laskawi R, Wolff JR. Transient changes in cortical distribution of S100 proteins during reorganization of somatotopy in the primary motor cortex induced by facial nerve transection in adult rats. Eur J Neurosci. 2000;12:3729-40. [ Links ]
12. Toldi J, Farkas T, Perge J, Wolff JR. Facial nerve injury produces a latent somatosensory input through recruitment of the motor cortex in the rat. Neuroreport. 1999;10:2143-7. [ Links ]
13. Donoghue JP, Suner S, Sanes JN. Dynamic organization of primary motor cortex output to target muscles in adult rats II. Rapid reorganization following motor nerve lesions. Exp Brain Res. 1990;79:492-503. [ Links ]
14. Sanes JN, Wang J, Donoghue JP. Immediate and delayed changes of rat motor cortical output representation with new forelimb configurations. Cereb Cortex. 1992;2:141-52. [ Links ]
15. Toldi J, Laskawi R, Landgrebe M, Wolff JR. Biphasic reorganization of somatotopy in the primary motor cortex follows facial nerve lesions in adult rats. Neurosci Lett. 1996;203:179-82. [ Links ]
16. Keller A, Weintraub ND, Miyashita E. Tactile experience determines the organization of movement representations in rat motor cortex. Neuroreport. 1996;7:2373-8. [ Links ]
17. Franchi G. Persistence of vibrissal motor representation following vibrissal pad deafferentation in adult rats. Exp Brain Res. 2001; 137:180-9. [ Links ]
18. Tailby C, Wright LL, Metha AB, Calford MB. Activitydependent maintenance and growth of dendrites in adult cortex. Proc Natl Acad Sci USA. 2005;102:4631-6. [ Links ]
19. Holtmaat A, Wilbrecht L, Knott GW, Welker E, Svoboda K. Experience-dependent and cell-type-specific spine growth in the neocortex. Nature. 2006;441:979-83. [ Links ]
20. Troncoso J, Múnera A. Cambios inducidos en la corteza motora primaria de la cara por lesión periférica del nervio facial contralateral. Acta Biológica Colombiana. 2008;13:220. [ Links ]
21. Alonso JR. Los métodos de Golgi. Salamanca: Ediciones Universidad de Salamanca; 1994. [ Links ]
22. Sholl DA. Dendritic organization in the neurons of the visual and motor cortices of the cat. J Anat. 1953;87:387-406. [ Links ]
23. Bose M, Muñoz-Llancao P, Roychowdhury S, Nichols JA, Jakkamsetti V, Porter B, et al. Effect of the environment on the dendritic morphology of the rat auditory cortex. Synapse. 2010;64:97-110. [ Links ]
24. Sánchez F, Gómez-Villalobos M de J, Juárez I, Quevedo L, Flores G. Dendritic morphology of neurons in medial prefrontal cortex, hippocampus, and nucleus accumbens in adult SH rats. Synapse. 2011;65:198-206. [ Links ]
25. Brännström T, Kellerth JO. Recovery of synapses in axotomized adult cat spinal motoneurons after reinnervation into muscle. Exp Brain Res. 1999;125:19-27. [ Links ]
26. Peyghambari F, Valojerdi MR, Tiraihi T. A morphometric study on the early stages of dendrite changes in the axotomized motoneuron of the spinal cord in newborn rats. Neurol Res. 2005;27:586-90. [ Links ]
27. Kobayashi NR, Bedard AM, Hincke MT, Tetzlaff W. Increased expression of BDNF and trkB mRNA in rat facial motoneurons after axotomy. Eur J Neurosci. 1996;8:1018- 29. [ Links ]
28. Schmitt AB, Breuer S, Liman J, Buss A, Schlangen C, Pech K, et al. Identification of regeneration-associated genes after central and peripheral nerve injury in the adult rat. BMC Neurosci. 2003;4:8-20. [ Links ]
29. Gustafsson B. Changes in motoneurone electrical properties following axotomy. J Physiol. 1979;293:197-215. [ Links ]
30. Laiwand R, Werman R, Yarom Y. Electrophysiology of degenerating neurones in the vagal motor nucleus of the guinea-pig following axotomy. J Physiol. 1988;404:749-66. [ Links ]
31. Mentis GZ, Díaz E, Moran LB, Navarrete R. Early alterations in the electrophysiological properties of rat spinal motoneurones following neonatal axotomy. J Physiol. 2007;582:1141-61. [ Links ]
32. Kassa RM, Bentivoglio M, Mariotti R. Changes in the expression of P2X1 and P2X2 purinergic receptors in facial motoneurons after nerve lesions in rodents and correlation with motoneuron degeneration. Neurobiol Dis. 2007;25:121- 33. [ Links ]
33. Mattsson P, Delfani K, Janson AM, Svensson M. Motor neuronal and glial apoptosis in the adult facial nucleus after intracranial nerve transection. J Neurosurg. 2006;104:411-8. [ Links ]
34. de la Cruz RR, Pastor AM, Delgado-García JM. Influence of the postsynaptic target on the functional properties of neurons in the adult mammalian central nervous system. Rev Neurosci. 1996;7:115-49. [ Links ]
35. Huntley GW. Correlation between patterns of horizontal connectivity and the extent of short-term representational plasticity in rat motor cortex. Cereb Cortex. 1997;7:143-56. [ Links ]
36. Mountcastle VB. The columnar organization of the neocortex. Brain. 1997;120:701-22. [ Links ]
37. Troncoso J, Múnera A, Delgado-García JM. Learningdependent potentiation in the vibrissal motor cortex is closely related to the acquisition of conditioned whisker responses in behaving mice. Learn Mem. 2007;14:84-93. [ Links ]
38. Pardal-Fernández JM, García-Álvarez G, Jerez-García P, Marco-Giner J, Almodóvar-Álvarez C. Parálisis facial periférica. Utilidad de la neurofisiología clínica. Rev Neurol. 2003;36:991-6. [ Links ]
39. Cárdenas CA, Múnera A. Changes in cutaneous sensibility in patients with Bell´s palsy. FENS Abstr. 2010;5:136. [ Links ]














