Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157versão On-line ISSN 2590-7379
Biomédica v.32 n.1 Bogotá jan./mar. 2012
ARTÍCULO ORIGINAL
1Grupo de Inmunodeficiencias Primarias, Universidad de Antioquia, Medellín, Colombia
2Facultad Nacional de Salud Pública, Universidad de Antioquia, Medellín, Colombia
3Departamento de Pediatría, Children´s Hospital, New Orleans, LA, USA
Contribución de los autores:
Lucía Carolina Leal-Esteban: autora principal, estandarización del ensayo y escritura del manuscrito.
Jessica Lineth Rojas, Andrea Lizeth Jaimes y Juan David Montoya: realización del ensayo.
Nilton Edu Montoya: revisión del análisis estadístico.
Lily Leiva: asesoría para la estandarización del ensayo y revisión del manuscrito.
Claudia Milena Trujillo-Vargas: coordinación del proyecto, revisión y aprobación del manuscrito.
Recibido: 07/07/11; aceptado:07/11/11
Introducción. Streptococcus pneumoniae es causante de gran morbimortalidad en niños pequeños y ancianos. Sin embargo, en Colombia no está disponible una prueba que evalúe la respuesta humoral a la vacunación específica contra este microorganismo.
Objetivo. Estandarizar en Colombia un ensayo inmunoenzimático para evaluar los niveles séricos de anticuerpos IgG contra diez serotipos de S. pneumoniae en respuesta a la vacunación específica y caracterizar esta respuesta en individuos sanos de nuestra población.
Materiales y métodos. Se hizo un ELISA en fase sólida utilizando como antígenos los polisacáridos capsulares 1, 3, 4, 5, 6B, 9V, 14, 18, 19F y 23F de S. pneumoniae.
Resultados. Los sueros de referencia y control reaccionaron fuertemente contra los polisacáridos evaluados, especialmente contra 14 y 19F. En los cinco niños sanos evaluados, los polisacáridos 5 y 19F presentaron los mayores títulos antes de la vacunación. Antes de la vacunación en los niños, y antes y después de la vacunación en los adultos, los polisacáridos 14 y 19F reaccionaron fuertemente. Para todos los polisacáridos, excepto para el 5, existe una relación inversa entre títulos altos de anticuerpos IgG antes de la vacunación y la razón de incremento de los títulos después de la misma.
Conclusión. Esta prueba ELISA cuantifica de forma confiable los niveles de IgG sérica contra diez serotipos de S. pneumoniae y, de acuerdo con los resultados obtenidos en individuos sanos de nuestra población, en este trabajo se validan los parámetros internacionales para considerar adecuada la respuesta a la vacuna 23-valente contra este microorganismo.
Palabras clave: prueba ELISA, inmunoglobulina G, polisacáridos, Streptococcus pneumoniae, suero, vacunas neumocócicas.
An immunoenzymatic test for IgG antibody levels against 10 serotypes of Streptococcus pneumoniae
Introduction. Streptococcus pneumoniae is a major cause of morbi-mortality in early childhood and elderly. However, a test to measure the antibody responses after specific vaccination is not available in Colombia.
Objective. An immunoenzymatic test was standardized for the measurement of serum IgG levels against 10 serotypes of S. pneumoniae in response to the specific vaccination.
Material and methods. Capsular polysaccharides 1, 3, 4, 5, 6B, 9V, 14, 18, 19F, 23F of S. pneumoniae were used as antigens in a solid-phase ELISA. These responses were characterized in a randomized selected healthy individuals from a Colombian population.
Results. The reference and control sera showed great reactivity against all the polysaccharides evaluated, especially against polysaccharide 14 and 19F. The lowest reactivity in these two sera was observed against polysaccharide 3 and 4. Among the children evaluated, polysaccharide 5/19F showed the highes pre-vaccination reactivity, and polysaccharide 14/19F showed the highest post-vaccination reactivity. Among the adults, polysaccharides 14 and 19F showed the greatest reactivity pre- and post-vaccination. For all the polysaccharides (excepting polysaccharide 5), an inverse association among high polysaccharide-specific pre-vaccination- and the increase of post-vaccination-IgG levels was observed.
Conclusion. This ELISA test reliably quantifies the serum levels of specific IgG against 10 serotypes of S. pneumoniae. According to the responses by healthy individuals, the current study validates parameters used internationally as an adequate the response to the 23-valent pneumococcal vaccine.
Keywords: Enzyme-linked immunosorbent assay, immunoglobulin G, polysaccharides, Streptococcus pneumoniae, serum, pneumococcal vaccines.
Streptococcus pneumoniae es un microorganismo que comprende más de 90 serotipos según la estructura de sus polisacáridos capsulares (1). Es mundialmente conocido por ser una causa importante de morbimortalidad, puede producir desde un compromiso leve de las vías respiratorias superiores hasta otitis media, neumonía, bacteriemia y meningitis (2).
Este microorganismo es causa del 30 a 60 % de los casos de otitis media aguda en todo el mundo (3). La Organización Mundial de la Salud (OMS) estima que 1,6 millones de personas, que incluyen aproximadamente 1 millón de niños menores de cinco años, mueren por enfermedad neumocócica invasiva anualmente, y los países en desarrollo son los que aportan el mayor número de casos.
En Colombia, para el año 2006, el Ministerio de la Protección Social estimó en 8 a 10 mil casos anuales de enfermedad grave por S. pneumoniae y alrededor de 700 muertes en menores de dos años. En mayores de 60 años, se estimó que ocurrían alrededor de 1.500 casos de enfermedad neumocócica invasiva y 6.000 neumonías por S. pneumoniae cada año (De la Hoz F, Álvis N, Narváez J, Orozco J. Evaluación del impacto epidemiológico y económico de la introducción de la vacuna del neumococo en Colombia. Infectio. 2008;12(Supl.1):90). A septiembre de 2011, el Instituto Nacional de Salud confirmó 75 casos de meningitis por S. pneumoniae en todo el país (4).
Por su parte, Castañeda, et al., identificaron 61 serotipos diferentes de S. pneumoniae en el país, con los serotipos 14, 1 y 6B como los principales causantes de neumonía en niños (5).
Actualmente, existen tres vacunas contra S. pneumoniae disponibles en Colombia. La vacuna 23-valente no conjugada contiene los polisacáridos purificados de 23 serotipos de S. pneumoniae. Se calcula que estos serotipos causan el 88 % de las enfermedades por este microorganismo (6). La eficacia de esta vacuna en los adultos jóvenes es de casi el 80 %, con una prevención de 60 a 70 % de las infecciones neumocócicas y del 90 % de las enfermedades neumocócicas invasivas (7). Más de 80 % de los adultos sanos que la reciben desarrollan anticuerpos contra los serotipos presentes en la vacuna, aproximadamente dos a tres semanas después de la vacunación. Los niveles de anticuerpos persisten por cinco años, pero pueden declinar más rápidamente en ancianos e individuos inmunodeficientes (8).
Otra de las vacunas disponibles en el mercado contiene siete de los serotipos más prevalentes de S. pneumoniae unidos por enlaces covalentes a una variante no tóxica de la toxina diftérica (vacuna conjugada), por lo cual se generan anticuerpos por medio de respuestas inmunitarias dependientes de linfocitos T. Esta vacuna fue incluida recientemente en el programa oficial de inmunizaciones en Colombia y se emplea en niños menores de dos años, los cuales presentan una deficiencia fisiológica transitoria para inducir respuestas de tipo T independiente.
En tercer lugar, hace aproximadamente un año se aprobó en nuestro país la vacuna conjugada 13-valente, indicada para la prevención de la enfermedad invasiva, neumonía y otitis media en lactantes y niños de dos meses a cinco años de edad (9).
Para la evaluación de los anticuerpos específicos contra S. pneumoniae, la OMS sugiere un ensayo inmunoenzimático (ELISA) basado en los serotipos incluidos en la vacuna 23-valente (10). Al comparar los niveles de anticuerpos IgG contra los polisacáridos evaluados, se deben tener en cuenta principalmente tres aspectos: que los títulos después de la vacunación alcancen un nivel superior a 1,3 µg/ml; que se incremente, al menos, cuatro veces el valor determinado antes de la vacunación, y que se alcance el nivel protector después de la vacunación contra 50 % o más de los polisacáridos evaluados en niños de dos a cinco años o contra 70 % o más de estos polisacáridos en niños mayores de seis años y adultos (11).
Es importante señalar que, a pesar de la importancia epidemiológica de este microorganismo, en Colombia no está disponible esta prueba para evaluar la respuesta a la vacunación específica. Esta evaluación es necesaria en la población general para determinar la efectividad de los esquemas de vacunación. No obstante, una de las mayores indicaciones clínicas para realizarla son los pacientes con algunas inmunodeficiencias primarias ya diagnosticadas o con sospecha de defectos en la respuesta inmunitaria humoral. Por ejemplo, se sabe que los individuos con síndrome de Wiskott-Aldrich, síndrome de hiperinmunoglobulinemia E, ataxia-telangiectasia, inmunodeficiencia común variable o asplenia congénita, entre otros, presentan defectos en la producción de anticuerpos contra antígenos T independientes y muestran una respuesta defectuosa a la vacuna 23-valente contra S. pneumoniae.
Además, existe una condición denominada deficiencia de anticuerpos específicos, en la que existen defectos en la producción de anticuerpos contra antígenos T independientes con niveles de inmunoglobulinas totales normales. Wasserman, et al., estiman que 5 a 10 % de los niños referidos para evaluación inmunológica por infecciones recurrentes sufren de esta deficiencia (12). Aunque no se ha logrado establecer la causa genética de este defecto, su diagnóstico oportuno es vital para brindar un adecuado manejo clínico al paciente.
Por otra parte, la medición de los niveles de anticuerpos contra S. pneumoniae sería de gran utilidad en la evaluación de la respuesta a la vacunación específica en otras personas muy propensas a la infección por este microorganismo, tales como niños, ancianos, individuos inmuno-comprometidos por otras causas como trasplantes, e individuos con esplenectomía.
En este trabajo se reporta la estandarización de una prueba ELISA para cuantificar los niveles séricos específicos de IgG contra polisacáridos de los serotipos 1, 3, 4, 5, 6B, 9V, 14, 18, 19F y 23F de S. pneumoniae, que incluyen también los polisacáridos de la vacuna conjugada.
Durante este proceso de estandarización, se prepararon los sueros de referencia y control de la prueba, y se evaluaron los títulos de IgG, antes de la vacunación específica y después de ella, en cinco niños y diez adultos sanos. Los sueros de referencia y de control local reaccionaron fuertemente contra todos los polisacáridos evalua-dos en el estudio, especialmente contra el 14 y el 19F. La reacción más débil se obtuvo contra el 3 y el 4. Por otro lado, todos los individuos sanos evaluados después de la vacunación tenían títulos protectores para siete o más de los polisacáridos de S. pneumoniae evaluados.
Para todos los polisacáridos, excepto para el 5, existe una relación inversa entre títulos altos de anticuerpos IgG antes de la vacunación y la razón de incremento de los títulos después de la misma. Estos resultados indican que esta prueba ELISA es una herramienta útil para evaluar la respuesta a la vacunación específica contra S. pneumoniae y validan los parámetros usados internacionalmente para considerar adecuada la respuesta a la vacuna 23-valente contra este microorganismo.
Materiales y métodos
Recolección y preparación de las mezclas de sueros
Tanto el suero de referencia como el control local se prepararon a partir de mezclas de sueros de seis individuos sanos, un mes después de la vacunación. El suero de referencia se tomó de tres hombres y tres mujeres, en un rango de edad de 23 a 40 años (mediana de 39,5 años); el suero control se tomó de tres hombres y tres mujeres en un rango de edad de 20 a 45 años (mediana de 44,5 años). A los cinco niños sanos, dos hombres y tres mujeres en un rango de edad de 3 a 7 años (mediana de 7 años) y diez adultos sanos, cinco hombres y cinco mujeres en un rango de edad de 20 a 45 años (mediana de 29 años), se les tomó una muestra de suero antes de la vacunación y otra muestra un mes después de recibir la vacuna Pneumo23® (Sanofi Pasteur, Francia). Los sueros se almacenaron a -20 °C hasta el momento de ser utilizados.
Todos los individuos ingresaron a este estudio previa firma del consentimiento informado. En el caso de los niños, sus padres o adultos responsables aprobaron y firmaron el consentimiento informado. El trabajo fue aprobado por el Comité de Bioética de la Sede de Investigación Universitaria de la Universidad de Antioquia.
ELISA para medir los niveles de IgG contra los diferentes polisacáridos de Streptococcus pneumoniae
Los niveles de anticuerpos IgG específicos contra los diez serotipos de S. pneumoniae evaluados, se determinaron mediante un protocolo de ELISA modificado basado en el descrito por Koskela en 1987 (13). Este método incluye un paso previo de doble adsorción de los sueros usando el PS-C (Statens Serum Institut, Copenhagen, Denmark) y el PS 22F (ATCC, Rockville, MD, USA).
Brevemente, se adicionaron cada uno de estos polisacáridos (ambos a una concentración final de 50 µg/ml) a las muestras de suero diluidas 1:10 y se incubaron durante 30 minutos a temperatura ambiente. Estos sueros diluidos y adsorbidos se diluyeron, además, hasta 1:200 (suero de referencia y de control, sueros de adultos después de la vacunación), 1:50 (sueros de niños después de la vacunación o adultos antes de la vacunación) o 1:10 (sueros de niños antes de la vacunación), inmediatamente antes de adicionarse a los platos de ELISA como muestras problema.
Para practicar el ELISA, los platos de 96 pozos (MaxiSorp, Nunc, Rochester, USA) se sensibilizaron con una concentración previamente establecida de cada uno de los antígenos polisacáridos (1 a 10 µg/ml; ATCC) diluida en PBS 1X (Gibco, Carlsbad, California, USA), para incubarse por cinco horas a 37 °C y, posteriormente, toda la noche a 4 ºC. Después de un lavado con PBS/Tween 20 al 0,05 % (Sigma-Aldrich, St. Louis, MO, USA), en los pozos iniciales de cada uno de los platos se agregaron 100 µl de las diluciones previamente adsorbidas del suero de referencia y de control, como también de las muestras problema separadamente y por duplicado.
A partir de estos pozos, se hicieron varias diluciones dobles seriadas, para luego incubar los platos por 2 horas a temperatura ambiente. Después de tres lavados con PBS/Tween, se adicionaron a cada pozo 50 µl de anticuerpo monoclonal antihumano IgGFc PAN proveniente de ratón (a una concentración final de 0,25 µg/ml), conjugado con peroxidasa de rábano (Hybridoma Reagent Labs, Baltimore, USA). Después del último periodo de incubación por dos horas a temperatura ambiente y cuatro lavados con PBS/Tween, se adicionó una solución de tetrametil-bencidina (Sigma-Aldrich) disuelta en solución tampón fosfato/citrato (Sigma-Aldrich), como sustrato de la reacción enzimática. La reacción se detuvo después de cinco minutos, adicionando 50 µl de ácido sulfúrico 2,5 N.
La densidad óptica se leyó a 450 nm en un lector de ELISA (BioTek Instruments, ELx808, Winooski, USA).
Para calcular la concentración de IgG específica para cada uno de los polisacáridos, se construyó una curva de calibración con los valores de densidad óptica del suero de referencia internacional FDA 89SF (gentilmente donado por Mila S. Blake, Division of Bacterial, Parasitic and Allergenic Products, FDA, Rockville, MD) o el suero de referencia local, según el caso. Posteriormente, se hizo una regresión lineal (coeficientes de correlación de cada curva mayor de 0,9) usando el programa Graphpad Prism, version 5.0c para Mac (GraphPad Software, San Diego, California, USA), y los resultados del suero de control local y de los sueros problema se interpolaron en µg/ml de anticuerpos IgG.
Análisis de las mezclas de suero de referencia y de control local
Veinte alícuotas del suero de referencia o de control local se analizaron por medio del ELISA para detectar IgG contra cada uno de los diez polisacáridos de S. pneumoniae, usando, como referencia para construir la curva de calibración del ensayo, el suero FDA 89SF o el suero de referencia local, respectivamente. Los 20 valores de densidad óptica obtenidos se convirtieron a concentración de IgG. Posteriormente, se calculó la media de estos 20 valores. El rango permitido para cada serotipo en el suero de control local corresponde a la media ± 2 DE. Este suero se utiliza como control interno del ELISA en cada ensayo.
Cálculos y análisis estadísticos
Para comparar la respuesta antes de la vacunación y después de ella contra cada uno de los polisacáridos evaluados en los 15 individuos vacunados, se utilizó la prueba de Wilcoxon para muestras pareadas. Por otra parte, se hizo una regresión lineal para correlacionar los niveles de anticuerpos antes de la vacunación y la razón del incremento después de la vacunación. Un valor de p menor de 0,05 se consideró significativo.
Resultados
Niveles de IgG contra cada uno de los polisacáridos de Streptococcus pneumoniae en los sueros de referencia y de control local
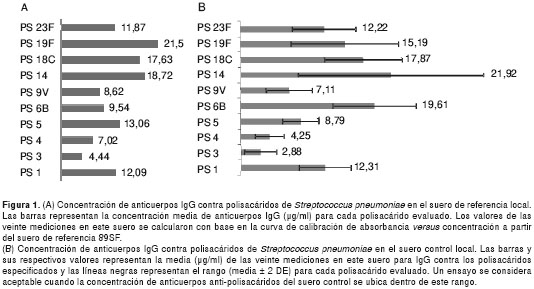
En la figura 1A se presenta la media de la concentración de los anticuerpos IgG para cada uno de los diez polisacáridos de S. pneumoniae incluidos en este estudio, en los sueros de referencia y de control local. También, se muestran los rangos (media ± 2 DE) de la concentración de IgG anti-S. pneumoniae para el suero de control local (figura 1B).
En general, el suero de referencia y el suero de control local mostraron una buena reacción contra todos los polisacáridos evaluados. Los niveles de anticuerpos IgG anti-S. pneumoniae fluctuaron entre 3,75 y 25,71 µg/ml. En orden creciente, los niveles de IgG en estos sueros, preparados a partir de mezclas de sueros de adultos sanos después de la vacunación, se distribuyeron así: anticuerpos anti-polisacáridos 3, 4, 9V, 6B, 23F, 1, 5, 18C, 14 y 19F, para el suero de referencia, y anticuerpos anti-polisacáridos 3, 4, 9V, 5, 23F, 1, 19F, 18C, 6B y 14, para el suero de control. Los polisacáridos 3 y 4 tuvieron una reacción dos a diez veces menor que los polisacáridos 6B, 14, 18C y 19F, para los cuales se observaron los mayores niveles de anticuerpos IgG.
Respuesta de anticuerpos específicos a la vacuna 23-valente para Streptococcus pneumoniae en niños sanos
Luego de analizar los sueros de referencia y de control local, se evaluó la respuesta de anticuerpos IgG a los 10 polisacáridos de S. pneumoniae después de la aplicación de la vacuna 23-valente en cinco niños sanos. Los títulos más bajos de IgG sérica anti-S. pneumoniae antes de la vacunación, se observaron para los polisacáridos 3 y 14 (en promedio 0,6 y 0,7 µg/ml, respectivamente).
Por otra parte, los polisacáridos 5 y 19F reaccionaron fuertemente antes de la vacunación, en promedio, 1,94 y 3,55 µg/ml, respectivamente. Al evaluar el número de sueros reactivos a cada polisacárido, se observó que: ninguno de los evaluados antes de la vacunación tenía títulos protectores para los polisacáridos 9V y 14; cuatro sueros tenían títulos de IgG protectores contra uno solo de los polisacáridos 1, 3, 4, 6B; sólo dos sueros tenían títulos protectores antes de la vacunación, específicamente contra el 18C, y además, tres sueros alcanzaron títulos protectores contra los 5 y 23F. Valga la pena anotar que todos los sueros de los niños tenían títulos protectores antes de la vacunación contra el PS19F.
Al evaluar la respuesta a la vacuna 23-valente en este grupo de niños, se observó que los títulos más bajos de IgG sérica eran aquellos contra el PS3 (promedio 2,4 µg/ml) y los más altos correspondían a aquellos contra los PS14 y 19F (en promedio, 9,5 y 18,15 µg/ml, respectivamente) (figura 2).
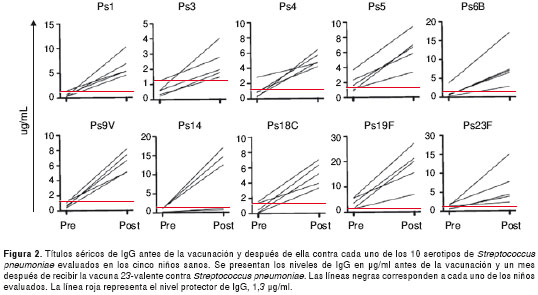
Todos los individuos presentaron una adecuada respuesta después de la vacunación, alcanzando títulos protectores (>1,3 µg/ml) para el 90 % o más de los 10 polisacáridos evaluados en este estudio. Sólo dos de los cinco niños incluidos, no alcanzaron un nivel protector de anticuerpos contra el polisacárido 14. Además, se observó un incremento de cuatro veces los títulos de antes de la vacunación para siete o más polisacáridos evaluados, en cuatro de los cinco niños.
En conclusión, teniendo en cuenta las edades de los niños sanos evaluados, todos cumplían con los parámetros de respuesta adecuada a la vacuna 23-valente contra S. pneumoniae.
Respuesta de anticuerpos específicos a la vacuna 23-valente para Streptococcus pneumoniae en adultos sanos
En la figura 3 se observan los niveles de IgG contra cada uno de los 10 polisacáridos de S. pneumoniae evaluados antes de la vacunación y después de ella en los 10 adultos sanos incluidos en este estudio. En este grupo, los polisacáridos que fueron menos reactivos antes de la vacunación fueron los 1 y 4 (en promedio 1,6 y 1,2 µg/ml, respectivamente). Por el contrario, los polisacáridos más reactivos fueron los 14 y 19F (en promedio, 7,46 y 4,55 µg/ml, respectivamente).
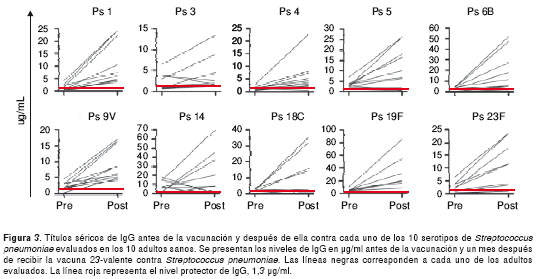
Al evaluar el número de sueros reactivos a cada polisacárido antes de la vacunación, para el 1 se observaron cuatro de diez sueros con títulos protectores de IgG; para cada uno de los polisacáridos 3 y 4, se observaron cinco sueros con niveles protectores de IgG; para cada uno de los polisacáridos 6B y 23F, se encontraron seis sueros con niveles protectores de IgG; para el polisacárido 18C, se observaron siete sueros con IgG que alcanzaban un nivel protector; para los polisacáridos 9V y 14, se encontraron ocho sueros con títulos de IgG que alcanzaban un nivel protector y, finalmente, para los polisacáridos 5 y 19F se observó la reacción más fuerte, ya que nueve sueros tenían títulos de IgG mayores de 1,3 µg/ml.
Después de la vacunación, los títulos de IgG más bajos se observaron contra los polisacáridos 3 y 4 (en promedio, 3,78 y 5,94 µg/ml, respectivamente). Por el contrario, se observaron los títulos más altos de IgG contra los polisacáridos 19F y 14 (en promedio, 24,9 y 19,6 µg/ml, respectivamente). Todos los adultos sanos incluidos en este grupo tenían títulos protectores (>1,3 µg/ml) después de la vacunación, para el 70 % o más de los polisacáridos de S. pneumoniae evaluados, como es de esperarse para individuos mayores de seis años. Los resultados más heterogéneos se observaron en los individuos en quienes se incrementaron cuatro veces los títulos antes de la vacunación, puesto que en este grupo se encontraron sólo dos individuos en quienes se cuadruplicaron los títulos contra ocho polisacáridos; en tres adultos, para siete polisacáridos; en dos adultos, para cinco polisacáridos, después de la vacunación; y en otros dos adultos, para cuatro polisacáridos.
Asimismo, se observó que en un adulto se cuadruplicaron los títulos después de la vacunación, solo para uno de los diez polisacáridos evaluados. Curiosamente, en tres adultos se presentó una considerable disminución en los títulos después de la vacunación, con respecto a aquellos antes de la vacunación, para el polisacárido 14. Sin embargo, la prueba de Wilcoxon para muestras pareadas, demostró que los niveles de anticuerpos después de la vacunación en el grupo de individuos vacunados (tanto niños como adultos) eran significativamente diferentes a aquéllos antes de la vacunación, para todos los polisacáridos evaluados.
Finalmente, se hizo un análisis de regresión lineal para comprobar si, tanto en niños como en adultos, los títulos altos de anticuerpos antes de la vacunación estaban relacionados con un menor incremento en estos títulos luego de la vacuna 23-valente.
En la figura 4 se observa la correlación entre el logaritmo natural de los títulos IgG antes de la vacunación para cada polisacárido evaluado y la razón del incremento de los títulos de IgG después de la misma. Para todos los polisacáridos, excepto para el 5, existe una relación inversa entre los títulos altos de anticuerpos IgG antes de la vacunación y la razón de incremento de los títulos después de la misma. El índice de correlación mayor (R2=0,797) se obtuvo al asociar el logaritmo natural de los niveles de IgG antes de la vacunación y la razón del incremento después de la misma, para el polisacárido 9V.
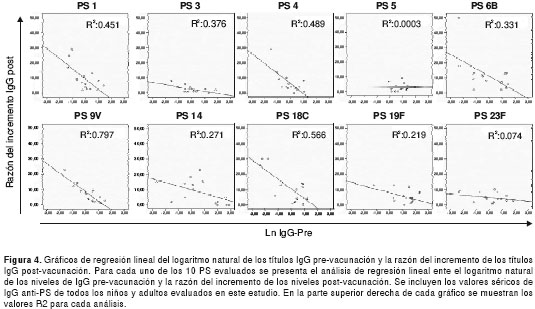
Teniendo en cuenta estos resultados, se podría inferir que, por cada unidad en µg/ml que aumenten los niveles de IgG anti-polisacárido 9V antes de la vacunación, se presenta un incremento de 0,0022 (antilogaritmo de la pendiente de esta recta) de estos anticuerpos después de la misma.
Discusión
En este estudio se reporta la estandarización de un ensayo para medir títulos de IgG sérica contra los serotipos 1, 3, 4, 5, 6B, 9V, 14, 18C, 19F y 23F de S. pneumoniae, basados en el método descrito por Koskela en 1987 y modificado en el 2000 para seguir los lineamientos de la OMS.
Esta entidad establece que las muestras de suero problema deben ser adsorbidas antes del análisis con los polisacáridos C y 22F (10). Esta adsorción es importante, ya que los polisacáridos capsulares específicos de serotipo purificados contienen, aproximadamente, 5 % (en peso) de polisacárido C contaminante. Entonces, es necesario neutralizar estos anticuerpos ya que no son específicos del polisacárido purificado y, además, no sufren opsonización ni protegen contra la infección neumocócica. Además, se ha reportado que esta infección induce la producción de anticuerpos contra un epítopo común presente en varios serotipos de S. pneumoniae que no es adsorbido con el polisacárido C, pero que puede ser removido usando el polisacárido 22F en una segunda adsorción (14). De esta forma, se logra incrementar la especificidad de la prueba, especialmente en muestras de suero previas a la vacunación, las cuales poseen mayor cantidad de anticuerpos inespecíficos adquiridos de forma transplacentaria o por la infección natural con este microorganismo u otros encapsulados (15). De esta manera, los títulos de anticuerpos específicos de serotipos determinados luego de la doble adsorción, se correlacionan mucho mejor con los anticuerpos funcionales medidos con el ensayo de opsonofagocitosis (16).
Otro aspecto importante por discutir son los pará-metros utilizados para considerar una adecuada respuesta a la vacuna 23-valente contra S. pneumoniae en los diferentes grupos de edad. Según Bonilla, et al., para interpretar estos resultados, se debe observar que se alcance un valor arbitrario de anticuerpos específicos después de la vacunación mayor o igual a 1,3 µg/ml o, al menos, que la razón de este incremento en comparación con los niveles previos a la vacunación sea mayor a 4 y el porcentaje de serotipos evaluados a los que el paciente responde adecuadamente.
En este estudio se adoptó, como nivel protector, una concentración de IgG igual o superior a 1,3 µg/ml para cada polisacárido, porque ese valor se ha asociado a protección contra la infección y, además, a una menor colonización neumocócica en nasofaringe de niños (17). Los títulos inferiores (0,15 µg/ml) se han asociado con protección contra enfermedad neumocócica invasiva, por ejemplo, septicemia (18). En adultos, la infección sistémica por S. pneumoniae es rara cuando los niveles de anticuerpos específicos son superiores a 1,5 µg/ml (19). Además, en niños entre los dos y cinco años de edad es normal esperar una adecuada respuesta a 50 % o más de los serotipos evaluados. Los niños sanos con más de 6 años de edad y los adultos, responden a 70 % o más de estos serotipos (11). Por último, se considera que un aumento de, al menos, cuatro veces los niveles de anticuerpos específicos contra los polisacáridos después de la vacunación, con relación a su valor antes de la vacunación, es adecuado en individuos sanos (11,19). Hedlung, et al., demostraron que los adultos mayores en quienes después de la vacunación se hayan cuadriplicado sus niveles de anticuerpos, con respecto a los previos, tienen un riesgo mucho menor de sufrir de neumonía neumocócica recurrente en comparación con los que presenten un menor incremento en dichos niveles (20).
Aunque existen muchos debates sobre la precisión de la prueba ELISA para determinar los niveles de anticuerpos contra los polisacáridos de S. pneumoniae y sobre los parámetros que deben considerarse para definir una respuesta apropiada, los presentes resultados validan las recomendaciones actuales para interpretar esta respuesta, ya que todos los individuos incluidos en este estudio eran sanos y, efectivamente, presentaban una respuesta adecuada a los polisacáridos de S. pneumoniae después de la vacunación.
En un estudio de Kamchaisatian, et al., también se validaron estos criterios en niños de 2 a 15 años, 95 controles y 22 infectados con el virus del VIH (21). Sin embargo, los controles que se utilizaron en este estudio eran individuos que habían sido remitidos para evaluación inmunológica por sospecha de inmunodeficiencia y, por consiguiente, no podrían considerarse controles sanos.
Por el contrario, en el presente estudio se incluyeron tanto niños como adultos jóvenes que no presentaban ningún tipo de sintomatología ni infecciones recurrentes, tumores, manifestaciones autoinmunitarias ni otras enfermedades en el momento de la toma de las muestras y, por lo tanto, confirma contundentemente la especificidad de los parámetros para evaluar las respuestas a la vacuna 23-valente. La respuesta inmunológica a esta vacuna se considera independiente del timo de tipo 2, en la cual, los linfocitos B1b y los linfocitos B de la zona marginal son los principales responsables de la producción de anticuerpos contra este tipo de antígenos (22).
A partir de 1980, se describen pacientes con niveles séricos normales de inmunoglobulinas que presentaban deficiencia de anticuerpos hacia antígenos T independientes. Desde ese entonces, el uso de la vacuna de polisacáridos de S. pneumoniae para valorar la respuesta de anticuerpos específicos, aumentó significativamente el diagnóstico del síndrome de deficiencia de anticuerpos específicos (23).
La importancia de contar con esta prueba ELISA en nuestro país es que, a medida que se acumula experiencia con pacientes que padecen este síndrome, también emerge mayor conocimiento de su variabilidad fenotípica, ya que existen deficiencias completas o parciales, permanentes o transitorias, aisladas o asociadas a otras anormalidades y, además, solamente de polisacáridos purificados o de polisacáridos conjugados a proteínas (24). Este conocimiento tiene gran impacto en la caracterización y el pronóstico clínico de estos pacientes.
En el presente estudio se observó que el suero de algunos de los adultos sanos presentaba niveles considerablemente menores de anticuerpos para el serotipo 14 después de la vacunación, en comparación con los niveles previos. Se ha planteado que las deficiencias en la respuesta adecuada a los serotipos de S. pneumoniae después de la vacunación, pueden explicarse porque la colonización nasofaríngea o las infecciones recientes con un serotipo específico inducen una interacción de grandes cargas de polisacáridos con el sistema inmunitario, lo cual induce una depleción de las células B de memoria específicas contra este serotipo (25). Esta hipótesis se ha demostrado también en ratones inoculados con grandes dosis de polisacáridos de S. pneumoniae, las cuales logran actuar como un agente inhibidor del sistema inmunitario (25).
Por otra parte, Castañeda, et al., reportaron que el serotipo 14 de S. pneumoniae es el más frecuente en América Latina, en aislamientos de niños menores de 6 años con neumonía, meningitis y otras enfermedades invasivas (5). A pesar de estos hallazgos, en los presentes resultados se encuentra que ninguno de los niños sanos evaluados antes de recibir la vacuna 23-valente para S. pneumoniae tenía títulos protectores de IgG contra el polisacárido 14. Sin embargo, la frecuencia de los aislamientos de cultivos de S. pneumoniae no necesariamente se correlaciona con la magnitud de la reacción a los polisacáridos de estos serotipos antes de la vacunación, ya que algunos de ellos pueden ser muy frecuentes en la población y, además, son poco inmunógenos, lo que aumenta aún más su capacidad patógena (26,27).
En conclusión, nuestros datos presentan los resultados de la estandarización de la prueba ELISA para la detección de los niveles de anticuerpos contra S. pneumoniae y validan los parámetros usados internacionalmente para considerar adecuada la respuesta a la vacuna 23-valente contra este microorganismo. Además se confirma que los polisacáridos 14 y 19F son muy inmunógenos luego de la aplicación de la vacuna 23-valente, tanto en niños como en adultos, y que para todos los polisacáridos excepto para el polisacárido 5, los altos niveles de anticuerpos antes de la vacunación se correlacionan con un menor incremento en los títulos posteriores a la misma. Prospectivamente, es imprescindible hacer una búsqueda activa de pacientes cuya sintomatología clínica sugiera defectos en las respuestas T independientes y estudiar los defectos moleculares asociados con esta condición clínica.
En la realización del presente trabajo, ninguno de los autores declara conflicto de interés financiero, político o académico.
Este trabajo fue llevado a cabo con el apoyo económico de la Estrategia de Sostenibilidad 2009-2011 de la Vicerrectoría de Investigación, Universidad de Antioquia; el Departamento Administrativo de Ciencia, Tecnología e Innovación, Colciencias (proyecto 111540820536); el programa Jóvenes Investigadores de Colciencias y la Fundación “Diana García de Olarte” para las Inmunodeficiencias Primarias (Colombia).
Correspondencia: Lucía Carolina Leal-Esteban, Sede de Investigación Universitaria, Calle 62 N° 52-59, laboratorio 530, Medellín, Colombia Teléfono: (574) 219-6472; fax:(574) 219-1065 cesteban01@hotmail.comcesteban01@hotmail.com
1. Henrichsen J. Six newly recognized types of Streptococcus pneumoniae. J Clin Microbiol. 1995;33:2759-62. [ Links ]
2. Konradsen HB, Kaltoft MS. Invasive pneumococcal infections in Denmark from 1995 to 1999: Epidemiology, serotypes, and resistance. Clin Diagn Lab Immunol. 2002;9:358-65. [ Links ]
3. Rodgers GL, Arguedas A, Cohen R, Dagan R. Global serotype distribution among Streptococcus pneumoniae isolates causing otitis media in children: Potential implications for pneumococcal conjugate vaccines. Vaccine. 2009;27:3802-10. [ Links ]
4. Instituto Nacional de Salud. Boletín Epidemiológico Semanal, semana 39. Fecha de consulta: 1° de noviembre de 2011. Disponible en: http://www.ins.gov.co/?idcategoria=90955. [ Links ]
5. Castañeda E, Agudelo CI, Regueira M, Corso A, Brandileone MC, Brandao AP, et al. Laboratory-based surveillance of Streptococcus pneumoniae invasive disease in children in 10 Latin American countries: A SIREVA II project, 2000-2005. Pediatr Infect Dis J. 2009;28:e265-70. [ Links ]
6. Coughlin RT, White AC, Anderson CA, Carlone GM, Klein DL, Treanor J. Characterization of pneumococcal specific antibodies in healthy unvaccinated adults. Vaccine. 1998;16:1761-7. [ Links ]
7. Sabin Vaccine Institute. Simposio Subregional de Nuevas Vacunas: neumococo, rotavirus y VPH. Acta del Simposio Subregional de Nuevas Vacunas: neumococo, rotavirus y VPH, 2008. Fecha de consulta: 1 de noviembre 1 de 2011. Disponible en: http://www.sabin.org/files/attachment/Acta%20del%20Simposio%20Subregional%20de%20Nuevas%20Vacunas-%20Neumococo,%20Rotavirus%20y%20VPH.pdf. [ Links ]
8. Medscape. Pneumococcal vaccine polyvalent. Fecha de consulta: ¿Día? de enero de 2011. Disponible en: http://www.medscape.com/druginfo/monograph?cid=med&drugid=5546&drugname=Pneumovax+23+Inj&monotype=monograph&secid=6. [ Links ]
9. Instituto Nacional de Vigilancia de Medicamentos y Alimentos. Registros concedidos o renovados en febrero de 2010. Fecha de consulta: 6 de noviembre 6 de 2011. Disponible en: http://web.sivicos.gov.co/registros/201002.htm. [ Links ]
10. WHO Pneumococcal Serology Reference Laboratories. Training manual for enzyme linked immunosorbent assay for the quantitation of Streptococcus pneumoniae serotype specific IgG (Pn PS ELISA). Fecha de consulta: 10 de enero 2011. Disponible en: http://www.vaccine.uab.edu/ELISA%20protocol.pdf. [ Links ]
11. Bonilla FA, Bernstein IL, Khan DA, Ballas ZK, Chinen J, Frank MM, et al. Practice parameter for the diagnosis and management of primary immunodeficiency. Ann Allergy Asthma Immunol. 2005;94(Suppl.1):S1-63. [ Links ]
12. Wasserman RL, Sorensen RU. Evaluating children with respiratory tract infections: The role of immunization with bacterial polysaccharide vaccine. Pediatr Infect Dis J. 1999;18:157-63. [ Links ]
13. Koskela M. Serum antibodies to pneumococcal C polysaccharide in children: Response to acute pneumococcal otitis media or to vaccination. Pediatr Infect Dis J. 1987;6:519-26. [ Links ]
14. Concepcion NF, Frasch CE. Pneumococcal type 22f polysaccharide absorption improves the specificity of a pneumococcal-polysaccharide enzyme-linked immuno-sorbent assay. Clin Diagn Lab Immunol. 2001;8:266-72. [ Links ]
15. Henckaerts I, Goldblatt D, Ashton L, Poolman J. Critical differences between pneumococcal polysaccharide enzyme-linked immunosorbent assays with and without 22F inhibition at low antibody concentrations in pediatric sera. Clin Vaccine Immunol. 2006;13:356-60. [ Links ]
16. Romero-Steiner S, Frasch CE, Carlone G, Fleck RA, Goldblatt D, Nahm MH. Use of opsonophagocytosis for serological evaluation of pneumococcal vaccines. Clin Vaccine Immunol. 2006;13:165-9. [ Links ]
17. Lawrence EM, Edwards KM, Schiffman G, Thompson JM, Vaughn WK, Wright PF. Pneumococcal vaccine in normal children. Primary and secondary vaccination. Am J Dis Child. 1983;137:846-50. [ Links ]
18. Paris K, Sorensen RU. Assessment and clinical interpretation of polysaccharide antibody responses. Ann Allergy Asthma Immunol. 2007;99:462-4. [ Links ]
19. Landesman SH, Schiffman G. Assessment of the antibody response to pneumococcal vaccine in high-risk populations. Rev Infect Dis. 1981;3(Suppl.)S184-97. [ Links ]
20. Hedlund J, Ortqvist A, Konradsen HB, Kalin M. Recurrence of pneumonia in relation to the antibody response after pneumococcal vaccination in middle-aged and elderly adults. Scand J Infect Dis. 2000;32:281-6. [ Links ]
21. Kamchaisatian W, Wanwatsuntikul W, Sleasman JW, Tangsinmankong N. Validation of current joint American Academy of Allergy, Asthma & Immunology and American College of Allergy, Asthma and Immunology guidelines for antibody response to the 23-valent pneumococcal vaccine using a population of HIV-infected children. J Allergy Clin Immunol. 2006;118:1336-41. [ Links ]
22. Sanz I, Wei C, Eun-Hyung Lee F, Anolik J. Phenotypic and functional heterogeneity of human memory B cells. Semin Immunol. 2008;20:67-82. [ Links ]
23. Ferreyra P, Nagao A, Costa-Carvalho B, Carneiro-Sampaio M. Syndrome of anti-polysaccharide antibodies deficiency with normal levels of immunoglobulins. Arch Alergia Inmunol Clin. 2001;32:109-16. [ Links ]
24. Sorensen R. Deficiencia de anticuerpos con inmuno-globulinas normales. Fecha de consulta: 6 de noviembre de 2011. Disponible en: http://www.archivos.alergia.org.ar/material/12002/2002_01_06_comentarios2.pdf. [ Links ]
25. Borrow R, Stanford E, Waight P, Helbert M, Balmer P, Warrington R, et al. Serotype-specific immune unresponsiveness to pneumococcal conjugate vaccine following invasive pneumococcal disease. Infect Immun. 2008;76:5305-9. [ Links ]
26. Douglas RM, Paton JC, Duncan SJ, Hansman DJ. Antibody response to pneumococcal vaccination in children younger than five years of age. J Infect Dis. 1983;148:131-7. [ Links ]
27. Boyle RJ, Le C, Balloch A, Tang ML. The clinical syndrome of specific antibody deficiency in children. Clin Exp Immunol. 2006;146:486-92. [ Links ]














