Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157
Biomédica vol.32 no.3 Bogotá jul./set. 2012
https://doi.org/10.7705/biomedica.v32i3.669
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v32i3.669
1Grupo de Inmunología Molecular, Centro de Investigaciones Biomédicas, Facultad de Medicina, Universidad del Quindío, Armenia, Colombia
2Programa de Biología, Facultad de Ciencias Básicas y Tecnológicas, Universidad del Quindío, Armenia, Colombia
Institución donde se realizó el trabajo:
Centro de investigaciones Biomédicas, Universidad del Quindío
Contribución de los autores:
Germán Alberto Téllez: mantenimiento de la colonia, tratamiento y valoración de los pacientes, participación en la elaboración del manuscrito y revisión de los datos.
Mónica Alejandra Acero y Luz Adriana Pineda: mantenimiento de la colonia, toma y procesamiento de las muestras, revisión de los datos y participación en la elaboración de manuscrito.
Jhon Carlos Castaño: participación en la elaboración de manuscrito y en la revisión de los datos.
Recibido: 30/05/11; aceptado:10/03/12
Introducción. Las úlceras crónicas son una afección con un impacto negativo importante en la calidad de vida de los pacientes y en el sistema de salud; la aparición de infecciones y su difícil manejo, así como la presencia de tejido necrótico, afectan el pronóstico de curación. La larvaterapia se presenta como una opción para el desbridamiento y el manejo de infecciones de úlceras crónicas.
Objetivo. Evaluar la larvaterapia en heridas con poca carga de tejido necrótico y evaluar las excreciones, secreciones y la hemolinfa de las larvas, respecto a su contenido enzimático.
Materiales y métodos. Se reporta una serie de tres casos clínicos con úlceras crónicas y poca carga de tejido necrótico, tratados con larvaterapia, y se evalúa su evolución por los índices PUSH (Pressure Ulcer Scale for Healing) y Wound Bed Score, así como el patrón electroforético y contenido enzimático por zimograma de las excreciones y secreciones, y de la hemolinfa de las larvas.
Resultados. Con solo una aplicación de la larvaterapia se evidenció una mejoría del aspecto de la herida y en los puntajes evaluados; en el PUSH hubo una disminución de 2,3 puntos, en promedio, y con el Wound Bed Score, un incremento de 2,7, lo que demuestra una mejoría en ambas escalas.
Conclusión. Se encontró una actividad enzimática diversa en su contenido de excreciones y secreciones, con predominio de actividad de la proteasa de tipo serina.
Palabras clave: úlceras de la pierna, desbridamiento, larva, cuidados de la piel, cicatrización de heridas, enzimas.
doi: http://dx.doi.org/10.7705/biomedica.v32i3.669Effect of maggot therapy on minimally necrotic tissues: characterization of larval enzymatic excretion/secretion
Introduction. Chronic leg ulcers are a burden for the health system and impact quality of life. The infections, the necrotic tissue and the difficult treatment affects the prognosis and healing time. Maggot therapy is presented as an acceptable alternative for the debridement and treatment of this pathology.
Objective. The larval therapy was assessed on chronic leg ulcers with little necrotic tissue. Larval excretion and secretion (E/S) was characterized with respect to hemolymph (HL) enzymatic content.
Materials and methods. Three patients with chronic leg ulcers and low necrotic tissue were treated with larval therapy and were assessed with the PUSH (pressure ulcer scale for healing) and Wound Bed Score. E/S and HL content was evaluated by SDS PAGE and zymogram.
Results. The clinical aspect of the wounds showed improvement, and the scores demonstrated an average decrease of 2.3 for the PUSH and an average increase of 2.7 for the Wound Bed Score. A wide diversity of enzymatic activity in the E/S was demontrated with major activity belonging to serine protease family.
Conclusions. Maggot therapy proved an effective treatment in cases with minimal tissue necrosis and can be considered a viable treatment option.
Key words: leg ulcer, debridement, larva, skin care, wound healing, enzymes.
doi: http://dx.doi.org/10.7705/biomedica.v32i3.669
La larvaterapia consiste en la aplicación de larvas vivas de moscas, microbiológicamente estériles –en especial, Lucilia sericata– sobre diversas lesiones de piel, tejidos blandos y hueso, que incluyen úlceras de pie diabético, úlceras posquirúrgicas infectadas, úlceras de decúbito, úlceras por estasis venosa y quemaduras. Este tratamiento se ha usado en pacientes hospitalizados y ambulatorios.
Las heridas crónicas son una afección de importancia médica que se presenta en 0,18 a 1,3 % de la población adulta, con un impacto considerable sobre la calidad de vida, especialmente de los adultos mayores (1). Las heridas crónicas más frecuentes son las úlceras venosas, con una prevalencia de 1 % para la población general (2). Los pacientes con diabetes tienen un riesgo anual entre 2 y 5 %, y durante toda su vida uno de 15 %, de desarrollar úlceras en los miembros inferiores; además, el 3 % de las hospitalizaciones de los diabéticos se atribuyen a úlceras en los miembros inferiores (3). Otra de las causas más importantes de heridas crónicas son las úlceras por presión, una de las complicaciones más comunes de las lesiones que afectan el sistema motor, el sensorial y el cognitivo. La incidencia de úlceras por presión en el ambiente hospitalario ha sido reportada hasta en 38 %. Las úlceras por presión incrementan la duración y los costos de hospitalización, así como el riesgo de muerte, entre 4 y 6 veces (4). En el aspecto económico, las heridas crónicas representan gastos por cerca de un billón de dólares por año para el sistema de salud en los Estados Unidos y cerca de siete billones de dólares a nivel mundial (5).
El tratamiento de las heridas crónicas requiere una mirada multidisciplinaria para lograr las metas sobre los diferentes factores que afectan la curación, como la humedad, la presión, la infección, el tejido necrótico, la edad, el estado nutricional y y las enfermedades concomitantes. El desbridamiento es un componente crítico, al disminuir la carga infecciosa y el tejido necrótico, y facilitar la función celular al retirar las células muertas y factores proinflamatorios que retrasan el proceso de curación (6). Sin embargo, muchas de las heridas crónicas no tienen una gran carga de tejido infeccioso o necrótico y, por lo tanto, desde una perspectiva convencional, la larvaterapia no estaría indicada en ellas. Se ha encontrado que la larvaterapia no solo se restringe al desbridamiento sino que, además, estimula la actividad en la promoción de la cicatrización con incremento del tejido granular y estimulación de la angiogénesis; por lo tanto, se evaluó la utilidad de la larvaterapia en heridas con poca carga de tejido necrótico o infeccioso.
A pesar de que se conocen algunos elementos clave de los mecanismos de acción de la larvaterapia aún quedan preguntas por responder, como la selectividad de la actividad enzimática por el tejido necrótico y los mecanismos promotores de la cicatrización. Por ello, es importante determinar los componentes mayoritarios de los productos de excreción y secreción de las larvas, y determinar su actividad enzimática, para explicar estos efectos.
Materiales y métodos
Cultivo y procesamiento de las larvas
El método utilizado para la producción de las larvas consistió en la captura ambiental de las moscas con trampa de hígado y posterior identificación de las larvas, en los alrededores del Centro de Investigaciones Biomédicas de la Universidad del Quindío, latitud 4° 33´ 33,37” norte con longitud 75° 39´ 58,78” oeste, a 1.483 msnm (7). Se criaron las moscas en cautiverio en el laboratorio, alimentándolas con glucosa al 10 % (p/v) e hígado para inducir la ovipostura (8). El proceso de descontaminación se siguió tomando los huevos del hígado, seguido de lavado e incubación por 20 minutos en una solución de formaldehído al 2,5 % (v/v) y sulfito de sodio al 1 % (p/v); posteriormente, se lavaron con solución de cloruro de sodio al 0,9 % (p/v), en una cabina de flujo laminar y, finalmente, se hizo control de contaminación en agar sangre, chocolate y tioglicolato (9).
Protocolo de manejo clínico
Se hizo una valoración clínica inicial mediante registro fotográfico y el diligenciamiento de una ficha de valoración clínica de la herida, con base en los registros de las variables siguientes: tamaño en cm2, tomando la mayor longitud por el mayor ancho; porcentaje de tejido necrótico o infectado; apariencia de la herida; profundidad; tipo y cantidad de exudado y presencia e intensidad de dolor, características de la piel alrededor de la lesión y signos de infección.
El análisis de los datos clínicos se hizo aplicando los puntajes de valoración de la herida por medio del PUSH (Pressure Ulcer Scale for Healing) y el Wound Bed Score, antes de la larvaterapia y después de ella (10,11). Asimismo, se obtuvo el consentimiento informado, y se educó al paciente y la familia sobre la larvaterapia.
Aplicación del tratamiento
Se tomaron larvas de primer estadio que pasaron los controles de esterilidad microbiológica a las 24 horas y se aplicaron de 5 a 10 larvas por cm2. La técnica de aplicación se hizo primero lavando la herida con solución salina estéril, cubriendo los bordes con cinta de papel adhesiva hipoalérgica (Micropore 3M®); posteriormente, se aplicaron las larvas en la base de la herida y se cubrieron con una malla de nailon estéril, la cual se había cortado previamente según la forma de la herida, y se pegó a la cinta hipoalérgica con esparadrapo. Finalmente, se cubrieron con una gasa estéril, la cual se cambió cada 12 horas. Se hicieron valoraciones telefónicas a las 24 horas y control clínico a las 72 horas para retirar las larvas, y valoración clínica posterior al tratamiento.
Se incluyeron tres pacientes con úlceras de miembros inferiores, de octubre a diciembre de 2008 en el Servicio de Consulta Externa del Centro de Salud de la Facultad de Ciencias de la Salud de la Universidad del Quindío.
Caso 1. Se trata de un paciente de sexo masculino de 35 años de edad, con diabetes de 15 años de evolución, antecedentes de amputación por úlcera seis meses antes del tratamiento con larvas y posterior osteomielitis.
Consultó por presentar pie diabético con úlcera de tres meses de evolución en la cara plantar del pie izquierdo sobre la base del segundo metatarsiano. En la consulta inicial presentaba una herida con maceración de la piel y callo alrededor de la lesión con borde en expansión de 8,7 cm2, sin signos de infección ni base necrótica.
Caso 2. Se trata de una paciente de sexo femenino, de 70 años de edad, con úlcera varicosa de dos meses de evolución, con tejido mucopurulento, edema alrededor de la lesión e hiperemia en la cara lateral de la pierna izquierda, en tratamiento con ambramicina y sulfaplata tópica en el último mes sin mejoría.
Caso 3. Se trata de una paciente de sexo femenino, de 68 años de edad, con úlcera varicosa de un mes de evolución, con eritema y exudado seroso, en tratamiento con dicloxacilina durante ocho días sin mejoría.
Obtención de los productos de excreciones y secreciones
Este procedimiento se llevó a cabo según lo descrito por Cazander, et al. (12), con algunas modificaciones. Se tomaron larvas de segundo estadio, se lavaron con cloruro de sodio al 0,9 % (p/v); dado que algunas larvas continuaban con detritus del medio de cultivo agar hígado, se lavaron en etanol al 70 % por 10 minutos, sin afectar la viabilidad de las larvas; finalmente, se lavaron con cloruro de sodio al 0,9 % (p/v) y se secaron con papel filtro estéril. Posteriormente se transfirieron a un tubo estéril de 50 ml, donde por cada 100 larvas se adicionaron 100 µl de cloruro de sodio al 0,9 % (p/v). Enseguida, las larvas se incubaron a 37 °C y cada hora el producto de excreciones y secreciones fue removido y almacenado en alícuotas de 200 µl a -70 °C hasta su uso posterior.
Obtención de la hemolinfa de las larvas
Se siguió la metodología propuesta por Huberman, et al. (13), en la cual las larvas desinfectadas de segundo estadio fueron removidas asépticamente de los frascos con agar hígado, y se lavaron con cloruro de sodio al 0,9 %. Posteriormente, bajo condiciones estériles, las larvas se secaron con papel absorbente y, con la ayuda de una tijera, se les cortó la parte apical y se transfirieron a un vial de 50 ml con agua estéril, en donde se centrifugó a 1.680g durante una hora a 4 °C; el sobrenadante se guardó a -70 °C hasta su uso posterior.
Electroforesis en gel de acrilamida-bisacrilamida
Se practicó SDS-PAGE, siguiendo los procedimientos descritos por Sambrook y Russell (14); se corrieron las muestras en gel de acrilamida-bisacrilamida al 10 % para el gel de corrido y al 5 % para el gel de resolución en una minicámara de electroforesis Fisher Biotech (Vertical Electrophoresis SystemTM de 10 x 10 cm), a 8 °C y 70 V. Los geles se tiñeron con solución de coloración (azul de Coomassie R-250 al 0,1 %, metanol al 40 % y ácido acético al 10 %), y luego se destiñeron con solución decolorante (metanol al 40 %, v/v, y ácido acético al 5%, v/v). Como patrón se utilizó un marcador de peso molecular medio (Prestained SDS-PAGETM, Bio-Rad).
Zimograma
Se aplicó la técnica según lo descrito por Choi, et al. (15); brevemente, se corrieron las muestras en un gel de electroforesis no desnaturalizador de acrilamida al 12 % (p/v) y bisacrilamida al 0,32 % (p/v), copolimerizado con gelatina al 0,12 % (p/v) o caseína al 0,12 % (p/v). Después de la electroforesis, el gel se incubó por 30 minutos en agitación constante a temperatura ambiente con un tampón de limpieza [Tritón X-100 al 2,5 % (pH 7,4)] y, consecutivamente, se lavó con agua estéril. Posteriormente, se incubó el gel por 12 horas a 37 °C en tampón de reacción (30mM Tris-HCl, pH 7,4, 200mM NaCl, 10mM CaCl2, Tween 20 0,02%) y, por último, se tiñó con azul de Coomassie por dos horas y se destiñó con solución de decoloración (metanol al 10 %, v/v, y ácido acético al 5 %, v/v) por tres horas en agitación constante a 80 rpm.
Para evaluar la familia de las proteasas de los productos de la hemolinfa de las larvas, excreciones y secreciones, se llevó a cabo un ensayo de zimograma como se describió previamente, pero se incubó la muestra previamente por una hora con inhibidores de proteasas específicos, como EDTA (100 µM), leupeptina (300 µM), pepstatina A (100 µM), L-1-cloro-3-(4-tosilamido)-4-fenil-2-butanona (TPCK)(100 mM) y 4-(2- aminoetil) benzenosulfonilfluoruro (AEBSF) (100 µM).
Aspectos bioéticos
Los pacientes tratados con tratamiento larvario aceptaron su participación mediante un proceso de consentimiento informado de acuerdo con la Resolución 8430 de 1993. La información clínica y fotográfica que se presenta fue aprobada por los pacientes y se garantizó su confidencialidad. El proyecto fue avalado por el Comité de Bioética de la Universidad del Quindío.
Resultados
Los resultados de la evaluación y el seguimiento del efecto de la larvaterapia sobre el pronóstico de curación de la herida con los puntajes Wound Bed Score y PUSH al inicio del tratamiento y a los tres días, se presentan en el cuadro 1.
Paciente 1: en la consulta de control a los tres días, se encontró disminución del tamaño de la herida a 6 cm2, aumento del tejido epitelial y bordes en cierre (figura 1 a y b).
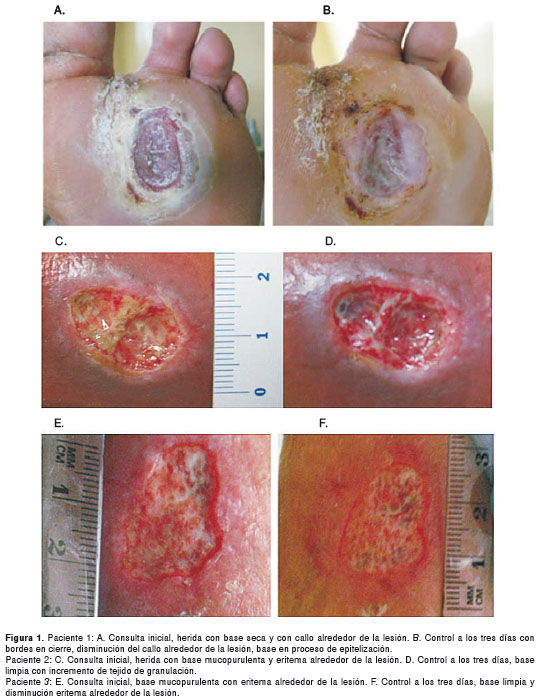
Paciente 2: en el control telefónico a las 24 horas, refirió aumento del dolor lancinante de predominio nocturno que se manejó con acetaminofén, 500 mg cada seis horas. En el control a los tres días, la herida presentaba eliminación del tejido mucopurulento y aumento del tejido de granulación con base rosada, y disminución del edema alrededor de la lesión y de la hiperemia (figura 1 c y d).
Paciente 3: en el control telefónico a las 24 horas, refería exudado serosanguinolento y dolor intenso de predominio nocturno, que se manejó con acetaminofén, 500 mg cada seis horas. En el control a los tres días, la herida presentaba una base limpia con disminución del eritema y del edema alrededor de la lesión (figura 1 e y f).
En los tres pacientes se encontró que, a pesar del poco tejido necrótico o infectado de las heridas, hubo una disminución del número de las larvas al final del tratamiento.
Análisis electroforético
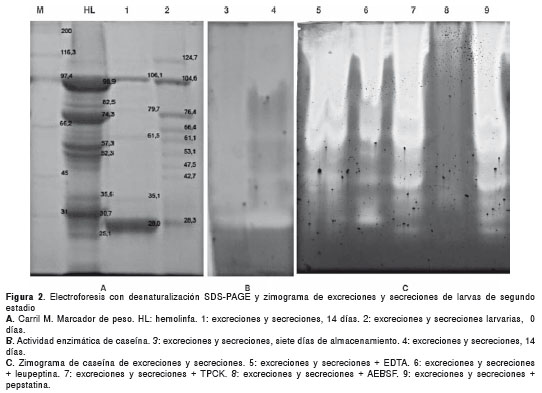
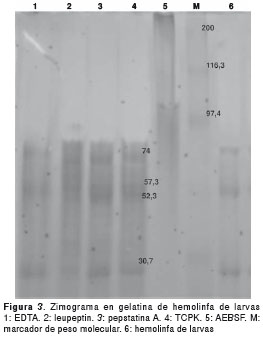
El patrón del corrido electroforético de los productos de excreción y secreción presentó bandas entre 114,7 kDa y 28 kDa, y para la hemolinfa de larvas, bandas con pesos entre 98,9 y 25 kDa (figura 2a). En el zimograma para excreciones y secreciones, se evidenció una actividad enzimática en la gelatina (no se presenta el dato) y caseína en todo el rango del corrido electroforético, evidenciando principalmente enzimas de la familia de proteasas de tipo serina; también, se identificaron: metaloproteasas (30 kDa), proteasas de tipo serina o de cisteína (30 a 60 kDa) y una quimotripsina (28 kDa) (figura 2b y c). Para la hemolinfa de las larvas se encontró actividad enzimática en el gel de gelatina para una proteasa de tipo serina (97,4 kDa) (figura 3).
Discusión
El tratamiento con larvas es un método de desbridamiento más rápido comparado con los tratamientos no quirúrgicos, que acelera la curación total de la herida, lo cual ha sido demostrado en estudios previos (16). Es importante destacar que el efecto del desbridamiento con larvaterapia se produce por un proceso de digestión extracorpórea, mediante la liberación de enzimas con actividad de tripsina, quimotripsina y colagenasa, que forman un caldo de tejido necrótico que posteriormente es ingerido. Este tipo de mezcla enzimática también es importante, pues ayuda a la remodelación de la matriz extracelular en el proceso de cicatrización (17,18), lo que podría explicar la inducción de la formación de tejido epitelial en el paciente uno, aunque también genera más preguntas sobre el por qué esta mezcla enzimática que tiene la capacidad de digerir el tejido necrótico no tiene efectos sobre el tejido sano. Algunas hipótesis para explicar este fenómeno, pueden ser la liberación de inhibidores por parte del sistema inmunitario del paciente, como las serpinas, o cambios a nivel de oxigenación y pH en el tejido sano que afecten la función de las enzimas liberadas por las larvas (19,20).
Recientemente, se ha confirmado la actividad antimicrobiana de los compuestos de las secreciones de las larvas con capacidad de destruir Staphylococcus aureus resistente a la meticilina y otras bacterias que causan infecciones importantes (21). También, se han encontrado varios péptidos antimicrobianos expresados en estas larvas (22), así como compuestos de bajo peso molecular en la hemolinfa con actividad contraMicrococcus luteus y Pseudomonas aeruginosa (13); estos mecanismos podrían explicar los efectos vistos en los pacientes dos y tres, en los cuales se registraron signos de infección al inicio del tratamiento a pesar de estar recibiendo antimicrobianos tópicos y orales, y con un solo uso de la larvaterapia se evidenció disminución del tejido mucopurulento y del eritema alrededor de la lesión.
La larvaterapia también se asocia con un rápido crecimiento del tejido de granulación (23), como se observó en el paciente dos. Aunque en el estudio VenUS II se encontró que la larvaterapia no afectaba significativamente el tiempo de curación final, es importante aclarar que la larvaterapia se aplicó en un periodo corto y se retiró después de cumplir su objetivo de desbridamiento del tejido necrótico. Una vez desbridadas, las heridas crónicas quedan expuestas a los mismos riesgos del cuidado convencional y, si tenemos en cuenta que una herida abierta está colonizada por bacterias en más del 90 % a las 24 horas y, además de esto, le sumamos la condición clínica subyacente y la condición de base del paciente, el desbridamiento es tan solo un parámetro dentro del complejo proceso de curación (24).
Se logró documentar el efecto de la larvaterapia por medio de los índices PUSH y Wound Bed Score. Para el índice PUSH se encontró una disminución promedio de 2,3 puntos con respecto al puntaje inicial. Aunque reconocemos que el puntaje PUSH fue desarrollado para evaluar el seguimiento de lesiones por presión, también se sabe que evalúa variables comunes para el pronóstico y seguimiento de las heridas crónicas, como el tamaño, la cantidad de exudado y el tipo de tejido en la base de la herida. Con respecto al puntaje por el Wound Bed Score, a pesar de que para su aplicación se escogieron únicamente pacientes con úlceras venosas, como referencia se evalúan parámetros importantes para el proceso de curación en otras condiciones, como úlceras por pie diabético, bordes de la herida, profundidad, exudado, edema, dermatitis, callo o fibrosis y base de la misma; con este puntaje, se logró evidenciar una mejora promedio en los tres pacientes de 2,7, lo que representa un aumento en la probabilidad de curación a las 24 semanas, de 52 % para la consulta inicial a 67 % de probabilidad para la consulta a los tres días. Es importante anotar que no existe una valoración objetiva y universal para la valoración, el seguimiento y el pronóstico de las heridas crónicas, pero consideramos que estos dos puntajes son herramientas útiles para evaluar el efecto de la larvaterapia.
Aunque los tres casos que se presentan no tenían gran cantidad de tejido necrótico o infectado, se observa que la aplicación temprana de la larvaterapia tiene un efecto benéfico sobre los parámetros de curación, lo que demuestra sus ventajas sobre la promoción de la cicatrización más allá del solo desbridamiento. Por lo tanto, es necesario estudiar más a fondo los mecanismos del efecto promotor de la cicatrización y el antimicrobiano de la larvaterapia.
Respecto a la disminución del número de larvas recuperadas al final del tratamiento, se desconoce si se produjo por muerte de las mismas o por fuga durante el cambio de las gasas; sin embargo, las larvas que se encontraron en la úlcera tuvieron un desarrollo morfológico normal para el tercer estadio.
Como se mencionó anteriormente, el proceso de curación de las heridas por larvaterapia se debe, en parte, a los productos presentes en las excreciones y secreciones de estos organismos; las bandas obtenidas en los productos de excreción y secreción tienen un rango amplio de peso molecular en el corrido electroforético, principalmente, en el segundo estadio larvario. En otros estudios se ha obtenido un perfil electroforético complejo de excreciones y secreciones de L. sericata, con un rango aproximado entre 205 y 29 kDa, principalmente con bandas de bajo peso molecular, siendo las de mayor concentración aquellas entre 20 y 30 kDa (12). En Lucilia cuprina se encontraron especialmente pesos entre 32,5 y 70 kDa (25). En esta investigación se encontró una mayor cantidad de bandas entre 42 y 75 kDa, que se fueron degradando con el tiempo y la temperatura de almacenamiento.
En otros trabajos se ha demostrado el rango de enzimas secretadas por L. sericata, en los que se han descrito, al menos, cuatro proteasas individuales con pesos entre 20 y 40 kDa (17) y entre 20 y 50 kDa (26). En este trabajo se encontró actividad en todo el rango del corrido electroforético, pudiendo deberse a la rápida degradación de las enzimas, producida por una actividad autoproteolítica, con una mezcla compleja y diversa de diferentes familias enzimáticas. La participación de proteasas de tipo serina de las larvas de L. sericata sobre los componentes de la matriz extracelular, produce una degradación de cúmulos de fibrina, degrada la fibronectina y la laminina, y hace soluble el colágeno de tipo I y de tipo III, ayudando en el desbridamiento de las heridas y la remodelación de la matriz extracelular (17).
También, se ha encontrado que las excreciones y secreciones son capaces de degradar y evitar la formación de biopelículas de P. aeuriginosa (12). Estos mecanismos hacen pensar que la elevada carga enzimática de las larvas de L. sericata degrada componentes del tejido necrótico, ayudando a la remodelación de la matriz extracelular y, además, evita la formación de biopelículas en las heridas expuestas, lo que facilitaría las condiciones de curación en una herida con tejido necrótico. En este estudio también se encontró que el uso de la larvaterapia en heridas con poca carga infecciosa tiene efectos positivos.
Es necesario evaluar más a fondo el efecto de la larvaterapia, tomando como punto final el efecto del desbridamiento y el promotor de la cicatrización. Encontramos, también, necesaria una mayor difusión de este tratamiento para poder beneficiar una mayor cantidad de pacientes en nuestra región, ya que la larvaterapia tuvo buena aceptación por parte de los pacientes y sus acompañantes, lo que demuestra la importancia de la educación médica para superar las barreras culturales ante este procedimiento.
Los autores de este manuscrito declaran no tener conflicto de intereses.
El presente trabajo se realizó mediante la financiación de recursos propios del Grupo de Inmunología Molecular de la Universidad del Quindío.
Correspondencia: Jhon Carlos Castaño, Facultad de Ciencias de la Salud, Universidad del Quindío, Carrera 15 calle 12 norte, Armenia, Colombia Fax: (576) 746 0129 jhoncarlos@uniquindio.edu.co
1. Margolis DJ, Allen-Taylor L, Hoffstad O, Berlin JA. The accuracy of venous leg ulcer prognostic models in a wound care system. Wound Repair Regen. 2004;12:163-8. http://dx.doi.org/10.1111/j.1067-1927.2004.012207.x [ Links ]
2. Araujo T, Valencia I, Federman DG, Kirsner RS. Managing the patient with venus ulcers. Ann Intern Med. 2003;138:326-34. [ Links ]
3. Lipsky BA. A current approach to diabetic foot infections. Curr Infect Dis Rep. 1999;1:253-60. [ Links ]
4. Burd C, Langemo D, Olson B, Hanson D, Hunter S, Sauvage T. Skin problems: Epidemiology of pressure ulcers in a skilled care facility. J Gerontol Nursing. 1992;18:29-39. [ Links ]
5. Margolis DJ. The swings and roundabouts of randomized controlled studies in wound healing. Int J Low Extrem Wounds. 2004;3:4-6. http://dx.doi.org/10.1177/153473460431002 [ Links ]
6. Ayello EA, Cuddigan JE. Debridement: Controlling the necrotic/cellular burden. Adv Skin Wound Care. 2004; 17:66-75. [ Links ]
7. Florez E, Wolff M. Descripción y clave de los estadios inmaduros de las principales especies de Calliphoridae (Diptera) de importancia forense en Colombia. Neotrop Entomol. 2009;38:418-29. http://dx.doi.org/10.1590/S1519-566X2009000300019/p> [ Links ]
8. Sherman RA, MyTien Tran JM. A simple, sterile food source for rearing the larvae of Lucilia sericata (Diptera: Calliphoridae). Med Vet Entomol. 1995;9:393-8. . http://dx.doi.org/10.1111/j.1365-2915.1995.tb00011.x [ Links ]
9. Nuesch R, Rahm G, Rudin W, Steffen I, Frei R, Rufli T, et al. Clustering of bloodstream infections during maggot debridement therapy using contaminated larvae of Protophormia terraenovae. Infection. 2002;30:306-9. . http://dx.doi.org/10.1007/s15010-002-3067-0 [ Links ]
10. Ratliff CR, Rodeheaver GT. Use of the PUSH tool to measure venous ulcer healing. Ostomy Wound Manage. 2005;51:58-60. [ Links ]
11. Falanga V, Saap LJ, Ozonoff A. Wound bed score and its correlation with healing of chronic wounds. Dermatol Ther. 2006;19:383-90. http://dx.doi.org/10.1111/j.1529-8019.2006.00096.x [ Links ]
12. Cazander G, Kiril EB, Bouwman L, Bernards A, Jukema G. The influence of maggot excretions on PAO-1 biofilm formation on different biomaterials. Clin Orthop Relat Res. 2009;467:536-45.http://dx.doi.org/10.1007/s11999-008-0555-2 [ Links ]
13. Huberman L, Gollop N, Mumcuoglu KY, Block C, Galun R. Antibacterial properties of whole body extracts and haemolymph of Lucilia sericata maggots. J Wound Care. 2007;16:123-7. [ Links ]
14. Sambrook J, Russell DW. Molecular cloning, a laboratory manual. Third edition. New York: Cold Spring Harbor Laboratory Press; 2001. p. A8.40-6. [ Links ]
15. Choi NS, Yoon KS, Lee JY, Han KY, Kim SH. Comparison of three substrates (casein, fibrin, and gelatin) in zymographic gel. J Biochem Mol Biol. 2001;34:531-6. [ Links ]
16. Tanyuksel M, Araz E, Dundar K, Uzun G, Gumus T, Alten B, et al. Maggot debridement therapy in the treatment of chronic wounds in a military hospital setup in Turkey. Dermatology. 2005;210:115-8. http://dx.doi.org/10.1159/000082566 [ Links ]
17. Chambers L, Woodrow S, Brown AP, Harris PD, Phillips D, Hall M, et al. Degradation of extracellular matrix components by defined proteinases from the greenbottle larva Lucilia sericata used for the clinical debridement of non-healing wounds. Br J Dermatol. 2003;148:14-23. http://dx.doi.org/10.1046/j.1365-2133.2003.04935.x [ Links ]
18. van der Plas MJ, van der Does AM, Baldry M, Dogterom-Ballering HC, van Gulpen C, van Dissel JT, et al. Maggot excretions/secretions inhibit multiple neutrophil pro-inflammatory responses. Microbes Infect. 2007;9:507-14. http://dx.doi.org/10.1016/j.micinf.2007.01.008 [ Links ]
19. Hoffmann DC, Textoris C, Oehme F, Klaassen T, Goppelt A, Römer A, et al. Pivotal role for alpha1-antichymotrypsin in skin repair. J Biol Chem. 2011;19;286:28889-901. http://dx.doi.org/10.1074/jbc.M111.249979 [ Links ]
20. van der Plas MJ, van Dissel JT, Nibbering PH. Maggot secretions skew monocyte-macrophage differentiation away from a pro-inflammatory to a pro-angiogenic type. PLoS One. 2009;4:e8071. http://dx.doi.org/10.1371/journal.pone.0008071 [ Links ]
21. Bexfield A, Nigam Y, Thomas S, Ratcliffe NA. Detection and partial characterization of two antibacterial factors from the excretions/secretions of the medicinal maggot Lucilia sericata and their activity against methicillin-resistant Staphylococcus aureus (MRSA). Microbes Infect. 2004;6:1297-304. http://dx.doi.org/10.1016/j.micinf.2004.08.011 [ Links ]
22. Altincicek B, Vilcinskas A. Septic injury-inducible genes in medicinal maggots of the green blow fly Lucilia sericata. Insect Mol Biol. 2009;18:119-25. http://dx.doi.org/10.1111/j.1365-2583.2008.00856.x [ Links ]
23. Sherman RA. Maggot therapy for treating diabetic foot ulcers unresponsive to conventional therapy. Diabetes Care. 2003;26:446-51. http://dx.doi.org/10.2337/diacare.26.2.446 [ Links ]
24. Dumville JC, Worthy G, Bland JM, Cullum N, Dowson C, Iglesias C, et al. Larval therapy for leg ulcers (VenUS II): Randomized controlled trial. BMJ. 2009;19;338:b773. http://dx.doi.org/10.1136/bmj.b773 [ Links ]
25. Young AR, Meeusen EN, Bowles VM. Characterization of ES products involved in wound initiation by Lucilia cuprina larvae. Int J Parasitol.1996;26:245-52. http://dx.doi.org/10.1016/0020-7519(95)00123-9 [ Links ]
26. Schmidtchen A, Wolff H, Rydengard V, Hansson C. Detection of serine proteases secreted by Lucilia sericata in vitro and during treatment of a chronic leg ulcer. Acta Derm Venereol. 2003:83:310-1. [ Links ]













