Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.32 no.3 Bogotá Jul./Sept. 2012
https://doi.org/10.7705/biomedica.v32i3.591
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v32i3.591
1Programa de Ofidismo-Escorpionismo, Universidad de Antioquia, Medellín, Antioquia, Colombia
2Facultad de Química Farmacéutica, Universidad de Antioquia, Medellín, Colombia
3Desarrollo de Programas e Investigación, Dirección Nacional de Posgrados, Universidad Cooperativa de Colombia, Medellín, Colombia
Contribución de los autores: Arley Camilo Patiño: pruebas de toxicidad aguda, actividad analgésica, actividad proteolítica, inhibición del efecto letal in vivo del veneno, electroforesis, tabulación y discusión de los resultados.
Jésica López: preparación de extractos y fracciones, pruebas de actividad coagulante y hemolítica.
Mónica Aristizábal: pruebas de toxicidad aguda.
Juan Carlos Quintana: prueba de inhibición del efecto letal in vivo del veneno.
Dora Benjumea: pruebas de actividad analgésica y estructura del artículo escrito.
Recibido: 11/11/11; aceptado:23/03/12
Introducción. La medicina tradicional es una invaluable fuente de investigación de nuevos remedios como complemento para el tratamiento del accidente ofídico, considerado como un grave problema de salud pública a nivel mundial.
Objetivo. Este trabajo de investigación pretende comprobar la capacidad de neutralizar los efectos hemorrágicos, coagulantes y proteolíticos, de los extractos de hojas de Renealmia alpinia, usada tradicionalmente por los indígenas del Chocó (Colombia) contra la mordedura de la serpiente Bothrops asper, causante de la gran mayoría de los accidentes ofídicos en nuestro país.
Materiales y métodos. Se llevaron a cabo ensayos de toxicidad aguda y de actividad analgésica in vivo de R. alpinia. Además, se hicieron ensayos in vitro sobre inhibición de las actividades coagulante, hemolítica y proteolítica del veneno de B. asper.
Resultados. El presente estudio demuestra que R. alpinia no produce efectos tóxicos en animales de experimentación; además, presenta efectos analgésicos in vivo y antiofídicos in vitro,y protege contra los efectos letales del veneno de B. asper, in vivo.
Conclusión. Renealmia alpinia puede ser una buena alternativa terapéutica como complemento al tratamiento con antiveneno en el accidente ofídico, por sus efectos analgésicos y antiofídicos.
Palabras clave: venenos de serpiente, mordeduras de serpiente, Bothrops, Zingiberaceae,plantas medicinales, etnofarmacología, analgesia, toxicidad aguda.
doi: http://dx.doi.org/10.7705/biomedica.v32i3.591
Evaluation of the inhibitory effect of extracts from leaves of Renealmia alpinia Rottb. Maas (Zingiberaceae) on the venom of Bothrops asper (mapaná)
Introduction. Traditional medicine is an invaluable source of research into new medicines as a supplement for the treatment of snakebite, considered as a serious public health problem worldwide. The extracts of the medicinal plant, Renealmia alpina, have been used traditionally by indigenous people of Chocó (Colombia) against Bothrops asper snakebite, a snake responsible for the majority of snakebite accidents in Colombia.
Objective. The ability of extracts of R. alpinia leaves was tested for its ability to neutralize the hemorrhagic, coagulant and proteolytic effects of the snakebite venom of B. asper.
Materials and methods. The acute toxicity tests and analgesic activity of R. alpina were evaluated in vivo. In addition, tests were undertaken in in vitro conditions to demonstrate inhibition of coagulant, haemolytic and proteolytic activity of the B. asper venom.
Results. Renealmia alpinia extracts had no toxic effects in experimental animals and also provided analgesic and antiophidian effects and protection against the lethal effects of the venom of B. asper.
Conclusion. Renealmia. alpinia was an effective therapeutic alternative in association with antivenom treatment in the event of a B. asper snakebite accident. It was demonstrated to protect against the lethal effects and provided analgesic properties as well.
Key words: snake venoms, snake bites, Bothrops, Zingiberaceae; plants, medicinal; ethnopharmacology, analgesia, acute toxicity.
doi: http://dx.doi.org/10.7705/biomedica.v32i3.591
Es incuestionable que la medicina tradicional es una invaluable fuente de investigación de nuevos remedios basados en plantas medicinales, como solución a problemas de salud que acechan la humanidad, principalmente en países con un bajo índice de desarrollo humano, donde paradójicamente abundan los recursos naturales. Uno de estos problemas de salud es el accidente ofídico, considerado como un problema de salud pública y para el cual el único tratamiento es el antiveneno; no obstante, por la lejanía de las zonas geográficas donde ocurren los accidentes, en muchas ocasiones se retrasa el inicio del tratamiento adecuado y se aumentan las posibilidades de mortalidad.
En abril de 2009, la Organización Mundial de la Salud emitió un listado de enfermedades tropicales desatendidas, entre las cuales se encontraba el accidente ofídico (1). Al igual que la malaria, el dengue, la tuberculosis y algunas enfermedades parasitarias, el riesgo de mordedura por serpiente siempre está presente y, aunque no tiene el potencial epidémico de las enfermedades infecciosas y parasitarias, sigue sin ser reconocida como un riesgo para la salud pública, a pesar de la carga de sufrimiento que causa en los seres humanos (2-4).
En el mundo se registran anualmente cerca de 5,4 millones de accidentes por serpientes, de los cuales, entre el 50 y el 75 % requiere tratamiento para evitar la muerte, amputaciones o secuelas permanentes. Para Latinoamérica se estiman 150.000 accidentes ofídicos y una cifra de 5.000 decesos por esta causa; la mayoría de los casos se registra en niños y trabajadores rurales en edad productiva, lo que pone en riesgo la subsistencia familiar; además, el impacto de las secuelas y las defunciones representan una gran carga, no solo social, sino de salud y económica. Por otra parte, su magnitud no es bien conocida debido a que los accidentes ocurren predominantemente en las áreas rurales, muchas veces alejadas de los servicios de salud y para las cuales no hay un registro adecuado (5).
Colombia no es ajena a esta realidad mundial. La diversidad de su fauna se refleja en la presencia de una gran cantidad de especies de serpientes venenosas que habitan, principalmente, en los climas cálidos y templados (6). En el 2010 se registraron 3.945 casos de accidente ofídicos con una incidencia de 8,66 casos por 100.000 habitantes; según la densidad de la población, esta incidencia osciló entre 127,61 para el departamento del Vaupés (zona con menos población) y 2,66 para el departamento de Cundinamarca (zona más densamente poblada), con una mortalidad de 0,96 % (7).
El veneno de las serpientes tiene como función inmovilizar, matar y ayudar a digerir la presa; está constituido por una compleja variedad de toxinas con actividad enzimática, que incluye hemorraginas, proteasas y fosfolipasas A2, y por otras toxinas sin actividad enzimática, como neurotoxinas, citotoxinas, cardiotoxinas y miotoxinas (8). Asimismo, contiene sustancias no proteicas, como las aminas (histamina, bradicinina, serotonina y acetilcolina), causantes de edema, hipotensión y el intenso dolor que manifiestan las víctimas (9,10). El accidente ofídico causado por miembros de la familia Viperidea se caracteriza por alteraciones patológicas locales y sistémicas, tales como edema, necrosis, hipotensión, alteraciones de la coagulación, hemorragia sistémica, trombocitopenia, dolor y nefrotoxicidad, que pueden variar en intensidad según la especie, la edad y el tamaño de la serpiente (11,12).
Hasta el momento, el antiveneno por vía parenteral es el único tratamiento disponible y aprobado en el mundo para el manejo del accidente ofídico (13). Sin embargo, el retraso en el inicio del tratamiento y la rápida instalación de los síntomas, proveen escasa protección del mismo; además, con frecuencia se producen reacciones de hipersensibilidad que demoran aún más el tratamiento (14,15). Sumado a esto, en muchas ocasiones el antiveneno no se encuentra disponible por razones tales como la lejanía de las comunidades rurales, las dificultades en la producción de los mismos y las difíciles condiciones geográficas que impiden un rápido acceso a los centros de atención hospitalaria, lo cual retrasa el inicio del tratamiento adecuado y aumenta las posibilidades de mortalidad (16).
Ante esta problemática, se hace necesaria la búsqueda de alternativas terapéuticas que eviten los efectos ocasionados por la mordedura de estos ofidios. Entre las alternativas naturales, las plantas medicinales se constituyen en la principal fuente de recursos contra la mordedura de serpientes, especialmente en áreas tropicales donde hay fuentes abundantes de especies vegetales. Algunos extractos de plantas han demostrado inhibir las alteraciones generadas, no sólo por los venenos, sino también por toxinas aisladas de los mismos (12-15,17-19).
Una de estas plantas es Renealmia alpinia (Rottb.) Maas, usada tradicionalmente por los indígenas de la región de Antioquia y Chocó contra la mordedura de serpiente (11). Además, entre sus usos populares tiene aplicación como antipirético y analgésico (20,21), lo que podría ser de gran utilidad como coadyuvante en el tratamiento del dolor que se produce durante el accidente ofídico. Su rica composición química incluye taninos, carotenoides, monoterpenos, diterpenos y sesquiterpenos (22-24), al igual que un alto contenido en cumarinas, metabolitos encontrados en algunas plantas con actividad antiofídica comprobada (9).
En diversos trabajos de investigación llevados a cabo por diferentes autores, se confirma el uso tradicional de R. alpinia al demostrar que neutraliza el efecto del veneno de Bothrops asper (12,25-27). El presente trabajo de investigación profundiza en los estudios de esta prominente especie botánica y explora la toxicidad aguda, la actividad neutralizadora in vitro de varios extractos obtenidos ex vitro de las hojas de R. alpinia sobre los efectos coagulante y hemolítico indirecto del veneno de B. asper, además de comprobar su actividad analgésica.
Materiales y métodos
Venenos
El veneno empleado fue recolectado por ordeño manual de especímenes adultos de serpientes B. asper, procedentes de diferentes lugares del departamento de Antioquia y Chocó, mantenidos en cautiverio en el serpentario de la Universidad de Antioquia. El veneno se centrifugó, y el sobrenadante se liofilizó y se congeló a -70 °C hasta su uso.
Animales de experimentación
Los animales utilizados para los estudios de toxicidad aguda y actividad analgésica, se obtuvieron del bioterio de la Sede de Investigación de la Universidad de Antioquia, y de acuerdo con la Declaración de Helsinki de 1975, modificada en 2000, después de la aprobación del Comité de Ética de Experimentación Animal de la Universidad de Antioquia, en el Acta No. 60.
Se usaron ratones Balb/c, hembras y machos, de peso comprendido entre 20 y 25 g con 12 a 14 semanas de edad, teniendo un periodo de adaptación al medio de cinco días. En todas las experiencias, los animales fueron dejados en ayunas durante seis horas previas al experimento y con acceso ad libitum al agua. Casi todos los ensayos se llevaron a cabo, aproximadamente, a las mismas horas del día para evitar los problemas del ritmo circadiano, en una habitación cerrada, con luz artificial con ciclos de 12 horas de luz y oscuridad con temperatura de 22±1 °C y 60±4 % de humedad.
Material vegetal y preparación de extractos
Las hojas de R. alpinia se recolectaron de plantas cultivadas en los predios de la Universidad de Antioquia y su identificación se hizo en el herbario de la misma institución, según voucher 107316, número de registro 6456 RF. Las partes frescas recolectadas de R. alpinia fueron troceadas y secadas en una estufa con circulación forzada de aire a temperatura de 37 °C. Posteriormente, se procedió a la pulverización mecánica del material vegetal desecado, en un molino modelo Electro Motor Pact™ (rpm 50 Hz). Luego, el material vegetal pulverizado y seco resultante, se depositó en recipientes herméticos y se almacenó en un ambiente fresco y seco hasta el momento de su empleo.
Para los ensayos farmacológicos propuestos se prepararon los extractos de R. alpinia, a partir de este material vegetal. Inicialmente, se preparó un extracto de etanol y, con posterioridad, se obtuvo una serie de fracciones más purificadas, mediante percolación sucesiva con diferentes solventes de polaridad creciente (hexano, diclorometano, acetato de etilo y metanol), con el propósito de determinar en cuál de ellas se manifestaba la actividad farmacológica. Posteriormente, todos los extractos se concentraron al vacío hasta la sequedad, se liofilizaron y congelaron, hasta su uso.
Toxicidad aguda
La toxicidad se determinó siguiendo la guía 423 de la Organization for Economic Cooperation and Development (OECD) (28). Dado que su uso tradicional indica que R. alpinia tiene una potencial baja toxicidad y la mortalidad es poco probable, el procedimiento de prueba se aplicó con una dosis inicial de 2.000 mg/kg de peso corporal (tres animales de cada sexo).
Los ratones se dividieron en cuatro grupos iguales, tres en cada grupo (dos controles y dos grupos tratados con el extracto de etanol de R. alpinia), a los cuales se les administró por vía oral, mediante sonda orogástrica, una dosis única de 2.000 mg/kg de peso corporal. Después de tres horas de la administración, se suministró la dieta estándar (Rodentina®, Purina, S.A., Bogotá, Colombia) hasta el final del experimento.
Los animales se observaron individualmente, al menos, una vez durante los primeros 30 minutos, de forma periódica, durante las primeras 24 horas, con especial atención durante las primeras 4 horas, y luego diariamente, para un total de 14 días.
Todas las observaciones se registraron sistemáticamente para cada animal, además de su peso corporal. Las observaciones incluyeron cambios en el sistema nervioso central (comportamiento, movimientos, reacción a estímulos, reflejos y tono muscular), en el sistema nervioso autónomo (medida de la pupila), en el sistema respiratorio (ventanas de la nariz: descarga o coloreado y bradipnea o disnea), en el sistema cardiovascular (palpación de la región cardiaca), en el sistema gastrointestinal (diarrea o estreñimiento, forma abdominal: contracción, consistencia de las heces y color), en la piel y el pelaje (color, turgencia e integridad), y en los ojos y las membranas mucosas (párpados, globo ocular, transparencia).
Los animales fueron sacrificados al final del período de observación y se sometieron a una necropsia para su observación macroscópica.
Inhibición del efecto letal in vivo del veneno de Bothrops asper
Se utilizaron tres grupos de 8 ratones para esta prueba, dos grupos (1 y 2) recibieron una dosis de extracto de etanol de 75 mg/kg diarios por vía intraperitoneal, durante tres días; el tercer grupo recibió PBS por la misma vía, a manera de control. El cuarto día se inocularon con 1,5 DL50 del veneno de B. asper, por vía intraperitoneal, en los grupos 1 y 3; el grupo 2 recibió PBS. Se registraron los casos de muerte en un periodo de 48 horas.
Inhibición de la actividad hemolítica indirecta
Se utilizó el método agarosayema de huevo-eritrocitos, descrito por Gutiérrez, et al. (29). Se empleó una dosis hemolítica mínima indirecta de los venenos de B. asper (2,2 µg), para generar un halo de hemólisis de 20 mm después de 20 horas de incubación a 37 °C. Se preincubaron diferentes proporciones de cada uno de los extractos de hojas de R. alpinia (metanol, acetato de etilo, diclorometano y hexano), durante 30 minutos a 37 °C, con una dosis hemolítica indirecta mínima del veneno. Como control positivo, se tomaron 2,2 µg de veneno, y como control negativo, 15 µl de cada extracto. Los resultados se expresaron como porcentaje de inhibición, tomando el 100 % de actividad el control positivo. Los ensayos se hicieron por triplicado.
Inhibición de la actividad coagulante
Se utilizó el método descrito por Theakston y Reid (30), con modificaciones. Diferentes concentraciones de los extractos (metanol, acetato de etilo, diclorometano y hexano) se mezclaron con una dosis fija de veneno y se incubaron a 37 °C por 30 minutos. La mezcla se agregó a 300 µl de plasma y se registró el tiempo para su coagulación. Como control positivo, se tomó 1 µg veneno, y como control negativo se tomaron 50 µl de cada extracto. Los resultados se expresaron como porcentaje de inhibición. Los ensayos se hicieron por triplicado.
Inhibición de la actividad proteolítica sobre azocaseína
Se utilizó el micrométodo de azocaseína propuesto por Wang, et al. (31), utilizando como control positivo una dosis proteolítica mínima (DPm) de 20 µg para el veneno de B. asper. Se preincubaron (30 minutos a 37 °C) diferentes cantidades de veneno y extractos (metanol, acetato de etilo, diclorometano y hexano), en relación 1:5, 1:10 y 1:20, respectivamente. En la prueba de inhibición se incubaron 100 µl de azocaseína (10 mg/ml) y 20 µl de mezcla de veneno y extracto (90 minutos a 37 °C), antes de la adición 200 µl de ácido tricloroacético al 5 % para detener la reacción. Una vez logrado este objetivo, los tubos fueron centrifugados (2.000 rpm por 5 minutos) y se transfirieron 100 µl de sobrenadante a pozos de platos de 96 pocillos de fondo plano, en los que posteriormente se agregaron 100 µl de NaOH 0,5M, antes de la lectura de la absorbancia a 450 nm en un lector para ELISA (Awareness, Stat Fax 3200) contra un blanco de reactivos (n=6).
Actividad analgésica
Para el estudio de la actividad analgésica de los extractos de etanol y las fracciones de metanol, acetato de etilo y diclorometano de R. alpinia,se llevó a cabo el test de Siegmund (32). Este método se basa en la inyección intraperitoneal de un agente que causa dolor, la 2-fenil-1,4-benzoquinona o fenilquinona, la cual es capaz de provocar contracciones o estiramientos como respuesta refleja, cuando se inyecta en el ratón.
Los ratones se repartieron al azar en grupos homogéneos, de forma tal que para cada dosis y producto ensayados se disponía de un grupo de, al menos, seis ratones.
Transcurrido el tiempo de ayuno, se comenzó la experiencia, administrando el excipiente de los productos en estudio al grupo control, a razón de 0,5 ml por 40 g de peso; al grupo patrón, ibuprofeno, utilizado como fármaco de referencia, a las dosis de 50 y 75 mg/kg de peso corporal del ratón. A los grupos tratados se les administraron por vía oral, las correspondientes dosis de extracto de etanol preparado, a razón de 50, 100, 200 y 500 mg/kg, y las de fracciones preparadas, a razón de 100 y 200 mg/kg.
Después del tratamiento y transcurridos 45 minutos, a todos los grupos de animales se les inyectó por vía intraperitoneal una solución de fenilquinona, a razón de 4 mg/kg (preparada a partir de una solución madre de 2 mg/ml en etanol). Después de un tiempo de latencia de cinco minutos, se comenzó a contar las contracciones en cada ratón individualmente durante un intervalo de 10 minutos. El dolor provocado en el ratón se ponía de manifiesto por las contracciones, considerando como positivas aquellas caracterizadas por el estiramiento de las patas posteriores y torsión de la musculatura dorso-abdominal. El efecto analgésico de los extractos de R. alpinia se determinó según su capacidad para reducir el número de contracciones dolorosas o estiramientos producidos por la fenilquinona. El porcentaje de inhibición se calculó siguiendo la siguiente fórmula:
formula 1

Electroforesis SDS-PAGE
La electroforesis se hizo sobre geles de poliacrilamida al 12 % en condiciones no reducidas, como lo describe Laemmli (33). Se tomaron 40 µg de veneno y se incubaron con 400 µg de cada extracto, durante 30 minutos a 37 °C, para luego correrlos en una cámara mini Protrean-II™de Biorad durante 60 minutos a 150 voltios. Las proteínas se colorearon empleando azul de Coomasie R 250.
Análisis estadístico
Se utilizó una prueba ANOVA de una vía seguida por un test de Dunnet (34,35), para comparar los controles positivos (veneno solo) con los resultados obtenidos con las dosis de la mezcla de veneno y extracto en la prueba de inhibición de la actividad coagulante, y se hizo un análisis de varianza de una vía, seguido por un test de Bonferroni, para determinar las diferencias entre el grupo control y los grupos problema para la prueba de inhibición de la actividad hemolítica indirecta. Todos los ensayos in vitro se practicaron por triplicado y los resultados se expresaron como la media ± SEM (error estándar de la media). Se consideraron diferencias significativas cuando p<0,05.
Resultados
Toxicidad aguda
Durante los 14 días de tratamiento con el extracto de etanol de R. alpinia a dosis de 2.000 mg/kg, no se observó en los ratones ningún signo de toxicidad, ni se presentaron muertes. No hubo diferencias significativas en los pesos corporales del grupo control comparados con los del grupo tratado, ni diferencias en el consumo de alimentos. Igualmente, las evaluaciones macroscópicas de los órganos pertenecientes a los dos grupos no presentaron alteraciones (no se presentan los datos).
Inhibición del efecto letal del veneno de Bothrops asper
El extracto demostró proteger al 100 % de los ratones que fueron previamente tratados con 225 mg/kg del extracto de etanol de R. alpinia. Durante la prueba, los ratones que solo recibieron extracto sobrevivieron, mientras que los que recibieron 1,5 DL50 del veneno de B. asper murieron antes de las 48 horas.
Inhibición de la actividad hemolítica indirecta
En la figura 1 se presentan los porcentajes de inhibición obtenidos, luego de la preincubación del veneno con las fracciones de metanol, acetato de etilo, diclorometano y hexano de R. alpinia, en relaciones de veneno:extracto de 1:10 y 1:20 (w/w), respectivamente. Cuando se evaluaron las relaciones 1:5 y 1:1, solamente el extracto de metanol mostró un porcentaje de inhibición estadísticamente significativo.
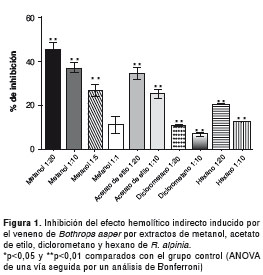
Inhibición de la actividad coagulante
Un microgramo de veneno indujo coagulación del plasma en 24,63±0,08 s. Se observó una prolongación del tiempo de coagulación dependiente de la concentración en todos los extractos utilizados (metanol, acetato de etilo, diclorometano y hexano), pero fue el extracto de metanol en una relación de 1:20 (w/w) el que mostró una mayor prolongación del tiempo. Estas diferencias fueron estadísticamente significativas en todos los casos, exceptuando la fracción de acetato de etilo y diclorometano en una relación 1:5 comparada con la del control positivo (cuadro 1).
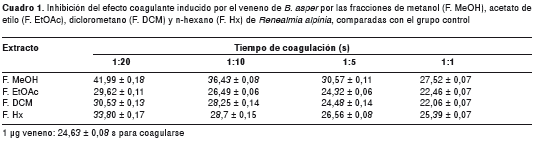
Inhibición de la actividad proteolítica sobre azocaseína
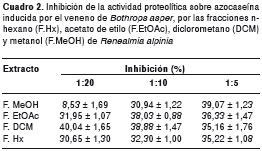
Después de la preincubación del veneno con las fracciones de metanol, acetato de etilo, diclorometano y hexano en una relación veneno:extracto 1:20 (w/w), se presentó un porcentaje de inhibición de 8,53±1,69, de 31,95±1,07, de 40,04±1,65 y de 30,65±1,30, respectivamente. Mientras que, con una relación 1:10 (w/w), los porcentajes de inhibición fueron de de 30,94±1,65, de 38,03±0,88, de 38,88±1,47 y de 32,30±1,00, respectivamente.
Cuando se evaluaron, las relaciones mostraron un porcentaje de inhibición de 39,07±1,23, de 36,33±1,47, de 35,16±1,76 y de 35,22±1,07, respectivamente (cuadro 2).
Actividad analgésica
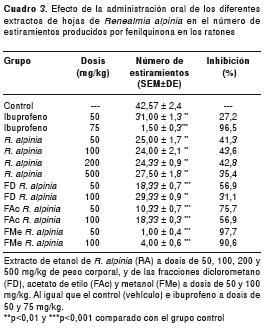
El cuadro 3 muestra el número de estiramientos producidos en los ratones con la administración oral del extracto de etanol y las fracciones de metanol, acetato de etilo y diclorometano de R. alpinia a diferentes dosis. Con ibuprofeno a 75 mg/kg, se presentó una disminución del número de estiramientos estadísticamente significativa con respecto al grupo control. Igualmente, se observó un bajo número de estiramientos con los extractos de etanol de R. alpinia. Sin embargo, las fracciones más purificadas fueron las que produjeron una mayor disminución, con p<0,001. Por otra parte, con el extracto de etanol se observó una inhibición entre 35,4 y 41,3 %, mientras que las fracciones presentaron un rango de inhibición entre 56,9 y 90 %, sobre todo con la fracción más acuosa.
Electroforesis SDS-PAGE
En la electroforesis de proteínas en geles de poliacrilamida se observó que las fracciones obtenidas con acetato de etilo y etanol reducían la presencia de todas las bandas del veneno, pero la obtenida con diclorometano redujo bandas en 25 y 48 KDa, mientras que el hexano y el metanol no mostraron reducción alguna en las bandas del veneno. Además, no se observaron proteínas en el extracto, según la figura 2.

Discusión
Renealmia alpinia es una planta usada tradicionalmente contra la mordedura de serpiente. En el presente trabajo se confirmó este uso tradicional, con el fin de encontrar nuevas alternativas terapéuticas a un grave problema de salud en Colombia; igualmente, se evaluó la actividad analgésica reportada para esta planta, la cual, a su vez, podría mejorar el dolor que refieren los pacientes que sufren una mordedura de serpiente B. asper. Inicialmente, se comprobó su seguridad mediante la evaluación de la toxicidad aguda, la cual no produjo efectos adversos a la dosis de 2.000 mg/kg; todos los animales tratados sobrevivieron durante los 14 días del experimento.
Por su parte, los estudios de actividad antiofídica mostraron que R. alpinia presenta efectos antiofídicos in vitro e, igualmente, una protección contra los efectos letales del veneno de B. asper, in vivo. La inhibición del efecto hemolítico indirecto del veneno de B. asper puede estar relacionada con la presencia de compuestos polifenólicos, los cuales pueden precipitar proteínas y formar complejos con metales como el Ca2+, lo cual explicaría la disminución en la actividad de fosfolipasas A2, enzimas que necesitan Ca2+; igualmente, estos compuestos pueden formar complejos con Zn2+, lo cual explicaría la disminución de la actividad proteolítica, mediada en parte por metaloproteinasas dependientes de Zn2+ (36-39).
Cuando se produce un accidente por B. asper, el efecto coagulante de su veneno es evidente desde los primeros 30 minutos, provocando graves alteraciones como sangrado local y sistémico, debido a un importante consumo de fibrinógeno (40-42). La fracción de metanol de R. alpinia mostró una mayor prolongación del tiempo de coagulación, dependiente de la concentración, comparada con los otros extractos. Esto podría deberse a una interacción de los componentes del extracto con las proteinasas de tipo serina presentes en el veneno (19).
Muchos extractos han demostrado inhibir el efecto letal de los venenos de serpientes, bien sea por preincubación del extracto y veneno o por inoculación independiente del extracto (12,16,26,43). Aunque, en trabajos anteriores este grupo de investigación demostró el efecto protector del extracto de rizomas de R. alpinia, cultivada in vitro,el método aquí empleado mostró inhibición a una dosis de 4,5 mg de extracto, por tres días antes de ser inoculado el veneno. Dosis más bajas (3 mg por 3 días) demuestran una disminución del 40 % en la efectividad del extracto (no se presentan los datos). El uso previo de extracto por parte de las comunidades expuestas a sufrir un accidente ofídico y con problemas de disponibilidad de antiveneno o de atención médica, podría ser una medida que permitiría disminuir el número de muertes y complicaciones por esta causa.
El mecanismo de inhibición de los efectos tóxicos de los venenos por extractos completos aún no se conoce, pero se sugiere que esta acción puede ser la suma de uno o varios efectos, mediados ya sea por uno o por un grupo de compuestos del extracto (44). En estudios previos se confirmó la presencia de metabolitos tales como esteroides y terpenoides, taninos y cumarinas, en hojas de R. alpinia, los cuales posiblemente podrían ser los responsables de su actividad antiofídica (27). Diversos autores han señalado que los taninos sirven para desintoxicar los venenos de distintas especies de serpientes (45). Se ha propuesto que las propiedades de los taninos podrían deberse a su capacidad para formar complejos con las proteínas que componen los venenos de serpientes (46).
Los resultados obtenidos con la actividad antiofídica no indican que se deba sustituir el uso del antiveneno, sino, por el contrario, usar nuevas estrategias que coadyuven a disminuir los efectos tóxicos de los venenos de las serpientes, mientras se acude a un centro de salud, recurriendo a las plantas medicinales de una forma adecuada y, así, disminuir las secuelas como amputaciones e incluso las muertes que actualmente se producen. De esta forma, se aprovecharían las plantas medicinales, usadas a través de muchos años y en forma habitual según la tradición indígena que hoy tiende a desaparecer.
Después de una mordedura de serpiente se presenta dolor en más de 70 % de los casos, alcanzando incluso el 95 %, probablemente inducido por efectos de miotoxinas, entre otros componentes de los venenos (47-49). En los estudios de actividad analgésica practicados en animales de experimentación, se demostró que R. alpinia tiene un efecto contra el dolor inducido por una substancia. La fracción de metanol de R. alpinia produjo el 97,7 % de protección contra la inducción del estímulo doloroso, comparada con el grupo control (vehículo), a dosis de 100 mg/kg, que produce un efecto comparable al del ibuprofeno a dosis de 75 mg/kg. El efecto analgésico del extracto, probablemente, ejerza su acción sobre los receptores sensibles viscerales de fenilquinona, o a la inhibición de la producción de sustancias que producen dolor, como las prostaglandinas, o la inhibición a nivel central de la transmisión de mensajes dolorosos (50). También, puede estar relacionado con la presencia de cumarinas, sustancias con actividad analgésica comprobada (51).
De acuerdo con los resultados obtenidos, se hace necesario profundizar en el estudio de R. alpinia (matandrea o achira de monte) con un modelo preclínico y acercar estos resultados al comportamiento mostrado en seres humanos, con el fin de contribuir a la búsqueda de soluciones que ayuden a proteger, guardar y reparar vidas, aliviar una carga económica y contribuir con las personas más expuestas a sufrir un accidente ofídico.
Conflicto de intereses
Los autores manifiestan que no se presenta ningún conflicto de intereses con autoridades públicas o privadas para su publicación.
Financiación
Este trabajo de investigación no se hubiera llevado a cabo sin la financiación de la Vicerrectoría de Investigación de la Universidad de Antioquia- Proyectos CODI-2008.
Correspondencia: Dora Benjumea, Calle 67 N° 53-108, bloque 2, oficina 123, Universidad de Antioquia, Barrio Sevilla, Medellín, Colombia Teléfonos: 219 5474 y 219 6535doraben2000@gmail.com
Referencias
1. World Health Organization. Listado de enfermedades desatendidas. 2009. Fecha de consulta: 13 de agosto de 2011. Disponible en: http://www.who.int/neglected_diseases/diseases/en/. [ Links ]
2. Williams D, Gutiérrez JM, Harrison R, Warrell DA, White J, Winkel KD, et al. The Global Snake Bite Initiative: An antidote for snake bite. Lancet. 2010;375:89-91. http://dx.doi.org/10.1016/S0140-6736(09)61159-4 [ Links ]
3. Gutiérrez JM, León G, Burnouf T. Antivenoms for the treatment of snakebite envenomings: The road ahead. Biologicals. 2011;39:129-42. http://dx.doi.org/10.1016/j.biologicals.2011.02.005 [ Links ]
4. Ault SK, Nicholls RS. Integrated approach to neglected tropical diseases in Latin America and the Caribbean: An ethical imperative to reach justice and social equity. Biomédica. 2010;30:159-63. [ Links ]
5. Organización Panamericana de la Salud. Informe final de la consulta técnica sobre accidentes con animales ponzoñosos en Latino América. Sao Paulo: Organización Panamericana de la Salud; 2007. p. 50. [ Links ]
6. Otero-Patiño R. Epidemiological, clinical and therapeutic aspects of Bothrops asper bites. Toxicon. 2009;54:998-1011. http://dx.doi.org/10.1016/j.toxicon.2009.07.001 [ Links ]
7. Instituto Nacional de Salud. Informe anual de accidente ofídico, 2010. Bogotá, D.C.: Instituto Nacional de Salud; 2011. p. 9-10. [ Links ]
8. Chipaux JP, Goyffon M. Venoms, antivenoms and immunotherapy. Toxicon. 1998;36:823-46. http://dx.doi.org/10.1016/S0041-0101(97)00160-8 [ Links ]
9.Maiorano VA, Marcussi S, Daher MA, Oliveira CZ, Couto LB, Gomes OA, et al. Antiophidian properties of the aqueous extract of Mikania glomerata. J Ethnopharmacol. 2005;102:364-70. http://dx.doi.org/10.1016/j.jep.2005.06.03910. [ Links ] Oliveira CZ, Maiorano VA, Marcussi S, Sant´ana CD, Januario AH, Lourenco MV, et al. Anticoagulant and antifibrinogenolytic properties of the aqueous extract from Bauhinia forficata against snake venoms. J Ethnopharmacol. 2005;98:213-6. http://dx.doi.org/10.1016/j.jep.2004.12.028 [ Links ]
11.Otero R, Núñez V, Barona J, Fonnegra R, Jiménez SL, Osorio RG, et al. Snakebites and ethnobotany in the northwest region of Colombia. Part III: Neutralization of the haemorrhagic effect of Bothrops atrox venom. J Ethnopharmacol. 2000;73:233-41. http://dx.doi.org/10.1016/S0378-8741(00)00321-4 [ Links ]
12. Otero R, Núñez V, Jiménez SL, Fonnegra R, Osorio RG, García ME, et al. Snakebites and ethnobotany in the northwest region of Colombia: Part II: Neutralization of lethal and enzymatic effects of Bothrops atrox venom. J Ethnopharmacol. 2000;71:505-11. http://dx.doi.org/10.1016/S0378-8741(99)00197-X [ Links ]
13. Alam MI, Gomes A. Snake venom neutralization by Indian medicinal plants (Vitex negundo and Emblica officinalis) root extracts. J Ethnopharmacol. 2003;86:75-80. http://dx.doi.org/10.1016/S0378-8741(03)00049-7 [ Links ]
14. Borges MH, Alves DL, Raslan DS, Pilo-Veloso D, Rodrigues VM, Homsi-Brandeburgo MI, et al. Neutralizing properties of Musa paradisiaca L. (Musaceae) juice on phospholipase A2, myotoxic, hemorrhagic and lethal activities of crotalidae venoms. J Ethnopharmacol. 2005;98:21-9. http://dx.doi.org/10.1016/j.jep.2004.12.014 [ Links ]
15. Pereáñez JA, Jiménez SL, Quintana JC, Núñez V, Fernández M, Restrepo Y. Inhibición de las actividades proteolítica, coagulante y hemolítica indirecta inducidas por el veneno de Bothrops asper por extractos etanólicos de tres especies de heliconias. Vitae. 2008;15:157-64. [ Links ]
16. Otero R, Fonnegra R, Jiménez SL, Núñez V, Evans N, Alzate SP, et al. Snakebites and ethnobotany in the northwest region of Colombia: Part I: Traditional use of plants. J Ethnopharmacol. 2000;71:493-504. http://dx.doi.org/10.1016/S0378-8741(00)00243-9 [ Links ]
17. Melo PA, do Nascimento MC, Mors WB, Suarez-Kurtz G. Inhibition of the myotoxic and hemorrhagic activities of crotalid venoms by Eclipta prostrata (Asteraceae) extracts and constituents. Toxicon. 1994;32:595-603. http://dx.doi.org/10.1016/0041-0101(94)90207-0 [ Links ]
18. Mors W. Plants active against snakebite. Economic y Medicinal Plant Research. 1991:5;353-73. [ Links ]
19. Oliveira CZ, Maiorano VA, Marcussi S, Sant´ana CD, Januario AH, Lourenco, et al. Anticoagulant and antifibrinogenolytic properties of the aqueous extract from Bauhinia forficata against snake venoms. J Ethnopharmacol. 2005;98:213-6. http://dx.doi.org/10.1016/j.jep.2004.12.028 [ Links ]
20. Coe FG. Rama midwifery in eastern Nicaragua. J Ethnopharmacol. 2008;117:136-57. http://dx.doi.org/10.1016/j.jep.2008.01.027 [ Links ]
21. Coelho-Ferreira M. Medicinal knowledge and plant utilization in an Amazonian coastal community of Maruda, Para State (Brazil). J Ethnopharmacol. 2009;126:159-75. http://dx.doi.org/10.1016/j.jep.2009.07.016 [ Links ]
22. Lognay G, Marlier M, Severin M, Haugruge E, Gibon V, Trevejo E. On the characterization of some terpenes from Renealmia alpinia Rottb. (Maas) Oleoresin. Flavour Frag J. 1991;6:87-91. [ Links ]
23. Yang SW, Zhou BN, Malone S, Werkhoven MC, van Troon F, Wisse JH, et al. A new labdane diterpenoid from Renealmia alpinia collected in the Suriname rainforest. J Nat Prod. 1999;62:1173-4. http://dx.doi.org/10.1021/np990055i [ Links ]
24. Zhou BN, Baj NJ, Glass TE, Malone S, Werkhoven MC, van Troon F, et al. Bioactive labdane diterpenoids from Renealmia alpinia collected in the Suriname rainforest. J Nat Prod. 1997;60:1287-93. http://dx.doi.org/10.1021/np970233c [ Links ]
25. Lomonte B, León G, Angulo Y, Rucavado A, Núñez V. Neutralization of Bothrops asper venom by antibodies, natural products and synthetic drugs: Contributions to understanding snakebite envenomings and their treatment. Toxicon. 2009;54:1012-28. http://dx.doi.org/10.1016/j.toxicon. 2009.03.015 [ Links ]
26. Núñez V, Otero R, Barona J, Fonnegra R, Jiménez SL, Osorio RG, et al. Inhibition of the toxic effects of Lachesis muta, Crotalus durissus cumanensis and Micrurus mipartitus snake venoms by plant extracts. Pharm Biol. 2004;42:49-56. http://dx.doi.org/10.1080/13880200490505483 [ Links ]
27. Alarcón JC, Martínez D, Quintana JC, Jiménez SL, Díaz A, Jiménez I. Propagación in vitro de Renealmia alpinia (ROTTB), planta con actividad antiofídica. Vitae. 2008;15:61-9. [ Links ]
28. Organization for Economic Cooperation and Development. Guidelines for testing of chemical. Guideline 423, acute oral toxicity&- acute toxic class method. Paris: OECD; 2001. [ Links ]
29. Gutiérrez JM, Ávila C, Rojas E, Cerdas L. An alternative in vitro method for testing the potency of the polyvalent antivenom produced in Costa Rica. Toxicon. 1988;26:411-3. http://dx.doi.org/10.1016/0041-0101(88)90010-4 [ Links ]
30. Theakston RD, Reid HA. Development of simple standard assay procedures for the characterization of snake venom. Bull World Health Organ. 1983;61:949-56. [ Links ]
31. Wang WJ, Shih CH, Huang TF. A novel P-I class metalloproteinase with broad substrate-cleaving activity, agkislysin, from Agkistrodon acutus venom. Biochem Biophys Res Commun. 2004;324:224-30. http://dx.doi.org/10.1016/j.bbrc.2004.09.031 [ Links ]
32. Siegmund E, Cadmus R, Lu G. A method for evaluating both non-narcotic and narcotic analgesics. Proc Soc Exp Biol Med. 1957;95:729-31. http://dx.doi.org/10.3181/00379727-95-23345 [ Links ]
33. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970;227:680-5. http://dx.doi.org/10.1038/227680a0 [ Links ]
34. Doménech J. Bioestadística. Métodos estadísticos para investigadores., 3ª edición. Barcelona: Editorial Herder; 1980. p. 642 [ Links ]
35. Dunnett CW, Gent M. Significance testing to establish equivalence between treatments, with special reference to data in the form of 2 x 2 tables. Biometrics. 1977;33:593-602. [ Links ]
36. Haslam E. Natural polyphenols (vegetable tannins) as drugs: Possible modes of action. J Nat Prod. 1996;59:205-15. http://dx.doi.org/10.1021/np960040+ [ Links ]
37. Iglesias CV, Aparicio R, Rodrigues-Simioni L, Camargo EA, Antunes E, Marangoni S, et al. Effects of morin on snake venom phospholipase A2 (PLA2). Toxicon. 2005;46:751-8.http://dx.doi.org/10.1016/j.toxicon. 2005.07.017 [ Links ]
38. McAllister TA, Bae HD, Yanke LJ, Cheng KJ, Muir A. Effect of condensed tannins from birdsfoot trefoil on endoglucanase activity and the digestion of cellulose filter paper by ruminal fungi. Can J Microbiol. 1994;40:298-305. [ Links ]
39. McDonald M, Mila I, Scalbert A. Precipitation of metal ions by plant polyphenols: Optimal conditions and origin of precipitation. J Agr Food Chem. 1996;44:599-606. http://dx.doi.org/10.1021/jf950459q [ Links ]
40. Markland FS. Snake venoms and the hemostatic system. Toxicon. 1998;36:1749-800. http://dx.doi.org/10.1016/S0041-0101(98)00126-3 [ Links ]
41. Otero-Patino R, Cardoso JL, Higashi HG, Núñez V, Díaz A, Toro MF, et al. A randomized, blinded, comparative trial of one pepsin-digested and two whole IgG antivenoms for Bothrops snake bites in Urabá, Colombia. The Regional Group on Antivenom Therapy Research (REGATHER). Am J Trop Med Hyg. 1998;58:183-9. [ Links ]
42. Otero R, Gutiérrez J, Mesa B, Duque E, Rodríguez O, Arango L, et al. Complications of Bothrops, Porthidium, and Bothriechis snakebites in Colombia. A clinical and epidemiological study of 39 cases attended in a university hospital. Toxicon. 2002;40:1107-14. http://dx.doi.org/10.1016/S0041-0101(02)00104-6 [ Links ]
43. Borges MH, Soares AM, Rodrigues VM, Oliveira F, Fransheschi AM, Rucavado A, et al. Neutralization of proteases from Bothrops snake venoms by the aqueous extract from Casearia sylvestris (Flacourtiaceae). Toxicon. 2001;39:1863-9. http://dx.doi.org/10.1016/S0041-0101(01) 00169-6 [ Links ]
44. Gowda T. Interaction of snake venom phospholipases A2 with plant isolates. En: Kini RM, editor. Venom phospholipase A2 enzymes. Chichester: Willey; 1997. p. 205-21. [ Links ]
45. Okonogi T, Hattori Z, Ogiso A, Mitsui S. Detoxification by persimmon tannin of snake venoms and bacterial toxins. Toxicon. 1979;17:524-7. http://dx.doi.org/10.1016/0041-0101 (79)90287-3 [ Links ]
46. Mors WB, do Nascimento MC, Parente JP, da Silva MH, Melo PA, Suarez-Kurtz G. Neutralization of lethal and myotoxic activities of South American rattlesnake venom by extracts and constituents of the plant Eclipta prostrata (Asteraceae). Toxicon. 1989;27:1003-9. [ Links ]
47. Tan HH. Epidemiology of snakebites from a general hospital in Singapore: A 5-year retrospective review (2004-2008). Ann Acad Med Singap. 2010;39:640-7. [ Links ]
48. Cintra-Francischinelli M, Caccin P, Chiavegato A, Pizzo P, Carmignoto G, Angulo Y, et al. Bothrops snake myotoxins induce a large efflux of ATP and potassium with spreading of cell damage and pain. Proc Natl Acad Sci USA. 2010;107:14140-5. http://dx.doi.org/10.1073/pnas.1009128107 [ Links ]
49. Lavonas EJ, Kokko J, Schaeffer TH, Mlynarchek SL, Bogdan GM, Dart RC. Short-term outcomes after Fab antivenom therapy for severe crotaline snakebite. Ann Emerg Med. 2011;57:128-37. http://dx.doi.org/10.1016/j.annemergmed.2010.06.550 [ Links ]
50. Mekonnen T, Urga K, Engidawork E. Evaluation of the diuretic and analgesic activities of the rhizomes of Rumex abyssinicus Jacq in mice. J Ethnopharmacol. 2010;127:433-9. http://dx.doi.org/10.1016/j.jep.2009.10.020 [ Links ]
51. Leal LK, Ferreira AA, Bezerra GA, Matos FJ, Viana GS. Antinociceptive, anti-inflammatory and bronchodilator activities of Brazilian medicinal plants containing coumarin: A comparative study. J Ethnopharmacol. 2000;70:151-9. http://dx.doi.org/10.1016/S0378-8741(99)00165-8 [ Links ]













