Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157
Biomédica vol.32 no.3 Bogotá jul./set. 2012
https://doi.org/10.7705/biomedica.v32i3.709
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v32i3.709
Laboratorio de Microbiología de Alimentos, Subdirección de Alimentos y Bebidas Alcohólicas, Instituto Nacional de Vigilancia de Medicamentos y Alimentos, Bogotá, D.C., Colombia
Recibido: 05/07/11; aceptado:20/04/12
Introducción. Listeria monocytogenes es un patógeno facultativo intracelular, oportunista, causante de graves infecciones en humanos, como meningitis, encefalitis y bacteriemias; también, es causa de abortos. Los alimentos actúan como medio de transporte para infectar al huésped.
La serotipificación ha discriminado trece serotipos: 1/2a,1/2b, 1/2c, 3a, 3b, 3c, 4a, 4ab, 4b, 4c, 4d, 4e, 7. El 4b es causante de la mayoría de listeriosis en el mundo.
Objetivo. Determinar la frecuencia en Colombia de los serotipos de L. monocytogenes aislados de alimentos, durante los años 2000-2009.
Materiales y métodos. Se trata de un estudio descriptivo y retrospectivo. Se analizaron 1.599 aislamientos, los cuales fueron confirmados como L. monocytogenes y otras especies de Listeria, con pruebas bioquímicas recomendadas por la Food and Drug Administration (Estados unidos) y utilización del sistema bioquímico api Listeria Biomérieux,serotipificadas con la metodología de Seeliger y Höhne.
Resultados. De los 1.599 aislamientos, 1.424 fueron confirmados como L. monocytogenes. Los serotipos encontrados fueron: 1/2a con 135 (9,5 %); 1/2b, 154 (10,8 %); 1/2c, 68 (4,8 %); 3a, 4 (0,3 %); 3b, 29 (2,0 %); 3c,2 (0,1 %); 4a, 44 (3,1 %); 4b, 820 (57,6 %); 4c, 6 (0,4 %); 4d- 4e, 140 (9,8 %); 4e, 17 (1,2 %); 7, 2 (0,1 %); y tres no serotipificables, (0,2 %). Los aislamientos procedían principalmente de Bogotá, 1.035 (73 %); de Antioquia, 199 (14 %); de Nariño, 109 (8 %); del Valle del Cauca, 50 (3,5 %), y de otros departamentos, 33 (2,3 %).
Conclusión. En los aislamientos analizados, 1.424 (89 %) correspondieron a L. monocytogenes, presentando una buena calidad en el aislamiento e identificación; la mayoría de estos aislamientos pertenecían al serotipo 4b, 820 (57,6 %), serotipo muy virulento. Se recomienda la vigilancia obligatoria de este microorganismo.
Palabras clave: Listeria monocytogenes, listeriosis, caracterización fenotípica, serotipos, vigilancia epidemiológica, salud pública.
doi: http://dx.doi.org/10.7705/biomedica.v32i3.709
Distribution of Listeria monocytogenes serotypes isolated from foods, Colombia, 2000-2009
Introduction. Listeria monocytogenes is an intracellular, opportunistic pathogen which can cause severe infections such as meningitis, encephalitis and bacteremia. It can also cause abortions in human beings. Foods are the vehicle for infection of the host. Serotypification has discriminated 13 serotypes: 1/2a,1/2b, 1/2c, 3a, 3b, 3c, 4a, 4ab, 4b, 4c, 4d, 4e, 7. 4b is the cause of the majority of cases of listeriosis in the world.
Objective. The frequency of serotypes of L. monocytogenes was determined in bacteria isolated from foods in Colombia.
Materials and methods. The study is descriptive and retrospective. Over a 10-year period, 2000-2009, 1,599 isolates were examined. All were confirmed as Listeria monocytogenes and other strains of Listeria, using biochemical tests recommended by the Food and Drug Administration (USA) and API Listeria and serotyped using the Seeliger and Höhne method.
Results. Of the 1,599 isolates, 1,424 were confirmed as L. monocytogenes. Serotypes identified were: 1/2a, 135 (9.5%); 1/2b, 154 (10.8%); 1/2c, 68 (4.8%); 3a, 4 (0.3%); 3b, 29 (2.0%); 3c, 2 (0.1%); 4a, 44 (3.1%); 4b, 820 (57.6%); 4c, 6 (0.4%); 4d- 4e, 140 (9.8%); 4e, 17 (1.2%); 7, 2 (0.1%); not susceptible of serotypification, three cases, (0.2%). Isolates came mainly from the Capital District of Bogotá, 1,035 (73%); from Antioquia 199 (14%), from Nariño, 109 (8%); from Valle del Cauca 50 (3,5%) and from other provinces 33 (2.3%).
Conclusion. Of the analyzed isolates, 1,424 (89%) belonged to L. monocytogenes, showing a good quality in isolation and identification. Most of these isolates belonged to serotype 4b, 820 (57.6%), a highly virulent serotype. Obligatory surveillance of this microorganism is recommended.
Key words: Listeria monocytogenes, listeriosis, characterization phenotype, serotypes, epidemiological surveillance, public health.
doi: http://dx.doi.org/10.7705/biomedica.v32i3.709
El género Listeria actualmente incluye ocho especies reconocidas (1,2), las seis especies anteriormente conocidas: L. monocytogenes, L. innocua, L. seeligeri, L. welshimeri, L. grayi y L. ivanovii (3), y dos nuevas especies que han sido descritas: L. rocourtiae (4) y L. marthii (5). Listeria monocytogenes y L. ivanovii se consideran patógenas para los animales, y L. monocytogenes, patógena para los humanos (1-4,6).
Listeria monocytogenes es un bacilo Gram positivo, patógeno facultativo intracelular y oportunista (1,6-8); su temperatura de crecimiento es de 1 a 45 °C (9,10), puede desarrollarse a temperaturas de refrigeración (9,11,12), crece en un amplio rango de pH, de 4,4 a 9,6 (10,13), y puede desarrollarse con altas concentraciones de cloruro de sodio (6,10,14). Está ampliamente distribuido en la naturaleza (1,3,7), se adhiere a las superficies que están en contacto con los alimentos, formando biopelículas (1,6,13,15,16) y, de esta forma, se protege de los desinfectantes y se convierte en un patógeno difícil de controlar en el ambiente de las fábricas de producción de alimentos (6,15,16), siendo posible la contaminación en cualquier etapa de la cadena de producción, y convirtiendo a los alimentos en vehículos para llegar al hombre y producir enfermedad (13,17).
Listeria monocytogenes es el agente etiológico de la listeriosis humana(3,8,9), una enfermedad transmitida por alimentos que representa un problema importante en la salud pública (17-19), debido al impacto que tiene la gravedad de sus síndromes, la incidencia residual de sus síntomas y el alto costo en hospitalizaciones, lo que origina costos elevados y una alta letalidad (3,6,8). También, repercute económicamente a nivel nacional e internacional, debido a la pérdida de alimentos contaminados con este microorganismo que son retirados de los mercados (1,6,18).
Listeria monocytogenes es causante de graves infecciones como meningitis (3,20-22), encefalitis (3,20), bacteriemias (3,6,20,21), septicemias (3,21,22), absceso cerebral o espinal, listeriosis pontobulbar, romboencefalitis (6) o meningoencefalitis (3,6). En el embarazo ocurre infección en el feto o en el recién nacido, dando origen a abortos espontáneos (3,6,21,22), muerte fetal (3,6,21) enfermedad y muerte neonatal (23). Esta listeriosis afecta a grupos de población vulnerables como mujeres en estado de gravidez, niños en periodo neonatal, personas ancianas y personas con fallas en el sistema inmunológico (3,6,20), pero también, afecta a adultos inmunocompetentes (3,6,20,21).
Listeria monocytogenes es causante también de infecciones no graves, como es la gastroenteritis febril que produce síntomas como diarrea, fiebre, cefalea y mialgias, con un periodo de incubación corto (3,6,20,22).
La listeriosis cobra importancia a partir de los brotes ocurridos en las últimas décadas del siglo XX (6,13,22), en Estados Unidos (22,24), Canadá (13,25), Europa (26,27) y Chile (28). Sin embargo, sigue siendo una enfermedad de rara presentación (13,21), si la comparamos con otras enfermedades transmitidas por alimentos, pero con una mortalidad alrededor del 20 al 30 % (1,3,29).
En Colombia son muy pocos los reportes de casos y brotes de listeriosis, debido a que no es una enfermedad de notificación obligatoria.
En el 2009 se notificaron al Sistema de Vigilancia en Salud Pública (Sivigila) tres brotes (30). Se detectó L. monocytogenes en restos de alimentos consumidos por las personas enfermas. En dos de estos brotes los alimentos implicados fueron comidas preparadas listas para consumir y el tercer brote correspondió al consumo de queso fresco; en este se aisló L. monocytogenes tanto de alimentos como del líquido cefalorraquídeo (31).
Los alimentos que con mayor frecuencia se han asociado con L. monocytogenes, son: quesos frescos, productos lácteos, patés, ensaladas, productos de delicatessen, productos industrializados, productos refrigerados listos para el consumo, salchichas, pescados ahumados, cárnicos ahumados, helados y productos de mar (3,13,17,21,32,33).
Debido a la seriedad de la listeriosis, la política de regulación en alimentos de los Estados Unidos en los programas de muestreo no acepta la presencia de L. monocytogenes en los alimentos que están listos para consumir y en los que puede crecer esta bacteria, y en todos los alimentos cocidos (11,32). En Colombia, el hallazgo de L. monocytogenes en estos alimentos implica la implementación de medidas sanitarias correspondientes al Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima); nuestro país comparte el mismo criterio establecido en las políticas de regulación de los Estados Unidos.
Se han utilizado varios métodos para diferenciar las cepas de L. monocytogenes. Uno de ellos es la tipificación serológica, que es un método fenotípico que ha sido una herramienta en el diagnóstico de Listeria spp. (34,35) para determinar la prevalencia de serotipos específicos en estudios epidemiológicos y rastreos de contaminaciones ambientales (7,34,35). El esquema utilizado actualmente, es el de Paterson modificado por Seeliger y Höhne (34,35). Es el primer sistema de tipificación que permite un análisis epidemiológico de la listeriosis (34). Está basado en la detección de antígenos somáticos y flagelares mediante antisueros polivalentes y monovalentes (34), lo que ha permitido caracterizar la especie L. monocytogenes en trece serotipos (7,16,32,36): 1/2a, 1/2b, 1/2c, 3a, 3b, 3c, 4a, 4ab, 4b, 4c, 4d, 4e y 7 (34,37).
En estudios moleculares previos de la estructura filogenética de L. monocytogenes, se dan a conocer tres divisiones genéticas, las cuales son consideradas en tres reconocidos linajes (1,6,7,8,13,38): el linaje I contiene serotipos 4b, 1/2b, 3b, 4d , 4e y 7; el linaje II, serotipos 1/2a, 1/2c, 3a y 3c; el linaje III incluye tres grupos, III A, IIIB y IIIC, (1,38,39) y los serotipos 4a , 4c y 4b (1,3,7,8,38).
El linaje I contiene todas las cepas epidémicas de brotes y casos de listeriosis humanas clínicas y transmitidas por alimentos (6,8,38). El linaje II contiene aislamientos de casos de humanos (1,38,39) y animales (6,38,39), muestras ambientales y de alimentos (1,8,38,39). El linaje III está asociado con aislamientos de animales (1,8,38,39); pocas listeriosis humanas se han descrito en este linaje.
En estudios recientes de subtipicación molecular de L. monocytogenes, se reporta la existencia de un cuarto linaje (2,39,40,41) conformado por los serotipos pertenecientes al grupo IIIB, que es genéticamente diferente al linaje III (40,41) y está asociado con aislamientos de humanos, de animales y de alimentos (39,41).
No todas las cepas de L. monocytogenes parecen tener igual capacidad de causar enfermedad en humanos (1,6,7,36,39). Los serotipos responsables de la mayoría de las listeriosis humanas han sido: 1/2 a, 1/2b, 1/2c y 4b (1,7,32,42); sin embargo, caracterizaciones fenotípicas y genotípicas relacionadas sugieren que el serotipo 4b aislado ha sido responsable de los más importantes brotes de listeriosis humanas transmitidas por alimentos (1,3,6,7,14,42). En ambientes de fábricas y en alimentos, se han aislado con mayor frecuencia los serotipos 1/2 a (16,43,44) y 1/2b (45).
Los análisis de rutina de tipificación serológica de L. monocytogenes con el método tradicional de aglutinación (34,42), tienen sus limitaciones por costos, asequibilidad, disponibilidad de los sueros, buena calidad en su preparación y experiencia técnica para efectuar el ensayo; estos factores hacen que la reproducibilidad de la serotipificación no siempre sea satisfactoria (42) y, además, solamente discrimina trece serotipos (7,13). Por lo tanto, el laboratorio de Listeria del Instituto Pasteur de París y el Centro Colaborativo de la Organización Mundial de la Salud (OMS) para la listeriosis de origen alimentario, ha desarrollado el método de PCR múltiple para diferenciar cuatro principales serotipos 1/2a, 1/2b, 1/2c y 4b, como método alternativo de la tipificación serológica de Listeria (42,46).
Según los datos coleccionados por el Centro Nacional de Referencia en Francia, los serotipos 1/2a, 1/2b, 1/2c y 4b representan el 98 % de 5.000 aislamientos recolectados de alimentos y de pacientes, los cuales fueron separados en cuatro perfiles diferentes mediante esta metodología (42,46).
En la investigación de brotes de listeriosis, la caracterización de los serotipos de L. monocytogenes proporciona una valiosa información, la cual permite diferenciar entre aislamientos pertenecientes a un brote y aquellos que no forman parte del mismo y, así, disminuir el número de cepas que necesitan ser caracterizadas por electroforesis en campo pulsado (PFGE) (13,32,42), prueba que tiene una mayor discriminación, se considera el método de referencia e identifica el subtipo molecular involucrado en el brote (13,41,42).
En estudios previos sobre la presencia de L. monocytogenes en diferentes alimentos, efectuados por el Laboratorio de Microbiología de Alimentos del Invima, se demostró que este microorganismo es muy frecuente (47). Por lo tanto, el Invima incluyó L. monocytogenes como un indicador de inocuidad en la vigilancia de los alimentos que son de su competencia en el país, vigilancia rutinaria ejercida por las entidades territoriales que le remiten los aislamientos de L. monocytogenes.
En el año 2000, se creó la Red Nacional de Vigilancia Microbiológica de Listeria monocytogenes, a la cual pertenecen todos los laboratorios de salud pública de los departamentos y del distrito capital del país, siendo obligatorio el envío de sus aislamientos al laboratorio de referencia del Invima para su confirmación y serotipificación.
Los objetivos de este estudio fueron confirmar los aislamientos pertenecientes a L. monocytogenes y determinar la frecuencia de los serotipos que circulan en el país, procedentes de los alimentos que son motivo de vigilancia, remitidos por los laboratorios de salud pública pertenecientes a la red, como también, los serotipos implicados en casos de brotes en el periodo comprendido entre el 2000 y el 2009, a partir de la vigilancia microbiológica de L. monocytogenes.
Materiales y métodos
Se llevó a cabo un estudio descriptivo y retrospectivo para establecer la frecuencia de los serotipos de los aislamientos de L. monocytogenes recibidos en el Laboratorio de Microbiología de Alimentos del Invima durante los años 2000 a 2009. Se procesaron todos los aislamientos enviados por los laboratorios de alimentos de los servicios de salud pública de Bogotá, Antioquía, Nariño, Valle del Cauca, Cundinamarca y Caldas, y el Laboratorio de Referencia Nacional del Invima, como parte del programa de vigilancia de los alimentos que se consumen en el país, cumpliendo con los requisitos de envío de material biológico y condiciones de procedimiento establecidos por este último organismo. No se recuperaron aislamientos de L. monocytogenes en las entidades restantes. Los aislamientos fueron confirmados y serotipificados. Durante esta década, se recibieron 1.599 aislamientos: 93 en el 2000, 44 en el 2001, 69 en el 2002, 175 en el 2003, 127 en el 2004, 194 en el 2005, 225 en el 2006, 250 en el 2007, 203 en el 2008, y 219 en el 2009.
Los alimentos de los cuales se aislaron L. monocytogenes, se clasificaron por grupos y estos, a su vez, en categorías, como también de acuerdo con su procedencia.
La identificación de cepas fue hecha de acuerdo con el procedimiento del Bacteriological Analytical Manual de la Food and Drug Administration (FDA) (37),que consiste en la coloración de Gram, la prueba de la catalasa, las pruebas bioquímicas para identificar la utilización de ramnosa, xilosa y manitol, el crecimiento en forma de sombrilla en agar de motilidad, las pruebas de hemólisis y la de Christie-Atkins-Munch-Peterson (CAMP), y el uso del sistema bioquímico api Listeria Biomérieux.
Para la tipificación de la bacteria, se siguió el protocolo de Seeliger y Höhne (34), desarrollado y enseñado por el Laboratorio de Listeria del Instituto Pasteur y verificado por el Laboratorio de Microbiología de Alimentos del Invima (48). Esta metodología incluye los siguientes factores somáticos: factor I, I/II, III, IV, V/VI, VI, VII, VIII, IX, X, XI, XII, XIII, XII/XIII y XV, y los factores flagelares A, AB, C, D y E. Estos factores se produjeron en el Laboratorio de Microbiología de Alimentos del Invima, mediante la inmunización de conejos con la utilización del Bioterio del Instituto Nacional de Salud. También se utilizaron sueros comerciales Eurobio. Se siguió el protocolo para la identificación del serotipo, enseñado por el Laboratorio de Listeria del Instituto Pasteur. Este laboratorio llevó a cabo el control de calidad externo para la serotipificación de los aislamientos encontrados.
Se utilizó el programa Microsoft Office Excel 2007® para calcular las frecuencias y proporciones, y luego se hizo el análisis univariado y bivariado de este estudio.
Resultados
De los 1.599 aislamientos recibidos para confirmación y serotipificación de L. monocytogenes, 1.424 (89 %) fueron confirmados como L. monocytogenes, 127 (8 %) como L. innocua, 39 (2,4%) como L. seeligeri y 9 (0,6 %) como L. welshimeri.
A aislamientos recibidos para control de calidad de alimentos, objeto de vigilancia del Invima y de los laboratorios de salud pública del país, correspondieron 1.592 (99,6 %), y siete aislamientos (0,4 %), a brotes de enfermedad transmitida por alimentos (cuadro 1).

Según su procedencia, se observó mayor frecuencia de L. monocytogenes en Bogotá, Antioquia, Nariño y Valle del Cauca (figura 1).
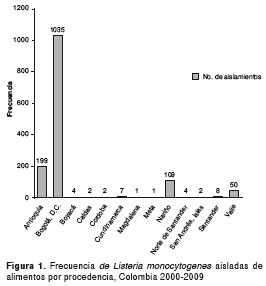
En los aislamientos de los alimentos confirmados por el laboratorio del Invima, la frecuencia de los serotipos de L. monocytogenes se distribuyó, según su procedencia, así: 1.035 (73 %) de Bogotá; 199 (14 %) de Antioquia; 109 (8 %) de Nariño; 50 (3,5%) del Valle del Cauca, y 33 (2,3%) de los departamentos de Santander, Cundinamarca, Boyacá, Caldas, Córdoba, San Andrés, Magdalena y Norte de Santander. Las categorías de alimentos, más frecuentes, según su procedencia, fueron: leches y derivados lácteos, con 486 (34,1%) de Bogotá, y carnes y derivados cárnicos, con 326 (22,9%) aislamientos de Bogotá (49).
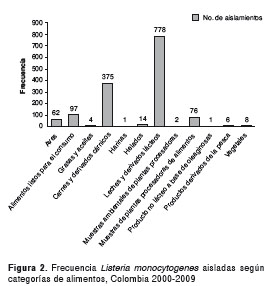
En general, las categorías de alimentos con mayor frecuencia de aislamientos de L. monocytogenes, fueron leches y derivados lácteos, carnes y derivados cárnicos (figura 2).
Se encontraron 12 serotipos, entre los cuales el más frecuente fue el 4b (figura 3).
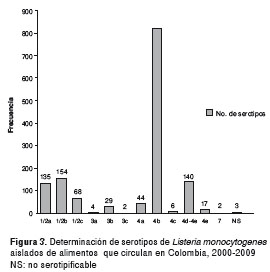
Los serotipos de L. monocytogenes encontrados en los aislamientos de las diferentes categorías de alimentos, según su frecuencia, se distribuyeron así: 1/2a en 135 (9,5 %); 1/b en 154 (10,8 %); 1/2c en 68 (4,8 %); 3a en 4 (0,3 %); 3b en 29 (2,0 %); 3c en 2 (0,1 %); 4a en 44 (3,1 %); 4b en 820 (57,6 %); 4c en 6 (0,4 %); 4d-4e en 140 (9,8 %); 4e en 17 (1,2 %); 7 en 2 (0,1 %), y no serotipificables en 3 (0,2%) (50).
Los grupos de alimentos con mayor frecuencia de aislamientos, fueron los quesos frescos, los cárnicos cocidos y las leches. En los quesos frescos se encontraron 563 (39,5 %) aislamientos y el serotipo con mayor proporción fue el 4b con 280 (19,7%). En los cárnicos cocidos hubo 295 (20,7 %) aislamientos y el serotipo más frecuente fue el 4b con 164 (11,5 %). En las leches hubo 154 (10,8%) aislamientos y el serotipo más frecuente fue el 4b, con 121 (8,5 %) (51).
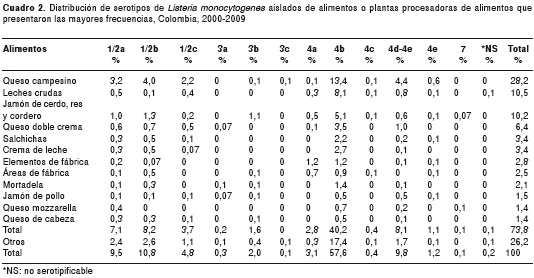
Con respecto a los alimentos, los quesos campesinos (del grupo de quesos frescos) mostraron la mayor frecuencia, con 401 (28,2 %) aislamientos de L. monocytogenes. En las leches crudas se encontraron 149 (10,5 %) aislamientos y, en los jamones de cerdo, de res y de cordero, 145 (10,2 %). El serotipo predominante en los alimentos fue el 4b (cuadro 2).
Discusión
A pesar de que L. monocytogenes no está legislada todavía en el país como patógeno indicador de inocuidad, se la ha contemplado por ser un microorganismo causante de enfermedades transmitidas por alimentos. Por consiguiente, la implementación de la tipificación serológica ha sido de gran importancia para identificar los serotipos que circulan en el país y aquellos comprometidos con listeriosis. Gracias a que últimamente se está fortaleciendo la vigilancia de las enfermedades transmitidas por alimentos en el país, se encontraron siete aislamientos involucrados en este tipo de enfermedad, de los cuales, cinco pertenecían al serotipo 4b; según los hallazgos en los diversos brotes acaecidos en el mundo, este serotipo se considera muy virulento y, generalmente, de origen humano (1,3,6,7,14,42).
El distrito de Bogotá fue la entidad territorial que envió al laboratorio de referencia en estos diez años un mayor número de aislamientos de L. monocytogenes de alimentos de vigilancia rutinaria. Esto puede deberse, posiblemente, a la existencia de un mejor sistema de vigilancia para este patógeno en esta entidad de salud. En los alimentos, se encontraron diversos serotipos circulantes y los más frecuentes fueron 4b, 1/2a, 1/2b, 4d-4e. La mayor frecuencia correspondió al serotipo 4b (57,6%). Los serotipos 4b,1/2a y 1/2b se han relacionado con brotes o casos de listeriosis (1,3,6,7,32,42); no así, los serotipos 4d y 4e (1,3). Todos los serotipos de L. monocytogenes se siguen considerando potencialmente patógenos para efectos de salud pública, hasta que existan metodologías que permitan cuantificar el grado de virulencia de un determinado serotipo y su capacidad de infectar a un determinado huésped según su estado inmunológico (1).
Según la procedencia, se encontró que el serotipo 4b fue el más frecuente en casi todos los departamentos. De todos los alimentos, es evidente que el grupo de quesos frescos (que incluye quesos campesinos y quesos doble crema), es del que se aisló con mayor frecuencia L. monocytogenes y el serotipo encontrado en su mayoría fue el 4b; esto se debe a la riqueza de sus nutrientes, pH≥4,4, humedad relativa mayor de 34 %, gran actividad de agua (≥0,92), conservación prolongada a temperaturas de refrigeración, elaboración artesanal y, posiblemente, con leche sin pasteurizar en muchos casos, y malas prácticas de manufactura en general, las cuales permiten el desarrollo de este microorganismo.
Se observó un porcentaje bajo de aislamientos procedentes del grupo de quesos madurados (0,6 %). A pesar de tener una actividad de agua ≤0,92, el desarrollo de L. monocytogenes en este tipo de quesos es posible por las características de crecimiento del microorganismo, las temperaturas bajas en que se conservan y los amplios rangos de pH en los que puede crecer.
Se encontró también una alta frecuencia de aislamientos de L. monocytogenes en las leches crudas (10,4 %), y una alta frecuencia del serotipo 4b (8,1 %). Esto se debe a que son leches no pasteurizadas, posiblemente pertenecen a programas de vigilancia del distrito de Bogotá, pues en algunos lugares se comercializan leches crudas.
Los jamones cocidos de cerdo, cordero y res, que presentaron una alta contaminación con L. monocytogenes, son alimentos ricos en nutrientes, con pH ≥4,4, y actividad de agua ≥0,92, muchas veces con largos periodos de conservación a bajas temperaturas. Esto, unido a deficiencias de higiene a lo largo de toda la cadena de producción, procedimiento, conservación, transporte, fraccionamiento y manipulación en la venta de estos productos, los hacen vulnerables al crecimiento de L. monocytogenes. Además, las concentraciones de nitritos como conservantes permitidas para este tipo de productos, no inhiben el crecimiento deeste microorganismo (21).
La alta presencia del serotipo 4b en estos alimentos implica mayores acciones de vigilancia y control de ellos, puesto que lo usual es encontrar mayores frecuencias de serotipos 1/2a, 1/2b y 1/2c (16,43,44,45). Sería conveniente hacer estudios posteriores para determinar la causa de la frecuencia tan alta del serotipo 4b, que amerita mayores acciones de vigilancia y control. Todos los serotipos informados en el presente estudio se encuentran en el laboratorio formando parte de la colección de cepas de L. monocytogenes aisladas de alimentos a nivel nacional.
Una dificultad en este estudio fue la clasificación de la procedencia de algunos aislamientos, como la de algunos quesos frescos, debido a que la información enviada al laboratorio no estaba completa.
Se hacen las siguientes recomendaciones a las fábricas productoras de alimentos del país.
1) Implementar un buen control de calidad como es el sistema de análisis de peligros y puntos críticos de control (APPCC) en todas las fábricas de alimentos (52-54).
2) Implementar buenas prácticas de manufactura con procedimientos sanitarios estandarizados (52,54).
3) Implementar la vigilancia ambiental de Listeria spp. en las fábricas de alimentos, como se hace en los países industrializados (52).
4) Implementar un intensivo programa de muestreo en las plantas procesadoras de alimentos de alto riesgo y efectivas acciones correctivas para reducir la contaminación en estos alimentos (52,54).
5) Usar tratamientos térmicos posteriores al empaque (54).
A las autoridades sanitarias directamente relacionadas con las enfermedades trasmitidas por alimentos, se les recomienda la elaboración de programas que contribuyan al fortalecimiento de la normatividad sobre la vigilancia, la reducción y el control de este microorganismo.
A pesar de los esfuerzos del Instituto Nacional de Salud y del Invima, para la formación y educación mediante materiales didácticos, se recomiendan los modelos de educación y prevención para L. monocytogenes empleados por otros países, como Estados Unidos y Francia (55,56).
Se recomienda incluir en la legislación colombiana de alimentos, el análisis de la presencia de L. monocytogenes en 25 g de muestra, como parámetro de inocuidad en los alimentos que por sus características intrínsecas y extrínsecas permiten su crecimiento, como son los alimentos listos para su consumo.
También, se recomienda la inclusión de la listeriosis como enfermedad de notificación obligatoria en el país.
A los laboratorios de Salud Pública de Bogotá D.C., Antioquia, Nariño, Valle del Cauca, Caldas, Cundinamarca, y al Laboratorio de Referencia para Listeria del Invima, por su activa participación en la Red Nacional de Vigilancia Microbiológica de Listeria y por la recuperación de los aislamientos de L. monocytogenes que han hecho posible este estudio.
Al Laboratorio de Listeria del Centro Colaborativo de la OMS para la listeriosis de origen alimentario del Instituto Pasteur de París, por su colaboración en el control de calidad externo para la tipificación serológica de los aislamientos.
A Jaime Moreno, coordinador del Grupo de Microbiología del Instituto Nacional de Salud, por la revisión del manuscrito.
A Oscar Eduardo Pacheco, coordinador del Grupo de Epidemiología Aplicada del Instituto Nacional de Salud, por la valiosa colaboración en la corrección, análisis e interpretación de resultados y la lectura crítica del presente artículo.
Declaro que durante la realización del trabajo no existió conflicto de intereses de ningún tipo.
Este estudio fue financiado por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos, como trabajo del área misional.
Correspondencia: Ana Isabel Muñoz, Laboratorio de Microbiología de Alimentos, Subdirección de Alimentos y Bebidas Alcohólicas, Instituto Nacional de Vigilancia de Medicamentos y Alimentos, Bogotá, D.C., Colombia Teléfono: (571) 220 7700, extensión 1221; fax: (571) 220 7700, extensión 1221 amunozc@invima.gov.co y anisabel2001@yahoo.com
1. Velge P, Roche SM. Variability of Listeria monocytogenes virulence: A result of the evolution between saprophytism and virulence? Rev Fut Microbiol. 2010;5:1799-821. http://dx.doi.org/10.2217/fmb.10.134 [ Links ]
2. Bakker HC, Cummings CA, Ferreira V, Vatta P, Orsi RH, Degoricija L, et al. Comparative genomics of the bacterial genus Listeria: Genome evolution is characterized by limited gene acquisition and limited gene loss. BMC Genomics. 2010;11:688-708. http://dx.doi.org/10.1186/1471-2164-11-688 [ Links ]
3. Vásquez-Boland JA, Kuhn M, Berche P, Chakraborty T, Domínguez-Bernal G, Goebel W, et al. Listeria pathogenesis and molecular virulence determinants. Clin Microbiol Rev. 2001;14:584-640. http://dx.doi.org/10.1128/CMR.14.3.584-640.2001 [ Links ]
4. Leclercq A, Clermont D, Bizet CH, Grimont P, Le-Fléche-Matéos A, Roche S, et al. Listeria rocourtiae sp. nov. Int J Syst Evol Microbiol. 2010;60:2210-4. http://dx.doi.org/10.1099/ijs.0.017376-0 [ Links ]
5. Graves LM, Helsel LO, Steigerwalt AG, Morey RE, Daneshvar MI, Roof SE, et al. Listeria marthii sp. nov. isolated from the natural environment, Finger Lakes National Forest. Int J Syst Evol Microbiol. 2010;60:1280-8. http://dx.doi.org/10.1099/ijs.0.014118-0 [ Links ]
6. Oevermann A, Zurbriggen A, Vandevelde M. Rhomboencefalitis caused by Listeria monocytogenes in humans and ruminants: A zoonosis on the rise? Interdiscip Persp Infect Dis. 2010;2010:1-22. http://dx.doi.org/10.1155/2010/632513 [ Links ]
7. Ragon M, Wirth T, Hollandt F, Lavenir R, Lecuit M, Le Monnier A, et al. New perspective on Listeria monocytogenes evolution. Plos Pathog. 2008;4:149-60. http://dx.doi.org/10.1371/journal.ppat.1000146 [ Links ]
8. van Stelten A, Nightingale KK. Development and implementation of a multiplex single-nucleotide polymorphism genotyping assay for detection of virulence-attenuating mutations in the Listeria monocytogenes virulence-associated gene inlA. Appl Environ Microbiol. 2008;74:7365-75. http://dx.doi.org/10.1128/AEM.01138-08 [ Links ]
9. Bayles DO, Annous BA, Wilkinson BJ. Cold stress proteins induced in Listeria monocytogenes in response to temperature down shock and growth at low temperatures. Appl Environ Microbiol. 1996;62:1116-9. [ Links ]
10. Seeliger HP, Jones D. Bergey´s manual of determinative bacteriology.Baltimore: The Williams and Wilkins, Co.; 1986. p. 1235-45. [ Links ]
11. Najjar MB, Chikindas M, Montville T. Changes in Listeria monocytogenes membrane fluidity in response to temperatures stress. Appl Environ Microbiol. 2007;73:6429-35. http://dx.doi.org/10.1128/AEM.00980-07 [ Links ]
12. Walker SJ, Archer P, Banks JG. Growth of Listeria monocytogenes at refrigeration temperatures. J Appl Bacteriol.1990;68:157-62. http://dx.doi.org/10.1111/j.1365-2672.1990.tb02561.x [ Links ]
13. Gilmour MW, Graham M, Domselaar GV, Tyler S, Kent H, Trout-Yake KM, et al. High-throughput genome sequencing of two Listeria monocytogenes clinical isolates during a large foodborne outbreak. BMC Genomics. 2010;11:1471-85. http://dx.doi.org/10.1186/1471-2164-11-120 [ Links ]
14. Cole NB, Jones MV, Holyoak C. The effect of pH, salt concentration and temperature on the survival and growth of Listeria monocytogenes. J Appl Bact.1990;69:63-72. [ Links ]
15. Wong AC. Biofilms in food processing environments. J Dairy Sci.1998;81:2765-70. http://dx.doi.org/10.3168/jds.S0022-0302(98)75834-5 [ Links ]
16. Pan Y, Breidt F Jr, Kathariou S. Competition of Listeria monocytogenes se rotype 1/2 a and 4 b strains in mixed-culture biofilms. Appl Environ Microbiol. 2009;75:5846-52. http://dx.doi.org/10.1128/AEM.00816-09 [ Links ]
17. Felicio MT, Hogg T, Gibbs P, Teixeira P, Wiedmann M. Recurrent and sporadic Listeria monocytogenes contamination in Alheiras represents considerable diversity, including virulence-attenuated isolates. Appl Environ Microbiol. 2007;73:3887-95. http://dx.doi.org/10.1128/AEM.02912-06 [ Links ]
18. Jemmi T, Stephan R. Listeria monocytogenes: Food-borne pathogen and hygiene indicator. Rev Sci Tech. 2006;25:571-80. [ Links ]
19. Rebagliati V, Philippi R, Rossi M, Troncoso A. Prevention of foodborne listeriosis. Indian J Pathol Microbiol. 2009;52:145-9. http://dx.doi.org/10.4103/0377-4929.48903 [ Links ]
20. Mammina C, Aleo A, Romani C, Pellissier N, Nicoletti P, Pecile P, et al. Characterization of Listeria monocytogenes isolates from human listeriosis cases in Italy. J Clin Microbiol. 2009;47:2925-30. http://dx.doi.org/10.1128/8203;JCM.00102-09 [ Links ]
21. Rossi ML, Paiva A, Mariela T, Chianelli S, Troncoso A. Brotes de infección por Listeria monocytogenes: una revisión de las vías que llevan a su aparición. Rev Chil Infect. 2008;25:328-35. http://dx.doi.org/10.4067/S0716-10182008000500002 [ Links ]
22. Graves LM, Hunter SB, Ong AR, Schoonmaker-Bopp D, Hise K, Kornstein L, et al. Microbiological aspects of the investigation that traced the 1998 outbreak of listeriosis in the United States to contaminated hot dogs and establishment of molecular subtyping-based surveillance for Listeria monocytogenes in the Pulse Net Network. J Clin Microbiol. 2005;43:2350-5. . http://dx.doi.org/10.1128/JCM.43.5.2350-2355.2005 [ Links ]
23. Payán A, Estudillo M. Listeriosis neonatal: ¿enfermedad poco frecuente o no diagnosticada? Enfoque microbiológico. Colombia Med. 1994;25:69-72. [ Links ]
24. Linan MJ, Mascola L, Lou XD, Goulet V, May S, Salminen D, et al. Epidemic listeriosis associated with Mexican-style cheese. N Engl J Med. 1988;319:823-8. [ Links ]
25. Schlech WF 3rd, La Vigne PM, Bortolussi RA, Allen AC, Haldane EV, Haldane EV, et al. Epidemic listeriosis-evidence for transmission by food. New Engl Med. 1983;308:203-6. [ Links ]
26. Rocourt J. Listeria monocytogenes: The state of the science. Dairy Food and Environmental Sanitation. 1994;14:70-82. [ Links ]
27. Freetz R, Sagel U, Ruppitsch W, Pietzka A, Stoger A, Huhulescu S, et al. Listeriosis outbreak caused by acid curd cheese quargel, Austria and Germany 2009. Euro Surveill. 2010;15:19477. [ Links ]
28. De Wikipedia, la enciclopedia libre. Brote de listeriosis de 2008-2009 en Chile. Chile: Ministerio de Salud, 2010. p. 7. Fecha de consulta: 7 de diciembre de 2010. Disponible en: http://es.wikipedia.org/wiki/brote_de_listeriosis_de_2008-2009_en Chile. [ Links ]
29. Kim JW, Siletzky RM, Kathariou S. Hot ranges of Listeria -specific bacteriophages from the turkey processing plant environment in the United States. Appl Environ Microbiol. 2008;74:6623-30. http://dx.doi.org/10.1128/AEM.01282-08 [ Links ]
30. Espinoza J, López MP, Álvarez CJ, Chaves JA, Guerrero JA. Informe de vigilancia de las enfermedades transmitidas por alimentos, semanas epidemiológicas 1 a 53, Colombia 2009. Bogotá: Instituto Nacional de Salud; 2009. p.10. [ Links ]
31. Chávez J, Calume M, Guerrero J. Caso de meningitis bacteriana relacionado con el consumo de queso fresco contaminado con Listeria monocytogenes. Inf Quinc Epidemiol Nac. 2009;14:305-10. [ Links ]
32. Chen Y, Zhang W, Knabel SJ. Multi-virulence-locus sequence typing identifies single nucleotide polymorphisms which differentiate epidemic clones and outbreak strains of Listeria monocytogenes. J Microbiol. 2007;45:835-46. http://dx.doi.org/10.1128/JCM.01575-06 [ Links ]
33. Larpent JP. Listeria. Paris: Technique and Documentation-Lavoisier; 1995. p. 101. [ Links ]
34. Seeliger HP, Hönne K. Serotyping of Listeria monocytogenes and related species. In: Bergan T, Novis J, editors. Methods in microbiology. London- New York: Academic Press; 1979. p. 31-49. [ Links ]
35. Seeliger HP, Langer B. Serological analysis of the genus Listeria its values and limitations. Int J Food Microbiol. 1989; 8:245-8. http://dx.doi.org/10.1016/0168-1605 (89)90020-2 [ Links ]
36. Doumith M, Cazalet C, Simoes N, Frangeul L, Jacquet C, Kunts F, et al. New aspects regarding evolution and virulence of Listeria monocytogenes revealed by comparative genomics and DNA arrays. Infect Immun. 2006;72:1072-83. http://dx.doi.org/10.1128/IAI.72.2.1072-1083.2004 [ Links ]
37. Food Drug Administration. Detection and enumeration of Listeria monocytogenes in foods. In: Bacteriologycal analytical manual online. Washington, D.C.: FDA; 2003. p. 1-28. Fecha de consulta: 8 de febrero de 2006. Disponible en: http://www.fda.gov/Food/ScienceResearch/LaboratoryMethods/ucm114664.htm. [ Links ]
38. Den Bakker HC, Didelot X, Fortes ED, Nightingale KK, Wiedmann M. Lineage specific recombination rates and microevolution in Listeria monocytogenes. BMC Evol Biol. 2008;8:277-90. http://dx.doi.org/10.1186/1471-2148-8-277 [ Links ] Orsi RH, den Bakker HC, Wiedmann M. Listeria monocytogenes lineages: Genomics, evolution, ecology, and phenotypic characteristics. Int Med Microbiol. 2011;301:79-96. http://dx.doi.org/10.1016/j.ijmm.2010.05.002 [ Links ]
40. Den Bakker HC, Bundrant BN, Fortes ED, Orsi RH, Wiedmann M. A population genetics-based and phylogenetic approach to understanding the evolution of virulence in the genus Listeria. Appl Environ Microbiol.2010;76:6085-100. http://dx.doi.org/10.1128/AEM.00447-10 [ Links ] Ward TJ, Ducey TF, Usgaard T, Dunn KA, Bielawski JP. Multilocus genotyping assays for single nucleotide polymorphism-based subtyping of Listeria monocytogenes isolates. Appl Environ Microbiol. 2008;74:7629-42. http://dx.doi.org/10.1128/AEM.01127-08 [ Links ]
42. Doumith M, Buchrieser C, Glaser P, Jacquet C, Martin P. Differentiation of the major Listeria monocytogenes serovars by multiplex PCR. J Clin Microbiol. 2004;42:3819-22. http://dx.doi.org/10.1128/JCM.42.8.3819-3822.2004 [ Links ]
43. Gorski L, Flaherty D, Mandrell RE. Competitive fitness of Listeria monocytogenes serotype 1/2a and 4b strains in mixed cultures with and without food in the U.S. Food and Drug Administration enrichment protocol. Appl Environ Microbiol. 2006;72:776-83. http://dx.doi.org/10.1128/AEM.72.1.776-783.2006 [ Links ]
44. Borucki MK, Kim SH, Call DR, Smole SC, Pagotto F. Selective discrimination of Listeria monocytogenes epidemic strains by a mixed-genome DNA microarray compared to discrimination by multilocus sequence typing. J Clin Microbiol. 2004;42:5270-6. http://dx.doi.org/10.1128/JCM.42.11.5270-5276.2004 [ Links ]
45. Gilbreth E, Call JE, Wallace M, Scott VN, Chen Y, Luchansky JB. Relatedness of Listeria monocytogenes isolated recovered from selected ready to eat foods and listeriosis patients in the United States. Appl Environ Microbiol. 2005;17:8115-22. http://dx.doi.org/10.1128/AEM.71.12.8115-8122.2005 [ Links ]
46. Doumith M, Jacquet C, Gerner-Smidt P, Graves LM, Loncarevic S, Mathisen T, et al. Multicenter validation of a multiplex PCR assay for differentiating the major Listeria. J Food Prot. 2005;68:2648-50. [ Links ]
47. Muñoz AI, Díaz G. Listeriosis. Santafé de Bogotá: Invima-INS; 1998. p. 64. [ Links ]
48. Institut Pasteur. Centre National de Référence des Listeria. Centre collaborateur de L´oms pour la listeriose d´origene alimentaire. Laboratoire des Listeria. Protocole de serotypie. Paris: Institut Pasteur; 1997. p. 22. [ Links ]
49. Muñoz AI. Distribución de serotipos de Listeria monocytogenes aislados de categorías de alimentos y de plantas procesadoras de alimentos de acuerdo a su procedencia. Colombia 2000-2009. Fecha de consulta: 6 de agosto de 2011. Disponible en: http://web.invima.gov.co/portal/documents/portal/documents/publicacion/datosserololm1.pdf. [ Links ]
50. Muñoz AI. Distribución y frecuencia de serotipos de Listeria monocytogenes aislados de categorías de alimentos y de plantas procesadoras de alimentos. Colombia 2000-2009. Fecha de consulta: 6 de agosto de 2011. Disponible en: http://web.invima.gov.co/portal/documents/portal/documents/ publicacion/datosserololm2.pdf. [ Links ]
51. Muñoz AI. Distribución de serotipos de Listeria monocytogenes aislados de grupos de alimentos. Colombia 2000-2009. Fecha de consulta: 6 de agosto de 2011. Disponible en: http://web.invima.gov.co/portal/documents/portal/documents/publicacion/datosserololm3.pdf. [ Links ]
52. Food and Agriculture Organization of the United Nations. Report of the FAO expert consultation on the trade impact of Listeria in fish products. Roma: FAO; 1999. p. 41. [ Links ]
53. United States Department of Agriculture. Producción e inspección. Recursos disponibles para la inocuidad de los alimentos. Sistema de análisis y puntos críticos de control (HACCP) programa de asistencia para planta procesadora pequeñas y micro. Programa de asistencia para el sistema HACCP. Fecha de consulta: 4 de agosto de 2011. Disponible en: http://www.fsis.usda.gov/En_Espanol/HACCP_Brochure_Sp/index.asp. [ Links ]
54. ILSI Research Foundation. Risk Science Institute. Achieving continuous improvement in reductions in foodborne listeriosis -a risk-based approach. J Food Prot. 2005;68:1932-94. [ Links ]
55. Rocourt J, Jacquet Ch, Bille J. Human listeriosis,1991-1992. (WHO/FNU/FOS/97.1). Geneva: WHO, 1997. p. 32-4. [ Links ]
56. United States Department of Agriculture. Producción e inspección. Food Safety and Inspection Service. Hojas informativas acerca de la intoxicación alimentaria; protéjase y proteja a su bebé de la listeriosis. Fecha de consulta: 4 de agosto de 2011. Disponible en: http://www.fsis.usda.gov/Fact_Sheets/Protect_Your_Baby_Spanish/index.asp. [ Links ]













