Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.32 no.3 Bogotá Jul./Sept. 2012
https://doi.org/10.7705/biomedica.v32i3.739
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v32i3.739
1Grupo de Biología de Sistemas, Universidad Pontificia Bolivariana, Medellín, Colombia
2 Grupo Interdisciplinario de Estudios Moleculares, Universidad de Antioquia, Medellín, Colombia
3 Grupo de Gestión y Modelación Ambiental, Universidad de Antioquia, Medellín, Colombia
Contribución de los autores: Isabel Cristina Ortiz: desarrollo experimental, análisis y elaboración del artículo.
Carlos Peláez: coordinación y revisión de los protocolos experimentales y del artículo.
Luz Yaneth Orozco: análisis y elaboración del artículo.
Margarita Zuleta: diseño, dirección y coordinación del proyecto que sustentó esta investigación.
Recibido: 16/06/11; aceptado:09/05/12
Introducción. Los mutágenos contenidos en mezclas complejas presentan interacciones de sinergismo, aditivas o antagónicas. Se han desarrollado enfoques experimentales que permitan dilucidar el responsable de las interacciones en la mezcla.
Objetivo. Desarrollar un diseño experimental para comprender los procesos que se llevan a cabo entre los compuestos presentes en las mezclas complejas.
Materiales y métodos. Se expusieron linfocitos humanos a mezclas binarias de mutágenos B[a]P, DMBA, Trp-P-1 y MX durante una hora, con activación metabólica y sin ella. La viabilidad se evaluó con azul de tripano y, la genotoxicidad, con cometa alcalino.
Resultados. Ningún hidrocarburo tuvo efecto con furanona. Con S9 y sin él, se observó que se presentaban interacciones tóxicas entre hidrocarburos. Se observó sinergismo sin S9 entre B[a]P y Trp-P-1 y, con actividad metabólica, entre DMBA y Trp-P-1. Sin S9 se observó interacción antagónica entre Trp-P-1 y DMBA y, con S9, entre Trp-P-1 y MX y entre MX y DMBA. Se observó un incremento dependiente de la dosis en la longitud de la cola. Hubo daño genotóxico medio y aumento de las células dañadas. Para todas las mezclas se pudo determinar la concentración mínima en la que se observaban efectos adversos y solo para algunas se determinó la concentración máxima en la cual no se observaron efectos adversos.
Conclusión. Se hace un aporte para comprender los procesos que ocurren cuando en una mezcla hay presentes, al menos, dos mutágenos y se valida un modelo de análisis que permite dilucidar el compuesto que tiene efecto sobre otro. También, se demostró que según el tipo de compuestos en la mezcla, se tendrá o no un umbral de riesgo.
Palabras clave: genotoxicidad, mutágenos, linfocitos, ensayo cometa, nivel sin efectos adversos observados.
doi: http://dx.doi.org/10.7705/biomedica.v32i3.739
Interaction of mutagens in binary mixtures using the alkaline comet assay in human lymphocytes
Introduction. Mutagens contained in complex mixtures can present synergistic interactions, either additive or antagonistic. Therefore, development of experimental approaches is necessary to elucidate which is the responsible agent for the effect in the mixtures.
Objective. An experimental design was developed that allowed an understanding of the processes between the compounds of complex mixtures.
Materials and methods. Human lymphocytes were exposed to binary mixtures of the mutagens B[a]P, DMBA, Trp-P-1 and MX for 1 hour with or without S9. Viability was assessed with trypan blue dye and the genotoxicity by the comet assay.
Results. All of the hydrocarbon showed an effect with furanone. With and without S9, the most toxic interactions were observed between hydrocarbons. Synergistic interaction was observed without S9 between B [a] P and Trp-P-1 and between DMBA and Trp-P-1 with metabolic activity. Without S9 antagonistic interaction was observed only between Trp-P-1+DMBA, and with S9 between Trp-P-1+MX and MX+DMBA. It observed an increase dose dependent in tail length. Half the cultures showed genotoxic damage and increased cell damage. For each mixture, minimum concentrations were determined at which adverse effects are observed; for some only the maximum concentration was determined at which no adverse effects are observed.
Conclusion. The processes between mutagens present in a mixture have become better understood, and the results validated an analytical model that determined which component had an effect on another. The results also showed that the type of compounds in the mixture determined whether or not a risk threshold was present.
Key words: genotoxicity, mutagens, lymphocytes, comet assay, no-observed-adverse-effect level.
doi: http://dx.doi.org/10.7705/biomedica.v32i3.739
El problema para la salud asociado con la exposición a un contaminante individual, se presenta bajo circunstancias específicas y con una gran exposición. Muchos de los cánceres humanos están asociados con la exposición a contaminantes presentes en mezclas complejas, como las de la industria, el agua, los alimentos y el humo de cigarrillo, entre otros (1,2). Los mutágenos contenidos en estas mezclas llegan continuamente a la población y, aunque estén en cantidades muy pequeñas del orden de partes por billón (ppb) o partes por trillón (ppt) (dosis aparentemente permisibles), que no conllevan a muerte celular, generan acumulación de mutaciones (3); si estas se presentan en células somáticas, en genes involucrados en la regulación de la división celular (protooncogenes), en genes que participan en la reparación de daños en el ADN, en genes que participan en uniones celulares o en genes supresores de tumores, pueden iniciar el proceso de carcinogénesis (4). Debido a la constante exposición a ambientes contaminados con mutágenos, es importante entender las interacciones potenciales de los componentes de la contaminación, que pueden ser interacciones de sinergismo, antagonistas o aditivas (5-9).
En general, los mutágenos llegan al organismo mezclados con otros compuestos mutágenos o no, y para determinar el riesgo que representa para la salud humana la presencia de estos compuestos en el ambiente, es necesario conocer el efecto geno-mutágeno de la mezcla. Aunque son muy pocas las investigaciones dirigidas a evaluar el riesgo de las mezclas, en algunas se ha demostrado que diferentes combinaciones de cinco aminas heterocíclicas (HA) aumentan la producción de adenocarcinomas en el intestino de ratas (10).
También, se ha comprobado que los mutágenos 3-cloro-4-(diclorometil)-5-hidroxi-2(5H)-furanona (MX) y la amina heterocíclica 2 amino-6-metildipirido(1,2-a:3’2’-d)imidazol (Glu-p-1), al estar mezclados, aumentan la “mutagenicidad” indirecta de Glu-p-1. En un estudio se evidenció que el cromo hexavalente mezclado con hidrocarburos policíclicos aromáticos (Polycyclic Aromatic Hydrocarbons, PAH) aumenta la unión de estos compuestos con el gen P53 en células humanas de pulmón (11). En otras investigaciones se ha observado que el contenido de benzo(a)pireno (B[a]P) de una muestra de aire producía menos del 2 % de la “mutagenicidad” inducida por la mezcla (12) y que mezclas complejas de compuestos aromáticos suprimían la actividad mutágena de B[a]P, del 7,12-dimetilbenzo(a)antraceno (DMBA), del 2-aminofluoreno y del 2-acetilaminofluoreno, en Salmonella spp. (13). Hermann (14) concluyó que varios hidrocarburos no mutágenos aumentaban la “mutagenicidad” de B[a]P y que muchos hidrocarburos policíclicos aromáticos mutágenos producían una disminución y algunas veces eliminaban la “mutagenicidad” de este hidrocarburo.
En compartimentos ambientales como aire, suelo, sedimentos, alimentos y agua, se presentan frecuentemente mutágenos como hidrocarburos policíclicos aromáticos, de los cuales son comunes el B[a]P y el dimetilbenzoantraceno, aminas heterocíclicas del tipo acetato de 3-amino-1,4-dimetil-5H-pirido-(4,3-b)indol (Trp-P-1) y, además, en el proceso de cloración del agua se forma la furanona MX (15-20).
Para evaluar el riesgo que representa el ambiente, la Environmental Protection Agency (EPA) de los Estados Unidos (21) sugiere hacerlo por medio del proceso del análisis de riesgo para la salud, con el uso de un conjunto de pruebas para determinar la genotoxicidad o la “mutagenicidad” en cuatro etapas, que son la identificación del peligro, el análisis dosis-respuesta, el análisis de exposición y la caracterización del riesgo, análisis que sólo se lleva a cabo para compuestos puros. El interés por determinar el peligro de la genotoxicidad de un compuesto puede ser su relación con el cáncer u otros procesos degenerativos crónicos, semejantes a la vejez y a las enfermedades coronarias y respiratorias, y dada la universalidad del ADN y del código genético es posible el uso de varios sistemas no humanos para predecir la “mutagenicidad” intrínseca generada por compuestos químicos.
Para este análisis de riesgo genotóxico, se deben tener datos de una amplia variedad de posibles efectos genéticos que puedan ser examinados y un único test no da cuenta de la cantidad de respuestas genotóxicas que pueden ser inducidas por un compuesto (22). La EPA también enfatiza en la obtención de datos de “geno-mutagenicidad” como una parte de la evidencia de peso para el análisis de riesgo de cáncer, uno de los eventos y procesos clave que están siendo considerados es si el carcinógeno es geno-mutágeno o no (23). Los biomarcadores genotóxicos son apropiados para el análisis de riesgo ambiental, porque relacionan los daños en el ADN con subsecuentes cambios a nivel molecular, celular y de tejidos en organismos expuestos (24,25).
Las pruebas de citotoxicidad y genotoxicidad para evaluar los biomarcadores de genotoxicidad usando líneas celulares, son eficientes para tamizar el potencial efecto peligroso de un gran número de químicos o mezclas complejas. Una de ellas es el ensayo cometa alcalino, que evalúa rupturas en el ADN, los cuales son potenciales lesiones premutágenas y marcadores sensibles de daño genético (26). Además, con este ensayo se ha demostrado en humanos una relación entre la exposición a diversos compuestos químicos y el proceso de carcinogénesis (27,28).
Dada la dificultad de estudiar las mezclas complejas y la poca existencia de estudios y metodologías que permitan su abordaje, un punto clave para enfrentar este problema es el diseño de enfoques experimentales que orienten en la selección de estrategias que puedan relacionar exposición, genotoxicidad, citotoxicidad, blanco evaluado, valor pronóstico de los resultados, determinar cuál o cuáles de sus componentes son el agente primario responsable del efecto genotóxico y, para ello, es necesario conocer y cuantificar los componentes presentes para poder evaluar la mezcla (29).
En el presente trabajo se propone un diseño experimental para comprender los procesos que se llevan a cabo entre los compuestos presentes en las mezclas complejas, de tal manera que se pueda iniciar el abordaje de un análisis de riesgo para estas mezclas. Para ello se estudió la interacción genotóxica de los mutágenos benzo(a)pireno, 7,12-dimetilbenzo(a)antraceno, acetato de 3-amino-1,4-dimetil-5H-pirido-(4,3-b)indol, y 3-cloro-4-(diclorometil)-5-hidroxi-2(5H)-furanona en mezclas binarias mediante el ensayo cometa alcalino en linfocitos humanos.
Materiales y métodos
Todos los compuestos químicos utilizados fueron de grado analítico, obtenidos de Sigma Aldrich, MOLTOX-Molecular Toxicology Inc. y Merck.
Diseño experimental
El diseño experimental propuesto para evaluar la interacción de dos mutágenos se basó en definir la mínima concentración genotóxica común a los dos. Luego se mezclaron diferentes concentraciones genotóxicas del mutágeno 1 con una concentración fija del mutágeno 2 y viceversa. De esta manera, se pudo dilucidar cuál de los mutágenos era el responsable de la interacción ya que, cuando cambió el efecto en alguna de las concentraciones del mutágeno 1, quien ejerció la acción fue el mutágeno 2 que se adicionó.
Cultivo de linfocitos
Las muestras de sangre fueron obtenidas de un voluntario joven (25 años), saludable, no fumador, sin ningún tipo de tratamiento clínico, no deportista. Se adicionaron 1,0 ml de sangre venosa con heparina y 0,2 ml de fitohemaglutinina (PHA) a 8 ml de medio RPMI-1640, con 5 % (v/v) de suplemento de suero bovino fetal inactivado por calor (56 °C, 30 minutos), penicilina (100 U/ml) y estreptomicina (100 µg/ml), y se cultivaron por 48 horas a 37 °C (30,31). Luego, la sangre se centrifugó y el precipitado de células se depositó en un gradiente de densidad de Hystopaque. Después de la centrifugación (2.000 rpm, 25 °C, 30 minutos), se recolectaron los linfocitos y se lavaron tres veces con solución amortiguadora salina de fosfatos (PBS) (1.200 rpm, 7 minutos) (32). Posteriormente, se hicieron los tratamientos respectivos como se describe a continuación.
Citotoxicidad
Se elaboraron curvas de citotoxicidad para cada mutágeno utilizado y se definió la concentración inhibitoria 50 (IC50) de cada uno. A partir de estos resultados, se eligió la concentración que presentaba una citotoxicidad máxima del 30±5 % (citotoxicidad moderada), con el fin de evitar falsos positivos en la genotoxicidad, ya que estos efectos están asociados con citotoxicidad nula a moderada (33). Se utilizó el colorante de exclusión azul de tripano para evaluar la citotoxicidad de los linfocitos después de una hora de exposición a los mutágenos individuales. Esta metodología se basa en que las células muertas pierden la capacidad de permeabilidad selectiva y, por lo tanto, el colorante ingresa a ellas por difusión, adquiriendo una coloración azul; en contraste, las células vivas son refringentes y selectivas al colorante. La cuantificación de la citotoxicidad se evaluó con ensayo doble ciego.
Genotoxicidad
Los linfocitos se suspendieron nuevamente en PBS a una concentración de 5 x 104 células/250 µl (34) y se sometieron a los mutagénos individuales y a las mezclas binarias por una hora, en presencia o en ausencia de un sistema metabólico exógeno (fracción microsómica S9). Como control negativo se utilizó el PBS, como control de solvente, el DMSO (1 %) y, como control positivo, H2O2 (50 µM).
La genotoxicidad se evaluó por medio del ensayo cometa alcalino que se basa en que los daños en el ADN nuclear generados por un agente genotóxico que no causa ligamientos cruzados, produce fragmentos de ADN de bajo peso molecular, generados por rupturas directas de cadena doble o sencilla, o indirectamente, por reparación por escisión incompleta o por la formación de sitios lábiles al álcali. Estos fragmentos de ADN se liberan durante el período de desnaturalización alcalina y generan la cola del cometa durante la electroforesis. El ADN de alto peso molecular no migra y forma la cabeza del cometa. Así, mientras mayor sea el daño y la fragmentación generados por el compuesto genotóxico, mayor será la longitud de la cola del cometa.
Se siguió la metodología propuesta por Singh, et al., en 1988 (35). En resumen, se tomaron 20 µl de cada suspensión celular y se mezclaron con 80 µl de agarosa de bajo punto de fusión (0,5 %, 37 °C), en PBS libre de calcio y magnesio, con el fin de formar una suspensión de células en agarosa. Se colocaron 100 µl de cada suspensión en un portaobjetos previamente cubierto con agarosa de punto de fusión normal (1 %). Luego de poner los cubreobjetos, se llevaron las placas a 4 °C para permitir la solidificación de la agarosa. Al finalizar el tiempo, se retiraron los cubreobjetos y se adicionó la tercera capa de agarosa (100 µl de agarosa de bajo punto de fusión) y, de nuevo, se llevaron a 4 °C para su solidificación.
Después de quitar los cubreobjetos, las muestras se sometieron a solución de lisis recién preparada (2,5 M NaCl, 100 mM Na2EDTA, 10 mM de Tris, 10 g/L de N-lauril sarcosinato de sodio y 1% de tritón X-100 a un pH de 10, ajustado con NaOH) a 4 °C, durante una hora. Al finalizar este tiempo, las placas se lavaron con PBS y, para permitir la desnaturalización del ADN y la expresión de los sitios lábiles al álcali, se cubrieron con solución amortiguadora de electroforesis (300 mM de NaOH y 1 mM de Na2EDTA a pH 13) por 20 minutos. Posteriormente, se corrió la electroforesis por 30 minutos, a 25 mV (1,1 V/cm) y 300 mA. Luego, las placas fueron neutralizadas sometiéndolas a tres lavados durante cinco minutos con solución amortiguadora neutralizante fría (0,4 M de Tris solución amortiguadora a pH 7,5 con HCl), se fijaron con metanol y se guardaron a 4 °C en un ambiente de baja humedad, hasta su lectura. Cada placa se coloreó con bromuro de etidio (BrEt, 20 µg/ml) y se leyó utilizando un microscopio de fluorescencia (Nikon), con filtro verde y con un objetivo de 40X.
Los parámetros validados para determinar el daño evaluado mediante este ensayo fueron: migración del ADN, concentración de ADN en la cola, momento de cola, y momento Olive, entre otros (36). En este estudio se utilizó como parámetro de medida la longitud de cola (µm) (37-40). El criterio para determinar el daño genético fue la media del control más una desviación estándar más uno (X±DE+1) y, de acuerdo con este valor, se clasificó arbitrariamente, el tipo de daño en cinco categorías: 0, células sin daño (0-18 µm); 1, células con daño bajo (19-37 µm); 2, células con daño medio (38-56 µm); 3, células con daño alto (57-75 µm) y 4, células con daño total (mayor de 75 µm). Otro parámetro que se tuvo en cuenta para los análisis de genotoxicidad, fue la frecuencia de células dañadas en cada tratamiento y cada lectura se hizo con doble ciego.
Con el fin de evaluar la reproducibilidad de los resultados, se hicieron tres experimentos independientes (41), cada uno por duplicado; y de cada tratamiento se contabilizaron 80 células (40 de cada placa), para un total de 240 células por tratamiento.
Selección de la concentración mínima en la cual se observa efecto adverso para las interacciones genotóxicas
Luego de definir la IC30 para cada mutágeno, se siguió con la determinación del efecto adverso (LOAEL) genotóxico común para los cuatro mutágenos usados, con el fin de dejar esta concentración como fija en las interacciones. Este valor fue de 1 µM, con y sin actividad metabólica.
Análisis estadístico
Tanto para los compuestos puros como para las mezclas, se determinó la homogeneidad de varianzas usando la prueba de Levene y, para establecer la normalidad, se utilizó la de Kolmogorov-Smirnov.
Para comparar el efecto genotóxico (longitud de cola en µm) de las mezclas binarias de los mutágenos, se utilizó análisis de varianza (ANOVA) bifactorial (mezcla y concentración). Se consideraron nueve concentraciones codificadas de 0 a 8, siendo 0 la dosis correspondiente al control negativo. Las comparaciones múltiples de medias para los mutágenos, se hicieron con la prueba de Newman-Keuls, con un α=0,05.
Para determinar el efecto de dosis, se hizo un análisis de regresión simple con p<0,05.
Los valores se expresan como la media ± la desviación estándar (X±DE) y las pruebas se consideraron significativas con una p≤0,05. Los análisis se llevaron a cabo con el programa estadístico Statistica 7.0™ (Stat Soft, Inc., Tulsa, OK, USA).
Resultados
La citotoxicidad y genotoxicidad en linfocitos humanos expuestos durante una hora a los mutágenos individuales B[a]P, DMBA, Trp-P-1 y MX, con activación metabólica y sin ella, fue de nula a moderada (cuadro 1).
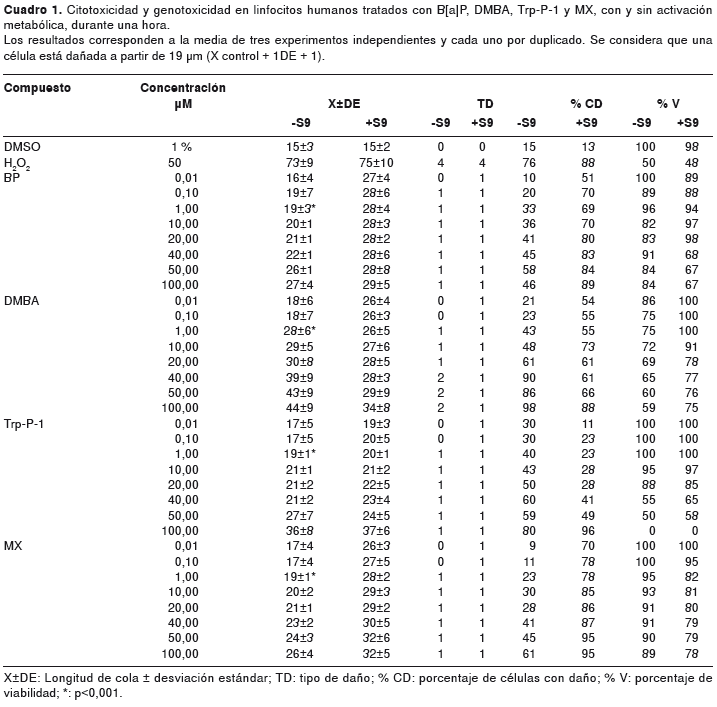
En las mezclas binarias, no se observó efecto citotóxico o genotóxico, con actividad metabólica y sin ella, en las mezclas correspondientes a la furanona MX variable con la concentración fija de B[a]P, DMBA y Trp P-1 y viceversa, excepto con la mezcla de DMBA variable y MX fijo y con actividad metabólica, que resultó citotóxica (datos no mostrados).
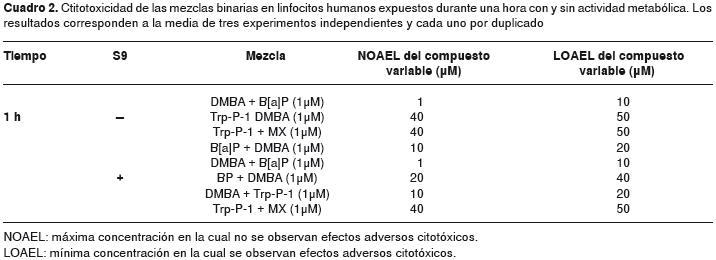
En el cuadro 2 se observa en algunas de las mezclas binarias citotoxicidad superior al 40 %, es decir, una citotoxicidad desde moderada-alta a total. Las interacciones más tóxicas se presentaron entre los dos hidrocarburos a partir de 10 µM, con actividad metabólica y sin ella. Sin actividad metabólica, la amina Trp-P-1 a partir de 50 µM con el DMBA y con la furanona MX fue citotóxica; en cambio, con actividad metabólica, se presentó citotoxicidad de esta misma mezcla con el hidrocarburo variable y con la furanona MX fija.
En el cuadro 3 y en la figura 1 se presentan las mezclas binarias en las cuales hubo interacción, con actividad metabólica y sin ella; se observa interacción de sinergismo sin actividad metabólica entre B[a]P y Trp-P-1, independientemente de cuál sea el compuesto variable. Cuando Trp-P-1 es variable, el sinergismo se presenta en las concentraciones de 20 y 40 µM, con interacción citotóxica superior al 50 % a partir de 50 µM, pero, cuando el B[a]P es variable, el sinergismo se presenta a partir de 20 µM y no se produce efecto citotóxico. La evaluación del daño en el ADN de estas mezclas, mediante el ensayo cometa alcalino, mostró un aumento en la longitud de cola de 1,6 veces; además, se duplicó la frecuencia de células con daño.
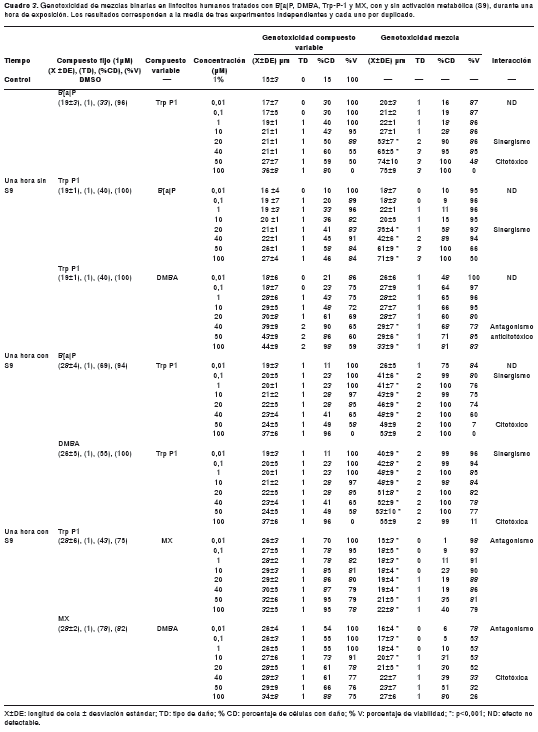
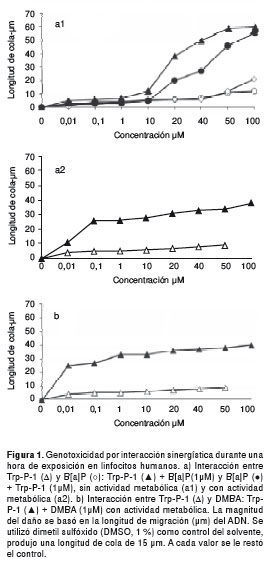
Con actividad metabólica esta misma mezcla presentó sinergismo hasta 40 µM y se duplicó la longitud de cola, pero el aumento de células con daño no cambió y fue muy citotóxica por encima de 50 µM. También, se observó sinergismo entre DMBA y Trp-P-1, variable hasta 50 µM solamente con actividad metabólica, se duplicó la longitud de cola, el porcentaje de células con daño fue 10 veces mayor y solo se presentó citotoxicidad alta en la concentración de 100 µM. En general, todas estas interacciones presentaron un daño de tipo medio.
Sin S9 solo se observó interacción antagónica entre DMBA variable desde 40 µM y Trp-P-1. El DMBA individual presentó citotoxicidad moderada en todas las concentraciones estudiadas (cuadro 1); en cambio, en esta mezcla binaria, la citotoxicidad fue casi nula, pudiéndose considerar esta mezcla anticitotóxica (cuadro 3). La genotoxicidad en la mezcla disminuyó aproximadamente una vez y el tipo de daño observado fue bajo; además, la frecuencia de células con daño disminuyó al 50 %.
En presencia de S9, hubo interacción antagónica entre MX variable y Trp-P-1 para todas las concentraciones utilizadas de la furanona, la disminución en la genotoxicidad de la mezcla fue superior a 1,5 veces, el tipo de daño observado fue bajo, la frecuencia de células con daño tuvo una disminución del 98,6 % en la concentración menor y la citotoxicidad fue inferior a 20 %. Otra mezcla con efecto antagónico con estas mismas condiciones fue DMBA variable desde 0,01 hasta 20 µM y MX, la disminución en la genotoxicidad fue 1,5 veces, pero fue citotóxica desde 40 µM del hidrocarburo. El tipo de daño presentado fue nulo y bajo, y hubo una disminución del 50 % en la frecuencia de células con daño (cuadro 3 y figura 2).
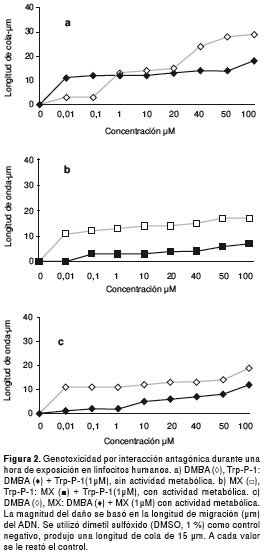
Se observa el efecto de dosis obtenido mediante un análisis de regresión simple de las mezclas binarias que presentaron interacción genotóxica. Se presentó efecto de dosis en ausencia de S9 entre las mezclas B[a]P-Trp-P-1 independientemente de cuál compuesto era el variable ,y con S9, entre las mezclas B[a]P-Trp-P-1, DMBA-Trp-P-1, Trp-P-1-MX y MX-DMBA (p<0,001). En general, se observó un incremento en la longitud de cola relacionado con la dosis (cuadro 3), con un coeficiente de correlación superior al 90 %.
Discusión
Aunque los compuestos utilizados son mutágenos y presentaron actividad genotóxica individualmente (cuadro 1), algunas de las mezclas binarias durante la exposición corta de una hora no presentaron ningún efecto, con actividad metabólica y sin ella. Las mezclas de la furanona MX con cualquiera de los otros tres mutágenos son un ejemplo de ello; el MX es un mutágeno de acción directa en comparación con los otros tres, B[a]P, DMBA y Trp-P-1, que requieren activación metabólica.
En esta investigación se encontró que el MX no presentaba actividad genotóxica coincidente con otros reportes. Los datos sobre la actividad genotóxica del MX son contradictorios; hay reportes que indican que el MX in vitro es genotóxico directo (42-45) y otros que reportan que es inactivado por enzimas metabólicas (46). En las mezclas MX variable con la concentración fija de B[a]P, DMBA y Trp P-1, la falta de evidencia de daño puede deberse a una competencia por los citocromos contenidos en la mezcla S9 para la inactivación del MX y la activación de los otros mutágenos. Los sistemas de reparación del ADN requieren más de una para iniciar o detectar el daño. Sin embargo, es posible que la expresión basal de las enzimas de reparación sea suficiente para reparar las lesiones ocasionadas por el MX sin S9 (33), puesto que los otros tres mutágenos requieren activación metabólica y los linfocitos no expresan los citocromos suficientes para su inducción (33,47).
En las mezclas binarias en las cuales la amina Trp-P-1 fue variable, la citotoxicidad presentada se le atribuye a la amina, ya que ella de manera individual es tóxica a partir de la dosis de 40 µM, concentración citotóxica por debajo del IC50 (cuadros 1 y cuadro 2), en comparación con los otros dos mutágenos, DMBA y MX.
Aunque los dos hidrocarburos, B[a]P y DMBA, no son citotóxicos individualmente en las concentraciones evaluadas, las mezclas entre ellos presentaron la mayor toxicidad. Esto puede deberse a que muchos hidrocarburos se unen al receptor hidrocarburo arilo e inducen otros blancos del receptor hidrocarburo arilo, aparte de los promotores del p450 (48,49), por ejemplo, activar vías alternativas de toxicidad (50) o porque los hidrocarburos policíclicos aromáticos aumentan la actividad metabólica de ellos mismos y de otros generando metabolitos activos muy tóxicos (51).
Los linfocitos pueden expresar los citocromos que degradan el B[a]P y la amina Trp-P-1; sin actividad metabólica se observó una potenciación de ambos, independientemente de cuál es el compuesto variable. Esto puede deberse a que el B[a]P induce la síntesis de CYP 1A1 y 1A2; este último actúa sobre aminas heterocíclicas y, a su vez, éstas inducen la producción de 1A2 (52). Serían dos maneras de aumentar el metabolito activo de cada compuesto, y sería un proceso de retroalimentación positiva en la inducción de los citocromos.
Por otro lado, la amina (Trp-P-1) puede aumentar la expresión del receptor hidrocarburo arilo, el cual se une a los hidrocarburos policíclicos aromáticos (B[a]P), translocándose al núcleo y convirtiéndose en un factor de transcripción para la producción de CYP1A1, que es el que lo degrada, aumentando de esta manera los metabolitos activos (42). La citotoxicidad presentada cuando el Trp-P-1 es variable sin S9, se debe a la citotoxicidad de este compuesto puro. Con actividad metabólica puede ocurrir que, cuando el Trp-P-1 está variable, se acetile por acción de enzimas de la fase II que también son inducidas y se generen metabolitos más electrofílicos muy genotóxicos (52).
La mezcla DMBA-Trp-P1 variable con S9, mostró sinergismo desde la primera dosis (cuadro 3). La potenciación del DMBA sobre la amina puede ser ocasionada por la inducción de enzimas de fase II, específicamente acetil transferasas, cuyo sustrato son las aminas hidroxiladas por los citocromos provenientes del S9, lo cual genera metabolitos muy genotóxicos (52,53). Sin embargo, se requiere profundizar en la identificación química de estos productos o, posiblemente, en la generación de nuevos compuestos.
Independientemente de la actividad metabólica en las mezclas con efecto genotóxico de sinergismo, se observa que hay una gran cantidad de células dañadas (superior al 60 %), con una viabilidad superior al 75 % y con medio un daño de tipo medio (2) (cuadro 3). Estos resultados implican que la exposición a estas mezclas y durante este tiempo, constituye un mayor riesgo genotóxico. Sin embargo, como se observa en las figura 1 y figura 2, en algunas el LOAEL presentado en las mezclas es más bajo que el compuesto puro, pero presentan umbral genotóxico, es decir, se puede encontrar la máxima dosis en la cual no se observa efecto adverso (NOAEL). El hallazgo de esta dosis es el inicio para detectar dosis permisibles de exposición en las mezclas que contengan estos mutágenos a estas concentraciones (33,47,50,54).
El antagonismo que se presentó se debe a que hay modulación en la inducción enzimática que lleva a que uno de los mutágenos individuales pueda ser un potente agonista de los receptores o la mezcla afecta la capacidad de inducción de los citocromos, evitando así la activación de los mutágenos indirectos (55). En muchas ocasiones los componentes de una mezcla pueden interactuar por un gran número de vías sobre un blanco celular semejante a un receptor o a una enzima; dos compuestos presentes en una mezcla se pueden unir permanentemente a la enzima inhibiendo su acción o unirse a ella con una disociación constante y lenta. Por este mecanismo de acción, la inhibición de enzimas del citocromo por hidrocarburos policíclicos aromáticos individuales puede influir la activación de otros procarcinógenos (48).
En algunas mezclas se pudo observar efecto dosis-respuesta desde la concentración más baja empleada, mientras que otras presentaron este efecto a partir de concentraciones más altas, afirmando los modelos dosis-respuesta genotóxicos en los cuales se presenta un umbral para el efecto (54). Muy pocos mutágenos tienen un blanco celular único; muchos actúan en múltiples órganos o tienen diversos blancos dentro de la misma célula, o es posible que una célula no sea el blanco para ese compuesto (48).
En esta investigación se hace un aporte importante en el abordaje para entender los procesos que pueden ocurrir cuando en una mezcla hay presentes, mínimo, dos mutágenos. El diseño establecido permitió evaluar mezclas binarias a bajas dosis y poder atribuir a cuál de los compuestos se debe el efecto, ya que en las mezclas los mutágenos pueden actuar en forma combinada alterando la expresión de genes, alterando el metabolismo o la producción de reguladores celulares o cambiando los niveles de concentración intracelular de iones. Lo importante de este diseño es que puede ser aplicado para tener un acercamiento de lo que puede estar ocurriendo en una mezcla, puesto que para iniciar el análisis de riesgo se deben entender los mecanismos celulares y moleculares que determinan el fenómeno toxicológico o genotóxico expresado, cuantificar la dosis que se absorbe del compuesto químico o la mezcla y determinar la magnitud de la respuesta. El establecer la concentración del mutágeno en la mezcla representa un punto crítico para el análisis. En este estudio se demuestra que la concentración de cada mutágeno en la mezcla es determinante para la producción del efecto.
Los resultados de esta investigación sugieren que no necesariamente la presencia de dos mutágenos en una mezcla implica un riesgo, sino que es necesario determinar si esto ocurre con todos los componentes de una mezcla, a qué concentración y qué procesos o mecanismos están determinando este tipo de interacciones.
Debido a la dificultad para determinar cómo interactúa un mutágeno con el resto de componentes de una mezcla y que este campo es poco explorado pero crece en importancia, este trabajo hace un aporte al análisis de riesgo de las mezclas y un modelo de análisis que permite dilucidar cuál compuesto tiene el efecto sobre otro y, también, se muestra que según el tipo de compuestos en la mezcla se tendrá o no un umbral de riesgo.
Conflicto de intereses
No existe ningún conflicto de intereses de este trabajo con los autores o con las instituciones involucradas en su desarrollo. No existe ningún interés en sacar provecho económico o afán de notoriedad, prestigio personal o reconocimiento y promoción profesional.
Financiación
Colciencias código 1115-04-14719, Universidad Pontificia Bolivariana y Universidad de Antioquia.
Correspondencia: Isabel Cristina Ortiz, Facultad de Medicina, Universidad Pontificia Bolivariana, Campus Robledo, Calle 78B N° 72A-109, Medellín, Colombia Teléfono: 493 6300, extensión 854, y (315) 455 0009; fax: 2572428 isabel.ortiz@upb.edu.co
Referencias
1. National Research Council. Complex mixtures: Method for in vivo toxicity testing. Washington, D.C.: National Academy Press; 1988. [ Links ]
2. Carpenter D, Arcaro K, Spink D. Understanding the human health effects of chemical mixtures. Environ Health Perspect. 2002;110:25-37. [ Links ]
3. Poirier MC, Beland FA. DNA adducts measurements and tumor incidence during chronic carcinogen exposure in animal models: Implications for DNA adduct-based human cancer risk assessment. Chem Res Toxicol. 1992;5:749-55. http://dx.doi.org/10.1021/tx00030a003 [ Links ]
4. Kakizoe T. Chemoprevention of cancer - focusing on clinical trials. Jpn J Clin Oncol. 2003;33:421-42. [ Links ]
5. Williams GM, Weisburger JH. Interactions of chemical carcinogens: Environmental mutagens and carcinogens. New York: A.R. Liss Publ; 1988. p. 288-94. http://dx.doi.org/10.1093/jjco/hyg090 [ Links ]
6. Deng ChZ, Fons MP, Rosenblatt J, El-Zein RA, Abdel-Rahman SZ, Albrecht T. Nickel potentiates the genotoxic effect of benzo(a)pyrene in Chinese hamster lung V79 cells. Environ Mol Mutagen. 2006;47:150-61. http://dx.doi.org/10.1002/em.20179 [ Links ]
7. Majer BJ, Hofer E, Cavin C, Lhoste E, Uhl M, Glatt HR, et al. Coffee diterpenes prevent the genotoxic effects of 2-amino-1meyhyl-6-phenylimidazo[4,5-b]pyridine (PhIP) and N-nitrosodimethylamine in a human derived liver cell line (Hep G2). Food Chem Toxicol. 2005;43:433-41. http://dx.doi.org/10.1016/j.fct.2004.11.009 [ Links ]
8. Ogawa S, Hirayama T, Nohara M, Tokuda M, Hirai K, Fukui S. The effect of quercetin on the mutagenicity of 2-acetylaminofluorene and benzo(a)pyrene in Salmonella typhimurium strains. Mutat Res. 1985;142:103-7. http://dx.doi.org/10.1016/0165-7992(85)90048-X [ Links ]
9. Wakabayashi K, Totsuka Y, Fukutome K, Oguri A, Ushiyama H, Sugimura T. Human exposure to mutagenic/carcinogenic heterocyclic amines and comutagenic b-carbolines. Mutat Res. 1997;376:253-9. http://dx.doi.org/10.1016/S0027-5107(97)00050-X [ Links ]
10. Hasegawa R, Shirai T, Hakoi K, Takaba K, Iwasahi S, Yoshida T, et al. Synergistic enhancement of glutatione S- transferase placental from positive hepatic foci development in diethylnitrosamine treated rats by combined administration of live heterociclic amines at lows doses. Jpn J Cancer Res. 1991;82:1378-84. [ Links ]
11. Feng ZC, Hu W, Rom WN, Costa M, Tang M. Chromium exposure enhance polyciclic aromatic hydrocarbone ADN binding at the P53 gene in human lung cells. Carcinogenesis. 2003;24:771-8. http://dx.doi.org/10.1093/carcin/bgg012 [ Links ]
12. Flessel P, Liu KS, Paz MK, Waldman J, Girman J. Unintentional carbon monoxide deaths in California from residential and other nonvehicular sources. Environ Health. 1988;55:375-81. [ Links ]
13. Haugen DA, Meyrick JP. Mixtures of polycyclic aromatic compounds inhibit mutagenesis en the Salmonella/microsome assay by inhibition of metabolic activation. Mutat Res. 1983;116:257-69. http://dx.doi.org/10.1016/0165-1218 (83) 90063-0 [ Links ]
14. Hermann M. Synergistic effects of individual polycyclic aromatic hydrocarbons on the mutagenicity of their mixture. Mutat Res. 1981;90:399-409. http://dx.doi.org/10.1016/0165-1218(81)90062-8 [ Links ]
15. Fernández-Sánchez JF, Segura-Carretero A, Cruces-Blanco C, Fernández-Gutiérrez A. Highly sensitive and selective fluorescente optosensor to detect and quantify benzo(a)pyrene in water simples. Anal Chim Acta. 2004;506:1-7. http://dx.doi.org/10.1016/j.aca.2003.11.002 [ Links ]
16. Boström CE, Gerde P, Hanberg A, Jernström B, Johansson C, Kyrklund T, et al. Cancer risk assessment, indicators, and guidelines for polycyclic aromatic hydrocarbons in the ambient air. Environ Health Perspect. 2002;110:451-88. http://dx.doi.org/10.1289/ehp.02110s3451 [ Links ]
17. International Agency for Research on Cancer. Polynuclear aromatic compounds: Chemical, environmental experimental data. Lyon: IARC; 1983. [ Links ]
18. Hiatt HH, Watson JD, Winsten JA. Origins of human cancer. New York: Cold Spring Harbor Laboratory Press; 1997. p. 1561-77. [ Links ]
19. Orozco LY, López C, Naranjo LC, Zuleta M. DNA damage and identification of mutagenic heterocyclic amines in municipal wastewater which contaminate water purification plants. Environ Mol Mutagen. 2003;41:196. [ Links ]
20. Onstad GD, Weinberg H. Evaluation of the stability and analysis of halogenated furanones in disinfected drinking waters. Anal Chim Acta. 2005;534:281-92. [ Links ]
21. Environmental Protection Agency. Guidelines for mutagenicity risk assessment. Washington, D.C.: Risk Assessment Forum; 1986. [ Links ]
22. Dearfield KL, Cimino M, Mc Carroll NE, Mauer I, Valcovic LR. Genotoxicity risk assessment: A proposed classification strategy. Mutat Res. 2002;521:121-35. http://dx.doi.org/10.1016/S1383-5718(02)00236-X [ Links ]
23. Dearfield KL, Moore MM. Use of genetic toxicology information for risk assessment. Environ Mol Mutagen. 2005;46:236-45. http://dx.doi.org/10.1002/em.20176 [ Links ]
24. Ohe T, Watanabe T, Wakabayashi K. Mutagens in surface waters: A review. Mutat Res. 2004;567:109-49. http://dx.doi.org/10.1016/j.mrrev.2004.08.003 [ Links ]
25. Torres A, Pereira P, Vaz JA, Ferrao VM. Mutagenicity assessment in a river basin influenced by agricultural, urban and industrial sources. Ecotoxicol Environ Saf. 2009;72:2058-65. http://dx.doi.org/10.1016/j.ecoenv.2009.08.006 [ Links ]
26. Park SY, Choi J. Cytotoxicity, genotoxicity and ecotoxicity assay using human cell and environmental species for the screening of the risk from pollutant exposure. Environ Int. 2007;33:817-22. http://dx.doi.org/10.1016/j.envint.2007.03.014 [ Links ]
27. Bertino J. Encyclopedy of cancer. 2nd edition. New York: Academic Press; 2002. p. 433-47. [ Links ]
28. ICH Expert Working Group. S2A: Guidance on specific aspects of regulatory genotoxicity tests for pharmaceuticals. Canada: Minister of Public Works and Government Services; 1996. [ Links ]
29. National Research Council. Environmental tobacco smoke: Measuring exposures and assessing health effects. Washington: National Academy Press; 1986. p. 54-62. [ Links ]
30. Kohji Y, Kusakabe H, Tanaka N. Comparative studies of MCL-5 cells and human limphocytes for detecting indirect-acting clastogens. Mutat Res. 1998;412:55-61. http://dx.doi.org/10.1016/S1383-5718(97)00170-8 [ Links ]
31. Jansson K, Mäki-Paakkanen J, Vaittinen SL, Vartiainen T, Komulainen H, Tuomisto J. Cytogenetic effects of 3-chloro-4-(dichloromethyl)-5-hydroxy-2(5H)-furanone (MX) in rat peripheral lymphocytes in vitro and in vivo. Mutat Res. 1993;229:25-8. http://dx.doi.org/10.1016/0165-1218(93)90115-T [ Links ]
32. Pitarque M, Vaglenov A, Nosko M, Hirvonen A, Norppa H, Creus A, et al. Evaluation of DNA damage by the Comet assay in shoe workers exposed to toluene and other organic solvents. Mutat Res. 1999;441:115-27. http://dx.doi.org/10.1016/S1383-5718(99)00042-X [ Links ]
33. Platel A, Gervais V, Sajot N, Nesslany F, Marzin D, Claude N. Study of gene expression profiles in TK6 human cells exposed to DNA-oxidizing agents. Mutat Res. 2010;689:21-49. http://dx.doi.org/10.1016/j.mrfmmm.2010.04.004 [ Links ]
34. Dhawan A, Bajpayee M, Pandey AK, Parmar D. Protocol for the single cell gel electrophoresis: Comet assay for rapid genotoxicity assessment. Lucknow, India: Industrial Toxicology Research Centre; 2009. [ Links ]
35. Singh NP, McCoy MT, Tice RR, Schneider EL. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp Cell Res. 1988;175:184-91. http://dx.doi.org/10.1016/0014-4827(88)90265-0 [ Links ]
36. Ejchart A, Sadlej-Sosnowska N. Statistical evaluation and comparison of comet assay results. Mutat Res. 2003;534:85-92. http://dx.doi.org/10.1016/S1383-5718(02)00250-4 [ Links ]
37. Brink A, Schulz B, Kobras K, Lutz WK, Stoppe H. Time-dependent effects of sodium arsenite on DNA breakage and apoptosis observed in the comet assay. Mutat Res. 2006;603:121-8. http://dx.doi.org/10.1016/j.mrgentox.2005.10.015 [ Links ]
38. Tice RR, Agurell E, Anderson D, Burlinson B, Hartmann A, Kobayashi A, et al. Single cell gel/comet assay: Guidelines for in vitro and in vivo genetic toxicology testing. Environ Mol Mutagen.2000;35:206-21. http://dx.doi. org/10.1002/(SICI)1098-2280(2000)35:3<206::AID-EM8>3.0.CO;2-J [ Links ]
39. Trisnawaty A, Vian L, Sabatier R, Cano JP. In vitro detection of indirect-acting genotoxins in the comet assay using Hep G2 cells. Mutat Res. 2000;468:227-34. http://dx.doi.org/10.1016/S1383-5718(00)00052-8 [ Links ]
40. Uhl M, Helma C, Knasmüller S. Single cell gel electrophoresis assays with human-derived hepatoma (HepG2) cells. Mutat Res. 1999;17:441:215-24. http://dx.doi.org/10.1016/S1383-5718(99)00050-9 [ Links ]
41. Uhl M, Christoph H, Siegfried K. Single-cell gel electrophoresis assays with human-derived hepatoma (Hep G2) cells. Mutat Res. 1999;441:215-24. http://dx.doi.org/10.1016/S1383-5718(99)00050-9 [ Links ]
42. Ishiguro Y, LaLonde RT, Dence CW, Santodonato J. Mutagenicity of chlorine-substituted furanones and their inactivation by reaction with nucleophiles. Environ Toxicol Chem. 1987;6:935-46. http://dx.doi.org/10.1002/etc.5620061205 [ Links ]
43. Meier JR, Knohl RB. Mutagenic and clastogenic properties of 3-chloro-4-(dichloromethyl)-5-hydroxy-2(5H)-furanone; a potent bacterial mutagen in drinking water. Environ Mol Mutagen. 1987;10:411-24. [ Links ]
44. Tikkanen L, Kronberg L. Genotoxic effects of various chlorinated butenoic acids identified in chlorinated drinking water. Mutat Res. 1990;240:109-16. http://dx.doi.org/10.1016/0165-1218(90)90014-S [ Links ]
45. LaLonde RT, Cook GP, Perakyla H, Dence CW, Babish JG. Salmonella typhimurium (TA 100) mutagenicity of 3-chloro-4-(dichloromethyl)-5-hydroxy-2(5H)-furanone and its open- and closed ring analogs. Environ Mol Mutagen. 1991;17:40-8. http://dx.doi.org/10.1002/em.2850170107 [ Links ]
46. Kinae N, Sugiyama C, Nasuda MY, Goto K, Tokumoto K, Furugori M, et al. Seasonal variation and stability of chlorinated organic mutagens in drinking water. Water Sci Technol. 1992;25:333-40. [ Links ]
47. Jenkins GJ, Zair Z, Johnson GE, Doak SH. Genotoxic thresholds, DNA repair, and susceptibility in human populations. Toxicology. 2010;278:305-10. http://dx.doi.org/10.1016/j.tox.2009.11.016 [ Links ]
48. Cherng SH, Lin P, Yang JL, Hsu SL, Lee H. Benzo g,h,i perylene synergistically transactivates benzopyrene-induced CYP1A1 gene expression by aryl hydrocarbon receptor pathway. Toxicol Appl Pharmacol. 2001;170:63-8. http://dx.doi.org/10.1006/taap.2000.9082 [ Links ]
49. Hestermann E, Stegeman J, Hahn M. Relationships among the cell cycle, cell proliferation, and ary hydrocarbon receptor expression in PLHC-1 cells. Aquat Toxicol. 2002;58:201-13. http://dx.doi.org/10.1016/S0166-445X(01)00229-6 [ Links ]
50. Pottenger L, Gollapudi B. A case for a new paradigm in genetic toxicology testing. Mutat Res. 2009;678:148-51. http://dx.doi.org/10.1016/j.mrgentox.2009.07.003 [ Links ]
51. Spink D, Spink B, Cao J, DePasquale J, Pentecost B, Fasco M, et al. Differential expression of CYP1A1 and CYP1B1 in human breast epithelial cells and breast tumor cells. Carcinogenesis. 1998;19:291-8. http://dx.doi.org/10.1093/carcin/19.2.291 [ Links ]
52. Ioannides C, Parke DV. The cytochrome P450 I gene family of microsomal hemoproteins and their role in the metabolic activation of chemicals. Drug Metab Rev. 1990;22:1-85. http://dx.doi.org/10.3109/03602539008991444 [ Links ]
53. Hahn M. Aryl hydrocarbon receptors: Diversity and evolution. Chem Biol Interact. 2002;141:131-60. http://dx.doi.org/10.1016/S0009-2797(02)00070-4 [ Links ]
54. Kirsch-Volders M, Gonzalez L, Carmichael P, Kirkland D. Risk assessment of genotoxic mutagens with thresholds: A brief introduction. Mutat Res. 2009;678:72-5. http://dx.doi.org/10.1016/j.mrgentox.2009.05.001 [ Links ]
55. Spink DC, Wu SJ, Spink BC, Hussain MM, Vakharia DD, Pentecost BT, et al. Induction of CYP1A1 and CYP1B1 by benzo(k)fluoranthene and benzo(a)pyrene in T-47D human breast cancer cells: Roles of PAH interactions and PAH metabolites. Toxicol Appl Pharmacol. 2008;226:213-24. http://dx.doi.org/10.1016/j.taap.2007.08.024 [ Links ]













