Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.32 no.3 Bogotá Jul./Sept. 2012
https://doi.org/10.7705/biomedica.v32i3.485
NOTA TÉCNICA
doi: http://dx.doi.org/10.7705/biomedica.v32i3.485
1Grupo de Investigación en Parasitología y Micología Molecular, Centro de Investigaciones Biomédicas, Universidad del Quindío, Armenia, Colombia
1Parque Tecnológico Tecnobahía, Cádiz, España
Contribución de los autores:
Jorge Andrés Cuéllar, Alejandro Hernández y Enrique Villegas planearon y realizaron los experimentos.
Jorge Enrique Gómez participó en el diseño de los experimentos y en el análisis de los resultados.
Todos los autores participaron en la redacción y aprobaron el texto del artículo.
Recibido: 06/10/11; aceptado:27/03/12
Introducción. El cultivo in vitro es un método importante para la obtención de Toxoplasma gondii con fines de diagnóstico clínico o biotecnológico.
Objetivo. Determinar el porcentaje de invasión y producción de T. gondii en las líneas celulares THP1 y Vero.
Materiales y métodos. Se determinó la curva de crecimiento para las células Vero y THP1 por conteo en hemocitómetro. Posteriormente, se identificó el porcentaje de invasión de T. gondii en células THP1 y Vero por citometría de flujo, en diferentes proporciones célula/taquizoíto de 1/5, 1/20, 1/50. Por otro lado, se calculó el índice de rendimiento de T. gondii, cepa RH, y del aislamiento CIBM1 en células THP1.
Resultados. Las células Vero crecen más rápidamente que las células THP1, con un crecimiento exponencial en un periodo de siete días. El aislamiento CIBM1 infecta las células THP1 en las tres proporciones diferentes de 1/5,1/20 y 1/50 con porcentajes de invasión de 57,1 %, 15,5 % y 12,2 %, y en células Vero, de 25,3 %, 17,8 % y 8,8 %. La cepa RH de T. gondii mostró porcentajes de invasión más bajos, de 32,6 %, 14,8 % y 8,1 % en células THP1 y de 22,3 %, 14,1 % y 3,4 % en células Vero.
Conclusiones. El aislamiento CIBM1 presentó mayor rendimiento con respecto a la cepa RH de T. gondii en células THP1, siendo estas células una buena línea para estudiar el proceso de invasión y probar candidatos farmacológicos para reducir la infección por T. gondii.
Palabras clave: Toxoplasma gondii, células, células Vero, citometría de flujo, in vitro.
doi: http://dx.doi.org/10.7705/biomedica.v32i3.485
Efficiency of in vitro culture of Toxoplasma gondii in THP1 and Vero cell lines
Introduction. Cell culture is an important method for isolating Toxoplasma gondii to make clinical diagnosis or for biotechnological purposes.
Objective. The percentage of invasion and production levels of T. gondii was determined for THP1 and Vero cell lines.
Materials and methods. The growth conditions for T. gondii in Vero and THP1 cell lines were determined by counting in hemocytometer chamber. The percentage of invasion of T. gondii in THP1 and Vero cells was determined by flow cytometry in different cell/tachyzoite ratios: 1/5, 1/20, 1/50. The growth performance index of the T. gondii RH strain and the CIBM1 isolate was calculated for THP1 cells.
Results. Vero cells multiplied faster than the THP1 cells, showing an exponential and a sigmoidal growth curve respectively, within a period of 7 days. The CIBM1 isolate infected the THP1 cells in three different parasite concentrations: 1/5, 1/20 and 1/50, with invasion percentages in THP1 cells of 57.1%, 15.5% and 12.2% and for the Vero cells 25.3%, 17.8% and 8.8% respectively. The RH strain of T. gondii had the lowest invasion percentage with 32.6%, 14.8% and 8.1% in THP1 cells and 22.3%, 14.1% and 3.4% in Vero cells.
Conclusions. The CIBM1 isolate had a higher yield than the RH strain of T. gondii in THP1 cells. THP1 cells were indicated to be a good model for the study of invasion and for the assays of new pharmacological candidates against T. gondii.
Key words: Toxoplasma, cells, Vero cells, flow cytometry, in vitro.
doi: http://dx.doi.org/10.7705/biomedica.v32i3.485
Toxoplasma gondii es un protozoario intracelular obligado perteneciente al supergrupo: Cromalveolata, primer rango: Alveolata y segundo rango, Apicomplexa (1), el cual tiene características morfológicas únicas, tales como una estructura celular polarizada, un complejo de citoesqueleto y un arreglo de organelas al final de su parte apical (2). Este parásito se ha utilizado extensamente como modelo experimental de los parásitos Apicomplexa gracias a su fácil reproducción in vitro, para la cual se han utilizado diferentes tipos celulares. Sin embargo, se hace necesario identificar la línea celular más apropiada para la infección y producción de este parásito, con el propósito de lograr un proceso más rápido y eficiente. Uno de los mejores modelos celulares para la invasión in vitro de T. gondii, es la línea celular THP1, que fue aislada de un niño con leucemia monocítica (3). Otra línea celular que se ha usado para propagar T. gondii son las células Vero, que son aisladas de células epiteliales de riñón, extraídas del mono verde africano (Cercopithecus aethiops) (4).
El porcentaje de invasión de taquizoítos de T. gondii en cualquier línea celular se puede medir por medio de la técnica de citometría de flujo, importante en la medición, separación y comparación de células (5). La citometría de flujo se ha convertido en un método innovador de análisis que permite tener una aproximación lo suficientemente objetiva, específica y rápida para diversas aplicaciones en estudios básicos (6).
El objetivo de este trabajo fue determinar el porcentaje de infección y producción de T. gondii en las líneas celulares THP1 y Vero.
Materiales y métodos
Cultivo de las líneas celulares Vero, THP1 y propagación del parásito
La línea celular Vero de crecimiento en adherencia fue propagada en medio de Eagle modificado de Dulbecco (DMEM), con suplemento al 10 % de suero fetal bovino y ampicilina (1 µg/ml) más estreptomicina (1 µg/ml) en frascos de 25 ml. El crecimiento de las células se mantuvo a temperatura de 37 °C con 5 % de CO2 y 95 % de aire atmosférico. La línea monocítica THP1 de crecimiento en suspensión se propagó en medio de cultivo RPMI-1640 con suplemento y se incubó de la misma manera que se describió para las células Vero. La línea THP1 sirvió para propagar los taquizoítos de la cepa RH y del aislamiento CIBM de T. gondii, cultivándolos con medio de cultivo RPMI-1640 y con suplemento de suero fetal bovino al 2 %.
Los parásitos extracelulares se purificaron a través de un filtro de policarbonato de 3 µm de tamaño de poro. La viabilidad de los parásitos antes de cada experimento se verificó con la coloración azul de tripano y se utilizaron solo los lotes con viabilidad de 95 % o más. La cepa RH fue donada por Daniel Ajzenberg (CHU Limoges, Francia) y el aislamiento CIBM1 se obtuvo en el Centro de Investigaciones Biomédicas de la Universidad del Quindío, a partir de una muestra de líquido cefalorraquídeo de un niño de nueve meses con toxoplasmosis congénita (aislamiento CIBM1).
Para evaluar el crecimiento de las dos líneas celulares, se utilizaron cajas de 24 pozos Cellstar™ donde se cultivaron por triplicado 50.000 células por pozo. Estas se evaluaron después de 24 horas durante 7 días, aproximadamente, dividiendo el número de células viables generadas diariamente por el número de células del día anterior; esto se hizo por conteo en hemocitómetro.
Porcentaje de invasión de Toxoplasma gondii, cepa RH y aislamiento CIBM1 en células THP1 y Vero por citometría de flujo
Para el proceso de identificación por citometría de flujo, se cultivaron las células THP1 y Vero en siete cajas de 25 ml. Cuando la confluencia era del 100 %, se realizaba la invasión con T. gondii, cepa RH, y con el aislamiento CIBM1, por duplicado, utilizando unas proporciones célula/taquizoíto de 1/5, 1/20, 1/50, en donde se usaron 2´000.000 de células THP1 y Vero con 400.000, 100.000 y 40.000 taquizoítos, respectivamente, de cada tipo parasitario. Las células control fueron células sin infectar en la misma cantidad.
Después de dos días de la invasión se les adicionó tripsina y se trasladaron a tubos Falcon™ de 15 ml para comenzar la primera etapa de fijación y permeabilización, que se hizo lavando dos veces con 2 ml de solución tampón fosfato, pH 7,4, en cada tubo y centrifugando cinco minutos a 280g y 4 °C; luego se descartó el sobrenadante y se agregaron 2 ml de etanol al 100 % durante 60 minutos a -20 °C.
La segunda etapa de la identificación es la de marcación con anticuerpos, en la cual se removió el alcohol por centrifugación, durante cinco minutos a 280g a 4 °C; después, las células se lavaron dos veces con 2 ml de solución tampón fosfato y se centrifugaron a 280g durante cinco minutos a 4 °C, seguido por el descarte del sobrenadante. Luego se inició la marcación con la P30 que tiene una dilución en PBT (PBS más 0,05 % Tween 20 y 0,5 % albumina sérica bovina) 1:200 durante 45 minutos. Posteriormente, se repitió el lavado con 2 ml de solución tampón fosfato, usando los mismos parámetros de centrifugación, y se inició la segunda marcación con Alexa flúor 488, diluido de la misma manera que el primer anticuerpo en una proporción 1:200, durante 45 minutos, en ausencia de luz. Terminando el proceso se lavaron otra vez con 2 ml de solución tampón fosfato por cada tubo, durante el mismo tiempo y a las mismas gravedades que en el paso anterior y, finalmente, se adicionaron 500 µl de PBT para iniciar el análisis en el citómetro de flujo Cytomics FC 500™, Beckman Coulter USA.
Cálculo del índice de rendimiento de Toxoplasma gondii, cepa RH y aislamiento CIBM1 en células THP1
Para analizar el índice de rendimiento de la cepa RH de T. gondii y el aislamiento CIBM1, se tomó una placa de 24 pozos, de los cuales se utilizaron 12, colocando 80.000 células THP1 con 2,5 ml de medio RPMI-1640, con suplemento de SFB al 2 % y penicilina más estreptomicina por duplicado en tres proporciones diferentes 1/5, 1/10, 1/20, utilizando la misma proporción de células y diferentes cantidades de taquizoítos: 16.000, 8.000 y 4.000, respectivamente.
Al cuarto día de invasión se inició el análisis del índice de rendimiento, el cual se realizó hasta tener todas las células lisadas. Este se obtuvo dividiendo el número de taquizoítos de cada día sobre el número de taquizoítos iniciales en cada proporción (índice de rendimiento = número final de taquizoítos / número inicial de taquizoítos).
El número de taquizoítos se obtuvo mediante conteo en cámara de hemocitómetro, obteniendo el promedio de parásitos en cuatro cuadrantes por µl de la dilución.
Resultados
Cultivo de las líneas celulares Vero, THP1 y propagación del parásito
Como primer ensayo, se analizó el crecimiento de las células THP1 y Vero por siete días, aproximadamente. Al final de los siete días se obtuvo un número similar de células, aunque el comportamiento de crecimiento en las células THP1 mostró una curva sigmoide, las células Vero crecieron de manera exponencial, mostrando este crecimiento después de los cinco días (figura 1).
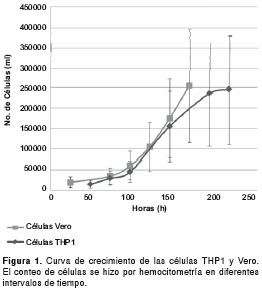
Las células THP1 necesitaron 180 horas, aproximadamente, para pasar a la fase estacionaria de crecimiento, mientras que las células Vero en ese mismo intervalo de tiempo solo presentaron un crecimiento exponencial (figura 1).
Porcentaje de invasión de Toxoplasma gondii, cepa RH y aislamiento CIBM1 en células THP1 y Vero por citometría de flujo
Al comparar los resultados de invasión de las células THP1 invadidas con la cepa RH de T. gondii y el aislamiento CIBM1, se observó que este último infectaba más células que la cepa RH en las tres proporciones diferentes célula/taquizoíto de 1/5, 1/20 y 1/50, con porcentajes de invasión del 57,1 %, 15,5 % y 12,2 %, respectivamente, para el aislamiento CIBM1, y para la cepa RH, unos porcentajes de invasión más bajos, de 32,6 %, 14,8 % y 8,1 %, respectivamente.
En la invasión de células Vero, el aislamiento CIBM1 sigue teniendo mayor capacidad de invasión que la cepa RH, ya que el aislamiento CIBM1 presentó porcentajes de invasión de 25,3 %,17,8 % y 8,8 %, y la cepa RH, de 22,3 %,14,1 % y 3,4 %, en las tres proporciones utilizadas (figura 2).
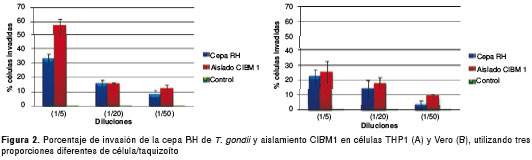
Índice de rendimiento de Toxoplasma gondii, cepa RH y aislamiento CIBM1 en células THP1
En cuanto al rendimiento de taquizoítos tanto de la cepa RH como del aislamiento CIBM1 de T. gondii en células THP1, se observó que el aislamiento CIBM1 en cada una de las proporciones célula/taquizoíto de 1/5, 1/10 y 1/20, fue el que más taquizoítos generó, ya que en la proporción menor –1/20– se observó un rendimiento de alrededor de 4.510±226,2, siendo diferente con la cepa RH de T. gondii que presentó en esa misma proporción un rendimiento de 3.600±537,4, aproximadamente. Por otro lado, la proporción de 1/5 presentó un rendimiento mayor de 902±24,7 para el aislamiento CIBM1 en comparación con el rendimiento de 780±19,4 para la cepa RH del parásito.
Las diferentes proporciones mostraron un aumento gradual de taquizoítos en la cepa RH de T. gondii y el aislamiento CIBM1, donde la proporción 1/5 con 16.000 taquizoítos fue la que tuvo más bajo rendimiento, mientras que la proporción 1/20 con 4.000 taquizoítos fue la que más alta producción de parásitos presentó en las células THP1.
El aislamiento CIBM1 tuvo un rendimiento en una escala de tiempo más amplia en comparación con la cepa RH de T. gondii, mientras que el aislamiento CIBM1 necesitó 14 días para la citólisis completa, la cepa RH necesitó de solo 10 días para generarla (figura 3).
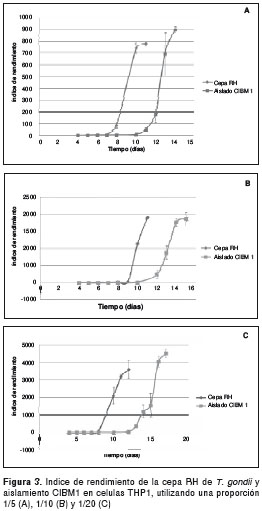
Discusión
El ensayo con el que se analizó el crecimiento de las células THP1 y Vero por 7 días, aproximadamente, mostró que las celulas Vero tienen un crecimiento más rápido y generan un mayor número de células en el mismo intervalo de tiempo que las celulas THP1.
Por otro lado, las células Vero mostraron, por citometría de flujo, un bajo porcentaje de invasión en comparación con las células THP1, siendo este último el mejor modelo celular para invasión con T. gondii. Esto fue confirmado por Bouchot, et al. (7), el cual utilizó la línea celular THP1 por su rápido crecimiento y alto rendimiento al ser infectada por T. gondii, cepa RH, lo que le permitió hacer un análisis de los cambios que sufre la membrana y el citoplasma de dichas células al formarse la vacuola parasitófora.
Sin embargo, existen reportes que confirman a las células Vero como el mejor modelo para trabajar rendimiento y viabilidad de T. gondii, por encima de las células THP1. Uno de estos reportes es el de Saadatnia, et al. (8), en el que se observó que las células Vero permiten la obtención del parásito con un alto porcentaje de viabilidad y bajo grado de contaminación, demostrando que la confluencia celular del 85 % en medio DMEM con suplemento de suero fetal bovino al 10 % y con una cantidad inicial de taquizoítos de 1 x 107, son las mejores condiciones para sembrar este parásito en estas células. Estos autores, después de tres días infección, obtuvieron una cantidad aproximada de 7,8 x 108 taquizoítos por placa, con 99 % de viabilidad y 3 % de contaminación por las células huésped.
Por otro lado, Meerschman, et al. (9), demostraron una producción de 10 millones de taquizoítos de T. gondii, cepa RH, por ml durante seis días en células Vero, mientras que nuestro estudio se centró en las células THP1 con una producción aproximada de 15 millones de taquizoítos por ml, durante 10 días.
Para obtener una adecuada proliferación del parásito en la línea celular Vero, la mayoría de autores describen que el medio de cultivo RPMI-1640 sin suplemento es el óptimo, lo cual es contradictorio con este estudio, ya que para el crecimiento del parásito en las células Vero se empleó medio de cultivo DMEM con suplemento de suero fetal bovino al 2 %.
La cepa RH de T. gondii bajo nuestras condiciones mostró una citólisis completa a los 10 días, mientras que otros autores (10,11) la obtuvieron al tercero y cuarto día en sus modelos celulares. Esto podría explicarse por el uso de constantes pases intraperitoneales de ratones BALB/C y Swiss-Webster antes de comenzar sus experimentos en cultivo celular.
Se plantea por parte del grupo de trabajo que el realizar solo pases en cultivo celular de la cepa RH de T. gondii, hace que la cepa vaya perdiendo virulencia gradualmente, hasta llegar al punto de no presentar ninguna invasión celular. Sin embargo, la producción de taquizoítos de T. gondii en sistemas de cultivo celular es favorable porque es de fácil manejo, bajo mantenimiento y no tiene tantas implicaciones éticas como el manejo de modelos animales (12-14).
El cálculo del índice de rendimiento dejó claro que, cuando se inocula gran cantidad de taquizoítos de T. gondii en las células, la competencia aumenta y los recursos dispuestos disminuyen. Además, cuando se utiliza poca cantidad de taquizoítos de T. gondii, la competencia es mínima y los recursos celulares son óptimos para un alto rendimiento del parásito.
En conclusión, las células Vero presentaron un mayor crecimiento en una escala de tiempo más corta en comparación con las células THP1, mientras que las células Vero mostraron, por citometría de flujo, un bajo porcentaje de invasión en comparación con las células THP1, siendo este último el mejor modelo celular para invasión con T. gondii. Además, utilizando una proporción 1/20 el aislamiento CIBM1 presentó mayor rendimiento con respecto a la cepa RH de T. gondii, debido posiblemente a los constantes pases que se hicieron en cultivo in vitro de la cepa RH.
Agradecimientos
Los autores agradecen la colaboración recibida por el personal del Centro de Investigaciones Biomédicas de la Universidad del Quindío y al Departamento Administrativo de Ciencia, Tecnología e Innovación-COLCIENCIAS por la beca Virginia Gutiérrez (2009-2010) asignada como joven investigador al biólogo Jorge Andrés Cuéllar.
Conflicto de intereses
Ninguno de los autores tuvo vinculación con alguna actividad que pudiera generar conflictos de interés.
Financiación
Departamento Administrativo de Ciencia, Tecnología e Innovación-COLCIENCIAS, código del proyecto P-2009-0006.
Jorge Andrés Cuéllar, Grupo de Investigación en Parasitología y Micología Molecular, Centro de Investigaciones Biomédicas, Universidad del Quindío, Carrera 15 calle 12 norte, Armenia, Colombia Telefax: (576) 746 0168 jacg136@gmail.com
Referencias
1. Adl SM, Simpson AG, Farmer MA, Andersen RA, Anderson OR, Barta JR, et al. The new higher level classification of eukaryotes with emphasis on the taxonomy of protists. J Eukaryot Microbiol. 2005;5:399-451. http://dx.doi.org/10.1111/j.1550-7408.2005.00053.x [ Links ]
2.Smith JR, Franc DT, Carter NS, Zamora D, Planck SR, Rosenbaum JT. Susceptibility of retinal vascular endothelium to infection with Toxoplasma gondii tachyzoites. Invest Ophthalmol Vis Sci. 2004;45:1157-61. http://dx.doi.org/10.1167/iovs.03-1105 [ Links ]
3.Gil A, Ramírez MC, Aguilera MC, Mesa MD. Modelos experimentales de enfermedad cardiovascular. Nutr Hosp. 2007;22:169-77. [ Links ]
4. Gizem S, Emin ÜB. Production of Toxoplasma gondii in Vero Cell Culture. Turkiye Parazitol Derg. 2011;35:61-4. [ Links ]
5. Shapiro HM. Practical flow cytometry. Fourth edition. Hoboken, NJ: John Wiley & Sons, Inc.; 2003. [ Links ]
6. Bouix M, Leveau JY. The applications of flow cytometry in microbiology. Bull Soc Fr Microbiol. 2001;16:210-8. [ Links ]
7. Bouchot A, Millot MJ, Charpentier S, Bonhomme A, Villena I, Aubert D, et al.Membrane potential changes after infection of monocytes by Toxoplasma gondii. Int J Parasitol. 2001;31:1114-20. http://dx.doi.org/10.1016/S0020-7519(01)00224-7 [ Links ]
8. Saadatnia G, Haj Ghani H, Khoo BY, Maimunah A, Rahmah N. Optimization of Toxoplasma gondii cultivation in Vero cell line. Trop Biomed. 2010;27:125-30. [ Links ]
9. De Meerschman F, Rettigner C, Focant C, Boreux R, Pinset C, Leclipteux T, et al. Use of a serum-free medium to produce in vitro Neospora caninum and Toxoplasma gondii tachyzoites on Vero cells. Vet Res. 2002;33:159-68. http://dx.doi.org/10.1051/vetres:2002004 [ Links ]
10. Degirmenci A, Doskaya M, Caner A, Cicek C, Korkmaz M, Guruz Y, et al. Toxoplasma gondii RH Ankara: Production of evolving tachyzoites using a novel cell culture method. Exp Parasitol. 2011;128:1-8. http://dx.doi.org/10.1016/j.exppara.2011.01.019 [ Links ]
11. Appleford JP, Smith EJ. Toxoplasma gondii: The growth characteristics of three virulent strains. Acta Tropica. 1997;65:97-104. http://dx.doi.org/10.1016/S0001-706X (97)00656-6 [ Links ]
12. Ashburn D, Evans R, Chatterton JM, Joss AW, Ho-Yen DO. Toxoplasma dye test using cell culture derived tachyzoites. J Clin Pathol. 2003;53:630-3. [ Links ] http://dx.doi.org/10.1136/jcp.53.8.630
13. Chatterton JM, Evans R, Ashburn D, Joss AW, Ho-Yen DO. Toxoplasma gondii in vitro culture for experimentation. J Microbiol Methods. 2002;51:331-5. http://dx.doi.org/10.1016/S0167-7012(02)00101-X [ Links ]
14. Evans R, Chatterton JM, Ashburn D, Joss AW, Ho-Yen DO. Cell-culture system for continuous production of Toxoplasma gondii tachyzoites. Eur J Clin Microbiol.1999;18:879-84. http://dx.doi.org/10.1007/s100960050423 [ Links ]













