Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.32 no.4 Bogotá Oct./Dec. 2012
https://doi.org/10.7705/biomedica.v32i4.765
PRESENTACIÓN DE CASO
doi: http://dx.doi.org/10.7705/biomedica.v32i4.765
1Unidad Cuidados Intensivos, Clínica Carlos Ardila Lülle-FOSCAL, Floridablanca, Colombia
2Servicio Neurología, Clínica Carlos Ardila Lülle-FOSCAL, Floridablanca, Colombia
Contribución de los autores:
Todos los autores participaron en la revisión de la literatura.
Diana L. Franco y Tomás Carvajal: escritura del artículo y organización de laboratorios e imágenes.
Adriana Martínez e Iván M. Peña: edición, revisión y escritura adicional, así como contribución en manejo y seguimiento de la paciente.
Adriana Martínez se encargó de la adquisición de las imágenes.
Recibido: 27/03/12; aceptado:25/06/12
La cirugía bariátrica es un tratamiento que garantiza una pérdida de peso sustancial y duradera, y beneficios tangibles respecto a condiciones médicas asociadas a la obesidad. El aumento del número de cirugías bariátricas ha llevado también a un aumento de las complicaciones relacionadas con ella, incluyendo la encefalopatía de Wernicke y la polineuropatía por deficiencia de vitaminas del complejo B.
En este artículo se reporta un caso de encefalopatía de Wernicke siete semanas después de la cirugía, enfatizando en la importancia de reconocer el espectro de la sintomatología para hacer un diagnóstico temprano, que permita intervenir en la fase reversible de esta enfermedad potencialmente letal.
Palabras clave: encefalopatía de Wernicke, polineuropatías, obesidad, derivación gástrica, tiamina, piridoxina.
doi: http://dx.doi.org/10.7705/biomedica.v32i4.765
Wernicke´s encephalopathy and polyneuropathy associated with vitamin B complex deficiency after a bariatric surgery
Bariatric surgery is a treatment that guarantees a substantial and lasting weight loss in addition to the tangible benefits relating to obesity-associated medical conditions. The increasing number of bariatric surgeries has revealed an increasing number of complications related to this procedure, including Wernicke´s encephalopathy and vitamin B deficiency polyneuropathies. Herein, a 7-week post-surgery case of Wernicke´s encephalopathy is presented that emphasizes the importance of an early recognition of these symptoms so as to initiate intervention during the reversible phase of these potentially lethal pathologies.
Key words: Wernicke encephalopathy, polyneuropathies, obesity, gastric bypass, thiamine, pyridoxine.
doi: http://dx.doi.org/10.7705/biomedica.v32i4.765
Existe una creciente preocupación mundial sobre la epidemia de la obesidad; en un censo realizado en el año 2000, se reportó que 63 millones de estadounidenses adultos tenían obesidad (índice de masa corporal, IMC>30) y 10,5 millones tenían obesidad mórbida (IMC>40) (1). En respuesta a este aumento de cifras de obesidad ha habido un incremento paralelo de la incidencia de cirugías bariátricas, que ha alcanzado en los Estados Unidos más de 180.000 cirugías en el año 2008, con una proyección de más de 600.000 para el 2010. Bajo este panorama, todo médico involucrado en la atención de estos pacientes debe conocer las complicaciones asociadas y siempre sospecharlas (1-3).
El aumento de las cirugías bariátricas ha traído efectos positivos como disminución de las enfermedades concomitantes asociadas con la obesidad (4,5). Sin embargo, durante estos últimos años se han reportado en series de casos, complicaciones neurológicas asociadas a estas cirugías, como neuropatía periférica, mielopatía postero-lateral, síndrome miotónico, neuropatía óptica y plexopatía lumbosacra. Si se asocia una encefalopatía a la presencia de polineuropatía, se produce el cuadro clínico que se denomina encefalopatía de Wernicke y polineuropatía por deficiencia de tiamina (3,4,6,7).
La cirugía bariátrica más común hasta el momento es el bypass gástrico en Y de Roux, que produce una combinación entre un estado restrictivo y uno de mala absorción. Aunque es un hecho que no ocurre una malabsorción de calorías, el efecto de pérdida de peso no se correlaciona con la reducción del volumen gástrico, sino con alteraciones centrales y con reducción en la ingestión, lo que produce una pérdida de peso de forma gradual y duradera (4,5,8,9).
En este artículo se reporta un caso de encefalopatía de Wernicke y polineuropatía siete semanas después de la cirugía bariátrica (bypass gástrico en Y de Roux), enfatizando en la importancia de reconocer el espectro de la sintomatología para hacer un diagnóstico temprano, que permita intervenir en la fase reversible de esta enfermedad potencialmente letal.
Presentación del caso clínico
Se trata de una paciente de 30 años de sexo femenino, con antecedentes de bypass gástrico siete semanas antes del ingreso a urgencias, con peso previo al procedimiento de 142 kg y un índice de masa corporal (IMC) de 48 kg/m2. Presentó en el periodo posoperatorio inmediato intolerancia a la vía oral, con edema de la boca de la anastomosis, la cual fue dilatada endoscópicamente, y luego fue dada de alta por presentar mejoría sintomática. Tres semanas después de la cirugía, consultó a urgencias por continuar con náuseas y episodios frecuentes de vómitos. Se descartaron trastorno electrolítico, obstrucción mecánica y trastorno orgánico de otra índole, con un estudio radiográfico de vías digestivas con doble contraste que mostró adecuado paso del medio, sin alteraciones obstructivas. Se manejó sintomáticamente con metoclopramida y, por glucometrías límites, se inició aporte de líquidos intravenosos con dextrosa en agua destilada al 5 %, después de lo cual mejoró y fue dada de alta.
La paciente persistió con similar sintomatología y, teniendo en cuenta su antecedentes de enfermedad psiquiátrica, se inició manejo ambulatorio bajo diagnóstico de trastorno facticio y trastorno ansioso, con clonazepam y psicoterapia.
Siete semanas después de la cirugía, la paciente refirió hipoacusia, con cambio del timbre de la voz, debilidad generalizada, sensación de inestabilidad y alteraciones en la marcha con pérdida progresiva de la fuerza en los miembros inferiores. Una semana después, presentó deterioro del estado de conciencia de forma progresiva hasta llegar a somnolencia, alteraciones del comportamiento, lenguaje con tono pueril, conducta inapropiada y episodios aislados de agresividad, motivo por el cual consultó y fue hospitalizada inicialmente en un instituto psiquiátrico, desde donde la remitieron al día siguiente para descartar un trastorno orgánico.
La paciente ingresó somnolienta, febril, taquicárdica, con tensión arterial normal y adecuado patrón respiratorio; en el examen neurológico se observó debilidad muscular generalizada sin focalización aparente. El peso al ingreso a la institución fue de 121 kg.
Se practicó una tomografía axial computadorizada cerebral simple, la cual fue normal; se hicieron exámenes de laboratorio generales que mostraron una infección de vías urinarias e hipotiroidismo (cuadro 1).

La paciente fue hospitalizada para manejo de la infección de vías urinarias con ciprofloxacina, estudiar su aparente cuadro psiquiátrico e iniciar suplemento de levotiroxina.
Tres días después de su ingreso, el estado de conciencia se deterioró hasta el coma superficial, alteración del patrón respiratorio y episodios de apnea, disminución de fuerza de las cuatro extremidades y pupilas puntiformes no reactivas. Se practicó una nueva tomografía cerebral simple que fue normal y se trasladó a la unidad de cuidados intensivos con puntaje de Glasgow 7/15. Se decidió hacer intubación orotraqueal y dar soporte con asistencia respiratoria mecánica.
La resonancia magnética cerebral mostró zonas hiperintensas en T2 y FLAIR (Fluid-Attenuated Inversion Recovery) de localización periventricular simétrica, en ventrículos laterales, tercer ventrículo, acueducto cerebral y porción alta del cuarto ventrículo, sin efecto de masa ni representación en T1 o defecto en la difusión (figuras 1a-d; figuras 1e-f y figuras 1g-h.
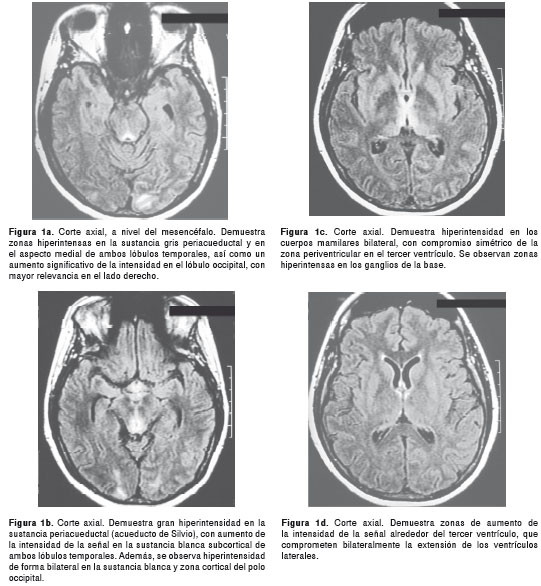
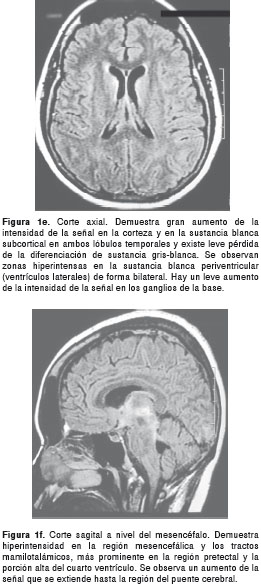

Los anteriores hallazgos se consideran indicativos de enfermedad desmielinizante o infecciosa. Se descartó infección por punción lumbar con examen citoquímico normal, sin células, y cultivo y tinción de Gram negativos.
Se inició manejo con vitamina B12 por el antecedente quirúrgico, y se solicitaron niveles de vitaminas séricas y exámenes paraclínicos para descartar porfiria intermitente aguda por el cuadro de debilidad.
La paciente continuó en coma superficial, con cuadriparesia, con compromiso respiratorio y arreflexia, a pesar del inicio de vitamina B12.
Dentro del contexto posquirúrgico de la paciente, los hallazgos neurológicos e imaginológicos no correspondían a una enfermedad psiquiátrica, por lo que se consideró que esa sintomatología neurológica, alteración en la marcha, debilidad y alteración en el estado de conciencia, era secundaria a enfermedad del sistema nervioso central. Se planteó el diagnóstico de encefalopatía de Wernicke secundaria a déficit de tiamina, precipitado por el cuadro emético recurrente y la baja ingestión de la paciente. Se inició manejo con 200 mg tiamina intravenosa como dosis inicial y 100 mg diarios como suplemento.
Dentro de las 48 horas después de iniciar la tiamina, se presentó recuperación progresiva de la conciencia con apertura ocular espontánea, pero con persistencia de la cuadriparesia flácida y arreflexia. Mediante estudios de laboratorio (cuadro 1) se descartó porfiria intermitente aguda y deficiencia de vitamina B12 y ácido fólico.
A las 72 horas de iniciado el tratamiento con tiamina, se decidió reajustar la dosis a 100 mg cuatro veces al día y se adicionó sulfato de magnesio. La paciente empezó a realizar movimientos espontáneos de cabeza y cara, con respuesta facial a los estímulos dolorosos y leve movilización de hombros, pero aún persistía con cuadriparesia, sin acudir a respiración mecánica asistida ni adecuada relación con el medio.
La paciente evolucionó de forma lenta y dos semanas después de su ingreso se practicó traqueostomía. Se logró suspender la sedaciónanalgesia, con adecuado acople respiratorio. En ese momento realizaba apertura ocular al llamado sin obedecer órdenes, con escasa interacción con el medio, y no movilizaba las extremidades excepto el miembro superior izquierdo. Ante la respuesta neurológica, se disminuyó la dosis de tiamina a 200 mg diarios. En vista de que se encontró deficiencia de piridoxina y riboflavina asociada, se decidió iniciar suplemento con complejo B intramuscular. Para suplir las vitaminas del complejo B (hidrosolubles, excepto la vitamina C), se incluyeron tiamina (B1), riboflavina (B2), niacina (B3), ácido pantoténico (B5), piridoxina (B6), biotina, ácido fólico y cianocobalamina (B12).
Debido al lento proceso de recuperación y la persistencia de las alteraciones en las cuatro extremidades, se practicó una electromiografía y neuroconducción de las extremidades que demostró compromiso polineuropático sensitivo y motor de tipo axonal con daño dependiente de longitud, más serio en los miembros inferiores e indicativo de degeneración de fibras secundaria al déficit sostenido de tiamina.
Discusión y revisión de tema.
Polineuropatía asociada a déficit vitamínico.
Las deficiencias de vitamina B1 (tiamina) y vitamina B12 (cianocobalamina) son las causas más comunes de polineuropatías después de cirugía bariátrica; las ocasionadas por deficiencia de tiamina son denominadas beriberi neurítico (beriberi seco). Además, se ven relacionados otros tipos de deficiencias vitamínicas, como lo son la deficiencia de niacina y piridoxina, que pueden estar asociadas a este tipo de polineuropatía y a otras neuropatías periféricas. Dentro de este gran espectro de alteraciones posteriores a la cirugia bariátrica, se incluyen cuadros similares al síndrome de Guillain Barré, la miastenia gravis, la polineuropatía asociada a hepatitis crónica activa y el lupus eritematoso (3,10-12).
La incidencia aproximada de polineuropatías después de cirugía bariátrica es de 0,06 % (10), aunque algunos estudios retrospectivos reportan una incidencia de hasta 16 % de algún tipo de polineuropatía después de cirugía bariátrica (8,13).
Encefalopatía de Wernicke.
La encefalopatía de Wernicke es una de las alteraciones neurológicas que puede producir el déficit de tiamina que, aunque conocida por ser una enfermedad atribuida solamente a alcohólicos, sorprendentemente fue descrita en un paciente no alcohólico (14,15).
La prevalencia de esta encefalopatía ha venido aumentado; en 2007 se describió una prevalencia de alrededor del 2 %, de los cuales solo 15% de los casos de diagnosticaban antes de la muerte, debido al subdiagnóstico de esta entidad (14). Como complicación de la cirugía bariátrica en las revisiones sistemáticas recientes, se estimó una incidencia del 0,2 %, aunque se sabe que hasta el 49 % de los pacientes con cirugía bariátrica tienen déficit de tiamina; esto lleva a un preocupante subdiagnóstico (2,8,15,16).
La naturaleza prevenible y tratable en su fase temprana, hace de esta enfermedad un tema actual y en plena evolución en la práctica clínica. Además, el pronóstico depende de un reconocimiento rápido y la instauración de un manejo temprano (8,14,17).
Fisiopatología.
La tiamina es un cofactor esencial para enzimas constituyentes del ciclo de Krebs, de la vía de la fosfato pentosa como la transcetolasa y cofactor de la enzima piruvato deshidrogenasa, todas importantes en la producción de energía. Su deficiencia puede causar daño tisular, inhibiendo el metabolismo en regiones cerebrales vulnerables, que son las de mayor actividad metabólica y mayor reserva de tiamina (14,18,19).
Después de tres semanas de deficiencia de tiamina, los niveles séricos caen y llevan a las enzimas que requieren pirofosfato de tiamina a disminuir su actividad,produciendo acumulación de intermediarios tóxicos como el lactato, que produce daño tisular (14,17,20). La disminución de la actividad de la transcetolasa en los astrocitos se inicia a la semana de la deficiencia, por lo que se aumenta la producción de radicales libres de oxígeno que causa el daño celular osmótico y edematoso. Además, se ve un aumento en la tasa de producción de ácidos libres, particularmente ácido láctico, lo cual lleva a una acidosis metabólica persistente que hace perseverar el daño celular. Por otra parte, la permeabilidad de los capilares cerebrales se ve alterada, produciendo áreas hemorrágicas y de edema celular. Se observa infiltración de macrófagos y fragmentación de ADN en el tálamo y los cuerpos mamilares. Hay apoptosis celular a las dos semanas de la deficiencia de tiamina. El cuadro clínico puede ser reversible hasta este punto, si se maneja de forma prioritaria con reposición de tiamina, para disminuir el lactato y la lesión tisular desencadenada con disminución de la producción de aminoácidos. Un retraso en el inicio del tratamiento con suplemento puede llevar a secuelas neurológicas permanentes (14,19,21-23).
Presentación clínica.
La encefalopatía de Wernicke-polineuropatía por deficiencia nutricional de vitaminas es una emergencia médica que puede ocurrir después de cualquier procedimiento dirigido a la pérdida de peso. El diagnóstico se establece fundamentalmente con los hallazgos clínicos, apoyado en estudios imaginológicos (1,3,8).
La tríada clínica para el diagnóstico de encefalopatía de Wernicke está constituida por: oftalmoplejía, inestabilidad para la marcha (ataxia) y alteración de la conciencia. Esta tríada es un elemento teórico no muy aplicable, ya que su presentación varía según el estudio, los criterios y la consideración específica, presentándose variablemente entre el 10 % y máximo el 56 % de los pacientes (1,8,14,19,21,22,24,25). Esta variabilidad en su presentación puede llevar a un subdiagnóstico o subregistro importante, que puede ser secundario a las diferentes formas de presentación o a la asociación de esta entidad con enfermedades concomitantes (1,8,14).
También se encuentran alteraciones en la oftalmoscopia y en el aparato visual, como papiledema, hemorragias retinales, miosis, anisocoria, disminución de la agudeza visual y hasta ceguera (1,5,26). Otras manifestaciones menos comunes pero reportadas, han sido: síntomas psicóticos, depresión, alteraciones comportamentales, disminución de la agudeza auditiva, disartria, alucinaciones visuales y disfunción vestibular (1,5,17,21,27). Entre estas presentaciones se encuentran los síntomas psicóticos, que se podrían relacionar con la presentación inicial de esta paciente, siendo esto un factor de confusión inicial.
La polineuropatía periférica es frecuente, con una tasa similar entre neuropatía motora y sensitiva, usualmente con mayor compromiso en los miembros inferiores, razón por la cual es común la dificultad de la marcha (1,27,28).
Es importante resaltar que algunos pacientes pueden iniciar sintomatología desde dos semanas hasta 10 meses después de la cirugía, siendo el promedio de 92 días para algunas revisiones (8,15,19). La progresión del déficit neurológico puede ser tan rápida como de pocos días hasta alcanzar el coma, siendo frecuente el empeoramiento con la administración de glucosa sin tiamina (1-3,8,14,15,19,29). Esta administración de glucosa parece ser un factor clave dentro de la historia de nuestra paciente y su rápida progresión.
Además, se debe mencionar que otra forma de presentación clínica de la deficiencia de tiamina está asociada a diferentes enfermedades, como la cardiomiopatía (beriberi húmedo) y otros subtipos de neuropatía (17,23).
Diagnóstico paraclínico.
Para determinar el diagnóstico de la encefalopatía de Wernicke-polineuropatía se debe recordar que no hay prueba paraclínica específica de rutina y se debe tener una alta sospecha diagnóstica por la clínica (1,3,7)..
La tiamina sérica se cuantifica a partir de la medición de la actividad de la enzima transcetolasa eritrocítica o la excreción urinaria de la transcetolasa de la tiamina. También, se han descrito métodos como la medición del difosfato de tiamina y el trifosfato de tiamina en glóbulos rojos hemolizados; para estos métodos se utiliza la cromatografía líquida (1,8,12,14,17,19,30). Los valores de normalidad y su interpretación varían, pero se acepta, como prueba positiva para el trifosfato de tiamina, un aumento de más del 16 % de la actividad de la enzima transcetolasa eritrocítica de la medición basal (17). Es importante resaltar que encontrar un nivel plasmático normal de tiamina no descarta el diagnóstico (3,14,17,19,25).
La neuroconducción-electromiografía es el examen no invasivo de elección para el diagnóstico de la polineuropatía por deficiencia nutricional (5,10- 12,27,28,31,32), encontrándose neuropatía difusa axonal con compromiso sensitivo y motor, usualmente dependiente de la longitud del nervio que, con mayor frecuencia, produce afectación de miembros inferiores que de los superiores (1,5,11,12,27).
Diagnóstico radiológico.
La resonancia magnética se considera la principal herramienta diagnóstica en la encefalopatía de Wernicke. Se han encontrado claras diferencias entre pacientes con encefalopatía de Wernicke de etiología alcohólica con pacientes no alcohólicos, siendo esto de gran utilidad para el diagnóstico diferencial (21,22,25,33,34).
En múltiples revisiones se ha descartado la tomografía computadorizada cerebral como ayuda diagnóstica (15,21,22,30,33,34); esto se refleja en el presente caso con que tuvo dos tomografías normales. Además, reportan que la resonancia magnética nuclear para la encefalopatía de Wernicke tiene una sensibilidad de 53 % y una especificidad de 93 % (21,22,33).
Las lesiones características de la encefalopatía de Wernicke se describen como un aumento de la intensidad de la señal en las secuencias T2 y FLAIR: lesiones en la sustancia gris periacueductal, alteraciones simétricas bilaterales en la región medial del tálamo, piso del cuarto ventrículo, el área periventricular del tercer ventrículo, región tectal y lesiones en los cuerpos mamilares (18,21,22,25,30,33,34). En la secuencia DW-MRI (diffusion-weighted Magnetic Resonance Imaging), se observa un aumento en la intensidad de la señal del tálamo bilateral y en la región periacueductal (21).
Las lesiones atípicas (no características) de encefalopatía de Wernicke se describen como un aumento de la intensidad de la señal en las secuencias T2 y FLAIR: lesiones en cerebelo y vermis cerebeloso, lesiones simétricas bilaterales en el núcleo rojo, en el núcleo dentado cerebeloso, en la cabeza del núcleo caudado, lesiones corticales frontales y corticales parietales, lesiones en los núcleos de los pares craneanos y la región posterior del cuerpo calloso (Corpus Callosum Splenium) y lesión en el bulbo dorsal (21,22,25,33,34).
Factores de riesgo.
Existen múltiples factores de riesgo para complicaciones neurológicas secundarias a cirugía bariátrica, de los cuales cabe resaltar los siguientes: tasa absoluta y cantidad de pérdida de peso, síntomas gastrointestinales prolongados (como vómito, diarrea), ausencia de valoración y seguimiento de clínica nutricional después de cirugía, no administrar suplemento de vitaminas y minerales, disminución de albúmina y transferrina (como indicadores de desnutrición), cualquier complicación posquirúrgica que requiera hospitalización, presencia de bypass yeyuno-ileal (presencia de cirugía gástrica restrictiva), administración intravenosa de dextrosa o nutrición parenteral sin suplemento de tiamina o síndromes de malabsorción prequirúrgicos. La mayoría de estos factores deberían ser buscados activamente en el estado prequirúrgico. (7,8,9,17,25).
Tratamiento.
La encefalopatía de Wernicke-polineuropatía es una emergencia neurológica, ya que su pronóstico depende fundamentalmente del tratamiento oportuno. En todo paciente en quien se sospeche, el tratamiento debe iniciarse de inmediato en forma empírica y por vía parenteral. El único tratamiento curativo es la pronta administración de suplemento de tiamina (7,8,15,19,21,22).
La dosis de suplemento de tiamina es de 100 mg intravenosos al día, como mínimo, aunque se ha visto beneficio y adecuada respuesta con hasta 500 mg de tiamina intravenosa tres veces al día por dos a tres días. Una vez superada la fase aguda, o cuando ya no se observa más recuperación del cuadro, se debe continuar con suplemento oral con tiamina en forma crónica, 30 mg dos veces al día, durante tres meses (12,14,17,19,27,29).
Es de suma importancia que el suplemento de tiamina se administre antes que cualquier suplemento con glucosa, ya que, como se dijo anteriormente, de no ser así se puede empeorar el pronóstico (3,9,12,14,17,19,21,22,27,29).
Las reacciones adversas reportadas son infrecuentes, desde eritema-prurito (0,093 %), irritación local (1,02 %), hasta anafilaxis en casos con incidencia de cuatro por millón de administraciones (12,14,19).
Existen recomendaciones específicas en las “Guías para cirugía bariátrica”, 2009 (9), y en revisiones más recientes de la literatura científica (7,25), para evitar complicaciones neurológicas nutricionales. La valoración nutricional prequirúrgica exhaustiva, la búsqueda activa prequirúrgica de deficiencias de tiamina, recibir complejo multivitamínico oral que tenga incluida tiamina, todo paciente con vómito frecuente debe ser tamizado, el paciente con vómito persistente después de cualquier cirugía bariátrica debe recibir tratamiento agresivo con suplemento de tiamina. La administración de glucosa (dextrosa) debe ser restringida, ya que empeora el déficit de tiamina. Se recomienda, en pacientes después de cirugía bariátrica con síntomas neurológicos sugestivos de una deficiencia de tiamina (encefalopatía de Wernicke o polineuropatía), iniciar un tratamiento intravenoso agresivo con tiamina (mínimo 100 mg/ día) por 7 a 14 días (1,3,4,6,7,9,19,24,25,27,29).
Aunque está descrito el suplemento antes y después de la cirugía, como medida de prevención de la encefalopatía de Wernicke-polineuropatía, existen reportes de caso y cohortes que informan que el suplemento estándar con multivitamínicos o por protocolo puede no ser efectivo, y que se requiere de suplemento específico antes y después de la cirugía para cada déficit encontrado (2,5,19,27,35).
Pronóstico.
El pronóstico en pacientes con encefalopatía de Wernicke-polineuropatía depende del tiempo de inicio del suplemento de tiamina (10,15,19,34), pero la relación entre la dosificación y la respuesta al tratamiento, así como la relación entre la dosificación y la recuperación incompleta, no se han establecido (3,14), aunque se sabe que no tratar oportunamente la enfermedad lleva a consecuencias más graves, con mayor compromiso, y a tener déficit neurológico crónico. Además, los pacientes que cursan con polineuropatía como única alteración tienden a tener deficiencias nutricionales múltiples y más graves, dando así un peor pronóstico (1,7,8,36).
Se han descrito múltiples factores que empeoran el pronóstico de pacientes con encefalopatía de Wernicke, como: diagnóstico tardío, reemplazo insuficiente de tiamina (dosis inadecuadas), y deficiencias simultáneas de otros micronutrientes, como la deficiencia de cianocobalamina, niacina y piridoxina, que como vimos anteriormente pueden producir sintomatología similar (1,3,36).
Existen reportes de caso de diminución de la sintomatología hasta dos años después del diagnóstico (1,19,21,27). Los síntomas persistentes residuales más frecuentes son nistagmus, ataxia y algún grado de síndrome de Korsakoff (alteraciones de la memoria, confabulaciones, amnesia, apatía, pérdida de la introspección, asociado a deficiencias crónicas), el cual se presenta más frecuentemente en población alcohólica (14,15,23). En algunos reportes de caso se muestra que cerca del 61 % de los pacientes que se recuperan de encefalopatía de Wernicke tienen de forma crónica alteraciones cognitivas y en la memoria (14).
Un mal pronóstico o resultados con menor grado de recuperación se han visto en una presentación con lesiones corticales y cambios difusos de lentificación de potenciales postsinápticos en el electroencefalograma, lo que puede indicar gran daño y un componente irreversible (1,8,15, 21,22,33).
Conclusiones.
La prevalencia de la encefalopatía de Wernicke se ha subvalorado y su diagnóstico se ha restringido en forma exclusiva a pacientes alcohólicos. El desarrollo de nuevos procedimientos quirúrgicos y nuevos tratamientos médicos, ha aumentado las circunstancias clínicas en que esta enfermedad puede presentarse.
Su diagnóstico continúa siendo eminentemente clínico y requiere un elevado nivel de sospecha por parte del médico tratante: todo paciente con deterioro o alteración de su esfera mental, con antecedente de haber sido sometido a un procedimiento quirúrgico intraabdominal, debe ser considerado como un paciente en riesgo. En el caso de nuestra paciente, es importante resaltar que tenía factores de riesgo claros, como vómito persistente, pérdida de peso e hiporexia sin suplemento de vitaminas. Además, un factor de riesgo que agravó el curso de esta enfermedad fue la administración de glucosa sin reposición de tiamina. Aunque posteriormente el manejo fue adecuado en cuanto a la reposición de suplementos vitamínicos, su condición progresó a polineuropatía y déficit motor grave, el cual aún persiste. Este resultado crónico y potencialmente irreversible, resalta la importancia de hacer un diagnóstico temprano, aun con niveles séricos normales de tiamina. En el escenario clínico, es de mayor utilidad el estudio imaginológico por resonancia magnética cerebral. Los casos reportados desde el advenimiento de la cirugía bariátrica como manejo de elección en obesidad mórbida, han permitido identificar los factores de riesgo para presentar esta complicación y así seleccionar los pacientes que van a requerir un seguimiento más estricto, tomando como base las guías de prevención y manejo ya disponibles en la literatura científica mundial (cuadro 2).

Los autores no expresan ningún conflicto de intereses y aceptan todo el contenido.
El artículo fue financiado por los autores.
Correspondencia: Tomas Carvajal, Carrera 10 N° 67A-60, apartamento 201, Bogotá, D.C., Colombia. Teléfono: (571) 803 3432, fax: (571) 248 3661 tom.carvajal@gmail.com
1. Aasheim ET. Wernicke encephalopathy after bariatric surgery: A systematic review. Ann Surg. 2008;248:714-20. [ Links ]
2. Bal B, Koch TR, Finelli FC, Sarr MG. Managing medical and surgical disorders after divided Roux-en-Y gastric bypass surgery. Nat Rev Gastroenterol Hepatol. 2010;7:320-34. http://dx.doi.org/10.1038/nrgastro.2010.60. [ Links ]
3. Ba F, Siddiqi ZA. Neurologic complications of bariatric surgery. Rev Neurol Dis. 2010;7:119-24. http://dx.doi.org/10.1001/archneur.61.8.1185. [ Links ]
4. Pournaras D, le Roux C. After bariatric surgery, what vitamins should be measured and what supplements should be given? Clin Endocrinol (Oxf). 2009;71:322-5. http://dx.doi.org/10.1111/j.1365-2265.2009.03564.x [ Links ]
5. Koffman BM, Greenfield LJ, Ali II, Pirzada NA. Neurologic complications after surgery for obesity. Muscle Nerve. 2006;33:166-76. http://dx.doi.org/10.1002/mus.20394 [ Links ]
6. Thaisetthawatkul P, Collazo-Clavell ML, Sarr MG, Norell JE, Dyck PJ. Good nutritional control may prevent polyneuropathy after bariatric surgery. Muscle Nerve. 2010;42:709-14. http://dx.doi.org/10.1002/mus.21802 [ Links ]
7. Ziegler O, Sirveaux MA, Brunaud L, Reibel N, Quilliot D. Medical follow up after bariatric surgery: Nutritional and drug issues. General recommendations for the prevention and treatment of nutritional deficiencies. Diabetes Metab. 2009;35:544-57. http://dx.doi.org/10.1016/S1262-3636(09) 73464-0 [ Links ]
8. Singh S, Kumar A. Wernicke encephalopathy after obesity surgery: A systematic review. Neurology. 2007;68:807-11. http://dx.doi.org/10.1212/01.wnl.0000256812.29648.86. [ Links ]
9. Mechanick JI, Kushner RF, Sugerman HJ, González-Campoy JM, Collazo-Clavell ML, Spitz AF. American Association of Clinical Endocrinologists, the Obesity Society, and American Society for Metabolic & Bariatric Surgery medical guidelines for clinical practice for the perioperative nutritional, metabolic, and nonsurgical support of the bariatric surgery patient: Perioperative Bariatric Guidelines. Obesity. 2009;17:1-70. http://dx.doi.org/10.1038/oby.2009.28. [ Links ]
10. Aluka KJ, Turner PL, Fullum TM. Guillain-Barré syndrome and postbariatric surgery polyneuropathies. JSLS. 2009;13:250-3. [ Links ]
11. Koike H, Ito S, Morozumi S, Kawagashira Y, Iijima M, Hattori N, et al. Rapidly developing weakness mimicking Guillain-Barré syndrome in beriberi neuropathy: Two case reports. Nutrition. 2008;24:776-80. http://dx.doi.org/10.1016/j.nut.2008.02.022. [ Links ]
12. Teitleman M, Katzka DA. A case of polyneuropathy after gastric bypass surgery. MedGenMed. 2005;7:21. [ Links ]
13. Thaisetthawatkul P, Collazo-Clavell ML, Sarr MG, Norell JE, Dyck PJ. A controlled study of peripheral neuropathy after bariatric surgery. Neurology. 2004;63:1462-70. [ Links ]
14. Donnino M, Miller J, Walsh M, Vega J. Myths and misconceptions of Wernicke´s encephalopathy: What every emergency physician should know. Ann Emerg Med. 2007;50:715-21. http://dx.doi.org/10.1016/j.annemergmed.2007.02.007. [ Links ]
15. Cirignotta F, Manconi M, Mondini S, Buzzi G, Ambrosetto P. Wernicke-Korsakoff encephalopathy and polyneuropathy after gastroplasty for morbid obesity: Report of a case. Arch Neurol. 2000;57:1356-9. http://dx.doi.org/10-1001/pubs.Arch Neurol.-ISSN-0003-9942-57-9-nob90055. [ Links ]
16. Aasheim E, Hofsø D, Søvik T. Vitamin supplements after bariatric surgery: Response to the editor. Clin Endocrinol (Oxf). 2009;72:133-6. [ Links ]
17. Kumar N. Neurologic presentations of nutritional deficiencies. Neurol Clin. 2010;28:107-70. http://dx.doi.org/10.1016/j.ncl.2009.09.006. [ Links ]
18. Wilson RK, Kuncl RW, Corse AM. Wernicke´s encephalopathy: Beyond alcoholism. Nat Clin Pract Neurol. 2006;2:54-8. . http://dx.doi.org/10.1038/ncpneuro0094. [ Links ]
19. Sechi GP, Serra A. Wernicke´s encephalopathy: New clinical settings and recent advances in diagnosis and management. Lancet Neurol. 2007;6:442-55. http://dx.doi.org/10.1016/S1474-4422(07)70104-7. [ Links ]
20. Donnino MW, Miller J, García AJ, McKee E, Walsh M. Distinctive acid-base pattern in Wernicke´s encephalopathy. Ann Emerg Med. 2007;50:722-5. http://dx.doi.org/10.1016/j.annemergmed.2006.10.022 [ Links ]
21. Fei G., Zhong C, Jin L, Wang J, Zhang Y, Zheng X, et al. Clinical characteristics and MR imaging features of nonalcoholic Wernicke encephalopathy. Am J Neuroradiol. 2008;29:164-9. http://dx.doi.org/10.3174/ajnr.A0827. [ Links ]
22. Zhong C, Jin L, Fei G. MR Imaging of nonalcoholic Wernicke encephalopathy: A follow-up study. Am J Neuroradiol. 2005;26:2301-5. [ Links ]
23. Kumar V, Fausto N, Abbas A. The central nervous system. En: Robbins and Cotran pathologic basis of disease. 8th edition. Philadelphia, PA: Saunders-Elsevier; 2009. p. 1328-9. [ Links ]
24. Foster D, Falah M, Kadom N, Mandler R. Wernicke encephalopathy after bariatric surgery: Losing more than just weight. Neurology. 2005;65:1987. [ Links ]
25. Galvin R, Bråthen G, Ivashynka A, Hillbom M, Tanasescu R, Leone MA. EFNS guidelines for diagnosis, therapy and prevention of Wernicke encephalopathy. Eur J Neurol. 2010;17:1408-18. http://dx.doi.org/10.1111/j.1468- 1331.2010.03153.x. [ Links ]
26. Longmuir R. Visual loss due to Wernicke syndrome following gastric bypass. Semin Ophthalmol. 2007;22:13-9. http://dx.doi.org/10.1080/08820530601182733. [ Links ]
27. Nakamura K, Roberson ED, Reilly LG, Tsao JW. Polyneuropathy following gastric bypass surgery. Am J Med. 2003;115:679-80. http://dx.doi.org/10.1016/j.amjmed.2003.05.002. [ Links ]
28. Hsia A, Hattab E, Katz J. Malnutrition-induced myopathy following Roux-en-y gastric bypass. Muscle Nerve. 2001;24:1692-4. http://dx.doi.org/10.1002/mus.1204. [ Links ]
29. Sechi GP. Prognosis and therapy of Wernicke´s encephalopathy after obesity surgery: Letters to the editor. Am J Gastroenterol. 2008;103:3219. http://dx.doi.org/10.1111/j.1572-0241.2008.02161_19.x. [ Links ]
30. Bhardwaj A, Watanabe M, Shah JR. A 46-year-old woman with ataxia and blurred vision 3 months after bariatric surgery. Am J Gastroenterol. 2008;103:1575-7. http://dx.doi.org/10.1111/j.1572-0241.2008.01880_10.x. [ Links ]
31. Juhasz-Pocsine K, Rudnicki SA, Archer RL, Harik SI. Neurologic complications of gastric bypass surgery for morbid obesity. Neurology. 2007;68:1843-50. http://dx.doi.org/10.1212/01.wnl.0000262768.40174.33. [ Links ]
32. Menezes MS, Harada KO, Álvarez G. Painful peripheral polyneuropathy after bariatric surgery: Case reports. Rev Bras Anestesiol. 2008;58:252-9. http://dx.doi.org/10.1590/ S0034-70942008000300008. [ Links ]
33. Zuccoli G, Gallucci M, Capellades J, Regnicolo L, Tumiati B, Cabada Giada T, et al. Wernicke encephalopathy: MR findings at clinical presentation in twenty-six alcoholic and nonalcoholic patients. Am J Neuroradiol. 2007;28:1328-31. http://dx.doi.org/10.3174/ajnr.A0544. [ Links ]
34. Zuccoli G, Santa Cruz D, Bertolini M, Rovira A, Gallucci M, Carollo C. MR imaging findings in 56 patients with Wernicke encephalopathy: Nonalcoholics may differ from alcoholics. AJNR Am J Neuroradiol. 2009;30:171-6. http:// dx.doi.org/10.3174/ajnr.A1280. [ Links ]
35. Gasteyger C, Suter M, Gaillard RC, Giusti V. Nutritional deficiencies after Roux-en-Y gastric bypass for morbid obesity often cannot be prevented by standard multivitamin supplementation. Am J Clin Nutr. 2008;87:1128-33. [ Links ]
36. Sechi GP. Peculiarities of Wernicke encephalopathy after bariatric surgery: Response to the editor. Ann Surg. 2009;249:1066. http://dx.doi.org/10.1097/SLA.0b013e 3181a 8860e [ Links ]













