Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157
Biomédica vol.32 no.4 Bogotá out./dez. 2012
https://doi.org/10.7705/biomedica.v32i4.773
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v32i4.773
Departamento de Entomología Médica, Instituto Conmemorativo Gorgas de Estudios de la Salud, Panamá, República de Panamá
Contribución de los autores:
Todos los autores contribuyeron en la redacción y corrección del manuscrito, análisis e interpretación de los datos, verificación de referencias bibliográficas, observaciones y revisión crítica del mismo.
Recibido: 17/01/12; aceptado:05/07/12
Introducción. Pocos estudios describen los factores asociados con la dinámica de transmisión de la malaria, o paludismo, por Plasmodium vivax en las regiones endémicas de Panamá.
Objetivo. Caracterizar la dinámica de transmisión de la malaria producida por P. vivax en la región fronteriza de Panamá con Costa Rica.
Materiales y métodos. Se llevó a cabo un estudio observacional, descriptivo y transversal. Se evaluaron la incidencia parasitaria anual, el índice de láminas positivas y el índice anual de exámenes de sangre.
Se identificaron los anofelinos vectores, y se caracterizaron sus criaderos preferenciales, densidad larvaria e índice de picada/hombre/noche. Se hizo búsqueda pasiva y activa de casos sospechosos mediante examen de gota gruesa.
Resultados. De 10.401 muestras de gota gruesa, 83 resultaron positivas para P. vivax. El 84 % de los casos provenía de zonas rurales, el 79 % constituía una población económicamente activa, la mediana de edad fue de 36 años y, la media, de 30 años. El 58,5 % de los casos fueron de sexo masculino.
La incidencia parasitaria anual fue de 4,1 por 1.000 habitantes; el índice de láminas positivas fue de 0,8 % y el índice anual de exámenes de sangre fue de 51,9 %. El 65,0 % de los casos diagnosticados registró entre 100 y 2.000 parásitos/μl de sangre. Se identificaron los mosquitos vectores Anopheles albimanus y An. punctimacula.
Conclusión. Es necesario el seguimiento de estudios entomológicos, el fortalecimiento de la vigilancia epidemiológica, la consideración de los factores de riesgo y la realización de un trabajo en coordinación con las autoridades de salud de Costa Rica, para controlar la malaria en esta región.
Palabras clave: Anopheles, malaria/prevención y control, parasitemia, Plasmodium vivax, vectores de enfermedades, control, signos y síntomas, cloroquina, primaquina.
doi: http://dx.doi.org/10.7705/biomedica.v32i4.773
Characterization of Plasmodium vivax malaria transmission at the border of Panamá and Costa Rica
Introduction. Few studies have described the factors associated with Plasmodium vivax transmission dynamics in endemic regions from Panamá.
Objective. Malaria transmission dynamics produced by P. vivax were characterized at the border between Panamá and Costa Rica.
Materials and methods. In the municipality of Barú, an observational, descriptive and cross-sectional study was undertaken to measure the annual parasite index (API), slide positivity index (SPR), and the annual blood examination rate (ABER). The most frequent symptoms and signs in malaria patients were recorded. The anopheline species were identified in the area and the preferred larval habitats, the density of larval populations in the larval habitats and the bites/human/night were characterized.
Results. Of a total of 10,401 thick smear blood samples, 83 were positive for P. vivax. Of these, 84% came from rural areas and 79% were from economically active individuals. The median and average ages were 36 and 30 years, respectively, and 58.5% of the malaria cases were male. API was 4.1/1,000 inhabitants; SPR was 0.8% and ABER was 51.9%. Of the diagnosed cases, 54% showed blood parasitemias ranging between 100-2,000 parasites/μl. The majority of the cases were observed in May and June. Two mosquito vector species were identified-- Anopheles albimanus and An. punctimacula.
Conclusion. These observations indicate the advisibility of continued entomological studies, strengthening of epidemiological surveillance, consideration of additional risk factors and evaluation of work performance in the border region. This will require coordination with health authorities of both countries to control malaria in this region.
Key words: Anopheles, malaria/prevention & control, parasitemia, Plasmodium vivax, disease vectors, signs and symptoms, chloroquine, primaquine.
doi: http://dx.doi.org/10.7705/biomedica.v32i4.773
La malaria, o paludismo, es la principal enfermedad de origen parasitario transmitida por mosquitos vectores que afecta grandemente la salud y la capacidad de trabajo de cientos de millones de personas, y es uno de los grandes obstáculos que ha frenado el desarrollo social y económico de muchas regiones del mundo. Según la Organización Mundial de la Salud (OMS), unos 3.200 millones de personas viven en riesgo de contraer esta enfermedad. En el 2010, se registraron 216 millones de casos de malaria y unas 655.000 muertes (1,2) El paludismo sigue siendo la enfermedad infecciosa con mayor prevalencia en regiones tropicales, causando 5.000 muertes diariamente, en su gran mayoría niños (3,4).
En la región de las Américas, 3 de cada 10 personas están en diversos grados de riesgo de contraer la enfermedad (5). El número de casos de malaria decreció de 1´140.000 en el 2000 a 572.000 casos en 2008. El 77 % de los casos producidos en América se debe a Plasmodium vivax. Belice, El Salvador, Guatemala y Nicaragua registraron la reducción de más del 50 % de los casos de malaria, en tanto que Panamá y Costa Rica reportaron fluctuaciones en el número de casos de malaria entre el 2000 y 2008. Centroamérica es una subregión donde el grado de transmisión es más bajo y donde predomina el paludismo por P. vivax (96 %). Las cepas de P. falciparum y P. vivax que se encuentran en estos países son sensibles a la cloroquina (2).
Diversos factores están asociados con la transmisión de la malaria en regiones endémicas, entre ellos, viviendas desprotegidas, presencia de criaderos cercanos a las viviendas, y características socioeconómicas, culturales, demográficas y epidemiológicas de la población (6). Es posible que se presenten brotes de malaria no sólo en áreas tradicionalmente palúdicas, sino en aquellas que incluso han sido declaradas con anterioridad libres de la enfermedad (7). Es importante indicar que la reemergencia de la malaria en muchas regiones obedece a diferentes factores, entre ellos, cambios en las políticas de control de los programas de malaria, aspectos biológicos del huésped humano, el vector y el parásito, cambios en el medio ambiente y desarrollo de resistencia a los insecticidas en poblaciones de anofelinos vectores (2,8).
Las zonas interfronterizas tienen una incidencia directa en los patrones de comportamiento epidemiológico de la enfermedad, debido a la migración constante entre países que permite la distribución y dispersión de la malaria a otras áreas no palúdicas o la introducción de personas vulnerables a zonas endémicas. Costa Rica ha sido un país de baja incidencia palúdica (9); junto con Belice, Nicaragua y Panamá, fue en el 2008 uno de los países de América Central con menos de 1.000 casos anuales de paludismo. La proporción de población total del país con riesgo de contraer paludismo era de 34 %. La transmisión del paludismo está altamente focalizada y en 2008, fue causada exclusivamente por la especie P. vivax. Los principales vectores son An. albimanus y An. pseudopunctipennis (2).
En Panamá, la malaria siempre ha representado un serio problema de salud pública, debido a su alto costo social y económico, y se considera la enfermedad reemergente más importante (10,11).
En 2008, se registraron en Panamá 744 casos de paludismo, 740 fueron por P. vivax y cuatro por P. falciparum. La incidencia de paludismo fue de 0,2 por 1.000 habitantes y la tasa de morbilidad de 21,9 por 100.000 habitantes. En cifras recientes, del 2010, se registraron 418 casos, 20 por P. falciparum y 398 de P. vivax. La incidencia fue de 0,1 por 1.000 habitantes y una tasa de morbilidad de 11,9 por 100.000 habitantes (2). El principal vector es An. albimanus, y las especies An. punctimacula y An. pseudopunctipennis se consideran vectores secundarios (12). El paludismo es causado principalmente por P. vivax, que se registra en casi el 90 % de los casos diagnosticados (2). En las regiones indígenas es donde se diagnostica más del 85 % del total de los casos a nivel nacional y en ellas habita solamente el 10 % de la población total del país (10,13). Igualmente, estas zonas endémicas se focalizan cercanas a las regiones interfronterizas de Panamá con Costa Rica y Colombia.
El inicio reciente de la transmisión de la malaria en el cordón fronterizo con Costa Rica en la parte sur del país, en donde esta enfermedad había sido eliminada, se ha convertido en un serio problema de salud pública. A partir del 2004 se inició la reemergencia de la malaria, que alcanzó en el 2008 el mayor número de casos registrado durante los últimos años. En el 2008, los reportes epidemiológicos del Programa de Malaria del Ministerio de Salud, indicaban un aumento importante en el número de casos de malaria distribuidos en 30 localidades, aproximadamente, pertenecientes a los municipios de Barú, Bugaba, Renacimientos y Alanje, todos ubicados en la provincia de Chiriquí y en el cordón fronterizo con Costa Rica. La región de Barú no registraba casos de malaria desde 1987. Estas localidades se caracterizan por el constante movimiento migratorio, relacionados con actividades socioeconómicas, culturales y agrícolas. De octubre a diciembre de 2008, el Instituto Conmemorativo Gorgas condujo un estudio en colaboración con el Programa Nacional de Malaria, considerando la reemergencia de la transmisión del paludismo en la región fronteriza suroccidental del país, región que con anterioridad fue considerada palúdica y donde la malaria había sido eliminada.
En este trabajo se describen por primera vez los aspectos clínicos, ecoepidemiológicos y entomológicos relacionados con la transmisión de malaria por P. vivax. El objetivo de este estudio fue caracterizar la dinámica de la transmisión de la malaria producida por P. vivax en la región fronteriza de Panamá con Costa Rica, con el propósito de lograr, mediante los resultados obtenidos, contribuir con la vigilancia, prevención y control de la malaria en esta región por parte del Programa Nacional de Malaria.
Materiales y métodos Tipo de estudio. El estudio realizado fue observacional, descriptivo y transversal, sobre el brote de malaria registrado en la región fronteriza de Panamá con Costa Rica.
Sitios de estudio. Para este estudio se seleccionaron las localidades de Progreso (8° 26´ 39,88" N y 82° 50´ 07,45" O), Kilómetro 32 (8° 25´ 01,36" N y 82° 50´ 24,15" O), Colorado (8° 26´ 13,70" N y 82° 49´ 02,43" O), Cedro (8° 26´ 13,70" N y 82° 49´ 02,43" O), Quira (8° 26´ 22,22" N y 82° 51´ 07,45" O), Guayabo (8° 24´ 31,70" N y 82° 54´ 22,44" O) y Almendro (8° 25´ 44,91" N y 82° 52´ 31,16" O), todas ubicadas en el municipio de Barú, provincia de Chiriqui y dentro del cordón fronterizo con Costa Rica (figura 1).
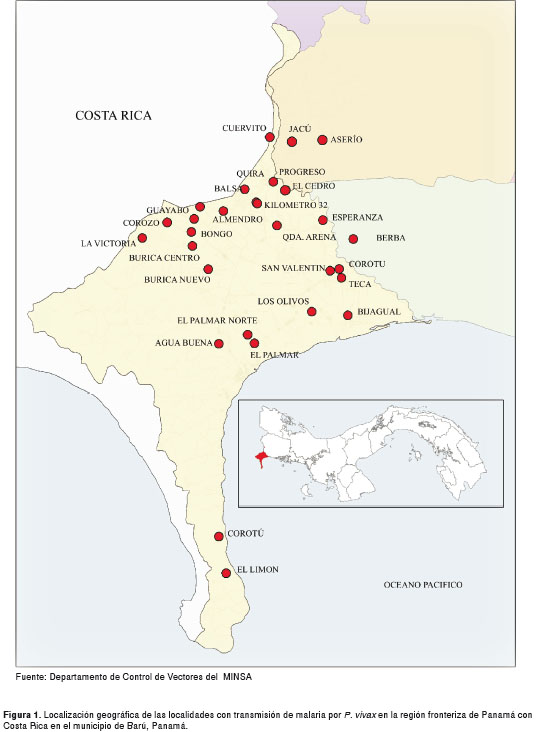
El medio ambiente biológico dentro del área de transmisión, está fuertemente modificado debido a la influencia antropógena que ha transformado el área boscosa en zonas ganaderas y con agricultura extensiva de plantaciones bananeras, palma de aceite, arroz y plátano, lo cual ha generado condiciones propicias para la presencia de criaderos de mosquitos anofelinos vectores de malaria.
Según los datos registrados en relación con las temperaturas, las máximas mensuales se alcanzan entre marzo y abril, con temperatura alrededor de los 32 °C (31,9 °C y 32,1 °C, respectivamente). La temperatura mínima se alcanza en enero y su valor es de 21 °C, aproximadamente. La temperatura promedio mensual oscila entre 26,0 °C y 27,0 °C, con humedad relativa entre 78,0 % y 92,0 %. En cuanto a las lluvias, las precipitaciones mínimas se registran entre enero y marzo, y se incrementan hacia finales de abril. El período de la estación lluviosa alcanza su máxima intensidad en octubre, disminuyendo luego hasta finalizar la estación lluviosa en diciembre. La precipitación anual oscila entre 1.600 y 3.000 mm (14).
Población en estudio. En el estudio retrospectivo
se incluyó el total de los casos de malaria registrados en el 2008 en los municipios Barú, Bugaba, Renacimiento y Alanje, todos ubicados en la provincia de Chiriquí y fronterizos con Costa Rica. Se incluyeron todos los casos sintomáticos con diagnóstico de malaria por gota gruesa, atendidos por el programa de malaria (búsqueda activa) y los servicios de salud (búsqueda pasiva).
Para el desarrollo de este trabajo se logró obtener información básica a través del Programa de Malaria en relación con el área de transmisión: localización geográfica de los casos de malaria, información demográfica, características clínicas de la enfermedad, fecha de primeros reportes, personas afectadas y expuestas, características del grupo de población por intervenir, información socioeconómica y cultural, hábitos sociales, saneamiento básico y características de los servicios de salud cercanos. Se seleccionaron 10 pacientes con diagnóstico de malaria para conocer los signos y síntomas clínicos más frecuentes padecidos durante la enfermedad.
Diagnóstico y tratamiento. El diagnóstico parasitológico se hizo en muestras de gota gruesa y extendido o frotis de sangre periférica y teñida con Giemsa (15). Todas las muestras fueron observadas con microscopio de luz, con aumento de 1.000X. Las características morfológicas de los diferentes estadios de maduración del Plasmodium fueron criterios diferenciales para el diagnóstico de P. vivax por microscopía. Esto confirma un caso de paludismo (16,17). En las muestras positivas se estimó la parasitemia por μl de sangre. Una vez hecho el diagnóstico de infección por P. vivax, se les proporcionó inmediatamente tratamiento completo a base de 1.500 mg de cloroquina y 210 mg de primaquina, según las normas y siguiendo el esquema de tratamiento del Programa Nacional de Malaria en ese momento (18,19).
Indicadores de malaria y entomológicos.
Se determinaron los indicadores de malaria de incidencia parasitaria anual, índice de láminas positivas e índice anual de exámenes de muestras de sangre, como medidas de presentación y vigilancia epidemiológica de la enfermedad (20).
En los meses de octubre a diciembre de 2008, se determinaron los indicadores entomológicos de índice de picadura/hombre/noche, densidad larvaria por m2, caracterización de criaderos preferenciales y la identificación de la especie de mosquito transmisor de la malaria (21).
Recolección de formas inmaduras de anofelinos.
Las recolecciones larvarias se llevaron a cabo de octubre a diciembre en los criaderos naturales cercanos a las viviendas y en un radio circundante de 500 m de las localidades seleccionadas. Los criaderos fueron clasificados en permanentes o temporales. Las larvas se recolectaron con cucharones de 350 ml de capacidad, con un promedio 10 "cucharonadas"/m2 de superficie, según la metodología de la OMS (20).
Recolección de mosquitos adultos. En los meses de octubre a diciembre se hicieron las capturas con atrayente humano en el peridomicilio, entre las 18:00 y 23:00 horas. Para minimizar el riesgo de infección en los técnicos de campo, se siguieron las recomendaciones técnicas de bioseguridad de la OMS (20). Todo el material biológico de larvas y mosquitos adultos recolectados fue colocado en envases especiales previamente codificados, que se transportaron a la Sección de Entomología Médica del Instituto Conmemorativo Gorgas para la identificación de especie mediante claves taxonómicas de mosquitos adultos (22), larvas (23) y la Colección de Referencia del Instituto Conmemorativo Gorgas.
Resultados
La principal actividad económica en el municipio de Barú, consiste en el comercio local, la agricultura (banano, plátano, palma de aceite y arroz) y la ganadería extensiva. La población en general está constituida por mestizos y una proporción menor de indígenas. La red de servicios de salud del municipio de Barú consiste en un hospital, dos centros de salud y cuatro puestos de salud donde se atiende la población. Esta región se caracterizó por ser con anterioridad endémica para paludismo.
De 20.055 habitantes que vivían en las localidades de transmisión de malaria, se obtuvieron y examinaron 10.401 láminas de gota gruesa (52 % de la población) durante el año 2008. Un total de 936 (9,0 %) correspondió a búsqueda pasiva y, 9.465 (91,0 %), a búsqueda activa. En 83 muestras se confirmó microscópicamente el diagnóstico de malaria, correspondiendo en 100 % a P. vivax. La mayoría de los pacientes, 74 (89,2 %), procedía del municipio de Barú, siete de Bugaba (8,4 %), uno de Alanje (1,2 %) y uno de Renacimiento (1,2 %). En la distribución cronológica de los casos, en julio se registró el mayor número casos diagnosticados (15; 18,3 %), seguido por mayo (13; 15,9 %), septiembre y octubre (9; 11,0 %). Los meses de febrero y marzo registraron la menor cantidad de casos de malaria (2 cada uno; 2,4 %).
El 84 % de los pacientes provenía de áreas rurales de la región donde se registró la transmisión. La incidencia parasitaria anual fue de 4,1 por 1.000 habitantes, el índice de láminas positivas, de 0,8 %, y el índice anual de exámenes de muestras de sangre, de 51,9 %.
La incidencia de casos de malaria fue mayor en adultos y con disminución hacia los extremos de las edades registradas. El 85,4 % de los casos eran pacientes menores de 50 años de edad, y la mediana fue de 36 años con un rango de un año a 79 años, y la media fue de 30 años. El 79 % de los casos se presentó en población económicamente activa, entre los 15 y los 50 años. El grupo de edad que registró un mayor número de casos fue el de 11 a 20 años (36,5 %), seguido por el de 0 a 10 años (13,4 %) y el 21 a 30 años (13,4 %).
El 58,5 % de los casos fueron de sexo masculino (cuadro 1).

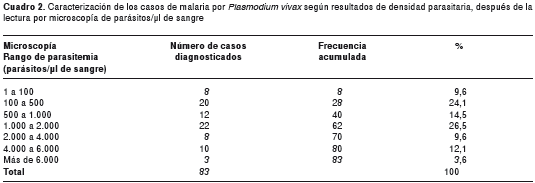
En los casos registrados es importante destacar que solo en tres (3,6 %) se registraron las más altas densidades parasitarias, con más de 6.000 parásitos/μl, 54 (65 %) registraron densidades parasitarias entre 1.000 y 2.000 parásitos/μl de sangre y ocho (9,6 %) registraron las más bajas densidades parasitarias, con 1 a 100 parásitos/ μl de sangre (cuadro 2). Los pacientes fueron exitosamente tratados mediante tratamiento con 1.500 mg de cloroquina más 210 mg de primaquina durante siete días. En los pacientes estudiados, el tiempo promedio transcurrido entre el inicio de los síntomas y la toma de muestra de gota gruesa, fue de ocho días y el del diagnóstico parasitológico fue de uno a tres días. El 100 % de los pacientes presentó solo una vez malaria durante todo el año. En los 10 pacientes encuestados, los signos y síntomas clínicos con mayor frecuencia manifestados fueron: fiebre y escalofrío (100 %), cefalea y vómitos (80 %), pérdida del apetito (70 %), y fiebre y cefalea (60 %).
Todos los casos presentaron fiebre como el signo más significativo.
En las recolecciones de larvas de Anopheles spp.
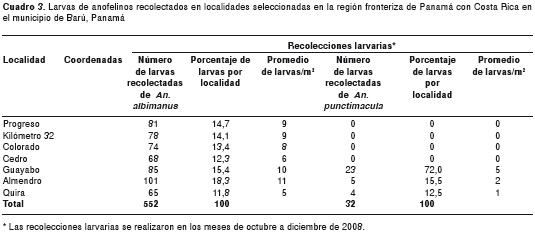
realizadas en los meses de octubre a diciembre, se caracterizaron cuatro tipos de criaderos naturales preferenciales, clasificados en permanentes y temporales, siendo ellos los arrozales, lagunas, canales y cunetas. Los criaderos o hábitats se caracterizaron, en general, por presentar vegetación emergente, flotante, circundante, semisombreado o no sombreado. Se recolectaron 1.241 larvas, entre las cuales se identificó la especie en 584; el resto no se pudo identificar debido a que eran menores al IV estadio. La especie más abundante y frecuente en las siete localidades fue An. Albimanus, con 552 (93,4 %), encontrándose en 142 (84,5 %) de las 168 recolecciones o muestreos realizados. Se identificaron 32 larvas (6,6 %) de An. punctimacula. La localidad que registró la mayor cantidad de recolección de larvas de An. albimanus por criadero, fue Almendro, con 11 larvas/m2, y el poblado de Cedro registró la menor cantidad de larvas recolectadas, con 6 larvas/m2 (cuadro 3).
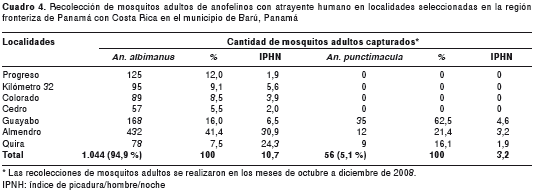
Se recolectaron, mediante atrayente humano, 1.100 mosquitos anofelinos hembras adultos en las siete localidades. La especie más frecuente y abundante fue An. albimanus, con 1.044 (94,9 %) especímenes, seguida por An. punctimacula, con 56 (5,1 %). La localidad donde se registró el mayor porcentaje de mosquitos capturados fue Almendro, con 432 (41,4 %) An. albimanus y 12 (21,4 %) An. punctimacula.
De An. punctimacula se registró la menor cantidad de especímenes adultos capturados. Las localidades de Almendro, Guayabo y Quira fueron las únicas en que se registraron recolecciones de mosquitos adultos An. punctimacula. Las localidades de Almendro, Guayabo y Quira fueron las únicas en que se registraron recolecciones de mosquitos adultos An. punctimacula. La localidad en que se registró el mayor índice de picada por An. albimanus fue Almendro (30,9 I/P/H/N), seguido por Quira (24,3 I/P/H/N) y Guayabo (6,5 I/P/H/N) (cuadro 4). Se presentaron variaciones del índice de picadura/hombre/noche en las especies An. albimanus y An. punctimacula en las localidades bajo estudio, destacándose el registro de una mayor frecuencia y densidad de picada por An. albimanus en las localidades seleccionadas, en comparación con An. punctimacula. Este indicador de densidad anofelina alcanza su mayor pico en el horario de 18:30 a 19:30 horas, para luego declinar el índice de picada.
Discusión
La malaria sigue representando un reto para los profesionales de la salud pública, dada la gran carga de morbilidad y mortalidad que ella implica en los países donde es endémica (24); por lo tanto, en los países donde esta enfermedad se hace presente, se deben intensificar la vigilancia y la investigación.
Panamá es un país con regiones endémicas con una considerable morbilidad por paludismo, fundamentalmente debido a P. vivax. El inicio de la reemergencia de la malaria en el municipio de Barú, en 1987, con el registro de un brote de malaria con distribución en 30 localidades en el 2008, planteó una problemática a los programas sanitarios para el control de esta enfermedad en esta región del país. Todos los casos de malaria registrados durante el brote fueron por P. vivax, principal agente causal de la malaria en Panamá.
En esta región del país, se puede asumir que la malaria se transmitió en forma de brotes o focos con variaciones que están muy asociadas al movimiento de población, el clima, la ecología, los patrones socioculturales, las actividades agrícolas y las económicas. En cuanto al movimiento de población, es importante indicar que esta región comparte una frontera con Costa Rica, lo que genera un movimiento constante de población debido a las actividades económicas, comerciales y migratorias entre los países. El surgimiento de la malaria en regiones donde la enfermedad había sido eliminada, llega a representar un reto para los programas sanitarios, debido a la complejidad de la vigilancia, la prevención y el control de esta enfermedad. Para lograr confrontar la malaria, es necesario obtener información básica sobre el vector, el parásito y la población bajo riesgo, como también sobre los factores de riesgos asociados con la transmisión de esta enfermedad.
La región donde se registró el brote de malaria se caracteriza por presentar movimiento constante de población, áreas extensas de cultivos, y condiciones climáticas que propician lluvias periódicas y constantes, factores estos que favorecen la transmisión cuando se registra un brote de esta enfermedad. Para poder contrarrestar su transmisión, es necesario que los servicios de salud cuenten con un buen sistema de vigilancia que pueda captar oportunamente a los casos sospechosos, iniciar el tratamiento y controlar la dispersión del brote. Es importante indicar que, para el control de la malaria, se deben considerar todos los factores de riesgo que puedan estar incriminados con la transmisión, entre ellos, los ecológicos, geográficos, entomológicos, sociales, económicos, demográficos, y los relativos a la estructura y organización de los servicios de salud.
Estos factores constituyen el marco epidemiológico de la malaria y es importante estimarlos en conjunto, con el propósito de desarrollar estrategias y planes adecuados de vigilancia, prevención y control de la enfermedad. Por otra parte, es trascendente mencionar que en las regiones de malaria inestable, como el área bajo estudio, se caracterizan por una endemicidad baja a moderada con variaciones en el nivel de transmisión y una inmunidad colectiva baja en la población, por consiguiente tienen una alta probabilidad de epidemias (25).
La distribución cronológica de casos de malaria, muestra que el mayor número de casos se presentó de mayo a julio y de septiembre a noviembre; el número de casos durante estos meses está muy asociado a la actividad agrícola. A principios de abril se inicia la preparación de la tierra para la siembra de arroz y, en mayo, la estación lluviosa, lo que origina la formación de grandes criaderos de mosquitos y dificulta en cierto modo el control de las fases inmaduras de los anofelinos vectores de la enfermedad. En los meses de agosto a octubre es la época de cosecha, cuando la población se expone al contacto con el vector. El hecho de ser esta zona eminentemente agrícola, y las condiciones ecológicas, ambientales, climatológicas y el deterioro de las viviendas (paredes incompletas, puertas y ventanas desprotegidas), hacen a esta zona muy vulnerable para la transmisión del paludismo. En la transmisión de la malaria inciden, en mayor o menor grado, diferentes factores de riesgo en un tiempo y un espacio determinados.
Unos de estos factores condicionantes más importantes son los elementos del clima, como precipitación lluviosa, temperatura y humedad relativa, que llegan a determinar la incidencia estacional de la malaria (26,27). La región interfronteriza donde se estableció el brote de malaria, se caracteriza por presentar precipitaciones lluviosas periódicas de abril a diciembre, con intensificación de las lluvias en octubre. La asociación de las lluvias con condiciones ecológicas y ambientales observadas en la región del brote que favorecen la presencia de criaderos de anofelinos vectores, puede llegar a tener una incidencia directa en la transmisión de la malaria. En la actualidad, se ha establecido que la variabilidad y el cambio climático influyen en las condiciones de vida, longevidad y dinámica de Anopheles adultos, lo que repercute en la transmisión de la enfermedad (28,29). Igualmente, en forma experimental se ha evidenciado que la temperatura y la humedad son factores que pueden alterar la longevidad del mosquito y la tasa de ovogénesis, y aumentar la dinámica de transmisión de la malaria (30,31).
Las localidades registraron variaciones en la densidad larvaria generadas por el tipo de criaderos, la ecología y los elementos del clima, entre otros factores de importancia. El muestreo larvario registró una densidad larvaria promedio en las siete localidades, de 8 larvas/m2. La especie más abundante y frecuente en los cuatro tipos de criaderos caracterizados, fue An. albimanus. Esta especie se reproduce en una gran diversidad de hábitats acuáticos y la vegetación en sus criaderos es diversa (32,33). Se llegó a observar que An. punctimacula mostró preferencia por aguas poco profundas, criaderos de tipo canales y sombreados por palmas de aceite. Esta característica coincide con trabajos previos, donde el hábitat se caracteriza por estar sombreado, y tener abundante vegetación flotante y emergente que suministra alimento para las larvas (34,35). En trabajos similares, se reporta que la presencia de larvas de anofelinos es controlada por la vegetación acuática dominante y no por las características físicas de los criaderos, como hidrografía y profundidad (36,37). Según nuestras observaciones, la presencia de larvas de An. albimanus y An. punctimacula es controlada por la vegetación acuática asociada a los criaderos. En el caso de An. albimanus, se presentó una mayor diversidad de criaderos, que iban desde pequeñas charcas a grandes lagunas, todos con diversidad de vegetación circundante, emergente y flotante.
An. punctimacula se encontró esencialmente en criaderos sombreados y con vegetación circundante, localizados en cultivos de palma de aceite.
Este hecho también se resalta en trabajos sobre caracterización de criaderos de anofelinos (38).
En las capturas de mosquitos adultos, predominó An. albimanus sobre An. punctimacula, con densidades fluctuantes de población, lo que indicaría su importancia en la transmisión estacional de la malaria en esta región. En cuanto a la variabilidad de la densidad de la población de anofelinos por localidad, se reportó que el tamaño de la recolección puede variar entre especies según el hábitat (39).
En la captura con cebo humano se demostró, al igual que en otros estudios, que el método es eficaz en la captura de anofelinos vectores (40). Es importante indicar que la abundancia de población de mosquitos, con cierta tendencia, se llega a correlacionar con la precipitación, lo cual constituye una característica primordial de las poblaciones de mosquitos de gran importancia epidemiológica.
Por otra parte, dentro de los programas de control de vectores, la determinación de la abundancia de las poblaciones de mosquitos, la frecuencia del contacto humano-vector y la tasa de paridad, son parámetros entomológicos fundamentales que deben considerarse como factores de riesgo en la transmisión de la malaria.
En términos epidemiológicos, el contacto humanovector es el suceso más importante en la transmisión cuando el mosquito está infectado y puede transmitir la enfermedad (41). Este acercamiento ocurre casi siempre por la noche, cuando los mosquitos acechan a los seres humanos dentro y fuera de las viviendas (42). Este periodo puede ser el momento crítico, y en él las personas pueden estar más expuestas a la picadura y, por ende, a la infección (43). En este estudio se observó una mayor frecuencia en el comportamiento de picada de An. albimanus en comparación con An. punctimacula, en las localidades estudiadas.
Esto podría explicar la focalización observada en la transmisión de la malaria en las localidades donde se registraron los casos de malaria (44).
An. albimanus se considera un vector primario de malaria en las Américas (45). Debido a la importancia de An. albimanus como principal mosquito transmisor de la malaria en nuestro país, es necesario profundizar en el conocimiento de su bionomía y comportamiento, en especial, sobre la ecología de sus criaderos, para detectar factores que permitan utilizar esta información en la planificación de estrategias de control. En las regiones endémicas de las Américas son muy escasos los esfuerzos que se han hecho en este sentido, a pesar de las carencias de conocimientos sobre aspectos fundamentales de los vectores del paludismo (46). Por tal motivo, estos tipos de estudios permiten determinar la relación entre el estatus taxonómico y los factores bioecológicos que regulan la abundancia y distribución espacio/ temporal de las especies de anofelinos vectores asociados con la transmisión de la malaria.
En este estudio se evidenció la gran necesidad de intensificar la investigación sobre la biología y la ecología de los anofelinos vectores, y caracterizar y ubicar sus hábitats larvarios y su posible participación en la transmisión de la malaria, con la finalidad de diseñar, reorientar y aplicar un programa de manejo integrado, en el cual el control larvario puede ser el principal componente, considerando, igualmente, las características ambientales, biológicas del parásito y el vector, así como las características socioculturales de la población (47,48). En regiones con transmisión de malaria como la estudiada, se requiere de mucha información básica sobre la ecología de los vectores, como su distribución espacial y temporal y sus interrelaciones con múltiples factores (bióticos y abióticos) del hábitat, que determinan su presencia y preferencia por determinados tipos de criaderos.
Para calcular la incidencia de la enfermedad en la región, se utilizó como indicador la incidencia parasitaria anual (20). Esta incidencia es una variable básica utilizada para estratificar epidemiológicamente las zonas de paludismo endémico, en donde la estimación de riesgo de contraer malaria está expresada por este indicador.
En esta región, la incidencia parasitaria anual fue de 4,1 por 1,000 habitantes, lo cual indica un moderado riesgo de transmisión de malaria en el área del brote. Las áreas con riesgo de malaria se definen en función del nivel de la exposición al riesgo de transmisión, que es el resultado de la interacción de diversos factores relacionados con desplazamientos humanos, estabilidad social y adopción de actitudes y comportamientos individuales y colectivos que previenen o facilitan el contacto con los vectores (49). El índice de láminas positivas de 0,8 % resulta sumamente alto, si se compara con la estadística nacional del mismo año, que registró un 0,2 %; ambos índices de láminas positivas consideran la búsqueda activa y pasiva de los casos diagnosticados. El índice de láminas positivas indica la cantidad de resultados positivos y la eficiencia de la toma de gota gruesa para el diagnóstico de la enfermedad, y no tiene una relación directa con la incidencia parasitaria anual. Mientras mayor sea el índice de láminas positivas, mayor será la eficiencia de la vigilancia epidemiológica. El índice anual de exámenes de muestras de sangre de un 51,9 %, expresa el buen rendimiento de la búsqueda activa y pasiva de los casos sospechosos de malaria por estrato, foco local o región, lo cual indica el desarrollado por el programa de malaria y los servicios de salud. Es significativo indicar que los indicadores de malaria tienen el propósito de ofrecer las herramientas epidemiológicas requeridas para la generación, el análisis y la utilización de la información sobre la cuantificación y distribución de la malaria y sus factores de riesgo, que hacen posible una adecuada selección de las estrategias de intervención y una asignación más racional de los recursos existentes para la vigilancia y el control de la malaria (19).
En la distribución de los casos de malaria por sexo, se observa que el masculino registró una moderada predominancia (58,5 %) en comparación con el femenino (41,5 %). Este mayor porcentaje de casos de malaria puede obedecer a la conducta o comportamiento del sexo masculino de migrar de sus trabajos durante las primeras horas de la noche y a los hábitos de recreación nocturna, que favorecen la transmisión de la malaria. En estudios de este mismo tipo se indica que la diferencia en la proporción de la enfermedad en hombres, usualmente se asocia con factores de tipo ocupacional y biológico (50). La distribución por edad mostró una significativa disminución de los casos de malaria en los grupos de edades extremas (menores de 5 y mayores de 55 años).
La incidencia de la enfermedad en el grupo de edad menor de 10 años (n=7, 13,4 %), sugiere que la magnitud de la transmisión intradomiciliar y peridomiciliar fue causa de su aumento. La población infantil se considera la más propensa a padecer episodios graves o complicados de malaria.
En el brote registrado se observo en la población infantil una baja incidencia de la enfermedad y no se reportaron casos con complicaciones graves. En las localidades bajo estudio, en menores de un año no se registró ningún caso, población considerada como vulnerable y con mayor posibilidad de complicaciones graves de salud (16).
La determinación de los niveles de parasitemia es importante, debido a que se relaciona con la gravedad de la malaria y sirve para evaluar la respuesta terapéutica del paciente según la intensidad de la parasitemia. Es importante indicar que en regiones endémicas, a diferencia de otras de baja endemia, los pacientes llegan a adquirir cierto grado de inmunidad y tienden a presentar bajos niveles de parasitemia, en comparación con sujetos no inmunes, tales como viajeros o inmigrantes. Dicha situación podría tener como consecuencia una disminución de la sensibilidad del diagnóstico en este grupo de pacientes. Previendo una disminución en la sensibilidad del diagnóstico, es preciso valorar la necesidad de aumentar la sensibilidad de la gota gruesa y el extendido, en pacientes sospechosos en el área endémica (51).
Como la región bajo estudio con anterioridad fue una zona endémica, puede haberse registrado una baja parasitemia en aquellos pacientes que habían tenido episodios de malaria anteriormente, al adquirir cierto grado de inmunidad, en tanto que, en la población joven que presentaba por primera vez malaria, la parasitemia pudo ser elevada.
Por otra parte, en zonas con brotes o epidemias, como lo observada en esta región, la incorporación de pruebas rápidas puede utilizarse como medida de contingencia, para complementar el diagnóstico microscópico y fortalecer la atención del paciente, considerando que entre el inicio de los síntomas de malaria, la toma de muestra, el diagnóstico y el inicio del tratamiento, transcurrieron en promedio 11 días. La incorporación de las pruebas rápidas contribuiría en gran medida a evitar la aparición de nuevos casos de malaria. Además, en general, el diagnóstico rápido permite proporcionar un tratamiento oportuno, evitando así el incremento de la transmisión. Mediante las encuestas, se detectó que las manifestaciones más frecuentes fueron la fiebre y los escalofríos, asociados con la parasitemia. Los signos y síntomas habituales de la malaria son escalofríos, fiebre, sudoración, cefalea, náuseas y, con menor frecuencia, dolor abdominal, vómitos y diarrea. Las manifestaciones clínicas de la malaria en zonas de alta transmisión, son más frecuentes en jóvenes y niños, mientras que las infecciones asintomáticas son más comunes en adultos (52,53). La fiebre es el síntoma más sensible para el diagnóstico probable de la malaria, después de excluir otras causas de fiebre (54). Es probable que este mismo comportamiento en la población vulnerable ante la malaria, se registre en regiones con baja transmisión de la enfermedad.
Contrariamente, se ha observado que en regiones de alta transmisión la población llega a desarrollar cierto grado de inmunidad a los parásitos y a las manifestaciones clínicas de la enfermedad.
Los pacientes adultos y jóvenes positivos para P. vivax recibieron un tratamiento radical antipalúdico convencional, con esquema de 214 mg de cloroquina diarios durante siete días para eliminar las formas eritrociticas y 30 mg diarios de primaquina durante siete días (17), para controlar las formas latentes hepáticas (hipnozoítos) y evitar recaídas. Mediante los resultados observados, se pudo comprobar que el esquema de tratamiento de siete días fue efectivo para la cura radical de la malaria. Durante el periodo del estudio no se registraron recaídas en ninguno de los casos. El tratamiento quimioprofiláctico tiene como objetivo la curación clínica, o sea, la eliminación de los signos y síntomas clínicos, y la prevención de recaídas, o la curación radical, es decir, la curación clínica con la eliminación de los parásitos (55,56).
La cobertura del tratamiento con cloroquina y primaquina fue de 100 % y el porcentaje de cumplimiento del esquema de tratamiento fue de 100 %. Es importante indicar que el diagnóstico oportuno de los casos de malaria es esencial para el tratamiento temprano de los pacientes, y permite la conducción de una vigilancia epidemiológica adecuada y la aplicación pertinente de medidas de control. Según datos del programa de malaria, no se registraron recaídas de malaria. Considerando el tiempo de inicio de síntomas, toma de gota gruesa y diagnóstico de la misma, que suma 11 días, se puede asumir que posiblemente este es uno de los factores que influyó en el incremento de los casos de malaria en la región. El diagnóstico temprano y el tratamiento oportuno de los casos de malaria, son de vital importancia para disminuir el tiempo de la enfermedad, el periodo de molestias e inactividad del paciente, los casos graves y la mortalidad, y contribuyen a interrumpir el ciclo de transmisión de la enfermedad (24).
Finalmente, según los resultados de este estudio, se puede predecir una continuidad de la situación de malaria en esta región, si no se logra llevar a cabo un trabajo antipalúdico de control integrado y multidisciplinario, en conjunto con las autoridades de salud de Costa Rica, debido a la migración de la población de ambos sectores fronterizos, las condiciones topográficas idóneas del lugar para la formación de criaderos, la presencia de más de una especie de mosquito vector de la malaria, el saneamiento ambiental deficiente, las viviendas desprotegidas, y factores como los climáticos, ecológicos, ambientales, migratorios, económicos y socioculturales, que han favorecido el aparecimiento repetitivo de este problema en estas localidades durante los últimos cinco años, haciendo énfasis en que esta región fue con anterioridad históricamente endémica. Por último, se hace necesario que se hagan nuevos estudios y por un tiempo mayor, para determinar la magnitud y la frecuencia del muestreo requerido para estimar con exactitud la variabilidad espacial y estacional de las poblaciones de mosquitos anofelinos vectores de la malaria en esta región del país.
Al Departamento de Control de Vectores del Ministerio de Salud; a Patricio Camarena, coordinador de Control de Vectores de la Región de Salud de Chiriquí; a Félix Acosta y Tomás Hernández, de las Unidades de Control de Vectores del Sector de Puerto Armuelles y Progreso, respectivamente.
No hay conflicto de intereses.
Esta investigación fue financiada mediante fondos económicos del Instituto Conmemorativo Gorgas de Estudio de la Salud y el Ministerio de Salud de Panamá.
Correspondencia: Lorenzo Cáceres, Instituto Conmemorativo Gorgas de Estudios de la Salud, Apartado postal 0816-02593, Panamá, República de Panamá Teléfono: (507) 527 4963; fax: (507) 527 4889 lcaceres@gorgas.gob.pa, cacereslorenzo@gmail.com
1. WHO/UNICEF. World Malaria Report 2005. Geneva: World Health Organization; 2005. p. 293. [ Links ]
2. World Health Organization. Global Malaria Programme. World Malaria Report 2011. Geneva: World Health Organization; 2005. p. 248. [ Links ]
3. Epstein PR. Is global warming harmful to health? Sci Am. 2000;283:50-7. [ Links ]
4. Martens WJ. Health impacts of climate change and ozone depletion: An ecoepidemiologic modeling approach. Environ Health Perspect. 1998;106(Suppl.1):241-51. [ Links ]
5. Organización Panamericana de la Salud, Organización Mundial de la Salud. Informe de la situación de los programas de malaria en las Américas. 26ª Conferencia Sanitaria Panamericana. 54ª Sesión del Comité Regional. Washington, D.C. 23-27 de septiembre de 2002. Fecha de consulta: 28 de noviembre de 2011. Disponible en: http://www.paho.org/spanish/gov/csp/csp26-inf3-s.pdf. [ Links ]
6. Rodríguez C, Rivera M, Rebaza H. Factores de riesgo para malaria por Plasmodium vivax en una población rural de Trujillo, Perú. Rev Peru Med Exp Salud Pública. 2007;24:35-9. [ Links ]
7. Ramal C, Vásquez M. Intervención de control de un brote de malaria en Nuevo Pevas, Loreto. Rev Perú Epidemiol. 2008;12:1-7. [ Links ]
8. Raghavendra K, Barik TK, Sharma P, Bhatt RM, Srivastava HC, Sreehari U, et al. Chlorfenapyr: A new insecticide with novel mode of action can control pyrethroid resistant malaria vectors. Malar J. 2011;10:1475-80. http://dx.doi.org/10.1186/1475-2875-10-16 [ Links ]
9. Ávila-Agüero M. Epidemiología de la malaria en Costa Rica. Acta Med Costarric. 2008;50:1-6. [ Links ]
10. Samudio F, Santamaría AM, Obaldia N III, Pascale JM, Bayard V, Calzada JE. Prevalence of Plasmodium falciparum mutations associated with antimalarial drug resistance in Kuna Yala, Panama. Am J Trop Med Hyg. 2005;71:839-41. [ Links ]
11. Ministerio de Salud de Panamá. Situación de la salud en Panamá. Documento marco. Panamá: Ministerio de Salud de Panamá; 2005. p. 309-10. [ Links ]
12. Loaiza JR, Bermingham E, Scott ME, Rovira JR, Conn JE. Species composition and distribution of adult Anopheles (Diptera: Culicidae) in Panama. J Med Entomol. 2008;45:841-51. [ Links ]
13. Cáceres L, Rovira J, García A, Torres R. Determinación de la resistencia a insecticidas organofosforados, carbamatos y piretroides en Anopheles albimanus (Díptera: Culicidae) de Panamá. Biomédica. 2011;31:419-27. [ Links ]
14. Empresa de Transmisión Eléctrica S. A. Departamento de Hidrometeorología. Estadística panameña. Situación física. Panamá: ETESA; 2008. p. 35. [ Links ]
15. López FJ, Schmunis G. Diagnóstico de malaria. Publicación científica No. 512. Washington, D.C.: Organización Panamericana de la Salud; 1988. p. 196. [ Links ]
16. Schellenberg JR, Smith T, Alonso PL, Hayes RJ. What is clinical malaria? Finding case definitions for field research in highly endemic areas. Parasitol Today. 1994;10:439-42. http://dx.doi.org/10.1016/0169-4758(94)90179-1 [ Links ]
17. Peters DH, Gray RH. When is fever malaria? Lancet. 1992;339:690. [ Links ]
18. World Health Organization. Practical chemotherapy of malaria. Geneva: World Health Organization; 1990. p. 805. [ Links ]
19. Ministerio de Salud de Panamá. Manual de normas y procedimientos para la malaria. Panamá: Ministerio de Salud de Panamá; 2008. p.120. [ Links ]
20. Castillo CS. Principios epidemiológicos para el control de la malaria. Módulo No. 2. Cuantificación de la malaria como problema de salud. Washington D.C.: Organización Panamericana de la Salud; 1991. [ Links ]
21. Organización Mundial de la Salud. Técnicas entomológicas de campo para la lucha antipalúdica. Parte II. Geneva: Organización Mundial de la Salud; 1993. p. 19-21. [ Links ]
22. Wilkerson RC, Strickman D, Fernández-Salas I, Ibañez- Bern SI, Litwak TR. Clave ilustrada de anofelinos hembras de México y Centroamérica. México: Secretaría de Salud; 1993. p. 46. [ Links ]
23. Stojanovich CJ, Gorham JR, Scott HG. Clave ilustrada para los mosquitos anofelinos de América Central y Panamá. Atlanta: Department of Health, Education and Welfare; 1966. p. 37. [ Links ]
24. Pan American Health Organization. Assessment of therapeutic efficacy of antimalarial drugs for uncomplicated falciparum malaria in the Americas. Manaus: OPS; 1998. [ Links ]
25. Onori E, Grab B. Indicators for their forecasting of malaria epidemics. Bull World Health Organ. 1980;58:91-8. [ Links ]
26. McMichael AJ, Haines A, Slooff R, Kovats S. Climate change and human health. Geneva: World Health Organization; 1996. p. 297. [ Links ]
27. World Health Organization. Information. Climate and Health. Fact Sheet No 266. Geneva: WHO; 2001. [ Links ]
28. Rogers D, Packer M. Vector-borne diseases, models, and global change. Lancet. 1993;342:1282-4. http://dx.doi.org/10.1016/0140-6736(93)92367-3 [ Links ]
29. De Carvalho SC, Martins Junior AJ, Lima JB, Valle D. Temperature influence on embryonic development of Anopheles albitarsis and Anopheles aquasalis. Mem Inst Oswaldo Cruz. 2002;97:1117-20. http://dx.doi.org/10.1590/ S0074-02762002000800009 [ Links ]
30. Rúa G, Quiñones ML, Vélez ID, Zuluaga JS, Rojas W, Poveda G, et al. Laboratory estimation of the effects of increasing temperatures on the duration of gonotrophic cycle of Anopheles albimanus (Diptera: Culicidae). Mem Inst Oswaldo Cruz. 2005;100:515-20. http://dx.doi.org/10.1590/S0074-02762005000500011 [ Links ]
31. Afrane YA, Zhou G, Lawson BW, Githeko AK, Yan G. Effects of microclimatic changes caused by deforestation the survivorship and reproductive fitness of Anopheles gambiae in western Kenya highlands. Am J Trop Med Hyg. 2006;74:772-8. [ Links ]
32. Mekuria Y, Tidwell MA, Williams DC, Mandeville JD. Bionomic studies of the Anopheles mosquitoes from Dajabon, Dominican Republic. J Am Mosq Control Assoc. 19900000; 6: 651-7. [ Links ]
33. Frederikson EC. Bionomics and control of Anopheles albimanus. Technical Paper No. 34. Washington, D. C.: Panamerican Health Organization; 1993. p.76. [ Links ]
34. Merritt RW, Dadd RH, Walker ED. Feeding behavior, natural food, and nutritional relationships of larval mosquitoes. Ann Rev Entomol. 1992;37:349-76. http://dx.doi.org/10.1146/annurev.en.37.010192.002025 [ Links ]
35. Rejmánková E, Roberts DR, Harbach RE, Pecor J, Peyton EL, Manguin S, et al. Environmental and regional determinants of Anopheles (Diptera: Culicidae) larval distribution in Belize, Central America. Environ Entomol. 1998;22:978-92. [ Links ]
36. Rubio-Palis Y, Menare C, Quinto A, Magris M, Amarista M. Caracterización de criaderos de anofelinos (Diptera: Culicidae) vectores de malaria del Alto Orinoco, Amazonas, Venezuela. Entomotropica. 2005;20:29-38. [ Links ]
37. Rejmánková E, Pope KO, Roberts DR, Lege MG, Andre R, Greico J, et al. Characterization and detection of Anopheles vestitipennis and Anopheles punctimacula (Diptera: Culicidae) larval habitats in Belize with field survey and SPOT satellite imagery. J Vector Ecol. 1993;23:74-88. [ Links ]
38. Reisen WK, Lopthrop HD. Effects of sampling design on the estimation of adult mosquito abundance. J Am Mosq Control Assoc. 1999;5:105-14. [ Links ]
39. Rubio-Palis Y. Evaluation of light traps combined with carbon dioxide and 1-octen-3-ol to collect anophelines in Venezuela. J Am Mosq Control Assoc. 1996;12:91-6. [ Links ]
40. Chanon KE, Méndez-Galván JF, Galindo-Jaramillo JM, Olguín-Bernal H, Borja-Aburto VH. Cooperative actions to achieve malaria control without the use of DDT. Int J Hyg Environ Health. 2003;206:387-94. [ Links ]
41. Díaz-López C. Efecto de la zooprofilaxis activa sobre la abundancia intradomiciliar y la estructura de edad de Anopheles albimanus (Wiedemann 1820) vector del agente causal del paludismo en el sur de Chiapas, México (Tesis). Villahermosa, Tabasco: Universidad Juárez Autónoma de Tabasco, 2003. [ Links ]
42. Adugna N, Petros B. Determination of the human blood index of some anopheline mosquitoes by using Elisa. Ethiop Med J. 1996;34:1-10. [ Links ]
43. Rodríguez MH, Loyola EG, Betanzos AF, Villarreal C, Bown DN. Control focal del paludismo. Tratamiento focal usando quimioprofilaxis y rociado intradomiciliar con insecticida para el control del paludismo en el sur de México. Gac Med Mex. 1994;130:313-9. [ Links ]
44. González R. Efecto del criadero sobre la duración del ciclo de vida y productividad de Anopheles albimanus Wiedemann (Díptera: Culicidae). Boletín del Museo de Entomología de la Universidad del Valle. 2005;6:1-6. [ Links ]
45. Moreno J, Rubio-Palis Y, Acevedo P. Identificación de criaderos de Anopheles en un área endémica del estado Bolívar, Venezuela. Entomotropica. 2002;17:157-65. [ Links ]
46. Magris M, Rubio-Palis Y, Villegas L, Ruíz B, Frías D, Lines J, et al. Malaria epidemiological and entomological situation in the upper Orinoco River, Venezuela, prior to intervention with insecticide treated nets. Am J Trop Med Hyg. 1999;61:464. http://dx.doi.org/10.1590/S0074-02762007005000049 [ Links ]
47. Berti J, Gutiérrez A, Zimmerman RH. Relaciones entre tipos de hábitat, algunas variables químicas y la presencia de larvas de Anopheles aquasalis Curry y Anopheles pseudopunctipennis Theobald en un área costera del Estado Sucre, Venezuela. Entomotropica. 2004;19:79-84. [ Links ]
48. Organización Mundial de la Salud. Comité de expertos de la OMS en paludismo. Ginebra: Organización Mundial de la Salud; 2000. [ Links ]
49. Spencer H. Epidemiology of malaria. En: Strickland GT, editor. The clinics in tropical medicine and communicable disease malaria. Philadelphia: W. B. Saunders Co.; 1986. p.1-28. [ Links ]
50. Bellina C, Castillo C. Resistencia del Plasmodium falciparum en el distrito de Querecotillo-Sullana. An Fac Med. 1999;60:129-32. [ Links ]
51. World Health Organization. Malaria diagnosis: Memorandum from a WHO meeting. Bull World Health Organ. 1988;66:575-94. [ Links ]
52. Artavanis-Tsakonas K, Tongren JE, Riley EM. The war between the malaria parasite and the immune system: Immunity, immunoregulation and immunopathology. Clin Exp Immunol. 2003;133:145-52. http://dx.doi.org/10.1046/ j.1365-2249.2003.02174.x [ Links ]
53. World Health Organization. Management of severe malaria. A practical handbook. Second edition. Geneva: WHO; 2000. p. 69. [ Links ]
54. Olliaro PL, Trigg PI. Status of antimalarial drugs under development. Bull World Health Organ. 1995;73:565-71. [ Links ]
55. Nafo F. Rolling back malaria: Opportunities and challenges. Trans R Soc Trop Med Hyg. 2005;99:403-6. http://dx.doi.org/10.1016/j.trstmh.2005.02.002 [ Links ]
56. Hetzel MW, Iteba N, Makemba A, Mshana C, Lengeler C, Obrist B, et al. Understanding and improving access to prompt and effective malaria treatment and care in rural Tanzania: the ACCESS Programme. Malar J. 2007;6:83. http://dx.doi.org/10.1186/1475-2875-6-83 [ Links ]













