Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Biomédica
versión impresa ISSN 0120-4157versión On-line ISSN 2590-7379
Biomédica v.32 supl.1 Bogotá mar. 2012
ARTÍCULO ORIGINAL
Grupo Malaria, Universidad de Antioquia, Medellín, Colombia
Recibido: 31/05/11; aceptado:24/11/11
Introducción. El pronto reconocimiento de los signos de peligro en los pacientes con malaria puede reducir las complicaciones y muertes. Sin embargo, se conoce poco sobre su valor pronóstico para la malaria complicada, especialmente en las zonas de transmisión baja e inestable de la enfermedad.
Objetivo. Estimar el valor pronóstico de gravedad que tienen diversos signos clínicos y parasitológicos en los pacientes con malaria.
Materiales y métodos. Se hizo un estudio en una cohorte prospectiva con pacientes de cinco municipios de Colombia, con diagnóstico de malaria por Plasmodium falciparum y P. vivax, en quienes se estudió la asociación de los signos clínicos y los parasitológicos con la malaria complicada.
Resultados. Se obtuvo un modelo de predicción con una sensibilidad de 47,4 % y especificidad de 92,8 %, valor pronóstico positivo de 63,2 % y valor pronóstico negativo de 87,1 %, el cual incluye ictericia, orina oscura, hiperpirexia y signos de deshidratación.
Conclusiones. Con el fin de causar un impacto en la morbilidad complicada de la malaria, se propone una estrategia de reconocimiento de los signos de peligro por el personal no médico, que se acompañe de otros elementos de la atención, como el suministro de un tratamiento antipalúdico adecuado y oportuno. Se proponen los criterios del diagnóstico de complicación moderada.
Palabras clave: malaria, signos y síntomas, Plasmodium falciparum, Plasmodium vivax.
Prognostic value of clinical and parasitological signs for severe malaria in patients from Colombia
Introduction. Early recognition of danger signs in patients with malaria can reduce complications and deaths, but little is known about their prognostic value for severe malaria, especially in areas of low transmission and unstable malaria.
Objective. To assess the prognostic value for severity of different clinical and parasitological signs in patients with malaria.
Materials and methods. A prospective cohort of patients from five municipalities in Colombia with diagnosis of Plasmodium falciparum or P. vivax malaria in whom the association between clinical and parasitological signs with complicated malaria was studied.
Results. A predictive model with 47.4% sensitivity, 92.8% specificity, 63.2% positive predictive value and 87.1% negative predictive value was obtained which includes jaundice, dark urine, hyperpyrexia and signs of dehydration.
Conclusions. To impact the morbidity of complicated proposed a strategy is proposed for the early recognition of danger signs by non-medical personnel, which could be complemented by other elements of health care, such as providing adequate and appropriate antimalarial treatment. Diagnostic criteria for moderate complication are also proposed.
Key words: Malaria, signs and symptoms, Plasmodium falciparum, Plasmodium vivax.
Han transcurrido más de 100 años desde que se identificó el microorganismo causante de la malaria, o paludismo, y su forma de transmisión; sin embargo, esta enfermedad sigue siendo el principal problema de salud pública en las zonas tropicales. En 2009 pudo haber causado hasta 968.000 muertes en el mundo (1) y se ha calculado que 85 % de estas muertes ocurren en niños menores de cinco años, pero los registros sólo informan una de cada cinco (2).
La malaria complicada se atribuye a las infecciones por Plasmodium falciparum (3), aunque también puede ser causada por P. vivax (4-8) y, recientemente, se han informado complicaciones y muertes por P. knowlesi (9). El paciente puede evolucionar en un corto tiempo a un estado grave con alto riesgo de muerte; en el transcurso de la enfermedad pueden manifestarse signos clínicos o parasitológicos que se han relacionado con mayor riesgo de complicación clínica, conocidos como signos de peligro. La descripción de los signos de peligro más informados en la malaria se presentó en una publicación previa (10), pero no es bien conocida la utilidad de estos signos en el pronóstico de gravedad.
La mortalidad producida por la malaria se explica en parte por la demora en su búsqueda como causa de la enfermedad y la deficiente calidad de la atención ofrecida; por ello, se requiere mejorar su diagnóstico, el reconocimiento de las complicaciones y la asistencia sanitaria (11).
En Colombia, como en muchos otros países endémicos, el diagnóstico y el tratamiento de esta enfermedad son realizados por personal sanitario de nivel técnico o auxiliar de salud no profesionales; puede afirmarse que son pocos los pacientes con diagnóstico de malaria que acceden a la consulta médica. Una vía para causar un impacto en la morbilidad grave y la mortalidad ocasionada por la malaria, sería sumar al diagnóstico temprano y al tratamiento oportuno, el reconocimiento precoz de las complicaciones clínicas, lo que podría lograrse mediante la aplicación de un protocolo para el reconocimiento de los signos de peligro en los servicios de diagnóstico y atención del paciente con malaria.
Con el propósito de conocer el valor en el pronóstico de gravedad que tienen los diferentes hallazgos en los pacientes con paludismo, se llevó a cabo este estudio prospectivo en la Región Pacífica y el Urabá antioqueño, zonas de alto riesgo para malaria en Colombia. El estudio se centró en la detección de los signos clínicos fácilmente reconocibles y de los signos parasitológicos detectables en el examen de la gota gruesa, para luego entrenar al personal de diagnóstico en su reconocimiento, puesto que se ha observado que el personal sanitario no médico tiene dificultades en reconocer los signos que se asocian con cuadros clínicos complicados (11,12), y porque se ha observado que su reconocimiento temprano conduce a la instauración de tratamiento (13) y atención hospitalaria temprana, que conlleva la reducción de la mortalidad (14,15).
En síntesis, se requiere establecer la utilidad de los signos informados en el pronóstico del paciente con malaria y cuáles son los más simples para que sean aplicados por personal sanitario no médico e, incluso, para ser usados en los hogares.
Materiales y métodos
Diseño del estudio
Se llevó a cabo un estudio de cohorte prospectiva en los municipios colombianos de Tumaco (1° 48’ N, 78° 45’ O), Timbiquí (2° 03’ N, 76° 56’ O) y Guapi (2º 34’ N, 75º 25’ O) en la Costa Pacífica, y en Turbo (8° 05’ N y 76° 44’ O) y Necoclí (8° 25’ N; 76° 45’ O) en la Costa Atlántica, región de Urabá.
El universo lo conformaron los pacientes de cualquier edad y sexo que acudieron a los puestos de diagnóstico de malaria y a los hospitales locales, a quienes se les hizo diagnóstico de malaria durante el período de febrero de 2007 a febrero de 2009 (figura 1).
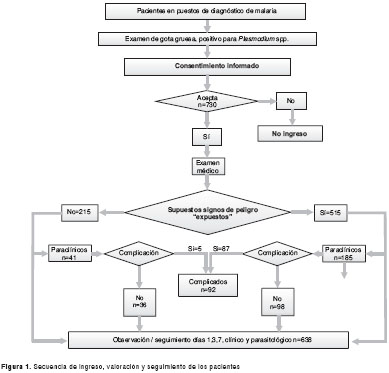
Los criterios de inclusión fueron: 1) tener diagnóstico de malaria por cualquier especie de Plasmodium, confirmado por gota gruesa o extendido de sangre periférica y, 2) dar el consentimiento informado de participación. Se excluyeron los pacientes con diagnóstico de enfermedad infecciosa o enfermedad crónica grave concomitante y aquellos que no eran residentes del municipio del estudio.
Se calculó una muestra de 684 pacientes (114 expuestos, 570 no expuestos) con base en los siguientes criterios: 1) nivel de confianza (1-α), 95 %; 2) poder (1-b), 80 %; 3) relación entre expuestos (con supuestos signos de peligro) y no expuestos (sin signos de peligro), 1:5; 4) frecuencia esperada del evento en no expuestos (malaria complicada: al menos, un criterio de complicación), 0,5%, y 5) frecuencia esperada del evento en expuestos, 5 %.
Diagnóstico de malaria y valoración clínica
Se confirmó el diagnóstico y el recuento de parásitos mediante examen de gota gruesa según las recomendaciones de la Organización Mundial de la Salud (OMS) (16); se hizo una segunda lectura en forma ciega, por un microbiólogo, y las lecturas discordantes fueron repetidas por un tercer evaluador, aceptándose está última como la definitiva.
Los pacientes fueron evaluados al ingreso y durante el seguimiento por médicos mediante un protocolo clínico estandarizado; se descartó enfermedad asociada según criterio del médico y con los exámenes de laboratorio ordenados a su juicio.
El primer día se inició el tratamiento ambulatorio y los casos de malaria complicada recibieron tratamiento hospitalario, de acuerdo con la guía de atención de la malaria de Colombia (17). En los hospitales de cada municipio se hicieron los exámenes de laboratorio y, en el laboratorio del Grupo Malaria de la Universidad de Antioquia, el control de calidad de la gota gruesa.
Supuestos signos de peligro y diagnóstico de malaria complicada
Los médicos valoraron y registraron la presencia de supuestos signos de peligro (cuadro 1) establecidos a partir de una revisión previa sobre el tema (10); se consideraron como hepatomegalia y esplenomegalia, la palpación o matidez del órgano por debajo del reborde costal.

Luego, para establecer las alteraciones funcionales, se tomaron muestras de sangre para hemograma, pruebas de coagulación y química sanguínea (creatinina, nitrógeno ureico en sangre, bilirrubinas, aminotransferasas, glucemia, bicarbonato) a una submuestra de pacientes en forma aleatoria (n=226); los resultados se clasificaron cualitativamente (cuadro 2).
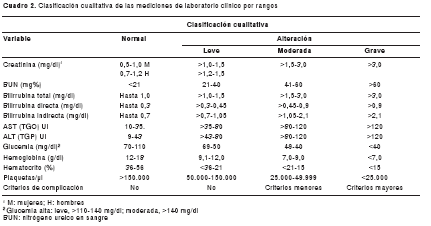
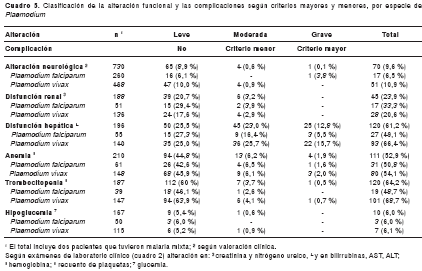
Según los resultados de laboratorio, el estado clínico se clasificó en: sin complicación (alteración ausente o leve), complicación con criterios menores (disfunción moderada) y complicación con criterios mayores (disfunción grave); esta última coincide con los criterios de malaria complicada para complicación renal y hepática, anemia grave, trombocitopenia grave e hipoglucemia grave de la OMS 2000 (18) (cuadro 3). La hiperparasitemia fue definida según el criterio empleado en Colombia (17) y aquí no se consideró entre las complicaciones sino como probable signo de peligro.

Algunas complicaciones se diagnosticaron mediante el examen clínico del paciente; los criterios mayores fueron: malaria cerebral (coma o convulsiones), colapso circulatorio, síndrome de dificultad respiratoria aguda o edema pulmonar (cuadro 3), y el criterio menor fue alteración neurológica moderada (debilidad extrema o postración). Tener, al menos, un criterio de complicación fue suficiente para ser clasificado como malaria complicada. En los demás pacientes, la valoración fue solamente clínica y parasitológica (n=504).
Se tomó una muestra de orina el primer día para análisis mediante tira reactiva y estudio del sedimento por microscopía. Se consideraron como alteraciones (19): 1) la hematuria, cualquier valor de eritrocitos sin hemólisis, o tres o más glóbulos rojos en el sedimento de orina; 2) hemoglobinuria, mayor de 10 eritrocitos sin hemólisis; 3) bilirrubinuria, cualquier cantidad de bilirrubina; 4) proteinuria, proteínas de 30 mg/dl o más; 5) densidad urinaria alta,superior a 1.022; y 6) urobilinógeno superior a 1,7 µmol/L (mayor de 1 mg/dl).
Seguimiento
Los pacientes con supuestos signos de peligro o indicios de gravedad (cuadro 1) fueron observados en los servicios de urgencias. A los de una submuestra aleatoria se les ordenaron exámenes de laboratorio (figura 1); los que presentaban criterios de gravedad se hospitalizaron y evaluaron diariamente hasta su curación clínica y parasitológica. Los demás pacientes recibieron tratamiento ambulatorio y se citaron para control clínico y parasitológico al día siguiente, al día 3 al completar tratamiento y al día 7. Se dieron instrucciones de regresar antes a la consulta si el cuadro clínico empeoraba. En todos los pacientes se procuró hacer evaluaciones de control los días 1, 3 y 7.
Análisis estadístico
Se practicó la prueba de normalidad (Kolmogorov-Smirnof) a las variables cuantitativas; aquellas con distribución normal se compararon mediante la prueba t de Student y, las demás, con la prueba U de Mann Whitney.
La asociación entre variables categóricas se estudió con las pruebas c2 y Kruskal-Wallis, y se estimaron los riesgos relativos. Se calculó el índice kappa para comparar las variables categóricas evaluadas en diferentes momentos o por diferentes evaluadores, y regresión lineal, para estudiar variables fisiológicas.
El análisis bivariado para buscar asociaciones entre signos y complicaciones, se hizo en dos niveles: 1) para los pacientes en los cuales la presencia o ausencia de complicación se estableció con los exámenes de laboratorio clínico más la valoración médica, y 2) para el total de pacientes, es decir, los anteriores y los pacientes que sólo tuvieron valoración clínica.
Se hizo un análisis discriminador para identificar los signos útiles, con el fin de elaborar un modelo pronóstico con las variables que en el análisis bivariado tuvieron un valor de p menor de 0,2, mediante regresión logística binaria con método hacia adelante, paso a paso, con probabilidad de entrada al modelo de 0,05 y salida de 0,1 y un punto de corte para clasificación de 0,5.
Se utilizó el programa SPSS®, versión 17,0. En todos los análisis se consideró como significativo estadísticamente un valor de p menor de 0,05.
Aspectos éticos
Se respetaron las normas éticas internacionales para investigación biomédica con sujetos humanos establecidas por la OMS y las normas del Ministerio de Protección Social de Colombia (Resolución 8430 de 1993). Se obtuvo el aval del Comité de Ética de la Facultad de Medicina de la Universidad de Antioquia.
Resultados
Se estudiaron 730 pacientes; se hicieron 3.121 revisiones médicas con, al menos, dos citas de control en 84,0 % de los pacientes y, tres, en 47,3 % (promedio, 3,3, mediana, 2,0); el 82,7 % fue evaluado, al menos, hasta el día 7, día en que presentaron cura clínica y parasitológica, excepto cuatro pacientes con persistencia de síntomas de enfermedad no grave que fueron evaluados un tiempo mayor. El 26 % (189) acudió a controles durante un tiempo superior a 7 días; el promedio de días de seguimiento fue de 12 días (mediana, 7,0).
Características generales de los pacientes
El 72,7 % era mayor de 15 años y hombres, el 62,3 %. La raza más representada fue la mestiza (66,3 %), seguida por la negra (29,8 %), la blanca (2,2 %) y la indígena (1,3 %). Entre 565 pacientes que informaron el número de episodios de malaria durante toda la vida, 400 (70,8 %) informaron al menos un episodio, 257 (64,3 %) durante el último año (cuadro 4).

Características parasitológicas y clínicas
El diagnóstico por especie se presenta en el cuadro 4. La concordancia entre el diagnóstico inicial y el control de calidad en 682 láminas presentó un índice kappa de 0,916. La mediana de la parasitemia fue 4.880 parásitos/µl y el 75 % de pacientes presentaron parasitemia menor de 9.980 parásitos/µl. El recuento fue significativamente mayor en las infecciones por P. vivax (mediana, 5.280) que en aquellas por P. falciparum (mediana, 3.560) (U Mann-Whitney, p=0,048). En 114 pacientes se determinó que el porcentaje de eritrocitos parasitados tuvo una mediana de 0,10 %, en infecciones por P. falciparum, 0,06 % (media, 0,15 %) y, en P. vivax, 0,11 % (media, 0,20 %) (U Mann-Whitney, p=0,053).
El curso natural de la enfermedad se caracterizó por fiebre diaria, cefalea, escalofríos, dolor osteomuscular, astenia, náuseas y dolor abdominal; hallazgos poco frecuentes fueron diarrea, tos y dificultad para respirar, síntomas que no difieren por especie de plasmodio.
Los signos más frecuentes al ingreso fueron los siguientes:
Ictericia. En 33 % de los casos se presentó ictericia, al menos, en un sitio anatómico (escleróticas, conjuntivas, mucosas o piel) y, durante el seguimiento, en 229 de 675 (33,9 %).
Palidez. En palmas, conjuntivas o lecho ungular se observó algún grado de palidez el primer día en 37 % de los pacientes y, durante el seguimiento, en 33%.
Signos respiratorios. Se presentaron en el 30 %, incluyendo tos (25,6 %) taquipnea sin fiebre (7,2 %), “crépitos” (1,2 %), roncus (0,4 %) y sibilancias (0,8%).
Orina oscura. De 372 muestras de orina estudiadas, 21 % presentó color anormal (amarillo oscuro, naranja o rojo).
Sangrado espontáneo. Se presentó en 8,1% de 724 pacientes, y las petequias fueron la forma más frecuente.
Signos abdominales. Se presentaron como dolor abdominal a la palpación (29,5 %), hepatomegalia (23,5 %) y esplenomegalia (8,2 %); la hepatomegalia y la esplenomegalia fueron de tres centímetros por debajo del reborde costal, en 5,2 y 3,8 % de los casos, respectivamente.
Con menor frecuencia, se observaron signos neurológicos con predominio de delirio e hiporreflexia, hiperpirexia y signos de deshidratación, entre los cuales el hallazgo más frecuente fue sequedad de las mucosas.
Algunos signos y su relación con complicaciones específicas
Se diagnosticaron complicaciones en 92 pacientes, 31 con criterios mayores, 61 con criterios menores, y 5 con ambos criterios. Ningún paciente presentó complicación respiratoria (cuadro 5).
Ictericia. Con base en el valor sérico de bilirrubinas y transaminasas, se estudió la disfunción hepática. De 195 pacientes con estos exámenes, 66 de 95 (69,5 %) presentó algún grado de disfunción hepática con ictericia y 53 de 100 (53,0%) sin ictericia (c2, p=0,018; RR=1,5; 1,1-2,2). El riesgo de disfunción hepática fue mayor en los pacientes con ictericia en cualquier momento que cuando no hubo ictericia (c2, p=0,002; RR=2,1; 1,3-3,5).
Se dispuso de pruebas de nitrógeno ureico en sangre (BUN), creatinina o ambas, en 188 pacientes; el 27,3 % de los ictéricos y el 20,2 % de los no ictéricos presentaron alteración en, al menos, una de ambas pruebas, sin que ello representase diferencia significativa (c2, p=0,255; RR=1,4; 0,8-2,3), como tampoco para la comparación en ambos grupos de la creatinina (c2, p=0,158; RR=1,5; 0,8-2,8) ni el nitrógeno ureico en sangre (c2, p=0,075; RR=1,7; 0,9-3,2).
Palidez. En 109 pacientes con palidez, la media de la concentración de hemoglobina fue de 11,2 frente a 12,5 en 101 pacientes sin palidez (prueba t, p=0,000). La media de la hemoglobina de quienes presentaron palidez, tanto al inicio como durante el seguimiento (n=69), fue de 10,8 g/dL, la cual difiere significativamente de 12,6 en quienes no la presentaron en ningún momento (n=84) (prueba t; p=0,000). La palidez acentuada se asoció con anemia (palmas: RR=1,9; 1,4-2,6; p=0,025; conjuntivas: RR=2,0; 1,5-2,9; p=0,014; lecho ungular: RR=2,1; 1,8-2,5; p=0,004), pero no se halló una mayor probabilidad de presentar anemia grave en estos pacientes (c2, p=0,22).
Orina oscura. Se encontró bilirrubina (coluria) en 41 de 293 (14 %) muestras color ámbar y en 44 de 78 (56,4 %) de color oscuro (RR=4,4; 3,0-6,3; p=0,000); el urobilinógeno se encontró, respectivamente, en 43 de 294 (14,6 %) y en 35 de 77 (44,9 %) (RR=3,1; 2,2-4,5; p=0,000). El riesgo de presentar sangre fue mayor en la orina oscura (RR=2,15; 1,57-2,95; p=0,000); fue igual para la presencia de eritrocitos lisados (RR=2,15; 1,38-3,35; p=0,001) y mayor para la presencia de eritrocitos intactos (RR=3,22; 1,81-5,72; p=0,000). No hubo diferencias respecto al nitrógeno ureico en sangre y la creatinina en relación con el color de la orina. La orina oscura se asoció con riesgo mayor de disfunción hepática (RR=2,01; 1,36-2,96), siendo mayor para disfunción grave (RR=3,32; 1,64-6,73; p=0,000) que moderada (RR=1,95; 1,11-1,93; p=0,027). No se encontró asociación entre orina oscura y anemia grave o trombocitopenia.
Signos de sangrado. No se asociaron con la especie parasitaria (c2, p=0,209), disfunción hepática moderada o grave (c2, p=0,365) o trombocitopenia moderada o grave (c2, p=0,113).
Hiperpirexia. Se asoció con signos neurológicos (RR=3,7; 2,3-6,0; p=0,000) y signos de deshidratación (RR=2,5; 1,2-5,7; p=0,048, Fisher). No se relacionó con la parasitemia; específicamente en los casos de P. falciparum, no se halló esta asociación (RR: 3,8; 0,6-24,7; p=0,25).
Deshidratación, vómito persistente y diarrea persistente. Se observaron signos de deshidratación en 28 pacientes (4 %). La manifestación más frecuente fueron las mucosas secas (n=19, 67,9 %) y los ojos hundidos (n=7, 25 %); el llenado capilar lento se observó en cuatro pacientes, uno de ellos con malaria cerebral. Los signos de deshidratación se asociaron con diarrea al ingreso (RR=2,9; 1,5-5,8; p=0,000), vómito (RR=2,1; 1,4-3,0; p=0,000) y vómito persistente (RR=6,5; 3,1-13,5; p=0,000).
Signos abdominales. No se encontró asociación entre hepatomegalia y disfunción hepática grave (c2, p=0,609) o moderada (c2, p=0,239), pero, cuando se empleó el criterio de tres centímetros por debajo del reborde costal, sí la hubo con disfunción hepática grave (RR=2,7; 1,1-6,3, p=0,039) o disfunción moderada o grave (RR=1,8; 1,1-2,9; p=0,038). El dolor abdominal a la palpación se relacionó con disfunción hepática moderada (RR=1,7; 1,0-2,7, p=0,048).
Hiperparasitemia. Se exploró inicialmente la relación entre parasitemia y otras variables cuantitativas. El análisis de regresión lineal muestra que la hemoglobina estuvo poco afectada por la parasitemia (R=0,136; R2=0,019; estadístico F, p=0,055). Hubo asociación con el recuento de plaquetas (R=0,181; R2=0,033; p=0,017, b= -1,162) y con temperatura axilar (R=0,155; R2=0,024; p=0,000, b= 1,155). No se encontró asociación con el nivel sérico de bilirrubina total, creatinina, nitrógeno ureico en sangre o glucemia, ni con el recuento de leucocitos (p>0,05). Se presentó hiperparasitemia en 11 pacientes, 6 con P. falciparum y 5 con P. vivax; de estos, presentaron disfunción hepática moderada tres (dos con infección por P. falciparum y uno por P. vivax) y anemia moderada uno con P. vivax.
Signos de peligro para cualquier complicación
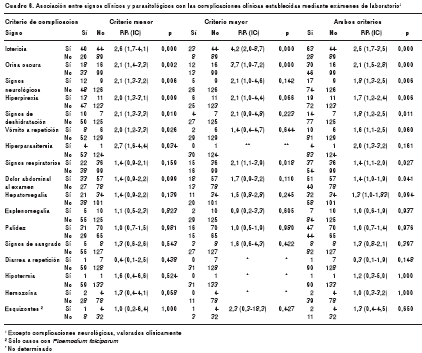
En los pacientes con exámenes de laboratorio clínico. Se exploraron las relaciones entre cada signo y tener cualquier complicación. Se asociaron ictericia, orina oscura, signos respiratorios, signos de deshidratación, signos neurológicos, hiperpirexia y dolor abdominal, con tener complicación, moderada o grave. Las asociaciones con cada grupo de complicaciones aparecen en el cuadro 5.
Para el total de pacientes. Cuando se analizó la relación entre los signos clínicos y los parasitológicos con cualquier tipo de complicación, para toda la muestra (establecida mediante exámenes de laboratorio o signos clínicos), los que mostraron asociación fueron: signos de deshidratación (OR=4,5; 2,9-6,8), ictericia (OR=4,4; 2,9-6,6), orina oscura (2,5; 1,7-3,6), hiperpirexia (2,6; 1,7-3,4), palidez (1,9; 1,3-2,8), vómito a repetición (2,5; 1,4-4,4), signos neurológicos (2,3; 1,5-3,6), dolor abdominal al examen (1,9; 1,3-2,8), hepatomegalia (1,9; 1,3-2,7), hiperparasitemia (3,0; 1,3-6,7) y signos respiratorios (1,6; 1,1-2,3).
Análisis de regresión logística
Criterios mayores de complicación. Se obtuvo un modelo de predicción de complicaciones mayores cuando éstas se diagnostican con base en los exámenes de laboratorio, modelo que sólo incluye la ictericia (beta=2,4) y la orina oscura (beta=1,5), con sensibilidad de 40,0 % y especificidad de 93,9 % (VPP=58,8 %; VPN=87,8 %; constante=0,5).
Criterios menores de complicación. Las variables que integran una ecuación para la complicación moderada en el grupo con diagnóstico por laboratorio, fueron: ictericia (beta=1,3), orina oscura (beta=1,1) e hiperpirexia (beta=0,98) (constante=1,5); conforman un modelo con 35,3 % de sensibilidad y 91,2 % de especificidad (VPP=64,3 %; VPN=75,9 %; constante=0,5).
Criterios mayores y menores. Con ambos tipos de criterios de gravedad, para el total de pacientes, se obtiene un modelo de predicción con sensibilidad de 47,4 % y especificidad de 92,8 % (VPP=63,2 %; VPN=87,1 %), el cual incluye ictericia (beta=7,9), orina oscura (beta=2,4), hiperpirexia (beta=3,4) y signos de deshidratación (beta=4,8) (constante=0,065). La inclusión de los signos respiratorios y esplenomegalia le permite al modelo una sensibilidad de 41,7 % y una especificidad de 99,0 %; (VPP=88,2 %; %; VPN=90,8 %). Excluyendo la esplenomegalia, entre los pacientes con complicación mayor, el 96,8 % presentó alguno de estos signos; la frecuencia de complicación entre los expuestos fue de 20,0 % y, en los no expuestos, de 2,3 % (RR=10,6; p=0,000).
En el grupo con exámenes de laboratorio, los signos asociados con paludismo complicado (cuadro 6) se presentaron en 95,7 % de pacientes con cualquier complicación, de manera que en los 515 expuestos, el 17,1 % se complicó, frente al 1,9 % en los no expuestos (RR=10,9, p=0,000).
Discusión
El 82,7 % de los pacientes fueron seguidos, al menos, siete días, tiempo que se consideró como suficiente para observar la evolución clínica, ya que un período de tres días es suficiente para garantizar una respuesta tanto clínica como parasitológica y descartar una falla terapéutica temprana (20). Los antipalúdicos suministrados han mostrado excelente eficacia terapéutica en el país, cloroquina para P. vivax (cloroquina) (21) y artesunato-mefloquina o amodiaquina-sulfadoxinapirimetamina paraP. falciparum (22), observándose mejoría clínica y cura parasitológica el día 3 después de iniciado el tratamiento, con ausencia de cuadros clínicos complicados, lo que coincide con este estudio.
En el paludismo, por el corto ciclo de vida del plasmodio y por los efectos patogénicos que pueden acumularse en cada replicación, las complicaciones puede producirse en cuestión de horas; por ejemplo, se ha observado en pacientes con infección por P. falciparum, que el tiempo entre la aparición de la fiebre y el desarrollo de complicación era corto, con aparición de disfunción hepática en 1,3 días, hematológica en 1,4 días, renal en 1,6 días y neurológica en 2,3 días, con un mayor intervalo, de 3,3 días, para disfunción respiratoria (23).
Las complicaciones en este estudio se diagnosticaron el primer día de estudio; debido a que todos los pacientes recibieron tratamiento antipalúdico eficaz el día del ingreso al estudio, era improbable observar casos complicados durante el seguimiento.
El suministro de un tratamiento antipalúdico eficaz el día del diagnóstico inicial, como se hizo en este estudio, es una conducta ineludible desde la perspectiva ética, aunque se convierta en una desventaja metodológica para observar el desenlace que se quiere pronosticar –la malaria complicada– a menos que la complicación se instaure tempranamente y pueda reconocerse el primer día.
Por ello, con este análisis se pretendió identificar signos asociados con complicación, independientemente del tiempo. Puede afirmarse que la cohorte fue seguida el tiempo suficiente para observar el curso clínico de la enfermedad, hasta el momento de la curación clínica.
Los pacientes y sus características
Los pacientes pertenecían a zonas ecológicas similares, compartían rasgos como la edad y la distribución por sexo, pero dos variables fundamentales en la epidemiología de la malaria, la raza de los pobladores y la especie de plasmodio, difieren mucho, de manera que en la Región Pacífica predomina la raza negra (84 %) y P. falciparum (83 %) y en Urabá predomina la raza mestiza (88 %) y P. vivax (83 %), lo que configura dos situaciones opuestas. No conocemos, por estudios previos, cuáles pueden ser las implicaciones de estas diferencias en la expresión clínica de la enfermedad.
La parasitemia debe estudiarse por separado en cada especie de plasmodio, dadas sus diferencias en el ciclo de vida que explican el menor número de formas circulantes de P. falciparum, porque las formas maduras permanecen adheridas en los capilares y, por ello, no aparecen generalmente en el examen de sangre periférica. Por lo tanto, el cálculo de la parasitemia en estas infecciones es una subestimación de la parasitemia total y resulta complejo hacer comparaciones con las parasitemias producidas por P. vivax. Para el total de pacientes, la parasitemia fue superior en las infecciones por P. vivax que en aquellas por P. falciparum, lo que sería razonable en función de lo explicado. Las parasitemias para ambas especies se mantienen entre los rangos considerados para las zonas de baja endemia (por debajo de 10.000 parásitos/µl).
Complicaciones clínicas diagnosticadas y criterios usados
Entre los problemas relacionados con los criterios diagnósticos de malaria complicada se cita la carencia de criterios estándar, tanto para clínicos como investigadores. Los criterios de la OMS han sido criticados por su gran sensibilidad que los hace útiles para los clínicos (detectan pacientes extremadamente graves), pero menos útiles para propósitos de investigación (no reconocen niveles menores de gravedad) (24).
Otros autores consideran que estos criterios son especialmente útiles para estandarizar pacientes que ingresan a ensayos clínicos y que reflejan más criterios de entrada que el resultado de la enfermedad, pero aceptan que muchas de las medidas de gravedad de los criterios de la OMS no son evidentes al ingreso hospitalario, sino que se desarrollan insidiosamente o inesperadamente durante el curso de la enfermedad (25).
Además, debido a la variabilidad que puede presentarse en la expresión de la enfermedad, se ha recomendado que estos criterios de la OMS sean adaptados a las condiciones epidemiológicas particulares (26). Por lo anterior, estos criterios deben ajustarse en la práctica clínica .
La OMS publicó en 2000 los criterios para el diagnóstico de malaria complicada (18). Una propuesta previa de la OMS separaba los criterios de “otras manifestaciones” de malaria complicada, como deterioro de la consciencia, debilidad extrema, hiperparasitemia, ictericia e hiperpirexia (27); aquellos han sido entendidos como criterios mayores de gravedad y éstas, como criterios menores (28). La importancia de esta clasificación más antigua reside en la capacidad de reconocer, entre los pacientes complicados, aquellos con mayor riesgo de muerte que requieren ser atendidos en una unidad de cuidados intensivos y aquellos que requieren atención médica pero probablemente no un cuidado intensivo.
Según esto, en este estudio se establecieron dos tipos de complicación, la complicación grave o la presencia de criterios mayores de disfunción (criterios OMS 2000), y la complicación moderada o con criterios menores de disfunción con base en criterios de la práctica clínica. La demostración de una alta frecuencia de disfunción moderada en distintos órganos hallada en este estudio, nos permite proponer criterios de valoración de la malaria complicada que se basan en el reconocimiento tanto de disfunción moderada como grave (cuadro 7).

Signos asociados con complicación en el análisis bivariado
El análisis se centró en la presencia de los supuestos signos de peligro al momento de la consulta, o en las 24 horas previas a ella (episodios de vómito y diarrea).
Los signos de sangrado fueron poco frecuentes y no se asociaron con disfunción hepática o trombocitopenia, que serían las causas más frecuentes de sangrado por alteración de la producción de factores procoagulantes o de la hemostasia plaquetaria.
La ictericia es un signo que necesita estudiarse detenidamente; muchas veces atribuido a la hemólisis, está más relacionado con la disfunción hepática, pero, además, puede ser un indicador de compromiso renal (29). Este signo estuvo presente en 33 % de los pacientes al ingreso y fue un indicador de aumento significativo de la bilirrubina directa e indirecta y de las aminotransferasas (ASt y ALT).
La ictericia se ha informado hasta en 45 % de los casos de malaria (30); se acompaña tanto de alteración hepática leve como de falla hepática, y afecta hasta 20 % de los pacientes con malaria grave por P. falciparum (31). Se considera un indicador directo de disfunción hepática porque la hemólisis, generalmente, no produce ictericia intensa (32,33). En malaria por P. vivax, otros estudios han encontrado este signo con menor frecuencia (hasta 9 %), aunque también asociado con gravedad (33,34).
No se encontró asociación entre disfunción renal e ictericia, a diferencia de otro estudio realizado en estas mismas regiones que sí mostró asociación con disfunción renal moderada (29); esta diferencia puede deberse a que en el estudio anterior el número de pacientes con disfunción renal fue superior y a que los pacientes de este estudio mostraron en su mayoría disfunción renal leve que no se consideró como complicación; es decir que en este estudio la afección renal pudo haber sido reconocida en su fase más temprana.
La orina oscura se asoció con mayor cantidad de urobilinógeno, bilirrubina total y directa, y aminotransferasas (AST y ALT); asimismo, se encontró una mayor probabilidad de ictericia en los pacientes con orina oscura. La bilirrubina y el urobilinógeno en orina, acompañados de alteración en las transaminasas séricas, indican tanto que hay un proceso hemolítico como disfunción hepática que puede involucrar la captación, conjugación y excreción de la bilirrubina (35).
Además, hubo asociación entre orina oscura y la presencia de eritrocitos lisados y aumento de la bilirrubina sérica indirecta, que son indicio de hemólisis, pero no se halló relación entre los eritrocitos lisados y anemia, lo que sugiere que la hemólisis en estos pacientes es poca y que su contribución a la anemia no es muy importante. Ello puede explicarse por las bajas parasitemias que contribuirían poco con la hemólisis. La orina oscura es, por tanto, un signo útil como indicador de disfunción hepática y, en menor grado, de hemólisis en los pacientes con malaria.
Los signos respiratorios fueron frecuentes en los pacientes con algún criterio de gravedad (40,2 %); se presentaron más casos de taquipnea en presencia de fiebre que en su ausencia, mostrando asociación significativa entre ambos signos. Ello hace necesario evaluar este signo en ausencia de la fiebre, para obtener una valoración confiable.
La hiperpirexia se ha considerado una característica de malaria complicada asociada con niveles elevados de factor de necrosis tumoral, interferón gamma, IL-6 e IL-10 (36), y se ha propuesto que la carga parasitaria se relaciona con este signo (37). En el presente estudio no se encontró esta asociación, aunque la mediana de la temperatura axilar fue significativamente superior (U de Mann-Whitney, p=0,020) en los pacientes con hiperparasitemia (38,5 ºC) que sin ésta (37,0 ºC). Esta diferencia en los resultados se explica porque sólo dos pacientes de 11 con hiperparasitemia, presentaron hiperpirexia. Sin embargo, la temperatura corporal fue superior a la de los pacientes con baja parasitemia. Debe resaltarse que las parasitemias en general fueron muy bajas, lo que podría explicar la poca frecuencia de fiebre muy elevada.
La frecuencia de signos de deshidratación entre los pacientes que tenían vómito o diarrea el día de ingreso al estudio fue baja, mientras que la fiebre se asoció con signos de deshidratación. El vómito, la diarrea y la fiebre son condiciones que contribuyen a la deshidratación, pero en su génesis deben participar otros factores, como la disminución de la ingestión de líquidos, porque una gran proporción de pacientes con vómito, diarrea o fiebre no presentaron signos de deshidratación.
La palidez ha sido reconocida ampliamente como signo de peligro en los niños, pero pocos trabajos se han dirigido a los adultos y, entre estos, a los que padecen malaria. Encontramos que la palidez se asociaba con menores valores de hemoglobina; por lo tanto, resulta ser una prueba diagnóstica útil, porque es fácil de aplicar y porque puede combinarse en serie con el hemograma, prueba de fácil acceso en muchos sitios.
Se conocen diferentes valores de recuento de parásitos a partir de los cuales se considera la hiperparasitemia. En infecciones por P. falciparum, la OMS propone un recuento superior a 100.000 o 250.000 parásitos/µl de sangre (2 % o 5 % de eritrocitos parasitados) según la endemia de malaria (3); incluso, para propósitos de investigación se considera como más de 10 % de los eritrocitos parasitados (25). En Colombia, se emplea como criterio un recuento superior a 50.000 formas asexuadas de P. falciparum/µl.
La hiperparasitemia se ha considerado en sí misma como una complicación (3); sin embargo, algunos investigadores consideran que no hay una noción fija y precisa de lo que es hiperparasitemia, basados en que la densidad de parásitos y la gravedad de la enfermedad varía en función de los grupos de edad y zonas de transmisión. Por ello, en ausencia de signos de peligro o criterios de malaria complicada, en estos pacientes se ha diagnosticado malaria no complicada y se han incluido en estudios de eficacia terapéutica (38,39).
Un método más apropiado parece ser la estimación de la biomasa parasitaria, la cual se ha asociado con la gravedad de la enfermedad, al contrario que la parasitemia periférica (40). No se utiliza en la práctica un criterio de hiperparasitemia en las infecciones por P. vivax, posiblemente porque la enfermedad producida por esta especie se ha considerado más benigna.
Se encontraron 11 pacientes con hiperparasitemia, 6 con P. falciparum y 5 con P. vivax; sólo se practicaron exámenes de laboratorio en cinco de ellos, de los cuales, tres presentaron disfunción hepática moderada (dos con infección por P. falciparum y uno por P. vivax) y anemia moderada, uno con malaria por P. vivax.
Con el fin de explorar los efectos de la carga parasitaria, se analizó su relación con diferentes variables cuantitativas, y se encontró una correlación negativa con el recuento plaquetario y una correlación positiva con la temperatura axilar. Sin embargo, los coeficientes son bajos, lo que indica que el efecto sobre estas dos variables no varía mucho en función de la carga parasitaria en estos pacientes.
No se encontró asociación con bilirrubina total, creatinina, nitrógeno ureico en sangre, glicemia o recuento leucocitario. El bajo número de casos con hiperparasitemia y la falta de asociación con alteración en las variables estudiadas, pueden explicar por qué la parasitemia sólo se asoció con complicaciones moderadas.
Se ha encontrado una relación directa entre la hiperparasitemia por P. falciparum (más de 2 % de eritrocitos parasitados) y paludismo grave (25) y mortalidad infantil (más de 10 % de eritrocitos parasitados) (41); por el contrario, se ha encontrado que más de 5 % de eritrocitos parasitados por esta misma especie no se asoció con mayor riesgo de muerte (28). Entre nuestros pacientes con P. falciparum, la hiperparasitemia se asoció con disfunción moderada, aunque el intervalo de confianza es muy amplio, debido al poco número de pacientes, mientras que los que presentaron hiperparasitemia por P. vivax no se asociaron con complicación.
El resultado de los pacientes con P. falciparum coincide con otros estudios, mientras que no tenemos un referente para comparar los pacientes con P. vivax. Puede concluirse que las parasitemias en estos pacientes son muy bajas en comparación con sujetos infectados de otras regiones, lo que impide encontrar un número importante de casos que pudiese mostrar asociación con malaria grave. No es necesaria una parasitemia alta para que se produzca lesión importante en diferentes órganos y, por otro lado, su presencia relacionada con complicación moderada indica que siempre todo paciente con este hallazgo debe considerarse como un paciente en riesgo de enfermedad grave.
Variables con mayor valor pronóstico
El mejor modelo de regresión obtenido para toda la muestra de pacientes, y que integra algunos de los signos con fuerte asociación en el análisis bivariado de los pacientes con exámenes de laboratorio, permite identificar casi el 50 % de los pacientes en riesgo de desarrollar una complicación moderada o una complicación mayor y reconocer casi el total (especificidad 99 %) de los que no tienen instaurada una complicación. El valor pronóstico positivo es moderado (88 %,) lo que implicaría remitir a los centros médicos pocos pacientes que no se agravarían; el valor pronóstico negativo es muy alto (91 %), lo que está a favor de que la mayoría de pacientes no remitidos probablemente no van a complicarse.
La inclusión de los signos respiratorios disminuye la sensibilidad del modelo; sin embargo, estos signos son de extrema utilidad en la valoración de los niños porque permiten reconocer, además, infecciones respiratorias asociadas a la malaria (42), las cuales contribuyen notoriamente con la mortalidad infantil.
La inclusión de la esplenomegalia no mejora la sensibilidad y tiene la desventaja de que este signo es más difícil de reconocer por personal no médico.
Desde el punto de vista estadístico, una sensibilidad de 50 % podría tener poca utilidad y, en comparación con cualquier prueba de laboratorio, su aplicación podría no representar ninguna ventaja; sin embargo, las particularidades del ámbito donde se puede aplicar un protocolo para reconocimiento de signos clínicos de peligro, permiten tener una mejor perspectiva sobre su utilidad. La primera es que el paciente con paludismo rara vez es atendido por un médico, y el diagnóstico y el tratamiento son realizados, en la mayoría de casos en todo el mundo, por auxiliares sanitarios y microscopistas, quienes generalmente carecen de formación en los conceptos clínicos básicos necesarios para atender estos pacientes. La segunda es que los signos de peligro propuestos en el modelo son de fácil reconocimiento por personal no médico; se han hecho estudios comunitarios con cuidadores de los niños y personal sanitario no profesional, en los cuales el entrenamiento en reconocimiento de signos clínicos y el uso de cartas para atención de los pacientes con malaria tuvieron resultados exitosos (43,44).
De manera práctica, nos parece más útil en este estudio encontrar el sentido de la asociación más que la magnitud: no interesa tanto si el paciente ictérico tiene mayor riesgo que el que tiene orina oscura: si cualquiera puede complicarse, ambos deben reconocerse oportunamente.
Una estrategia de reconocimiento de los signos de peligro no es útil si no se acompaña de otros elementos de la atención; en el mejor caso de atención, es decir, cuando se puede suministrar un tratamiento antipalúdico adecuado y oportuno, cabe esperar que, aun en presencia de signos de peligro, se evitará la evolución a un cuadro más grave o que, al contrario, aun en ausencia de estos signos, la falta de instauración del tratamiento correcto tendrá como desenlace el resultado fatal observado en muchas zonas endémicas.
Este es un primer estudio sobre el tema en zonas de baja endemia. Se estableció que la parasitemia característica, tanto por P. falciparum como por P. vivax, fue menor de 10.000 parásitos/µl con una invasión de eritrocitos promedio inferior a 0,20 %, cifra considerada muy baja, con un cuadro clínico y de gravedad similar; el patrón de complicaciones difiere del de las zonas de alta endemia de malaria y transmisión estable.
Los criterios de paludismo complicado definidos por la OMS han sido aplicados en las guías de atención en todo el mundo, como la directriz para la toma de decisiones clínicas. El problema de aplicar estos criterios de daño extremo es que son útiles sólo para definir la internación en una unidad de cuidado crítico; anteriormente, se incluían niveles intermedios de daño que configuraban complicación moderada, cuya utilidad era que permitían, por un lado, reconocer más tempranamente la instauración del daño y, por otro, ofrecer a los pacientes las medidas de soporte para evitar complicaciones mayores o la muerte.
Dos limitaciones del estudio se relacionan con sesgos potenciales: el ingreso de pacientes en momentos diferentes de la enfermedad, ya que algunos signos podrían presentarse sólo en aquellos que consultaron tardíamente, y la práctica de exámenes de laboratorio por diferentes laboratorios pues, aunque periódicamente se realizan controles de calidad, esto no lo controlaron los investigadores.
Las interacciones entre entorno, poblaciones humanas y parásitos, intervienen de manera poco conocida para producir mayor o menor gravedad; por ello, no se puede afirmar que los hallazgos de este estudio pueden ser aplicados en pacientes de regiones endémicas diferentes, lo que se constituye en una limitación para extrapolar los resultados y hace necesario validarlos en otras condiciones epidemiológicas.
Otra limitación es que las complicaciones se diagnosticaron con exámenes de laboratorio en la tercera parte de los pacientes (n=226) y, aunque con esta muestra se tiene una potencia superior al 90 % (a posteriori) para reconocer asociaciones en el análisis bivariado, el análisis multivariado cuando se analiza este subgrupo muestra un modelo de pronóstico poco útil que únicamente incluye dos signos clínicos con baja sensibilidad.
Una fortaleza del estudio es haber aplicado dos criterios para reconocer las complicaciones clínicas en los pacientes con la enfermedad y proponer criterios para reconocer un nivel intermedio de gravedad; además, la inclusión tanto de pacientes con malaria por P. falciparum como por P. vivax, es un aporte al conocimiento de la enfermedad en zonas consideradas de baja endemia y al reconocimiento de las complicaciones de la malaria por P. vivax, menos estudiada en el mundo.
La perspectiva a corto plazo es implementar una escala de valoración de los signos clínicos para ser validada en las condiciones de campo por microscopistas y proponer un programa de entrenamiento para el personal de diagnóstico de malaria en los países endémicos, en el cual se integren los conocimientos de este estudio y los que se han obtenido en otras regiones de alta endemia palúdica.
En resumen, se identificaron los signos clínicos y parasitológicos que se asociaron con mayor riesgo de un cuadro clínico complicado y, por ello, pueden denominarse “signos de peligro”.
A los pacientes, quienes dieron su consentimiento para participar en la investigación. A Josep Vaqué Rafart, catedrático de la Universidad Autónoma de Barcelona, director de la tesis que dio origen al manuscrito. Al equipo de campo, integrado por Alexandra Ríos O. (bacterióloga), Andrés Felipe Miranda, Carolina Vanegas, Felipe Sanín, Luis Gover Diuza y Luis Henry Quiñones (médicos de campo); y a César Murillo (sistematización de datos).
Los autores declaramos ausencia de conflicto de intereses en la publicación de este manuscrito.
Programa de becas de alto nivel para América Latina ALBAN, de la Asociación del Grupo Santander, para el proyecto de estudios de doctorado de Alberto Tobón Castaño (código E06D101704CO).
Colciencias: proyecto de investigación código 115-333-18854 (Contrato RC-185-2006).
Secretaría de Salud de departamento del Cauca, convenio interadministrativo de cooperación para la investigación 1684-2007.
Grupo Malaria y Estrategia de Sostenibilidad 2009-2011, Universidad de Antioquia.
Correspondencia: Alberto Tobón, Grupo Malaria, Universidad de Antioquia, calle 62 Nº 52-59, laboratorio 610, Medellín, Colombia Telefax: (574) 219 6487 albertobon@saludpublica.udea.edu.co
1. World Health Organization. World Malaria Report 2010. Geneva: World Health Organization; 2010. [ Links ]
2. World Health Organization RBM, UNICEF. World Malaria Report 2008. Geneva: World Health Organization; 2008. [ Links ]
3. World Health Organization. Guidelines for the treatment of malaria. Second ed. Geneva: WHO Press; 2010. [ Links ]
4. Kochar DK, Saxena V, Singh N, Kochar SK, Kumar SV, Das A. Plasmodium vivax malaria. Emerg Infect Dis. 2005;11:132-4. [ Links ]
5. Baird JK. Neglect of Plasmodium vivax malaria. Trends Parasitol. 2007;23:533-9. [ Links ]
6. Genton B, D´Acremont V, Rare L, Baea K, Reeder JC, Alpers MP, et al. Plasmodium vivax and mixed infections are associated with severe malaria in children: A prospective cohort study from Papua New Guinea. PLoS Med. 2008;5:e127. [ Links ]
7. Rogerson SJ, Carter R. Severe vivax malaria: Newly recognized or rediscovered. PLoS Med. 2008;5:e136. [ Links ]
8. Lomar A, Vidal J, Lomar F, Valente C, Janot-de Matos G, Boulos M. Acute respiratory distress syndrome due to vivax malaria: Case report and literature review. Braz J Infect Dis. 2005;9:425-30. [ Links ]
9. Daneshvar C, Davis TM, Cox-Singh J, Rafa´ee MZ, Zakaria SK, Divis PC, et al. Clinical and laboratory features of human Plasmodium knowlesi infection. Clin Infect Dis. 2009;49:852-60. [ Links ]
10. Tobon A. Signos de peligro en el paciente con malaria. Biomédica. 2009;29:320-9. [ Links ]
11. de Savigny D, Mayombana C, Mwageni E, Masanja H, Minhaj A, Mkilindi Y, et al. Care-seeking patterns for fatal malaria in Tanzania. Malar J. 2004;3:27. [ Links ]
12. World Health Organization. Integrated management of childhood illness: Conclusions. WHO Division of Child Health and Development. Bull World Health Organ. 1997;75(Suppl.1):119-28. [ Links ]
13. Kidane G, Morrow RH. Teaching mothers to provide home treatment of malaria in Tigray, Ethiopia: A randomized trial. Lancet. 2000;356:550-5. [ Links ]
14. Molyneux ME, Taylor TE, Wirima JJ, Borgstein A. Clinical features and prognostic indicators in paediatric cerebral malaria: A study of 131 comatose Malawian children. Q J Med. 1989;71:441-59. [ Links ]
15. Waller D, Krishna S, Crawley J, Miller K, Nosten F, Chapman D, et al. Clinical features and outcome of severe malaria in Gambian children. Clin Infect Dis. 1995; 21:577-87. [ Links ]
16. López-Antuñano FJ, Schmunis G. Diagnóstico de malaria. Washington, D.C.: OPS; OMS; 1988. [ Links ]
17. Ministerio de Salud de Colombia. Guía de atención de la malaria. Bogotá: Ministerio de Salud; 2000. [ Links ]
18. World Health Organization. Severe falciparum malaria. Tran R Soc Trop Med Hyg. 2000;94(Suppl.1):S1-90. [ Links ]
19. Campuzano G, Arbeláez M. Uroanálisis: más que un examen de rutina. Med Lab. 2006;12:511-53. [ Links ]
20. World Health Organization. Assessment and monitoring of antimalarial drug efficacy for the treatment of uncomplicated falciparum malaria. Geneva: World Health Organization; 2003. [ Links ]
21. Carmona-Fonseca J, Álvarez G. Plasmodium vivax malaria: Treatment of primary attacks with primaquine, in three different doses, and a fixed dose of chloroquine, Antioquia, Colombia, 2003-2004. Biomédica. 2006; 26: 353-65. [ Links ]
22. Álvarez G, Tobón A, Pineros JG, Ríos A, Blair S. Dynamics of Plasmodium falciparum parasitemia regarding combined treatment regimens for acute uncomplicated malaria, Antioquia, Colombia. Am J Trop Med Hyg. 2010;83:90-6. [ Links ]
23. Krishnan A, Karnad DR. Severe falciparum malaria: An important cause of multiple organ failure in Indian intensive care unit patients. Crit Care Med. 2003;31:2278-84. [ Links ]
24. Anstey NM, Price RN. Improving case definitions for severe malaria. PLoS Med. 2007;4:e267. [ Links ]
25. Phillips A, Bassett P, Zeki S, Newman S, Pasvol G. Risk factors for severe disease in adults with falciparum malaria. Clin Infect Dis. 2009;48:871-8. [ Links ]
26. Luxemburger C, Ricci F, Nosten F, Raimond D, Bathet S, White NJ. The epidemiology of severe malaria in an area of low transmission in Thailand. Tran R Soc Trop Med Hyg. 1997;91:256-62. [ Links ]
27. World Health Organization. Severe and complicated malaria. Tran R Soc Trop Med Hyg. 1990;84(Suppl.2):65. [ Links ]
28. Bruneel F, Hocqueloux L, Alberti C, Wolff M, Chevret S, Bedos JP, et al. The clinical spectrum of severe imported falciparum malaria in the intensive care unit: Report of 188 cases in adults. Am J Respir Crit Care Med. 2003;167:684-9. [ Links ]
29. Tobón A, Cortina A, Miranda F, Blair S. Orina oscura e ictericia como signos de peligro en malaria por P. falciparumen Colombia. Rev Cub Med Trop. 2009;62:28-36. [ Links ]
30. Dondorp AM, Lee SJ, Faiz MA, Mishra S, Price R, Tjitra E, et al. The relationship between age and the manifestations of and mortality associated with severe malaria. Clin Infect Dis. 2008;47:151-7. [ Links ]
31. Devarbhavi H, Alvares JF, Kumar KS. Severe falciparum malaria simulating fulminant hepatic failure. Mayo Clin Proc. 2005;80:355-8. [ Links ]
32. Anand AC, Puri P. Jaundice in malaria. J Gastroenterol Hepatol. 2005;20:1322-32. [ Links ]
33. Bhalla A, Suri V, Singh V. Malarial hepatopathy. J Postgrad Med. 2006;52:315-20. [ Links ]
34. González L, Guzmán M, Carmona J, Lopera T, Blair S. Características clínico-epidemiológicas de 291 pacientes hospitalizados por malaria en Medellín (Colombia). Acta Med Colomb. 2000;25:163-7. [ Links ]
35. Barbagelata C, Otero M, de la Cámara M. Ictericia. Cuad Aten Primaria. 2006;13:186-8. [ Links ]
36. Seoh JY, Khan M, Park SH, Park HK, Shin MH, Ha EH, et al. Serum cytokine profiles in patients with Plasmodium vivax malaria: A comparison between those who presented with and without hyperpyrexia. Am J Trop Med Hyg. 2003;68:102-6. [ Links ]
37. Prybylski D, Khaliq A, Fox E, Sarwari AR, Strickland GT. Parasite density and malaria morbidity in the Pakistani Punjab. Am J Trop Med Hyg. 1999;61:791-801. [ Links ]
38. Ndounga M, Basco LK. Rapid clearance of Plasmodium falciparum hyperparasitaemia after oral amodiaquine treatment in patients with uncomplicated malaria. Acta Trop. 2003;88:27-32. [ Links ]
39. Winstanley PA, Watkins WM, Newton CR, Nevill C, Mberu E, Warn PA, et al. The disposition of oral and intramuscular pyrimethamine/sulphadoxine in Kenyan children with high parasitaemia but clinically non-severe falciparum malaria. Br J Clin Pharmacol. 1992;33:143-8. [ Links ]
40. Dondorp AM, Desakorn V, Pongtavornpinyo W, Sahassananda D, Silamut K, Chotivanich K, et al. Estimation of the total parasite biomass in acute falciparum malaria from plasma PfHRP2. PLoS Med. 2005;2:788-97. [ Links ]
41. Tripathy R, Parida S, Das L, Mishra DP, Tripathy D, Das MC, et al. Clinical manifestations and predictors of severe malaria in Indian children. Pediatrics. 2007;120:e454-60. [ Links ]
42. Kallander K, Nsungwa-Sabiiti J, Peterson S. Symptom overlap for malaria and pneumonia--policy implications for home management strategies. Acta Trop. 2004;90:211-4. [ Links ]
43. Winch PJ, Bagayoko A, Diawara A, Kane M, Thiero F, Gilroy K, et al. Increases in correct administration of chloroquine in the home and referral of sick children to health facilities through a community-based intervention in Bougouni District, Mali. Trans R Soc Trop Med Hyg. 2003;97:481-90. [ Links ]
44. Zurovac D, Rowe AK, Ochola SA, Noor AM, Midia B, English M, et al. Predictors of the quality of health worker treatment practices for uncomplicated malaria at government health facilities in Kenya. Int J Epidemiol. 2004;33:1080-91. [ Links ]














