Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.32 suppl.1 Bogotá Mar. 2012
REVISIÓN DE TEMA
Recibido: 12/07/11; aceptado:17/11/11
Introducción. Las prácticas para eliminar la malaria en el mundo han pasado de los programas de control sanitario, conocidos en Colombia como la “lucha higiénica” en los primeros años del siglo XX, a la erradicación en los años 50 y de vuelta al control en 1978. Hoy, después de 43 años de haber fracasado el Programa Mundial de Erradicación, la Organización Mundial de la Salud propone a los países miembro adoptar como meta un programa de eliminación con miras a la erradicación. ¿Será esto posible en Colombia?
Objetivo. Revisar las posibilidades de eliminación de la malaria en Colombia desde un análisis histórico del saber y de las prácticas que se desarrollaron para lograrlo.
Resultados. Se presentan los obstáculos y las posibilidades para el desarrollo de un programa de eliminación de la malaria en Colombia, donde el modelo etiopatogénico de sufrir una enfermedad infecciosa, basado en la teoría microbiana, sigue vigente y respalda prácticas como la erradicación.
Conclusiones. La eliminación de la malaria es no sólo un problema de saber científico, de vacíos en el conocimientos sobre el objeto mismo, sino una forma de sustentar ese conocimiento en una única teoría, la microbiana o la etiopatogénica, para explicar enfermedades como la malaria, y también, un problema de poder; aun cuando el poder político puede ser una forma de saber, se entiende con esto la mezcla de estrategias y de intereses de las instituciones que dictan las políticas públicas, las agencias internacionales, los que venden insecticidas y medicamentos, y los que fabrican reactivos y nuevos dispositivos para diagnósticos.
Palabras clave: malaria, paludismo, salud pública, saneamiento
Challenges for the elimination of malaria in Colombia: A problem of knowledge or of power
Introduction. Practices to end malaria in the world have evolved from the sanitary control programs, known in Colombia as the fight for hygiene, in the early twentieth century, to the eradication efforst in the 50´s and back to control in 1978. Today, after 43 years of failure of the malaria eradication program, the World Health Organization proposes its members a program to eliminate malaria malaria with eradication in view. Will this be possible in Colombia?
Objective. To review the possibilities of eliminating malaria in Colombia, from a historical analysis of the knowledge and practices developed to reach this aim.
Results. We present the obstacles and opportunities for the development of a malaria elimination program in Colombia, where the etiopathogenic model of infectious diseases, based on the germ theory, still remains valid and supports practices such as eradication.
Conclusion. Eliminating malaria is not just a scientific problem of the gaps in knowledge, but a way of supporting that knowledge with a single theory, the microbial or the etiopathogenic theory, to explain diseases such as malaria; it is also a problem of power. Even though the political power can be a form of knowledge, understanding it as a mixture of strategies and interests of the institutions that dictate the public policies, the international agencies, the companies selling sellers of insecticides and antimalarials and the producers of new reagents and diagnostic tools.
Key words: malaria, public health, sanitation.
En los 130 años de historia de la malaria, o paludismo, como enfermedad parasitaria, se han generado saberes y se han establecido prácticas para combatirla. El primero de estos correspondía a una difusa etiología de la enfermedad que se apoyaba en las teorías miasmáticas entrecruzadas con las teorías microbianas anteriores y posteriores a Pasteur. Fueron proyectos higienistas que contaron con estrategias claras de intervención sobre el ambiente, las viviendas, los sujetos, la moral y los cuerpos, incluso sobre las fiebres (1). Estos proyectos se consolidaron como un programa de control sanitario iniciado en forma desigual en la mayoría de los países del mundo y llevado a cabo hasta finales de los años 30 del siglo XX (2).
El descubrimiento del hematozoario que hiciera Luis Alfonso Laverán en 1880 (3), el hallazgo que hizo el bacteriólogo inglés Ronald Ross (1857-1932), con el descubrimiento en 1887 del ciclo completo del parásito en el mosquito en la malaria de las aves (4), la noción de vector mediada por los anofelinos y su relación con la transmisión de la enfermedad que hiciera Giovani Batista Grassi (1854-1925) en 1898 (5), fueron los pilares del conocimiento de la malaria y trajeron consigo una forma de enfermar de malaria que nunca ha abandonado la biomedicina: el paradigma etiopatogénico y, con él, las prácticas para combatir la enfermedad.
Durante los primeros años del siglo XX se concretó la lucha higiénica, en la que la ingeniería desplazó a la medicina. Se intervinieron los terrenos, la vivienda, los charcos “miasmáticos” y los charcos como criaderos de larvas; se implementó el uso del verde de París y del petróleo, lo mismo que la profilaxis con quinina de las fiebres. Este proyecto higienista se llevó a cabo entre las dos guerras mundiales, 1919 a 1939, expresado siempre en un “agente causal y en un zancudo transmisor”. Estos llegan desde afuera hacia la vivienda y del medio exterior hacia el interior en el humano.
La reflexión tomó en cuenta la similitud con los vientos de guerra, que siempre traen un enemigo exterior que hay que combatir y matar. Así llegaba el zancudo y, con él, los parásitos como enemigos externos que ingresaban, paradójicamente, a medios ambientes sanos, a casas sanas, a individuos sanos, como si nada del tiempo y del espacio, de las realidades sociales y políticas, dejara huella sobre los sujetos y los cuerpos (1,3). En esta limpieza aparecieron las prácticas utilizadas para sanar durante la segunda guerra mundial, cuando se hicieron públicos los secretos de guerra para combatir los zancudos transmisores; llegaron el DDT y la cloroquina para matar los parásitos y, con ellos, la posibilidad de terminar con la malaria en poco tiempo.
Al parecer estos hechos hicieron posible la consolidación de la Gran Campaña Mundial de Erradicación, iniciada en Venezuela en 1945, y en el resto de los países palúdicos del mundo a partir de 1958 (6,7). Así se constituyó el hito más visible en la era de las enfermedades infecciosas, y específicamente las transmitidas por vectores, porque se consolidó, no sólo el saber de la malaria relacionado con el paradigma etiopatogénico de la enfermedad –iniciada con Pasteur y Koch en el siglo XIX–, sino nuevas prácticas para exterminarla que aún están vigentes: al parásito se le combate con medicamentos y con insecticidas se destruye el zancudo, como bien lo señalaron S. Franco en 1990 (8) y M. Hernández en 2002 (9).
Esta concepción belicista está relacionada con la experiencia de las epidemias durante las confrontaciones militares que, con frecuencia, han sido causantes de más bajas que las mismas balas y que se han enfrentado médicamente en un ambiente bélico que deja huellas en la psicología profunda de las colectividades y los grupos profesionales implicados (8,9).
En la década de los años 50 se marcó el tránsito de la higiene a la salud pública (10) ,y en el año de 1957, se establecieron los preparativos para iniciar la Gran Campaña Mundial de Erradicación, cuyos principios y prácticas fueron apoyados por la Organización Mundial de la Salud (OMS). Las agencias internacionales hicieron un gran despliegue para señalar que con esta estrategia se acabaría con la malaria en cinco años, 1958-1963. Algunos de los países lograron la erradicación, pero en el resto de países fue un fracaso (11). En 1968, la OMS dio el parte de no haber erradicado el paludismo de la mayoría de los países del mundo y, en consecuencia, se regresaba al control, con el fin de disminuir la morbimortalidad (12). Esta estrategia de control, o tercer espacio de saber palúdico, fue consolidándose hasta 1978 (13), fecha en que fue reconocida universalmente como la práctica vigente contra la malaria.
En el 2008, la OMS (14) dio pie a un nuevo reto para cumplir los objetivos del milenio, y propuso el nuevo programa de control por niveles, con miras a alcanzar la eliminación de la malaria en el mundo y, a largo plazo, su erradicación. Con ello aparecieron nuevos discursos, nuevos dispositivos, nuevos indicadores y, por supuesto, las esperanzas centradas en que esta vez sí fuera posible el éxito.
Sin embargo, y a pesar de las diferencias en los espacios de saber, de la teoría común para explicar la malaria y de las prácticas utilizadas para terminarla, la historia de la malaria y sus prácticas conservaron regularidades objetivas y operativas: una de ellas es la vivienda, que ha permanecido siempre como objeto de prevención. La vivienda durante la lucha higiénica ha sido objeto de limpieza, de moralidad y buenas costumbres para transformarse, durante la Campaña Mundial de Erradicación, en paredes y ventanas. En ella se valoraba –con porcentajes de protección y desprotección– que la hacían más o menos palúdica, materiales de construcción que atraían o repelían el vector, leyes de aplicación de insecticidas, altura a la cual debía aplicarse el insecticida, frecuencia de aplicación del DDT en sus paredes, insecticidas residuales, cercanía a criaderos y, por último, viviendas con riesgos diferentes. Posteriormente, la vivienda desapareció como objetivo de erradicación, al comenzar la etapa de control en la cual la vivienda pasó a convertirse en unidad de análisis para la distribución de toldillos.
Poco se sabía de los habitantes de esa vivienda: sanos o enfermos de malaria, de su probabilidad de complicaciones y muerte en función de la edad, la inmunidad, el embarazo, la raza y la nutrición; se desconocían también su propensión a enfermar por una determinada especie de Plasmodium,lasespecies de Anopheles que habitaban la vivienda con riesgo diferente, y las que habían sido abandonadas por ellos; se desconocían, a su vez, los aspectos biológicos, culturales y sociales que interactuaban para que la malaria existiera históricamente en ellas.
Otra de las regularidades de los programas y prácticas contra la malaria ha sido centrar en los números el diseño y el cambio de las estrategias. Se trataba de alta y baja endemia, una o cien picaduras por hombre por año, porcentaje de falla terapéutica mayor o menor. Sin embargo, fue desde los números y a partir de ellos que se delineó la forma de leer los impactos y las gravedades. La higiene se centró en los números para contar avenamientos y paredes protegidas, y la erradicación, y contó los litros de insecticidas y los medicamentos suministrados, así como se hizo con los muertos de la guerra. Los números permitieron siempre el cambio de las prácticas: número de charcos miasmáticos-criaderos, número de picaduras por noche, número de casos, número de medicamentos suministrados, número de toldillos…, pero la malaria continuaba presente en 109 países (15).
Los números han reemplazado el conocimiento y es con base en ellos que se hace el análisis explicativo de la situación problemática frente al saber de la malaria. Los informes y los programas se han basado en “la explicación de un fenómeno por la eficacia de las medidas aplicadas” (8). Bajo esta perspectiva, se hace necesario mirar detenidamente la nueva estrategia de la eliminación y poder señalar si la mirada se desplaza, si el paradigma cambia, y cuáles son los retos y las posibilidades para que la malaria desaparezca.
Este artículo tiene como objetivo responder a las posibilidades de eliminación de la malaria en Colombia, aportando algunos elementos en el análisis de la tensión problemática planteada por Saúl Franco Agudelo, investigador colombiano, que en los años 80 se preguntaba si la situación de la malaria era explicable por un problema de saber o de poder (8). En otras palabras, se trata de responder al reto de si con lo que se conoce hoy sobre malaria, es decir, si con el modelo explicativo vigente de enfermar y con las prácticas utilizadas para combatirla –caso específico, la eliminación– se puede terminar con ella.
Para cumplir con el objetivo, es necesario pasar de forma general por los siguientes pasos:
• enfatizar la persistencia de la malaria en Colombia como problema de salud pública;
• visibilizar algunos aspectos históricos sobre el saber de la malaria construido sobre la teoría microbiana, en la cual descansa el modelo biomédico actual;
• exponer las prácticas utilizadas para combatir la malaria, resaltando lenguajes y discursos que la cruzaron durante el siglo XX;
• presentar en qué consiste el programa de eliminación planteado por algunas agencias internacionales, como la OPS en 2008 (16), como una nueva práctica antipalúdica, y
• considerar las voces críticas de algunos investigadores sobre el tema.
Panorama mundial de la malaria
El Informe Mundial sobre Paludismo 2010 (15) es producto de los datos aportados por los países durante los años 2008 y 2009. Esta revisión es, entonces, la versión oficial de la situación mundial de la malaria. La región de América Latina y el Caribe aportan a la malaria mundial el 1,1 % de los casos (14) y 23 países tienen transmisión activa de Plasmodium spp., con predominio de P. vivax en más de 80 % de los enfermos (15).
Durante el año 2009, hubo 236´863.095 casos sospechosos de malaria en el mundo y 7´273.098 en las Américas; en total, 11 países, incluyendo una zona de la región africana, presentaron una reducción en los casos de malaria superior al 50 % y, en regiones diferentes de África, el número de casos declarados descendió en más de 50 % en 32 de los 56 países con paludismo endémico (15). Entre 2000 y 2009 se observaron tendencias a la disminución entre 25 y 50 % en otros ocho países. Según el Informe Mundial de Malaria de la OMS, 2010 (15), en el 2000 ocurrieron 233 millones de casos y 985.000 muertes por paludismo. En el año 2009, el número de casos fue de 225 millones y las muertes fueron 781.000. Se concluyó que hubo un descenso en la carga de paludismo en todas las regiones, principalmente en Asia y las Américas (15).
Por otro lado, y más allá de los datos, Margaret Chan, directora general de la OMS, reconoció que los progresos eran frágiles: “[…] Si bien hay mucho que podemos celebrar, los datos de este informe subrayan también la fragilidad de nuestros progresos […]”(15) y enunció que había aumento de la malaria en algunas partes de África, y fallas en la vigilancia y seguimiento de pacientes; los progresos los atribuyó al aumento en el número de mosquiteros tratados con insecticidas, la fumigación intradomiciliaria y el diagnóstico: “[…] Ya que la mayoría de los casos de fiebre no se deben a paludismo incluso en África. Ello constituye otro indicativo claro de progreso y una señal de cómo se depuran constantemente las estrategias de control […]”(15).
La OMS expresó, también “[…] Están sucediendo rápidamente grandes cambios en la forma en que nos enfrentamos al paludismo. Este año por fin se declaró que toda persona con un presunto caso de paludismo tiene derecho a una prueba diagnóstica que lo confirme […]” (15). Señaló que “[…] En 2009, más de una tercera parte de los presuntos casos de paludismo notificados en África se confirmaron con una prueba de diagnóstico, lo que representa un drástico incremento con respecto al porcentaje, que es inferior al 5 % correspondiente al principio de la década[…]” (15).
Por otra parte, la versión oficial de la situación mundial de malaria en el mundo en 2010, presentó los progresos así:
1) El aumento de la financiación, que se refleja en el acceso a toldillos impregnados con insecticidas: “[…] El 42 % de los hogares de África dispusieron a mediados de 2010 de al menos una red mosquitera tratada con insecticidas […]”.
2) El aumento de los programas de fumigación intradomiciliaria.
3) El suministro de tratamientos combinados con artemisininas.
4) “La intensificación en el seguimiento de la eficacia para hacer posible la detección precoz de la resistencia a fármacos antipalúdico”.
5) La cobertura con tratamientos preventivos intermitentes en la mujer embarazada, y
6) los progresos en el diagnóstico basados en prueba rápidas (15).
Sin demeritar la importancia del Informe Mundial para presentar la información oficial sobre la situación de la malaria en el mundo y su gran aporte para la visión global del problema, la novedad que se encuentra 52 años después de iniciada la estrategia de erradicación, 1958-2010, es la de presentar la variación de las estrategias operativas en términos de mejoría o empeoramiento de la situación de la malaria en los países. No se pueden leer en este informe los indicadores de impacto de las medidas ni las causas de la variación de las cifras; no hay análisis ni correctivos sobre la morbilidad ni mortalidad general, ni de la materna en particular. No se hacen visibles los fracasos ni las responsabilidades.
Cada trabajador de malaria sabe que los progresos planteados en el Informe Mundial de Malaria, 2010 (15), generan cuestionamientos porque no sólo se deben poner toldillos impregnados con insecticidas sino que estos deben cambiarse con frecuencia y utilizarse de forma adecuada. También, se sabe que tener un toldillo por vivienda es ineficaz cuando el resto del grupo familiar no se protege.
Además, la OMS estableció, como una de las ventajas de las pruebas rápidas, la gran sensibilidad: casi de 100 %, sobre 100 parásitos/µl; otra ventaja es el tiempo de lectura, de 15 a 20 minutos. No ostante, estas pruebas tienen limitaciones, como las bajas parasitemias, los cambios en la sensibilidad dependiendo de la prueba y los falsos negativos (17), y se conoce la variabilidad de sus resultados en términos de sensibilidad y especificidad según el diseño utilizado para el estudio (18), así como su alteración con la temperatura y la humedad (19).
Se olvida la irregularidad en la disponibilidad de los medicamentos en los ministerios de salud de los países y las dificultades para su acceso por parte de la población. Se omite, también, la mención de los grandes problemas de seguimiento del tratamiento, la falta de seguimiento de la respuesta terapéutica que normalmente hacen los programas y la escasez de datos sobre la resistencia de los parásitos a los medicamentos.
Situación de la malaria en Colombia
Colombia tiene 18 millones de personas expuestas a la malaria y ocupa el segundo lugar como país palúdico de América Latina (20). En su territorio se presenta un promedio anual de 140.000 casos, con una fluctuación aún no explicada durante los últimos años. En 2007 se informaron 107.189 casos y, en el 2009, 84.525; de ellos, el 73,5 % fueron producidos por P. vivax(21). La “Guía de malaria, 2011” informa que las muertes por malaria, según el registro del Departamento Administrativo Nacional de Estadística (DANE) a partir de los certificados de defunción, en la última década (1999-2009) ha oscilado entre 65 y 165 muertes por año, y el Sivigila revela cifras de mortalidad entre 20 y 60 muertes al año (22).
Este fenómeno de la variabilidad del paludismo en el tiempo ha sido muy poco analizado y publicado en Colombia. Padilla y Piñeros (23) hicieron una revisión sobre el comportamiento de la malaria desde 1937 hasta el año 2000, y señalaron que entre 1937 y 1939 el promedio de casos de malaria, a pesar del subregistro, fue de 34.092. Entre 1940 y 1949 se registraron 398.473 casos de malaria.
En la década del 60, el promedio anual de casos de malaria fue de 20.872. En la década del 70 se informaron, en promedio, 48.709 casos de malaria por año, lo que significó un deterioro de la situación del paludismo en el país. En los años 80 continuó el deterioro progresivo de la malaria y un aumento del 86 % en el número de casos en relación con la década anterior (23).
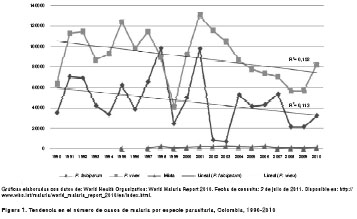
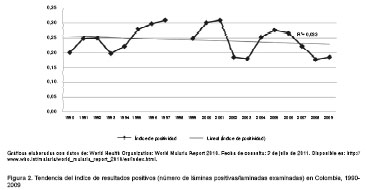
Según la OMS (2010), desde 1990 hasta la fecha, el número de casos de malaria por año ha estado entre 79.209 y 231.233, con un promedio de 138.553 casos confirmados por año (15). En las figura 1 y figura 2 puede verse que, a pesar de la inversión creciente en el control de la malaria y la introducción de nuevas herramientas de intervención, la tendencia en el número de láminas examinadas y el número de casos de malaria por P. falciparumy por P. vivaxen el país, entre los años 1990 y 2009, sólo es posible predecir con una certeza muy baja que estos comportamiento se mantendrán en el tiempo (R2=0,113 para la tendencia de P. falciparumy R2=0,152 para la tendencia de P. vivax). Por su parte, en el caso de los índices de casos positivos se observa una tendencia estable (15). Dado el predominio de malaria por P. vivax en los países de Suramérica, y especialmente en Colombia, se quiere mostrar que el saber de la malaria es un problema reciente y aún lleno de preguntas sin respuesta.
El saber de la malaria
Una serie de eventos se constituyeron en condiciones para la posibilidad del desarrollo de la teoría microbiana y el descubrimiento del hemoparásito como causa del paludismo. El microscopista holandés Anton von Leeuwenhoek (1632-1723), en 1674, encontró seres vivos en el agua y los llamó “animáculos” (24). La emergencia de la bacteriología como disciplina científica apareció con Louis Pasteur (1822-1895), Alois Pollender y Robert Koch (1843-1910) (25), quienes serían los padres de la teoría microbiana (25). Un tercer evento fue cuando Charles Emmanuel Sedillot (1804-1883) presentó a la Academia de Ciencias de París, en 1798, una propuesta para llamar microbios a esos “animáculos”. Una nueva interpretación de las enfermedades se hizo visible en la medicina y su padre sería Louis Pasteur (24).
En ese contexto microbiano, el médico francés Charles Louis Alphonse Laverán (1845-1922) informó al mundo científico, en 1881, el hallazgo en la sangre humana del agente que causaba la malaria (3). En 1887, el bacteriólogo inglés Ronald Ross (1857-1932) hizo el descubrimiento del ciclo completo del parásito en el mosquito de género Anopheles en la malaria de las aves y apareció con ello la noción de vector, mediada por los anofelinos. La relación de éstos con la transmisión de la enfermedad, que hiciera Giovani Batista Grassi (1854-1925) en 1898, fue el pilar que fundamentó las bases del conocimiento de la enfermedad (26) y, con ello, la emergencia de la teoría “mosquito-malaria”, la cual abrió las posibilidades de exterminar la enfermedad (27) y respaldó las prácticas para terminarla. Además, se inició con ello el desplazamiento de las explicaciones miasmáticas al parásito Plasmodium spp., noción que permaneció en el modelo biomédico durante todo el siglo XX. Durante los 20 años posteriores a estos descubrimientos, se reconocieron los aspectos fundamentales de la malaria: se estudió el plasmodio, sus ciclos de vida y se clasificaron las distintas especies que causan la enfermedad en los humanos (26).
El siglo XX se inició con una mirada casi completa de los aspectos básicos de la malaria. Fritz Schaudinn (1871-1906), en 1903, dio a conocer las características morfológicas de P. vivax; en ese año también, se logró conocer la morfología de P. falciparum y de P. malariae (28). Más tarde, el médico italiano Giovanni Batista Grassi (1854-1925), quien trabajaba en una tercera fase de desarrollo de P. vivax, fue frenado por un error histórico que retardó los avances en el conocimiento, porque Fritz Schaudinn, investido como autoridad académica, informó incorrectamente la penetración de los esporozoítos en los glóbulos rojos (29). Y las recaídas producidas por P. vivax fueron explicadas por Schaudinn como producidas por la “reversión de gametos, retroceso, o esquizogonia de gametos”. El hecho que le permitió a Schaudin afirmar estos aspectos,fueel hallazgo en sangre y en bazo de unas formas del parásito que hablarían de que el macrogameto, por reducción parcial de su núcleo y del protoplasma, poseería la capacidad de multiplicarse por esquizogonia (30).
Al inicio de los años 30, las teorías de Grassi fueron revisadas y se concluyó, en 1931, que después de su ingreso por la piel, los esporozoitos invaden las células reticuloendoteliales y que en la malaria aviar ocurre un ciclo exoeritrocitario en el sistema reticuloendotelial. Para 1944 aún no se sabía nada del ciclo hepático de P. vivax en el humano (31). Posteriormente en 1947, Garnhamm describió un ciclo exoeritrocitario de P. kochi en los hepatocitos de los monos; y un año después (1948) con Shortt describieron, después de varios hallazgos en monos, las formas preeritrocitarias de P. vivax(32) y, años después, las formas de plasmodios lentos o dormidos de P. vivax y P. ovale.
En 1922, John William Stephens informó la presencia de una nueva especie, P. ovale, localizada en África oriental (28,31,32), y sólo hasta 1966 Garnham, refiriéndose a P. vivax,habló de cortos y largos períodos de incubación y reconoció dos especies y dos tipos de malaria P. vivax vivax de corto periodo y P. vivax hibernans,de periodo más prolongado (33). Además, afirmó que cada subespecie existe en un número de cepas diferentes. Para respaldar su teoría, presentó las características de algunas cepas y subespecies de P. vivax en función del origen, del periodo de incubación, de los patrones de recaídas, del número de merozoítos por esquizonte y de su vida en los diferentes vectores (33); por tanto, concluyó que son posibles distintos tipos de malaria por P. vivax, inaugurando de esta forma una nueva concepción de la enfermedad y un punto de referencia para la profilaxis, la clínica y el tratamiento.
La máxima expresión de la era genómica llegó el 26 de junio de 2000, cuando el bioquímico norteamericano Craig Vender informó al mundo la secuencia del genoma humano (34). Estas investigaciones condujeron a nuevas y excitantes formas de explicar la vida de nuestro planeta, lo normal y lo patológico, y consolidaron el pensamiento de que hay una malaria para cada sujeto y que ésta depende de un juego de interrelaciones entre poblaciones de parásitos, de huéspedes y de ambientes.
Desde otro punto de vista, se puede afirmar que la historia del diagnóstico de Plasmodium en sangreestá marcada fundamentalmentepor la invención de una técnica de coloración basada en el azul de metileno, que Romanowski desarrolló en 1891, la cual permitió diferenciar las especies (27) y fue fundamental para la coloración de la gota gruesa y el extendido de sangre periférica, que son la base del diagnóstico microscópico.
La historia del tratamiento de las fiebres mias-máticas se inició en 1630 con el uso de la quina por los indígenas suramericanos; posteriormente, a la botánica le siguió la química y, en 1820, los franceses Pierre Pelletier (1788-1842) y Joseph Caventu (1795-1877) aislaron un alcaloide de su corteza, la quinina (30). En 1944, dos químicos lograron la síntesis de la quinina. A partir de ese momento la quinina fue el tratamiento utilizado durante el siglo XX.
Durante la segunda guerra mundial, y ante la escasez de quinina, el ejército de los Estados Unidos presionó para que se desarrollara un gran programa de investigación. Se sintetizaron más de 14.000 preparados contra el paludismo, entre los cuales se seleccionaron los 150 más promisorios. Uno de ellos fue utilizado en los soldados en los campos de operaciones, al cual se le dió el nombre secreto de SN7618 y Win 244 (30), que corresponde al difosfato de 7-cloro-4 (4dietilamino.1.metil,butilamino) quinolina o difosfato de cloroquina, o Aralén®, que fue el medicamento utilizado en la Gran Campaña Mundial de la Erradicación.
Entre 1920 y 1950 se desarrollaron algunos medicamentos como pamaquina (Plasmoquina®), mepacrina (Atebrina®), cloroquina (Reoschin®) o difosfato de cloroquina (Aralen®), en 1934 (31,35), proguanilo y pirimetamina, en 1952, y primaquina, en 1956. Falta por explicar las razones históricas del cambio de uno a otro. Sólo hasta la década del 60 se informaron los primeros casos de P. falciparumresistentes a la cloroquina (36). Es de anotar que los esquemas combinados de tratamiento se utilizaban desde 1930. Algunos fueron quinina más plasmoquina, que es la quinoplasmina, quinina más arsenicales, y atebrina más plasmoquina (28,30,37).
Después del año 80 aparece una nueva ‘cabeza de serie´, la artemisinina, producto de la etnobotánica tradicional china a partir de la planta Artemisia annua, familia Asteraceae. La planta china qinghao, o A. annua, fue consumida en forma de té por el pueblo chino durante mil años para curar la malaria y, en 1972, el gobierno chino la incluyó en el programa de descubrimiento de nuevos fármacos. De esta planta se aisló la dihidroartemisinina (DE50=9,20 nM), de la cual se derivaron nuevas moléculas, como el artemeter (EC50=4,70 nM), el arteeter y el artesunato de sodio, que hoy son los derivados de artemisininas más utilizados para combatir la malaria (38) y de los cuales se discute su mecanismo molecular (39).
Esta nueva ‘cabeza de serie´, la artemisinina, inició todo su despliegue terapéutico y es la base fundamental sobre la cual descansa la nueva práctica antipalúdica, la eliminación.
Historia de las prácticas para combatir la malaria
En Latinoamérica, el programa de lucha higiénica se concibió como una estrategia sanitaria de atacar el agente causal y al zancudo transmisor higienizando la vivienda, tratando al hombre enfermo mediante acciones profilácticas y terapéuticas, y al medio ambiente mediante la construcción de avenamientos y drenajes. Este programa de control de principios del siglo XX se inició en Panamá durante el proceso de construcción del canal, en los años 1904-1914, cuando el general William Gorgas llegó a pensar y a plantear que “[…] para combatir los mosquitos hay que aprender a pensar como ellos […]” (8); luego se aplicó en Venezuela, en 1916, coincidiendo con los grandes proyectos de exploración de petróleo y la formación de la escuela de malariología de Maracay, Caracas (6,40), con gran apoyo de la Fundación Rockefeller que, al parecer, orientó los programas contra la malaria en Latinoamérica.
En Colombia, mediante la Resolución número 76 de 1920 de la Dirección Nacional de Higiene y el Acuerdo número 29 de 1926 de la Junta Central de Higiene y la Ley 12 de 1926 y otras disposiciones sobre la materia, se fijaron muy bien las condiciones de saneamiento y el deber de los médicos de sanidad de hacer un programa efectivo contra el paludismo (6,41).
Cuervo Márquez afirmaba en Colombia, en 1926, que el programa de lucha de principios del siglo XX se dirigía a tres niveles: al individuo enfermo para hacer desaparecer el foco de infección, al Anopheles para impedir la transmisión y al individuo sano para protegerlo contra la picadura del anofeles infectado (6,42). En los primeros años del siglo XX, los discursos higienistas sobre malaria estuvieron en Colombia mezclados con los sanitaristas, proceso que se desarrolló en dos momentos, antes y después de 1940. Caicedo Castilla resumió así la labor hecha por el Gobierno durante el año 1941:
“[…] Avenamientos construidos en metros lineales, avenamientos arreglados en metros lineales, pantanos petrolizados, depósitos y sifones petrolizados, petróleo gastado pantanos verdificados, verde de París gastado, terraplenes en metros cuadrados, diagnósticos clínicos de paludismo, diagnósticos microscópicos, personal tratado […]”(1,6).
Venezuela ejerció un papel de mucha importancia en el establecimiento de las estrategias de intervención de la malaria en Latinoamérica y fue puerta de entrada de los programas de enseñanza y de las prácticas para combatirla, porque presentó un gran problema palúdico cruzado por grandes proyectos de desarrollo, como la explotación comercial del petróleo:
“[…] Poderosas compañías extranjeras exploran nuestro territorio en busca del rico aceite mineral, establecen campamentos y fundan poblados en la selva y en las orillas del lago de Maracaibo. Para ello, sin embargo, deben sanearse las zonas y combatir el mortífero paludismo, lo cual emprenden de inmediato y de lo cual resultará una mejoría de la situación sanitaria de los lugares en que trabajan […]´´(6,7).
Esto, junto a la presencia de asesores internacionales, forzó las prácticas en el momento del tránsito de los programas de control a los de erradicación.
Tulio López afirmó:
“[…] Traen frescas las experiencias de Centro América y de la zona del canal de Panamá en contra de la fiebre amarilla y la malaria; allí se utiliza quinina para el tratamiento de enfermos, un larvicida a base de fenol y la aplicación de un larvicida como el petróleo. Esta campaña iniciada en Venezuela en 1916 coincide con la llegada al país de una comisión de la Fundación Rockefeller, visita que incluyó a Colombia, Perú y Brasil, integrada por los médicos norteamericanos Williams Gorgas y Henry Rose y el cubano Juan Guiteras decididos a combatir ese flagelo […]” (6,7).
Además, en 1936, Venezuela contó con el establecimiento de la única Escuela de Malariología de las Américas, fundada mediante la Ley de Defensa contra el Paludismo promulgada por el Congreso Nacional el 16 de junio de 1936 (40). Fue puesta en funcionamiento por el presidente de la República, general Eleazar López Contreras, el 27 del mismo mes cuando Santos Dominici, en calidad de ministro, firmó la resolución (40). El primer director de la Escuela de Malariología de Caracas fue Arnoldo Gabaldón (40). En ella se dictó el “Curso de malariología” para médicos e ingenieros. Con duración de un año, el curso contemplaba aspectos básicos de ingeniería, entomología y vectores asociados a prácticas para acabar con la malaria. Allí se formaron los malariólogos del mundo, incluyendo los de Colombia.
Es de anotar que hasta 1985 se habían organizado 39 cursos internacionales, en los cuales participaron 938 alumnos, 485 venezolanos y 453 extranjeros. De Colombia asistieron 84 personas, entre 1944 y 1985. Entre los asistentes estuvieron la mayor parte de los jefes de campaña de los países de América (6,7).
En concepto de la autora, la Escuela de Malariología fue la que más posibilitó los discursos y prácticas sobre el Programa Mundial de Erradicación de Malaria en todos los países, porque allí se formaron especialistas malariólogos, extranjeros y nacionales, comprometidos con replicar lo aprendido en sus respectivos países. En ese espacio de saber entraron en conjunción el saber teórico sobre la malaria y las prácticas para combatirla, dado que allí se contaba no sólo con el respaldo gubernamental sino con uno de los más decididos e influyentes malariólogos de la época, el médico Arnoldo Gabaldón, quien desde 1916 actuó como el padre de la erradicación en Latinoamérica, pues contaba con el apoyo irrestricto de la Fundación Rockefeller y de todos los organismos asesores internacionales quienes entraron a las Américas de la mano de Gabaldón (6,7).
A partir de 1949, la Escuela de Malariología modificó su enseñanza por el éxito logrado con la introducción del DDT y la destrucción casi total de los anofelinos. El curso se llamó “Curso Internacional de Malaria y otras Enfermedades Metaxénicas”. La reorientación se puede leer así: “Este curso está fundamentalmente dirigido a preparar personal sanitario en la lucha eficaz contra los vectores de las enfermedades metaxénicas; no es un curso de Patología e Higiene Tropical en el sentido clásico” (6,7).
Por otro lado, y continuando con los programas para combatir el paludismo, la XIV Conferencia Sanitaria Panamericana, en 1954, resolvió que todos los países miembros “[…] Deberían convertir con la mayor brevedad posible todos los programas de lucha en campañas de erradicación a fin de que esta sea lograda antes de la aparición de resistencia de los anofelinos a los insecticidas […]” (6,8).
Programa Mundial de Erradicación de Malaria
En 1939, Paul Herman Müller generó un cambio definitivo en el abordaje de las prácticas para combatir la malaria al presentar una sustancia sintetizada en 1874 por Othmar Zeidler, como el más potente insecticida de contacto, con el cual bastaba que tocara las patas de los insectos para matarlos. Además, debido a su composición química, éste podía seguir siendo letal durante varios meses después de haber sido rociado sobre cualquier superficie; también, era de bajo costo y no se consideraba peligroso para el resto de animales ni para el hombre. Esta sustancia era el dicloro-difenil-tricloroetano (DDT) (40), la cual iba a dividir la historia de las prácticas para terminar con la malaria, al pasar de un programa de intervención en los individuos, los ambientes y los charcos, utilizando sustancias larvicidas como el petróleo y el verde de París, a un programa basado exclusivamente en este insecticida (8).
Después de la segunda guerra mundial y de la fundación de la OMS en 1946, y con la OMS y la OPS dirigiendo los programas, el terminar con la malaria cobró gran interés porque se reconoció su alta prevalencia en los países y el gran número de vidas perdidas. El Programa Mundial de Erradicación de Malaria, según la Organización Mundial de la Salud en 1957 (43), se definió así:
“[…] Se entiende por erradicación del paludismo la supresión de la transmisión de la enfermedad y del reservorio de casos infecciosos mediante una campaña de tiempo limitado llevada con tal perfección que, cuando acabe, no se restablezca la transmisión […]”(6,8,9).
El Programa Mundial de Erradicación de la Malaria se inició en el mundo en 1958 y se dió un tiempo limitado de cinco años, hasta 1963, para terminar con la malaria, siempre apoyado en combatir parásitos y vectores y siguiendo la versión de la erradicación de Fred L. Soper. Él fue el primer director de la OPS y padre de la erradicación. Puede resumirse añadiendo el concepto de la OMS: “Erradicación es la completa eliminación de todas las fuentes de infección de un determinado agente patógeno” (8,44,45).
Operativamente, la erradicación debía realizarse en las siguientes fases.
• Fase preparatoria. Debía durar dos años y, básicamente, consistía en el reconocimiento y la demarcación del área de trabajo, el establecimiento del personal de campo, el número de casas para rociar y el equipo disponible, entre otros.
• Fase de ataque. Consistía en el cubrimiento total con insecticida y quimioterapia.
• Fase de consolidación. Comprendía la vigilancia de la transmisión, midiendo las tasas de parásitos, según el grupo de edad. Se empezaba cuando el índice parasitario anual (IPA) era menor de 0,1 por 1.000.
Fase de mantenimiento. Era la fase de vigilancia en la cual se establecían las condiciones para que la endemia no volviera a presentarse. Después de esta fase, la OMS expedía a los países el certificado de erradicación (46).
La erradicación, en sus fundamentos, fue concebida como un programa uniforme, a pesar de que en algunos países se hicieron cambios en la aplicación de la estrategia que apoyaban el lema de destruir parásitos y vectores en un tiempo de cinco años. El ejemplo es Brasil, donde se empleó el método de M. Pinnoti, que consistía en añadir un medicamento antipalúdico a la sal común, y se eligió la cloroquina por ser resistente a la acción del calor durante tres o cuatro horas, a un pH entre 4 y 7 (6,46,47):
“ […] La dosis diaria que habría de ingerirse mezclada con la sal se fijó en un principio en 45 mg... Se llegó a un acuerdo con los mayoristas para que no se vendiera más sal ordinaria y se hicieron inspecciones palúdicas para comprobar que sólo se usaba sal cloroquinada […]”.
También en Brasil, el personal de la campaña
“ […] ha tratado de destruir las bromeliáceas mediante rociamientos con herbicidas, se destruían también otras plantas arrancándolas a mano, o talando árboles y reemplazándolos por eucaliptos, métodos laboriosos y caros y de resultados dudosos […]” (48).
En 1960, la OMS revisó los programas de erradicación de malaria en América y concluyó que, entre 21 programas, 13 no contaban con adecuada legislación y en 10 de éstos se consideró que la falta de dicha legislación había obstaculizado el logro, mostrando que estos aspectos locales pueden impactar los objetivos internacionales de Programa Global. Así, los parámetros definidos por la OMS no podían ser acatados y puestos en funcionamiento en menos de la mitad de los casos; además, estos fueron haciéndose cada vez más insostenibles económica y técnicamente, motivando su retiro y dando como resultado el recrudecimiento o la reaparición de la malaria en diferentes zonas. Por ello, mediante la resolución adoptada por la XXII Asamblea de la Salud en 1969, la OMS aceptó que la estrategia mundial de la erradicación del paludismo no había logrado la meta propuesta y le pidió a los países preparar sus propios planes de erradicación a largo plazo y regresar a los programas de control.
El director general de la OMS, en 1970, propuso una estrategia mundial de control, la cual se aprobó en 1978 en la XXXI Asamblea Mundial de la Salud, mediante la Resolución WHO 31.45 (28). Se instó a los países a reorientar los programas nacionales de salud y se pidió a la OMS prestar asesoría técnica mediante unas variantes tácticas (48). Fue a partir de la década de 1970 cuando en el mundo se establecieron los objetivos contra la malaria, dentro de una propuesta de control de la enfermedad más que de erradicación (48).
En 1978, se diseñó el Programa de Control de la Malaria con la meta de disminuir la mortalidad y la morbilidad (13). Este programa debía estar incorporado a los sistemas de salud de cada país y sugería continuar sin interrupciones las prácticas operativas diseñadas:
“[…] En el control del paludismo dentro de la estrategia de atención primaria de salud son igualmente importantes otras medidas que no tienen efecto directo en la transmisión de la enfermedad, tales como la modificación del medio ambiente para mejorar el riesgo, las mejores condiciones de vivienda, ventilación y ubicación de asentamientos humanos y la modificación del hábito de dormir al aire libre; fomento del uso de mosquiteros; persuadir a las personas enfermas que busquen atención médica […]” (13).
La controversia mundial en el periodo contemplado en los años posteriores a la década de los 50 del siglo XX, fue definirse entre control o erradicación, su inicio y terminación. Con independencia de las razones que se tuvieron para regresar al control a partir de 1978, parece de interés presentar las palabras de un exfuncionario de OMS, A. Farid, (49) sobre las prácticas para erradicar la malaria, quien hizo un llamado a la OMS para que no mezclaran los problemas técnicos con los políticos en los programas para combatir la malaria:
“ […] De la lucha a la erradicación y vuelta a la lucha en un plazo de veinte años. Uno de los principales programas de salud pública emprendidos en el mundo ha oscilado, pasando de las grandes esperanzas de los años cincuenta, cuando la Asamblea Mundial de la Salud adoptó la política de erradicación mundial del paludismo, a la desilusión de los años 70, cuando hubo de admitirse que era imposible mantener el ímpetu y el éxito iniciales. Hoy día, cuando el paludismo campea por sus respetos, en muchas zonas donde antes se había llegado a dominar, las autoridades sanitarias se ven obligadas a volver a considerar sus políticas y su orden de prioridad. El paludismo no es sólo una enfermedad del pasado, sino también del futuro. Por eso se debe proceder a echarle una mirada hacia el pasado y traer a colación algunas de las lecciones de ayer que pueden seguir siendo válidas hoy […]” (7,49).
Foucault señaló como uno de los fenómenos fundamentales del siglo XX la asunción de la vida por el poder (50), donde el Soberano tenía en sus manos el poder de decidir sobre la vida y la muerte de los individuos. Se retomó para afirmar que mucho de este actuar se hace visible en el saber de la malaria y en las prácticas utilizadas por las organizaciones nacionales e internacionales, además de los gobiernos para combatirla. Los mismos entes han podido definir lo normal, lo asimétrico, lo que se sale de la media, las enfermedades tropicales, las enfermedades endémicas, lo natural y lo artificial, las epidemias y sus programas.
Otro marco en la lucha contra la malaria fue la implementación de la Estrategia Mundial de Lucha contra el Paludismo, adoptada por un grupo de estudio de la OMS en Ginebra en 1993, quienes hicieron propia la Conferencia Ministerial sobre Paludismo (Amsterdam, 26-27 de octubre de 1992), presentada como respuesta a una situación inmodificable del paludismo en las zonas tropicales, al fracaso de las anteriores estrategias y a la necesidad de poner en vigencia la reforma mundial de los servicios de salud. Esta nueva Estrategia Mundial de Control Integrado orientaría el quehacer de la lucha contra el paludismo entre 1993 y 2000, y me atrevería a decir que, con algunas modificaciones, ha estado presente en la mente de los organismos responsables de combatir el paludismo durante todo este tiempo hasta el 2007, cuando se empezó a hablar de eliminación teniendo como fin último la erradicación.
La finalidad de la nueva estrategia era prevenir la mortalidad y disminuir la morbilidad por malaria, mediante los siguientes objetivos: eliminar los programas de control uniformes para los países y hacerlos de forma descentralizada en cada municipio, teniendo en cuenta la situación ecoepidemiológica y la presencia de los llamados focos de malaria, pero manteniendo la responsabilidad a nivel nacional. Otro aspecto fundamental era la integración de los programas de lucha antipalúdica a los servicios de salud y la presión sobre los gobiernos para que suministraran la infraestructura básica de atención, y el último, en el que mayor énfasis hacía la nueva estrategia, fuera la participación comunitaria con énfasis en la prevención, mediante la aplicación de medidas preventivas que fueran sostenibles y selectivas, no sólo en lo que tiene que ver con el diagnóstico microscópico, sino en la lucha contra los vectores, que era su énfasis prioritario, la cual debía ser apoyada por los municipios y debe llevarse a cabo de forma individual y colectiva. Los aspectos técnicos más destacados en la nueva estrategia eran: realizar diagnóstico y tratamiento tempranamente, utilizar medidas preventivas sostenibles y selectivas, prevenir las epidemias y fortalecer la investigación básica para retroalimentar los programas (51).
En Colombia, según Jiménez, et al. (52), apoyada en el estudio de dos de los municipios más palúdicos, se informó que la política de control se llevó a cabo en tres periodos consecutivos. El primero, entre 1975 y 1982, correspondió a un programa vertical de control a cargo de la Dirección de Campañas Directas del Ministerio de Salud que dirigía el Servicio de Erradicación de la Malaria, cuya meta era reducir en 50 % el riesgo de contraer la enfermedad en las áreas palúdicas. Se debe recordar que el Sistema Nacional de Salud fue creado en 1975.
El segundo periodo fue entre 1983 y 1990. Correspondió a la descentralización del programa de control, pues pasó del orden nacional a los departamentos. Al parecer, según la autora citada, se inició el resquebrajamiento de los programas de salud pública que se hizo más visible en el tercer periodo, entre 1991 y 2004, que correspondió al final de los programas nacionales de control de la malaria y al debilitamiento del Estado a partir de la Ley 100 de 1993. Estas decisiones implicaron un gran deterioro en el control de las enfermedades transmitidas por vectores en el país (52,53)
“[…] asociado con la descentralización y la sujeción de la política sanitaria a los principios del mercado; el deterioro se caracteriza por el debilitamiento progresivo de la responsabilidad del Estado, el desmonte de la capacidad instalada, la pérdida de conocimiento, la fragmentación de las acciones de control, el colapso del sistema de información y el deterioro de los indicadores de mortalidad y morbilidad […]”(52).
Por otro lado, y de forma circular a nivel mundial, se inició de nuevo la discusión sobre cuál era el mejor programa para terminar la malaria. La vieja disputa sobre erradicación y control se puso sobre el tapete. En 2007, la OMS optó por la eliminación (53).
¿En qué consiste el nuevo programa de eliminación de la malaria?
Los programas de control de los últimos 39 años, 1978-2007, no lograron disminuir la malaria de forma apreciable y un número significativo de países aún presentan gran carga de enfermedad. La oportunidad de contar con nuevos antipalúdicos derivados de la artemisinina, nuevos insecticidas y nuevas pruebas diagnósticas, hace que iniciativas de la OMS, como la de Roll Back Malaria, respaldadas con fondos privados y públicos, “resuciten” la posibilidad de la erradicación para los países y planteen ingresar a un nuevo programa de control por niveles: control, preeliminación, eliminación y erradicación, para reducir la carga de malaria a cero y mantener como meta la erradicación (54,55).
Estos niveles de control se definen como sigue:
- Control: reducción de la carga de enfermedad para que no sea un problema de salud pública.
- Eliminación: interrupción de la transmisión local de malaria por vía vectorial en un área geográfica definida; es decir, incidencia de cero de casos infectados localmente, aunque los casos importados continuarán ocurriendo.
- Erradicación: reducción permanente a cero de la incidencia de la infección palúdica (54,55).
El concepto de eliminación, según la OPS “[…] no requiere eliminación de los vectores de la enfermedad o una ausencia total de casos en el país: los casos importados continuarán siendo detectados debido a viajes internacionales y pueden ocasionalmente llevar a la ocurrencia de casos introducidos en los cuales la infección es una primera generación de transmisión local, subsecuente a casos importados […]” (55).
Según la OPS, las fases para que los programas vayan del control a la eliminación son los siguientes:
Reorientación del programa/programa de preeliminación:
1) cuando la información de las unidades de salud representativas de la localidad o país afirmen que la tasa mensual de láminas positivas entre febriles con sospecha de malaria es constantemente menor de 5 % a lo largo del año;
2) los estudios con base en la población en el pico de la temporada de transmisión confirman una tasa de infección de 5 % entre personas de todas las edades con fiebre o historia de fiebre.
- Programa de eliminación: se inicia cuando se ha logrado la preeliminación y cuando las unidades de salud informan una incidencia de malaria menor de 1 caso por 1.000 personas en riesgo, por año. El objetivo de la eliminación es detener la transmisión local, limpiar los focos de malaria y reducir a cero el número de casos localmente adquiridos.
- Segunda reorientación: se basa en la vigilancia de los objetivos de eliminación para que se cumplan a la perfección.
- Prevención de la reintroducción: cuando hay ausencia comprobada de casos localmente adquiridos durante tres años consecutivos y se inicia la certificación por la OMS (55).
Las guías señalan muy cuidadosamente algunos cambios que deben llevarse a cabo en los programas de control de malaria, para reorientar las acciones hacia la eliminación:
1) que todos los casos sean confirmados micros-cópicamente y tratados de acuerdo con la política nacional;
2) que el sistema de gestión de calidad de diagnóstico sea completamente funcional;
3) que todos los casos sean investigados epidemio-lógicamente y registrados a nivel central;
4) que las áreas palúdicas estén claramente delimitadas y se haya hecho un inventario de los focos de transmisión;
5) que se haya creado una base de datos y un sistema de información geográfica que incluya la información de los casos, las intervenciones y el comportamiento de los parásitos y vectores, y
6) que se hayan identificado las necesidades gerenciales, administrativas, tecnológicas, financieras y sociales dentro del contexto de la salud pública (55).
Es necesario, entonces, conocer estos requisitos y contrastarlos con la realidad de los programas de malaria de la mayoría de países del mundo, para responder si es posible eliminarla.
Retos para la eliminación
Uno de los retos que han señalado algunos investigadores es la falta de claridad del concepto de eliminación. Es en este contexto de saber de la malaria y en este espacio conceptual de eliminación, en donde se movilizan diferentes opiniones y las probabilidades de llevarlo a buen término, sin poder afirmar que se trata de un nuevo o viejo concepto, Cohen, et al. (56), presentaron históricamente que la definición de eliminación propuesta ha cambiado en el tiempo y refirieron que en 1961 se definía como erradicación local; veinte años más tarde (1982), la eliminación se definió como la desaparición de la transmisión de una infección; en 1998, se habló de la reducción a cero de la incidencia de infección, y para terminar, en el 2008, se definía como la interrupción local de la transmisión de la malaria por mosquitos, en una área geográfica definida.
Cohen puso de manifiesto las ambigüedades de los términos utilizados, ya sea como control, erradicación o eliminación, y la necesidad de hacer claridad para poder alcanzar los objetivos de los países sobre el estado de la malaria (56).
La OMS tiene un criterio operacional de eliminación, interesante de señalar: “[…] menos de 3 casos en todo el país que tengan nexo epidemiológico, sin otro factor de riesgo identificable, diferente a la transmisión por mosquitos locales, durante 3 años consecutivos […]”. Este criterio se presenta porque la mayoría de países que han alcanzado la eliminación tienen en forma ocasional casos primarios a partir de casos importados (57) y categoriza a los países en alguna de estas cuatro fases, según los esfuerzos que se hacen y los resultados de incidencia: control, preeliminación, eliminación y prevención de la reintroducción (57). Por ejemplo, un país en la fase de eliminación tiene una incidencia parasitaria anual de menos de un caso por cada 1.000 personas en riesgo.
En la iniciativa Roll Back Malaria se afirma que la eliminación es una base sólida de consenso diseñada como una estrategia en tres partes: control, eliminación e investigación. Esta última es el piso de las fases de inicio y culminación (58).
El panel de expertos de Roll Back Malaria señala la necesidad que tienen todos los jugadores de actuar juntos: grupos comunitarios, científicos y donantes multilaterales, deben hacer todo lo posible para mantener esta tendencia hacia la eliminación, porque en el 2050 se va a estar luchando contra la malaria en un frente limitado. La visión de un mundo libre de malaria estará al alcance. Los expertos instan a la acción a todos los actores, gobiernos y países.
Los aspectos más significativos de sus mensajes son los siguientes:
- A los países con malaria endémica les piden hacer las evaluaciones de la viabilidad global de eliminación de la malaria, antes de embarcarse en una política nacional de eliminación. Y, si deciden hacerlo, deben desarrollar estrategias para el mantenimiento y financiación de la eliminación.
- A la OMS le piden que oriente y coordine los programas de eliminación de la malaria en los países.
- Al Fondo Mundial le solicitan que revise la normatividad vigente para dar un efectivo apoyo a los programas regionales y multinacionales, así como reconstruir las guías y el apoyo técnico para reconocer explícitamente las necesidades de los países en plan de eliminación de la malaria.
- A la industria farmacéutica y Medicines for Malaria Venture les piden centrar sus esfuerzos en desarrollar fármacos para su suministro masivo, medicamentos que brinden una cura radical para malaria porP. vivax, especialmente en entornos donde se busca la eliminación. Igualmente, les piden medicamentos para interrumpir la transmisión.
- Al sector privado le piden apoyar al gobierno en sus políticas y programas de eliminación.
- A la comunidad de investigadores le piden elaborar y acordar una agenda de investigación a corto plazo para apoyar la eliminación, y priorizar el desarrollo y ensayo de métodos innovadores para crear y mantener sistemas de vigilancia y respuesta para la malaria y otras infecciones. Se les solicita, de igual manera, dar prioridad a la investigación sobre la epidemiología de P. vivax, y priorizar el desarrollo y los ensayos de medicamentos para lograr la eliminación de P. falciparum yP. vivax(56).
La agenda Malaria Eradication Research (malERA) puesta en escena en el 2008 con la participación de destacados científicos, liderada por la OMS y su comité directivo, el Global Health Program de Bill y Melinda Gates, el National Institute of Allergy and Infectious Diseases (NIAID) de los Estados Unidos y Roll Back Malaria, definen las prioridades en investigación, así: mejorar los datos y su flujo para que posibiliten el paso del control a la eliminación y, específicamente, lo que tiene que ver con la distribución mundial de las especies parasitarias y, fundamentalmente, el conocimiento sobre la biología y comportamiento de P. vivax: cultivo in vitro, estudio de hipnozoítos, medicamentos para la administración masiva de vacunas y desarrollo de nuevas herramientas que permitan eliminar la malaria, así como el comportamiento de los vectores en lo que tiene que ver con su biología y formas de transmisión (58,59).
La agenda señala también la necesidad de trabajar en algunos de los retos operativos en áreas de baja endemia. En estos casos sugiere tener buenos sistemas de vigilancia, evaluar medicamentos y sus respuestas para obtener el mayor margen de seguridad posible e, idealmente, contar con una vacuna que otorgue inmunidad a estas personas en riesgo y que sería el empuje final hacia la eliminación. Es importante que desde cada país surjan las soluciones (59).
Voces frente a la eliminación
Para Das Pam, et al. (60), la eliminación significa interrumpir la transmisión de malaria en el orden regional o nacional. Para lograrlo, estos autores proponen reducir el mapa de la malaria, lo cual significa disminuir la malaria en los países con mayor carga de la enfermedad utilizando estrategias agresivas de control y desarrollando investigaciones sobre problemas prioritarios enfocados en el mejoramiento de herramientas sobre diagnóstico, vacunas, insecticidas y medicamentos. Todo ello podría generar progresos tangibles hacia la eliminación.
Señalan también que, al perseguir la eliminación de la malaria, cambian las prioridades en cuanto a tratamiento, quimioprevención, control de vectores y vacunas y, reflexionando sobre el mismo problema, plantean que para lograr la eliminación se requiere un sistema de salud fuerte, sostenido en el tiempo.
Enfatizan que cada país endémico debe asumir la responsabilidad de mantener la eliminación sin requerir ayudas económicas internacionales, lo que significa responsabilidad con sus propios programas (60). Citan un reporte de análisis financiero de Sabot, et al., en el que se calculan los costos de la eliminación comparados con los del control en áreas de baja endemia, mediante el estudio de cinco áreas, y concluyen que el ahorro financiero no debería ser la principal razón para pensar en la eliminación. Ésta debería ser una inversión a largo plazo (60).
Otro grupo de autores, Feachem, et al. (61), plantea que para que la eliminación sea posible, se debe adoptar una estrategia en tres partes: control agresivo en regiones de alta endemia, eliminación progresiva desde los márgenes endémicos para reducir el mapa, e investigación y desarrollo en busca de nuevas herramientas y técnicas. Señalan que la eliminación debe ser una decisión de cada país y que cuando éste decida implantar la eliminación sería porque ya tiene una infraestructura respaldando el control.
Se requiere que los países se agrupen fuertemente, hagan guías claras y se respalden con asistencia técnica. Los países que ya han logrado el control con baja endemia se enfrentan al dilema de si erradicar o no. Ellos deben tener la capacidad de calcular el costo del control comparativamente con el costo de la eliminación y de mantenerla (61-64).
Los retos para la eliminación de la malaria en Colombia
Se ha dedicado buena parte del artículo a brindar elementos para que esta respuesta sea posible sin tener que abordarla directamente, dada su complejidad, la ambigüedad de los conceptos y el sistema de salud vigente: descentralizado en la década de los años 90, y sostenido bajo profundas reformas sociales y de salud que se consolidaron en la Ley 100 de 1993, modelo de competencia regulada de la salud brindado por el Estado y las empresas privadas (52) con vacíos e iniquidades profundas y base de muchas discusiones internas.
A pesar de lo anterior, se pueden mencionar algunos obstáculos para la reducción de la malaria en Colombia, independientemente del programa antipalúdico que se lleve a cabo:
1) la carencia de buenos sistemas de vigilancia que permitan hacer correctivos a las acciones que se realizan, las cuales deben estar basadas fundamentalmente en resultados de investigaciones;
2) la falta de acceso de todas las personas al diagnóstico microscópico, tal como lo señala la directora general de la OMS en el informe del 2010 (64) y aplicable a Colombia;
3) a lo anterior se le puede agregar que no todas las personas tienen acceso a tratamientos oportunos, a pesar de estar incluidos en el Plan Obligatorio de Salud (POS), realidad explicada fundamentalmente por varias razones:
a) ausencia de contratación de personal que administren tratamientos en puestos de diagnóstico,
b) dificultades para el acceso y disponibilidad de medicamentos,
c) carencia de sistemas de vigilancia de la respuesta terapéutica y
d) la pobre, y ahora, mínima destinación de dineros para la financiación de investigaciones que aporten al conocimiento y a la transformación de la situación de la malaria;
4) El desconocimiento de la presentación de la malaria en el país está relacionado con el saber de la malaria y dificulta su eliminación en Colombia.
A continuación se describen algunos de los elementos ignorados:
- ¿Cuáles son los perfiles clínicos de la malaria por P. vivax?
- ¿Cuáles son los patrones de recaídas de cepas y subespecies de P. vivax?
- ¿Cuál es la parasitemia promedio de la malaria colombiana por regiones y por especie?
Ángela Castañeda mostró hace algunos años que en dos zonas muy palúdicas del departamento de Antioquia, el Bajo Cauca y Urabá, durante los años 1988 y 1989, la gente se complicaba y se moría con una parasitemia baja, menor de 10.000 parásitos/µl, y que el 95 % de los pacientes palúdicos presentaban parasitemias menores de 20.000 parásitos/µl (65).
- Se desconoce también la respuesta terapéutica a los esquemas antipalúdicos vigentes. Los datos existentes se limitan a tres departamentos: Antioquia, Nariño y Cauca. No se ha dado la discusión sobre los marcadores de resistencia en P. falciparumyP. vivax y los estudios son restringidos y poco aportan.
- Se desconoce, a su vez, cuál es el desarrollo de los niños nacidos de madres sintomáticas o asintomáticas con malaria placentaria.
- No se sabe si los gametocitos circulantes tienen diferente capacidad infecciosa si se trata de un paludismo activo (parasitológica y clínicamente) o de uno asintomático.
- Se ignora cuáles son las poblaciones de parásitos presentes en cada país objeto de eliminación y cómo han cambiado comparativamente en los últimos años.
- Se desconoce cuánta falla terapéutica se explica por la resistencia de los plasmodios a los antipalúdicos presentes en cada departamento y cómo ha variado el fenómeno de la falla dela cloroquina para P. vivax, en los últimos 10 años.
- No se sabe si la administración masiva de cloroquina y primaquina a los enfermos con malaria por P. vivax y a los contactos cercanos, es una medida de riesgo para inducir la resistencia o si, por el contrario, es la solución a un problema.
- Se ignora si la existencia de patrones clínicos de paludismo grave por P. vivax es un problema nuevo o es, desde la mirada positivista de la medicina, una realidad anterior no leída.
- Se desconoce si la recurrencia de la enfermedad por P. vivax en viajeros provenientes de zonas endémicas y residentes en zonas no endémicas, se deben a nuevas poblaciones de hipnozoítos, a falla terapéutica de la primaquina, a resistencia de esta especie a la primaquina o a dosis insuficientes.
- Y, la última y más problemática: ¿puede una vacuna terminar con la malaria en Colombia?
A continuación se señalan los problemas de poder que se enuncian y que han estado presentes en las prácticas para terminar con la malaria.
a) Las políticas públicas que median el paso de un programa de erradicación a uno de control y de éste de nuevo a la erradicación pasando por la eliminación, sin contar con un programa de salud pública comprometido con el manejo de las enfermedades transmitidas por vectores.
b) El problema epistemológico en el diseño de prácticas para terminar la malaria, llámense de erradicación, de control y ahora de eliminación, llevadas a cabo durante 110 años de historia y basadas en el mismo paradigma etiopatológico y en una concepción positiva de la medicina y de la salud pública, sin que medie una reflexión hacia otro modelo.
c) La incorporación de programas mundiales contra la malaria cruzados por intereses comerciales y de mercado, como la gran minería trasnacional y sus impactos sobre la economía y la salud. Cabe preguntarse si ¿ las agencias internacionales que distribuyen y venden medicamentos, toldillos e insecticidas, están verdaderamente interesadas en eliminar la malaria?
Sólo en el siglo XIX el parasitismo se asoció con enfermedad y fue en el siglo XX cuando se empezó a definir esa relación entre el huésped y el parásito, en términos ecológicos. Sin embargo, los límites epistemológicos del conocimiento biomédico, en el cual lo más generalizado es pensar que todo parásito es un patógeno potencial que hay que destruir y, específicamente, en enfermedades como la malaria en las cuales se han podido evidenciar las causas y factores que la provocan en un escenario histórico determinado, han ignorado los aportes de áreas como la ecología, la biología molecular, la evolución y la inmunología para entenderla como un complejo sistemas de interrelaciones y construir desde ahí un nuevo paradigma para la enfermedad.
Son estas razones las que permiten afirmar que la explicación causal de la malaria hoy, en el siglo XXI, sigue basada en una única concepción de enfermedad infecciosa iniciada por Koch en el siglo XIX y respaldada por Charles Chapin en 1888, según informa Soper (8,65,66); y las prácticas para terminarla, como la de eliminación y erradicación, no introducen cambios sustanciales a las realizadas en los años 50 y continúan siendo producto de esa concepción de enfermar basada en la teoría microbiana, la misma que ha mostrado que se pierde la guerra emprendida para exterminar parásitos y vectores. Es así como se afirma la imposibilidad de eliminar la malaria porque ésta no es sólo un problema de saber, sino un problema de poder.
A Adolfo León González, por su acompañamiento en el trabajo sobre la historia de la malaria. A Adriana Pabón y Lía Palacio, miembros del Grupo Malaria de la Universidad de Antioquia, por su ayuda con la bibliografía.
La autora no manifiesta ningún tipo de conflicto de interés.
Este trabajo fue financiado por la Estrategia de Sostenibilidad 2009-2011, Universidad de Antioquia.
Correspondencia: Silvia Blair, Grupo Malaria, Universidad de Antioquia, Calle 62 N°52-59, Sede de Investigación Universitaria, torre 1, laboratorio 610, Medellín, Colombia Teléfono: (574) 219 6486; fax: (574) 210 6487 silviablair@gmail.com
1. Rey H. Plan para el control de la malaria en Colombia. Revista de la Facultad de Medicina de Bogotá. 1943;XI:442. [ Links ]
2. Najera JA. Malaria control achievements, problems & strategies. Geneva: WHO; 2009. p.32. [ Links ]
3. Laín Entralgo P. Historia universal de la Medicina. Barcelona: Salvat 1982. p.94-166. [ Links ]
4. Gilles H. Historical outline. In: Gilles DW, editor. Essential malariology. Euston Road, London: Arnold; 2002. p.1 -7. [ Links ]
5. Giordan A, Raichvarg D, Canay AM. La respiración, los microbios, el ecosistema, la neurona. Conceptos de biología. Barcelona: Ministerio de Educación y Ciencia; 1988. p.81. [ Links ]
6. Blair S. Formación del discurso de la parasitología. Concepto hospedero parásito, caso especifíco: la malaria, 1940-1990 en Colombia. Medellin: Universidad Nacional de Colombia; 2006. [ Links ]
7. López T. Historia de la Escuela de Malariología y Saneamiento Ambiental de Venezuela. Dirección General de Malariología y Saneamiento Ambiental, Ministerio de Sanidad y Asistencia Social. Caracas: Imprenta de la Universidad Central; 1987. p.55. [ Links ]
8. Franco S. El paludismo en América Latina. Jalisco: Universidad de Guadalajara; 1990. p.133. [ Links ]
9. Hernández M, Obregón D, Miranda N. La Organización Panamericana de la Salud y el estado colombiano: cien años de historia 1902-2002. Bogotá: OPS; 2002. p.442. [ Links ]
10. Quevedo E. Café y gusanos, mosquitos y petróleo. El tránsito desde la higiene hacia la medicina tropical y la salud pública en Colombia, 1873-1953. Bogotá: Universidad Nacional de Colombia/ Instituto de Salud Pública/Centro de Historia de la Medicina; 2004. p.12. [ Links ]
11. World Health Organization. Report on development of malaria erradication Programme. Provisional minutes of the third meeting, Commitee on Programme and Budget. Geneva: WHO; 1963. [ Links ]
12. World Health Organization. Expert Committee on Malaria. Fourteenth Report. Geneva: WHO; 1968. [ Links ]
13. World Health Organization. Malaria control strategy. Report by the Director General. Geneva: WHO; 1978. [ Links ]
14. World Health Organization. Global malaria control and elimination: report of technical review. Geneva: WHO; 2008. [ Links ]
15. World Health Organization. World malaria report. Geneva: WHO; 2010. p.190. [ Links ]
16. Panamerican Health Organization. Roll back malaria. Key malaria facts. 2010, Fecha de consulta: 3 de septiembre de 2010. Disponible en: http:/www.rolbackmalaria.org/gmap/toc.pdf. [ Links ]
17. World Health Organization. New perspectives: Malaria diagnosis. Report of a join WHO/USAID informal consultation 25-27 october 1999. Geneva: WHO; 2000. [ Links ]
18. World Health Organization. Malaria rapid diagnostics test performance- results of WHO products testing of malaria RDTs: Round 1. Geneva: WHO; 2008. p.97. [ Links ]
19. Mendoza NM, García M, Cortés LJ, Vela C, Erazo R, Perez P, et al. Evaluation of two rapid diagnostic tests, NOW ICT Malaria Pf/Pv and OptiMAL, for diagnosis of malaria. Biomédica. 2007;27:571-80. [ Links ]
20. Panamerican Health Organization. Basic Health Indicator Data Base: Colombia. 2008. Fecha de consulta: 3 de septiembre de 2010. Disponible en: http://www.paho.org/English/DD/AIS/cp_170.htm. [ Links ]
21. Instituto Nacional de Salud. Boletín Epidemiológico semana 51. Bogotá 2009 Fecha de consulta: 15 de agosto de 2007. Disponible en: http://www.ins.gov.co/?idcategoria=5694#. [ Links ] [ Links ]
23. Padilla JC, Piñeros JG. Epidemiología de la malaria en Colombia. Bogotá: Ministerio de Salud, Instituto Nacional de Salud; 2001. [ Links ]
24. Giordan A, Raichvarg D, Canay AM. Conceptos de biología. Barcelona: Labor; 1988. p.65-9. [ Links ]
25. Goerke H. 3000 años de historia de la medicina. Barcelona: Gustavo Gil S; 1986. p.58. [ Links ]
26. Desowitz R. Milestones and milistone in the history of malaria. In: Perlman EM, editor. Malaria: molecular and clinical aspects. Amsterdam: Harwood Academic Publishers; 1999. p.1-15. [ Links ]
27. Harrison G. Mosquitoes malaria and man a history of the hostilities since 1880. New York: Dutton; 1978. [ Links ]
28. Bruce-Chwatt L. History of malaria from prehistory to eradication. In: Wernsdorfer WH, McGregor IS, editors. Malaria principles and practices of malariology. London: Churchill Livingstone; 1988. p.1-59. [ Links ]
29. Sinden R, Gillesm H. The malaria parasites. In: Warrell DA, Gilles HM, editors. Essential malariology. New York: Oxford Press; 2002. p.2-34. [ Links ]
30. Nocht B, Mayer M. El paludismo: su clínica, parasitología y los problemas de la lucha antipalúdica. Córdoba: El Ateneo; 1938. p.1-75. [ Links ]
31. Bispham WN Malaria: Its diagnosis, treatment and prophylaxis. Baltimore: Williams and Wilkins; 1944. p.30. [ Links ]
32. Manson S, editor. Tropical disease. Baltimore: Williams and Wilkins; 1972. p.59. [ Links ]
33. Garnham PC. Malaria parasites and other haemosporidia. Oxford: Black Well Scientific Publications; 1966. [ Links ]
34. Davies K. La conquista del genoma humano. Craig Venter, Francis Collins, James Watson y la historia del mayor descubrimiento científico de nuestra época. Barcelona: Paidós; 2001. p.355. [ Links ]
35. Young MD. Amodiaquine and hydroxychloroquine resistance in Plasmodium falciparum. Am J Trop Med Hyg. 1961;10:689-93. [ Links ]
36. Carter R, Kamini NM. Evolutionary and historical aspects of the burden of malaria. Clin Microbiol Rev. 2002;15:564-94. [ Links ]
37. Brunton L, Lazo J, Parker S. Las bases farmacológicas de la terapéutica. Undécima edición. Bogotá: Mc Graw Hill; 2006. p.1035. [ Links ]
38. Haynes RK. From artemisinin to new artemisinin antimalarials: Biosynthesis, extraction, old and new derivatives, stereochemistry and medicinal chemistry requirements. Curr Top Med Chem. 2006;6:509-37. [ Links ]
39. O´Neill PM, Barton VE, Ward SA. The molecular mechanism of action of artemisinin-the debate continues. Molecules. 2010;15:1705-21. [ Links ]
40. Gabaldón A. Problemas de población y la campaña contra la malaria. Revista Hall. 1956;5:39-47. [ Links ]
41. Restrepo F. Profilaxis del paludismo y de la fiebre recurrente. Medellín: Universidad de Antioquia; 1935. [ Links ]
42. Cuervo L. Profilaxia y tratamiento del paludismo. Londres: Bale J; 1926. p.1. [ Links ]
43. OMS. Serie de Informes técnicos número 123. Ginebra: WHO; 1957. [ Links ]
44. Soper F, Bruce W. Erradicacion de la especie: un objetivo práctico de la reducción de una especie en la lucha contra las enfermedades transmitidas por mosquitos. Washington, D.C.: OPS; 1972. p.319-36. [ Links ]
45. Soper FL. Proyectos nacionales de erradicación de la malaria en las Américas. V Principios generales de los programas de erradicación en el hemisferio occidental. Washington, D.C.: OPS; 1972. p.505-16. [ Links ]
46. World Health Organization. Terminología del paludismo y de la erradicación del paludismo. Geneva: WHO; 1964. p.33. [ Links ]
47. Pinotti M. Paludismo. Método de Pinotti. Revista Kuba de Medicina Tropical. 1959;15:43. [ Links ]
48. OPS/OMS. Malaria en las Américas. Análisis crítico. Presentación del Programa de Enfermedades Transmisibles a la XVIII Reunión del Comité de Expertos de la OMS en Paludismo. Ginebra: WHO; 1985. p. 60. [ Links ]
49. Farid MA. El programa antipalúdico: de la euforia a la anarquía. Foro Mundial de la Salud. 1980;(1-2):1-22. [ Links ]
50. Foucault M. Hacer vivir y dejar morir. La guerra como racismo. Revista Fin de Siglo. 1991;1:19. [ Links ]
51. OMS. Aplicación de la estrategia mundial de lucha contra el paludismo. Informe Grupo de Estudios de la OMS sobre la aplicación del Plan Mundial de Acción de Lucha Contra el Paludismo 1993-2000. Ginebra: WHO; 1993. p. 61. [ Links ]
52. Jiménez M, Hinestroza J, Gómez R. Reformas sanitarias e impacto del control de malaria en dos áreas endémicas de Colombia 1982-2004. Colombia Médica. 2007;38:13-131. [ Links ]
53. Cano E. Boletín de la cátedra abierta: reforma de los servicios de salud en el mundo 1998-2002. Medellín: Universidad de Antioquia; 1999. p. 3. [ Links ]
54. OMS. Eliminación de la malaria OMS. Manual de terreno para países endémicos de moderada y baja transmisión. Malaria en las Américas. Ginebra: WHO; 2007. [ Links ]
55. OPS. Guía para la reorientación de los programas de control de la malaria con miras a la eliminación. Fecha de consulta: 8 de julio de 2011. Disponible en http://www.usaidami.com/extras/Guia_para_la_reorientacion_control_malaria_revisada.pdf. [ Links ]
56. Cohen JM, Moonen B, Snow RW, Smith DL. How absolute is zero? An evaluation of historical and current definitions of malaria elimination. Malar J. 2010;9:213. [ Links ]
57. World Health Organization. Malaria elimination: A field manual for low and moderate endemic countries. Geneva: WHO; 2011. Fecha de consulta: 22 abril de 2011. Disponible en: http://whqlibdoc.who.int/publications/2007/9789241596084_eng.pdf [ Links ]
58. Roll Back Malaria. The Global Malaria Action Plan: For a malaria free world. 2010. Fecha de consulta: 18 de septiembre de 2010. Disponible en: http:/www.rolbackmalaria.org/gmap/toc.pdf . [ Links ]
59. Alonso PL, Brown G, Arévalo-Herrera M, Binka F, Chitnis C. A research agenda to underpin malaria erradication. Plos Med. 2011;8:e1000406. [ Links ]
60. Das P, Horton R. Malaria elimination: Worthy, challenging, and just possible. Lancet. 2010;376:1515-7. [ Links ]
61. Feachem RG, Phillips AA, Hwang J, Cotter C, Wielgosz B, Greenwood BM, et al. Shrinking the malaria map: Progress and prospects. Lancet. 2010;376:1566-78. [ Links ]
62. Delacollette C, Rietveld A. WHO GMP-Informal consultation on malaria elimination: Setting up the WHO agenda. Tunis: WHO; 2006. Fecha de consulta: 5 de abril de 2011. Disponible en: http://whqlibdoc.who.int/hq/2006/WHO_HTM_MAL_2006.1114_eng.pdf. [ Links ]
63. Dowdle W. The principles of disease elimination and eradication. Bull World Health Organ. 1998;76:22-5. [ Links ]
64. World Health Organization. World Malaria Report. Geneva: WHO; 2009. [ Links ]
65. Castañeda AM, Daza C. Niveles de parasitemia por Plasmodium falciparum y algunos factores relacionados: Urabá y Bajo Cauca, Departamento de Antioquia 1988-1989 (tesis). Medellín: Universidad de Antioquia; 1990. [ Links ]
66. Soper F. La erradicación y el control en la prevención de enfermedades transmisibles. Washington D.C.: OPS; 1972. p. 349. [ Links ]














