Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157
Biomédica vol.33 no.3 Bogotá jul./set. 2013
https://doi.org/10.7705/biomedica.v33i3.780
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v33i3.780
1 Grupo de Investigaciones Biomédicas, Universidad de Sucre, Sincelejo, Colombia
2 Doctorado en Medicina Tropical, SUE-Caribe, Cartagena, Colombia
Recibido: 26/07/12; aceptado:03/04/13
Introducción. Aunque el perro se considera el principal reservorio doméstico de Leishmania infantum en varios países de Latinoamérica, se desconocen las tasas de infección por parásitos del género Leishmania en perros de algunos focos de leishmaniasis visceral del norte de Colombia.
Objetivo. Establecer las tasas de infección por Leishmania spp. en poblaciones caninas del departamento de Sucre en el norte de Colombia.
Materiales y métodos. Se estudiaron perros de zonas rurales de los municipios de Sincelejo, Sampués y Ovejas. Los parásitos del género Leishmania se detectaron mediante la amplificación de un segmento de ADN de la subunidad ribosómica pequeña (rSSU). Se analizó la relación entre variables como sexo, grupos etarios y presencia de signos clínicos, respecto a la infección por Leishmania .
Resultados. Se amplificó un fragmento de 561 pb de la rSSU de Leishmania spp. en 34,9 % (29/83), 35,7 % (15/42) y 11,1 % (1/9) de los perros analizados de Sincelejo, Sampués y Ovejas, respectivamente. La prevalencia total de infección por Leishmania spp. fue de 33,6 %. En dos perros de Sincelejo, dos de Sampués y uno de Ovejas, se obtuvo una banda de 650 pb, característica de parásitos del género Trypanosoma . El 64,2 % de los perros que mostraron al menos un signo clínico indicativo de leishmaniasis canina, fue positivo por PCR. Se halló una relación estadísticamente significativa entre los perros mayores de 33 meses de edad y el resultado positivo para Leishmania spp. (p=0,043). No se encontró relación entre el sexo del perro y el resultado positivo para Leishmania spp. (p=0,85) .
Conclusión. Un tercio de la población canina analizada se encontró infectada con parásitos del género Leishmania , lo cual podría sustentar su posible papel como fuente de infección para el insecto vector.
Palabras clave: Leishmania , perros, epidemiología, Colombia.
doi: http://dx.doi.org/10.7705/biomedica.v33i3.780
High prevalence of infection with Leishmania (Kinetoplastea: Trypanosomatidae) in dogs in northern Colombia
Introduction: Although the dog is considered to be the main domestic reservoir of Leishmania infantum in several Latin American countries, the rate of infection with Leishmania parasites remains unknown in dogs from foci of visceral leishmaniasis of northern of Colombia.
Objetive: To determine the prevalence of Leishmania infection in canine population from department of Sucre in northern Colombia.
Materials and methods: The canine population of rural areas of the municipalities of Sincelejo, Sampués and Ovejas was studied. Parasites of the genus Leishmania were detected by amplifying a DNA segment of the small ribosomal subunit (rSSU). The relationship among sex, age group and clinical signs with infection by Leishmania was analyzed.
Results: A 561 bp fragment of the Leishmania rSSU was amplified in 34.9% (29/83), 35.7% (15/42) and 11.1% (1/9) of the dogs analyzed from Sincelejo, Sampués and Ovejas, respectively. Overall prevalence of Leishmania infection was 33.6%. A 650 bp band, characteristic of parasites of the genus Trypanosoma, was amplified in two dogs from Sincelejo and Sampués and in one dog from Ovejas. The 64.2% of the dogs that showed clinical signs compatible with canine leishmaniasis, was PCRpositive. A statistically significant relationship was found between dogs over 33 months old and positivity to Leishmania (p=0.043). No relationship was observed between sex and positivity to Leishmania (p=0.85) .
Conclusion: A third of the canine population studied is infected with Leishmania , which could support its potential role as a source of infection for the insect vector.
Keywords: Leishmania , dogs, epidemiology, Colombia.
doi: http://dx.doi.org/10.7705/biomedica.v33i3.780
La leishmaniasis es un grupo de enfermedades causadas por la infección con parásitos protozoos del género Leishmania Ross, 1903, de la familia Trypanosomatidae Doflein, 1901. Se estima que 350 millones de personas están en riesgo de infectarse con el parásito (1). La leishmaniasis visceral es la forma clínica más grave de la enfermedad y es letal cuando no se trata a tiempo. Esta infección es causada por parásitos pertenecientes al complejo Leishmania donovani (Laveran y Mesnil, 1903), entre los cuales, Le. donovani es causante de leishmaniasis visceral en Europa, África y Asia, mientras que Le. infantum Nicolle, 1908, causa la enfermedad tanto en América como en Europa (2).
En Colombia, los focos de leishmaniasis visceral se encuentran distribuidos a lo largo de la cuenca del río Magdalena y sus afluentes, en los departamentos de Huila, Tolima, Cundinamarca, Santander, Córdoba, Bolívar y Sucre (3). Los dos últimos departamentos han constituido históricamente el foco de leishmaniasis visceral humana más importante del país (4).
En varios países de América Latina el perro seconsidera el principal reservorio doméstico de Le.infantum (5,6). En focos endémicos de la CostaCaribe colombiana, donde se presenta anualmenteel mayor número de casos de leishmaniasisvisceral humana del país, se ha reportado unaalta prevalencia de la enfermedad en perros,con tasas de hasta el 36 % con la prueba deinmunofluorescencia indirecta (IFI) y del 17,24 %por reacción en cadena de la polimerasa (PCR)(7,8). En los departamentos de Huila y Tolima laseroprevalencia varía entre 5,1 y 50,2 % (9,10).
En Colombia, Didelphis marsupialis también seconsidera como un importante reservorio de Le.infantum , con tasas de infección que alcanzan el32,4 % en el foco de transmisión de Cundinamarca(11), mientras que en la Costa Caribe varían entre9,5 y 23 % (3,12). El comportamiento nómada yla dieta omnívora de estos mamíferos promuevensu capacidad de vivir en estrecha asociación conhumanos, por lo que se convierten en una fuentefrecuente de parásitos para los insectos vectoresque habitan en ambientes peridomésticos. Proechimysconicollis también se ha encontrado infectado con Le. infantum en focos de la Costa Caribe, con tasasde 8,8 % (3).
La detección de Leishmania spp. en el examenmicroscópico directo requiere de un considerablegrado de experiencia para distinguir los amastigotesen el interior de la célula huésped, mientras quelas técnicas serológicas proveen una herramientaútil en la vigilancia del contacto entre Leishmania yperros, pero no permiten diferenciar entre infecciónactiva e infecciones pasadas (13).
Actualmente, la PCR ha permitido una mejoraimportante en el diagnóstico de esta parasitosisy en el conocimiento de aspectos importantesde la interacción entre el parásito y el reservorio(3). La sensibilidad de la PCR suele ser alta encomparación con otras técnicas, aunque dependede las características de la región genómica diana. Esta sensibilidad puede incrementarse mediante el uso de cebadores dirigidos a secuencias multicopias como secuencias repetitivas nucleares y del cinetoplasto (14,15), así como a las familias génicas multicopias (16).
A esta última categoría pertenece la subunidad ribosómica pequeña ( Small Ribosomal Subunit , rSSU), gen codificante del ARN ribosómico 18S, que es la secuencia mejor estudiada tanto en metazoarios como en protozoarios (17) y posee cerca de 166 copias por genoma haploide en Le. donovani , equivalente al 0,82 % del ADN haploide total, características que la convierten en un objetivo apropiado para la amplificación de ADN (18,19).
El perro puede utilizarse como indicador biológico para determinar el carácter endémico real de la leishmaniasis en una zona bajo estudio, debido al contacto cercano que tiene con los reservorios silvestres de Leishmania y los humanos, y a que tiene fácil acceso a los microhábitats de los vectores de esta enfermedad (20).
Considerando estas razones y teniendo en cuenta que son escasos los estudios de leishmaniasis canina en la costa norte de Colombia, el objetivo del presente estudio fue establecer la prevalencia de la infección por Leishmania spp. en perros de áreas rurales del departamento de Sucre, Colombia.
Materiales y métodos
Áreas de estudio
El trabajo se desarrolló en el área rural del departamento de Sucre, en los corregimientos de Sabanas del Potrero (municipio de Sincelejo) y Escobar Arriba (municipio de Sampués), y la vereda El Campín del corregimiento El Floral (municipio de Ovejas), que fueron seleccionados teniendo en cuenta los registros de casos de leishmaniasis visceral (Secretaría de Salud de Sucre, datos sin publicar). La búsqueda activa de perros en las zonas de estudio, se realizó entre agosto y diciembre del año 2006 mediante visita a todas las viviendas de las tres localidades analizadas. Sólo se tomaron muestras y datos clínicos de aquellos animales cuyos propietarios lo autorizaron.
Obtención de muestras biológicas y recolección de datos
Se obtuvieron 5 ml de sangre periférica por punción de la vena braquial, se transfirieron a tubos con EDTA y se transportaron hasta el Laboratorio de Investigaciones Biomédicas de la Universidad de Sucre, donde se almacenaron a -20 °C hasta la extracción de ADN. Se registraron los datos básicos de cada animal incluido en el trabajo, como edad en meses, sexo y signos clínicos indicativos de leishmaniasis canina, como caquexia, onicogrifosis, alopecia y lesiones cutáneas.
Extracción de ADN genómico
El ADN genómico se extrajo siguiendo un protocolo de altas concentraciones de sales y proteinasa K, descrito brevemente a continuación. Un volumen de 500 µl de sangre se centrifugó a 12.000 rpm durante 10 minutos a 4 °C. El precipitado obtenido se incubó con 495 µl de solución tampón de lisis celular (Tris 10 mM, EDTA 1 mM, SDS 1 %) durante 10 minutos; luego se adicionaron 5 µl de proteinasa K (200 mg/ml) y se incubó a 65 °C durante una hora; después se inactivo la proteasa a 97 °C durante cinco minutos. Las muestras se centrifugaron nuevamente, durante 10 minutos a 12.000 rpm y 4 °C, y el sobrenadante se transfirió a un microtubo y se incubó con 500 µl de acetato de potasio 5 M a -20 °C durante 15 minutos. Al sobrenadante obtenido mediante una nueva centrifugación de la mezcla, durante 10 minutos a 12.000 rpm y 4 °C, se le adicionaron 0,6 volúmenes de isopropanol y se incubó a -20 °C durante toda la noche. El precipitado de ácidos nucleicos totales se lavó con etanol al 70 % por centrifugación, durante cinco minutos a 12.000 rpm y 4 °C, se secó y finalmente se volvió a suspender en 50 µl de agua ultrapura.
Amplificación de ADN de Leishmania
La detección de parásitos del género Leishmania se llevó a cabo mediante la amplificación de un fragmento del ADN de la rSSU de la familia Trypanosomatidae, con cebadores que amplifican una región de aproximadamente 561 pb del ADN ribosómico en Leishmania (16,21) (cuadro 1, figura 1). La organización estructural de los genes ribosómicos nucleares es común a todas las especies del género Leishmania , incluidas las del Nuevo Mundo (16) (figura 1). En la determinación de la infección natural de los perros con Leishmania spp., se incluyó ADN de Le. infantum (MHOM /FR / 91 / LEM 2259) como control positivo y agua como control negativo, utilizando el siguiente perfil térmico: desnaturalización inicial a 94 °C durante cinco minutos, seguida por 35 ciclos de desnaturalización a 94 °C, alineamiento a 54 °C y extensión a 72 °C, cada paso durante un minuto, seguida por una etapa de extensión final a 72 °C durante cinco minutos.


Electroforesis en gel de agarosa y análisis de imágenes
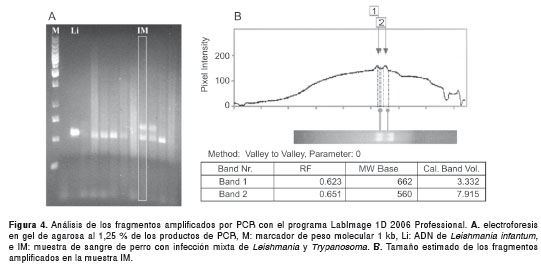
Los productos de amplificación de la PCR se sometieron a electroforesis en geles de agarosa al 1,25 % con solución tampón TBE 0,5X durante 60 minutos a 9,5 V/cm, con previa adición de bromuro de etidio, y luego se visualizaron por exposición de los geles a luz ultravioleta de onda corta (254 nm). Durante cada electroforesis se corrieron los controles positivos y negativos, así como también un marcador de peso molecular, para facilitar la estimación del tamaño del producto de PCR amplificado, con el programa para análisis de electroforesis LabImage 1D 2006. Con este programa se analizó el tamaño de los fragmentos amplificados por PCR, de acuerdo con el criterio Running Front (RF) ajustado para la migración de fragmentos y con una curva de masa molecular de tipo cuadrático. Las muestras se consideraron positivas para Leishmania spp. cuando se detectó un fragmento de aproximadamente 560 pb.
Análisis estadístico
Los datos obtenidos durante el desarrollo del estudio se tabularon y procesaron para llevar a cabo un análisis estadístico descriptivo de las características generales de la población canina bajo estudio. Las clases o categorías se calcularon usando los criterios de la regla de Sturges. Los cálculos de prevalencia de la infección se computaron por localidad; para el departamento de Sucre se consideraron intervalos de confianza de 95 % (IC95%). La relación del resultado positivo para Leishmania spp. con el sexo, los grupos etarios y los signos clínicos de leishmaniasis canina, se analizó mediante el test exacto de Fisher con el programa GraphPad Instat (GraphPad Software).
Aspectos éticos
La muestra de sangre periférica se obtuvo con el consentimiento previo de los propietarios de los perros. Todos los procedimientos fueron avalados por el Comité de Bioética de la Universidad de Sucre.
Resultados
Características de la población canina
La población canina incluida en el estudio estuvo constituida por 134 perros, 83 de ellos pertenecientes al municipio de Sincelejo, 42 al municipio de Sampués y 9 del municipio de Ovejas. El 41,8 % de los animales eran hembras y el 58,2 % restante, machos. La mayor parte de la población canina estuvo conformada por perros mestizos jóvenes (figura 2), que cumplían la función de guardianes de las viviendas, por lo que eran mantenidos fuera de ellas durante la noche.
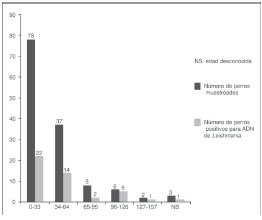
Prevalencia de infección por Leishmania spp.
Para el diagnóstico molecular de Leishmania spp. en perros a partir del ADN extraído de sangre periférica, fue necesario el uso de 1,5 U de Taq DNA polimerasa para obtener el producto de amplificación y garantizar la reproducibilidad del ensayo; las cantidades de Taq polimerasa inferiores a esta no generaron productos de amplificación. Una vez estandarizada la PCR, fue posible amplificar un fragmento de, aproximadamente, 560 pb correspondiente a la rSSU de Leishmania spp. en 29/83 (34,9 %), 15/42 (35,7 %) y 1/9 (11,1 %) de los perros analizados en los municipios de Sincelejo, Sampués y Ovejas, respectivamente. Se presentó una prevalencia total de infección por Leishmania spp. del 33,6 % (45/134; IC95%: 25,2-41,9) en los animales analizados.
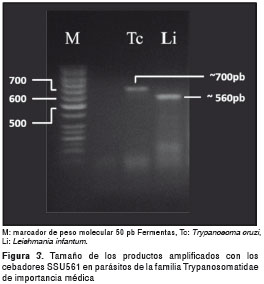
Los cebadores SSU561 amplificaron una banda de 650 pb, aproximadamente, en algunos perros de las tres localidades. Estas bandas se observaron en dos perros de Sincelejo y en dos de Sampués, mientras que en un perro de Ovejas sólo se presentó la banda de mayor peso molecular (figura 3 y figura 4). Con el programa LabImage 1D se determinó que el tamaño de la banda más grande correspondía a lo esperado para especies del género Trypanosoma (superior a los 630 pb), las cuales poseen el fragmento de mayor peso molecular entre los parásitos de la familia Trypanosomatidae cuando se realiza la PCR con estos cebadores (figura 3).
Relación del resultado positivo para Leishmania con la sintomatología de leishmaniasis, la edad y el sexo de los perros
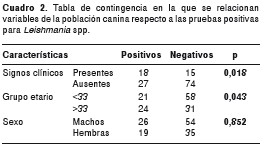
El análisis de los datos de sintomatología indicativa de leishmaniasis canina respecto al resultado positivo para Leishmania spp., demostró que la presencia de signos clínicos no está relacionada de forma directa con la infección por Leishmania spp.; de hecho, existe una mayor probabilidad de encontrar individuos positivos para Leishmania spp. y asintomáticos (p=0,018). El 20,9 % (28/134) de los perros estudiados presentó, al menos, un signo clínico de leishmaniasis visceral canina; los más prevalentes fueron caquexia (22,2 %), onicogrifosis (20 %), alopecia (11,1 %) y, en menor medida lesiones cutáneas (8,8 %). En el 64,3 % (18/28) de los perros sintomáticos se detectó ADN de Leishmania spp.
El 45,6 % de la población positiva estaba entre los 3 y los 33 meses de edad. Debido a que la mayor parte de la población canina pertenecía a ese intervalo etario, se evaluó si existía diferencia estadística entre este grupo compuesto de población juvenil y los grupos etarios mayores (intervalos de 34 a 64, 65 a 95, 96 a 126 y 127 a 157 meses); este análisis permitió hallar una relación estadísticamente significativa entre los perros mayores de 33 meses de edad y la infección por Leishmania spp. (p=0,043), mientras que no existió ningún tipo de relación aparente entre el sexo y la infección por Leishmania spp. (p=0,85) (cuadro 2).
Discusión
Los resultados del presente estudio demuestran que el 33,6 % de la población canina analizada, que habita en áreas del departamento de Sucre donde la leishmaniasis es endémica, padece la infección con parásitos del género Leishmania . Esto se podría atribuir a que los perros residentes en estas zonas rurales permanecen la mayor parte del tiempo en el exterior de las viviendas, principalmente durante la noche, debido al papel que cumplen como guardianes de cultivos y de animales domésticos. Este comportamiento podría explicar el alto porcentaje de perros positivos con diagnóstico mediante PCR de la rSSU, los cuales se encuentran permanentemente expuestos a la picadura del insecto vector, Lutzomyia evansi , que exhibe grandes densidades peridomiciliarias, con un horario de actividad crepuscular que se inicia a las 18:00 horas y se extiende hasta las 06:00 horas (22,23).
Aunque varios animales positivos para Leishmania presentaron uno o más signos clínicos de la enfermedad, el mayor porcentaje de estos fue asintomático. Se han encontrado resultados similares en otros países, lo que indica que la mayoría de la población canina de áreas endémicas para la enfermedad permanece asintomática (24). Esta condición de aparente resistencia podría estar relacionada con el desarrollo de una respuesta inmunitaria protectora que permite el control de la infección en el animal o con un alto grado de infecciones subclínicas (25). Por otro lado, la existencia de perros negativos pero con signos clínicos característicos de leishmaniasis canina, puede deberse al mimetismo de esta parasitosis con infecciones como ehrlichiosis o a alteraciones inmunológicas (24,26), lo que pone en evidencia que el cuadro clínico de la enfermedad es insuficiente para establecer un diagnóstico confiable.
Son escasos los estudios de leishmaniasis canina desarrollados a la fecha en el departamento de Sucre (7,27,28), a pesar de constituir uno de los focos de la enfermedad más importantes del país. Las seroprevalencias registradas previamente en el municipio de Ovejas, van desde 3,8 hasta 9,6 % por IFI (27). Asimismo, mediante la técnica ELISA se encontró una seroprevalencia del 23,3 % de leishmaniasis canina en la zona de los Montes de María, incluido el municipio de Ovejas, mientras que en el resto del departamento de Sucre el procentaje de seropositivos osciló entre 1,9 y 5 % (28). En el único estudio de detección de Leishmania spp. En caninos de Sucre, llevado a cabo en el municipio de Sampués, se informaron prevalencias de infección entre 10 y 17,24 % mediante PCR (7). En su conjunto, estos hallazgos contrastan con las prevalencias de infección encontradas en el presente estudio, que alcanzaron valores de hasta 35,7 %, sin desconocer las diferencias en la sensibilidad y especificidad de cada técnica, y en el número de perros muestreados.
Hasta la fecha, no existían estudios de leishmaniasis canina en Sincelejo, a pesar del registro de casos humanos de la enfermedad, aunque en menor proporción que en otras zonas del departamento (4,22). Sin embargo, la prevalencia detectada en caninos de este último municipio es tan alta como la que se presenta en Sampués (7). Por otra parte, la baja prevalencia de Leishmania spp. en perros de Ovejas se puede atribuir al escaso número de animales analizados en esta zona, que correspondió a toda la población canina de la vereda El Campín, donde ocurrió un caso de leishmaniasis visceral humana (Secretaría de Salud de Sucre, datos sin publicar).
Además de la infección por parásitos del género Leishmania , se pudo detectar la presencia de otros parásitos de la familia Trypanosomatidae que afectan la población canina de las localidades estudiadas. Por el tamaño diferencial que exhiben los fragmentos amplificados (figura 3), se presume que estos parásitos pertenecen al género Trypanosoma , con lo que se establecería por primera vez para la Costa Caribe colombiana la infección mixta de Leishmania - Trypanosoma en perros. Este hallazgo se suma a la previa detección en la zona de triatomínos reconocidos como vectores de los parásitos causantes de la enfermedad de Chagas (29). La alta tasa de infección por Leishmania spp. en perros (33,6 %) de áreas rurales del departamento de Sucre, es indiscutiblemente una de las mayores tasas de prevalencia de leishmaniasis canina en el país (9,27) e indica un progresivo incremento de la infección en perros de esta región como una probable consecuencia de la escasa efectividad de las medidas hasta ahora implementadas para su control, como la eliminación de perros seropositivos (30).
El reciente hallazgo en Colombia de perros infectados con especies de Leishmania causantes de la forma cutánea, como Le . mexicana Biagi, 1953 (31), Le . guyanensis Floch, 1954 (32), Le . braziliensis Vianna, 1911, y Le. Panamensis Lainson y Shaw, 1972 (33), así como la coexistencia de leishmaniasis visceral y cutánea en los tres municipios analizados (34), ponen de manifiesto la necesidad de realizar estudios adicionales para establecer la especie de Leishmania que infecta a los perros en esta región y precisar el papel de estos como fuente de infección para el insecto vector.
A la entomóloga Suljey Cochero de la Secretaría de Salud de Sucre.
Ninguno.
Este estudio recibió el apoyo financiero de la División de Investigación de la Universidad de Sucre.
Correspondencia:
Margaret Paternina-Gómez, Centro de Diagnóstico Médico, Universidad de Sucre, Carrera 14 N° 16B-32, apartado aéreo 406, Sincelejo, Colombia. Teléfono: (575) 282 0830; fax: (575) 282 1240 margaretpaternina@gmail.com
1. World Health Organization. Control of the leishmaniases. Technical Report Series, 949. Geneva: WHO; 2010. p. 186. [ Links ]
2. Pearson RD, Sousa AQ. Clinical spectrum of leishmaniasis. Clin Infect Dis. 1996;22:1-13. http://dx.doi.org/10.1093/clinids/22.1.1 [ Links ]
3. Travi BL, Osorio Y, Becerra MT, Adler GH. Dynamic of Leishmania chagasi infection in small mammals of the undisturbed and degraded tropical dry forests of northern Colombia. Trans R Soc Trop Med Hyg. 1998;92:275-8. [ Links ]
4. Zambrano P. Informe de leishmaniasis, Colombia semanas 1 a 52 de 2005. Inf Quinc Epidemiol Nac. 2006;11:40-3. [ Links ]
5. Dantas-Torres F, Brandao-Filho SP. Visceral leishmaniasis in Brazil: Revisiting paradigms of epidemiology and control. Rev Inst Med Trop Sao Paulo. 2006;48:151-6. http://dx.doi.org/10.1590/S0036-46652006000300007 [ Links ]
6. Dantas-Torres F. The rol of dogs as reservoirs of Leishmania parasites, with emphasis on Leishmania ( Leishmania ) infantum and Leishmania ( Viannia ) braziliensis . Vet Parasitol. 2007;149:139-46. http://dx.doi.org/10.1016/j.vetpar.2007.07.007 [ Links ]
7. Rivero M. Identificación de Leishmania chagasi en Canis familiaris en un foco de los Montes de María (tesis). Sincelejo: Universidad de Sucre; 2003. [ Links ]
8. Cortés LA. Foco de leishmaniasis en El Hobo, municipio del Carmen de Bolívar, Bolívar, Colombia. Biomédica. 2006;26(Supl.1):236-41. [ Links ]
9. Romero M, López M, Echeverry C, Rivas F. Leishmaniasis visceral canina: pruebas diagnósticas no identifican estados reales de la infección. Rev Salud Pública. 2008;10:290-8. [ Links ]
10. Fernández J, Bello F, López M, Moncada L, Vargas J, Ayala M, et al . Seroprevalencia de leishmaniasis visceral canina en la comuna 8 de Neiva y en cuatro municipios de Huila, Colombia. Biomédica. 2006;26(Supl.1):121-30. [ Links ]
11. Corredor A, Gallego J, Tesh R, Morales A, Ferro C, Young D, et al . Epidemiology of visceral leishmaniasis in Colombia. Am J Trop Med Hyg. 1989;40:480-6. [ Links ]
12. Vélez I, Travi B, Gallego J, Palma G, Agudelo S, Montoya J, et al . Evaluación ecoepidemiológica de la leishmaniasis visceral en la comunidad indígena Zenú de San Andrés de Sotavento, Córdoba: primer paso para su control. Rev Col Entomol. 1995;2:111-22. [ Links ]
13. Pinelli E, Killick-Kendrick R, Wagenaar J, Bernadina W, Del Real G, Ruitenberg J . Cellular and humoral immune responses in dogs experimentally and naturally infected with Leishmania infantum . Infect Immun. 1994;62:229-35. [ Links ]
14. Fernandes O, Murthy V, Kurath U, Degrave W, Campbell D. Mini-exon gene variation in human pathogenic Leishmania species. Mol Biochem Parasitol. 1994;66:261-71. http://dx.doi.org/10.1016/0166-6851(94)90153-8 [ Links ]
15. Cupolillo E, Grimaldi JG, Mamen H, Beverley SM. Intergenic region typing (IRT): A rapid molecular approach to the characterization and evolution of Leishmania . Mol Biochem Parasitol. 1995;73:145-55. http://dx.doi.org/10.1016/0166-6851(95)00108-D [ Links ]
16. Noyes H, Pérez A, Chance M. Leishmania herreri (Kinetoplastida; Trypanosomatidae) is more closely related to Endotrypanum (Kinetoplastida: Trypanosomatidae) than to Leishmania . Mol Biochem Parasitol. 1996;80:119-23. http://dx.doi.org/10.1016/0166-6851(96)02679-5, [ Links ]
17. Dams E, Hendriks L, van de Peer Y, Neefs JM, Smits G, Vandenbempt I, et al . Compilation of small ribosomal subunit RNA sequences. Nucleic Acids Res. 1988;16(Suppl.1):87-173. [ Links ]
18. Leon W, Fouts DL, Manning J . Sequence arrangement of the 16S and 26S rRNA genes in the pathogenic haemoflagellate Leishmania donovani . Nucleic Acids Res. 1978;5:491-503. [ Links ]
19. van Eys G, Schoone GJ, Kroon NC, Ebeling SB. Sequence analysis of small subunit ribosomal RNA genes and its use for detection and identification of Leishmania parasites. Mol Biochem Parasitol. 1992;51:133-42. http://dx.doi.org/10.1016/0166-6851(92)90208-2 [ Links ]
20. Harith AE, Slappendel RJ, Reiter I, van Knapen F, de Korte P, Huigen E et al. Application of a direct agglutination test for detection of specific anti- Leishmania antibodies in the canine reservoir. J Clin Microbiol. 1989;27:2252-7. [ Links ]
21. Noyes HA, Stevens JR, Teixeira M, Phelan J, Holz P. A nested PCR for the ssrRNA gene detects Trypanosoma binneyi in the platypus and Trypanosoma sp. in wombats and kangaroos in Australia. Int J Parasitol. 1999;29:331-9. http://dx.doi.org/10.1016/S0020-7519(98)00167-2 [ Links ]
22. Bejarano EE, Uribe S, Rojas W, Vélez ID. Phlebotomine sand flies (Diptera: Psychodidae) associated with the appearance of urban Leishmaniasis in the city of Sincelejo, Colombia. Mem Inst Oswaldo Cruz. 2002;97:645-7. http://dx.doi.org/10.1590/S0074-02762002000500010 [ Links ]
23. Cochero S. Papel de Lutzomyia evansi (Diptera: Psychodidae) como vector de leishmaniasis visceral en un foco en los Montes de María (tesis). Sincelejo: Universidad de Sucre; 2002. [ Links ]
24. Ferrer LM. Clinical aspects of canine leishmaniasis. En: Killick-Kendrick R. Canine leishmaniasis: An update. Barcelona: Proceedings of a Canine Leishmaniasis Forum; 1999. p. 6-10. [ Links ]
25. Kramer L, Calvi LE, Grandi G. Immunity to Leishmania infantum in the dog: Resistance and disease. Vet Res Commun. 2006;30(Suppl.1):53-7. http://dx.doi.org/10.1007/s11259-006-0012-1 [ Links ]
26. De Sousa-Oliveira TM, Furuta PI, Carvalho D, Machado RZ. A study of cross-reactivity in serum samples from dogs positive for Leishmania sp., Babesia canis and Ehrlichia canis in enzyme-linked immunosorbent assay and indirect fluorescent antibody test. Rev Bras Parasitol Vet. 2008;17:7-11. [ Links ]
27. Bejarano E, Rivera CM. Recopilación de trabajos de investigación sobre zoonosis y áreas afines (tesis). Bogotá: Universidad de La Salle; 1996. [ Links ]
28. Le Pape P. Écoépidémiologie de la leishmaniose a Leishmania infantum = L. chagasi dans la plaine des caraïbes (Colombie): corrélation vecteur et réservoir canin. Montpellier: Université de Montpellier; 1992. [ Links ]
29. Guhl F, Aguilera G, Pinto N, Vergara D. Actualización de la distribución geográfica y ecoepidemiología de la fauna de triatominos (Reduviidae: Triatominae) en Colombia. Biomédica. 2007;27(Supl.1):143-62. [ Links ]
30. Moreira ED, Mendes de Souza VM, Sreenivasan M, Nascimento EG, Carvalho LP . Assessment of an optimized dog-culling program in the dynamics of canine Leishmania transmission. Vet Parasitol. 2004;122:245-52. [ Links ]
31. López-Céspedes A, Longoni S, Sauri-Arceo C, Sánchez-Moreno M, Rodríguez-Vivas E, Escobedo-Ortegón F, et al. Leishmania spp. epidemiology of canine leishmaniasis in the Yucatan Peninsula. Scientific World Journal. 2012; 945871. http://dx.doi.org/10.1100/2012/945871 [ Links ]
32. Santaella J, Ocampo C, Saravia N, Méndez F, Góngora R, Gomez M, et al. Leishmania ( Viannia ) infection in the domestic dog in Chaparral, Colombia Am J Trop Med Hyg . 2011;84:674-80. http://dx.doi.org/10.4269/ajtmh.2011.10-0159 [ Links ]
33. Vélez I, Carrillo L, López L, Rodríguez E, Robledo S. An epidemic outbreak of canine cutaneous leishmaniasis in Colombia caused by Leishmania braziliensis and Leishmania panamensis . Am J Trop Med Hyg. 2012;86:807-11. http://dx.doi.org/10.4269/ajtmh.2012.11-0408. [ Links ]
34. Martínez L, Rebollo J, Luna A, Cochero S, Bejarano E. Molecular identification of the parasites causing cutaneous leishmaniasis on the Caribbean coast of Colombia. Parasitol Res. 2010;106:647-52. http://dx.doi.org/10.1007/s00436-009-1712-6. [ Links ]













