Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157
Biomédica vol.33 no.4 Bogotá out./dez. 2013
https://doi.org/10.7705/biomedica.v33i4.1468
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v33i4.1468
1 Escuela de Bioanálisis, Facultad de Medicina, Universidad del Zulia, Maracaibo, Venezuela
2 Facultad de Salud, Programa de Microbiología, Universidad Popular del Cesar, Valledupar, Colombia
3 Laboratorio de Parasitología, Servicio Autónomo Hospital Universitario de Maracaibo (SAHUM), Maracaibo, Venezuela
4 Escuela de Medicina, Facultad de Medicina, Universidad del Zulia, Maracaibo, Venezuela
Institución donde se realizó la investigación: Laboratorio de Parasitología "Lic. Regino Arapé García" de la Universidad del Zulia Contribución de los autores:
Zulbey Rivero-Rodríguez: concepción y diseño de la investigación, análisis e interpretación de resultados, aprobación final de la versión.
Amparo Hernández: procesamiento de muestras y redacción del manuscrito.
Ángela Bracho: procesamiento de muestras y redacción del manuscrito.
Solneumar Salazar: procesamiento de muestras.
Rafael Villalobos: evaluación clínica de los pacientes y análisis e interpretación de los resultados.
Recibido: 20/11/12; aceptado:23/05/13
Introducción. Desde 1985, los microsporidios se consideran parásitos causantes de infecciones emergentes y oportunistas en individuos inmunocomprometidos en todo el mundo.
Objetivo. Detectar la presencia de microsporidios y otros enteroparásitos en pacientes con VIH/sida del Servicio Autónomo Hospital Universitario de Maracaibo (SAHUM), donde no existían estudios previos en este campo.
Materiales y métodos. Las muestras fecales se analizaron mediante examen directo, método de concentración con formol-éter, coloración de Kinyoun y coloración Gram-cromotropo rápida. Se realizaron PCR separadas para diferenciar Entamoeba histolytica o Entamoeba dispar , cuando se observó el complejo E. histolytica/dispar al microscopio. Mediante historia clínica se obtuvo información del paciente.
Resultados. De los 56 individuos participantes, 38 (67,86 %) presentaron alguna especie parasitaria comensal o patógena en su muestra fecal. Predominaron los individuos portadores de especies parásitas patógenas (26/38). Fueron diagnosticados protozoos como Isospora belli (17,65 %), Blastocystis spp .(17,65 %), Cryptosporidium spp. (7,84 %), complejo Entamoeba histolytica/dispar (5,88 %) , Entamoeba coli (3,92 %) , Giardia lamblia (3,92 %) , Endolimax nana (3,92 %) , Cyclospora cayetanensis (3,92 %) y Chilomastix mesnili (1,96 %). Entre los helmintos, Ascaris lumbricoides, Trichuris trichiura y Strongyloides stercoralis, presentaron un porcentaje de 27,27 % cada uno, e Hymenolepis nana , de 18,18 %. Solo se detectó E. histolytica en uno de los tres casos que presentaron el complejo al examen microscópico. Mediante Gram-cromotropo, 17 muestras evidenciaron esporas del filo Microsporidia, lo que equivale a un 33,33 % de prevalencia.
Conclusión. Los microsporidios pueden ocupar el primer lugar de prevalencia en pacientes con VIH positivo, cuando se utilizan técnicas diagnósticas específicas.
Palabras clave: microsporidios, VIH, síndrome de inmunodeficiencia adquirida, reacción en cadena de la polimerasa, prevalencia, infecciones oportunistas relacionadas con el sida, Venezuela.
doi: http://dx.doi.org/10.7705/biomedica.v33i4.1468
Prevalence of intestinal microsporidia and other intestinal parasites in hiv positive patients from Maracaibo, Venezuela.
Objective: To detect the presence of microsporidia and other enteric parasites in patients with HIVAIDS of the Autonomous Services University Hospital of Maracaibo (SAHUM), where there are no previous studies in this field.
Materials and methods: Fecal samples were analyzed by means of direct exam, concetration method with formal-ether, Kinyoun coloration and fast Gram-Chromotrope coloration. Separate PCR were perfomed to differentiate Entamoeba histolytica and Entamoeba dispar , when the E. histolytica/E. dispar complex was observed in the microscope. Information on the patient was obtained trough clinical history.
Results: Of 56 individuals that participated, 38 (67.86%) presented some commensal parasite and/ or pathogenic species in their fecal sample. Carriers of pathogenic species were predominat (26/38). Protozoa such as Isospora belli protozoa (17.65%), Blastocystis spp. (17.65%), Cryptosporidium spp. (7.84%), E. histolytica/E. dispar (5.88%), Entamoeba coli (3.92%), Giardia lamblia (3.92%), Endolimax nana (3.92%), Cyclospora cayetanensis (3.92%), and Chilomastix mesnilli (1.96%) were diagnosed. Among the helminths, Ascaris lumbricoides, Trichuris trichiura and Strongyloides stercoralis , had a percentage of 27.27% each, and Hymenolepis nana , 18.18%. Entamoeba histolytica was only detected in one of three cases presenting complex microscopic examination. By Gram-chromotrope, 17 samples showed spores of the Microsporidia phylum, equivalent to 33.33% prevalence.
Conclusion: Microsporidia may be first prevalente in HIV positive patients when specific diagnostic techniques are used.
Key words: Microsporidia, HIV, acquired immunodeficiency syndrome, polymerase chain reaction, prevalence, AIDS-related opportunistic infections, Venezuela.
doi: http://dx.doi.org/10.7705/biomedica.v33i4.1468
Desde 1985, los microsporidios se consideran como agentes causales de infecciones emergentes y oportunistas en individuos inmunocomprometidos en todo el mundo. Se han detectado en pacientes con el síndrome de inmunodeficiencia adquirida, asociados a diarrea y enfermedad sistémica. (1). Este grupo de microorganismos ha sido tradicionalmente conflictivo en cuanto a su clasificación taxonómica y sólo muy recientemente se han relacionado con los hongos; el término "microsporidios" reúne a una serie de géneros incluidos en el filo Microsporidia. Clasificados antes dentro de los protozoos, los microsporidios se consideran ahora hongos degenerados en función de las secuencias a y ß -tubulina y los árboles de secuencia para el chaperón molecular hsp70. Evidencias adicionales de la naturaleza fúngica de los microsporidios son las esporas con pared de quitina, ausencia del aparato de Golgi y un mecanismo mitótico indistinguible del que tienen los ascomicetos fúngicos (2).
Los microsporidios se caracterizan por formar esporas resistentes que presentan en su interior una estructura peculiar denominada tubo o filamento polar, a través de la cual infectan las células vulnerables donde desarrollan su ciclo vital (3). Son ubicuos por naturaleza y se consiguen ampliamente distribuidos en el ambiente. Las especies y genotipos que infectan al hombre se han detectado también en el agua, en los alimentos, y en animales salvajes, domésticos y de granja. Esto sugiere que existen diversas fuentes de infección y modos de transmisión para las infecciones humanas (1).
El diagnóstico de la microsporidiosis humana se dificulta por diferentes razones, pero entre las más importantes está el tamaño pequeño de las esporas de las especies que parasitan al hombre (promedio de 1 a 2 µm). Además, la espora se confunde fácilmente con bacterias, levaduras u otros artefactos, poseen capacidad de coloración variable y producen una respuesta inflamatoria mínima en el huésped (4). Los exámenes coproparasitológicos directos no son útiles para el diagnóstico y no aportan ninguna información que permita sospechar la presencia de este microorganismo intestinal.
El número de infecciones causadas por estos agentes ha aumentado con la aparición de la pandemia del sida (5,6) y ha comprometido seriamente la salud de estos pacientes, debido a que algunos microsporidios se pueden diseminar a otros órganos a partir del intestino y causar infecciones en riñón, cerebro y pulmón, entre otros (7). En el ámbito mundial, la prevalencia de la microsporidiosis es variable y se ha reportado desde el 7 al 50 %, en individuos con sida y diarrea crónica (8). Entre los microsporidios de hábitat intestinal, Enterocytozoon bieneusi fue la primera especie identificada en pacientes con VIH/sida y con diarrea; posteriormente, se reconoció a Encephalitozoon spp., también como causa de diarrea y de formas diseminadas de infección (9). La infección intestinal causada por estos dos microsporidios representa una amenaza grave para los pacientes con sida. La sintomatología se caracteriza por diarrea crónica de semanas o meses, líquida, de volumen variable, sin moco ni sangre, de cuatro a ocho evacuaciones diarias, que se exacerba con la ingestión de alimentos, de curso afebril, debilitante y con pérdida de un kg de peso semanal (10). Encephalitozoon intestinalis , además de producir infección en el tubo digestivo, puede diseminarse a la vía biliar, riñón, ojos, senos paranasales y algunas veces al sistema respiratorio (8). Otros géneros que pueden provocar enfermedad en el hombre son: Vittaforma, Nosema, Brachiola (Anncaliia ), Trachipleistosphora, Microsporidium y Pleistosphora , produciendo diversas afecciones (9).
Los pacientes con sida se caracterizan por presentar infecciones oportunistas secundarias que se originan como consecuencia de la pérdida en el número y la función de los linfocitos CD 4, a causa de la infección con el virus de la inmunodeficiencia humana (VIH). Este puede infectar y alterar macrófagos, células presentadoras de antígenos como células dendríticas y de Langerhans, además de los linfocitos T CD 8, importantes en la inmunidad celular, haciéndolos más propensos a infecciones por microorganismos oportunistas como microsporidios, Cryptosporidium spp., Isospora belli y Cyclospora cayetanensis (11).
Parásitos comunes en la población general, como Entamoeba histolytica, Giardia lamblia, Blastocystis spp., Strongyloides stercoralis , Ancylostomideos, Ascaris lumbricoides y Trichuris trichiura , pueden causar diarrea en los pacientes con sida y deben ser considerados en el diagnóstico diferencial del agente productor de la misma (12).
La literatura científica disponible sobre agentes causales de diarrea en pacientes con el VIH/sida en los países en vías de desarrollo es limitada. En Venezuela, la extensión de la microsporidiosis y su impacto en la salud se desconocen (1). Sin embargo, en un estudio reciente de 103 individuos con VIH del estado Zulia, se refiere una prevalencia de la infección de 13,6 % (14/103). Los 14 pacientes infectados provenían de 10 diferentes sectores de esta área geográfica. Estos hallazgos sugieren que la infección es común y ampliamente distribuida en la región. Aún así, como no se conoce la frecuencia de la microsporidiosis en la población general del Estado, no está claro si la frecuencia de microsporidios observada está realmente asociada con el VIH o solamente refleja un alto riesgo de exposición de la población general a estos microorganismos (1).
Con el fin de identificar los agentes parasitarios productores de diarrea más frecuentes en pacientes con VIH positivo, se realizó la presente investigación.
Materiales y métodos
Este estudio se llevó a cabo en Maracaibo, estado Zulia, Venezuela. La ciudad se sitúa al noroeste de Venezuela, con una longitud 78° 31´ O y latitud 10° 38´ N. El clima es semiárido; su temperatura se mantiene continuamente alta, con un promedio de 32 °C en el año y una humedad relativa promedio de 75 %. La población estuvo constituida por todos los pacientes con VIH que asistieron a la consulta de VIH/sida del Servicio de Autónomo Hospital Universitario de Maracaibo (SAHUM), durante un año, desde septiembre 2007 hasta octubre 2008.
Se incluyeron en la investigación todos los pacientes que cumplieron con los criterios de inclusión del estudio, a saber, confirmados como positivos para VIH mediante dos pruebas inmunológicas, preferiblemente con cuadro diarreico activo y que entregara una muestra fecal, en cantidad suficiente para realizar el protocolo completo de laboratorio.
El médico de la consulta hizo una evaluación clínica del paciente, así como una historia clínica con datos personales y pruebas de laboratorio. Posteriormente, el paciente fue remitido al Laboratorio de Parasitología. La mayor parte de la información aportada por el paciente para su historia clínica, se utilizó en este estudio.
Se recibió una muestra fecal por individuo, recolectada en un envase plástico, grande, limpio y seco, con abundante cantidad de heces.
Cada una de las muestras de heces se dividió en tres partes, para los siguientes estudios.
1. Una porción se utilizó para los exámenes coproparasitológicos. Se efectuó en primer término el examen macroscópico, en el cual se determinaron las características físicoquímicas de las heces: color, olor, consistencia, aspecto, reacción, presencia de moco, sangre, pus, restos alimenticios (heces lientéricas o heterogéneas) y presencia de parásitos adultos. Posteriormente, se hizo el examen microscópico con solución salina fisiológica y lugol, para identificar las diferentes formas evolutivas parasitarias, tanto de protozoos como de helmintos. En caso de observarse trofozoítos de amibas, la muestra fue coloreada con azul de metileno amortiguado (NAIR), para identificar la especie de amiba con base en las características del núcleo del parásito. Además, se usó el método de concentración (formoléter) y la coloración de Kinyoun (coloración ácido-alcohol resistente). Esta última se utilizó para el diagnóstico y la identificación de Cryptosporidium spp., C. cayetanensis e I. belli (10). Cuando hubo duda en la identificación, se utilizó un micrómetro ocular para medir el tamaño del coccidio intestinal y llegar a la identificación definitiva. Las láminas coloreadas se revisaron al microscopio de luz con objetivo de inmersión en aceite (aumento de 100X). Estas láminas fueron revisadas a doble ciego por dos miembros del equipo de investigación.
2. Otra parte de la muestra se preservó en formol al 10 % y, posteriormente, se usó la coloración de Gram-cromotropo rápida para la identificación de esporas de microsporidios. Se utilizó la coloración propuesta por Botero y Montoya (11); en ella, las esporas se tiñen de un color violeta oscuro y muestran como mínimo uno de los rasgos estructurales característicos de los microsporidios. Las láminas se visualizaron con el objetivo de inmersión (100X) y en algunos casos las esporas de microsporidios se midieron con la ayuda del micrómetro ocular.
3. Otra porción se congeló a -20 °C, hasta su procesamiento por técnicas de biología molecular, en las que se hicieron la extracción de ADN, su purificación y luego la amplificación mediante reacción en cadena de la polimerasa (PCR) en forma separada para E. histolytica y E. dispar , según procedimiento de Rivero, et al. (13).
El análisis de los datos se efectuó con estadística descriptiva, empleando valores absolutos y porcentajes, y los resultados se muestran en cuadros. Para el análisis estadístico de las variables en estudio, se utilizó la prueba de ji al cuadrado y la correlación de Spearman, con el paquete estadístico SPSS, versión 10. Se calculó el índice de Fager y la prueba t de Student, para determinar la asociación entre microsporidios y otros enteroparásitos identificados en los pacientes. Para todos los análisis, un valor de p<0,05 fue considerado como el nivel crítico de significación.
Consideraciones éticas
Todos los pacientes que se incluyeron en el estudio, dieron su consentimiento informado de participación. Los procedimientos efectuados no representaron ningún riesgo para el paciente.
Además, recibieron el tratamiento específico, con en base en los resultados de todos los exámenes coproparasitológicos efectuados en la presente investigación. En la elaboración del estudio, se siguieron las recomendaciones del Comité de Bioética del SAHUM, para estudios de investigación biomédica. El protocolo de estudio fue aprobado por dicho comité.
Resultados
Colaboraron con su muestra fecal 56 individuos, con edades comprendidas entre 21 y 79 años (promedio, 35±11,95 años), de los cuales, 23 eran mujeres y 33 hombres. Estos pacientes fueron diagnosticados como positivos para VIH, desde un periodo comprendido entre uno y cuatro años, con un promedio de 1,72±0,79 años. Según su historia clínica, solo ocho individuos se encontraban totalmente asintomáticos al momento de entregar la muestra fecal. El resto de los pacientes (48) refirieron, como los síntomas más frecuentes, diarrea (78,57 %), pérdida de peso (28,57 %) y síntomas gastrointestinales que incluían dolor abdominal, cólicos, vómitos o estreñimiento (17,85 %). Muchos pacientes presentaron conjuntamente candidiasis oral y neumocistosis, por lo que podía presumirse que se encontraban en etapa de sida.
Treinta y ocho individuos (67,86%) presentaron alguna especie parasitaria comensal o patógena en su muestra fecal. Se observaron cuadros de poliparasitosis en la mayoría de ellos (21/38), lo que representó el 55,26 %. Se detectó una mayor presencia de protozoarios que de helmintos en los individuos estudiados. Asimismo, predominaron los portadores de especies parásitas patógenas (26/38), sobre los que portaban solo comensales o combinaciones de comensales y patógenas.
En el cuadro 1 se muestra la prevalencia de especies parasitarias según los resultados del examen microscópico (examen en fresco, concentrado, Kinyoun y Gram-cromotropo rápida), donde se observa que 17 muestras presentaron esporas del filo Microsporidia (33,33%); mientras que el segundo lugar lo ocupó el coccidio I. belli (17,65 %). Por otro lado, A. lumbricoides, T. trichiura y S. stercoralis , lideraron la prevalencia de helmintos, con 27,27 % cada uno. Los resultados de la visualización de las láminas de Kinyoun a doble ciego, demostraron una correlación significativa (p<0,01) en la identificación de I. belli y Cryptosporidium spp.
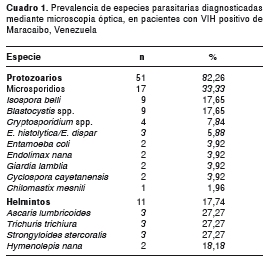
Mediante PCR, se identificó E. histolytica en uno de los tres pacientes que presentaron E. histolytica/E. dispar en el examen microscópico; no se detectó material genético de E. dispar .
Al analizar las asociaciones más frecuentes entre microsporidios y otras especies parasitarias, se observó que la principal agrupación detectada fue de los microsporidios y los coccidios intestinales, aunque esta correlación no fue estadísticamente significativa (t<1,64) (cuadro 2).

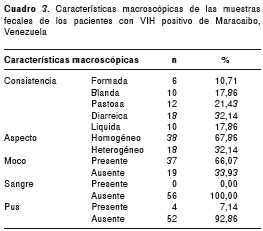
Las características macroscópicas presentes en las muestras fecales estudiadas se totalizan en el cuadro 3, donde se aprecia que la mayoría de ellas eran diarreicas (32,14 %) y homogéneas (67,86 %). Asimismo, ninguna de las muestras presentó sangre macroscópica (100 %), 7,14 % presentó pus y 66,07 % mostró moco en cantidad importante.
Discusión
La epidemiología de la microsporidiosis todavía está siendo determinada y la prevalencia varía enormemente en diferentes partes del mundo. Un factor que complica la determinación de esta prevalencia, es la enorme dificultad para el diagnóstico microscópico de estos microorganismos que, por su pequeño tamaño y características morfológicas, puede ser confundido fácilmente con detritos fecales, bacterias y otros microorganismos. Además, las técnicas específicas apropiadas para su diagnóstico (coloraciones fluorescentes, PCR) son costosas y laboriosas, por lo que no se practican rutinariamente en los laboratorios de parasitología.
Aunque existen pocos reportes sobre la prevalencia de microsporidios en el país, en investigaciones previas se refieren cifras diferentes a las obtenidas en el presente estudio. Báez, et al. (14), estudiaron las heces de 76 pacientes con diarrea, de los cuales la mayoría eran positivos para VIH, mediante coloración tricrómica modificada por Weber, y encontraron 50 % de prevalencia. Cermeño, et al. (12), refieren 11,4 % de prevalencia de microsporidios en pacientes positivos para VIH del Estado Bolívar. Bonilla, et al. estudiaron 103 pacientes positivos para VIH del estado Zulia, y observaron una prevalencia del 13,6 % (15). La prevalencia en el presente estudio es realmente elevada, si consideramos el bajo número de pacientes estudiados. Es importante conocer la prevalencia de la infección por microsporidios en pacientes con VIH positivo y, asimismo, sospechar su presencia en caso de que estos presenten diarreas crónicas, porque en muchas ocasiones no se solicita el descarte de estos parásitos en la muestra fecal.
A nivel internacional, en diversos estudios se refieren a los microsporidios como los microorganismos más prevalentes en pacientes positivos para VIH, con valores variables; Kotler, et al. (16), refieren 39 % en Estados unidos, Kaminski, et al. (17), 25 % en Honduras, mientras que Botero, et al. (18), refieren 3,9 % en Colombia.
Las diversas frecuencias citadas reflejan las variaciones epidemiológicas propias de cada región pues, aunque los mecanismos de transmisión de estos parásitos no han sido totalmente definidos, se proponen la transmisión mediante aguas y alimentos contaminados, así como la transmisión zoonótica. La transmisión hídrica es una de las vías más estudiadas y existen reportes de contaminación de aguas con E. bieneusi y E. intestinalis en países latinoamericanos (19). Este mecanismo de transmisión también podría ser el responsable de la alta prevalencia detectada de I. belli y Cryptosporidium spp., pues estos parásitos se han relacionado con la transmisión por aguas contaminadas en publicaciones previas en otros países (19-21) e incluso en nuestro país (22).
Realmente se debe destacar la prevalencia elevada de I. belli observada, pues en las publicaciones previas en el país se refieren a Cryptosporidium spp. como el coccidio intestinal más frecuente entre los pacientes con VIH (12,14,15,23). Sin embargo, Singh, et al. (24), también refieren a la isosporiasis como una infección común en individuos inmunocomprometidos. Desde el punto de vista epidemiológico, siempre se ha considerado más factible la transmisión de la criptosporidiosis, por las posibilidades de contagio directo humano a humano, así como su transmisión por aguas y alimentos contaminados, en comparación con ciclosporiasis e isosporiasis, que no tienen infección directa. A pesar de ello, recientemente Neira, et al. (25), describieron la posibilidad de transmisión directa de la isosporiasis, mediante el contacto oro-anal en las relaciones homosexuales, lo que sugiere necesariamente la maduración del ooquiste en el intestino del individuo, lo cual podría explicar la elevada prevalencia de isosporiasis observada en esta investigación.
Es importante señalar que todos los casos de isosporiasis detectados (9) se diagnosticaron mediante la coloración de Kinyoun. Al comparar las técnicas utilizadas, solo uno de los nueve casos también resultó positivo mediante examen al fresco y, cuatro, mediante el método de concentración. Tal acotación se hace porque, aunque los ooquistes de I. belli tienen un tamaño aproximado de 20 a 25 µm y son fácilmente distinguibles al examen microscópico con 10X y 40X, por razones que desconocemos, fue más sensible la coloración ácido-alcohol resistente para su diagnóstico específico, que las otras técnicas.
Los parásitos más frecuentes en los pacientes positivos para VIH estudiados, fueron los microsporidios, seguidos de I. belli . Tal situación ha sido referida en otras investigaciones similares efectuadas en el país (14,15). Bonilla, et al. (15), destacan la prevalencia de microsporidios, seguida de Cryptosporidium spp. , I. belli y C. cayetanensis en pacientes con VIH del Estado Zulia. A nivel internacional, Kaminsky, et al. (17), reportan 41,5 % de microsporidios y 30,4 % de I. belli en pacientes con sida, en Honduras. Es muy importante destacar estos valores, pues estas parasitosis se consideraran infecciones emergentes a nivel mundial y están estrechamente relacionadas con la infección por el virus de la inmunodeficiencia humana. Por estas razones, el médico tratante debe solicitar el descarte de estas parasitosis en todo paciente con VIH positivo y con diarrea acuosa persistente no inflamatoria, sobre todo cuando los conteos de CD 4 son bajos.
La especie parasitaria más frecuentemente asociada a los microsporidios fue Cryptosporidium spp., aunque tal asociación no fue estadísticamente significativa. Los microorganismos asociados a ellos en todos los casos fueron protozoarios, lo que confirma un mecanismo de transmisión común para todos ellos.
Es conveniente destacar el valor porcentual observado de S. stercoralis , pues este se encontró en igual condición que la infección por helmintos comunes, como son A. lumbricoides y T. trichiura . Además, uno de los tres pacientes con esta parasitosis presentó recuentos de CD 4 por debajo de 200 células/mm 3 . Aunque no se ha demostrado una predisposición a la infección por este parásito por parte de los pacientes con VIH, si se ha demostrado que en ellos la infección puede cursar de forma más grave, progresando a cuadros de hiperinfección o estrongiloidiasis masiva (26,27).
De los 17 pacientes parasitados por microsporidios, diez presentaron diarrea y siete, pérdida de peso.
De estos, la mayoría (10/17) presentaba infección mixta con otros parásitos patógenos, los cuales seguramente contribuyeron en la aparición de estas manifestaciones. Particularmente, la asociación de microsporidios y coccidios intestinales, afecta gravemente el epitelio intestinal, ya que ambos son microorganismos intracelulares obligados que se multiplican allí. En los pacientes inmunocomprometidos, estas parasitosis provocan gastroenteritis secretorias con abundante pérdida de líquidos y electrolitos, así como síndrome de mala absorción, caracterizado por pérdida de peso, desnutrición e hipovitaminosis.
Lamentablemente, por razones económicas, no se pudo practicar PCR a todas las muestras recolectadas, para el diagnóstico de E. histolytica y E. dispar . Solo se realizó el procedimiento en las tres muestras donde se observó E. histolytica/ dis par al microscopio. En ellas, no se detectó E. dispar y solo una muestra amplificó para E. histolytica . La inexistencia de ADN de alguna de las dos amibas en las muestras que habían sido calificadas como positivas, pudiera explicarse por un error técnico del observador al hacer el examen microscópico de la muestra, por la confusión probable con otras amibas intestinales o, finalmente, porque se trataba de E. moshkovskii , amiba morfológicamente idéntica a E. histolytica y a E. dispar , que todavía no ha sido reportada en el país y que no fue investigada mediante PCR. Hasta la fecha, los pacientes con VIH/sida no parecen tener un riesgo aumentado de presentar infección por E. histolytica , ni de desarrollar amibiasis graves, a diferencia de aquellos que reciben quimioterapia o corticoides y los que han recibido trasplantes, quienes sí tienen un gran riesgo de desarrollar colitis amibiana fulminante. En relación con la propensión de los pacientes con VIH/sida a las formas invasivas de la infección, existe evidencia contradictoria; sin embargo, la morbilidad parece estar más relacionada con la prevalencia particular de la cepa de E. histolytica con fenotipos invasivos, que con el estatus inmunológico específico del paciente (28).
La edad promedio de los pacientes positivos para VIH analizados (35±11,95 años) corresponde ampliamente con la etapa de mayor actividad sexual del individuo, por lo tanto, representan uno de los mayores grupos de riesgo de la infección por VIH (18). Al considerar el tiempo promedio de haber adquirido el virus, se observó que la mayoría de los individuos tenían en promedio un año de evolución; tal situación se explica pues, según el desarrollo de la infección por VIH, es justo alrededor de un año (si el paciente no recibe tratamiento antirretroviral) que se evidencia la mayoría de los síntomas y signos típicos de la enfermedad.
Con base en los resultados, recomendamos al personal de laboratorio sospechar la presencia de microsporidios o coccidios intestinales, al recibir una muestra fecal diarreica, heterogénea o no, con moco, pero sin sangre ni pus, sobre todo si proviene de un paciente con VIH positivo. Este tipo de muestra es característica de las diarreas no inflamatorias y tal tipo de diarrea es frecuentemente producida por S. stercoralis , coccidios intestinales y microsporidios. En la presente investigación se observó una relación significativa entre la presencia de moco y C. cayetanensis (p<0,05).
Esta relación se explica por los daños producidos por estos microorganismos en la mucosa intestinal, principalmente la del intestino delgado. Como consecuencia, se producen diarreas no inflamatorias (de allí la ausencia de leucocitos y hematíes), muestras con abundantes residuos alimenticios debido a la malabsorción de alimentos y exceso de moco, el cual se produce abundantemente como una respuesta de la mucosa intestinal al tratar de formar una barrera que impida la entrada de los microorganismos.
En conclusión, los microsporidios fueron los microorganismos más prevalentes en los pacientes estudiados y se encontraron frecuentemente asociados a los coccidios intestinales, superando la presencia de microorganismos comunes en la población general, como Blastocystis spp.
Informamos que durante el desarrollo de la presente investigación, ni los autores ni la institución que representamos incurrimos en ningún tipo de conflicto de intereses.
Esta investigación no recibió financiación institucional para su realización.
Correspondencia: Zulbey Rivero, Urb. Rotaria, Avenida 87 Nº 82-36, Maracaibo, Estado Zulia, Venezuela. Teléfono: 00582617541650; fax: 00582617980825 zulbeyrivero@gmail.com
1. Chacín L. Microsporidiosis: una infección emergente y oportunista. Invest Clin. 2006;47:105-7. [ Links ]
2. Murray P, Rosenthal K, Pfaller M. Microbiología médica. 6ª edición. Barcelona: Editorial ELSEVIER; 2009. p. 839. [ Links ]
3. Bornay F, Acosta B, Peman J, Moura H, Schwartz D, Da Silva A, et al . Mantenimiento en cultivo y caracterización de un microsporidio ( Encephalitozoon hellem ) aislado en un paciente con SIDA y neumonía. Parasitol Día. 2000;24:69- 70. http://dx.doi.org/10.4067/S0716-07202000000300001 [ Links ]
4. Chinchilla M, Reyes L, Guerrero O, Castro A. Microsporidiosis: una parasitosis de reciente adaptación al hombre. Rev Costarric Cienc Méd. 1998;19:209-21. [ Links ]
5. Flórez A, García D, Moncada L, Beltrán M. Prevalencia de microsporidios y otros parásitos intestinales en pacientes con infección por VIH, Bogotá, 2001. Biomédica. 2003;23:271-82. [ Links ]
6. Aikawa N, Twardowsky A, Carvalho J, Silva C, Avelino I, Medeiros A, et al . Intestinal microsporidiosis: A hidden risk in rheumatic disease patients undergoing anti-tumor necrosis factor therapy combined with disease-modifying anti-rheumatic drugs? Clinics. 2011;66:1171-5. http://dx.doi.org/10.1590/S1807-59322011000700008 [ Links ]
7. Bedoya K, Montoya M, Botero J, Galván A. Primer aislamiento de Encephalitozoon intestinalis a partir de muestra de material fecal de un paciente colombiano con sida. Biomédica. 2008;28:441-7. [ Links ]
8. Agudelo S, Montoya M. Parasitosis intestinales oportunistas teoría y práctica. 1ª edición. Medellín: Biogénesis Fondo Editorial; 2005. p. 62. [ Links ]
9. Fernández N, Combo A, Zanetta E, Acuña A, Gezuele E. Primer diagnóstico de microsporidiosis humana en Uruguay. Rev Méd Uruguay. 2002;18:251-5. [ Links ]
10. Atías A. Parasitología Médica. 3ª edición. Santiago de Chile: Editorial Salecianos; 1991. p. 168. [ Links ]
11. Botero J, Montoya M. Microsporidiosis intestinal: una visión integral. Infectio. 2002;6:213-25. [ Links ]
12. Cermeño J, Hernández I, Uzcátegui O, Páez J, Rivera M, Baliachi N. Parasitosis intestinal en pacientes infectados con el virus de inmunodeficiencia humana. Kasmera. 2004;32:101-7. [ Links ]
13. Rivero Z, Bracho A, Chourio G, Díaz I, Calchi M, Acurero E, et al . Detección y diferenciación de Entamoeba histolytica y Entamoeba dispar mediante reacción en cadena de la polimerasa (PCR) en individuos de una comunidad del Estado Zulia, Venezuela. Cad Saúde Publica. 2009;25:151-9. http://dx.doi.org/10.1590/S0102-311X2009000100016 [ Links ]
14. Baez E, Arcay L, Reverand S, Otero E. Microspora: Etiological agent in chronic diarrhoea. Rev Soc Ven Microbiol. 2000;20:53-6. [ Links ]
15. Chacin L, Panunzio A, Monsalve F, Parra I, Matínez R. Microsporidiosis in Venezuela: Prevalence of intestinal microsporidiosis and its contribution to diarrhea in a group of Human Immunodeficiency Virus–infected patients from Zulia State. Am J Trop Med Hyg. 2006;74:482-6. [ Links ]
16. Kotler D, Orenstein J. Prevalence of intestinal microsporidiosis in HIV-infected individuals referred for gastroenterological evaluation. Am J Gastroenterol. 1994;89:1998-2002. [ Links ]
17. Kaminsky R, Stovall M, Mayer M, Martin A. Microsporidia intestinales en pacientes viviendo con SIDA en Honduras. Rev Méd Hondur. 2007;75:116-23. [ Links ]
18. Botero J, Montoya M, Vanegas A, Díaz A, Martínez L, Bornay F, et al . Frecuencia de microsporidiosis intestinal en pacientes positivos para VIH mediante las técnicas de Gram cromotropo rápido y PCR. Biomédica. 2004;24:375-84. [ Links ]
19. Dowd S, Gerba C, Pepper I. Confirmation of the humanpathogenic Microsporidia Enterocytozoon bieneusi, Encephalitozoon intestinalis , and Vittaforma corneae in water .Appl Environ Microbiol. 1998;64:3332-5. [ Links ]
20. Sturbaum G, Ortega Y, Gilman R. Sterling C, Cabrera L, Klein D. Detection of Cyclospora cayetanensis in wastewater. Appl Environ Microbiol. 1998;64:2284-6. [ Links ]
21. Peralta M, Ayala J. Some considerations on the actual prevalence of: Entamoeba histolytica, Giardia duodenalis, Coccidios, microsporidios and mixosporidios in Colombia. Salud Uninorte. 2008;24:294-302. [ Links ]
22. Cermeño J, Arenas J, Yori N, Hernández I. Cryptosporidium parvum y Giardia lamblia en aguas crudas y tratadas del estado Bolívar, Venezuela. Revista UCT. 2008;12:39-42. [ Links ]
23. Caraballo A, Orozco I, Muñoz L. Intestinal parasitic infections in human immunodeficiency virus positive individuals in Southeastern Venezuela. Bol Chil Parasitol. 2001;5:91-4. [ Links ]
24. Singh A, Houpt E, Petri W. Rapid diagnosis of intestinal parasitic protozoa, with a focus on Entamoeba histolytica . Interdiscip Perspect Infect Dis. 2009;2009:547090. http://dx.doi.org/10.1155/2009/547090 [ Links ]
25. Neira P, Barthel E, Wilson G, Muñoz N. Infección por Isospora belli en pacientes con infección por VIH. Presentación de dos casos y revisión de la literatura. Rev Chil Infect. 2010;27:219-27. http://dx.doi.org/10.4067/S0716-10182010000300007 [ Links ]
26. Dorvigny M, Castro O, Núñez F, Capo V. Estrongiloidiasis diseminada en pacientes con SIDA: a propósito de 2 casos. Rev Cubana Med Trop. 2006;58:165-8. [ Links ]
27. Sauca G, Barrufet P, Besa A, Rodríguez E. Hiperinfección por Strongyloides stercoralis en un paciente con síndrome de inmunodeficiencia adquirida. An Med Interna. 2005;22:43-5. http://dx.doi.org/10.4321/S0212-71992005000300009 [ Links ]
28. Ximénez C, Morán P, Rojas L, Valadez A, Gómez A, Ramiro M, et al . Novelties on amoebiasis: A neglected tropical disease. J Glob Infect Dis. 2011;3:166-74. http://dx.doi.org/10.4103/0974-777X.81695 [ Links ]













