Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.33 no.4 Bogotá Oct./Dec. 2013
https://doi.org/10.7705/biomedica.v33i4.1489
doi: http://dx.doi.org/10.7705/biomedica.v33i4.1489
ARTÍCULO ORIGINAL
1 Grupo de Genética Molecular, Universidad de Antioquia, Medellín, Colombia
2 Hospital Universitario San Vicente de Paúl, Universidad de Antioquia, Medellín, Colombia
El trabajo se llevó a cabo en el Laboratorio de Genética Molecular de la Universidad de Antioquia.
Contribución de los autores:
Diana María Valencia, Carlos Andrés Naranjo y María Antonieta Caro obtuvieron los pacientes y realizaron la genotipificación.
Diana María Valencia, María Victoria Parra, Ana Victoria Valencia, Carlos José Jaramillo y Gabriel Bedoya analizaron los resultados y elaboraron el manuscrito.
Carlos José Jaramillo y Gabriel Bedoya gestionaron la financiación.
Recibido: 05/12/12; aceptado:16/06/13
Introducción. La hipertensión arterial es una enfermedad multifactorial influenciada por componentes genéticos y ambientales, cuya prevalencia varía entre grupos étnicos. Se han llevado a cabo numerosos estudios en genes de sistemas reguladores de la presión arterial, como el sistema renina-angiotensinaaldosterona, el sistema nervioso simpático, los factores endoteliales, y el balance de sodio, mostrando resultados incongruentes entre poblaciones.
Objetivos. Evaluar el efecto de variantes en los genes AGT , AGTR1 , ACE , ADRB2 , DRD1 , ADD1 , ADD2 , ATP2B1 , TBXA2R y PTGS2 y del componente ancestral individual, sobre la hipertensión arterial y las cifras de presión arterial en una muestra de población antioqueña.
Materiales y métodos. Se genotipificaron 107 casos y 253 controles para 12 variantes en los genes AGT , AGTR1 , ACE , ADRB2 , DRD1 , ADD1 , ADD2 , ATP2B1 , TBXA2R y PTGS2 , y para 20 marcadores informativos de ascendencia. Se evaluó la asociación de los polimorfismos y sus interacciones, y de la composición genética ancestral con hipertensión y cifras de presión arterial.
Resultados. Los genes ADD2 , rs4852706 (OR=3,0; p=0,023); DRD1 , rs686 (OR=0,38; p=0,012) y ADRB2 , rs1042718 (OR=10,0; p=0,008); y combinaciones genotípicas de DRD1 con AGTR1 ; de AGT con ADD1 ; y de ADD1 con ATP2B1 y PTGS2 , se asociaron con hipertensión arterial. El componente ancestral amerindio se asoció con disminución en la presión arterial diastólica.
Conclusiones. Variantes en los genes ADD2 , DRD1 , ADRB2 , AGTR1 , AGT , ADD1 , ATP2B1 y PTGS2 , individualmente o en su interacción, se encuentran asociadas con hipertensión. El componente ancestral amerindio tiene un efecto sobre las cifras de presión arterial.
Palabras clave: hipertensión, epístasis genética, herencia multifactorial, estudios de asociación genética, genotipo, polimorfismo de nucleótido simple.
doi: http://dx.doi.org/10.7705/biomedica.v33i4.1489
Association and interaction of AGT, AGTR1, ACE, ADRB2, DRD1, ADD1, ADD2, ATP2B1, TBXA2R and PTGS2 genes on the risk of hypertension in Antioquian population
Introduction: Hypertension is a multifactorial disease influenced by genetic and environmental components, with its prevalence varying across ethnic groups. Manifold studies on blood pressure regulatory system genes have been carried out such as the renin-angiotensin-aldosterone system, the sympathetic nervous system, endothelial factor, and sodium balance, but the results yielded were inconsistent among populations.
Objectives: To evaluate the effect of both variants in genes AGT, AGTR1, ACE, ADRB2, DRD1, ADD1, ADD2, ATP2B1, TBXA2R PTGS2, and the result of the individual ancestry component on hypertension and blood pressure levels among population in Antioquia.
Methods and materials: 107 cases and 253 controls were genotyped for 12 variants on genes AGT, AGTR1, ACE, ADRB2, DRD1, ADD1, ADD2, ATP2B1, TBXA2R y PTGS2, and for 20 ancestry informative markers. The association of polymorphisms and their interactions, and the association of ancestral genetic composition with hypertension and blood pressure levels were examined.
Results: Genes ADD2, rs4852706 (OR=3.0; p=0.023); DRD1, rs686 (OR=0.38; p=0.012) and ADRB2, rs1042718 (OR=10.0; p=0.008); as well as genotypic combinations of DRD1 and AGTR1; AGT and ADD1; and ADD1 to ATP2B1 and PTGS2 were associated to hypertension. The Amerindian ancestry component was associated to some decrease in diastolic blood pressure.
Conclusion: Variants on genes ADD2, DRD1, ADRB2, AGTR1, AGT, ADD1, ATP2B1 and PTGS2 individually or interacting, are associated to hypertension. The Amerindian ancestry component has an effect on blood pressure.
Key words: Hypertension; epistasis, genetic; multifactorial inheritance, genetic association studies, genotype; polymorphism, single nucleotide.
doi: http://dx.doi.org/10.7705/biomedica.v33i4.1489
La hipertensión arterial es un importante problema de salud pública a nivel mundial debido a su alta prevalencia y a su impacto sobre el riesgo cardiovascular (1-3). Se estima que el 25 % de la población adulta en el mundo presenta hipertensión arterial (4,5), aunque esta cifra varía entre las diferentes poblaciones continentales. En Estados Unidos se calcula que uno de cada tres adultos la padece, siendo mayor la prevalencia y seriedad de su presentación en afroamericanos y, menor, en poblaciones hispanas (5-8). Asimismo, se ha reportado que su prevalencia es menor en las poblaciones amerindias (9-11). La mayor propensión a desarrollar hipertensión en afroamericanos se ha explicado por la presencia de variantes genéticas ancestrales que influencian la retención de sal y agua, y el tono arterial, las cuales tienen una mayor frecuencia en la población ancestral africana que en otras. Así, la hipertensión sería el resultado de las condiciones ambientales modernas interactuando con la propensión genética ancestral (12).
La influencia del componente genético sobre los niveles de presión arterial se ha documentado en estudios en gemelos, estudios de adopción y estudios en familias (13), en los cuales se ha podido observar una mayor concordancia en los valores de presión arterial entre gemelos monocigotos que entre dicigotos, así como una mayor similitud de esta dentro de las familias que entre ellas (14,15). La herencia de los niveles de presión arterial se ha estimado en 30 a 60 % (13).
Entre 5 y 10 % de los casos de hipertensión arterial presentan formas monogénicas de trastornos que conllevan a una hipertensión secundaria, como son la enfermedad renal o suprarrenal (16), y condiciones que afectan las arterias, el corazón o el sistema endocrino. Además, puede ocurrir durante el embarazo o ser inducida por fármacos (16-18). Sin embargo, para la forma común de la enfermedad, conocida como hipertensión arterial esencial, presente en 90 a 95 % de los casos, no se tiene claridad de los mecanismos genéticos involucrados en su desarrollo (17).
Actualmente se sabe que su causa etiológica es multifactorial, que resulta del efecto e interacción de múltiples genes que intervienen en la regulación de la presión arterial y de factores de riesgo ambientales, entre los que se encuentran la obesidad (19, 20), el consumo de sal (21,22), el sedentarismo(23), el estrés (24), la edad, el sexo y la composición genética ancestral (12,25,26). Los principales sistemas fisiológicos que se encuentran involucrados en el control de la presión arterial son el sistema renina-angiotensina-aldosterona, el endotelio vascular, la transducción de señales por vía del sistema nervioso y las proteínas del citoesqueleto, que se encargan del mantenimiento del flujo sanguíneo (presión sanguínea y volumen de fluidos extracelulares en el cuerpo), mediación de reacciones de vasodilatación-vasoconstricción y la regulación de la concentración de sales (27-44).
Se han llevado a cabo numerosos estudios genéticos sobre estos sistemas; sin embargo, los resultados han sido incongruentes entre poblaciones, lo que evidencia la heterogeneidad de la hipertensión arterial en su etiología genética en las poblaciones continentales (45-58).
Las poblaciones latinoamericanas, como la colombiana, son el resultado de la mezcla reciente entre tres poblaciones: europea, nativa americana y africana (59,60) en diferentes porcentajes de acuerdo con la región. Esto hace que, en estudios de casos y controles, se pueda presentar estratificación entre los grupos, lo que puede generar resultados erróneos de asociación; por lo tanto, para los estudios de asociación en genes candidatos en poblaciones mezcladas, es necesario el uso de marcadores genéticos informativos de ascendencia (61-63) que permitan calcular la composición ancestral individual, y hacer uso de esta en la corrección de los análisis de asociación.
Este trabajo se hizo con el fin de evaluar el efecto independiente de alelos y genotipos en variantes en los genes de angiotensinógeno ( AGT ), receptor de angiotensina II de tipo 1 ( AGTR1 ), enzima convertidora de angiotensina ( ACE ), receptor ß 2 adrenérgico ( ADRB2 ), receptor de dopamina de tipo 1 ( DRD1 ), aduccinas a y ß ( ADD1, ADD2 ), ATPasa de Ca2+ de membrana plasmática 1 ( ATP2B1 ), receptor de tromboxano A2 ( TBXA2R ) y sintasa de prostaglandina 2 ( PTGS2 ); además del efecto de la interacción entre los polimorfismos sobre los niveles de presión arterial y la propensión a hipertensión arterial en una muestra de población antioqueña, incluyendo en los modelos, además de los factores de riesgo tradicionales, la composición genética ancestral individual como un factor que puede modificar estas asociaciones.
Materiales y métodos
Población de estudio
Para el estudio se recolectó una muestra total de 360 individuos residentes en el municipio de Medellín, Antioquia, de los cuales, 107 fueron individuos con diagnóstico de hipertensión arterial esencial, según los criterios establecidos por la American Heart Association (64), y 253 fueron personas sin antecedentes personales de hipertensión. Tanto los casos como los controles fueron captados en grupos de recreación del adulto mayor de la Alcaldía de Medellín en las diferentes comunas de la ciudad, empleados de la IPS Universidad de Antioquia y del Museo Universitario de la Universidad de Antioquia.
Los grupos fueron conformados por personas de ambos sexos mayores de 18 años, residentes en Medellín. Se excluyeron quienes tuvieran diagnóstico de hipertensión arterial secundaria. A todos los participantes se les hizo una encuesta general que incluyó información sociodemográfica (sexo, edad, estrato socioeconómico), antropométrica (peso, talla, índice de masa corporal), clínica (consumo de fármacos, enfermedades actuales, antecedentes personales y familiares de enfermedades) y del estilo de vida relevantes a la enfermedad (frecuencia de ejercicio físico); además, se aplicó una encuesta de origen en la cual se especificó para cada participante el origen de padres, abuelos y bisabuelos.
Mediciones antropométricas y de presión arterial
El peso en kilogramos fue determinado con una balanza, con la menor cantidad de ropa posible y sin calzado. La talla, en centímetros, se estableció usando el tallímetro. Con los datos de peso y talla se calculó el índice de masa corporal (IMC): peso (kg)/talla (m 2 ).
A cada persona se le tomaron tres medidas de tensión arterial en días diferentes. La tensión arterial se midió con un esfigmomanómetro de mercurio calibrado, teniendo en cuenta los siguientes criterios, según las guías de la American Heart Association (64): mínimo cinco minutos de reposo antes de tomar la medición; sentado, brazo derecho descubierto y apoyado al nivel del corazón, no haber ingerido bebidas con contenido de cafeína, ni haber fumado treinta minutos antes de la toma de presión arterial, no haber hecho ejercicio antes del examen, estar lo más relajado posible y haber evacuado la vejiga antes del procedimiento.
Muestras biológicas y genotipificación
Para las pruebas genéticas, se tomó una muestra de sangre periférica. El ADN genómico se extrajo de leucocitos por el método de fenol-cloroformo (65).
Se amplificaron 12 polimorfismos en los genes: angiotensinógeno ( AGT ), receptor de angiotensina II tipo 1 ( AGTR1 ), enzima convertidora de angiotensina ( ACE ), receptor ß 2 adrenérgico ( ADRB2 ), receptor de dopamina tipo 1 ( DRD1 ), aduccinas a y ß ( ADD1 , ADD2 ), ATPasa de Ca2+ de membrana plasmática 1 ( ATP2B1 ), receptor de tromboxano A2 ( TBXA2R ) y sintasa de prostaglandina 2 ( PTGS2 ). La amplificación de los marcadores se hizo por medio de la reacción en cadena de la polimerasa (PCR). De las 12 variantes, 11 fueron cambios en el polimorfismo de un solo nucleótido ( Single Nucleotide Polymorphism , SNP) y la discriminación alélica se hizo con la digestión de enzimas específicas de restricción ( Specific Restriction Fragment Length Polymorphism, RFLP). Uno de los polimorfismos localizado en el gen ACE corresponde a la presencia o ausencia de una inserción de tipo Alu de 288 pb en el intrón 16; el tamaño alélico se determinó mediante electroforesis en geles de agarosa al 2 %, teñidos con bromuro de etidio.
Las variantes evaluadas, la secuencia de los cebadores para la amplificación y la enzima de restricción utilizada, se muestran en el cuadro 1.
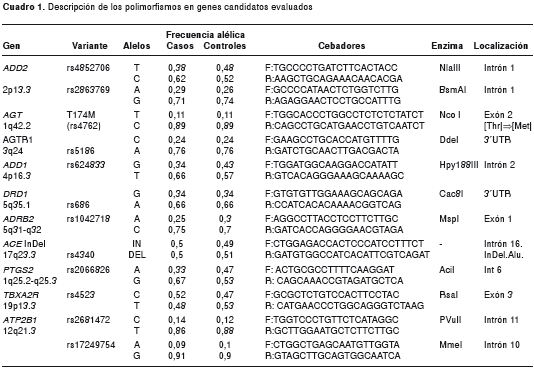
La secuencia de nucleótidos alrededor de cada SNP seleccionado, se tomó de la base de datos del genoma humano del National Center for Biotechnology Information , disponible en http://ncbi.nlm.nih.gov. Para el diseño de los iniciadores y la determinación de las condiciones de amplificación, se utilizó el software PRIMER3plus (http://www.bioinformatics.nl/cgi-bin/primer3plus/primer3plus.cgi). Las enzimas de restricción para cada polimorfismo se seleccionaron empleando el software NEBcutter, versión 2.0, disponible en http://tools.neb.com/NEBcutter2/. Los fragmentos digeridos se visualizaron en geles de agarosa teñidos con bromuro de etidio y se emplearon marcadores de peso molecular adecuados para los tamaños alélicos esperados.
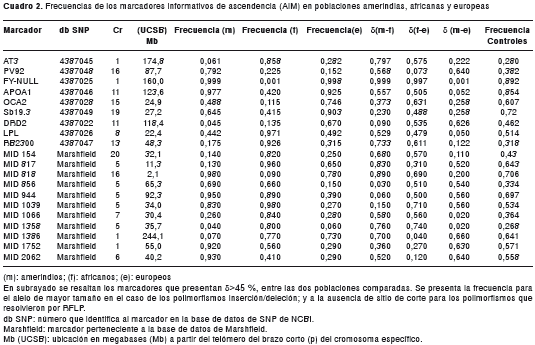
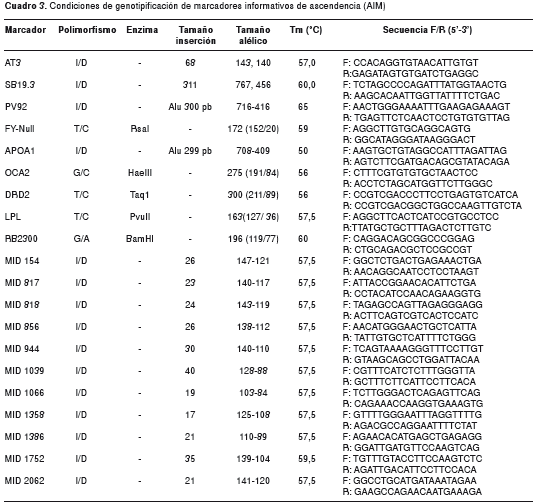
Para el análisis de mezcla, se utilizó un grupo de 20 marcadores informativos de ascendencia ( Ancestry - Informative Marker, AIM) ubicados en cromosomas autosómicos y con alto poder informativo (d>45 %) entre las poblaciones ancestrales de la población antioqueña (amerindia, africana y europea) (cuadro 2). Los valores delta promedio entre poblaciones para este panel son de 0,51 (amerindio-africano); 0,46 (africanoauropeo), y 0,41 entre amerindio y auropeo. Nueve de estos marcadores se genotipificaron utilizando el método de PCR-RFLP (cuadro 3); los tamaños alélicos se resolvieron en geles de agarosa. Los 11 AIM restantes son de tipo inserción/deleción, denominados MID ( Marker Insertion Deletion ), tomados de la base de datos de Marshfield-Human Insertion/Deletion Polymorphisms , disponible en http://www.marshfieldclinic.org/mgs/pages/default.aspx?page=didp y fueron tipificados directamente por diferencias de tamaño en geles de agarosa teñidos con bromuro de etidio. Para la determinación de los fragmentos se utilizaron marcadores de peso molecular. La lectura de los genotipos fue hecha por dos personas independientemente, sin previo conocimiento del grupo al que pertenecían las muestras.
Análisis estadístico
Se hizo la descripción de las variables para toda la muestra y en los grupos de casos y controles, así como las diferencias entre estos grupos. Para evaluar la asociación de las variables categóricas (estrato socioeconómico y sexo) con el estatus de afección, se practicaron pruebas de ji al cuadrado ( ? 2 ) de independencia. Se hicieron comparaciones de promedios o medianas, entre los grupos de casos y controles para las variables continuas, como edad, IMC, y proporciones de mezcla individual, según se cumpliera el supuesto de normalidad de los datos. Las variables que presentaron diferencias significativas entre casos y controles, se consideraron en análisis posteriores como posibles variables de confusión de las asociaciones con los marcadores genéticos. Estos análisis se hicieron con el paquete estadístico SPSS ( Statistical Package for the Social Sciences ), versión 15.1; en todos los casos se utilizó un nivel de significancia de 0,05.
El cálculo de las frecuencias alélicas, genotípicas y el equilibrio Hardy-Weinberg para los grupos de casos y controles, se llevó a cabo utilizando el programa PLINK Versión 1.07 disponible en http://pngu.mgh.harvard.edu/~purcell/plink/index.shtml.
Se utilizó el programa ADMIXMAP, versión 3.8, para calcular la composición genética ancestral (europea, amerindia y africana) para cada individuo, así como para la población total, la de casos y la de controles. ADMIXMAP, versión 3.8, es un programa que emplea aproximaciones clásicas y bayesianas para modelar la mezcla individual, haciendo uso de la información aportada por los genotipos para los AIM en la población híbrida en estudio, así como de la información a priori sobre la frecuencia de estos marcadores en las poblaciones parentales (66,67). Los índices de ascendencia individuales europeo, africano y amerindio obtenidos, se usaron como posibles variables de confusión, por los cuales las asociaciones fueron corregidas.
Asimismo, se probó el grado de diferenciación genética entre los grupos mediante el cálculo del índice de fijación de Wright F ST para los AIM, para lo cual se empleó el programa ARLEQUIN 2.000.
Se evaluó la asociación entre la presencia de hipertensión arterial esencial con los polimorfismos estudiados; se calcularon las razones de momios ( odds ratio , OR) con intervalos de confianza del 95 %. Además, se construyeron modelos multivariados de regresión logística binaria, incluyendo en el modelo las covariables edad, IMC, sexo e índice individual de ascendencia. Para la evaluación de asociación alélica, se utilizó el programa PLINK, versión 1.07, y el paquete SNPassoc del programa R, versión 2.6.1, para la evaluación de asociaciones genotípicas; estas últimas se hicieron mediante análisis de regresión logística para los modelos de herencia dominante, recesivo, sobredominante y aditivo. El mejor modelo genético para explicar la asociación se seleccionó usando el criterio de información de Akaike (68,69).
Para el análisis de asociación entre la proporción de mezcla genética e hipertensión arterial, se emplearon modelos de regresión lineal multivariado, en los cuales se incluyeron como covariables la edad, el sexo, el IMC y el estrato socioeconómico. Fue necesario transformar los valores de los componentes ancestrales a valores z, dado que estos no presentaron una distribución normal.
Para evaluar el efecto del componente ancestral sobre los niveles de presión arterial diastólica y sistólica, se calcularon los coeficientes de correlación. Este análisis se hizo en la población total. Se evalúo la asociación de los genes con los niveles de presión arterial sistólica y diastólica mediante ANOVA no paramétrica de Kruskal Wallis. Se construyeron modelos multivariados de regresión lineal, con el fin de ajustar la asociación de los genotipos con los niveles presión arterial diastólica y sistólica, por las variables edad, sexo, IMC e índice de ascendencia; cada índice de ascendencia se evaluó por separado. Los valores de presión arterial sistólica y diastólica se transformaron previamente a valores z con el fin de cumplir con el supuesto del modelo de regresión lineal. Además, se exploraron los posibles efectos de interacción entre pares de polimorfismos mediante análisis de regresión logística, incluyendo los términos de interacción con las variables de confusión identificadas previamente. Los resultados de estos modelos se evaluaron con modelos de permutación, debido a que se encontraron intervalos de confianza amplios para el OR. Estos análisis se hicieron con el software SPSS, versión 15.1.
Consideraciones éticas
El protocolo del estudio y el formato de consentimiento informado fueron aprobados por el Comité de Ética de la Sede de Investigación Universitaria de la Universidad de Antioquia. Todos los participantes leyeron y comprendieron el documento informativo y luego firmaron el consentimiento informado.
Resultados
Población de estudio
Las características sociodemográficas de la población y la comparación entre los grupos para variables antropométricas y niveles de presión arterial, se presentan en el cuadro 4. Se encontraron diferencias significativas para edad, IMC y sexo, entre los grupos de casos y controles. Se encontró mayor edad (p=0,01), mayor IMC (p=0,01) y mayor porcentaje de hombres (p=0,01) en el grupo de controles que en el de casos. Como era de esperarse, las medidas de presión arterial sistólica y diastólica fueron mayores en casos que en controles.

Marcadores informativos de ascendencia
Todos los AIM estuvieron en equilibrio Hardy- Weinberg en la población total y en el grupo de casos. Se observan pequeñas desviaciones de estas frecuencias dentro del grupo de controles para los marcadores FY-null, MID1358 y Sb19.3; sin embargo, la significancia de la prueba no permanece luego de la corrección de Bonferroni, donde el umbral de significancia corregido es de 0,0025.
Los promedios de ascendencia amerindia, africana y europea para la población total, fueron de 24,2±7,6 %, 10,6±6,9 % y 65,2±8,9 %, respectivamente. No hubo diferencias significativas entre los grupos de casos y controles.
Pruebas de estructuración de población
No se encontraron indicios de estructuración de población entre los grupos de casos y controles, medidos mediante del índice de fijación de Wright F ST a partir de los 20 AIM evaluados (F ST =0,0004).
Variantes en los genes candidatos
Los genotipos para los marcadores en genes candidatos se distribuyeron de acuerdo con lo esperado bajo el modelo de equilibrio Hardy- Weinberg en la población total. Sin embargo, se observó una leve desviación de la expectativa según este modelo para el marcador rs686 en el gen DRD1 , pero sólo en el grupo de casos; la significancia se pierde al hacer la corrección por múltiples pruebas.
Análisis de asociación de los genes candidatos con hipertensión arterial
En el análisis de asociación alélica de cada SNP en los genes candidatos con hipertensión arterial, se encontró asociación entre el alelo C del polimorfismo rs4852706 en el gen ADD2 , con un OR de 1,5 (p=0,031) y para el alelo T del polimorfismo rs624833 en el gen ADD1 con un OR de 1,5 (p=0,037) (cuadro 5). Al ajustar por edad, sexo e IMC, se conservó la asociación con la variante rs4852706 del gen ADD2 , donde el alelo C es el que confiere riesgo para la hipertensión con un OR de 2,0 (p=0,013), pero se perdió la asociación identificada con el rs624833 en ADD1 (cuadro 5), lo cual indica que esta asociación se debía realmente al efecto de alguno de los factores de confusión por los cuales se corrigió. No se observó modificación significativa en la asociación al incluir cada uno de los componentes ancestrales por separado como covariables. En ninguno de los casos se conserva la asociación después de hacer la corrección por múltiples pruebas, la cual arrojó un umbral de significancia de 0,0045. Este fue calculado como 0,05/11, ya que se observó que los marcadores en el gen ATP2B1 (rs2681472 y rs17249754) se encuentran en desequilibrio de ligamiento en la población analizada (D´=0,832).
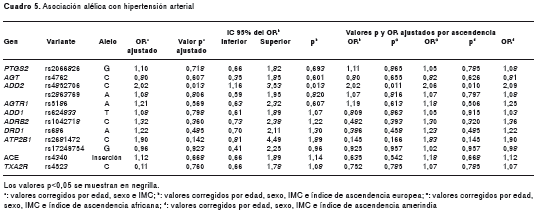
Al evaluar la asociación genotípica ajustando por las covariables IMC, edad y sexo, e incluyendo cada uno de los componentes ancestrales por separado, se observó asociación genotípica con tres de los SNP: nuevamente como en la asociación alélica el marcador rs4852706 en el gen ADD2 , donde se encontró que los genotipos CC-CT confieren tres veces el riesgo de presentar hipertensión arterial en relación con el genotipo TT (modelo dominante, OR=3,0; IC 95% 1,1-8,3; p=0,023). Para el rs1042718 en ADR ß 2 se observó un riesgo de 10 veces para hipertensión arterial para los genotipos CC-AC con respecto al homocigoto AA (modelo dominante, OR=10,0; IC 95% 1,5-100,0; p=0,008); y, finalmente, el genotipo heterocigoto AG para el rs686 en DRD1 se encontró como un genotipo protector, relacionado con una disminución en la propensión a hipertensión arterial del 62 %, comparado con los genotipos homocigóticos (modelo sobredominante, OR=0,38; IC 95% 0,16-0,82; p=0,012) (cuadro 6). Luego de incluir uno a uno los componentes ancestrales, no se observó modificación significativa en las asociaciones encontradas. Las asociaciones no se conservan significativas luego de hacer el ajuste por Bonferroni, el cual arrojó un valor de significancia de 0,001.
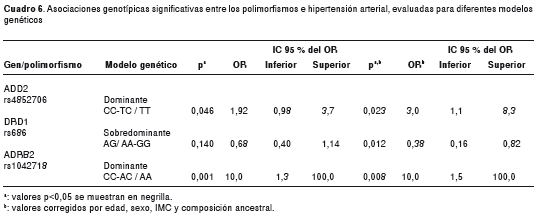
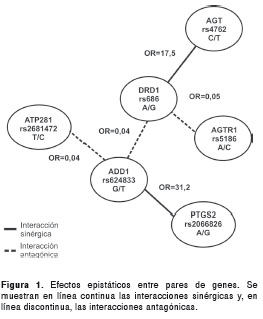
Mediante análisis de regresión logística binaria, se evaluaron los efectos de interacción entre los polimorfismos, y su asociación con hipertensión arterial, al incluir y evaluar la significancia de los términos de interacción construidos por pares de marcadores. En todos los modelos se ajustó por edad, sexo, IMC y composición ancestral. Al probar todas las posibles combinaciones por pares de marcadores, fueron significativas cinco interacciones; tres de ellas involucran el marcador rs686 del gen DRD1 , este presenta efectos de interacción sobre el riesgo para hipertensión arterial con las variantes rs4762 ( AGT ), rs5186 ( AGTR1 ) y rs624833 ( ADD1 ). La variante rs624833 ( ADD1 ), además de modificar el efecto de rs686, también lo hizo con las variantes rs2681472 del gen ATP2B1 , y 2066826 en el gen PTGS2 (cuadro 7). La naturaleza de las interacciones encontradas es sinérgica, potenciando el riesgo sobre la enfermedad, en el caso de DRD1 - AGT (OR=17,5; p=0,008) y ADD1 con PTGS2 (OR=31,2; p=0,031); y antagónicas, contrarrestando el riesgo que aportan las variantes si actuaran de manera independiente una de la otra; en el caso de las interacciones DRD1 - AGTR1 (OR=0,05; p=0,03); DRD1 - ADD1 (OR=0,04; p=0,008) y ATP2B1 - ADD1 (OR=0,04; p=0,016) (figura 1).
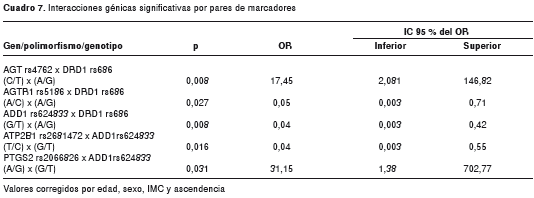
Los resultados de estas interacciones se evaluaron mediante modelos de permutación, esto debido a los amplios intervalos de confianza observados para los OR. Se encontró que, para las interacciones entre los pares de marcadores rs624833 ( ADD1 ) y rs686 ( DRD1 ), y entre rs2066826 ( PTGS2 ) y rs624833 ( ADD1 ), fueron suficientes siete permutaciones en ambos casos para encontrar convergencia entre los coeficientes de regresión; en el caso de el programa empleado (SPSS) las permutaciones se detienen (la estimación finaliza) cuando las estimaciones de dichos parámetros han cambiado en menos de 0,001. Además, se observó que el valor de -2 Log de la verosimilitud disminuyó de 300,8 a 148,9 para la interacción entre rs624833 ( ADD1 ) y rs686 ( DRD1 ), después de incluir todas las covariables (sexo, edad, IMC y componente genético ancestral); y de 303,7 a 154,3, para la interacción entre rs2066826 ( PTGS2 ) y rs624833 ( ADD1 ), luego de incluir todas las covariables (sexo, edad, IMC y componente genético ancestral). De manera contraria, para las interacciones por pares de marcadores restantes AGT rs4762 x DRD1 rs686; AGTR1 rs5186 x DRD1 rs686; y ATP2B1 rs2681472 x ADD1 rs624833, no fue posible encontrar convergencia entre las estimaciones de los coeficientes de regresión después de llegar al número máximo de iteraciones que permitió el programa empleado (700 iteraciones); es decir, que las estimaciones de los parámetros fueron diferentes en un valor mayor a 0,001, por lo cual no pudieron ser estimadas por el programa.
Análisis de asociación de los genes candidatos con niveles de presión arterial sistólica y diastólica
Al evaluar el efecto de los genotipos en los genes candidatos sobre los niveles de presión arterial sistólica y diastólica mediante ANOVA no paramétrica, no se encontraron diferencias significativas por genotipo para ninguno de los polimorfismos (46). Posteriormente, se incluyeron las covariables edad, sexo, IMC, edad e índices de ascendencia en un modelo multivariado de regresión lineal; ninguno de los marcadores en los genes candidatos presentaron una relación con presión arterial sistólica o diastólica. Los modelos muestran una relación directa del IMC con los niveles de presión arterial sistólica; un incremento de una unidad en el IMC incrementa en 0,048 y 0,047 desviaciones estándar los niveles de presión arterial sistólica y diastólica, respectivamente. De igual manera, la edad se relaciona directamente con los niveles de presión arterial sistólica y diastólica; un incremento en un año de edad responde por el incremento en 0,027 y 0,019 desviaciones estándar de los niveles de presión arterial sistólica y diastólica, de manera respectiva. Se observó que la proporción de mezcla genética amerindia es un factor protector independiente del IMC, la edad y el sexo; el incremento en el índice de ascendencia amerindia reduce en 1,5 desviaciones estándar la presión arterial diastólica; la relación de la ascendencia amerindia con los niveles de presión arterial sistólica no son significativos; sin embargo, se observa la misma tendencia que para la presión arterial diastólica.
Análisis de asociación entre composición ancestral e hipertensión arterial
Para el análisis de asociación entre los componentes ancestrales y la hipertensión arterial se empleó un modelo de regresión lineal multivariado, incluyendo las covariables sexo, edad, IMC y estrato socioeconómico; ninguno de los componentes ancestrales mostró asociación con hipertensión arterial. Sin embargo, los modelos muestran una asociación del índice de ascendencia africana con el IMC; por cada desviación estándar que aumenta la proporción de mezcla africana, se observa un aumento de 0,035 unidades en el IMC.
Asociación entre composición ancestral y niveles de presión arterial sistólica y diastólica
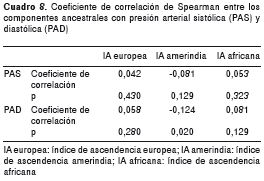
Se estimó la correlación entre cada componente ancestral y los niveles de presión arterial, tanto para presión arterial sistólica como para la diastólica (46). Se observó una correlación inversa y significativa entre el porcentaje de mezcla amerindia con los niveles de presión arterial sistólica; por cada incremento en el grado de mezcla ancestral amerindia, la presión arterial diastólica disminuyó en 0,12 mm Hg. Para la presión arterial sistólica se observó una tendencia en el mismo sentido, pero no es significativa (cuadro 8).
Discusión
En este estudio identificamos efectos principales de polimorfismos en los genes DRD1 , ADD2 y ADRB2 sobre el riesgo a hipertensión arterial después de ajustar por las variables de confusión edad, sexo, IMC y composición genética ancestral. Se encontró que las personas portadoras del alelo C del polimorfismo rs4852706 en el gen de la ß -aduccina ( ADD2 ), tienen un riesgo 2,0 veces (OR=2,02; p=0,013) el de las personas que no lo portan, de presentar hipertensión arterial. De la misma manera, se encontró que las personas que presentan los genotipos CC y CT para este mismo marcador, tienen una propensión a desarrollar hipertensión arterial de 3,0 veces el riesgo de las personas homocigotas T/T. Hasta el momento, no hay estudios reportados que evalúen el efecto que tiene la variante rs4852706 del gen ADD2 sobre la propensión a la hipertensión arterial. Sin embargo, otra variante ubicada en el mismo intrón se ha asociado previamente con variación en los valores de presión arterial en población caucásica (70,71). Esto puede indicar que en esta región existen una o más variantes en desequilibrio de ligamiento (DL) con las asociadas que aportan al riesgo de hipertensión, o que la variante rs4852706 se encuentra en DL con la asociada previamente en la población caucásica. Además, se han reportado estudios en los que se han evaluado otras variantes en el gen ADD2 que han mostrado estar asociadas con hipertensión arterial o rasgos hemodinámicos relacionados en poblaciones europeas (72), aunque las asociaciones no han sido constantes en otras poblaciones (72-74).
Por otro lado, se encontró asociación estadísticamente significativa entre el marcador rs1042718 en el gen del receptor ß -adrenérgico 2 y la hipertensión arterial, con el cual se observa que las personas portadoras de los genotipos CC y AC presentan 10 veces el riesgo de quienes portan el genotipo AA. Sin embargo, su intervalo de confianza es bastante amplio, lo cual puede deberse a la frecuencia tan baja del genotipo de referencia (AA) en esta muestra.
Hongyan Wu, et al ., han descrito resultados similares, quienes encontraron asociación significativa entre el alelo C del polimorfismo rs1042718 con hipertensión esencial en población asiática (75). El análisis se hizo en dos poblaciones chinas consideradas genéticamente aisladas y sólo se encontró asociación para una de ellas, lo cual sugiere una clara heterogeneidad genética para la variación en el gen ADRB2 relacionado con hipertensión esencial, aun entre poblaciones cercanamente relacionadas (75,76).
A pesar de estas evidencias a favor de la asociación entre el gen ADRB2 y la hipertensión o presión arterial, otros estudios han fallado al replicar dicha asociación en población caucásica (77,78) y en afroamericanos (79). En el estudio de Aristizábal, et al ., en población antioqueña, se evaluó la asociación entre 9 polimorfismos en ADRB2 y la presión arterial elevada, sin encontrarse asociación con ninguno de los SNP (47). No obstante, uno de los marcadores evaluados, el polimorfismo Arg16Gly que ha sido asociado con la propensión al desarrollar hipertensión arterial en otras poblaciones y cuyo alelo de riesgo Gly16 presenta una gran frecuencia en poblaciones latinas (80,81), se asoció con alteraciones hemodinámicas relacionadas con el gasto cardiaco en individuos homocigotos en dicho estudio (47).
El polimorfismo evaluado en el presente estudio, rs686 en el gen del receptor de dopamina 1, DRD1 , se encontró asociado con hipertensión arterial; la condición heterocigota A/G se relaciona con una reducción del 62 % en el riesgo de presentar hipertensión arterial, en comparación con las personas portadoras de los genotipos homocigotos AA y GG. Aunque en varios estudios se ha demostrado asociación del gen DRD1 con hipertensión arterial y fenotipos relacionados (51,82,83), no se ha reportado en la literatura asociación específicamente del polimorfismo rs686 con hipertensión arterial. Se eligió evaluar la asociación con este polimorfismo debido a su influencia comprobada, en los niveles de este receptor de dopamina. Se demostró que el polimorfismo se encuentra en el sitio de unión del microARN miR-504, localizado en la región 3´UTR del gen. El polimorfismo rs686 reside en la parte del 3´UTR complementaria a la secuencia de unión del miR-504; la adecuada complementariedad es crítica en la función de unión del microARN ; el cambio de A a G, reduce la unión del microARN y, por lo tanto, la eficiencia en el expresión del receptor de dopamina(84) este microARN actúa sobrerregulando la expresión del gen, de tal manera que habrá una mayor expresión de los receptores DRD1 en los individuos portadores del alelo A. Los efectos de la dopamina mediados por los receptores D1 (DRD1) se han asociado con la regulación de la presión arterial por medio de la estimulación de la diuresis y natriuresis, y del aumento de la vasodilatación (85,86). La activación de DRD1 por la dopamina responde por el 50 % de la excreción de sodio en condiciones basales (87); por ello, la deficiencia intrarrenal de dopamina puede llevar a hipertensión (88). Además, la secuencia que codifica el miR-504 se encuentra en el cromosoma X; por lo tanto, la modulación de la expresión de estos receptores por parte de este microARN puede jugar un papel importante en la influencia del sexo sobre el riesgo de hipertensión.
Es posible que en este estudio no se encontrara una asociación independiente significativa de las variantes rs2066826, rs4762, rs2863769, rs5186, rs624833, rs2681472, rs17249754 y rs4340, debido al tamaño de la muestra, lo cual le confiere un bajo poder (64 % para detectar variantes con un OR de 1,5), o a la heterogeneidad genética de la hipertensión arterial. Sin embargo, el efecto que algunas de estas variantes tienen sobre la propensión a la hipertensión arterial se pudo evidenciar al evaluar efectos de interacción por pares de genes. Se encontró una clara evidencia de interacción génica entre las combinaciones DRD1 - AGT , DRD1 - AGTR1 , ADD1 - DRD1 , PTGS2 - ADD1 y ATP2B1 - ADD1 . Los efectos de interacción entre los genes DRD1 - AGT y DRD1 - AGTR1 , son coherentes con hallazgos previos que reportan la existencia de interacción funcional entre los genes del sistema RAAS y el sistema dopaminérgico.
La dopamina renal es uno de los principales reguladores de la excreción de sodio renal con efectos natriuréticos y diuréticos (37). En forma similar a la dopamina, los péptidos del sistema renina-angiotensina-aldosterona RAS, contribuyen de manera importante a la regulación de la homeostasis del sodio por medio de los receptores AGTR1 y AGTR2, por lo cual se han llevado a cabo varios estudios con el fin de comprender la relación existente entre el sistema dopaminérgico y el sistema RAAS, encontrándose que existe una interacción entre estos factores (87,89). Se ha mostrado que, al envejecer, una exagerada función de los receptores renales AGTR1 está asociada con una disminución en la función del receptor DRD1 y con niveles elevados de presión arterial en modelos de ratón (90). Además, el efecto natriurético de DRD1 es potenciado durante el bloqueo de los receptores AGTR1 (91); y la dopamina, por medio de sus acciones en los receptores DRD1, disminuye la expresión del AGTR1 y los sitios de unión de la angiotensina II en las células del túbulo proximal renal (92,93).
Por otro lado, la interacción fisiológica entre DRD1 y ADD1 se ha reportado previamente en la literatura científica. La unión de la dopamina a DRD1 lleva a una inhibición de la reabsorción de sodio, al promover la internalización de las Na+/K+ATPasas; este mecanismo requiere la formación de vesículas revestidas de clatrina, para lo cual la participación de las proteínas de citoesqueleto aduccinas es clave (94). Se ha observado que en presencia de mutaciones en ADD1 no se no lleva a cabo la endocitosis de las Na+/K+ ATPasas, a pesar del estímulo por la dopamina, y por lo tanto, no se produce la inhibición esperada de la reabsorción de Na+ (39,94).
Asimismo, la interacción entre ADD1 y ATP2B1 corresponde con observaciones de que la ATPasas de calcio de membrana plasmática (ATP2Bs), además de participar en la regulación de la concentración de calcio intracelular en el corazón y los vasos, son moléculas implicadas en la modulación de las vías de transducción de señales dependientes de calcio. De este modo, se ha observado interacción funcional de las ATP2Bs con proteínas dependientes de la calmodulina como las sintasas de óxido nítrico endotelial, (eNOS) y neuronal (nNOS), y la cinasa de serina dependiente de calcio (CASK), entre otras (43,44,94,95). Por lo anterior, es posible que esta enzima se encuentre también modulando la función de las aduccinas, ya que estas proteínas dependen de la acción de la calmodulina (39).
De manera similar, los efectos de COX2 (PTGS2) se encuentran relacionados con la regulación de la presión arterial, participando principalmente en la síntesis de la prostaciclina PGI2, un importante vasodilatador, antiagregante plaquetario y estimulador de la diuresis (96,97). Aunque no se ha reportado interacción de PTGS2 con aduccinas, nuestro hallazgo es coincide con reportes previos que han mostrado que la expresión renal de PTGS2 se incrementa en condiciones que llevan a un aumento en la reabsorción de sodio (98,99). Por lo tanto, una asociación fisiológica de las proteínas de citoesqueleto aduccinas involucradas en la regulación de la concentración renal de sodio, con PTGS2, es posible.
Sin embargo, al realizar modelos de permutación para las interacciones observadas, quedaron validados los coeficientes de regresión y, por lo tanto, los OR obtenidos para las interacciones entre los polimorfismos rs624833 ( ADD1 ) y rs686 ( DRD1 ), y entre rs2066826 ( PTGS2 ) y rs624833 ( ADD1 ); pero no así para las interacciones entre rs4762 ( AGT ) y rs686 ( DRD1 ) o rs5186 ( AGTR1 ) y rs686 ( DRD1 ), ni para rs2681472 ( ATP2B1 ) y rs624833 ( ADD1 ), al hacer el número máximo de permutaciones que el programa permitió (700 iteraciones). Por tal razón, estudios posteriores que cuenten con un tamaño de muestra mayor podrían permitir una mejor claridad, al menos desde el punto de vista estadístico, de las relaciones epistáticas que pueden existir entre estos genes.
Por otro lado, se observó un efecto del componente genético ancestral amerindio, sobre la reducción en los niveles de presión arterial diastólica; sin embargo, no se encontró asociación entre el componente ancestral africano y la hipertensión arterial. En numerosos estudios se han demostrado que la prevalencia de la hipertensión arterial es bastante mayor en población afroamericana, comparada con otros grupos étnicos (5,6), y que la ascendencia africana se presenta como factor de riesgo para hipertensión (6,100,101). No obstante, la falla de nuestro estudio para encontrar un efecto del componente ancestral africano sobre la hipertensión arterial, puede explicarse porque la población antioqueña estudiada presenta un bajo componente genético ancestral africano (10 %), lo cual sumado al modesto tamaño de muestra, dificulta encontrar asociación con el rasgo en estudio.
Aunque la ascendencia amerindia se ha descrito como un factor de riesgo cardiovascular, se ha observado que la prevalencia de hipertensión arterial es menor en poblaciones amerindias (9,10), y, por lo tanto, también el riesgo para estas poblaciones. Así, el riesgo cardiovascular que aporta el componente ancestral amerindio, está relacionado con la mayor prevalencia observada de diabetes mellitus II en poblaciones indígenas americanas, que en poblaciones con mayor porcentaje de ascendencia europea (102,103). La baja prevalencia de hipertensión arterial observada en poblaciones amerindias, como los indígenas pima mejicanos, puede en parte explicarse por la menor actividad simpática, acompañada de una menor respuesta beta-adrenérgica, observada en estos individuos en comparación con población caucásica; estos mecanismos pueden contribuir al menor riesgo que presentan estas poblaciones de desarrollar hipertensión arterial. Al igual que lo reportado en nuestro estudio, en un trabajo en Perú, se encontró que los niveles de presión arterial son menores en individuos de ascendencia indígena, que en población europea (10,104). Estos resultados son similares a los obtenidos en un estudio de Kosoy, et al . (105), en el cual se evaluó la relación entre composición ancestral e hipertensión, usando las medidas de la presión arterial y mezcla individual, encontrándose una asociación del componente ancestral amerindio como factor protector para hipertensión arterial (105).
Nuestros hallazgos aportan al conocimiento de los complejos mecanismos implicados en el desarrollo de hipertensión arterial. Sin embargo, la principal limitación del estudio es el reducido tamaño de la muestra, lo cual hace que el estudio presente un modesto poder para detectar variantes con efectos pequeños (del 64 % para variantes con un OR de 1,5). Por lo tanto, es muy probable que en este estudio no se estén detectando asociaciones de factores de riesgo moderados. Aunque, como ya fue observado, el efecto de algunos polimorfismos pudo ser detectado cuando se hicieron los análisis de interacciones entre los genes de las vías reguladoras estudiadas, donde fueron evidentes los efectos de interacción génica sobre la etiología de la hipertensión arterial esencial en población antioqueña. Igualmente, pudo observarse el efecto del componente ancestral amerindio como factor protector para el desarrollo de hipertensión arterial en esta muestra de población.
Agradecemos el apoyo institucional de la Universidad de Antioquia y del Hospital Universitario San Vicente de Paúl, Laboratorio Clínico IPS Universitaria, a todas las personas que amablemente colaboraron con la donación de sus muestras y con su información, y al proyecto de sostenibilidad CODI UDEA 2013-2014.
Los autores declaran que no existe conflicto de intereses y que no hubo injerencia externa en el desarrollo de esta investigación.
El estudio fue financiado por COLCIENCIAS (proyecto No. 111545921593)
Correspondencia:
Diana María Valencia, Laboratorio de Genética Molecular, Universidad de Antioquia, Sede de Investigación Universitaria, Calle 62 Nº 52-59, torre 2, laboratorio 430, Medellín, Colombia.
Teléfono: (574) 219 6467; fax (574) 219 6469 dianav12@gmail.com
1. De Souza F, Muxfeldt ES, Salles GF. Prognostic factors in resistant hypertension: Implications for cardiovascular risk stratification and therapeutic management. Expert Rev Cardiovasc Ther. 2012;10:735-45. http://dx.doi.org/10.1586/erc.12.58 [ Links ]
2. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL, et al . Seventh report of the Joint National Committee on prevention, detection, evaluation, and treatment of high blood pressure. Hypertension. 2003;42:1206-52. http://dx.doi.org/10.1161/01.HYP.0000075790.33892.AE [ Links ]
3. Grundvold I, Skretteberg PT, Liestol K, Erikssen G, Kjeldsen SE, Arnesen H, et al . Upper normal blood pressures predict incident atrial fibrillation in healthy middle-aged men: A 35-year follow-up study. Hypertension. 2012;59:198-204. http://dx.doi.org/10.1161/HYPERTENSIONAHA.111.179713 [ Links ]
4. Kearney PM, Whelton M, Reynolds K, Muntner P, Whelton PK, He J. Global burden of hypertension: Analysis of worldwide data. Lancet. 2005;365:217-23. http://dx.doi.org/10.1016/S0140-6736(05)17741-1 [ Links ]
5. Wrobel MJ, Figge JJ, Izzo JL Jr. Hypertension in diverse populations: A New York State Medicaid clinical guidance document. J Am Soc Hypertens. 2011;5:208-29. http://dx.doi.org/10.1016/j.jash.2011.05.003 [ Links ]
6. Roger VL, Go AS, Lloyd-Jones DM, Benjamin EJ, Berry JD, Borden WB, et al . Heart disease and stroke statistics –2012 update: A report from the American Heart Association. Circulation. 2012;125:e2-e220. http://dx.doi.org/10.1161/CIR.0b013e31823ac046 [ Links ]
7. Fox ER, Young JH, Li Y, Dreisbach AW, Keating BJ, Musani SK, et al . Association of genetic variation with systolic and diastolic blood pressure among African Americans: The Candidate Gene Association Resource study. Hum Mol Genet. 2011;20:2273-84. http://dx.doi.org/10.1093/hmg/ddr092 [ Links ]
8. Hall JL, Duprez DA, Barac A, Rich SS. A review of genetics, arterial stiffness, and blood pressure in African Americans. J Cardiovasc Transl Res. 2012;5:302-8. http://dx.doi.org/10.1007/s12265-012-9362-y [ Links ]
9. Weyer C, Pratley RE, Snitker S, Spraul M, Ravussin E, Tataranni PA. Ethnic differences in insulinemia and sympathetic tone as links between obesity and blood pressure. Hypertension. 2000;36:531-7. [ Links ]
10. Lindgarde F, Soderberg S, Olsson T, Ercilla MB, Correa LR, Ahren B. Overweight is associated with lower serum leptin in Peruvian Indian than in Caucasian women: A dissociation contributing to low blood pressure? Metabolism.2001;50:325-9. http://dx.doi.org/10.1053/meta.2001.21033 [ Links ]
11. Santos PC, Alvim Rde O, Ferreira NE, de Sa Cunha R, Krieger JE, Mill JG, et al . Ethnicity and arterial stiffness in Brazil. Am J Hypertens. 2011;24:278-84. http://dx.doi.org/10.1038/ajh.2010.244 [ Links ]
12. Young JH, Chang YP, Kim JD, Chretien JP, Klag MJ, Levine MA, et al . Differential susceptibility to hypertension is due to selection during the out-of-Africa expansion.PLoS Genet. 2005;1:e82. http://dx.doi.org/10.1371/journal.pgen.0010082 [ Links ]
13. Jermendy G, Horvath T, Littvay L, Steinbach R, Jermendy AL, Tarnoki AD, et al . Effect of genetic and environmental influences on cardiometabolic risk factors: A twin study. Cardiovasc Diabetol. 2011;10:96. http://dx.doi.org/10.1186/1475-2840-10-96 [ Links ]
14. Harrison M, Maresso K, Broeckel U. Genetic determinants of hypertension: An update. Curr Hypertens Rep.2008;10:488-95. [ Links ]
15. Lifton RP, Gharavi AG, Geller DS. Molecular mechanisms of human hypertension. Cell. 2001;104:545-56. http://dx.doi.org/10.1016/S0092-8674(01)00241-0 [ Links ]
16. Chiong JR, Aronow WS, Khan IA, Nair CK, Vijayaraghavan K, Dart RA, et al . Secondary hypertension: Current diagnosis and treatment. Int J Cardiol. 2008;124:6-21. http://dx.doi.org/10.1016/j.ijcard.2007.01.119 [ Links ]
17. Cowley AW Jr. The genetic dissection of essential hypertension. Nat Rev Genet. 2006;7:829-40. http://dx.doi.org/10.1038/nrg1967 [ Links ]
18. Grossman E, Messerli FH. Drug-induced hypertension: An unappreciated cause of secondary hypertension. Am J Med. 2012;125:14-22. http://dx.doi.org/10.1016/j.amjmed.2011.05.024 [ Links ]
19. Czernichow S, Castetbon K, Salanave B, Vernay M, Barry Y, Batty GD, et al . Determinants of blood pressure treatment and control in obese people: Evidence from the general population. J Hypertens. 2012;30:2338-44. http://dx.doi.org/10.1097/HJH.0b013e3283593010 [ Links ]
20. Dorresteijn JA, Spiering W, van Der Graaf Y, Visseren FL. Relation between adiposity and hypertension persists after onset of clinically manifest arterial disease. J Hypertens.2012;30:2331-7. http://dx.doi.org/10.1097/HJH.0b013e328357f18a [ Links ]
21. Vollmer WM, Sacks FM, Ard J, Appel LJ, Bray GA, Simons-Morton DG, et al . Effects of diet and sodium intake on blood pressure: Subgroup analysis of the DASHsodium trial. Ann Intern Med. 2001;35:1019-28. http://dx.doi.org/10.7326/0003-4819-135-12-200112180-00005 [ Links ]
22. Kelly TN, He J. Genomic epidemiology of blood pressure salt sensitivity. J Hypertens. 2012;30:861-73. http://dx.doi.org/10.1097/HJH.0b013e3283524949. [ Links ]
23. Sugiyama T, Xie D, Graham-Maar RC, Inoue K, Kobayashi Y, Stettler N. Dietary and lifestyle factors associated with blood pressure among U.S. adolescents. J Adolesc Health. 2007;40:166-72. http://dx.doi.org/10.1016/j.jadohealth.2006.09.006 [ Links ]
24. Djordjevic J, Vuckovic T, Jasnic N, Cvijic G. Effect of various stressors on the blood ACTH and corticosterone concentration in normotensive Wistar and spontaneously hypertnesive Wistar-Kyoto rats. Gen Comp Endocrinol. 2007;153:217-20. http://dx.doi.org/10.1016/j.ygcen.2007.02.004, [ Links ]
25. Rojas J, Bermúdez V, Leal E, Aparicio D, Peña G, Acosta L, et al . Origen étnico y enfermedad cardiovascular. Archivos Venezolanos de Farmacología y Terapéutica. 2008;27:40-57. [ Links ]
26. Meng XJ, Dong GH, Wang D, Liu MM, Liu YQ, Zhao Y, et al . Epidemiology of prehypertension and associated risk factors in urban adults from 33 communities in China –the CHPSNE study. Circ J. 2012;76:900-6. http://dx.doi.org/10.1253/circj.CJ-11-1118 [ Links ]
27. Stiefel P, Vallejo-Vaz AJ, García S, Villar J. Role of the reninangiotensin system and aldosterone on cardiometabolic syndrome. Int J Hypertens. 2011;2011:685238. http://dx.doi.org/10.4061/2011/685238 [ Links ]
28. Wang CH, Li F, Takahashi N. The renin angiotensin system and the metabolic syndrome. Open Hypertens J. 2010;3:1-13. http://dx.doi.org/10.2174/1876526203010001 [ Links ]
29. Newton-Cheh C, Johnson T, Gateva V, Tobin MD, Bochud M, Coin L, et al . Genome-wide association study identifies eight loci associated with blood pressure. Nat Genet. 2009;41:666-76. http://dx.doi.org/10.1038/ng.361 [ Links ]
30. Kishi T, Hirooka Y, Konno S, Sunagawa K. Angiotensin II receptor blockers improve endothelial dysfunction associated with sympathetic hyperactivity in metabolic syndrome. J Hypertens. 2012;30:1646-55. http://dx.doi.org/10.1097/HJH.0b013e328355860e [ Links ]
31. Jeunemaitre X, Soubrier F, Kotelevtsev YV, Lifton RP, Williams CS, Charru A, et al . Molecular basis of human hypertension: Role of angiotensinogen. Cell. 1992;71:169-80. http://dx.doi.org/10.1016/0092-8674(92)90275-H [ Links ]
32. Stanzione R, Di Angelantonio E, Evangelista A, Barbato D, Marchitti S, Zanda B, et al . Beta2-adrenergic receptor gene polymorphisms and risk of ischemic stroke. Am J Hypertens. 2007;20:657-62. http://dx.doi.org/10.1016/j.amjhyper.2007.01.006 [ Links ]
33. Lu Y, Zhu H, Wang X, Snieder H, Huang Y, Harshfield GA, et al . Effects of dopamine receptor type 1 and Gs protein alpha subunit gene polymorphisms on blood pressure at rest and in response to stress. Am J Hypertens. 2006;19:832-6. http://dx.doi.org/10.1016/j.amjhyper.2006.01.006 [ Links ]
34. Beige J, Bellmann A, Sharma AM, Gessner R. Ethnic origin determines the impact of genetic variants in dopamine receptor gene (DRD1) concerning essential hypertension. Am J Hypertens. 2004;17:1184-7. http://dx.doi.org/10.1016/j.amjhyper.2004.07.013 [ Links ]
35. Gong M, Hubner N. Molecular genetics of human hypertension. Clin Sci (Lond). 2006;110:315-26. http://dx.doi.org/10.1042/CS20050208 [ Links ]
36. Hussain T, Lokhandwala MF. Renal dopamine receptors and hypertension. Exp Biol Med (Maywood). 2003;228:134-42. [ Links ]
37. Asghar M, Tayebati SK, Lokhandwala MF, Hussain T. Potential dopamine-1 receptor stimulation in hypertension management. Curr Hypertens Rep. 2011;13:294-302. http://dx.doi.org/10.1007/s11906-011-0211-1 [ Links ]
38. Torielli L, Tivodar S, Montella RC, Iacone R, Padoani G, Tarsini P, et al . Alpha-Adducin mutations increase Na/K pump activity in renal cells by affecting constitutive endocytosis: Implications for tubular Na reabsorption. Am J Physiol Renal Physiol. 2008;295:F478-87. http://dx.doi.org/10.1152/ajprenal.90226.2008 [ Links ]
39. Citterio L, Lanzani C, Manunta P, Bianchi G. Genetics of primary hypertension: The clinical impact of adducin polymorphisms. Biochim Biophys Acta. 2010;1802:1285-98. http://dx.doi.org/10.1016/j.bbadis.2010.03.014 [ Links ]
40. Schulz E, Gori T, Munzel T. Oxidative stress and endothelial dysfunction in hypertension. Hypertens Res. 2011;34:665-73. http://dx.doi.org/10.1038/hr.2011.39 [ Links ]
41. Higashi Y, Kihara Y, Noma K. Endothelial dysfunction and hypertension in aging. Hypertens Res. 2012;35:1039-47 http://dx.doi.org/10.1038/hr.2012.138 [ Links ]
42. Francois H, Athirakul K, Mao L, Rockman H, Coffman TM. Role for thromboxane receptors in angiotensin-IIinduced hypertension. Hypertension. 2004;43:364-9. http://dx.doi.org/10.1161/01.HYP.0000112225.27560.24 [ Links ]
43. Cartwright EJ, Oceandy D, Austin C, Neyses L. Ca2+ signalling in cardiovascular disease: The role of the plasma membrane calcium pumps. Sci China Life Sci. 2011;54:691-8. http://dx.doi.org/10.1007/s11427-011-4199-1 [ Links ]
44. Holton ML, Wang W, Emerson M, Neyses L, Armesilla AL. Plasma membrane calcium ATPase proteins as novel regulators of signal transduction pathways. World J Biol Chem.2010;1:201-8. http://dx.doi.org/10.4331/wjbc.v1.i6.201 [ Links ]
45. Mohana VU, Swapna N, Surender RS, Vishnupriya S, Padma T. Gender-related association of AGT gene variants (M235T and T174M) with essential hypertension –a casecontrol study. Clin Exp Hypertens. 2012;34:38-44. http://dx.doi.org/10.3109/10641963.2011.618207 [ Links ]
46. Di Pasquale P, Cannizzaro S, Paterna S. Does angiotensin-converting enzyme gene polymorphism affect blood pressure? Findings after 6 years of follow-up in healthy subjects. Eur J Heart Fail. 2004;6:11-6. http://dx.doi.org/10.1016/j.ejheart.2003.07.009 [ Links ]
47. Aristizábal DG, Ewen E, Caulfield J, Méndez M, Medina J, Zapata E, et al . Bases genéticas de la hipertensión arterial esencial en Colombia: avances en nueve años de estudio. Revista Colombiana de Cardiología. 2006;12:409-30. [ Links ]
48. Niu T, Yang J, Wang B, Chen W, Wang Z, Laird N, et al . Angiotensinogen gene polymorphisms M235T/T174M: No excess transmission to hypertensive Chinese. Hypertension. 1999;33:698-702. http://dx.doi.org/10.1161/01.HYP.33.2.698 [ Links ]
49. Tang Z, Li X, Liao D. Associations of polymorphisms in the beta2-adrenergic receptor gene with essential hypertension in Han Chinese population. Mol Biol Rep. 2012;39:9339-45. http://dx.doi.org/10.1007/s11033-012-1750-5 [ Links ]
50. Tomaszewski M, Brain NJ, Charchar FJ, Wang WY, Lacka B, Padmanabahn S, et al . Essential hypertension and beta2-adrenergic receptor gene: Linkage and association analysis. Hypertension. 2002;40:286-91. http://dx.doi.org/10.1161/01.HYP.0000029105.21202.FE [ Links ]
51. Krushkal J, Xiong M, Ferrell R, Sing CF, Turner ST, Boerwinkle E. Linkage and association of adrenergic and dopamine receptor genes in the distal portion of the long arm of chromosome 5 with systolic blood pressure variation. Hum Mol Genet. 1998;7:1379-83. http://dx.doi.org/10.1093/hmg/7.9.1379 [ Links ]
52. Lou YQ, Liu Y, Wu H, Wang ZG, Liu K, Li Y, et al . Relationship between genetic polymorphisms of beta2- adrenergic receptor gene and essential hypertension risk among the Han Chinese population: A meta-analysis. Zhonghua Yu Fang Yi Xue Za Zhi. 2011;45:136-42. [ Links ]
53. Orun O, Nacar C, Cabadak H, Tiber PM, Dogan Y, Guneysel O, et al . Investigation of the association between Dopamine D1 receptor gene polymorphisms and essential hypertension in a group of Turkish subjects. Clin Exp Hypertens. 2011;33:418-21. http://dx.doi.org/10.3109/10641963.2011.561898 [ Links ]
54. Tian XY, Wong WT, Leung FP, Zhang Y, Wang YX, Lee HK, et al . Oxidative stress-dependent cyclooxygenase-2- derived prostaglandin f(2alpha) impairs endothelial function in renovascular hypertensive rats. Antioxid Redox Signal. 2012;16:363-73. http://dx.doi.org/10.1089/ars.2010.3874 [ Links ]
55. Levy D, Ehret GB, Rice K, Verwoert GC, Launer LJ, Dehghan A, et al . Genome-wide association study of blood pressure and hypertension. Nat Genet. 2009;41:677-87. http://dx.doi.org/10.1038/ng.384 [ Links ]
56. Xi B, Tang W, Wang Q. Polymorphism near the ATP2B1 gene is associated with hypertension risk in East Asians: A meta-analysis involving 15 909 cases and 18 529 controls. Blood Press. 2012;21:134-8. http://dx.doi.org/10.3109/08037051.2012.632845. [ Links ]
57. Hong KW, Go MJ, Jin HS, Lim JE, Lee JY, Han BG, et al . Genetic variations in ATP2B1, CSK, ARSG and CSMD1 loci are related to blood pressure and/or hypertension in two Korean cohorts. J Hum Hypertens. 2010;24:367-72. http://dx.doi.org/10.1038/jhh.2009.86 [ Links ]
58. Hong KW, Jin HS, Lim JE, Kim S, Go MJ, Oh B. Recapitulation of two genomewide association studies on blood pressure and essential hypertension in the Korean population. J Hum Genet. 2010;55:336-41.http://dx.doi.org/10.1038/jhg.2010.31 [ Links ]
59. Price AL, Patterson N, Yu F, Cox DR, Waliszewska A, McDonald GJ, et al . A genomewide admixture map for Latino populations. Am J Hum Genet. 2007;80:1024-36. http://dx.doi.org/10.1086/518313 [ Links ]
60. Mao X, Bigham AW, Mei R, Gutiérrez G, Weiss KM, Brutsaert TD, et al. A genomewide admixture mapping panel for Hispanic/Latino populations. Am J Hum Genet. 2007;80:1171-8. http://dx.doi.org/10.1086/518564 [ Links ]
61. Chakraborty R, Weiss KM. Admixture as a tool for finding linked genes and detecting that difference from allelic association between loci. Proc Natl Acad Sci USA. 1988;85:9119-23. [ Links ]
62. Parra EJ, Marcini A, Akey J, Martinson J, Batzer MA, Cooper R, et al . Estimating African American admixture proportions by use of population-specific alleles. Am J Hum Genet. 1998;63:1839-51. http://dx.doi.org/10.1086/302148 [ Links ]
63. Shriver MD, Parra EJ, Dios S, Bonilla C, Norton H, Jovel C, et al . Skin pigmentation, biogeographical ancestry and admixture mapping. Hum Genet. 2003;112:387-99. http://dx.doi.org/10.1007/s00439-002-0896-y [ Links ]
64. Pickering TG, Hall JE, Appel LJ, Falkner BE, Graves J, Hill MN, et al . Recommendations for blood pressure measurement in humans and experimental animals: Part 1: Blood pressure measurement in humans: A statement for professionals from the Subcommittee of Professional and Public Education of the American Heart Association Council on High Blood Pressure Research. Hypertension. 2005;45:142-61. http://dx.doi.org/10.1161/01.HYP.0000150859.47929.8e [ Links ]
65. Sambrook JF, Fritsch EF, ManiatisT. Molecular cloning: A laboratory manual. 2nd edition. Cold Spring: Harbor Laboratory Press; 1989. p. 253. [ Links ]
66. Hoggart CJ, Parra EJ, Shriver MD, Bonilla C, Kittles RA, Clayton DG, et al . Control of confounding of genetic associations in stratified populations. Am J Hum Genet. 2003;72:1492-1504. http://dx.doi.org/10.1086/375613 [ Links ]
67. Hoggart CJ, Shriver MD, Kittles RA, Clayton DG, McKeigue PM. Design and analysis of admixture mapping studies. Am J Hum Genet. 2004;74:965-78. http://dx.doi.org/10.1086/420855 [ Links ]
68. Olsen SJ, Supawat K, Campbell AP, Anantapreecha S, Liamsuwan S, Tunlayadechanont S, et al . Japanese encephalitis virus remains an important cause of encephalitis in Thailand. Int J Infect Dis. 2010;14:e888-92. http://dx.doi.org/10.1016/j.ijid.2010.03.02 [ Links ]
69. Posada D, Buckley TR. Model selection and model averaging in phylogenetics: Advantages of akaike information criterion and bayesian approaches over likelihood ratio tests. Syst Biol. 2004;53:793-808. http://dx.doi.org/10.1080/10635150490522304 [ Links ]
70. Kardia SL, Sun YV, Hamon SC, Barkley RA, Boerwinkle E, Turner ST. Interactions between the adducin 2 gene and antihypertensive drug therapies in determining blood pressure in people with hypertension.BMC Med Genet. 2007;8:61. http://dx.doi.org/10.1186/1471-2350-8-61 [ Links ]
71. Kato N, Miyata T, Tabara Y, Katsuya T, Yanai K, Hanada H, et al . High-density association study and nomination of susceptibility genes for hypertension in the Japanese National Project. Hum Mol Genet. 2008;17:617-27. http://dx.doi.org/10.1093/hmg/ddm335 [ Links ]
72. Tikhonoff V, Kuznetsova T, Stolarz K, Bianchi G, Casiglia E, Kawecka-Jaszcz K, et al . Beta-Adducin polymorphisms, blood pressure, and sodium excretion in three European populations. Am J Hypertens. 2003;16:840-6. [ Links ]
73. Lanzani C, Citterio L, Jankaricova M, Sciarrone MT, Barlassina C, Fattori S, et al . Role of the adducin family genes in human essential hypertension. J Hypertens. 2005;23:543-9. [ Links ]
74. Niu T, Xu X, Cordell HJ, Rogus J, Zhou Y, Fang Z, et al . Linkage analysis of candidate genes and genegene interactions in chinese hypertensive sib pairs. Hypertension. 1999;33:1332-7. http://dx.doi.org/10.1161/01.HYP.33.6.1332 [ Links ]
75. Wu H, Tang W, Li H, Zhou X, Yang Y, Yu H, et al . Association of the beta2-adrenergic receptor gene with essential hypertension in the non-Han Chinese Yi minority human population. J Hypertens. 2006;24:1041-7. http://dx.doi.org/10.1097/01.hjh.0000226193.21311.e1 [ Links ]
76. Ge D, Huang J, He J, Li B, Duan X, Chen R, et al . Beta2-Adrenergic receptor gene variations associated with stage-2 hypertension in northern Han Chinese. Ann Hum Genet. 2005;69:36-44. http://dx.doi.org/10.1046/j.1529-8817.2003.00093.x [ Links ]
77. Wu H TW, Li H, Zhou X, Yang Y, Yu H, Li K, Xiao C, Deng AY. Association of the beta2-adrenergic receptor gene with essential hypertension in the non-Han Chinese Yi minority human population. J Hypertens. 2006 24:1041-7. http://dx.doi.org/10.1097/01.hjh.0000226193.21311.e1 [ Links ]
78. Wessel J MG, Rao F, Mahata M, Zhang L, Greene W, Rana BK, et al . C-reactive protein, an ´intermediate phenotype´ for inflammation: Human twin studies reveal heritability, association with blood pressure and the metabolic syndrome, and the influence of common polymorphism at catecholaminergic/beta-adrenergic pathway loci. J Hypertens. 2007;25:329-43. http://dx.doi.org/10.1097/HJH.0b013e328011753e [ Links ]
79. Bao X, Mills PJ, Rana BK, Dimsdale JE, Schork NJ, Smith DW, et al . Interactive effects of common beta2-adrenoceptor haplotypes and age on susceptibility to hypertension and receptor function. Hypertension. 2005;46:301-7. http://dx.doi.org/10.1161/01.HYP.0000175842.19266.95 [ Links ]
80. Pereira AC, Floriano MS, Mota GF, Cunha RS, Herkenhoff FL, Mill JG, et al . Beta2 adrenoceptor functional gene variants, obesity, and blood pressure level interactions in the general population. Hypertension. 2003;42:685-92. http://dx.doi.org/10.1161/01.HYP.0000085648.65419.17 [ Links ]
81. Rupert JL, Monsalve MV, Devine DV, Hochachka PW. Beta2-adrenergic receptor allele frequencies in the Quechua, a high altitude native population. Ann Hum Genet. 2000;64:135-3. http://dx.doi.org/10.1017/S0003480000008009S0003480000008009 [ Links ]
82. Staessen JA, Kuznetsova T, Zhang H, Maillard M, Bochud M, Hasenkamp S, et al . Blood pressure and renal sodium handling in relation to genetic variation in the DRD1 promoter and GRK4. Hypertension. 2008;51:1643-50. http://dx.doi.org/10.1161/HYPERTENSIONAHA.107.109611 [ Links ]
83. Fung MM, Rana BK, Tang CM, Shiina T, Nievergelt CM, Rao F, et al . Dopamine D1 receptor (DRD1) genetic polymorphism: Pleiotropic effects on heritable renal traits. Kidney Int. 2009;76:1070-80. http://dx.doi.org/10.1038/ki.2009.306 [ Links ]
84. Huang W, Li MD. Differential allelic expression of dopamine D1 receptor gene (DRD1) is modulated by microRNA miR-504. Biol Psychiatry. 2009;65:702-5. http://dx.doi.org/10.1016/j.biopsych.2008.11.024 [ Links ]
85. Felder CC, Albrecht FE, Campbell T, Eisner GM, Jose PA. cAMP-independent, G protein-linked inhibition of Na+/H+ exchange in renal brush border by D1 dopamine agonists. Am J Physiol. 1993;264:F1032-7. [ Links ]
86. Ladines CA, Zeng C, Asico LD, Sun X, Pocchiari F, Semeraro C, et al . Impaired renal D(1)-like and D(2)- like dopamine receptor interaction in the spontaneously hypertensive rat. Am J Physiol Regul Integr Comp Physiol. 2001;281:R1071-8. [ Links ]
87. Padia SH, Kemp BA, Howell NL, Keller SR, Gildea JJ, Carey RM. Mechanisms of dopamine d1 and angiotensin type 2 receptor interaction in natriuresis. Hypertension. 2011;59:437-45. http://dx.doi.org/10.1161/HYPERTENSIONAHA.111.184788 [ Links ]
88. Zhang MZ, Yao B, Wang S, Fan X, Wu G, Yang H, et al . Intrarenal dopamine deficiency leads to hypertension and decreased longevity in mice. J Clin Invest. 2011;121:2845-54. http://dx.doi.org/10.1172/JCI57324 [ Links ]
89. Khan F, Spicarova Z, Zelenin S, Holtback U, Scott L, Aperia A. Negative reciprocity between angiotensin II type 1 and dopamine D1 receptors in rat renal proximal tubule cells. Am J Physiol Renal Physiol. 2008;295:F1110-6. http://dx.doi.org/10.1152/ajprenal.90336.2008 [ Links ]
90. Chugh G, Lokhandwala MF, Asghar M. Oxidative stress alters renal D1 and AT1 receptor functions and increases blood pressure in old rats. Am J Physiol Renal Physiol. 2010;300:F133-8. http://dx.doi.org/10.1152/ajprenal.00465.2010 [ Links ]
91. Zeng C, Luo Y, Asico LD, Hopfer U, Eisner GM, Felder RA, et al . Perturbation of D1 dopamine and AT1 receptor interaction in spontaneously hypertensive rats. Hypertension. 2003;42:787-92. http://dx.doi.org/10.1161/01.HYP.0000085334.34963.4E [ Links ]
92. Yang S, Yao B, Zhou Y, Yin H, Zhang MZ, Harris RC. Intrarenal dopamine modulates progressive angiotensin II-mediated renal injury. Am J Physiol Renal Physiol. 2012;302:F742-9. http://dx.doi.org/10.1152/ajprenal.00583.2011 [ Links ]
93. Zeng C, Jose PA . Dopamine receptors: Important antihypertensive counterbalance against hypertensive factors. Hypertension. 2011;57:11-7. http://dx.doi.org/10.1161/HYPERTENSIONAHA.110.157727 [ Links ]
94. Rosskopf D, Schurks M, Rimmbach C, Schafers R. Genetics of arterial hypertension and hypotension. Naunyn Schmiedebergs Arch Pharmacol. 2007;374:429-69. http://dx.doi.org/10.1007/s00210-007-0133-2 [ Links ]
95. Holton M, Mohamed TM, Oceandy D, Wang W, Lamas S, Emerson M, et al . Endothelial nitric oxide synthase activity is inhibited by the plasma membrane calcium ATPase in human endothelial cells. Cardiovasc Res. 2010;87:440-8. http://dx.doi.org/10.1093/cvr/cvq077 [ Links ]
96. Yu Y, Ricciotti E, Scalia R, Tang SY, Grant G, Yu Z, et al . Vascular COX-2 modulates blood pressure and thrombosis in mice. Sci Transl Med. 2012;4:132ra54. http://dx.doi.org/10.1126/scitranslmed.3003787 [ Links ]
97. Green T, González AA, Mitchell KD, Navar LG. The complex interplay between cyclooxygenase-2 and angiotensin II in regulating kidney function. Curr Opin Nephrol Hypertens. 2012;21:7-14. http://dx.doi.org/10.1097/MNH.0b013e32834d9d75. [ Links ]
98. Jaimes EA, Zhou MS, Pearse DD, Puzis L, Raij L. Upregulation of cortical COX-2 in salt-sensitive hypertension: Role of angiotensin II and reactive oxygen species. Am J Physiol Renal Physiol. 2008;294:F385-92. http://dx.doi.org/10.1152/ajprenal.00302.2007 [ Links ]
99. Jaimes EA, Tian RX, Pearse D, Raij L. Up-regulation of glomerular COX-2 by angiotensin II: Role of reactive oxygen species. Kidney Int. 2005;68:2143-53. http://dx.doi.org/10.1111/j.1523-1755.2005.00670.x [ Links ]
100. Ong KL, Cheung BM, Man YB, Lau CP, Lam KS. Prevalence, awareness, treatment, and control of hypertension among United States adults 1999-2004. Hypertension. 2007; 49:69-75. http://dx.doi.org/10.1161/01.HYP.0000252676.46043.18 [ Links ]
101. Fields LE, Burt VL, Cutler JA, Hughes J, Roccella EJ, Sorlie P. The burden of adult hypertension in the United States 1999 to 2000: A rising tide. Hypertension. 2004;44:398-04. http://dx.doi.org/10.1161/01.HYP.0000142248.54761.56 [ Links ]
102. Martínez-Marignac VL, Valladares A, Cameron E, Chan A, Perera A, Globus-Goldberg R, et al . Admixture in Mexico City: Implications for admixture mapping of type 2 diabetes genetic risk factors. Hum Genet. 2007;120:807-19. http://dx.doi.org/10.1007/s00439-006-0273-3 [ Links ]
103. Florez JC, Price AL, Campbell D, Riba L, Parra MV, Yu F, et al . Strong association of socioeconomic status with genetic ancestry in Latinos: Implications for admixture studies of type 2 diabetes. Diabetologia. 2009;52:1528-36. http://dx.doi.org/10.1007/s00125-009-1412-x [ Links ]
104. Tataranni PA, Christin L, Snitker S, Paolisso G, Ravussin E. Pima Indian males have lower betaadrenergic sensitivity than Caucasian males. J Clin Endocrinol Metab. 1998;83:1260-3. [ Links ]
105. Kosoy R, Qi L, Nassir R, García L, Allison M, Shigeta R, et al . Relationship between hypertension and admixture in post-menopausal African American and Hispanic American women. J Hum Hypertens. 2012;26:365-73. http://dx.doi.org/10.1038/jhh.2011.52 [ Links ]













