Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157
Biomédica vol.33 supl.1 Bogotá set. 2013
https://doi.org/10.7705/biomedica.v33i0.735
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v33i0.735
1 Grupo de Investigación en Ciencias Veterinarias, Centauro, Universidad de Antioquia, Medellín, Colombia
2 Grupo de Inmunovirología, Universidad de Antioquia, Medellín, Colombia
3 Instituto Colombiano de Medicina Tropical, Universidad CES, Medellín, Colombia
Contribución de los autores:
Juan Carlos Quintero contribuyó con el diseño del estudio, la elaboración de las pruebas diagnósticas en laboratorio, participó en las salidas de campo, realizó la clasificación taxonómica de ectoparásitos y desarrolló el análisis.
Andrés Felipe Londoño participó en el diseño del estudio, las salidas de campo y la clasificación taxonómica de pequeños mamíferos.
Francisco Javier Díaz llevó a cabo el análisis filogenético y contribuyó al análisis.
Piedad Agudelo-Flórez colaboró en el diseño del estudio.
Margarita Arboleda realizó la revisión médica de pacientes sintomáticos en el Instituto Colombiano de Medicina Tropical.
Juan David Rodas participó en el diseño del estudio, las salidas de campo y el análisis.
Todos los autores participaron en la revisión y discusión del manuscrito final.
Recibido: 10/05/12; aceptado: 02/09/12
Introducción. Las rickettsias son bacterias patógenas usualmente transmitidas por ectoparásitos, como garrapatas, piojos o pulgas. En la última década se presentaron tres brotes de rickettsiosis con casos fatales en la región noroccidental de Antioquia y en un municipio limítrofe de Córdoba.
Objetivo. Describir la ecología y la epidemiología de las infecciones por Rickettsia spp. en el Urabá antioqueño.
Materiales y métodos. Se obtuvieron muestras de 354 roedores y se recolectaron 839 ectoparásitos de estos en los municipios de Apartadó, Turbo y Necoclí. Asimismo, se obtuvieron 220 sueros humanos. Estas muestras fueron estudiadas por reacción en cadena de la polimerasa (PCR) e inmunofluorescencia indirecta (IFI) para la detección de infección por rickettsias.
Resultados. Por IFI se detectaron anticuerpos antirickettsias en 130 (43 %) de los roedores y en 53 (24 %) de los sueros humanos estudiados. Además, se amplificaron secuencias del gen gltA específicas del género Rickettsia en 23 (6,8 %) muestras de hígado de roedores, las cuales mostraron una similitud del 98,7 % con R. prowazekii . Una secuencia de gltA obtenida de larvas de garrapatas del género Amblyomma sp., tuvo una identidad mayor de 99 % con las secuencias de R. tamurae .
Conclusión. Estos resultados demuestran la circulación de rickettsias en roedores, ectoparásitos y humanos en los municipios estudiados.
Palabras clave: Rickettsia , vectores de enfermedades, fiebre maculosa de las montañas rocosas, fiebre tifoidea, diagnóstico, Colombia
doi: http://dx.doi.org/10.7705/biomedica.v33i0.735
Ecoepidemiology of rickettsial infection in rodents, ectoparasites and humans in northeastern Antioquia, Colombia
Introduction: Rickettsia spp. are tick, flea or lice-borne pathogenic bacterium, usually carried by rodents. In the last decade three outbreaks of rickettsial disease including fatalities, occurred in the provinces of Antioquia and Córdoba in northwestern Colombia.
Objective: The purpose of this study was to perform an ecological and epidemiological description of the Rickettsia spp infection in the recently affected region of Colombia.
Materials and methods: Samples were obtained from 354 rodents and their parasites captured in the municipalities of Apartadó, Turbo and Necoclí. Likewise, 220 human sera were also collected, for detection of infection by Rickettsia spp.
Results: Indirect immunofluorescence assay (IFA) revealed that 130 (43%) of the rodents and 53 (24%) of the humans produced antibodies to Rickettsia spp. Additionally, rickettsial DNA was amplified by PCR from 23 (6.8%) rodent liver samples using primers directed to the genus specific gltA gene. While gltA sequences from rodent samples exhibited a 98.7% similitude with R . prowazekii, a sequence amplified from larvae of Amblyomma sp exhibited identities of >99% similarity with R. tamurae .
Conclusion: These results demonstrate the presence of rickettsia in rodents, ectoparasites and humans throughout the municipalities studied.
Key words: Rickettsia , disease vectors, Rocky Mountain spotted fever, typhoid fever, diagnosis , Colombia.
doi: http://dx.doi.org/10.7705/biomedica.v33i0.735
Las rickettsias son bacterias Gram negativas pequeñas que se reproducen intracelularmente y que producen infecciones sistémicas con compromiso prominente del endotelio vascular, lo cual conduce a enfermedades de gravedad variable, algunas de ellas potencialmente fatales, como el tifus epidémico y la fiebre manchada de las Montañas Rocosas (1). Las rickettsias son transmitidas por vectores artró-podos, principalmente garrapatas, ácaros, piojos y pulgas (1,2), aunque también se ha demostrado la transmisión por medio de aerosoles (3). Los roedores, tanto silvestres como sinantrópicos, son huéspedes frecuentes de estos artrópodos, especialmente durante sus estadios inmaduros, lo cual los convierte en potenciales reservorios de rickettsias.
El género Rickettsia pertenece a la familia Rickettsiaceae, del orden Rickettsiales. Este género se subdividió recientemente en cuatro grupos, conocidos como: el grupo de la fiebres manchadas ( Spotted Fever Group ), en el cual se encuentran las especies R. rickettsii , R. conorii y R. peacockii , entre otras; el grupo de los tifus dentro del cual se encuentran R. typhi y R. prowazekii ; el grupo transicional conformado por R. felis y R. akari ; y por último, el grupo ancestral que incluye a R. canadensis y R. bellii (1).
En Colombia, las enfermedades causadas por rickettsias fueron descritas por primera vez en 1937, cuando se presentó un brote epidémico de un síndrome febril grave, el cual tuvo una letalidad del 95 % en el municipio de Tobia, Cundinamarca. En ese entonces, se identificaron bacterias que parecían corresponder a Rickettsia spp. como el agente causal del síndrome, y a la forma clínica observada se le llamó fiebre de Tobia (4). A pesar de la alta letalidad de dicho brote, en los siguientes 70 años no se reportaron otros casos y solo en el 2005 se hizo un estudio serológico en Villeta (Cundinamarca), el cual arrojó, una seroprevalencia de 40,3 % en personas sanas, lo que indicaba la permanencia del agente y la frecuente exposición al mismo en esa región (5).
En años recientes se presentaron tres brotes sucesivos de enfermedad por rickettsias en los municipios de Necoclí (Antioquia, 2006), Los Córdobas (Córdoba, 2007) y Turbo (Antioquia, 2008), todos ellos en el noroeste de Colombia. Estos se manifestaron como síndromes febriles, acompañados de hipotensión, choque y falla respiratoria aguda, y tuvieron una gran letalidad. En todos ellos se identificó R. rickettsii como el agente causal de los casos fatales (6-8). A partir de estos brotes se llevó a cabo un estudio exploratorio de factores de riesgo para rickettsiosis en Necoclí, en el cual se encontró una seroprevalencia de anticuerpos IgG antirrickettsias de 29,2 % y un mayor riesgo para la población que habita en zonas rurales (7). Por otra parte, en un estudio conducido en el 2008 en el departamento de Caldas, se encontraron anticuerpos contra R. typhi en 14 de 120 pacientes con síndrome febril y con reacción positiva de Weil-Félix (9).
Los anteriores reportes evidencian la presentación de rickettsiosis en Colombia, en ocasiones con una alta letalidad, y muestran que es necesario emprender estudios que describan los factores que favorecen la aparición de los brotes . En particular, es urgente identificar los huéspedes vertebrados e invertebrados que mantienen el ciclo enzoótico de estas bacterias, así como las condiciones que favorecen su transmisión a los humanos , con el propósito de mejorar la comprensión, la vigilancia epidemiológica y el control de la enfermedad .
Materiales y métodos
Ubicación geográfica
El trabajo se llevó a cabo en tres municipios del Urabá antioqueño: Apartadó, Turbo y Necoclí, los cuales se ubican a 344, 373 y 424 km al noroeste de Medellín, y una altitud de 25, 3 y 8 msnm, respectivamente. La temperatura y la precipitación promedio para los tres municipios son de 28 °C y de 2.500 mm.
Captura y toma de muestra de roedores
Se capturaron roedores silvestres y sinantrópicos en zonas rurales y urbanas de los tres municipios previamente mencionados. Las capturas se hicieron con trampas tipo Tomahawk y Sherman, cebadas con hojuelas de avena, esencia de vainilla y mantequilla de maní (10).
Con el fin de obtener un buen nivel de confianza en los resultados, y ante la ausencia de datos exactos sobre el universo de estudio, el muestreo se basó en una población de más de 100.000 roedores, probablemente mayor a la real, tomando como límite de confianza el 95 % y aceptando un error del 5 %, se estimó una muestra de 333 especímenes. Las capturas se hicieron durante una semana cada mes, por un periodo de 14 meses. Las muestras se tomaron tal como fue descrito por Londoño, et al . (11). Brevemente, a los roedores capturados se les anestesió con una mezcla de ketamina y xilazina. Se registraron variables tales como peso, sexo y medidas corporales (10), y se identificó la especie por métodos morfométricos de acuerdo con las claves taxonómicas disponibles (12-16). Los roedores se clasificaron con la colaboración del Laboratorio de Mastozoología de la Universidad de Antioquia. Igualmente, se tomó una muestra de sangre por punción cardiaca, para detectar anticuerpos antirrickettsias.
Los animales capturados, aún anestesiados, se sometieron a eutanasia con una sobredosis de pentotal sódico y, posteriormente, se les extrajo el hígado, que fue usado para obtener el ADN.
Colección de ectoparásitos
Los ectoparásitos presentes en los animales fueron recolectados, identificados y transportados, según los protocolos recomendados por el Instituto Nacional de Salud de Colombia (17). Los ectoparásitos se clasificaron en el Laboratorio de Entomología del grupo PECET de la Universidad de Antioquia, utilizando claves taxonómicas previa-mente descritas (18,19).
Extracción y amplificación del material genético
Las muestras de hígado obtenidas de los roedores capturados se procesaron para la extracción de ADN, utilizando un método basado en columnas de sílica gel (QIAamp DNA Mini Kit , Qiagen), siguiendo las instrucciones del fabricante. Igualmente, se extrajo ADN de los ectoparásitos, en forma individual para los adultos previamente clasificados de acuerdo con su especie, sexo, huésped y procedencia. Los artrópodos en estadios inmaduros se distribuyeron en grupos, cuando fueron recolectados del mismo roedor y pertenecían al mismo grupo taxonómico.
El ADN obtenido de roedores y de vectores se amplificó, usando Supermix ® (Invitrogen, Brasil), para evidenciar la presencia o ausencia del ADN de rickettsias (17). Se hicieron dos amplificaciones por reacción en cadena de polimerasa (PCR), la primera con cebadores para el gen de la citrato-sintasa ( gltA ) común a todos los miembros del género Rickettsia , y la segunda, con cebadores para el gen ompA específico de rickettsias del grupo de las fiebres manchadas (20).
Análisis filogenético
Los productos de la PCR del gen gltA fueron enviados para su secuenciación en un servicio comercial (Macrogen, Corea). Las secuencias obtenidas se alinearon con secuencias homólogas de otras rickettsias disponibles en el GenBank , utilizando el programa Clustal X (21). Los métodos filogenéticos empleados fueron el análisis de probabilidades bayesianas con el modelo de substitución general con tiempo reversible y el análisis por distancias genéticas con el algoritmo de neighbor-joining con las distancias estimadas según el modelo de sustitución de Hasegawa-Kishino-Yano. Estos análisis se hicieron con los programa MrBayes 3.1.2 y PAUP v. 4.10, respectivamente (22).
Selección y muestreo de humanos
El estudio en la población humana se hizo en pacientes que acudían a la sede del Instituto Colombiano de Medicina Tropical, ubicada en el Hospital Regional de Apartadó, o a los hospitales locales de Turbo y Necoclí. Los participantes se seleccionaron por conveniencia, ingresando al estudio los individuos que se ajustaran a alguno de los siguientes criterios de inclusión: a) pacientes con historia de síndrome febril indiferenciado de, al menos, una semana de evolución, con prueba de gota gruesa negativa para malaria; b) pacientes con síndrome febril y cuadro respiratorio agudo o con evidencia radiológica de infiltrado intersticial pulmonar que requirieran asistencia respiratoria; y c) pacientes con fiebre y trastornos hemorrágicos.
A los pacientes que cumplían con alguno de estos criterios se les tomaron muestras de sangre sin anticoagulante para obtener suero, el cual se almacenó a -20 °C hasta su análisis. En la medida de lo posible, se tomaron dos muestras para estos estudios serológicos, la primera durante la fase aguda o sintomática, y la segunda, correspondiente a la fase de convalecencia, 15 a 20 días después de la primera muestra.
Prueba serológica
La detección de anticuerpos de tipo IgG contra rickettsias del grupo de las fiebres manchadas, tanto en muestras de suero de humanos como de roedores, se llevó a cabo por inmunofluorescencia indirecta (IFI). Se usaron placas de múltiples pozos sensibilizadas con antígeno de R. rickettsii . A cada pozo se le adicionaron 10 µl del suero en una dilución de 1:64. Después de incubar durante 30 minutos a 37 °C y de dos lavados, se adicionó una gota de anticuerpo conjugado con isotiocianato de fluoresceína correspondiente a la especie evaluada (anti-IgG humana, anti-IgG de rata o anti-IgG de ratón, Sigma-Aldrich, St. Louis, MO) por pozo. Después de un nuevo periodo de incubación y de nuevos lavados, se hizo una contratinción con azul de Evans y se leyó en un microscopio de fluorescencia. En cada placa se incluyeron sueros de control negativo y positivo. Se consideraron positivos los sueros que reaccionaron en una dilución de 1:64. Las muestras pareadas con resultados positivos fueron tituladas hasta la máxima dilución reactiva (23,24).
Análisis estadístico
Se hizo un análisis descriptivo de la infección por rickettsias en los roedores, ectoparásitos y humanos.
Se tuvieron en cuenta las siguientes variables: en roedores, sexo, género, edad, especie, presencia o ausencia de ectoparásitos, fecha de captura, municipio, zona geográfica y sitio específico donde se colocaron las trampas; en humanos, sexo, edad, municipio de consulta médica, lugar de residencia, ocupación, convivencia con animales, disposición de basuras, presencia o ausencia de alcantarillado, roedores en sus viviendas y exposición a ectoparásitos.
También, se hizo un análisis factorial de correspon-dencia múltiple para asociar las frecuencias de infección con las variables evaluadas en los humanos y roedores, donde las variables categóricas activas fueron: presencia o ausencia de la infección detectada por PCR o por IFI, y presencia o ausencia de ectoparásitos. Las variables categóricas suplementarias fueron todas las tenidas en cuenta en los pacientes muestreados y en roedores antes mencionadas. Los análisis estadísticos descriptivos se hicieron en el paquete estadístico SAS (25) y, el análisis factorial de correspondencia múltiple, en el paquete SPAD , versión 5.6 (26).
Aspectos éticos
Los procedimientos llevados a cabo en humanos fueron revisados y aprobados por el Comité de Ética Humana de la Facultad de Medicina de la Universidad de Antioquia. Igualmente, el Comité de Ética en la Experimentación Animal de la Sede de Investigación Universitaria de la Universidad Antioquia y la Corporación Ambiental Regional, Corpourabá, aprobaron los procedimientos de captura y muestreo realizados en los roedores en la zona de estudio.
Resultados
Identificación de roedores capturados
El muestreo de roedores de este estudio, es el mismo descrito por Londoño, et al ., para la detección de virus transmitidos por roedores (11). Brevemente, durante 56 noches de muestreo con 66 trampas, se capturaron 354 roedores en los tres municipios (Apartadó, Turbo y Necoclí), lo que representó un éxito de captura del 9,6 %. De los animales obtenidos, 124 (35%) fueron clasificados como Rattus rattus , 24 (6,8 %), como Rattus norvegicus , 71 (20,1 %), como Mus musculus , 109 (30,7 %), como Zygodontomys cherrei , 22 (6,2 %), como Proechimys semiespinosus , y 4 (1,1 %), como Heteromys anomalus .
Identificación de ectoparásitos
Se recolectaron 839 ectoparásitos en 94 roedores, de los cuales, 96 (11,4 %) eran garrapatas, 138 (16,4 %) pulgas, 168 (20,0 %) piojos, y 437 (52,1 %) ácaros. La mayoría de las garrapatas recolectadas estaban en estadio de larva y correspondían a garrapatas blandas (familia Argasidae ) que fueron clasificadas en la especie Ornithodoros (Alecterobius) puertoricensis . Las demás fueron larvas y ninfas de garrapatas duras (familia Ixodidae ), todas ellas del género Amblyomma spp. Las pulgas recolectadas se clasificaron como Xenopsylla cheopis y Polygenis sp. Los piojos se clasificaron dentro de los géneros Gyropus sp. y Hoplopleura sp. y, por último, los ácaros se identificaron como pertenecientes a los géneros Laelaps sp. y Ornithonyssus sp. (figura 1).
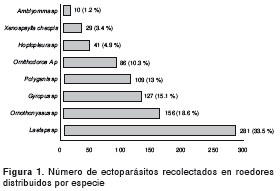
Distribución de los ectoparásitos recolectados en los roedores capturados
Las garrapatas blandas (familia Argasidae ) fueron casi exclusivamente recolectadas de especímenes del género Ratus y las duras (principalmente larvas y ninfas de la familia Ixodidae y género Amblyomma sp.) se encontraron en roedores Z. cherrei y P. semiespinosus. Las pulgas Xenopsylla cheopis se detectaron únicamente en R. norvegicus y las del género Polygenis sp. se encontraron uniformemente distribuidas en casi todas las especies de roedores capturados. Finalmente, los piojos del género Gyropus sp. solo se recolectaron de Z. cherrei y P. semiespinosus , y los del género Hoplopleura sp., únicamente de Z. cherrei , pero los ácaros ( Laelaps sp. y Ornithonyssus sp.) se recolectaron de casi todas las especies de roedores capturados (no se presentan los datos).
Frecuencia de infección por Rickettsia spp. en roedores
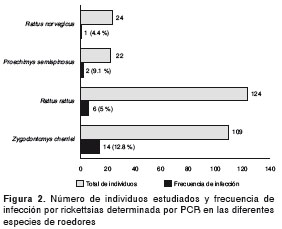
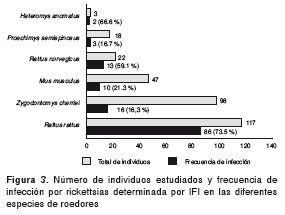
Se extrajo ADN de muestras de hígado de 335 roedores, a las cuales se les practicó PCR para el gen gltA . De estas muestras, 23 fueron positivas, resultando en una frecuencia de infección del 6,8 %. Todos los roedores positivos procedían del corregimiento Las Changas del municipio de Necoclí, excepto un R. norvegicus que fue capturado en la zona urbana del municipio de Turbo. Todas las especies de roedores capturadas fueron positivas en algún grado, excepto M. musculus y H. anomalus . En la figura 2 se presentan los números y frecuencias de infección por PCR en cada una de las especies de roedores. Además, mediante IFI se midió la frecuencia total y por especie de los anticuerpos IgG antirrickettsias en los roedores capturados. La frecuencia total de infección para los animales recolectados fue de 43 % y las frecuencias discriminadas por especie se presentan en la figura 3.
Análisis filogenéticos
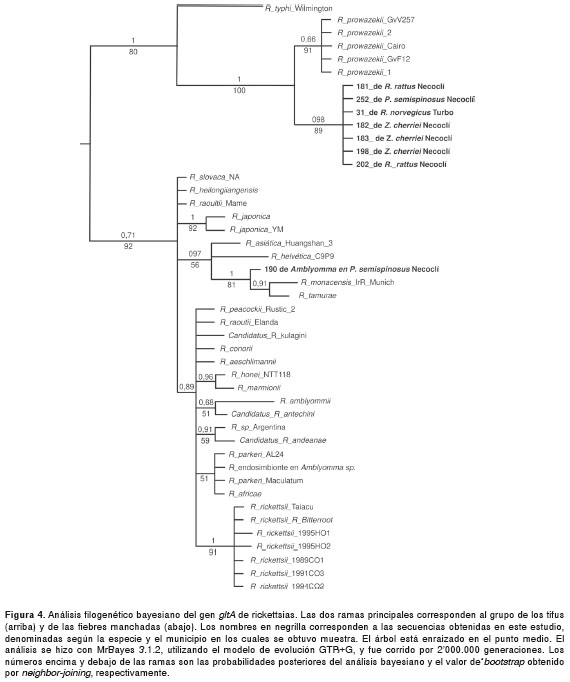
Los análisis filogenéticos por los métodos bayesiano y de neighbor-joining de las secuencias del gen gltA , fueron congruentes y permitieron clasificar las secuencias obtenidas dentro de los grupos de rickettsias previamente establecidos. En la figura 4 se presenta el árbol filogenético obtenido por análisis bayesiano. Las secuencias amplificadas a partir de hígado de siete roedores, fueron idénticas entre sí y formaron un grupo monofilético con gran soporte de la rama, tanto por bootstrap (89 %) como por probabilidad posterior (0,98). Estas secuencias aparecen dentro de las rickettsias del grupo de los tifus y exhiben una similitud de 98,7 % y 94,4 % con las secuencias homólogas de R. prowazekii y R. thypi , respectivamente. La única secuencia obtenida de las larvas de Amblyomma spp. encontradas en un P. semispinosus se agrupó monofiléticamente con las secuencias de R. tamurae y R. monacensis , con las cuales compartía identidades de 99,5 % y 99,2 %, respectivamente (figura 4). Todas las secuencias empleadas en estos análisis fueron enviadas al GenBank para su publicación y recibieron los siguientes números de acceso: roedores: Rickettsias Colombia Turbo_ 31JX519576, Rickettsias Colombia Necocli_181 JX519577, Rickettsias Colombia Necocli_182 JX519578, Rickettsias Colombia Necocli_183 JX519579, Rickettsias Colombia Necocli_198 JX51 9580, Rickettsias Colombia Necocli_202 JX519581, Rickettsias Colombia Necocli_252 JX519582L; garrapatas: Rickettsias Colombia Necocli_190 JX5 19583.
Asociación entre infección por rickettsias y otras variables obtenidas de los roedores
Las frecuencias de los roedores positivos para rickettsias por PCR y por IFI, teniendo en cuenta todas las variables consideradas para el análisis, se distribuyeron como se muestra en el cuadro 1.
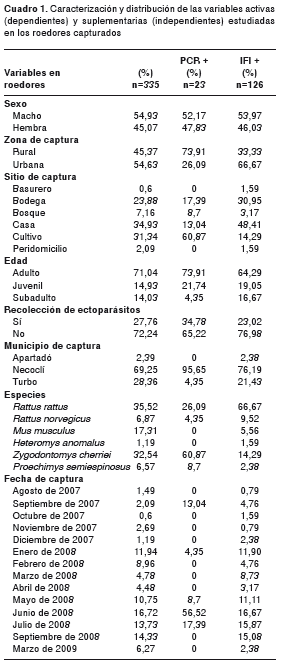
En el análisis factorial de correspondencia múltiple (figura 5), se encontró que la variable activa presencia de infección en los roedores se asoció significativamente (p<0,01) con las siguientes variables suplementarias: fecha de captura (junio de 2008), municipio (Necoclí), sitio de captura (cultivo), zona de captura (rural) y especie ( Z. cherriei ). La variable activa ausencia de infección, a su vez, se asoció (p<0,01) con las variables suplementarias municipio (Turbo) y zona de captura (urbana). La presencia de anticuerpos contra rickettsias del grupo de las fiebres manchadas, se relacionó significativamente (p<0,01) con la especie ( R. rattus) , el sitio de captura (casa o bodega), la zona de captura (urbana), la ausencia de ectoparásitos y la fecha de captura (marzo de 2008). Además, la presencia de ectoparásitos se asoció (p<0,01) con las especies de roedores ( P. semispinosus , Z. cherriei y R. norvegicus ), el sitio de captura (bosque y cultivo), la zona de captura (rural), el municipio (Necoclí) y las fechas de captura (septiembre de 2008 y marzo de 2009).
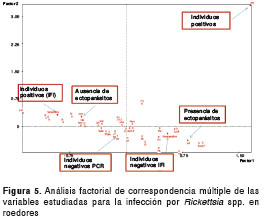
Frecuencia de la infección por Rickettsia spp. en ectoparásitos
Todas las muestras de ectoparásitos recolectados de los roedores fueron analizadas por PCR en forma individual o agregadas en grupos, dependiendo de la cantidad de individuos recolectados por animal, y según el sexo, la especie del parásito y el roedor del cual se había obtenido (cuadro 2). Solo una muestra, consistente en dos larvas del género Amblyomma spp. capturadas de un roedor silvestre de la especie P. semispinosus , fue positiva para los genes gltA y OmpA de rickettsias.
Seroprevalencia de anticuerpos y frecuencia de seroconversión a Rickettsia spp. en pacientes sintomáticos
De 220 humanos estudiados, 53 (24,1 %) fueron positivos para IgG anti-rickettsias del grupo de las fiebres manchadas a la dilución de 1:64 (figura 6 y figura 7).

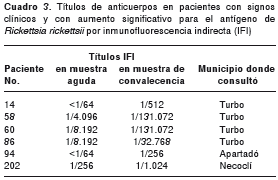
En 26 de los pacientes positivos se disponía de una muestra de la fase de convalecencia y se titularon sus anticuerpos. En seis (23,1 %) de estos sueros pareados, se observó un alza cuádruple o mayor del título de anticuerpos antirrickettsias (cuadro 3). Este hallazgo evidenció infección reciente por rickettsias al momento de la consulta. Uno de estos pacientes (Nº 202 en el cuadro) era un niño de siete años del corregimiento Las Changas de Necoclí. Otro (Nº 94) era un joven de 20 años que provenía de la zona urbana de Apartadó. Los demás casos corresponden a pacientes de Turbo. Dos de ellos fueron reactivos hasta una dilución de 1:131.072 Nº 58 y 60, cuadro 3). Estos dos eran agricultores procedentes del corregimiento Alto de Mulatos y de la vereda Caracolí del municipio de Turbo. Sólo hubo una mujer entre los pacientes con seroconversión, una ama de casa de 55 años de edad procedente del barrio Julio Orozco del municipio de Turbo (Nº 14, cuadro 3).
Asociación entre las frecuencias de infección por rickettsias y variables en humanos
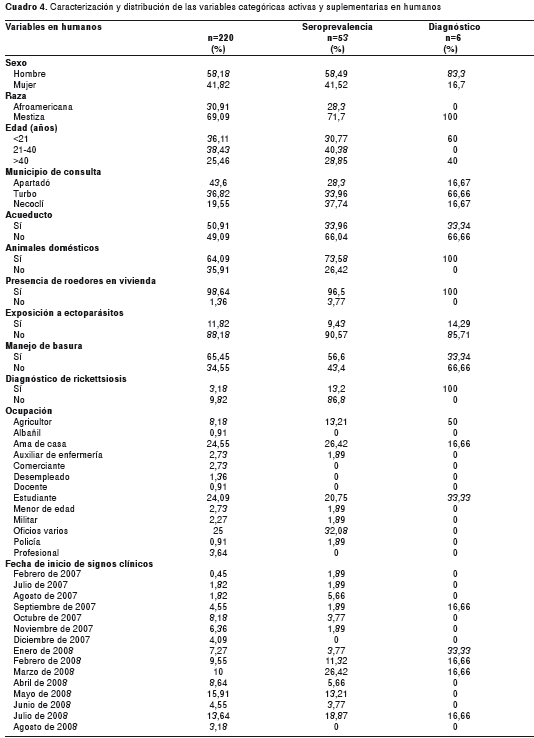
Las variables tenidas en cuenta en los humanos, se distribuyeron como se muestra en el cuadro 4. De igual manera, los datos de frecuencia de infección de los individuos muestreados y el diagnóstico de rickettsiosis (seroconversión en muestras pareadas), se describen en el mismo cuadro.
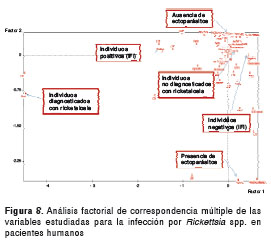
En el análisis factorial de correspondencia múltiple se encontró que la variable activa frecuencia de infección (positivos por IFI) se asoció significativamente (p<0,01) con el inicio de signos clínicos en marzo de 2008, con la consulta en el municipio de Necoclí y con la ausencia de acueducto. La exposición a ectoparásitos en los pacientes humanos se asoció con el municipio de Necoclí (p<0,001), el inicio de signos clínicos en mayo y junio del 2008 (p<0,05), la ocupación profesional (p<0,01) y el mal manejo de basuras (p<0,01) (figura 8).
Discusión
En este estudio fue posible avanzar en el conocimiento de los huéspedes involucrados en el ciclo de las rickettsias en el noroeste de Colombia y también se obtuvo una estimación de la frecuencia de infección por estos agentes en la población humana, que complementa los resultados del estudio de Padmanabha, et al . (7).
Entre los aportes de este trabajo cabe destacar la identificación de un potencial vector de la enfer-medad, las garrapatas del género Amblyomma , de las cuales se obtuvo amplificación de los genes gltA y OmpA de Rickettsia spp. por PCR. Además, la secuenciación de los productos de PCR permitió un acercamiento a la identificación de las especies de rickettsias circulantes en esta zona endemo-enzoótica. Infortunadamente, el estadio inmaduro de estas garrapatas infectadas no permitió identificar la especie. Estas larvas se capturaron en un roedor silvestre de la especie Proechimys semispinosus , el cual fue a su vez reactivo por IFI para anticuerpos contra el antígeno de las fiebres manchadas y positivo en la PCR para gltA con cebadores específicos de género.
Lo anterior parece natural, puesto que las garrapatas del género Amblyomma spp. se han considerado como uno de los vectores más importantes de las rickettsias del grupo de las fiebres manchadas en diferentes partes del mundo, incluyendo Centroamérica y Suramérica (27-29). Sin embargo, sorpresivamente, las secuencias de estos productos de PCR no coincidieron: mientras que las secuencias de gltA encontradas en las garrapatas tienen una identidad de más del 99 % con las secuencias homólogas de R. tamurae y R. monacencis, pertenecientes al grupo de las fiebres manchadas, la secuencia de gltA encontrada en el hígado del roedor mostró una identidad del 98,7 % con R. prowazekii , la cual hace parte del grupo de los tifus. El análisis filogenético muestra claramente que se trata de secuencias pertenecientes a dos especies diferentes, ubicadas en estos dos grupos distantes dentro del género Rickettsia , los más importantes epidemiológicamente (figura 4). La presencia de dos rickettsias diferentes en el hígado y en los ectoparásitos del mismo roedor, podría tener varias explicaciones: las larvas de Amblyomma spp. pudieron haberse infectado transováricamente y no haber permanecido el tiempo suficiente sobre el roedor para transmitir la infección; el roedor podría no haberse infectado con la rickettsia detectada en la larva, debido a que poseía inmunidad contra agentes del grupo de las fiebres manchadas; alternativamente, el animal podría tener la coinfección con las dos especies, pero solo se detectó la que predominaba en cada muestra.
Igualmente, se identificaron otros potenciales re- ser vorios de Rickettsia spp. entre los roedores capturados, al encontrar 23 de 335 (6,8 %) individuos positivos por PCR y 43 % por IFI (figura 2 y figura 3). Vale la pena aclarar que la diferencia en las frecuencias obtenidas por las dos técnicas anteriores se debe, en parte, a que ellas examinan diferentes momentos de la infección. Mientras que las secuencias genéticas detectadas por PCR indican la presencia actual del microorganismo, en este caso, en el hígado del roedor, la detección de anticuerpos IgG por IFI indica que el animal estuvo infectado por alguna rickettsia en algún momento del pasado o del presente. Lo anterior explicaría por qué algunos M. musculus y H. anomalus fueron reactivos por IFI a pesar de que todos los ejemplares de esas especies resultaron negativos por PCR. Este hallazgo es similar al de Pluta, et al . (30) quienes no encontraron ningún roedor positivo por PCR de ADN extraído de tejidos de las especies Microtusarvalis , Apodemos flavicollis , Apodemos sylvaticus y Apodemos arvicola , en el sur de Alemania, aunque la serología mostró una prevalencia del 43 %.
Otro de los hallazgos sorpresivos en este estudio, fue la alta frecuencia de anticuerpos para Rickettsia spp. en R. rattus y R. norvegicus , 73,5 % y 59,1 %, respectivamente. Esto tiene, sin embargo, un precedente en otro estudio llevado a cabo en la región de Santa Cruz, Brasil, donde se encontró una reacción serológica del 81,3 % en R. rattus (23). En el mismo estudio no se encontró ningún resultado reactivo en los roedores silvestres Nectomys squamipes y Oryzomys subfalus , contrario a lo observado en nuestro caso, en el cual sí se presentó con mucha frecuencia IgG antirrickettsias en Z. cherriei (16,3 %), P. semispinosus (16,7 %) y H. annomalus (66,6 %). Las diferentes especies de roedores silvestres capturadas en estos trabajos, podrían explicar la diferencia en los hallazgos.
En relación con este último punto, el análisis factorial de correspondencia múltiple que se realizó con las variables en los roedores, demostró una relación entre la presencia de infección detectada por PCR y la especie Z. cherriei , lo cual indica que esta especie se debe tener en cuenta para posteriores estudios donde el objetivo sea encontrar posibles reservorios de la enfermedad en Colombia. La relación que se demostró con la presencia de infección y la zona de captura (rural) y el sitio de captura (cultivo), se debe a que la mayoría de los Z. cherriei fueron capturados en esas condiciones particulares.
La variable activa, reacción de anticuerpos contra rickettsias, se relacionó de manera estrecha con la presencia de infección detectada por PCR; además, se encontraron asociaciones con los sitios de captura (casa y bodega), con la zona (urbana) y con la fecha (marzo del 2008). Todos las variables anteriores, a su vez, se relacionaron con la especie R. rattus , lo cual explica las asociaciones de la infección con el sitio y la zona de captura. Existen pocos reportes de los posibles vectores para rickettsias en este roedor, aunque previamente se sugirió que ácaros del género Ornithonyssus ( O. bacoti recolectados de R. rattus y R. norvegicus ) eran vectores de Rickettsia spp. en Egipto, pues resultaron positivos por PCR con cebadores específicos para rickettsias (31). En el presente estudio, la mayoría de ectoparásitos que se recolectaron en R. rattus también fueron ácaros del género Ornithonyssus sp., pero a diferencia del estudio en Egipto, todos fueron negativos por PCR. Lo anterior podría indicar que esta especie no se comporta como vector para rickettsias en este hábitat particular, o que lo hace pero con una baja prevalencia de la infección.
La frecuencia de seropositos en humanos encontrada en ese estudio (29,2 %) es similar a la encontrada (24%) en el estudio de Padmanabha, et al ., publicado en el 2008. En un estudio similar llevado a cabo en el municipio de Villeta, Cundinamarca, se encontró una seroprevalencia de anticuerpos anti- Rickettsia de 40,3 %, pero no se encontró ninguna asociación entre la presencia de anticuerpos y otras variables analizadas, como ocupación, nivel de educación, material de construcción de la vivienda y convivencia con animales domésticos. Por el contrario, el presente estudio muestra una asociación de la infección por rickettsias con variables tales como consulta en el municipio de Necoclí, inicio de los síntomas en marzo de 2008 y ausencia de acueducto en las viviendas. Aunque las variables analizadas en ambos estudios son diferentes, la disparidad de los resultados podría también explicarse por variaciones metodológicas y diferencias en condiciones ecológicas y socioeconómicas en ambas zonas endémicas.
En otro estudio realizado en el departamento de Córdoba, en una región vecina y ecológicamente similar a la zona de Urabá, se demostró una seroprevalencia de hasta el 49 % por IFI en trabajadores del campo (32). Además, nuestro estudio permitió hacer una estimación de la frecuencia de rickettsiosis como causa de síndrome febril. Aunque esta estimación solo se pudo hacer en los 26 pacientes con muestras pareadas, el 23,1 % encontrado indica que Rickettsia spp. es una causa importante de este tipo de síndrome en los municipios estudiados. Tomados en su conjunto, estos hallazgos demuestran que la infección por rickettsias es un evento frecuente en varias zonas del país, cuyo impacto en la salud pública parece haber sido subestimado.
Un asunto que queda por definir es la identidad precisa de las rickettsias que han causado los brotes anteriores y los casos recientes demostrados en este estudio. En los casos fatales de los brotes en Antioquia (6,7) y Cundinamarca (33), los estudios post mórtem con inmunohistoquímica y PCR con cebadores específicos para agentes del grupo de las fiebres manchadas, fueron positivos para R. rickettsii , lo cual está de acuerdo con la gravedad del cuadro clínico, ya que esta especie es reconocida como la más virulenta del género Rickettsia . En este estudio, el único indicio de que esa especie si está presente en la zona fueron los títulos de 1:131.072 alcanzados por dos de los pacientes sintomáticos residentes en el municipio de Turbo, en la zona donde se presentó un brote de rickettsiosis que dejó cuatro personas fallecidas en el 2008 (cuadro 3). Los títulos de este valor probablemente sean específicos de la especie utilizada en la sensibilización de las placas de IFI, en este caso, de R. rickettsii (M . Labruna, comunicación personal).
Sin embargo, en este estudio no se encontraron secuencias de R. rickettsii ni en garrapatas ni en roedores. Esto pudo deberse a que la especie vector de este agente en la zona de estudio, hasta ahora desconocida, no utiliza los roedores como huésped o a que su prevalencia en las garrapatas de esta región es baja y, por tal razón, no se detectó. Una explicación alternativa es que los resultados interpretados como indicativos de R. rickettsii en los estudios anteriores, en realidad, correspondían a infecciones por otra rickettsia del grupo de las fiebres manchadas, quizá el agente similar a R. tamurae encontrado en larvas de Amblyomma spp. en este estudio, el cual también podría ser el responsable de los seis casos de seroconversión detectados. Rickettsia tamurae se aisló originalmente de Amblyomma testudinarium en el Japón, en 1993 (34) y, recientemente, se asoció a enfermedad localizada sin síntomas generales, en un caso en el mismo país (35).
Otro hallazgo inesperado y de implicaciones desconocidas, fue la presencia de secuencias de una rickettsia del grupo de los tifus, cercana a R. prowazeki , en el hígado de siete roedores, tanto silvestres como sinantrópicos, capturados en Necoclí y Turbo. Rickettsia prowazeki es el agente causal del tifus epidémico transmitido por piojos y se considera la segunda especie más virulenta del género Rickettsia . En Suramérica, en los años recientes esta especie solo se ha diagnosticado en pacientes humanos en el Perú, especialmente en zonas de Calca-Cuzco (36). Más recientemente aún, se ha sugerido la participación de las garrapatas del género Amblyomma spp. como vectores de R. prowazekii en México (37).
Las secuencias del gen gltA de R. prowazeki disponibles en el GenBank son todas idénticas, razón por la cual la pequeña diferencia encontrada (1,3 %) en estas secuencias probablemente indique que se trata de otra especie aún no catalogada. Sin embargo, es necesario estudiar secuencias de otros genes y, en lo posible, aislar esta rickettsia para establecer su identidad y estudiar sus propiedades biológicas. Tomados en su conjunto, estos hallazgos indican que en la zona de Urabá circulan varias especies del género Rickettsia , algunas de ellas con potencial patógeno y otras cuya virulencia está por estudiarse.
Finalmente, es bien sabido que el ciclo de vida de las rickettsias involucra factores ecológicos que no fueron incluidos dentro del presente estudio, como son la cobertura vegetal relacionada con la presencia de garrapatas y los factores climáticos. La presentación de tres brotes en los meses de febrero y marzo de 2006 a 2008, y la asociación estadísticamente significativa encontrada aquí entre infección por rickettsias y el inicio de los síntomas en marzo de 2008, claramente sugieren la importancia de los factores estacionales como determinantes de la transmisión a humanos. La complejidad de las interacciones entre agente, vector y reservorio, y de todos estos a su vez con el hombre, hacen que la comprensión integral de la ecoepidemiología de las rickettsiosis requiera de enfoques mltidisciplinarios, con participación de ciencias como ecología, entomología, medicina, microbiología, epidemiología y ciencias sociales.
En el presente estudio hemos aportado datos importantes para el esclarecimiento de dicho asunto, especialmente en cuanto a la diversidad de los vertebrados, artrópodos y agentes que pueden estar involucrados en el problema de las rickettsiosis en el noroeste de Colombia. Estos resultados no son concluyentes pero aportan un punto de partida para continuar el estudio de estas enfermedades en una región en la cual han impactado gravemente la salud de la población humana.
A Sergio Solari y Daisy Gómez, por su colaboración con la clasificación de los roedores silvestres (Grupo de Mastozoología, Departamento de Biología, Universidad de Antioquia); a Sergio Bermúdez (Instituto Conmemorativo Gorgas, Panamá); a José Manuel Venzal (Universidad de la República Regional del Norte, Uruguay) y a Luis Paternina (Universidad de Sucre, Colombia), por su aporte en la clasificación de los vectores; a Luis Fernando Restrepo (profesor de la Facultad de Ciencias Agrarias de la Universidad de Antioquia), por su asesoría en el análisis estadístico; a Carlos Muskus (PECET, Universidad de Antioquia), por su apoyo en la logística de este estudio; a Gustavo Valbuena (University of Texas Medical Branch, USA), Marcelo Labruna (Universidad de Sao Paulo, Brasil) y Marylin Hidalgo (Pontificia Universidad Javeriana, Bogotá, Colombia), por su asesoría en pruebas de diagnóstico y generosa donación de reactivos no comerciales para las mismas; y al Instituto Nacional de Salud de Colombia, por ayudarnos a implementar la prueba la inmunofluorescencia en nuestro laboratorio.
Los autores declaran que no existe ningún conflicto de intereses para la publicación del presente manuscrito.
Fundación para la Promoción de la Investigación y la Tecnología del Banco de la República (proyecto 2387) y Estrategia de Sostenibilidad 2009-2010 del Comité para el Desarrollo de la Investigación (CODI) de la Universidad de Antioquia.
Correspondencia: Juan David Rodas, Grupo de Investigación en Ciencias Veterinarias, Centauro, SIU, laboratorio 233, Universidad de Antioquia, Carrera 53 N° 61-30, Medellín, Colombia. Telefax: (574) 219 6525
juandavid.rodas@gmail.com
1. Gillespie JJ, Williams K, Shukla M, Snyder EE, Nordberg EK, Ceraul SM, et al . Rickettsia phylogenomics: Unwinding the intricacies of obligate intracellular life. PloS ONE. 2008;3:e2018.http://dx.doi.org/10.1371/journal.pone.0002018 [ Links ]
2. Brenner DJ, Krieg NR, Staley JT. Bergey´s Manual of systematic bacteriology. Second edition. New York: Springer; 2005. p. 99. [ Links ]
3. Walker DH. The realities of biodefense vaccines against Rickettsia . vaccine. 2009;27:52-5. http://dx.doi.org/10.1016/j.vaccine.2009.07.045 [ Links ]
4. Patiño L, Afanador A, Paul JH. A spotted fever in Tobia, Colombia. 1937. Biomédica. 2006;26:178-93. [ Links ]
5. Hidalgo M, Sanchez R, Orejuela L, Hernández J, Walker DH, Valbuena G. Prevalence of antibodies against spotted fever group Rickettsiae in a rural area of Colombia. Am J Trop Med Hyg. 2007;77:378-80. [ Links ]
6. Acosta J, Díaz A, Urquijo L, Rey G, Sepúlveda C, Herrera D , et al . Brote de Rickettsia rickettsii en Necoclí, Antioquia, Colombia, 2006. Inf Quinc Epidemiol Nac. 2006;11:161-76. [ Links ]
7. Padmanabha HM, Valbuena G, Castañeda E, Galeano A, Puerta H, Cantillo C , et al . Geographic variation in risk factors for SFG rickettsial and leptospiral exposure in Colombia. Vector Borne Zoonotic Dis. 2009;9:483-90. http://dx.doi.org/10.1089/vbz.2008.0092. [ Links ]
8. Pacheco O, Giraldo R, Martínez M, Hidalgo M, Galeano A, Echeverri I , et al. Estudio de brote febril hemorrágico en el corregimiento de Alto de Mulatos - Distrito Especial Portuario de Turbo, Antioquia, enero de 2008. Inf Quinc Epidemiol Nac. 2008;13:145-60. [ Links ]
9. Hidalgo M, Salguero E, de la Ossa A, Sánchez R, Vesga JF, Orejuela L , et al . Murine typhus in Caldas, Colombia. Am J Trop Med Hyg. 2008;78:321-2. [ Links ]
10. Mills JN, Childs JE, Ksiazek TG, Peters CJ. Métodos para trampeo y muestreo de pequeños mamíferos para estudios virológicos. Atlanta: CDC; 1998. [ Links ]
11. Londoño AF, Díaz FJ, Agudelo-Flórez P, Levis S, Rodas JD. Genetic evidence of hantavirus infections in wild rodents from northwestern Colombia. Vector Borne Zoonotic Dis. 2011; 11:701-8 . http://dx.doi.org/10.1089/vbz.2010.0129. [ Links ]
12. Emmons L, Feer F. Neotropical rainforest mammals. Second edition. Chicago and London: The University of Chicago Press; 1997. p. 184-245. [ Links ]
13. Voss R. An introduction to the neotropical muroid rodent genus Zygodontomys . New York: American Museum of Natural History; 1991. p. 59-62. [ Links ]
14. Weksler M. Phylogenetic relationships of Oryzomine rodents (Muroidea, Sigmodontinae): Separate and combined analyses of morphological and molecular data. New York: American Museum of Natural History; 2006. p. 3-82. [ Links ]
15. Anderson R. Preliminary review of the systematics and biogeography of the spiny pocket mice ( Heteromys ) of Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales. 1999;23:613-27. [ Links ]
16. Patterson BD, Timm RM. Studies in neotropical mammalogy essays in honor of Philip Hershkovitz. Fieldiana Zoology No. 39. Illinois; Field Museum of Natural History; 1987. p 289-346. [ Links ]
17. Instituto Nacional de Salud. Manual de procedimientos. Proyecto Las rickettsias como agentes etiológicos de entidades febriles no diagnosticadas en Colombia. Bogotá: INS; 2006. p. 4-27. [ Links ]
18 . Kohls GM, Sonenshine DE, Clifford CM. The systematics of the subfamily Ornithodorinae (Acarina: Argasidae). II. Identification of the larvae of the Western hemisphere and descriptions of three new species. Ann Entomol Soc Am. 1965;58:331-64. [ Links ]
19. Wenzel RL, Tipton VJ. Ectoparasites of Panamá species. Chicago: Field Museum of Natural History; 1966. p. 289-300. [ Links ]
20. Labruna MB, Ogrzewalska M, Martins TF, Pinter A, Horta MC. Comparative susceptibility of larval stages of Amblyomma aureolatum , Amblyomma cajennense , and Rhipicephalus sanguineus to infection by Rickettsia rickettsii . J Med Entomol. 2008;45:1156-9. http://dx.doi.org/10.1603/0022-2585(2008)45[1156:CSOLSO]2.0.CO;2 [ Links ]
21. Thompson JD, Gibson TJ, Plewniak F, Jeanmougin F, Higgins DG. The CLUSTAL_X windows interface: Flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Res. 1997;25:4876-82. http://dx.doi.org/10.1093/nar/25.24.4876 [ Links ]
22. Swofford D. PAUP*. Phylogenetic Analysis Using Parsimony (* and other methods). Version 4.0b 10. ed. Sinauer; 2002. [ Links ]
23. Pena DC, Mafra CL, Calic SB, Labruna MB, Milagres BS, Walker DH , et al . Serologic survey for antibodies to Rickettsia among domestic and wild animal populations in Brazil. Clin Microbiol Infect. 2009;15:243-4. http://dx.doi.org/10.1111/j.1469-0691.2008.02165.x [ Links ]
24. Pinter A, Horta MC, Pacheco RC, Moraes-Filho J, Labruna MB. Serosurvey of Rickettsia spp. in dogs and humans from an endemic area for Brazilian spotted fever in the State of Sao Paulo, Brazil. Cad Saude Publica. 2008;24:247-52. http://dx.doi.org/10.1590/S0102-311X2008000200003 [ Links ]
25. SAS Institute Inc. The SAS system for Windows 9.0. V9 ed. Nueva California, USA: SAS Institute; 2002. [ Links ]
26. Decisia S. SPAD. V56 ed. Levallois-Perret Cedex, Francia: 2003. [ Links ]
27. Horta MC, Labruna MB, Sangioni LA, Vianna MC, Gennari SM, Galvao MA, et al. Prevalence of antibodies to spotted fever group rickettsiae in humans and domestic animals in a Brazilian spotted fever-endemic area in the state of Sao Paulo, Brazil: Serologic evidence for infection by Rickettsia rickettsii and another spotted fever group Rickettsia . Am JTrop Med Hyg. 2004;71:93-7. [ Links ]
28. Silveira I, Pacheco RC, Szabo MP, Ramos HG, Labruna MB. Rickettsia parkeri in Brazil. Emerg Infect Dis. 2007;13:1111-3. http://dx.doi.org/10.3201/eid1307.061397 [ Links ]
29. Labruna MB, Whitworth T, Horta MC, Bouyer DH, McBride JW, Pinter A, et al. Rickettsia Rickettsia species infecting Amblyomma cooperi ticks from an area in the state of Sao Paulo, Brazil, where Brazilian spotted fever is endemic. J Clin Microbiol. 2004;42:90-8. http://dx.doi.org/10.1128/JCM.42.1.90-98.2004 [ Links ]
30. Pluta S, Harteltb K, Oehmeb R, Mackenstedta U, Kimmiga P. Prevalence of Coxiella burnetii and Rickettsia spp. in ticks and rodents in southern Germany. Ticks Tick Borne Dis. 2010;1:145-7. http://dx.doi.org/10.1016/j.ttbdis.2010.04.001, [ Links ]
31. Reeves W, Loftis A, Szumlas D, Abbassy M, Helmy I, Hanafi H, et al . Rickettsial pathogens in the tropical rat mite Ornithonyssus bacoti (Acari: Macronyssidae) from Egyptian rats (Rattus spp.). Exp Appl Acarol. 2007;41:101-7. http://dx.doi.org/10.1007/s10493-006-9040-3 [ Links ]
32. Miranda A, Flores S, Máttar S. Alta seroprevalencia de rickettsiosis en trabajadores del campo en el municipio de Ciénaga de Oro, Córdoba. Inf Quinc Epidemiol Nac. 2002;7:65-80. [ Links ]
33. Hidalgo M, Orejuela L, Fuya P, Carrillo P, Hernández J, Parra E, et al . Rocky Mountain spotted fever, Colombia. Emerg Infect Dis.2007;13:1058-60. http://dx.doi.org/10.3201/eid1307.060537 [ Links ]
34. Fournier PE, Takada N, Fujita H, Raoult D. Rickettsia tamura e sp. nov., isolated from Amblyomma testudinarium ticks. Int J Syst Evol Microbiol. 2006;56:1673-5. http://dx.doi.org/10.1099/ijs.0.64134-0 [ Links ]
35. Imaoka K, Kaneko S, Tabara K, Kusatake K, Morita E. The first human case of Rickettsia tamurae infection in Japan. Case Rep Dermatol. 2011;3:68-73. http://dx.doi.org/10.1159/000326941 [ Links ]
36. Labruna MB. Ecology of rickettsia in South America. Ann N Y Acad Sci. 2009;1166:156-66. http://dx.doi.org/10.1111/j.1749-6632.2009.04516.x [ Links ]
37. Medina-Sánchez A, Bouyer DH, Alcantara-Rodríguez V, Mafra C, Zavala-Castro J, Whitworth T , et al . Detection of a typhus group Rickettsia in Amblyomma ticks in the state of Nuevo Leon, Mexico. Ann N Y Acad Sci. 2005;1063:327-32. http://dx.doi.org/10.1196/annals.1355.052 [ Links ]













