Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.34 no.1 Bogotá Jan./Mar. 2014
https://doi.org/10.7705/biomedica.v34i1.1677
1 Fundación para el Desarrollo de las Ciencias Médicas y Biológicas (FUNDEMEB), Cartagena, Colombia
2 Grupo de Alergología Experimental e Inmunogenética, Instituto de Investigaciones Inmunológicas, Universidad de Cartagena, Cartagena, Colombia
3 Grupo de Alergología Clínica y Experimental, Universidad de Antioquia, Medellín, Colombia
Contribución de los autores:
Jorge Sánchez: idea central del artículo.
Carlos Chinchilla y Ricardo Cardona: revisión bibliográfica.
Jorge Sánchez, María Restrepo, José Mopan, Carlos Chinchilla y Ricardo Cardona: redacción y producción del artículo.
Recibido: 25/05/13; aceptado: 03/10/13
La sensibilización a alimentos y el desarrollo de alergias alimentarias viene aumentando en todo el mundo, siendo la leche de vaca y el huevo de gallina los principales alimentos implicados. En la mayoría de los países latinoamericanos no existen guías de manejo y cuando se elaboren deberán adaptarse a las condiciones de la población de cada región.
En el presente artículo presentamos una revisión del manejo de la alergia alimentaria a la leche y al huevo útil para el personal de salud de todos los niveles, así como algunas consideraciones de los factores presentes en los países latinoamericanos.
Palabras clave: alergia e inmunología, hipersensibilidad al huevo, hipersensibilidad a la leche, alimentos, anafilaxia, dieta, desensibilización inmunológica, inmunoterapia, tolerancia.
doi: http://dx.doi.org/10.7705/biomedica.v34i1.1677
Milk and egg allergy: Diagnosis, management and implications for Latin America
Sensitization to food allergens, as well as the development of food allergies, is increasing worldwide, and cow´s milk and hen´s eggs are the main implicated foods. In most Latin American countries there are no management guidelines on the aforementioned topics; at their creation, such guidelines should be adapted to the conditions of the population in each region.
This paper presents a review of the management of food allergy to milk and eggs useful for health personnel at all levels and some considerations of the factors found in Latin American developing countries.
Keywords: Allergy and immunology, egg hypersensitivity, milk hypersensitivity, food, anaphylaxis, diet; desensitization, immunologic; immunotherapy, permissiveness.
doi: http://dx.doi.org/10.7705/biomedica.v34i1.1677
Las reacciones adversas a los alimentos se producen por una gran variedad de mecanismos que incluyen el sistema inmunitario, los procesos enzimáticos, las reacciones fisiológicas y los componentes psicológicos (1). Cuando se demuestra un mecanismo inmune, se le denomina alergia a alimentos, y si se encuentran niveles elevados de inmunoglobulina E (IgE) específica para alérgenos de alimentos con relevancia clínica, se habla de alergia alimentaria mediada por IgE (2). Igualmente, se pueden presentar reacciones alérgicas a alimentos mediadas por mecanismos celulares y alergias alimentarias mixtas, en las cuales participan los dos mecanismos anteriores.
Los alimentos implicados y la frecuencia de las reacciones dependen de los hábitos y costumbres alimentarias en los distintos países, al igual que de los parámetros metodológicos utilizados en los diferentes estudios. Se estima que la prevalencia de reacciones adversas a alimentos es de entre 13 y 43 %, según informes de los padres de niños preescolares (3,4); sin embargo, solo una parte de las reacciones reportadas en dichos informes se deben realmente a un alimento; en un estudio en el que 28 % de los pacientes había informado de reacción adversa a un alimento, solo 4 % presentó tal reacción durante la prueba de reto controlado (5). Esto puede deberse a varias causas: mala clasificación del evento, incorrecta identificación del alimento sospechoso o adquisición de tolerancia en el lapso entre el momento de la reacción y la prueba de provocación. Debido a los riesgos inherentes en la provocación, esta se debe utilizar solo en casos específicos. Cuando se realizan exámenes como la medición de IgE específica se observa que la prevalencia de alergia alimentaria varía con la edad y la población estudiada: en Dinamarca se encontró una prevalencia general de 2,3 % a los tres años y 3,2 % en adultos, mientras que en Estados Unidos el promedio general es de 8 % en niños y de 2 % en adultos (6,7).
La alergia alimentaria puede ser causa de manifestaciones clínicas en cualquier sistema o factor agravante de otras enfermedades alérgicas, especialmente aquellas que comprometen el sistema gastrointestinal y cutáneo (8,9). El cuadro clínico más grave se presenta cuando una alergia alimentaria produce una anafilaxia, ya que implica un compromiso multisistémico que progresa rápidamente y pone en riesgo la vida del paciente. Aunque cualquier alimento puede llevar a una reacción alérgica, en 90 % de los casos estas se deben a ocho alimentos: la leche de vaca, el huevo de gallina, el maní, las nueces, los pescados, los mariscos, la soya y el trigo (10). La leche de vaca y el huevo de gallina son los que probablemente tienen mayor impacto en la dieta, especialmente de los niños, por su importancia como portadores de nutrientes y su presencia en casi todas las comidas.
A pesar de los múltiples estudios y guías disponibles actualmente sobre el tema, el manejo más adecuado de la alergia alimentaria sigue siendo discutido y existe un amplio desconocimiento entre el personal de salud en cuanto a la forma correcta de manejar a estos pacientes. En un estudio realizado en Brasil se evaluó mediante un cuestionario el conocimiento de los pediatras sobre la alergia alimentaria: 895 pediatras diligenciaron el cuestionario con preguntas enfocadas a la clínica de las alergias alimentarias y la forma de manejo. El estudio concluyó que la información con la que contaban los pediatras era deficiente, ya que la mayoría realizaba el diagnóstico sólo con la historia clínica (97 %) y no utilizaba pruebas confirmatorias, realizando manejos agresivos como dietas de restricción amplias –usualmente innecesarias– y muchas veces no excluían alimentos con reacción cruzada (11).
A continuación presentamos una revisión de la alergia a la leche de vaca y al huevo de gallina centrada en el manejo de estas alergias y considerando algunos factores propios de los países latinoamericanos.
Alergia a las proteínas de la leche de vaca
Epidemiología
La alergia a las proteínas de la leche de vaca es una de las principales causas de alergia alimentaria en niños menores de tres años, con una prevalencia en la población general que varía entre 2 y 3 % (12). La alergia a las proteínas de la leche de vaca suele desarrollarse en las primeras semanas posteriores a la introducción de la leche de vaca en la dieta, pero también puede desarrollarse en niños que están siendo alimentados con leche materna debido al consumo de leche de vaca por parte de la madre o al uso de fórmulas de leche infantiles que contienen las proteínas completas (12,13). Entre 50 y 80 % de los pacientes supera la alergia y desarrolla tolerancia en la infancia, similar a lo que ocurre con la alergia al huevo; sin embargo, si los síntomas frente al contacto con estos alimentos perduran hasta después de los cinco años, rara vez desaparecen (14,15).
Mecanismos de acción y proteínas alergénicas
Las manifestaciones clínicas (dermatitis atópica, asma, rinitis alérgica, urticaria, angioedema, anafilaxia) pueden deberse a un mecanismo mediado por IgE que se caracteriza por reacciones inmediatas, es decir, durante las primeras dos horas posteriores al consumo de la leche, o mecanismos no mediados por IgE, en los cuales la reacción se debe a activación celular (síntomas gastrointestinales, síndrome de Heiner) y se caracterizan por ser reacciones tardías, o sea, aquellas que ocurren entre 48 horas y una semana después del consumo; además, hay que tener en cuenta que pueden ocurrir ambos mecanismos en un mismo paciente, situación que no es infrecuente (50 % de los casos), especialmente cuando sufren de dermatitis atópica o tienen síntomas gastrointestinales (16,17).
Las reacciones de hipersensibilidad desarrolladas tras el consumo de la leche de vaca se deben a sus proteínas, las cuales se comportan como alérgenos; suelen ser caseínas, que son fosfo- proteínas que se encuentran en forma soluble asociadas al fosfato de calcio y que constituyen cerca de 80 % del total de las proteínas de la leche de vaca, y las beta-lactoglobulinas, que conforman el 10 %. Con menor frecuencia se han visto involucradas proteínas menores como las inmunoglobulinas bovinas y la albúmina sérica (18). Las beta-lactoglobulinas son termoestables, por lo que no se degradan fácilmente con el calor si bien la cocción prolongada a altas temperaturas puede disminuir su capacidad alergénica (19,20).
Diagnóstico
El diagnóstico de alergia a las proteínas de la leche de vaca se basa en la historia clínica, pero debe confirmarse por medio de la evaluación del mecanismo subyacente para evitar dietas innecesarias y para establecer cuándo se puede reintroducir de manera segura la leche. La prueba de reto oral controlado y una dieta con eliminación de la leche y sus derivados son los estándares de referencia y nos sirven para confirmar o descartar una reacción adversa por alimentos en un paciente con sospecha clínica; sin embargo, estas pruebas no permiten definir el mecanismo subyacente y por ello es necesario realizar otras pruebas, como la prueba intraepidérmica, la medición de IgE específica en sangre y la prueba de parche (21).
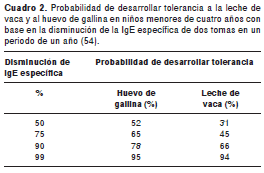
La prueba intraepidérmica y la medición de IgE específica permiten saber si el paciente está sensibilizado a la leche y predecir el riesgo de una nueva reacción (cuadro 1 y cuadro 2); la probabilidad de que un paciente tenga un resultado positivo en la prueba de reto oral controlado es mayor de 95 % cuando se tiene una concentración de IgE específica en menores de dos años mayor de 5 UI/ml, y de 15 Ul/ml en mayores de dos años (15). Se debe tener en cuenta que estos puntos de corte fueron estandarizados cuantificando la IgE por medio del equipo ImmunoCAP y que pueden variar según el tipo de técnica utilizada (RAST, ELISA). Se han propuesto otros puntos de predicción utilizando fracciones proteicas o proteínas específicas, pero no han sido validados. Con la prueba intraepidérmica, el valor pronóstico positivo (VPP) de una reacción al consumo de leche es mayor a 95 % cuando se forma un habón de 6 mm en menores de dos años y de 8 mm en mayores de esta edad (22).

Otra herramienta diagnóstica útil para evaluar los mecanismos de una reacción alérgica es el parche atópico con alimentos, el cual se utiliza ampliamente, aunque la técnica empleada varía entre los diferentes centros donde se practica. La utilidad de esta técnica radica en que permite evaluar la respuesta celular a un alimento, lo cual puede ocurrir conjuntamente o por separado de la respuesta mediada por IgE. Un estudio publicado por Roehr, et al., describió un VPP de 88 % y un valor pronóstico negativo (VPN) de 56 % para reacciones tempranas y un VPP de 93 % y un VPN de 8 6% en las reacciones tardías cuando se hacía junto a la medición de IgE específica (23). Estos porcentajes son similares a los encontrados por Mehl, et al. , quienes observaron un aumento en los valores pronóstico cuando se usaba el parche atópico y la prueba intraepidérmica de alimentos o la medición de IgE específica en suero (24).
Manejo
Evitación. La restricción del alimento implicado es el tratamiento inicial de la alergia alimentaria, el cual debe estar acompañado de educación e instrucciones tales como leer las etiquetas de los productos manufacturados y una comunicación clara con la persona que prepara los alimentos del paciente para evitar reacciones al consumir alimentos contaminados con sus proteínas.
En la mayoría de las ocasiones las etiquetas son incompletas y solo tienen en cuenta si los ingredientes incluyen leche de vaca, pero usualmente no contienen avisos del tipo "podría contener", "elaborado en equipo compartido" o en "instalaciones compartidas". Este tipo de advertencias son importantes, ya que, a pesar de que un producto tal vez no utilice leche directamente, puede contener restos si se prepara en recipientes previamente empleados para leche. En un estudio se buscó la presencia de leche en productos rotulados con los avisos anteriormente mencionados y se encontró la presencia de leche en casi la mitad (42 %) de los 81 productos evaluados, entre los cuales se encontraban principalmente mezclas para hornear, mezclas para comida instantánea, barras de granola, confitería y chocolate negro (25).
Aunque la mayoría de los pacientes pueden tolerar productos que contienen poca cantidad de leche, especialmente si estos han sido procesados a altas temperaturas, en otros pacientes, una mínima cantidad, como la que podría transmitirse por el contacto de los labios o por compartir utensilios, por ejemplo, los cubiertos, es suficiente para producir una reacción (26). Incluso si un paciente ha tenido siempre síntomas leves, no es posible predecir con seguridad la gravedad de la reacción que tendrá en una nueva exposición, por lo que es preferible evitar al máximo el contacto. Algunos productos no comestibles como el maquillaje, los lubricantes, las vacunas o los medicamentos pueden contener restos de leche, por lo que deben revisarse antes de utilizarlos. Si el paciente ha mostrado tolerancia a ciertos productos que contienen leche o a ciertos alimentos, tal vez podrá seguir consumiéndolos, pero es recomendable consultar previamente con el médico tratante.
Inducción de la tolerancia. Dado que la leche es un alimento esencial en la dieta y que, además, puede encontrarse en múltiples alimentos, existe un gran riesgo de ingestión accidental a pesar de las medidas de evitación. Por otra parte, dichas medidas tienen un impacto importante en la calidad de vida de los pacientes y sus familias, ya que el paciente se encuentra excluido de actividades comunes como salir a comer o aceptar refrigerios en reuniones sociales por temor a una reacción.
La inducción de la tolerancia, también llamada " desensibilización con alimento " o "inmunoterapia con alimentos", es una medida cuyo principal objetivo es permitir al paciente consumir el alimento en cuestión sin temor a una reacción (27). Aunque hoy no es frecuente lograr que el paciente genere una tolerancia permanente que le permita consumir grandes cantidades de leche, los protocolos actuales logran que un buen número de pacientes tolere alrededor de 200 ml, lo que es suficiente para evitar una reacción luego de un consumo accidental (28,29).
Este procedimiento consiste en la administración gradual de pequeñas cantidades de leche con un aumento de la concentración hasta alcanzar la dosis tope, la cual se continúa suministrando de manera permanente todos los días. Durante el procedimiento, los mastocitos que tienen en su membrana receptores de IgE se degranulan por el estímulo continuo con los alérgenos y no se repolarizan, evitando de esta manera nuevas degranulaciones y consiguiendo que no ocurra una reacción. Además, se estimula la producción de inmunomoduladores como la IL10 y el TGF beta, que evitan la respuesta inflamatoria. Para mantener esta respuesta es necesario que la administración del alimento sea diaria y sin suspensiones.
A pesar de los buenos resultados reportados en la mayoría de los pacientes (30,31), la tasa de abandono en el primer año ronda entre 10 y 40 % de los pacientes debido a síntomas usualmente leves o moderados, aunque también ocurren en ocasiones reacciones anafilácticas (32,33), por lo que dicha inducción debe hacerse bajo estricta vigilancia médica especializada. Debido a que actualmente no existen criterios aceptados de manera unánime sobre qué pacientes pueden recibir esta terapia, nosotros proponemos los criterios del cuadro 3 basándonos en nuestra experiencia y en la literatura actual disponible.

Dispositivo portátil de adrenalina. Aunque en Estados Unidos y en varios países de Europa estos dispositivos son fáciles de conseguir con una formula médica (34), actualmente no hay acuerdo de si todos los pacientes que hayan tenido una reacción con alimentos deben portar adrenalina autoinyectable o solo aquellos con antecedentes de reacción grave.
En la mayoría de países latinoamericanos y asiáticos no se dispone de estos dispositivos, por lo que una alternativa es utilizar jeringas con adrenalina en estuches oscuros, preferiblemente de tapa dura. La adrenalina en este tipo de jeringas puede permanecer estable incluso después de seis meses; sin embargo, cuando no están selladas al vacío, existe un riesgo mayor de contaminación microbiana. La dosis suministrada debe ser de 0,01 mg por kg, sin sobrepasar los 0,5 mg. La vía intramuscular ha mostrado tener una distribución más rápida y uniforme que la vía subcutánea; en caso de que no haya mejoría en los 15 minutos siguientes a la aplicación, se debe aplicar una segunda dosis. También hay que ser enfático con el paciente en el sentido de que solo debe usar la adrenalina cuando tenga compromiso respiratorio o de otro sistema diferente al cutáneo, y que dicha medida es temporal, por lo que debe asistir inmediatamente a un servicio de urgencias aun si está presentando mejoría. Debido a las campañas de educación y al estado de alerta de los pacientes, el porte de adrenalina ha disparado el número de reportes de reacciones con alimentos. Aunque en gran parte de las ocasiones dichos reportes son resultado de una mala interpretación del paciente, estas medidas han disminuido sustancialmente el número de reacciones graves (35).
Consideraciones en menores de dos años. En los niños menores de dos años, la leche de fórmula que contiene proteínas de leche de vaca debe ser sustituida por formulas hipoalergénicas, las cuales se definen como formulas toleradas por 90 % de los infantes con diagnóstico de alergia a las proteínas de la leche de vaca, tales como las fórmulas extensamente hidrolizadas (contienen péptidos con un peso molecular menor de 3.000 Da), que cumplen con el criterio mencionado anteriormente. Sin embargo, debido al alto costo de estas presentaciones y a la necesidad de suplir los requerimientos nutricionales de los infantes, una alternativa es la administración de fórmulas a base de soya y arroz (36), pero estas se deben administrar bajo vigilancia, ya que 10 a 15 % de los pacientes con alergia a la leche de vaca tienen también alergia a la soya y el arroz (37).
Otra alternativa son las fórmulas parcialmente hidrolizadas, las cuales no se aconsejan actual- mente, ya que pueden conservar péptidos suficientemente largos como para producir reacciones y suelen administrarse con fines preventivos en niños con alto riesgo, pero que no han desarrollado la enfermedad (38). Los mamíferos filogenéticamente relacionados tienen gran similitud en la expresión de las proteínas de la leche. La homología de la secuencia de aminoácidos entre la leche de oveja, de cabra, de búfalo hembra, de yegua y la de vaca hacen que esta no sea una buena opción para los alérgicos a la leche de vaca. En estudios llevados a cabo en pacientes con diagnóstico de alergia a las proteínas de la leche de vaca a quienes se les aplicaron pruebas por punción o de reto oral controlado usando leches de origen animal, los resultados mostraron que las de menor reacción cruzada con la leche de vaca fueron la leche de yegua, cerda, burra y camella (18).
Debido al paso placentario, en los niños altamente sensibles puede ser necesario que la madre evite el consumo de leche y sus derivados para evitar suministrar péptidos de la leche de vaca al lactante a través de la leche materna (39). También se debe considerar la necesidad del suministro de vitamina D y de calcio de manera individualizada.
Alergia al huevo
Epidemiología
El huevo de gallina es un alimento de alto consumo en todo el mundo y se usa en casi todos los alimentos horneados (40). Junto a la leche de vaca es uno de los alimentos más frecuentemente responsables de reacciones de hipersensibilidad mediadas por inmunoglobulina E (IgE) en niños (1).
La alergia al huevo se inicia usualmente en la infancia temprana, poco tiempo después de su introducción, incluso en lactantes alimentados exclusivamente con leche materna que reciben dichas proteínas a través de la leche materna. La alergia al huevo de gallina presenta ciertas similitudes con la alergia a la leche de vaca, aunque usualmente no se presentan de manera concomitante. Las proteínas de huevo pueden desencadenar episodios de eccema, síntomas asociados con esofagitis eosinofílica y enteropatía asociada a proteína de huevo. La edad media de presentación es a los 10 meses de edad, lo que se correlaciona con la edad de introducción de este alimento (41).
La prevalencia general de la alergia al huevo de gallina, según informes de los propios afectados, varía entre 2 y 33 % (42,43), e igual que para otros tipos de alimentos, la percepción de alergia es muy alta cuando se compara con pruebas objetivas tales como la determinación de IgE específica (1 a 9 %), la prueba intraepidérmica (1 a 3 %) y de reto controlado (0 a 2 %) (44-46).
Las manifestaciones clínicas pueden ocurrir, prácticamente, en cualquier sistema y pueden iniciar minutos o pocas horas después de su ingestión. La gravedad de la reacción es impredecible y puede variar de un episodio a otro, presentándose anafilaxias hasta en 7 % de los niños y lactantes con alergia al huevo (47). El huevo crudo puede desencadenar reacciones más graves que el huevo cocido debido a la degradación de algunas de las proteínas al igual que ocurre con la leche de vaca.
Mecanismos de acción y proteínas alergénicas
Entre las proteínas alergénicas del huevo están el ovomucoide (Gal d 1), la ovoalbúmina (Gal d 2), la ovotransferrina (Gal d 3), la lisozima (Gal d 4) y la alfa levitina (Gal d 5); las cuatro primeras predominan en la clara y la última en la yema (41).
Los mecanismos que causan alergia inducida por huevo son los mismos que para otros alimentos e incluyen las reacciones mediadas por IgE y las no mediadas por IgE, entre las que se pueden encontrar las relacionadas con mecanismos celulares de inflamación eosinofílica, aunque frecuentemente suelen ser mecanismos mixtos (6). Las proteínas más alergénicas del huevo parecen compartir ciertas propiedades con las proteínas alergénicas de otros alimentos: un peso molecular menor de 70 kD, frecuente glucosilación, solubilidad en agua y resistencia al calor y a la digestión por enzimas presentes en el tracto gastrointestinal (48).
Vale la pena aclarar que estas características, aunque son frecuentes entre los alérgenos, no son universales. Cuando la alergia al huevo es transitoria, se ha relacionado con la sensibilización a epítopos en la conformación de proteínas sensibles al calor; cuando por el contrario es persistente y dura más allá de los cinco años se atribuye a epítopos secuenciales que no se degradan fácilmente con las altas temperaturas a los que son sometidos durante la preparación de los alimentos (49); no obstante, la tendencia general en el caso del huevo es que su potencial alergénico se atenúe con el calor más frecuentemente que el de la leche (70 a 80 %) y también es más sensible a los cambios del pH (50).
El ovomucoide, que es la proteína más frecuentemente implicada en las reacciones con huevo, disminuye su potencial alergénico con pH alcalino, lo que quiere decir que a mayor tiempo de almacenamiento, menor potencial alergénico. Esto también puede suceder con la digestión gástrica, lo que explica por qué algunos pacientes pueden reaccionar ante el contacto con huevo, pero no tras su ingestión.
Diagnóstico
En un estudio realizado por Eggesbo, et al. , se observó que al intentar confirmar el diagnóstico implícito en los reportes de pacientes con un solo antecedente de reacción al huevo, el VPP era de 50 %, mientras que en aquellos que habían tenido tres o más reacciones recientes aumentaba a casi 100 % (43). Esto demuestra que una historia clínica clara puede ser suficiente para realizar un diagnóstico de alergia alimentaria. Sin embargo, debido al alto riesgo de reacciones graves, a todo paciente que haya tenido así sea una sola reacción, se le debe aconsejar la evitación del huevo hasta no aclarar el riesgo de una nueva reacción con las pruebas diagnósticas, las cuales permiten fortalecer el índice diagnóstico sin exponer al paciente al alimento (cuadro 1 y cuadro 2) e incluyen la determinación de IgE específica para huevo por medio de métodos como ELISA, RAST o Phadia para evaluar el posible riesgo de una nueva reacción y hacer seguimiento del paciente.
Una historia de reacciones recientes (menor de un año) y niveles elevados de IgE a alguna proteína del huevo suelen ser suficientes para diagnosticar alergia alimentaria (51). Se ha propuesto que la detección de niveles de IgE específica por ImmunoCAP mayores de 7 kU/L en niños mayores de dos años o de 2 kU/L en menores de dos años equivale a un VPP de 95 % (41). El VPP para la prueba RAST de clase 3 o mayor es de 60 a 80 % (52). Una concentración de IgE específica a ovomucoide menor de 1,2 kU/L tiene un VPN de 97 % y niveles mayores a 11,8 kU/L, un VPP de 88 % por provocación usando huevo cocido (53). Sin embargo, a pesar de que estos valores son útiles, las concentraciones por debajo de lo considerado "normal" (<0,35 KUa/ml para ImmunoCAP) no necesariamente excluyen reacción clínica al huevo (15). Estos índices tampoco predicen el nivel de gravedad de la reacción alérgica, pero si se realizan de manera seriada, permiten predecir si en el futuro se generará tolerancia o no (54).
En la prueba intraepidérmica con huevo un habón de 3 mm se asocia con una probabilidad de reacción en la provocación de 60 a 80 % (55), y de 95 % cuando es igual a 7 mm (52). En niños menores de dos años de edad, un habón de 5 mm o más tiene un VPP de 95 % (56). La prueba epidérmica de parche es útil principalmente en pacientes con dermatitis atópica y trastornos gastrointestinales con eosinofilia o sin ella; sin embargo, sus valores pronóstico y su estandarización aún no está claramente definida (57).
Al igual que para la leche, la prueba de provocación con huevo sirve tanto para confirmar el diagnóstico como para constatar que el paciente ha adquirido tolerancia. Aunque es infrecuente, pueden obtenerse resultados falsos negativos por el empleo de cantidades inadecuadas, por potencial alergénico alterado de los alimentos procesados al realizar la prueba o por los epítopos de conformación en aquellos pacientes que reaccionan al huevo crudo y a quienes se les realiza la prueba con una forma horneada que lo desnaturaliza (58).
Manejo
La probabilidad de remisión depende de varios factores: la edad de inicio de la reacción, la gravedad del cuadro, los sistemas afectados y el tiempo de que lleve el paciente con el cuadro. Se estima que entre 30 y 50 % de los menores de 5 años adquieren tolerancia al huevo entre los 5 y los 10 años, especialmente si la afectación es solo cutánea (14,59). Por ello se recomienda evaluar la sensibilidad mediante la determinación de IgE específica y la prueba intraepidérmica cada año y, si parece que se ha adquirido tolerancia, esta debe probarse mediante una prueba de provocación vigilada.
Dieta de exclusión. La piedra angular del tratamiento de la alergia al huevo sigue siendo la evitación, incluso de trazas, previniendo la exposición inadvertida a las proteínas del huevo. La educación de los pacientes y de los cuidadores seguirá siendo parte fundamental del manejo de todo individuo con alergia alimentaria, con el fin de prevenir ingestiones accidentales de alimentos de los cuales no se conocen sus componentes o que han sido contaminados al ser preparados o envasados (60). Sin embargo, estas dietas de evitación en la adolescencia o en etapas de crecimiento rápido pueden implicar consecuencias nutricionales y psicológicas serias y en muchos casos no se cumplen las metas propuestas por la conducta indiferente o desafiante en este grupo etario (61). Al igual que para la leche, se ha demostrado el paso de proteínas del huevo a la leche materna, por lo que la madre debe evitar los productos con huevo si el niño padece una alergia muy grave.
Algunos alimentos que contienen huevo presentes en la dieta diaria son la mayonesa, los merengues, los macarrones, los malvaviscos, los turrones, las pastas, el pan, las galletas, los barquillos, los alimentos apanados, las cremas y los pasteles de carne. El propofol, un medicamento usado en anestesiología, también contiene proteínas de huevo de tipo lisozima y se han reportado reacciones de hipersensibilidad relacionadas con esta proteína (62).
Consideraciones en torno a la alergia al huevo y las vacunas. Existen trazas de huevo en muchas vacunas, aunque la cantidad presente no suele ser suficiente para producir reacciones en los individuos alérgicos. Por ejemplo, no se recomienda evitar la vacuna triple viral ( Mumps, Measles and Rubella, MMR) ni medidas especiales para su aplicación en pacientes con antecedentes de alergia al huevo, incluso si esta es grave. Sólo debe tenerse un cuidado especial con las vacunas contra la fiebre amarilla y la influenza (63). Se debe considerar si el riesgo de la reacción excede el beneficio de su aplicación, por lo que el alergólogo debe evaluar el caso.
Introducción de alimentos con huevo muy cocidos. Como mencionamos anteriormente, las altas temperaturas destruyen los epítopos de conformación y, de esta manera, se evitan reacciones tanto a la leche como al huevo, especialmente al huevo, cuyas proteínas suelen ser menos termorresistentes, por lo que 43 % de los niños alérgicos al huevo toleran alimentos altamente cocidos durante la provocación (64). En algunos pacientes se puede realizar una dieta de restricción selectiva con aquellos productos menos cocidos, lo cual resulta más cómodo para el paciente y para su familia. Algunos artículos recientemente publicados sugieren que el consumo frecuente de productos que contienen huevo y están altamente cocidos reduce el tiempo de sensibilización y favorece la tolerancia de los pacientes (65). El tiempo necesario para este proceso varía entre los estudios, pero, en general, se considera que una cocción del huevo a 90 °C durante 15 minutos es suficiente en 95 % de los casos.
Inducción de la tolerancia. Al igual que para la leche, se ha intentado la administración de dosis graduales de huevo con el fin de generar una tolerancia en el paciente que evite la presencia de reacciones en caso de un consumo accidental (cuadro 3). Con el fin de reducir el riesgo de eventos adversos se han intentado esquemas de inducción de la tolerancia y de modulación de la respuesta inmune con huevo cocido y horneado (66). En un estudio de niños alérgicos al huevo, se comparó la inmunoterapia oral con huevo y un placebo durante dos años, y se encontró que a los 10 meses, 55 % de los niños toleraban 5.000 mg de huevo en comparación con 0 % en el grupo de placebo. A los 22 meses, 75 % del grupo activo ya toleraba 10.000 mg de huevo (67). El tiempo de los esquemas para alcanzar la dosis tope puede variar de algunas horas hasta meses, según la sensibilidad del paciente.
Nuevas terapias emergentes
Debido a la frecuencia creciente de la alergia alimentaria y a la falta de respuesta aun con medidas de evitación prolongada o protocolos de inducción de tolerancia, algunas alternativas han sido propuestas.
Prebióticos, probióticos, simbióticos
En el tracto gastrointestinal conviven miles de especies de bacterias, las cuales son la primera barrera indirecta para la absorción de los alimentos. Actualmente se sabe que entre esta flora y las células inmunes hay una importante interacción y que este equilibrio puede verse alterado en la alergia a la leche de vaca y al huevo de gallina (68,69), por lo que se ha explorado si la administración de ciertas sustancias puede restablecer dicho equilibrio. Los prebióticos son sustancias que estimulan un ambiente adecuado para el crecimiento de un microbioma favorable para el huésped (70). Los probióticos son microorganismos vivos que, administrados en cantidades adecuadas, favorecen al huésped, y los simbióticos son mezclas de estas dos sustancias que buscan potenciar su efecto (70). La evidencia actual no permite recomendar el uso de estas sustancias para el manejo de las alergias alimentarias; sin embargo, algunos estudios muestran que su uso puede acortar el tiempo necesario para adquirir tolerancia y tener cierto efecto protector.
Anti-IgE y anti-IL5
Con el advenimiento de nuevas terapias biológicas, se han podido crear anticuerpos monoclonales dirigidos a puntos específicos de la cascada inflamatoria, lo cual permite bloquear estos puntos y evitar el desarrollo de un proceso inflamatorio.
El uso de anticuerpos anti-IgE tiene el propósito de reducir la cantidad de IgE total y específica (71). Como efecto secundario se produce una reducción de los receptores de alta afinidad con IgE en los mastocitos y basófilos, lo que dificulta la activación de estas células y el desarrollo de la respuesta alérgica. Aunque se requieren estudios controlados, esta terapia, sola o conjugada con la inducción de tolerancia, ha mostrado resultados alentadores en reportes de casos de pacientes con alergia alimentaria mediada por IgE (72-74). En los pacientes con alergias y procesos eosinofílicos, la respuesta ha sido variada, tal vez debido a la heterogeneidad de los pacientes seleccionados, lo cual dificulta determinar qué criterios debería cumplir el paciente para obtener el máximo beneficio con esta terapia (71).
El uso de anticuerpos anti-IL5 se propuso en las alergias alimentarias con un proceso eosinofílico de base como la esofagitis eosinofílica y la colitis eosinofílica (75,76); sin embargo, de forma similar a lo encontrado en los pacientes con estas enfermedades que recibieron anti-IgE (71), la mejoría clínica y los cambios histológicos varían entre los pacientes, lo que todavía impide recomendar esta terapia en el manejo rutinario de las alergias alimentarias. Una mejor clasificación de los pacientes, basada en los mecanismos fisiopatológicos de las síndromes eosinofílicos gastrointestinales, tal vez permitiría vislumbrar cuáles son los sujetos que realmente pueden beneficiarse con este tipo de terapias.
Hierbas chinas
Desde hace cientos de años, en China y en varios países asiáticos la medicina tradicional se ha utilizado para manejar múltiples dolencias. Debido a que existe una carencia importante de estudios controlados que permitan recomendar esta terapia en el manejo de las alergias alimentarias, actual- mente varios grupos vienen adelantando proyectos que han arrojado resultados prometedores (77).
Tipo de dieta
Algunos tipos de dieta, especialmente aquellas basadas en el consumo de frutas y vegetales y enriquecidas con ácidos grasos poliinsaturados como el omega 3, se han popularizado alrededor del mundo. Si bien existen resultados que demuestran los beneficios de estas dietas, especialmente en la prevención y en el manejo de procesos inflamatorios, e incluso en pacientes con dermatitis atópica y sensibilización a alimentos (78,79), al igual que para las otras terapias emergentes mencionadas se requieren estudios controlados que permitan cuantificar el aporte de estas alternativas frente a las ya existentes para el manejo de las alergias alimentarias.
Consideraciones para América Latina
Actualmente, en América Latina existen pocas investigaciones que exploren la epidemiología de la alergia alimentaria (80), por lo que poco se conoce de la frecuencia de la alergia a la leche de vaca y al huevo de gallina. Sin embargo, algunos estudios publicados principalmente en México (81,82) y Brasil (57,83) reportan que, aunque ambos alimentos son las fuentes más usuales de alérgenos, la frecuencia encontrada es menor que en Europa y Estados Unidos y que otras fuentes, como el maíz y algunas frutas y verduras, tienen una frecuencia similar de sensibilización que incluso es mayor en algunas ciudades. Estos datos indican que las costumbres alimenticias, las características genéticas y el tipo de ambiente influyen de manera importante.
Las técnicas más modernas de medición de IgE específica por medio de ImmunoCAP han tenido una rápida acogida, pero en la mayoría de los países de América Latina todavía se siguen utilizando técnicas como la prueba RAST y métodos semicuantitativos como la electroforesis en SDS PAGE, que son útiles para detectar la presencia de IgE específica, pero no son los más adecuados para el seguimiento del paciente por su menor especificidad para predecir cuándo se podría tolerar una prueba de provocación.
Este tipo de inconvenientes, al igual que no disponer de dispositivos de adrenalina auto- inyectable en la mayoría de los países, parecen ser un problema temporal debido al rápido crecimiento de la globalización en los servicios médicos. Sin embargo, el principal problema en el manejo de las alergias alimentarias en América Latina es el desconocimiento por parte del personal de salud de las medidas que debe observar el paciente. Actualmente, solo en Argentina se ha elaborado una guía de manejo del paciente con alergia a la leche (84) y una página oficial (www.alergialimentaria.org) que busca ayudar y educar al paciente, a los familiares y a los cuidadores en todos los ámbitos en donde existen riesgos potenciales de reacciones graves por exposición inadvertida, que van desde la casa, el colegio, la escuela, la guardería y los restaurantes hasta las aerolíneas comerciales. De igual forma, es necesario avanzar en las medidas de etiquetamiento de los ingredientes contenidos en los productos.
Atención primaria
Diagnóstico. Por lo general, el paciente que ha tenido una reacción a un alimento consulta inicialmente con el médico general, el médico familiar o el pediatra. En este primer encuentro es necesario realizar algunas preguntas para determinar la probabilidad de que la reacción se haya debido a un alimento. Esta primera aproximación se enfoca en las reacciones agudas o tardías a la leche o al huevo, pero las medidas iniciales de atención primaria pueden aplicarse a cualquier alergia alimentaria.
En la figura 1 se presenta el flujograma de manejo que a continuación se explica.
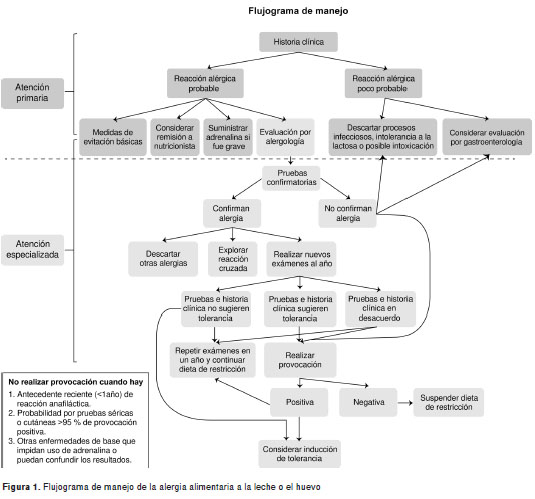
1. ¿En qué consistió la reacción? Es necesario registrar los signos y síntomas del paciente, ya que pueden ayudar a sospechar una reacción alérgica o una posible intoxicación. Los sistemas frecuentemente afectados son la piel (60 a 80 %), el tracto respiratorio (40 a 60 %) y el tracto gastrointestinal (30 a 40 %). Los síntomas en la piel suelen ser eritema, prurito y presencia de habones; cuando se presentan se consideran una reacción leve, pero si esta reacción se acompaña de afectación de otro sistema, se considera que el paciente puede tener una anafilaxia que debe registrarse como una reacción grave. En América Latina los alimentos son la segunda causa más frecuente de anafilaxia después de los medicamentos (85). Los síntomas bronquiales o cardiovasculares también se consideran reacciones graves frente a los cuales debe contemplarse el porte de adrenalina por parte del paciente.
2. ¿Hace cuánto tuvo la reacción? El tiempo que ha pasado desde el momento de la reacción hasta que el paciente asiste a la consulta es clave para definir la conducta que se debe seguir. Si el paciente tuvo la reacción hace más de un año y fue leve, tal vez pueda ser candidato para una provocación bajo supervisión por parte de un médico especializado.
3. ¿Cuáles son los alimentos sospechosos? Es indispensable consignar en la historia clínica qué alimentos consumió el paciente. En caso de que hayan sido comidas con varios ingredientes, se deben listar todos ellos, haciendo énfasis en si se encuentra entre ellos alguno de los ocho alimentos más frecuentes, en especial leche o huevo, o alguno que sea usual en el medio. También es necesario preguntar sobre el tipo de cocción del alimento y descartar el contacto con otras fuentes probables de reacción como procesos infecciosos de base y uso de medicamentos.
4. ¿Cuánto tiempo después de consumir el alimento sospechoso se presentó la reacción? Se consideran alimentos altamente sospechosos a aquellos consumidos en las primeras dos horas antes de la reacción y poco sospechosos a los consumidos más de 24 horas antes de la reacción. En las primeras dos horas, usualmente el mecanismo es mediado por IgE, y en reacciones más tardías puede intervenir una respuesta celular, por lo que es necesario realizar pruebas de parche. Las reacciones tardías suelen ser de tipo eccematoso o presentarse con síntomas gastrointestinales, probablemente con mediación eosinofílica.
5. ¿Ya había consumido antes este alimento o productos que lo contienen? Es común que el paciente haya tolerado durante un corto periodo el alimento sospechoso y posteriormente presente reacción tras su contacto. Esta primera fase es la de sensibilización, en la cual se establece la respuesta inmunológica específica. Para el caso de la leche y el huevo, las reacciones pueden ocurrir luego del primer contacto directo, lo que se debe al contacto del niño con las proteínas de estos alimentos a través de la leche materna o al consumo de productos que tienen leche o huevo como ingredientes.
6. ¿Ha consumido alguno de estos alimentos después de la reacción? Saber si el paciente ha tolerado el alimento sospechoso en nuevas exposiciones puede ayudar a descartar una alergia o, en caso de que existan varios alimentos sospechosos, a afinar el diagnóstico. También es posible que el paciente haya generado tolerancia al alimento. El tipo de alimento tolerado posteriormente debe quedar consignado, ya que si se trata de un alimento muy cocido, no puede asegurarse que el paciente no reaccionará con formas menos cocidas.
Los síntomas del paciente y el tiempo de la reacción después de la exposición sirven para definir si esta puede ser alérgica o no. Las demás preguntas ayudan a determinar el manejo.
Manejo. El manejo inicial del paciente consiste en una educación adecuada dirigida a la restricción completa del alimento sospechoso. En caso de niños menores de dos años, tal vez sea necesario que dicha restricción esté acompañada de la evaluación de un nutricionista para evitar trastornos en el desarrollo del niño. En caso de haber presentado reacciones graves, debe explicársele al paciente cómo usar la adrenalina y en qué momento. En caso de sospechar de una alergia, el paciente debe ser evaluado por un alergólogo sin importar la gravedad de la reacción.
Atención especializada
Exámenes confirmatorios. De acuerdo con los síntomas del paciente, se deben realizar pruebas cutáneas epidérmicas, intraepidérmicas y medición de IgE específica sérica para el alimento sospechoso. Se debe descartar la alergia a otros alimentos o la reacción cruzada, en especial con soya y arroz, en el paciente alérgico a la leche. Si existe duda en el diagnóstico, puede ser necesario realizar pruebas de provocación.
Manejo. A todo paciente con alergia a la leche o al huevo se le deben practicar pruebas seriadas anualmente, ya que un buen porcentaje adquiere tolerancia y puede levantársele la dieta de restricción. De acuerdo con la evolución del paciente y los resultados de las pruebas, se puede realizar una provocación con el fin de confirmar que se ha adquirido tolerancia. En caso de que el paciente no tolere la provocación y cumpla los criterios, se puede observar un protocolo de inducción de tolerancia, con el cual, tal vez, no se pueda levantar la restricción de manera total, pero sí hacerla más selectiva.
Los autores declaramos no tener conflicto de intereses con ninguna persona o institución.
Declaramos no haber recibido ningún tipo de financiación externa, pública o privada, para la elaboración de este artículo.
Correspondencia:
Jorge Sánchez, Carrera 42 N° 7ª-sur-92, apartamento 1710, bloque 3, Medellín, Colombia Teléfono: (300) 393 4000 jotamsc@yahoo.com
1. Eggesbø M, Halvorsen R, Tambs K, Botten G. Prevalence of parentally perceived adverse reactions to food in young children. Pediatr Allergy Immunol. 1999;10:122-32. http://dx.doi.org/10.1034/j.1399-3038.1999.00022.x [ Links ]
2. Pereira B, Venter C, Grundy J, Clayton CB, Arshad SH, Dean T. Prevalence of sensitization to food allergens, reported adverse reaction to foods, food avoidance, and food hypersensitivity among teenagers. J Allergy Clin Immunol. 2005;116:884-92. http://dx.doi.org/10.1016/j.jaci.2005.05.047 [ Links ]
3. Young E, Stoneham MD, Petruckevitch A, Barton J, Rona R. A population study of food intolerance. Lancet. 1994;343:1127-30 . http://dx.doi.org/10.1016/S0140-6736(94)90234-8 [ Links ]
4. Marrugo J, Hernández L, Villalba V. Prevalence of self-reported food allergy in Cartagena (Colombia) population. Allergol Immunopathol (Madr). 2008;36:320-4. [ Links ]
5. Bock SA. Prospective appraisal of complaints of adverse reactions to foods in children during the first 3 years of life. Pediatrics. 1987;79:683-8. [ Links ]
6. Jones SM, Burks AW. The changing CARE for patients with food allergy. J Allergy Clin Immunol. 2013;131:3-11. http://dx.doi.org/10.1016/j.jaci.2012.11.012 [ Links ]
7. Osterballe M, Hansen TK, Mortz CG, Høst A, Bindslev-Jensen C. The prevalence of food hypersensitivity in an unselected population of children and adults. Pediatr Allergy Immunol. 2005;16:567-73. http://dx.doi.org/10.1111/j.1399-3038.2005.00251.x [ Links ]
8. R oy-Ghanta S, Larosa DF, Katzka DA. Atopic characteristics of adult patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol. 2008;6:531-5. http://dx.doi.org/10.1016/j.cgh.2007.12.045 [ Links ]
9. Schäfer T, Böhler E, Ruhdorfer S, Weigl L, Wessner D, Heinrich J, et al . Epidemiology of food allergy/food intolerance in adults: associations with other manifestations of atopy. Allergy. 2001;56:1172-9. http://dx.doi.org/10.1034/j.1398-9995.2001.00196.x [ Links ]
10. Venter C, Arshad SH. Epidemiology of food allergy. Pediatr Clin North Am. 2011;58:327-49. http://dx.doi.org/10.1016/j.pcl.2011.02.011 [ Links ]
11. Sole D, Jacob C, Pastorino A, Porto A, Burns D, Sarinho E, et al . Pediatricians´ knowledge on food allergy: Pilot study. Revista Paulista de Pediatria. 2007;25:311-6. [ Links ]
12. De Greef E, Hauser B, Devreker T, Veereman-Wauters G, Vandenplas Y. Diagnosis and management of cow´s milk protein allergy in infants. World J Pediatr. 2012;8:19-24. http://dx.doi.org/10.1007/s12519-012-0332-x [ Links ]
13. Bascuñán Gamboa KA, Weisstaub Nuta SG, Chamorro Melo RA, Guzmán MA, Araya Quezada M. Association of dietary patterns and food allergy in infants during the first year of life. Arch Argent Pediatr. 2012;110:375-80. http://dx.doi.org/10.1590/S0325-00752012000500003 [ Links ]
14. Savage JH, Matsui EC, Skripak JM, Wood RA. The natural history of egg allergy. J Allergy Clin Immunol. 2007;120:1413-7. http://dx.doi.org/10.1016/j.jaci.2007.09.040 [ Links ]
15. Sampson HA. Utility of food-specific IgE concentrations in predicting symptomatic food allergy. J Allergy Clin Immunol. 2001;107:891-6. http://dx.doi.org/10.1067/mai.2001.114708 [ Links ]
16. Fiocchi A, Brozek J, Schünemann H, Bahna SL, von Berg A, Beyer K, et al . World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow´s Milk Allergy (DRACMA) Guidelines. World Allergy Organ J. 2010;3:57-161. http://dx.doi.org/10.1097/WOX.0b013e3181defeb9 [ Links ]
17. Koletzko S, Niggemann B, Arato A, Dias JA, Heuschkel R, Husby S, et al . Diagnostic approach and management of cow´s-milk protein allergy in infants and children: ESPGHAN GI Committee practical guidelines. J Pediatr Gastroenterol Nutr. . 2012;55:221-9. http://dx.doi.org/10.1097/MPG.0b013e31825c9482 [ Links ]
18. Järvinen KM, Chatchatee P. Mammalian milk allergy: Clinical suspicion, cross-reactivities and diagnosis. Curr Opin Allergy Clin Immunol. 2009;9:251-8. http://dx.doi.org/10.1097/ACI.0b013e32832b3f33 [ Links ]
19. Matsumoto T. Mitigation of the allergenic activity of beta- lactoglobulin by electrolysis. Pediatr Allergy Immunol. 2011;22:235-42. http://dx.doi.org/10.1111/j.1399-3038.2010.01069.x [ Links ]
20. Nowak-Wegrzyn A, Bloom KA, Sicherer SH, Shreffler WG, Noone S, Wanich N, et al . Tolerance to extensively heated milk in children with cow´s milk allergy. J Allergy Clin Immunol. 2008;122:342-7. http://dx.doi.org/10.1016/j.jaci.2008.05.043 [ Links ]
21. Nowak-Wegrzyn A, Assa´ad AH, Bahna SL, Bock SA, Sicherer SH, Teuber SS, et al . Work Group report: Oral food challenge testing. J Allergy Clin Immunol. 2009;123:S365-83. http://dx.doi.org/10.1016/j.jaci.2009.03 [ Links ]
22. Du Toit G, Santos A, Roberts G, Fox AT, Smith P, Lack G. The diagnosis of IgE-mediated food allergy in childhood. Pediatr Allergy Immunol. 2009;20:309-19. http://dx.doi.org/doi:10.1111/j.1399-3038.2009.00887 [ Links ]
23. Roehr CC, Reibel S, Ziegert M, Sommerfeld C, Wahn U, Niggemann B. Atopy patch tests, together with determination of specific IgE levels, reduce the need for oral food challenges in children with atopic dermatitis. J Allergy Clin Immunol. 2001;107:548-53. http://dx.doi.org/10.1067/mai.2001.112849 [ Links ]
24. Mehl A, Rolinck-Werninghaus C, Staden U, Verstege A, Wahn U, Beyer K, et al . The atopy patch test in the diagnostic workup of suspected food-related symptoms in children. J Allergy Clin Immunol. 2006;118:923-9. http://dx.doi.org/10.1016/j.jaci.2006.07.003 [ Links ]
25. Crotty MP, Taylor SL. Risks associated with foods having advisory milk labeling. J Allergy Clin Immunol. 2010;125:935-7. http://dx.doi.org/10.1016/j.jaci.2009.12.003 [ Links ]
26. Kim JS, Sicherer SH. Living with food allergy: allergen avoidance. Pediatr Clin North Am. 2011;58:459-70. http://dx.doi.org/10.1016/j.pcl.2011.02.007 [ Links ]
27. Berin MC, Mayer L. Can we produce true tolerance in patients with food allergy? J Allergy Clin Immunol. 2013;131:14-22. http://dx.doi.org/10.1016/j.jaci.2012.10.058 [ Links ]
28. Burks AW, Laubach S, Jones SM. Oral tolerance, food allergy, and immunotherapy: Implications for future treatment. J Allergy Clin Immunol. 2008;121:1344-50. http://dx.doi.org/10.1016/j.jaci.2008.02.037 [ Links ]
29. Chafen JJ, Newberry SJ, Riedl MA, Bravata DM, Maglione M, Suttorp MJ, et al. Diagnosing and managing common food allergies: A systematic review. JAMA. 2010;303:1848-56. http://dx.doi.org/10.1001/jama.2010.582 [ Links ]
30. Martorell A, De la Hoz B, Ibáñez MD, Bone J, Terrados MS, Michavila A, et al. Oral desensitization as a useful treatment in 2-year-old children with cow´s milk allergy. Clin Exp Allergy. 2011;41:1297-304. http://dx.doi.org/10.1111/j.1365-2222.2011.03749.x [ Links ]
31. Keet CA, Frischmeyer-Guerrerio PA, Thyagarajan A, Schroeder JT, Hamilton RG, Boden S, et al . The safety and efficacy of sublingual and oral immunotherapy for milk allergy. J Allergy Clin Immunol. 2012;129:448-55. http://dx.doi.org/10.1016/j.jaci.2011.10.023 [ Links ]
32. Vázquez-Ortiz M, Alvaro-Lozano M, Alsina L, Garcia-Paba MB, Piquer-Gibert M, Giner-Muñoz MT, et al . Safety and predictors of adverse events during oral immunotherapy for milk allergy: Severity of reaction at oral challenge, specific IgE and prick test. Clin Exp Allergy. 2013;43:92-102. http://dx.doi.org/10.1111/cea.12012 [ Links ]
33. Patriarca G, Nucera E, Pollastrini E, Roncallo C, De Pasquale T, Lombardo C, et al . Oral specific desensitization in food-allergic children. Dig Dis Sci. 2007;52:1662-72. http://dx.doi.org/10.1007/s10620-006-9245-7 [ Links ]
34. Niggemann B, Beyer K. Adrenaline autoinjectors in food allergy: In for a cent, in for a euro? Pediatr Allergy Immunol. 2012;23:506-8. http://dx.doi.org/10.1111/j.1399-3038.2012.01300.x [ Links ]
35. Clark AT, Ewan PW. Good prognosis, clinical features, and circumstances of peanut and tree nut reactions in children treated by a specialist allergy center. J Allergy Clin Immunol. 2008;122:286-9. http://dx.doi.org/10.1016/j.jaci.2008.05.015 [ Links ]
36. Henderson CJ, Abonia JP, King EC, Putnam PE, Collins MH, Franciosi JP, et al . Comparative dietary therapy effectiveness in remission of pediatric eosinophilic esophagitis. J Allergy Clin Immunol. 2012;129:1570-8. http://dx.doi.org/10.1016/j.jaci.2012.03.023 [ Links ]
37. Rozenfeld P, Docena GH, Añón MC, Fossati CA. Detection and identification of a soy protein component that cross- reacts with caseins from cow´s milk. Clin Exp Immunol. 2002;130:49-58. [ Links ]
38. Osborn DA, Sinn J. Formulas containing hydrolysed protein for prevention of allergy and food intolerance in infants. Cochrane Database Syst Rev. 2006:CD003664. http://dx.doi.org/10.1002/14651858.CD003664.pub3 [ Links ]
39. Lucarelli S, Di Nardo G, Lastrucci G, D´Alfonso Y, Marcheggiano A, Federici T, et al . Allergic proctocolitis refractory to maternal hypoallergenic diet in exclusively breast-fed infants: a clinical observation. BMC Gastroenterol. 2011;11:82. http://dx.doi.org/10.1186/1471-230X-11-82 [ Links ]
40. Ando H, Movérare R, Kondo Y, Tsuge I, Tanaka A, Borres MP, et al . Utility of ovomucoid-specific IgE concentrations in predicting symptomatic egg allergy. J Allergy Clin Immunol. 2008;122:583-8. http://dx.doi.org/10.1016/j.jaci.2008.06.016 [ Links ]
41. Boyano Martínez T, García-Ara C, Díaz-Pena JM, Muñoz FM, García Sánchez G, Esteban MM. Validity of specific IgE antibodies in children with egg allergy. Clin Exp Allergy. 2001;31:1464-9. http://dx.doi.org/10.1046/j.1365-2222.2001.01175.x [ Links ]
42. Rona RJ, Keil T, Summers C, Gislason D, Zuidmeer L, Sodergren E, et al . The prevalence of food allergy: A meta- analysis. J Allergy Clin Immunol. 2007;120:638-46. http://dx.doi.org/10.1016/j.jaci.2007.05.026 [ Links ]
43. Eggesbø M, Botten G, Halvorsen R, Magnus P. The prevalence of allergy to egg: A population-based study in young children. Allergy. 2001;56:403-11. http://dx.doi.org/10.1034/j.1398-9995.2001.056005403.x [ Links ]
44. Chen J, Hu Y, Allen KJ, Ho MH, Li H. The prevalence of food allergy in infants in Chongqing, China. Pediatr Allergy Immunol. 2011;22:356-60. http://dx.doi.org/10.1111/j.1399-3038.2011.01139.x [ Links ]
45. Osborne NJ, Koplin JJ, Martin PE, Gurrin LC, Lowe AJ, Matheson MC, et al. Prevalence of challenge-proven IgE-mediated food allergy using population-based sampling and predetermined challenge criteria in infants. J Allergy Clin Immunol. 2011;127:668-76.e1-2. http://dx.doi.org/10.1016/j.jaci.2011.01.039 [ Links ]
46. Jansen JJ, Kardinaal AF, Huijbers G, Vlieg-Boerstra BJ, Martens BP, Ockhuizen T. Prevalence of food allergy and intolerance in the adult Dutch population. J Allergy Clin Immunol. 1994;93:446-56. http://dx.doi.org/10.1016/0091-6749(94)90353-0 [ Links ]
47. Mehl A, Wahn U, Niggemann B. Anaphylactic reactions in children- a questionnaire-based survey in Germany. Allergy. 2005;60:1440-5. http://dx.doi.org/10.1111/j.1398-9995.2005.00909.x [ Links ]
48. Besler M, Steinhart H, Paschke A. Stability of food allergens and allergenicity of processed foods. J Chromatogr B Biomed Sci Appl. 2001;756:207-28. [ Links ]
49. Wang J, Lin J, Bardina L, Goldis M, Nowak-Wegrzyn A, Shreffler WG, et al. Correlation of IgE/IgG4 milk epitopes and affinity of milk-specific IgE antibodies with different phenotypes of clinical milk allergy. J Allergy Clin Immunol. 2010;125:695-702. http://dx.doi.org/10.1016/j.jaci.2009.12.017 [ Links ]
50. Konstantinou GN, Kim JS. Paradigm shift in the management of milk and egg allergy: baked milk and egg diet. Immunol Allergy Clin North Am. 2012;32:151-64. http://dx.doi.org/10.1016/j.iac.2011.11.003 [ Links ]
51. Reibel S, Röhr C, Ziegert M, Sommerfeld C, Wahn U, Niggemann B. What safety measures need to be taken in oral food challenges in children? Allergy. 2000;55:940-4. http://dx.doi.org/10.1034/j.1398-9995.2000.00689.x [ Links ]
52. Niggemann B, Sielaff B, Beyer K, Binder C, Wahn U. Outcome of double-blind, placebo-controlled food challenge tests in 107 children with atopic dermatitis. Clin Exp Allergy. 1999;29:91-6. http://dx.doi.org/10.1046/j.1365-2222.1999.00454.x [ Links ]
53. Ando H, Movérare R, Kondo Y, Tsuge I, Tanaka A, Borres MP, et al . Utility of ovomucoid-specific IgE concentrations in predicting symptomatic egg allergy. J Allergy Clin Immunol. 2008;122:583-8. http://dx.doi.org/10.1016/j.jaci.2008.06.016 [ Links ]
54. Shek LP, Soderstrom L, Ahlstedt S, Beyer K, Sampson HA. Determination of food specific IgE levels over time can predict the development of tolerance in cow´s milk and hen´s egg allergy. J Allergy Clin Immunol. 2004;114:387-91. http://dx.doi.org/10.1016/j.jaci.2004.04.032 [ Links ]
55. Lack G. Clinical practice. Food allergy. N Engl J Med. 2008;359:1252-60. http://dx.doi.org/10.1056/NEJMcp0800871 [ Links ]
56. Hill DJ, Heine RG, Hosking CS. The diagnostic value of skin prick testing in children with food allergy. Pediatr Allergy Immunol. 2004;15:435-41. http://dx.doi.org/10.1111/j.1399-3038.2004.00188.x [ Links ]
57. Levy SA, Dortas Junior SD, Pires AH, Abe AT, Valle SO, Coelho VP, et al . Atopy patch test (APT) in the diagnosis of food allergy in children with atopic dermatitis. An Bras Dermatol. 2012;87:724-8. http://dx.doi.org/10.1590/S0365-05962012000500009 [ Links ]
58. Urisu A, Ando H, Morita Y, Wada E, Yasaki T, Yamada K, et al . Allergenic activity of heated and ovomucoid-depleted egg white. J Allergy Clin Immunol. 1997;100:171-6. http://dx.doi.org/10.1016/S0091-6749(97)70220-3 [ Links ]
59. Boyano-Martínez T, García-Ara C, Díaz-Pena JM, Martín-Esteban M. Prediction of tolerance on the basis of quantification of egg white-specific IgE antibodies in children with egg allergy. J Allergy Clin Immunol. 2002;110:304-9. http://dx.doi.org/10.1067/mai.2002.126081 [ Links ]
60. Ahuja R, Sicherer SH. Food-allergy management from the perspective of restaurant and food establishment personnel. Ann Allergy Asthma Immunol. 2007;98:344-8. http://dx.doi.org/10.1016/S1081-1206(10)60880-0 [ Links ]
61. Alessandri C, Calvani M, Rosengart L, Madella C. Anaphylaxis to quail egg. Allergy. 2005;60:128-9. http://dx.doi.org/10.1111/j.1398-9995.2004.00449.x [ Links ]
62. Hofer KN, McCarthy MW, Buck ML, Hendrick AE. Possible anaphylaxis after propofol in a child with food allergy. Ann Pharmacother. 2003;37:398-401. [ Links ]
63. Roukens AH, Vossen AC, van Dissel JT, Visser LG. Reduced intradermal test dose of yellow fever vaccine induces protective immunity in individuals with egg allergy. Vaccine. 2009;27:2408-9. http://dx.doi.org/10.1016/j.vaccine.2009.02.049 [ Links ]
64. Lemon-Mulé H, Sampson HA, Sicherer SH, Shreffler WG, Noone S, Nowak-Wegrzyn A. Immunologic changes in children with egg allergy ingesting extensively heated egg. J Allergy Clin Immunol. 2008;122:977-83. http://dx.doi.org/10.1016/j.jaci.2008.09.007 [ Links ]
65. Anet J, Back JF, Baker RS, Barnett D, Burley RW, Howden ME. Allergens in the white and yolk of hen´s egg. A study of IgE binding by egg proteins. Int Arch Allergy Appl Immunol. 1985;77:364-71. [ Links ]
66. Caubet JC, Wang J. Current understanding of egg allergy. Pediatr Clin North Am. 2011;58:427-43. http://dx.doi.org/10.1016/j.pcl.2011.02.014 [ Links ]
67. Burks AW, Jones SM, Wood RA, Fleischer DM, Sicherer SH, Lindblad RW, et al . Oral immunotherapy for treatment of egg allergy in children. N Engl J Med. 2012;367:233-43. http://dx.doi.org/10.1056/NEJMoa1200435 [ Links ]
68. Thompson-Chagoyan OC, Vieites JM, Maldonado J, Edwards C, Gil A. Changes in faecal microbiota of infants with cow´s milk protein allergy--a Spanish prospective case-control 6-month follow-up study. Pediatr Allergy Immunol. 2010;21:e394-400. http://dx.doi.org/doi:10.1111/j.1399-3038.2009.00961.x [ Links ]
69. Rodriguez B, Prioult G, Bibiloni R, Nicolis I, Mercenier A, Butel MJ, et al. Germ-free status and altered caecal subdominant microbiota are associated with a high susceptibility to cow´s milk allergy in mice. FEMS Microbiol Ecol. 2011;76:133-44. http://dx.doi.org/10.1111/j.1574-6941.2010.01035.x [ Links ]
70. Vyas U, Ranganathan N. Probiotics, prebiotics, and synbiotics: gut and beyond. Gastroenterol Res Pract. 2012;2012:872716. http://dx.doi.org/10.1155/2012/872716 [ Links ]
71. Sánchez J, Ramírez R, Díez S, Sus S, Echenique A, Olivares M, et al. Omalizumab beyond asthma. Allergol Immunopathol (Madr). 2012;40:306-15. http://dx.doi.org/10.1016/j.aller.2011.09.011 [ Links ]
72. Riffelmann F. Anti IgE therapy (off label use) in severe peanut allergy with recurrent anaphylaxis. Pneumologie. 2008;62:337-9. http://dx.doi.org/10.1055/s-2008-1038114 [ Links ]
73. Plaza-Martín MTG-Mo, O. Domínguez-Sánchez, M. Piquer-Gibert, M. A. Martín-Mateos. Omalizumab and the induction of tolerance to cow´s milk proteins in children at high risk of anaphylaxis. J Allergy Clin Immunol. 2009;123:s26. http://dx.doi.org/10.1016/j.jaci.2008.12.114 [ Links ]
74. Rafi A, Do LT, Katz R, Sheinkopf LE, Simons CW, Klaustermeyer W. Effects of omalizumab in patients with food allergy. Allergy Asthma Proc. 2010;31:76-83. http://dx.doi.org/10.2500/aap.2010.31.3304 [ Links ]
75. Corren J. Inhibition of interleukin-5 for the treatment of eosinophilic diseases. Discov Med. 2012;13:305-12. [ Links ]
76. Stone KD, Prussin C. Immunomodulatory therapy of eosinophil-associated gastrointestinal diseases. Clin Exp Allergy. 2008;38:1858-65. http://dx.doi.org/10.1111/j.1365-2222.2008.03122.x [ Links ]
77. Wang J, Li XM. Chinese herbal therapy for the treatment of food allergy. Curr Allergy Asthma Rep. 2012;12:332-8. http://dx.doi.org/10.1007/s11882-012-0265-4 [ Links ]
78. Palmer DJ, Sullivan T, Gold MS, Prescott SL, Heddle R, Gibson RA , et al . Effect of n-3 long chain polyunsaturated fatty acid supplementation in pregnancy on infants´ allergies in first year of life: Randomised controlled trial. BMJ. 2012;344:e184. http://dx.doi.org/10.1136/bmj.e184 [ Links ]
79. Furuhjelm C, Warstedt K, Larsson J, Fredriksson M, Böttcher MF, Fälth-Magnusson K, et al. Fish oil supplementation in pregnancy and lactation may decrease the risk of infant allergy. Acta Paediatr. 2009;98:1461-7. http://dx.doi.org/10.1111/j.1651-2227.2009.01355.x [ Links ]
80. B oye JI. Food allergies in developing and emerging economies: need for comprehensive data on prevalence rates. Clin Transl Allergy. 2012;2:25. http://dx.doi.org/10.1186/2045-7022-2-25 [ Links ]
81. Ortega EV, Vázquez MI, Tapia JG, Feria AJ. Most common allergens in allergic patients admitted into a third-level hospital. Rev Alerg Mex. 2004;51:145-50. [ Links ]
82. Ortega Cisneros M, Vidales Díaz MA, del Río Navarro BE, Sienra Monge JJ. Cutaneous reactivity to foods among patients with allergic rhinoconjunctivitis. Rev Alerg Mex. 1997;44:153-7. [ Links ]
83. Barreto ML, Cunha SS, Fiaccone R, Esquivel R, Amorim LD, Alvim S , et al . Poverty, dirt, infections and non-atopic wheezing in children from a Brazilian urban center. Respir Res. 2010;11:167. http://dx.doi.org/10.1186/1465-9921-11-167 [ Links ]
84. Marina O, Fernández A, Follett FR, Marchisone S, Saieg G, Busoni VB, et al . Cow´s milk protein allergy: proposed guidelines for the management of children with cow´s milk protein allergy. Arch Argent Pediatr. 2009;107:459-67. http://dx.doi.org/10.1590/S0325-00752009000500016 [ Links ]
85. Sole D, Ivancevich JC, Borges MS, Coelho MA, Rosario NA, Ardusso LR, et al. Anaphylaxis in Latin America: A report of the online Latin American survey on anaphylaxis (OLASA).Clinics. 2011;66:943-7. http://dx.doi.org/10.1590/S1807-59322011000600004 [ Links ]













