Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157
Biomédica vol.34 no.2 Bogotá abr./jun. 2014
https://doi.org/10.7705/biomedica.v34i2.1550
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v34i2.1550
1 Departamento de Medicina Interna, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, D.C., Colombia
2 Grupo de Investigación en Enfermedades Infecciosas, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, D.C., Colombia
Contribución de los autores:
Leidy González: desarrollo del protocolo de investigación
Jorge Alberto Cortés: idea de la investigación, supervisión del protocolo
Ambos autores participaron en la búsqueda y análisis de la información y en la redacción del manuscrito.
Recibido: 29/01/13; aceptado: 27/11/13
Introducción. La resistencia bacteriana es un problema de salud pública a nivel mundial que compromete seriamente la capacidad de tratar las infecciones.
Objetivo. Describir el perfil de resistencia a los antimicrobianos marcadores en enterobacterias identificadas en hospitales colombianos.
Materiales y métodos. Se hizo una revisión bibliográfica sistemática de las publicaciones indexadas en Medline, Embase y Lilacs, además de la búsqueda manual de todos los números de revistas colombianas reconocidas en el campo de la infectología y otros afines para identificar referencias no disponibles electrónicamente.
Resultados. Se identificaron 43 estudios y reportes de vigilancia epidemiológica con información sobre la resistencia de las enterobacterias en hospitales, principalmente de Bogotá, Cali y Medellín. La tasa de resistencia en Escherchia coli oscila entre 3 y 11 %, 5 y 20 % y 0,2 a 0,8 % para piperacilina-tazobactam, cefalosporinas de tercera generación y carbapenémicos, respectivamente. En aislamientos de Klebsiella pneumoniae , la resistencia oscila entre 21,8 y 48,1 % frente a piperacilina-tazobactam, 20 y 35 % frente a cefalosporinas de amplio espectro y 3 y 8 % frente a carbapenémicos, con variaciones importantes por ciudades, niveles de atención y circunstancias clínicas.
Conclusiones. La diseminación de la resistencia bacteriana en enterobacterias aisladas en hospitales colombianos es un problema creciente que requiere medidas prontas para cortar las cadenas de transmisión.
Palabras clave: resistencia a medicamentos, farmacorresistencia bacteriana, farmacorresistencia microbiana, farmacorresistencia bacteriana múltiple, infecciones por Enterobacteriaceae, Entero-bacteriaceae; infecciones por Klebsiella ; infecciones por Escherichia coli ; Enterobacter cloacae .
doi: http://dx.doi.org/10.7705/biomedica.v34i2.1550
Systematic review of antimicrobial resistance in Enterobacteriaceae isolates from Colombian hospitals
Introduction: Bacterial resistance is a public health problem worldwide that seriously compromises the possibility to treat infections.
Objective: To identify levels of resistance to antibiotic markers in Enterobacteriaceae isolates from Colombian hospitals.
Materials and methods: A systematic literature survey was done including articles indexed in Medline, Embase and LILACS. A manual search was made of Colombian scientific journals and other publications on infectious disease that were not available electronically.
Results: In total, 43 observational studies and epidemiological reports were identified with information about resistance among Enterobacteriaceae isolates in Colombian hospitals, mainly from Bogotá, Cali and Medellín. The resistance rate of Escherichia coli ranges from 3 to 11%, 5 to 20% and from 0.2 to 0.8% for piperacillin-tazobactam, third generation cephalosporins and carbapenems, respectively. For Klebsiella pneumoniae resistance rates ranges from 21.8 to 48.1% to piperacillin-tazobactam, 20 to 35% to broad-spectrum cephalosporins and 3 to 8% to carbapenems, with significant variations by cities, levels of care and clinical settings.
Conclusions: The spread of bacterial resistance in Enterobacteriaceae isolated in Colombian hospitals is a growing problem that calls for priority action to cut the chains of transmission.
Key words: Drug resistance; drug resistance, bacterial; drug resistance, microbial; drug resistance, multiple, bacterial; Enterobacteriaceae ; Enterobacteriaceae infections; Klebsiella infections; Escherichia coli infections; Enterobacter cloacae .
doi: http://dx.doi.org/10.7705/biomedica.v34i2.1550
Las bacterias Gram negativas de la familia Entero bacteriaceae, como Escherichia coli , Klebsiella spp. y Enterobacter spp., son una causa importante de infecciones hospitalarias del aparato urinario, de bacteriemia, de neumonía hospitalaria y de meningitis posoperatoria (1-3). Este grupo de microorganismos ha generado un interés especial por el aumento de cepas productoras, unas de betalactamasas de espectro extendido (BLEE) y otras de carbapenemasas (4). En los últimos cinco años ha aumentado en todo el mundo la frecuencia de aislamientos de enterobacterias productoras de BLEE con tasas tan altas que llegan hasta 55 y 79 % en China e India, respectivamente (5). En América Latina la resistencia de las enterobacterias viene en aumento desde 1990 por la difusión de las BLEE, algunas de las cuales se originaron en el continente y pueden ser responsables de tasas de resistencia hasta de 40 % en los aislamientos de Klebsiella pneumoniae (6). También constituye un problema en aumento la resistencia de las enterobacterias a los carbapenémicos en casos reportados cada vez con mayor frecuencia en Colombia, Argentina y otros países latinoamericanos (6).
Esta resistencia a los antibióticos se ha asociado con el retraso en el inicio del tratamiento antibiótico apropiado, con la prolongación de la estancia en los hospitales y con el aumento en los costos hospitalarios. Además, el inicio tardío del tratamiento antibiótico adecuado parece ser el responsable directo del aumento en las tasas de mortalidad en pacientes con infecciones por microorganismos resistentes (5). Debido a las altas tasas de resistencia en las enterobacterias, es necesario conocer la epidemiología local con el fin de hacer una mejor selección de los antibióticos para el control de las infecciones y prevenir así la expresión y diseminación de las diferentes formas de resistencia bacteriana (7).
En el presente estudio se reportan los hallazgos de una revisión bibliográfica sistemática, incluida la literatura gris identificada, sobre los perfiles de resistencia de las enterobacterias a los antimicrobianos marcadores y se describe la frecuencia de BLEE y su caracterización molecular en enterobacterias aisladas en hospitales colombianos.
Materiales y métodos
Búsqueda de la información
Se hizo una revisión bibliográfica sistemática sobre resistencia bacteriana de las enterobacterias en hospitales colombianos, entre enero de 1980 y el 30 de julio de 2012. En ella se incluyeron las bases de datos Medline, Embase y Lilacs, además de la búsqueda manual en los registros de publicación de todas las revistas biomédicas colombianas y de literatura gris, tales como trabajos presentados en congresos afines al tema; se siguieron los lineamientos de la colaboración Cochrane (8) y de las guías PRISMA (9) para las revisiones sistemáticas.
Se diseñaron búsquedas concatenadas acordes con cada una de las bases de datos. En el caso de PubMed y Embase se utilizó una estructura de búsqueda usando términos MeSH ["Drug resistance", "Drug resistance, bacterial", "Drug resistance, microbial", "Beta-lactam resistance", "Drug resistance, multiple, bacterial"]; en el caso de Lilacs se utilizaron los términos DeCS ["resistencia a medicamentos", "farmacorresistencia bacteriana", "farmacorresistencia microbiana", "resistencia betalactámica", "farmacorresistencia bacteriana múltiple"]; AND [" Enterobacteriaceae ", " Klebsiella ", " Klebsiella pneumoniae ", " Klebsiella oxytoca ", " Escherichia coli ", "Enteropathogenic Escherichia coli ", "Enterotoxigenic Escherichia coli ", " Escherichia coli K12", "Shiga-Toxigenic Escherichia coli ", "Enterohemorrhagic Escherichia coli ", " Escherichia coli O157", "Uropathogenic Escherichia coli ", " Proteus ", " Proteus mirabilis ", " Proteus vulgaris "] AND [ "Colombia" , "Cali", "Medellín", "Bucaramanga", "Barranquilla", "Cartagena", "Montería"].
En la búsqueda manual en cada una de las revistas biomédicas colombianas, se identificaron los artículos por medio de la información contenida en el título o resumen. En el caso de trabajos presentados en congresos, se revisaron las memorias de cada versión del Congreso Colombiano de Enfermedades Infecciosas, del Congreso de la Asociación Colombiana de Medicina Interna, ACMI, y del Encuentro Nacional de Investigaciones en Enfermedades Infecciosas. La búsqueda se hizo por fecha de publicación entre enero de 1980 y el 30 de julio de 2012. No se consideraron restricciones de idioma.
Los resultados identificados que se evaluaron en el presente estudio fueron los siguientes: 1) porcentaje de resistencia de enterobacterias a piperacilina-tazobactam, cefalosporinas de tercera y cuarta generación y carbapenémicos ; 2 ) frecuencia de BLEE; 3) perfil de resistencia por circunstancias clínicas, unidad de cuidados intensivos, hospitalización no relacionada con la unidad de cuidados intensivos (otras áreas diferentes) y unidades de cuidados intensivos neonatales, y 4) caracterización molecular de las enzimas implicadas en la resistencia bacteriana.
Evaluación de los estudios incluidos
Los criterios de inclusión contemplaban los estudios observacionales analíticos (cohortes, casos y controles, de corte transversal) y descriptivos (estudios ecológicos, series de casos, reportes de vigilancia epidemiológica) que reportaran uno o más de los cinco marcadores epidemiológicos de relevancia clínica considerados en el presente estudio, así como información completa y adecuada sobre el tamaño de la muestra, el porcentaje de resistencia de cada enterobacteria en estudio por cada año específico, el origen de las muestras biológicas según si fuera ambulatorio u hospitalario; en cuanto a los estudios que reportaban muestras de ambos orígenes, se incluyeron aquellos que reportaron los resultados por separado según cada uno; para describir el perfil global de resistencia, se incluyeron los estudios multicéntricos y los reportes de vigilancia epidemiológica, y para describir diferencias locales en los perfiles de resistencia, se incluyeron los estudios realizados en una sola institución.
Para describir la frecuencia de las cepas produc toras de BLEE, se incluyeron los estudios que reportaron de forma clara y detallada la selección del fenotipo BLEE por medio de la prueba de tamización estandarizada de sensibilidad a una o más de las cefalosporinas de tercera generación, y la confirmación microbiológica de las BLEE mediante la adición de ácido clavulánico. Se excluyeron los estudios sobre aislamientos por conveniencia (pruebas de antibióticos para mercadeo), aislamientos de muestras no clínicas (cultivos de fuentes inanimadas), aislamientos exclusivos de muestras ambulatorias, así como los reportes de resistencia durante períodos diferentes al anual, los de resistencia por grupo general de enterobacterias, los de casos únicos, y aquellos considerados de mala calidad o incongruentes (por carecer de la información antes mencionada).
Análisis de la información
Terminada la recolección de los estudios, dos evaluadores independientes estudiaron los artículos, en forma ciega e independiente, en su formato de texto completo y se aseguraron de que cumplieran con los criterios de inclusión y exclusión para el análisis final.
Para la extracción de la información se dispuso de un formato con énfasis en el tipo de estudio, la metodología, los resultados y el resultado de interés, así como la evaluación global del estudio. Se describieron los hallazgos y se consolidó la información de los artículos que resultaron relevantes y contenían la información requerida.
Se determinó el porcentaje de resistencia para cada uno de los antibióticos marcadores, categorizándolos en el tiempo como previos al año 2000 y, luego, año tras año desde el 2001 hasta el 2012. Los resultados sobre el perfil de resistencia bacteriana se reportaron como la media de los porcentajes de resistencia hallados en cada uno de los estudios multicéntricos y los reportes de vigilancia epidemiológica. Se determinó la distribución de perfiles de resistencia por áreas clínicas relevantes, como unidades de cuidados intensivos, unidades de cuidados neonatales y demás áreas hospitalarias (diferentes a la unidad de cuidados intensivos). Se describió la frecuencia de las BLEE según la confirmación de su fenotipo por medio de las técnicas vigentes para la fecha de publicación. Se describió la información disponible sobre la caracterización molecular de las betalactamasas circulantes en el país, según la frecuencia de detección, el contexto del brote y la circulación en general.
Resultados
Se incluyeron 25 estudios observacionales y 18 estudios de vigilancia epidemiológica sobre el perfil de resistencia de las enterobacterias (figura 1). Entre los estudios observacionales identificados, nueve estudios multicéntricos y dos realizados en una sola institución hospitalaria reportaban datos sobre el porcentaje de resistencia media a los antibióticos marcadores en adultos hospitalizados en unidades de cuidados intensivos y en otras áreas; cuatro estudios llevados a cabo en una sola institución y seis boletines de vigilancia epidemiológica reportaron información sobre el perfil de resistencia en las unidades de cuidados intensivos neonatales; ocho estudios relativos a una sola institución reportaron información sobre la caracterización molecular de las enzimas responsables de la resistencia en las entero-bacterias; un estudio multicéntrico, dos estudios llevados a cabo en una sola institución y un boletín epidemiológico informaron sobre la frecuencia de las cepas productoras de BLEE.
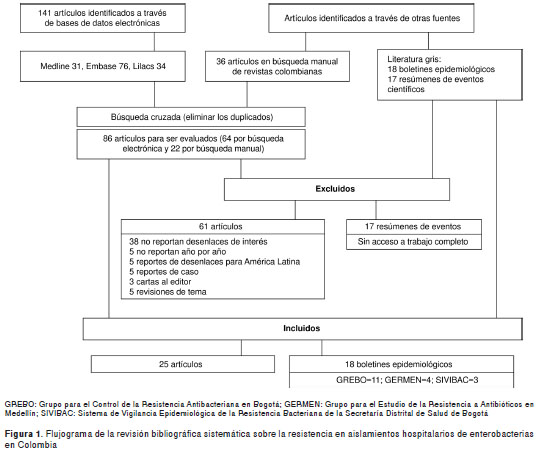
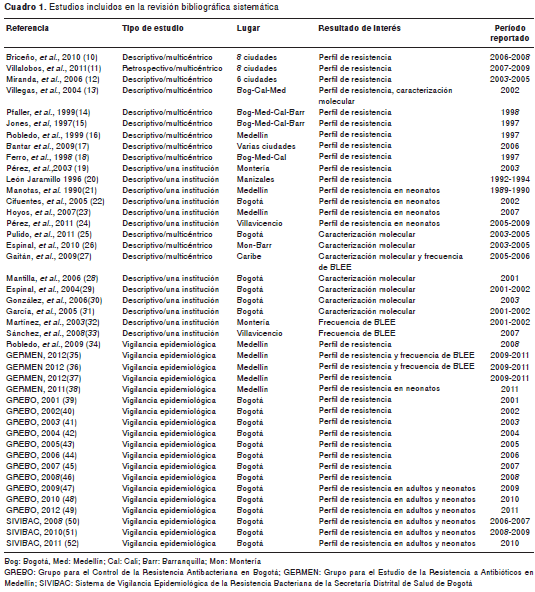
De los reportes de vigilancia epidemiológica, tres eran del Sistema de Vigilancia Epidemiológica de Resistencia Bacteriana de la Secretaría Distrital de Salud de Bogotá (SIVIBAC), cinco eran del Grupo para el Estudio de la Resistencia a Antibióticos en Medellín (GERMEN), y 10 eran del Grupo para el Control de la Resistencia Antibacteriana en Bogotá (GREBO) (cuadro 1) (10-52). No se encontraron reportes de estudios multicéntricos previos a 1990 y sólo a partir del año 2001 se tienen reportes consecutivos.
Perfil de resistencia de enterobacterias en unidades de cuidados intensivos de adultos y en otras áreas hospitalarias
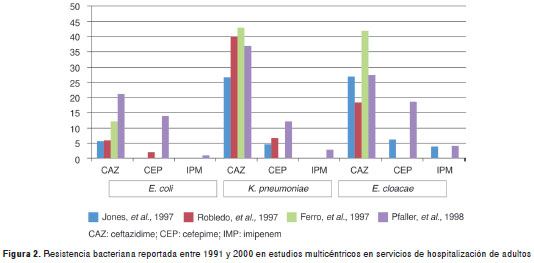
Resistencia antes del 2000. En la década de 1991 al 2000 se encontraron cuatro estudios multicéntricos que reportaron resistencia en enterobacterias. La figura 2 muestra las tasas de resistencia de los estudios de Jones, et al., (15) en cuatro ciudades colombianas, el estudio de Robledo, et al., (16) en tres hospitales de Medellín, el estudio de Ferro, et al., (18) en Medellín, y el estudio de Pfaller, et al., (14), todos ellos realizados antes del 2000. Se encontró un estudio llevado a cabo en un solo centro, el Hospital de Caldas en Manizales (20), que reportó resistencia de E. coli a imipenem inferior a 1 % en la unidad de cuidados intensivos para el período de 1992 a 1994, mientras que las tasas de resistencia a ceftriaxona y ceftazidime fueron de 40 %; este estudio no diferenció entre colonización e infección y mostró tasas elevadas de resistencia de E. cloacae a imipenem (inferiores a 10 %) y tasas de resistencia a cefalosporinas de tercera generación superiores a 40 %.
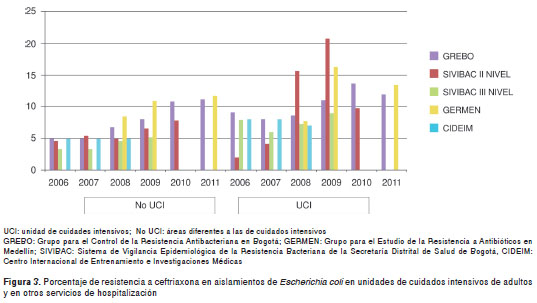
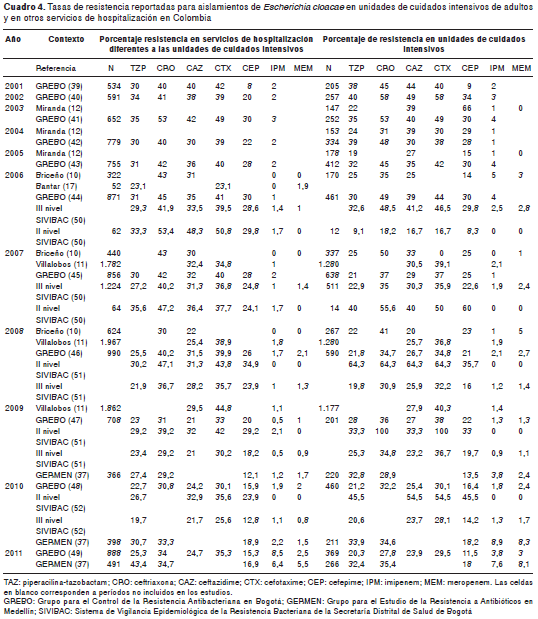
Resistencia a cefalosporinas de tercera generación. Del 2001 al 2011 la tasa de resistencia a piperacilina-tazobactam, ceftriaxona, ceftazidime, cefotaxime, cefepime, imipenem y meropenem en las unidades de cuidados intensivos de adultos y en otras áreas de hospitalización reportada en los e studios multicéntricos (10-13,17) y en los estudios de vigilancia epidemiológica (34-37,39-52) para E. coli y K. pneumoniae, se presentan en los cuadro 2 y cuadro 3, respectivamente. Estos estudios mostraron una mayor resistencia a estos antibióticos en las unidades de cuidados intensivos que en otros servicios de hospitalización y, en general, una tasa de resistencia frente a cefalosporinas de tercera generación de 2 a 20 % para E. coli, y de 20 a 40 % para K. pneumoniae . En K. pneumoniae parece observarse una tendencia a la disminución después del 2008. Debido a que en algunos reportes del grupo del Centro Internacional de Entrenamiento e Investigaciones Médicas (CIDEIM) (12,13) aparecen instituciones que también pertenecen a GREBO, hay similitudes en las tasas de resistencia, especialmente antes del 2005. Los porcentajes de resistencia de E. coli a ceftriaxona encontrados en los servicios de las áreas hospitalarias diferentes a las unidades de cuidados intensivos mostraron un incremento a partir del 2006. También se observaron altas tasas de resistencia en las unidades de cuidados intensivos de segundo nivel, más elevadas que las halladas en las unidades de cuidados intensivos de tercer nivel de complejidad, particularmente en 2008 y 2009 (figura 3). En la figura 4 se muestran las tasas de resistencia en aislamientos de K. pneumoniae y, en el cuadro 4, las tasas de resistencia en los aislamientos de E. cloacae .


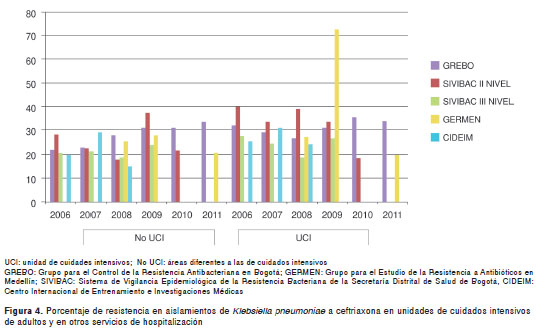
Frecuencia de aislamientos con el fenotipo BLEE. En lo referente a este resultado, se encontraron un estudio multicéntrico, un reporte de vigilancia epidemiológica y dos estudios analíticos llevados a cabo en una única institución. En el estudio multicéntrico de Gaitán, et al., (27) en el Caribe colombiano sobre el período 2005-2006, se reportaron 93 aislamientos de E. coli , de los cuales, 39 tenían fenotipo BLEE y, de estos últimos, 12 aislamientos se habían sometido a la prueba microbiológica confirmatoria con el test estandarizado de dilución de ácido clavulánico, correspondiendo a una frecuencia de 12,9 %; para K. pneumoniae se reportaron 51 aislamientos estudiados, 31 de ellos con fenotipo BLEE y, de estos, 16 se sometieron a test microbiológico confirmatorio, resultando en una frecuencia de 31,4 %. En el estudio de Martínez, et al ., (32) llevado a cabo en una sola institución de Montería entre 2001 y 2002, se reportaron 34 aislamientos de E. coli, siete de ellos con fenotipo BLEE, y una prueba microbiológica confirmatoria, dando como resultado una frecuencia en la institución bajo estudio de 20,5 %; para K. pneumoniae se reportaron 37 aislamientos, 17 con fenotipo de BLEE, que fueron sometidos a test microbiológico confirmatorio para una frecuencia de 46 % en esa institución. En el estudio de Sánchez, et al ., (33) realizado en una institución de Villavicencio en el 2007, se reportaron 29 aislamientos de E. coli con fenotipo BLEE, uno de los cuales se sometió a test confirmatorio, lo que resultó en una frecuencia de BLEE de 3,5 %, en tanto que, de los 21 aislamientos de K. pneumoniae reportados, dos tenían fenotipo BLEE y fueron sometidos a test microbiológico confirmatorio, lo cual resultó en una frecuencia de 9,5 % en la institución bajo estudio. Los estudios de vigilancia epidemiológica del grupo GERMEN de Medellín (35) reportaron tasas de resistencia de E. coli debida a BLEE superiores a 10 % en las unidades de cuidados intensivos entre el 2009 y el 2011. La frecuencia de BLEE fue levemente inferior en las áreas diferentes a las unidades de cuidados intensivos en esos mismos años. En cuanto a K. pneumoniae , en las unidades de cuidados intensivos, se encontraron frecuencias de BLEE decrecientes: 19,3 % en 2009, 14,6 % en 2010 y 14,7 % en 2011. En las áreas hospitalarias diferentes a las unidades de cuidados intensivos las tasas de resistencia fueron mayores: 22,3 % en 2009, 18,7 % en 2010 y 17,7 % en 2011.
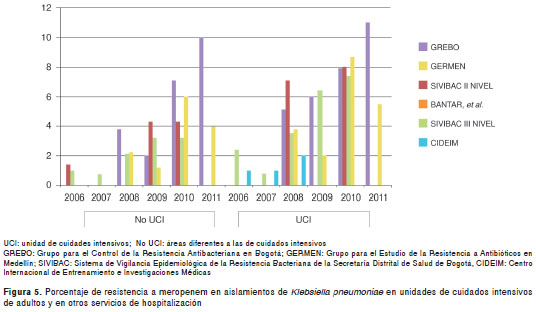
Resistencia a carbapenémicos. En lo relativo a la resistencia de K. pneumoniae a meropenem, se observó un comportamiento similar en todos los estudios, con aumento progresivo en la tasa de resistencia (figura 5). También se observó resistencia de E. cloacae a los carbapenémicos, con variaciones entre 1 y 8 %.
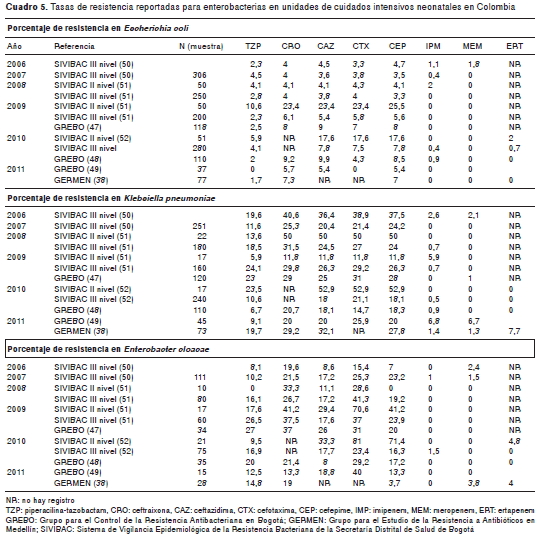
Perfil de resistencia de las enterobacterias en las unidades de cuidados intensivos neonatales. Se encontraron cuatro estudios adelantados cada uno en una única institución y cinco estudios de vigilancia epidemiológica que reportaron la resistencia de las enterobacterias en las unidades de cuidados intensivos neonatales en Colombia. Se identificaron estudios sobre un solo hospital en Medellín a finales de los años ochenta (Manotas, et al. ) (21); uno en Bogotá a principios de la década del 2000 (Cifuentes, et al .) (22); uno en Villavicencio entre 2005 y 2009 (Pérez, et al .) (24), y otro en Medellín en el 2007 (Hoyos, et al .) (23). Se encontraron estudios de vigilancia epidemiológica con datos multicéntricos y el reporte sistemático y consecutivo de la resistencia en las unidades de cuidados intensivos neonatales a partir del 2006 (cuadro 5) (38,47-52). Con respecto a E. coli , en los diferentes reportes se observó resistencia a piperacilina-tazobactam y a cefalosporinas de tercera y cuarta generación entre 2 y 8 %, siendo especialmente más altas las tasas de resistencia reportadas en unidades de segundo nivel de complejidad que las registradas en el tercer nivel de atención, en todos los años hasta el 2010.
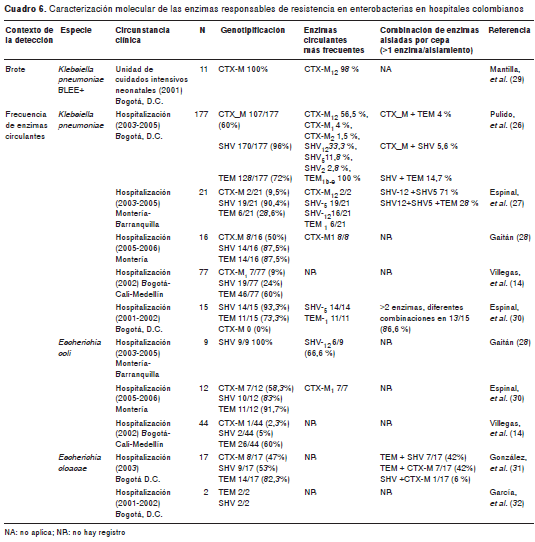
Caracterización molecular. Se encontró únicamente un estudio de caracterización molecular de las enzimas responsables de la resistencia a betalactámicos en enterobacterias en el contexto clínico del brote por K. pneumoniae productora de BLEE en las unidades de cuidados intensivos neonatales, en el cual se identificaron enzimas del tipo de CTX-M en 100 % de los casos (28). Se identificaron siete estudios que reportaron la frecuencia de las enzimas circulantes y la expresión de dos o más betalactamasas (cuadro 6). Se observó una alta tasa de circulación de diferentes enzimas.
Discusión
La resistencia bacteriana es un problema de salud pública a nivel mundial que compromete seriamente la capacidad de tratar infecciones, tanto en el ámbito hospitalario como en la comunidad. Especialmente en esta última década, se ha asistido a la emergencia y diseminación global de cepas de E. coli productoras de cefalosporinasas, principalmente de betalactamasas de tipo CTX-M y de cepas de K. pneumoniae resistentes a carbapenémicos por producción de betalactamasas de tipo KPC (53,54).
Nuestro estudio, que recopila la información dispo nible entre 1989 y 2012, deja ver que la situación de Colombia no se diferencia del panorama mundial, y que, en general, las tasas de resistencia a los antibióticos son mayores que en los países desarrollados, pero similares a las de algunos países latinoamericanos con características socio-demográficas equiparables, y menores que las de algunos países asiáticos (55).
El reporte de la resistencia se inició en Colombia a finales de los años 90 y ya entonces se dio la primera gran alarma sobre el aumento de la resistencia bacteriana en las enterobacterias. A partir del 2001 empezó a reportarse de forma sistemática y consecutiva la resistencia bacteriana en hospitales colombianos gracias a la aparición de sistemas de vigilancia implementados por diversos grupos de investigación (por ejemplo, los grupos GREBO y GERMEN), y a la adopción de dichos sistemas de vigilancia por parte de los entes gubernamentales (SIVIBAC en Bogotá). Este estudio muestra que las tasas de resistencia en el periodo analizado variaron según la ciudad y los niveles de atención, siendo más altas en las ciudades intermedias y pequeñas y en los hospitales de segundo nivel que en las instituciones de tercer nivel de complejidad. La tendencia de la resistencia bacteriana tendría un comportamiento diferente según el antibiótico marcador, permaneciendo, por lo general, estable para piperacilina-tazobactam, mientras que suscita mayor preocupación la tendencia al aumento de la resistencia a cefalosporinas de amplio espectro y a carbapenémicos, tendencia ésta más acentuada en K. pneumoniae y E. cloacae , lo que coincide con lo reportado a nivel mundial (53).
Los estudios identificados no permitieron establecer la frecuencia de las BLEE en Colombia, puesto que no hay uniformidad de criterios en este sentido, y los reportes encontrados no corresponden a los mismos períodos y no son secuenciales. Con base en los estudios identificados, en los últimos años (2009 a 2011) la frecuencia de BLEE podría situarse entre 10,1 y 11,8 % en E. coli y entre 14,6 y 32,6 % en K. pneumoniae . A nivel mundial, los datos del estudio TEST ( Tigecycline Evaluation and Surveillance Trial ) (56-59), los del proyecto Sentry (60) y los del estudio SMART ( Study for Monitoring Antimicrobial Resistance Trends ) muestran cómo en la última década las tasas más altas se observan en Asia, seguidas por las de América Latina y, por último, las de los países desarrollados(61-63). Al comparar la situación de Colombia con los datos reportados, en el caso de K. pneumoniae productora de BLEE el país estaría al nivel de América Latina, con las tasas de resistencia más altas. En el caso de E. coli productora de BLEE, Colombia se situaría a nivel de Europa con una prevalencia intermedia. En comparación con los países vecinos, los datos reportados por Bantar, et al., (17) y García, et al., (64) sugieren que en Colombia la frecuencia del fenotipo BLEE en E. coli estaría por debajo de la detectada en Venezuela, Argentina y Chile, y en K. pneumoniae , se ubicaría después de Perú (75 % de cepas con producción de BLEE) (64), Venezuela (58 % de resistencia) y Argentina, pero con mayor frecuencia de resistencia que Chile.
Se necesitan estudios que muestren la prevalencia de las diferentes betalactamasas circulantes en Colombia; sin embargo, los cuatro estudios identificados en nuestra revisión sistemática muestran una aparente tendencia al aumento en la expresión de las betalactamasas de tipo CTX-M y una circulación estable con alta expresión simultánea de enzimas de tipo SHV y TEM. En conjunto, lo observado en los estudios colombianos sugiere que el aumento en la frecuencia de variantes de CTX-M es el reflejo de una selección presionada po r el aumento en el uso de las cefalosporinas de amplio espectro en la última década, similar a lo registrado en Suramérica (65), lo que, insistimos, subraya la necesidad del uso racional de los antibióticos.
Un aspecto preocupante es el comportamiento observado en la resistencia de K. pneumoniae a carbapenémicos. Identificada inicialmente en el país en el 2006 (66), los estudios posteriores muestran que a partir del 2008 se presentó un aumento progresivo en las tasas de resistencia. Estas observaciones coinciden con la situación mundial, en la que se evidencia que los carba penémicos ven comprometida su efectividad por la diseminación de carbapenemasas de tipo KPC (53). Las alternativas terapéuticas se han visto reducidas a productos de menor eficacia, o sobre los cuales hay menor información, como la tigeciclina y la colistina, aunque en algunas cepas también se ha detectado el surgimiento de resistencia a estos antibióticos (67,68). Otro problema ya conocido es la resistencia mediada por betalactamasas de la variante AmpC con expresión cromosómica natural en Enterobacter spp., y la aparición de variantes AmpC mutantes capaces de elevados niveles de producción, lo que explicaría en parte el aumento observado en la resistencia de E. cloacae al meropenem en los últimos años. La selección de estos patrones de resistencia, principalmente en las unidades de cuidados intensivos, se debe probablemente al uso intensivo de carbapenémicos en ellas. Curcio, et al., (69) demostraron que los antibióticos más frecuentemente prescritos en las unidades de cuidados intensivos en Latinoamérica son los carbapenémicos, seguidos de la vancomicina, de la piperacilina-tazobactam y de las cefalosporinas de amplio espectro, principalmente el cefepime.
Por último, el comportamiento de la resistencia antimicrobiana reportado en unidades de cuidados intensivos neonatales en Colombia, no dista mucho del observado en adultos con resistencias altas de E. coli y K. pneumoniae a las cefalosporinas, especialmente en los hospitales de segundo nivel. La alta tasa de resistencia de K. pneumoniae a las cefalosporinas de tercera generación es preocupante si se tiene en cuenta que el arsenal antibiótico disponible para este grupo etario es menor. En neonatos, las bacteriemias son una de las principales causas de sepsis neonatal, ya que ocurren con una frecuencia de 1,7 a 33 casos por cada 1.000 recién nacidos, siendo K. pneumoniae el agente etiológico de cerca de 50 % de las bacteriemias tempranas y el agente causal de 16 a 28 % de todas las sepsis neonatales confirmadas por cultivo en América Latina (70-72). No se conoce claramente el impacto en la mortalidad de las infecciones por este microrganismo, pero se estima que puede llegar a ser de 40 %.
Los hallazgos reportados sugieren que la diseminación de la resistencia bacteriana en nuestro país es un problema muy serio que exige el cumplimiento de las medidas de control de infecciones para (73-76) disminuir la transmisión por parte del personal de salud mediante la limpieza de los equipos médicos, el lavado de manos, la cantidad de personal idóneo (relación adecuada entre número de enfermeras y número de pacientes), así como la identificación de las áreas de alto riesgo de transmisión de resistencia: unidades de cuidados intensivos de adultos, unidades de cuidados intensivos neonatales y área de hemato-oncología; igualmente, debe identificarse a los pacientes de alto riesgo para instaurar los aislamientos pertinentes, limitar el uso de dispositivos invasivos y hacer uso racional y prudente de los antibióticos de acuerdo con las guías basadas en la epidemiología local determinada por los infectólogos en cada hospital. En este proceso, el laboratorio de microbiología juega un papel fundamental para identificar la resistencia (en ocasiones, incluso a nivel molecular) y brindar información oportuna para limitar el uso de moléculas de amplio espectro o mayor capacidad de selección de la resistencia.
Las limitaciones de este estudio incluyen las siguientes: los hallazgos eran descriptivos, muchos eran reportes de vigilancia epidemiológica, con pocos estudios clínicos que analizaran el problema; no siempre se utilizaron los mismos antibióticos ni se hicieron las mismas pruebas de sensibilidad al total de los aislamientos de una especie bacteriana dada, y, además, aunque se usaron los puntos de corte estandarizados del Clinical and Laboratory Standards Institute para establecer la resistencia, el reporte de GREBO para el 2011 denota cómo el cambio en los puntos de corte modificó la tasa de resistencia reportada (49). La detección de las BLEE se basa en el estudio de aislamientos de cepas con fenotipo compatible por la resistencia a alguna de las oximinocefalosporinas, pero si no se prueba la sensibilidad a ceftriaxona, ceftazidime y cefotaxime en cada cepa, podrían escaparse las BLEE con sustrato preferente con respecto a alguna de ellas.
La falta de un arsenal suficiente de nuevos anti-bióticos, particularmente contra bacterias Gram negativas (77), subraya la importancia de usar todas las estrategias disponibles para limitar la selección de resistencia por presión e interrumpir las cadenas de transmisión, implementar estrategias para el diagnóstico temprano y el diagnóstico molecular, y aumentar el reporte sistemático y oportuno a los grupos de vigilancia epidemiológica.
A Óscar Pérez, Carmelo Espinosa y Juan Sebastián Castillo, por su apoyo en la búsqueda bibliográfica inicial, y a Anita Montañez, por su apoyo administrativo.
Los autores declaran no tener conflictos de intereses.
Este proyecto fue financiado por la División de Investigación de la Sede Bogotá de la Universidad Nacional de Colombia a través de la convocatoria "Apoyo de la DIB a tesis de investigación en posgrados" del año 2012, código Hermes 15015.
Correspondencia: Jorge Alberto Cortés, Departamento de Medicina Interna, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, D.C., Colombia Teléfono: (571) 316 5000, extensión 15011 jacortesl@unal.edu.co
1. Paterson DL. Resistance in Gram-negative bacteria: Enterobacteriaceae . Am J Med. 2006;119:S20-8. http://dx.doi.org/10.1016/j.amjmed.2006.03.013 [ Links ]
2. Talbot GH, Bradley J, Edwards JE Jr., Gilbert D, Scheld M, Bartlett JG. Bad bugs need drugs: An update on the development pipeline from the Antimicrobial Availability Task Force of the Infectious Diseases Society of America. Clin Infect Dis. 2006;42:657-68. http://dx.doi.org/10.1086/499819 [ Links ]
3. Instituto Nacional de Salud. Estado del arte de la resistencia bacteriana y la vigilancia epidemiológica de las infeccones asociadas al cuidado de la salud en Colombia. Fecha de consulta: 1 de agosto de 2012. Disponib le en: http://www.ins.gov.co/temas-de-interes/IAAS/Forms/AllItems.aspx. [ Links ]
4. Kanj SS, Kanafani ZA. Current concepts in antimicrobial therapy against resistant Gram-negative organisms: Extended-spectrum beta-lactamase-producing Entero-bacteriaceae , carbapenem-resistant Enterobacteriaceae , and multidrug-resistant Pseudomonas aeruginosa . Mayo Clin Proc. 2011;86:250-9. http://dx.doi.org/10.4065/mcp.2010.0674 [ Links ]
5. Pitout JD. Infections with extended-spectrum beta- lactamase-producing enterobacteriaceae : Changing epidemiology and drug treatment choices. Drugs. 2010;70:313-33. http://dx.doi.org/10.2165/11533040-000000000-00000 [ Links ]
6. Casellas JM. Antibacterial drug resistance in Latin America: Consequences for infectious disease control. Rev Panam Salud Pública. 2011;30:519-28. http://dx.doi.org/10.1590/S1020-49892011001200004 [ Links ]
7. Lye DC, Kwa AL, Chlebicki P. World health day 2011: Antimicrobial resistance and practical solutions. Ann Acad Med Singapore. 2011;40:156-7. [ Links ]
8. Higgins J, Green S. Cochrane Handbook for Systematic Reviews of Interventions. Version 5.1.0. Fecha de consulta: 1 de junio de 2012. Disponible en: http://handbook.cochrane.org/ [ Links ]
9. Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gotzsche PC, Ioannidis JP, et al . The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: Explanation and elaboration. J Clin Epidemiol. 2009;62:e1-34. http://dx.doi.org/10.1016/j.jclinepi.2009.06.006 [ Links ]
10. Briceño DF, Correa A, Valencia C, Torres JA, Pacheco R, Montealegre MC, et al . Actualización de la resistencia a antimicrobianos de bacilos Gram negativos aislados en hospitales de nivel III de Colombia: años 2006, 2007 y 2008. Biomédica. 2010;30:371-81. [ Links ]
11. Villalobos AP, Díaz MH, Barrero LI, Rivera SM, Henríquez DE, Villegas MV, et al . Tendencias de los fenotipos de resistencia bacteriana en hospitales públicos y privados de alta complejidad de Colombia. Rev Panam Salud Pública 2011;30:627-33. http://dx.doi.org/10.1590/S1020-49892011001200022 [ Links ]
12. Miranda MC, Pérez F, Zuluaga T, Olivera M del R, Correa A, Reyes SL, et al . Resistencia antimicrobiana en bacterias Gram negativas aisladas de unidades de cuidado intensivo de hospitales colombianos, Whonet 2003, 2004 y 2005. Biomédica. 2006;26:424-33. [ Links ]
13. Villegas MV, Correa A, Pérez F, Miranda MC, Zuluaga T, Quinn JP. Prevalence and characterization of extended- spectrum beta-lactamases in Klebsiella pneumoniae and Escherichia coli isolates from Colombian hospitals. Diagn Microbiol Infect Dis. 2004;49:217-22. http://dx.doi.org/10.1016/j.diagmicrobio.2004.03.001 [ Links ]
14. Pfaller MA, Jones RN, Doern GV, Salazar JC. Multicenter evaluation of antimicrobial resistance to six broad-spectrum beta-lactams in Colombia: Comparison of data from 1997 and 1998 using the Etest method. The Colombian Antimicrobial Resistance Study Group. Diagn Microbiol Infect Dis. 1999;35:235-41. http://dx.doi.org/10.1016/S0732-8893(99)00077-2 [ Links ]
15. Jones RN, Salazar JC, Pfaller MA, Doern GV. Multicenter evaluation of antimicrobial resistance to six broad-spectrum beta-lactams in Colombia using the Etest method. The Colombian Antimicrobial Resistance Study Group. Diagn Microbiol Infect Dis. 1997;29:265-72. http://dx.doi.org/10.1016/S0732-8893(97)00157-0 [ Links ]
16. Robledo JA, López J, Sierra P, Robledo C, Pfaller MA, Jones RN. El programa de vigilancia antimicrobiana SENTRY en Colombia: hallazgos iniciales en tres hospitales de Medellín. Infectio. 1999;3:100-7. [ Links ]
17. Bantar C, Curcio D, Canigia FL, García P, Blanco GM, Leal AL. Comparative in vitro activity of tigecycline against bacteria recovered from clinical specimens in Latin America. J Chem 2009;21:144-52. [ Links ]
18. Ferro S, Cure N, Sussmann O, Vélez JD, Robledo C, Robledo J, et al. Sensibilidad in vitro de cepas obtenidas de pacientes hospitalizados a meropenem y otros antibióticos. Infectio. 1998;2:31-5. [ Links ]
19. Pérez D, Mattar S, Mercado M. Alta resistencia de los microorganismos nosocomiales en el Hospital San Jerónimo de Montería. Univ Médica. 2003;44:131-7. [ Links ]
20. León E. Resistencia bacteriana a los antibióticos en la unidad de cuidados intensivos, Hospital de Caldas, 1992-1994. Colombia Médica. 1996;27:69-76. [ Links ]
21. Manotas R, Uribe A. Sensibilidad a los antibióticos de bacterias aisladas de neonatos hospitalizados. Iatreia. 1990;3:74-9. [ Links ]
22. Cifuentes Y, Ruiz A, Leal A, Muñoz L, Herrera M, Jiménez L. Perfil microbiológico de aislamientos en unidades neonatales en un hospital de tercer nivel de Bogotá, Colombia. Rev Salud Pública. 2005;7:191-200. http://dx.doi.org/10.1590/S0124-00642005000200007 [ Links ]
23. Hoyos A, Rivera O, Hoyos C, Mesa C, Alfaro J. Características clínicas, epidemiológicas y de susceptibilidad a los antibióticos en casos de bacteriemia por Klebsiella pneumoniae en neonatos. Rev CES Medicina. 2007;21:31-9. [ Links ]
24. Pérez N, Pavas N, Rodríguez I. Resistencia a los antibióticos en Escherichia coli con beta-lactamasas de espectro extendido en un hospital de la Orinoquia colombiana. Infectio. 2011;15:147-54. [ Links ]
25. Pulido IY, Mantilla JR, Valenzuela EM, Reguero MT, González EB. Distribution of extended spectrum beta- lactamases-codifying genes in Klebsiella pneumoniae isolates from hospitals of Bogota, D.C., Colombia. Biomédica. 2011;31:15-20. [ Links ]
26. Espinal P, Garza-Ramos U, Reyna F, Rojas-Moreno T, Sánchez-Pérez A, Carrillo B, et al . Identification of SHV- type and CTX-M-12 extended-spectrum beta-lactamases (ESBLs) in multiresistant Enterobacteriaceae from Colombian Caribean hospitals. J Chemother. 2010;22:160-4. [ Links ]
27. Gaitán CS, Espinal MP. Molecular characterization of extended-spectrum ss-lactamases-producing Escherichia coli and Klebsiella pneumoniae in hospitals of the Caribean Region, Colombia. Rev Chil Infectol. 2009;26:239-46. http://dx.doi.org/10.4067/S0716-10182009000400006 [ Links ]
28. Mantilla JR, Reguero MT, González EB, García IA, Leal AL, Espinal PA, et al . Caracterización molecular de un brote causado por Klebsiella pneumoniae productora de CTX-M12 en la unidad de cuidado intensivo neonatal de un hospital colombiano. Biomédica. 2006;26:408-14. [ Links ]
29. Espinal PA, Mantilla JR, Saavedra CH, Leal AL, Alpuche C, Valenzuela EM. Molecular epidemiology of nosocomial infection by extended-spectrum beta-lactamases-producing Klebsiella pneumoniae . Biomédica. 2004;24:252-61. [ Links ]
30. González-Mejía EB, Valenzuela EM, Mantilla-Anaya JR, Leal-Castro AL, Saavedra-Trujillo CH, Eslava-Schmalbach J, et al. Resistance to cefepime in Enterobacter cloacae isolates from hospitals in Bogota, Colombia. Rev Salud Pública. 2006;8:191-9. http://dx.doi.org/10.1590/S0124-00642006000200007 [ Links ]
31. García IA, Valenzuela E, Saavedra C, Leal A, Eslava J, Mantilla JR. Caracterización molecular de aislamientos de Enterobacter cloacae multirresistentes, productores de B- lactamasas provenientes de pacientes de un hospital de tercer nivel de Bogotá. Rev Fac Medicina Universidad Nacional de Colombia. 2005;53:148-59. [ Links ]
32. Martínez P, Mercado M, Máttar S. Determinación de beta - lactamasas de espectro extendido en gérmenes nosocomiales del Hospital San Jerónimo, Monteri´a. Colombia Médica. 2003;34:196-205. [ Links ]
33. Sánchez L, Ríos R, Máttar S. Detección de beta-lactamasas de espectro extendido en Escherichia coli y Klebsiella pneumoniae aislados en una cli´nica de Villavicencio, Colombia. Infectio. 2008;12:193-200. [ Links ]
34. Robledo C, Maldonado N, López J, Sierra P, Correa L, Robledo J. Resistencia a antibióticos en el Valle de Aburra´: resultados del programa de vigilancia en el 2008. Rev Salud Pública de Medellín. 2009;4:33-48. [ Links ]
35. Grupo para el Estudio de la Resistencia a Antibióticos de Medellín - GERMEN. Boletín epidemiológico de perfiles de sensibilidad a antibióticos de Klebsiella pneumoniae 2009-2010-2011. Fecha de consulta: 1 de octubre de 2012. Disponible en: http://www.grupogermen.org/pdf/klebsiella.pdf. [ Links ]
36. Grupo para el Estudio de la Resistencia a Antibióticos de Medellín - GERMEN. Boletín epidemiológico de perfiles de sensibilidad a antibióticos de Escherichia coli 2009-2010-2011. Fecha de consulta: 1 de octubre de 2012. Disponible en: http://www.grupogermen.org/pdf/escherichia.pdf. [ Links ]
37. Grupo para el Estudio de la Resistencia a Antibióticos de Medellín - GERMEN. Boletín epidemiológico de perfiles de sensibilidad a antibióticos de Enterobacter cloacae 2009-2010-2011. Fecha de consulta: 1 de octubre de 2012. Disponible en: http://www.grupogermen.org/pdf/enterobacter.pdf. [ Links ]
38. Grupo para el Estudio de la Resistencia a Antibióticos de Medellín - GERMEN. Boletín epidemiológico de los aislamientos obtenidos en las unidades de cuidados neonatales de 11 instituciones hospitalarias de alto nivel de complejidad del Valle de Aburrá durante el año 2011. Fecha de consulta: 1 de octubre de 2012. Disponible en: http://www.grupogermen.org/pdf/frecuencia.pdf. [ Links ]
39. Grupo para el Control de la Resistencia Antibacteriana en Bogotá - GREBO. Información de resistencia bacteriana GREBO año 2001. Fecha de consulta: 1 de septiembre de 2012. Disponible en: http://www.grebo.org/Boletin2001.pdf. [ Links ]
40. Grupo para el Control de la Resistencia Antibacteriana en Bogotá - GREBO. Información de resistencia bacteriana GREBO año 2002. Fecha de consulta: 1 de agosto de 2012. Disponible en: http://www.grebo.org/Boletin2002.pdf. [ Links ]
41. Grupo para el Control de la Resistencia Antibacteriana en Bogotá - GREBO. Información de resistencia bacteriana GREBO año 2003. Fecha de consulta: 1 de agosto de 2012. Disponible en: http://www.grebo.org/Boletin2003.pdf. [ Links ]
42. Grupo para el Control de la Resistencia Antibacteriana en Bogotá - GREBO. Información de resistencia bacteriana GREBO año 2004. Fecha de consulta: 1 de agosto de 2012. Disponible en: http://www.grebo.org/Boletin2004.pdf. [ Links ]
43. Grupo para el Control de la Resistencia Antibacteriana en Bogotá - GREBO. Información de resistencia bacteriana GREBO año 2005. Fecha de consulta: 1 de agosto de 2012. Disponible en: http://www.grebo.org/Boletin2005.pdf. [ Links ]
44. Grupo para el Control de la Resistencia Antibacteriana en Bogotá - GREBO. Información de resistencia bacteriana GREBO año 2006. Fecha de consulta: 1 de agosto de 2012. Disponible en: http://www.grebo.org/Boletin2006.pdf. [ Links ]
45. Grupo para el Control de la Resistencia Antibacteriana en Bogotá - GREBO. Información de resistencia bacteriana GREBO año 2007. Fecha de consulta: 1 de agosto de 2012. Disponible en: http://www.grebo.org/Boletin2007.pdf. [ Links ]
46. Grupo para el Control de la Resistencia Antibacteriana en Bogotá - GREBO. Información de resistencia bacteriana GREBO año 2008. Fecha de consulta: 1 de agosto de 2012. Disponible en: http://www.grebo.org/Boletin_2008.pdf. [ Links ]
47. Grupo para el Control de la Resistencia Antibacteriana en Bogotá - GREBO. Información de resistencia bacteriana GREBO año 2009. Fecha de consulta: 1 de agosto de 2012. Disponible en: http://www.grebo.org/BOLETiN2009_web.pdf. [ Links ]
48. Grupo para el Control de la Resistencia Antibacteriana enBogotá - GREBO. Resistencia a los antimicrobianos: si no actuamos hoy, no habrá cura mañana. Fecha de consulta: 1 de agosto de 2012. Disponible en: http://www.grebo.org/Boletines/BoletinGREBOFinaljulio2011.pdf. [ Links ]
49. Grupo para el Control de la Resistencia Antibacteriana en Bogotá - GREBO. Análisis de la vigilancia de la resistencia bacteriana año 2011, componente pediátrico y adulto. Fecha de consulta: 1 de octubre de 2012. Disponible en: http://www.grebo.org/boletin2012.html.
50. Sistema de Vigilancia Epidemiológica de Resistencia Bacteriana - SIVIBAC. Boletín del sistema de vigilancia epidemiológica de resistencia bacteriana- SIVIBAC 2006-2007. Fecha de consulta: 1 de octubre de 2012. Disponible en: http://www.saludcapital.gov.co/StyleLibrary/default.aspx. [ Links ]
51. Sistema de Vigilancia Epidemiológica de Resistencia Bacteriana - SIVIBAC. Análisis de la resistencia bacteriana distrital SIVIBAC - años 2008 - 20 09. Fecha de consulta: 1 de octubre de 2012. Disponible en: http://www.saludcapital.gov.co/StyleLibrary/default.aspx. [ Links ]
52. Sistema de Vigilancia Epidemiológica de Resistencia Bacteriana - SIVIBAC. Análsis de la resistencia bacteriana -SIVIBAC 2010. Fecha de consulta: 1 de octubre de 2012. Disponible en : http://www.saludcapital.gov.co/Style Library/default.aspx. [ Links ]
53. Rice LB. The clinical consequences of antimicrobial resistance. Curr Opin Microbiol. 2009;12:476-81. http://dx.doi.org/10.1016/j.mib.2009.08.001 [ Links ]
54. Bonnet R. Growing group of extended-spectrum beta-lactamases: The CTX-M enzymes. Antimicrob Agents Chemother. 2004;48:1-14. http://dx.doi.org/10.1128/AAC.48.1.1-14.2004 [ Links ]
55. Hawser SP, Bouchillon SK, Hoban DJ, Badal RE, Hsueh PR, Paterson DL. Emergence of high levels of extended-spectrum-beta-lactamase-producing Gram-negative bacilli in the Asia-Pacific region: Data from the Study for Monitoring Antimicrobial Resistance Trends (SMART) program, 2007. Antimicrob Agents Chemother. 2009;53:3280-4. http://dx.doi.org/10.1128/AAC.00426-09. [ Links ]
56. Dhillon RH, Clark J. ESBLs: A clear and present danger? Crit Care Res Pract. 2012;2012:625170. http://dx.doi.org/10.1155/2012/625170 [ Links ]
57. Reinert RR, Low DE, Rossi F, Zhang X, Wattal C, Dowzicky MJ. Antimicrobial susceptibility among organisms from the Asia/Pacific Rim, Europe and Latin and North America collected as part of TEST and the in vitro activity of tigecycline. J Antimicrob Chemother .2007;60:1018-29. http://dx.doi.org/10.1093/jac/dkm310 [ Links ]
58. Rossi F, García P, Ronzón B, Curcio D, Dowzicky MJ. Rates of antimicrobial resistance in Latin America (2004-2007) and in vitro activity of the glycylcycline tigecycline and of other antibiotics. Braz J Infect Dis. 2008;12:405-15. http://dx.doi.org/10.1590/S1413-86702008000500012 [ Links ]
59. Fernández-Canigia L, Dowzicky MJ. Susceptibility of important Gram-negative pathogens to tigecycline and other antibiotics in Latin America between 2004 and 2010. Ann Clin Microbiol Antimicrob. 2012;11:29. http://dx.doi.org/10.1186/1476-0711-11-29 [ Links ]
60. Castanheira M, Farrell SE, Deshpande LM, Mendes RE, Jones RN. Prevalence of beta-lactamase-encoding genes among Enterobacteriaceae bacteremia isolates collected in 26 U.S. hospitals: Report from the SENTRY Antimicrobial Surveillance Program (2010). Antimicrob Agents Chemother. 2013;57:3012-20. http://dx.doi.org/10.1128/AAC.02252-12 [ Links ]
61. Huang CC, Chen YS, Toh HS, Lee YL, Liu YM, Ho CM, et al . Impact of revised CLSI breakpoints for susceptibility to third-generation cephalosporins and carbapenems among Enterobacteriaceae isolates in the Asia-Pacific region: Results from the Study for Monitoring Antimicrobial Resistance Trends (SMART), 2002-2010. Int J Antimicrob Agents. 2012;40(Suppl.):S4-10. http://dx.doi.org/10.1016/S0924-8579(12)70003-1 [ Links ]
62. Hsueh PR. Study for Monitoring Antimicrobial Resistance Trends (SMART) in the Asia-Pacific region, 2002-2010. Int J Antimicrob Agents. 2012;40(Suppl):S1-3. http://dx.doi.org/10.1016/S0924-8579(12)00244-0 [ Links ]
63. Villegas MV, Blanco MG, Sifuentes-Osornio J, Rossi F. Increasing prevalence of extended-spectrum-betalactamase among Gram-negative bacilli in Latin America - 2008 update from the Study for Monitoring Antimicrobial Resistance Trends (SMART). Braz J Infect Dis. 2011;15:34-9. http://dx.doi.org/10.1590/S1413-86702011000100007 [ Links ]
64. García C, Horna G, Linares E, Ramírez R, Tapia E, Velásquez J, et al . Antimicrobial drug resistance in Peru. Emerg Infect Dis. 2012;18:520-1. http://dx.doi.org/10.3201/eid1803.100878 [ Links ]
65. Villegas MV, Kattan JN, Quinteros MG, Casellas JM. Prevalence of extended-spectrum (beta)-lactamases in South America. Clin Microbiol Infect. 2008;14:154-8. [ Links ]
66. Villegas MV, Lolans K, Correa A, Suárez CJ, López JA, Vallejo M, et al . First detection of the plasmid-mediated class A carbapenemase KPC-2 in clinical isolates of Klebsiella pneumoniae from South America. Antimicrob Agents Chemother. 2006;50:2880-2. http://dx.doi.org/10.1128/AAC.00186-06 [ Links ]
67. Woodford N, Zhang J, Warner M, Kaufmann ME, Matos J, Macdonald A, et al . Arrival of Klebsiella pneumoniae producing KPC carbapenemase in the United Kingdom. J Antimicrob Chemother 2008;62:1261-4. http://dx.doi.org/10.1093/jac/dkn396 [ Links ]
68. Lee J, Patel G, Huprikar S, Calfee DP, Jenkins SG. Decreased susceptibility to polymyxin B during treatment for carbapenem-resistant Klebsiella pneumoniae infection. J Clin Microbiol. 2009;47:1611-2. http://dx.doi.org/10.1128/JCM.02466-08 [ Links ]
69. Curcio D, Alí A, Duarte A, Defilippi A, Ibáñez-Guzmán C, Chung M, et al . Prescription of antibiotics in intensive care units in Latin America: An observational study. J Chemother. 2009;21:527-34. [ Links ]
70. Cordero L, Rau R, Taylor D, Ayers LW. Enteric Gram- negative bacilli bloodstream infections: 17 years´ experience in a neonatal intensive care unit. Am J Infect Control. 2004;32:189-95. http://dx.doi.org/10.1016/j.ajic.2003.07.004 [ Links ]
71. Larson EL, Cimiotti JP, Haas J, Nesin M, Allen A, Della-Latta P, et al . Gram-negative bacilli associated with catheter-associated and non-catheter-associated bloodstream infections and hand carriage by healthcare workers in neonatal intensive care units. Pediatr Crit Care Med. 2005;6:457-61. http://dx.doi.org/10.1097/01.PCC.0000163669.37340.91 [ Links ]
72. Zaidi AK, Huskins WC, Thaver D, Bhutta ZA, Abbas Z, Goldmann DA. Hospital-acquired neonatal infections in developing countries. Lancet. 2005;365:1175-88. http://dx.doi.org/10.1016/S0140-6736(05)71881-X [ Links ]
73. Matthaiou DK, Michalopoulos A, Rafailidis PI, Karageorgopoulos DE, Papaioannou V, Ntani G, et al. Risk factors associated with the isolation of colistin-resistant Gram-negative bacteria: A matched case-control study. Crit Care Med. 2008;36:807-11. http://dx.doi.org/10.1097/CCM.0B013E3181652FAE [ Links ]
74. Patterson JE, Hardin TC, Kelly CA, García RC, Jorgensen JH. Association of antibiotic utilization measures and control of multiple-drug resistance in Klebsiella pneumoniae . Infect Control Hosp Epidemiol. 2000;21:455-8. http://dx.doi.org/10.1086/501787 [ Links ]
75. Rodríguez J, Navarro MD, Romero L, Muniain MA, Perea EJ, Pérez-Cano R, et al . Clinical and molecular epidemiology of extended-spectrum beta-lactamase- producing Escherichia coli as a cause of nosocomial infection or colonization: Implications for control. Clin Infect Dis. 2006;42:37-45. http://dx.doi.org/10.1086/498519 [ Links ]
76. Warren RE, Harvey G, Carr R, Ward D, Doroshenko A. Control of infections due to extended-spectrum beta- lactamase-producing organisms in hospitals and the community. Clin Microbiol Infect. 2008;14(Suppl.1):124-33. [ Links ]
77. Projan SJ. Whither antibacterial drug discovery? Drug Discov Today. 2008;13:279-80. http://dx.doi.org/10.1016/j.drudis.2008.03.010 [ Links ]













