Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157
Biomédica vol.34 no.2 Bogotá abr./jun. 2014
https://doi.org/10.7705/biomedica.v34i2.1580
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v34i2.1580
Mónica Llano 1 , Paula Pavía 1 , Astrid Carolina Flórez 2 , Adriana Cuéllar 3 , John M. González 4 , Concepción Puerta 1
1 Laboratorio de Parasitología Molecular, Departamento de Microbiología, Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
2 Grupo de Parasitología, Instituto Nacional de Salud, Bogotá, D.C., Colombia
3 Grupo de Inmunobiología y Biología Celular, Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
4 Grupo de Ciencias Básicas Médicas, Facultad de Medicina, Universidad de los Andes, Bogotá, D.C., Colombia
Institución donde se llevó a cabo el trabajo : Laboratorio de Parasitología Molecular, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia.
Contribución de los autores:
Mónica Llano: realización de los ensayos con la prueba comercial, análisis de los datos, preparación del manuscrito.
Astrid Carolina Flórez y Paula Pavía: realización de las pruebas serológicas de referencia y de PCR en tiempo real, respectivamente, preparación del manuscrito.
Adriana Cuéllar y John Mario González: diseño del estudio, análisis de los datos y preparación del manuscrito.
Concepción Judith Puerta: diseño y supervisión del estudio, obtención del apoyo financiero, análisis de los datos, elaboración del manuscrito.
Todos los autores leyeron y aprobaron el manuscrito.Recibido: 01/03/13; aceptado: 05/02/14
Introducción. El diagnóstico de la enfermedad de Chagas es fundamental para brindar un tratamiento oportuno y mejorar el pronóstico del paciente. La capacidad discriminatoria de las pruebas serológicas para el diagnóstico varía de acuerdo con la prevalencia de la enfermedad y el antígeno utilizado en la prueba.
Objetivo. Evaluar la capacidad discriminatoria de la prueba comercial Chagas ( Trypanosoma cruzi ) IgG-ELISA ® (NovaTec Immunodiagnostica GmbH) en un grupo de individuos colombianos utilizando la prueba de inmunofluorescencia indirecta (IFI) y el ensayo de inmunoabsorción enzimática (ELISA) como referencia.
Materiales y métodos. Se incluyeron 78 muestras de pacientes crónicos (36 asintomáticos y 42 sintomáticos) y 21 de controles sanos. También se analizaron 17 individuos no infectados con riesgo epidemiológico para la enfermedad de Chagas, siete con leishmaniasis y nueve con enfermedad cardiaca. Se evaluaron por PCR en tiempo real cuatro individuos cuyos resultados variaron entre pruebas.
Resultados. Se encontraron diferencias significativas a una densidad óptica de 450 nm (p<0,0001) al comparar la mediana de la absorbancia entre los controles sanos (0,143) y los asintomáticos (2,401) o sintomáticos (2,776), entre los asintomáticos y sintomáticos (p=0,0408), entre los seronegativos con riesgo (0,232), individuos con enfermedades cardiacas (0,367) o con leishmaniasis (0,337) y los pacientes con enfermedad de Chagas (p<0,0001), y entre los controles sanos y los pacientes seronegativos con riesgo (p=0,0264), con enfermedades cardiacas (p=0,0015) o con leishmaniasis (p=0,002). La PCR en tiempo real fue positiva en tres de los cuatro casos.
Conclusiones. Esta prueba comercial de ELISA permitió discriminar a los pacientes con Chagas de los controles. Se requieren estudios de fase II para determinar las características operativas de la prueba.
Palabras clave: enfermedad de Chagas/diagnóstico, Trypanosoma cruzi , anticuerpos, ensayo de inmunoabsorción enzimática, reacción en cadena de la polimerasa.
doi: http://dx.doi.org/10.7705/biomedica.v34i2.1580
Preliminary evaluation of the commercial kit Chagas ( Trypanosoma cruzi ) IgG-ELISA ® in Colombian individuals
Introduction: The diagnosis of Chagas´ disease is essential to provide early treatment and improve patients´ prognosis . The discriminatory efficiency of the serological tests varies according to the disease prevalence and the test- antigen used .
Objective: To evaluate the discriminatory efficiency of the commercial kit Chagas ( Trypanosoma cruzi ) IgG-ELISA ® (Nova Tec Immunodiagnostica GmbBH) in a group of Colombian individuals, using indirect immunofluorescence antibody testing (IFAT) and enzyme immunoassay (ELISA) tests as references.
Materials and methods: Seventy-eight samples from chronic chagasic patients (36 asymptomatic and 42 symptomatic) and 21 healthy controls were included. Seventeen samples from non-infected people with Chagas´ disease epidemiological risk, seven with leishmaniasis and nine with non-chagasic cardiomyopathy were also analyzed. Real time PCR was performed on four individuals whose results differed among tests.
Results: Significant differences at 450 nm optical absorbance were found (p<0.0001) when the median absorbance values of healthy controls (0.143), asymptomatic (2.401) and symptomatic (2.776) chagasic patients were compared, as well as when asymptomatic and symptomatic patients (p=0.0408) and seronegative people with epidemiological risk (0.232), cardiomyopathy (0.367) or leishmaniasis (0.337) were compared with chagasic patients (p<0.0001). Finally, there were differences among healthy controls and non-infected people with epidemiological risk (p=0.0264), patients with non-chagasic cardiomyopathy (p=0.0015) and patients with leishmaniasis (p=0.002). Real-time PCR was positive in three out of four analyzed cases.
Conclusions: The commercial ELISA test allowed us to discriminate the chagasic patients from the controls. A phase II study of diagnostic tests for determining field reliability of this test is required.
Keywords: Chagas disease/diagnosis, Trypanosoma cruzi, antibodies, enzyme-linked immunosorbent assay, polymerase chain reaction.
doi: http://dx.doi.org/10.7705/biomedica.v34i2.1580
La enfermedad de Chagas es causada por el flagelado Trypanosoma cruzi , parásito que exhibe una gran variabilidad genética representada en las seis unidades discretas de tipificación ( Discrete Typing Units, DTU ) establecidas (I a VI) y el nuevo genotipo Tcbat identificado en murciélagos en Brasil (1,2).
La enfermedad de Chagas es endémica en Centroamérica y Suramérica, donde se calcula que 9,8 millones de personas se encuentran infectadas con el parásito (3,4). Debido a la migración de la población infectada, la enfermedad se ha extendido a países no endémicos, principalmente Estados Unidos, Canadá, España, Japón y Australia (5). En Colombia se estima que 437.000 personas tienen la infección (6) y el 11 % de la población se encuentra en riesgo de adquirir la enfermedad (7). Un estudio reciente en Casanare, departamento endémico para esta enfermedad, reveló una sero-prevalencia de 16,91 % en la población de 15 a 89 años de edad (8).
La enfermedad de Chagas se inicia con una fase aguda que en la mayoría de los casos es inaparente o cursa con síntomas constitutivos y cuyo diagnóstico se realiza por medio de pruebas parasitológicas directas (3,9). Esta fase progresa a una fase crónica asintomática o indeterminada, en la cual el paciente desconoce su estado de infección en la mayoría de los casos (3,10). Cerca de 30 a 40 % de los pacientes infectados desarrolla sintomatología (3,9), siendo la miocardiopatía chagásica la afección más prevalente en Colombia (10). El diagnóstico con pruebas de laboratorio de la enfermedad de Chagas en su fase crónica (asintomática y sintomática) se realiza principalmente mediante técnicas serológicas que detectan anticuerpos de tipo inmunoglobulina G específicos de antígenos parasitarios (11). De hecho, la Organización Mundial de la Salud acepta como parámetro de diagnóstico de laboratorio los resultados positivos en dos pruebas basadas en principios inmunológicos diferentes (3,11). Así, la inmunofluorescencia indirecta (IFI) y el inmunoensayo enzimático (ELISA) constituyen dos de las técnicas más utilizadas (3,10,11). De estas, la prueba ELISA se destaca por su potencial de automatización y la posibilidad de examinar numerosas muestras de forma simultánea y en corto tiempo, así como la objetividad en la lectura de los datos y en su interpretación.
Entre las pruebas ELISA disponibles, la prueba comercial Chagas ( Trypanosoma cruzi ) IgG-ELISA ® (NovaTec Immunodiagnostica GmbH) utiliza como antígeno una proteína de fusión denominada TcF que codifica para cinco epítopos procedentes de antígenos distintos del parásito: TcD, PEP-2, TcLo1.2, TcE, y una variante polimórfica de este último denominada TcHi29 (12). Varios estudios han demostrado la capacidad de estos epítopos de inducir respuesta inmune humoral en el curso de la enfermedad en pacientes con enfermedad de Chagas procedentes de Argentina, Chile, Brasil, Bolivia y Ecuador (13-20) . Además, la evaluación de la ELISA basada en el antígeno TcF en pacientes de Brasil y Argentina mostró porcentajes de sensibilidad y especificidad de 100 y 98,94 %, respectivamente (12).
Teniendo en cuenta que la capacidad discrimi natoria de las pruebas serológicas puede variar dependiendo del tipo de antígeno utilizado, así como de la incidencia y la prevalencia de la enfermedad en la región, el objetivo de este estudio fue determinar la capacidad discriminatoria de la prueba comercial Chagas ( Trypanosoma cruzi ) IgG- ELISA ® (NovaTec Immunodiagnostica GmbH) en un grupo de individuos colombianos seleccionados en un muestreo por conveniencia.
Materiales y métodos
Tipo de estudio
Se llevó a cabo un estudio de fase I o de discriminación general con muestreo seudorretrospectivo por conveniencia de acuerdo a la disponibilidad de las muestras y de los datos asociados, cuyas conclusiones se restringieron al número de sujetos con resultados positivos y negativos en cada prueba (21,22).
Pacientes y grupos de estudio
En este estudio participaron 99 individuos entre los 21 y 83 años procedentes de distintas áreas geográficas del país (cuadro 1). Dichos individuos fueron clasificados en tres grupos de acuerdo con el cuadro clínico y el resultado de las pruebas serológicas de IFI y ELISA realizadas por el Instituto Nacional de Salud, institución de referencia para el diagnóstico y confirmación de la enfermedad de Chagas en Colombia (23): un grupo de controles sanos conformado por 21 individuos procedentes de áreas no endémicas para la enfermedad de Chagas con un promedio de edad de 29,4±10,4 años, examen físico y electrocardiograma normales y resultados de IFI y ELISA negativos; un grupo de pacientes infec tados asintomáticos, conformado por 36 individuos con un promedio de edad de 41,3±11,5 años, examen físico y electrocardiograma normales y pruebas serológicas positivas, y un grupo de pacientes infectados con enfermedad cardiaca, compuesto por 42 individuos sintomáticos con un promedio de edad de 53,6±11,6 años, examen físico y electrocardiograma anormales, con síntomas cardiovasculares clínicamente significativos y pruebas serológicas positivas. Como control adicional se examinaron 17 individuos no infectados por el parásito que presentaban riesgo epidemiológico (haber nacido o haber vivido en áreas endémicas para la enfermedad, haber estado en contacto con el vector, tener familiares con la enfermedad o haber recibido transfusiones), así como siete con leishmaniasis y nueve con enfermedad cardiaca de origen no chagásico (no infectados).

Pruebas de ELISA e IFI de referencia
El antígeno utilizado para la técnica de ELISA fue un extracto total preparado a partir de epimastigotes de cultivo de la cepa colombiana NV (MHOM/CO/07/NV) previamente caracterizada como DTU-I (24). Para la técnica de IFI se utilizó un antígeno total de la misma cepa de T. cruzi obtenida a partir de epimastigotes completos de cultivo fijados en formol al 1 %. Las pruebas se realizaron según lo descrito por Beltrán, et al. (23). Los puntos de corte para estas técnicas fueron valores mayores o iguales a una dilución de 1:32 para la prueba de IFI y valores mayores o iguales a una densidad óptica de 0,300 para ELISA.
Prueba comercial Chagas (Trypanosoma cruzi) IgG-ELISA ®
Esta prueba de ELISA se realizó de acuerdo con las instrucciones y recomendaciones de la casa fabricante (NovaTec Immunodiagnostica GmbH, Dietzenbach, Alemania). La lectura se realizó en un espectrofotómetro Thermo Scientific Multiskan FC ® a una densidad óptica de 450 nm.
PCR en tiempo real
A partir de muestras de sangre anticoaguladas con EDTA y preservadas en una solución amortiguadora de clorhidrato de guanidina-EDTA a 4 °C, se obtuvo el ADN utilizando el estuche comercial High Pure PCR Template Preparation Kit ® (Roche, Mannheim, Alemania). Posteriormente, las muestras se amplificaron mediante PCR convencional con los iniciadores de la betaglobina F-R (25) con el fin de comprobar la integridad del ADN y descartar la presencia de inhibidores que pudieran afectar los resultados en la prueba de PCR en tiempo real. Las muestras positivas se amplificaron luego por PCR en tiempo real utilizando los iniciadores específicos cruzi 1 (ASTCGGCTGATCGTTTTCGA), cruzi 2 (AATTCCTCCAAGCAGCGGATA) y la sonda cruzi 3 (6FAM-CACACACTGGACACCAA-BBQ), que tienen como blanco de amplificación e hibridación una región de 166 pb del ADN satelital del parásito (26). Cada muestra se montó por duplicado.
Se incluyeron los siguientes controles: de reacción (adición de agua en un cuarto de la preparación de la mezcla de reacción); un control gris (adición de agua en un cuarto de la adición de las muestras a la reacción); un control negativo (ADN de un individuo sano), y controles positivos (ADN genómico de T. cruzi I, correspondiente a 1.000, y un parásito/ml). La carga parasitaria se estimó con base en una curva estándar establecida con diferentes concentraciones de ADN genómico del parásito mezcladas con sangre libre de infección entre un rango de 10 5 a 10 0 parásitos/ml (27).
Análisis estadístico
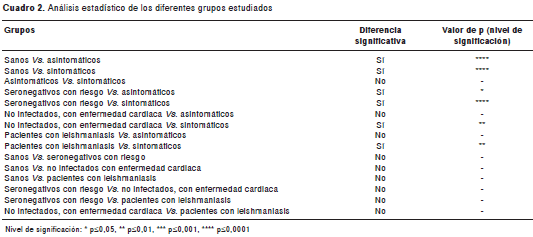
Los datos se consignaron en una base de datos en Excel TM (Microsoft). El análisis estadístico de las pruebas se realizó a través del paquete estadístico Stata ® , versión 10.0 (STATA Corporation, Texas, USA). Es de anotar que las muestras que se situaron en la zona gris para estos análisis se consideraron como negativas después de repetirlas, tal como lo recomienda el fabricante (NovaLisa, Chagas - Trypanosoma cruzi - IgG-ELISA ® , producto número CHAGA0560, NovaTec Immunodiagnostica GmbH, Dietzenbach, Alemania). Las diferencias entre las medianas de las densidades ópticas de los grupos analizados se determinaron mediante la prueba para múltiples comparaciones de Kruskal-Wallis seguida del test de Dunn en el programa GraphPad Prism ® , versión 6.04 (cuadro 2). Las diferencias se consideraron significativas cuando p<0,05.
Aspectos éticos
Este estudio correspondió a una investigación con riesgo mínimo de acuerdo con la resolución No. 08430 del Ministerio de Salud de Colombia y fue aprobado por el Comité de Investigación y Ética de la Facultad de Ciencias de la Pontificia Universidad Javeriana. Se obtuvo consentimiento informado de todos los individuos participantes.
Resultados
Comparación de los resultados de la prueba comercial Chagas (Trypanosoma cruzi) IgG-ELISA ® con los de las pruebas serológicas de IFI y ELISA de referencia
De las 78 muestras con resultado positivo en las pruebas de IFI y ELISA de referencia, 75 (96,1 %) tuvieron el mismo resultado en la prueba comercial y correspondieron a 35/36 (97,2 %) muestras de pacientes asintomáticos y 40/42 (95,2 %) muestras de pacientes sintomáticos (figura 1). Además, una de las muestras del grupo de asintomáticos se situó en la zona gris de la prueba comercial. Se encontraron diferencias significativas entre las medianas de las absorbancias de los controles sanos y las de los pacientes chagásicos asinto-máticos (p<0,0001) y sintomáticos (p<0,0001) (cuadro 2, figura 1).
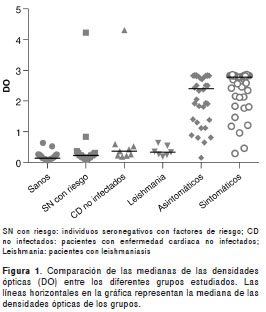
Por otra parte, de las 21 muestras con resultado negativo en las pruebas de IFI y ELISA de referencia, 100 % también dio resultado negativo en la prueba comercial (figura 1). El resultado de una de las muestras de los individuos del grupo de control se situó en la zona gris y al repetir la prueba se obtuvo el mismo resultado, por lo que se consideró negativo de acuerdo con las recomendaciones del fabricante.
De forma exploratoria también se aplicaron tanto la prueba comercial como las pruebas de ELISA e IFI a las muestras de suero de 17 individuos no infectados pero con riesgo epidemiológico, siete con leishmaniasis y nueve no infectados pero con enfermedad cardiaca. La prueba comercial detectó como positivas a dos (3H y KT095) de las 17 muestras de individuos seronegativos en riesgo, con densidades ópticas a 450 nm (DO 450 ) de 4,226 y 0,839, respectivamente, a uno (1L) de los siete pacientes con leishmaniasis (DO 450 =0,638) y a uno (KT009) de los nueve con enfermedad cardiaca no infectados y en riesgo (DO 450 =4,311). Una de las muestras de los individuos con leishmaniasis (4L) y una de los no infectados pero con enfermedad cardiaca (39H) se situaron en la zona gris (DO 450 =0,548 y 0,597, respectivamente). Pese a lo anterior, la prueba comercial presentó diferencias significativas al comparar los resultados de cada uno de estos grupos de control adicionales con los de los pacientes con enfermedad de Chagas sintomáticos (cuadro 2). En el caso de los pacientes asintomáticos, solo se encontraron diferencias significativas al comparar la mediana de los valores de absorbancia con la de los individuos seronegativos con riesgo epidemiológico, pero no con la de los individuos con leishmaniasis o con la de aquellos con enfermedad cardiaca no infectados (cuadro 2). Sin embargo, al comparar la mediana de las absorbancias de todos los grupos de control con la de los controles sanos, no se encontraron diferencias significativas (cuadro 2). En cuanto a las pruebas de referencia, estas fueron negativas en todos los casos con excepción de tres de las muestras de los individuos con leishmaniasis (1L, 3L y 4L), de las cuales una también dio resultado positivo en el ELISA comercial (1L), otra se situó en la zona gris (4L) y la otra fue negativa (3L).
Determinación por PCR en tiempo real de la presencia del parásito en muestras serológicamente discordantes o situadas en la zona gris
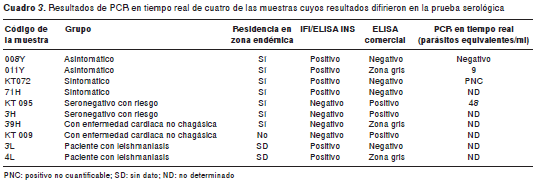
Con el fin de tener evidencias para definir el estado de infección de los individuos con resultados discordantes en las pruebas serológicas de referencia y en la prueba de NovaTec (n=7) y de quienes se situaron en la zona gris (n=3) en la ELISA comercial, se realizó PCR en tiempo real en las muestras de sangre de cuatro de estos individuos. Como se observa en el cuadro 3, tres de las cuatro muestras analizadas fueron positivas, con cargas parasitarias bajas. Estas tres muestras positivas por PCR en tiempo real correspondieron a dos de las tres muestras con resultados positivos (011Y y KT072) en las pruebas de referencia y a la muestra con resultado positivo (KT095) en la prueba comercial (cuadro 3). La muestra negativa por PCR en tiempo real (008Y) correspondió a un paciente con resultado positivo en las pruebas de referencia (cuadro 3).
Discusión
Actualmente, existen numerosas pruebas serológicas de ELISA para la detección de anticuerpos IgG contra el parásito T. cruzi (28), las cuales difieren en el antígeno empleado según su naturaleza (proteínas de lisados totales del parásito, fracciones o proteínas purificadas, proteínas recombinantes, péptidos sintéticos o proteínas de fusión que contienen epítopos de distintas proteínas del parásito), según su expresión en algún estadio de diferenciación particular del parásito (epimastigote, amastigote o tripomastigote), o según la unidad discreta de tipificación de la cepa del parásito de donde se originó el antígeno (DTU-I a VI). Esta diversidad en la oferta de pruebas de ELISA, unida a las diferencias en los aislamientos circulantes en cada región, la prevalencia de la enfermedad en cada población y en los protocolos utilizados, resulta en una considerable fuente de variación en una misma prueba y entre pruebas (10-20).
Si bien en Colombia se han empleado distintas pruebas de ELISA (29-35), estas, por lo general, incluyen lisados proteicos de cepas pertenecientes a la DTU I, pues es la DTU de mayor circulación en el país (35). Sin embargo, en nuestro medio existen reportes del hallazgo en pacientes chagásicos de las DTU II, III, IV y VI (35-41). Por ello, en este estudio con muestreo por conveniencia, se evaluó en un grupo de individuos colombianos la capacidad discriminatoria de la prueba comercial Chagas ( Trypanosoma cruzi ) IgG-ELISA ® (NovaTec Immuno-diagnostica GmbH), la cual emplea como antígeno la proteína de fusión TcF que incluye epítopos expresados por las DTU I, II, V y VI del parásito. Para ello se determinaron los valores de absorbancia de dicha prueba comercial y se compararon los resultados positivos y negativos con los de las pruebas serológicas de IFI y ELISA (DTU-I) utilizadas por el Instituto Nacional de Salud en su laboratorio de referencia para el diagnóstico y la confirmación de la enfermedad de Chagas en Colombia.
En la mayoría de los casos la prueba comercial de ELISA permitió diferenciar a los pacientes infectados de los individuos sanos de control con una clara y amplia diferencia en los valores de absorbancia entre los distintos grupos estudiados. Los valores de absorbancia de los pacientes sintomáticos fueron significativamente más altos que los de los asintomáticos, hecho reportado para otros antígenos del parásito como la proteína KMP-11 (42) y que podría explicarse por un tiempo mayor de exposición al antígeno en los pacientes sintomáticos.
En lo relacionado con los pacientes seropositivos en las pruebas convencionales, y negativos (008Y, KT072, 71H y 3L) o en la zona gris (011Y y 4L) en la prueba comercial (cuadro 3), la diferencia en los resultados podría deberse a la presencia de anticuerpos dirigidos contra antígenos del parásito diferentes de los contenidos en la proteína de fusión TcF, pero presentes en las formas epimastigotas de las cepas del parásito utilizadas en las pruebas de IFI y ELISA utilizadas por el laboratorio de referencia. Por el contrario, la muestra del grupo de individuos seronegativos con riesgo epidemiológico (KT095, cuadro 3) con resultado positivo en la ELISA comercial puede explicarse por el hecho de que tres (TcD, Pep-2 y TcLo1.2) de los cinco epítopos de las proteína TcF provienen de proteínas de superficie de formas tripomastigotas (14,16). Por lo tanto, estos resultados sugieren que este estuche comercial podría contener antígenos específicos del estadio tripomastigote del parásito que no son detectados por las pruebas de referencia.
Los resultados de la prueba de PCR en tiempo real sustentan los anteriores supuestos, ya que se pudo detectar el ADN del parásito tanto en las muestras con resultado positivo en las pruebas de referencia (011Y y KT072, cuadro 3), como en la prueba comercial (KT095, cuadro 3). En relación con el resultado negativo de la PCR en tiempo real del paciente con resultado positivo en las pruebas de referencia (008Y, cuadro 3), esta discrepancia puede obedecer a la ausencia del parásito en el volumen de muestra analizada o a que la cantidad de parásitos en esta muestra fue inferior a la sensibilidad analítica de la PCR en tiempo real.
Una de las aplicaciones más importantes de las pruebas diagnósticas serológicas es su uso en zonas endémicas, en donde la prueba debe discriminar a los individuos infectados de aquellos que sin estarlo pueden tener otras condiciones que generen falsos positivos. Por esta razón, además del grupo de controles sanos, en el presente estudio se incluyeron de forma exploratoria otros grupos de control: a) individuos con factores de riesgo, quienes por vivir o haber vivido en áreas endémicas pueden desa rrollar respuesta inmune específica tanto humoral como celular contra el parásito (43); b) individuos infectados con Leishmania , parásito que al igual que T. cruzi pertenece a la familia Trypanosomatidae, y comparte con este algunos de sus epítopos (44,45), y c) individuos con enfermedad cardiaca no infectados, quienes por presentar inflamación o por residir en áreas endémicas pueden tener un ruido de fondo mayor que el de los controles sanos sin estas características (46,47). Los resultados obtenidos indican que si bien estos individuos de control presentaron valores de absorbancia similares a los del grupo de individuos sanos, en la mayoría de los casos se pudo discriminar entre individuos infectados y no infectados.
En conclusión, la prueba comercial evaluada permitió discriminar a los pacientes con Chagas de los controles sanos (100 %), de aquellos con enfermedades cardiacas no infectados (77,8 %), de los pacientes con leishmaniasis (71,4 %) y de los individuos con riesgo epidemiológico (88,2 %). Se requieren estudios de fase II para la evaluación de pruebas diagnósticas con el fin de determinar las características operativas de la prueba.
Los autores expresan su agradecimiento a los pacientes e individuos de control por su participación en el estudio, a Zulma Cucunubá y a Lorena Valencia por su asesoría en la evaluación de las pruebas diagnósticas y al Laboratorio de Parasitología del Instituto Nacional de Salud por facilitar las muestras de suero de los sujetos con leishmaniasis.
Los autores del presente artículo declaramos que no teníamos conflictos de intereses de orden acadé mico, institucional u operacional en el momento de la investigación. Ninguno de los autores tiene vínculos con la compañía fabricante del producto.
El estudio fue desarrollado como parte del proyecto No. 00004375 financiado por la Pontificia Universidad Javeriana.
Correspondencia:
Concepción Judith Puerta, Carrera 7 N° 43-82, Edificio Carlos Ortiz, oficina 608, Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia.
Teléfono: (571) 320 8320, extensión 4024; fax: (571) 320 8320, extensión 4021. cpuerta@javeriana.edu.co
1. Zingales B, Miles MA, Campbell DA, Tibayrenc M, Macedo AM, Teixeira MM, et al . The revised Trypanosoma cruzi subspecific nomenclature: Rationale, epidemiological relevance and research applications. Infect Genet Evol. 2012;12:240-53. http://dx.doi.org /10.1016/j.meegid.2011.12.009 [ Links ]
2. Marcili A, Lima L, Cavazzana M, Junqueira AC, Veludo HH, Maia Da Silva F, et al . A new genotype of Trypanosoma cruzi associated with bats evidenced by phylogenetic analyses using SSU rDNA, cytochrome b and histone H2B genes and genotyping based on ITS1 rDNA. Parasitology. 2009;136:641-55. http://dx.doi.org/10.1017/S0031182009005861 [ Links ]
3. World Health Organization. Control of Chagas disease. Report of a WHO Expert Committee. Technical Report Series 905. Geneva: World Health Organization; 2002. p.1-120. [ Links ]
4. World Health Organization. Working to overcome the global impact of neglected tropical diseases. First WHO report on neglected tropical diseases. Geneva: WHO; 2010. p.75-81. [ Links ]
5. Navarro M, Navaza B, Guionnet A, López-Vélez R. Chagas disease in Spain: Need for further public health measures. PLoS Negl Trop Dis. 2012;6:e1962. http://dx.doi.org/10.1371/journal.pntd.0001962 [ Links ]
6. Organización Panamericana de la Salud. Estimación cuantitativa de la enfermedad de Chagas en las Américas. Washington, D.C.: OPS; 2006. p. 1-28. [ Links ]
7. Moncayo A, Silveira A. Current epidemiological trends for Chagas disease in Latin America and future challenges in epidemiology, surveillance and health policy. Mem Inst Oswaldo Cruz. 2009;104(Supl.1):17-30. http://dx.doi.org/10.1590/S0074-02762009000900005 [ Links ]
8. Gutiérrez FR, Trujillo Guiza ML, Escobar Martínez MC. Prevalence of Trypanosoma cruzi infection among people aged 15 to 89 years inhabiting the Department of Casanare (Colombia). PLoS Negl Trop Dis. 2013;7:e2113. http://dx.doi.org/10.1371/journal.pntd.0002113 [ Links ]
9. Rassi A Jr, Rassi A, Marcondes de Rezende J. American trypanosomiasis (Chagas disease). Infect Dis Clin North Am. 2012;26:275-91. http://dx.doi.org/10.1016/j.idc.2012.03.002 [ Links ]
10. Rosas F, Roa N, Cucunubá Z, Cuéllar A, González JM, Puerta C. Chagasic cardiomyopathy. En: Veselka J. Cardiomyopathies - From Basic Research to Clinical Management. Rijeka, Croatia: Editorial INTECH; 2012. p. 775-800. [ Links ]
11. Coura JR, Borges-Pereira J. Chagas disease. What is known and what should be improved: A systemic review. Rev Soc Bras Med Trop. 2012;45:286-96. http://dx.doi.org/10.1590/S0037-86822012000300002 [ Links ]
12. Ferreira AW, Belem ZR, Lemos EA, Reed SG, Campos- Neto A. Enzyme-linked immunosorbent assay for serological diagnosis of Chagas´ disease employing a Trypanosoma cruzi recombinant antigen that consists of four different peptides. J Clin Microbiol. 2001;39:4390-5. http://dx.doi.org/10.1128/JCM.39.12.4390-4395.2001 [ Links ]
13. Vergara U, Lorca M, Veloso C, González A, Engstrom A, Aslund L, et al . Assay for detection of Trypanosoma cruzi antibodies in human sera based on reaction with synthetic peptides. J Clin Microbiol. 1991;29:2034-7. [ Links ]
14. Burns JM Jr, Shreffler WG, Rosman DE, Sleath PR, March CJ, Reed SG. Identification and synthesis of a major conserved antigenic epitope of Trypanosoma cruzi . Proc Natl Acad Sci USA. 1992;89:1239-43. [ Links ]
15. Vergara U, Veloso C, González A, Lorca M. Evaluation of an enzyme-linked immunosorbent assay for the diagnosis of Chagas´ disease using synthetic peptides. Am J Trop Med Hyg. 1992;46:39-43. [ Links ]
16. Peralta JM, Teixeira MG, Shreffler WG, Pereira JB, Burns JM Jr, Sleath PR, et al . Serodiagnosis of Chagas´ disease by enzyme-linked immunosorbent assay using two synthetic peptides as antigens. J Clin Microbiol. 1994;32:971-4. [ Links ]
17. Chico M, Sandoval C, Guevara A, Calvopiña M, Cooper PJ, Reed SG, et al . Chagas disease in Ecuador: Evidence for disease transmission in an Indigenous population in the Amazon region. Mem Inst Oswaldo Cruz. 1997;92:317-20. http://dx.doi.org/10.1590/S0074-02761997000300002 [ Links ]
18. Houghton RL, Benson DR, Reynolds LD, McNeill PD, Sleath PR, Lodes MJ, et al . A multi-epitope synthetic peptide and recombinant protein for the detection of antibodies to Trypanosoma cruzi in radioimmunoprecipitation-confirmed and consensus-positive sera. J Infect Dis. 1999;179:1226-34. http://dx.doi.org/10.1086/314723 [ Links ]
19. Rabello A, Luquetti AO, Moreira EF, Gadelha M de F, dos Santos JA, de Melo L, et al . Serodiagnosis of Trypanosoma cruzi infection using the new particle gel immunoassay -ID-PaGIA Chagas. Mem Inst Oswaldo Cruz. 1999;94:77-82. [ Links ]
20. Hernández P, Heimann M, Riera C, Solano M, Santalla J, Luquetti AO, et al . Highly effective serodiagnosis for Chagas´ disease. Clin Vaccine Immunol. 2010;17:1598-604. http://dx.doi.org/10.1128/CVI.00489-08 [ Links ]
21. Orozco LC, Camargo DM. Evaluación de tecnologías diagnósticas y tipos de muestreos. Biomédica. 1997;17: 321-4. [ Links ]
22. Carnero-Pardo C. Evaluación de las pruebas diagnósticas. Rev Neurol. 2005;40:641-3. [ Links ]
23. Beltrán M, Duque S, Guhl F, Herrera CP, López MC, Moreno AL, et al . Prueba de ELISA y prueba de inmunofluorescencia indirecta (IFI). En: Guhl F, Nicholls RS, editores. Manual de procedimientos para el diagnóstico de la enfermedad de Chagas. Bogotá: Ministerio de Salud; 2001. p.32-48. [ Links ]
24. Falla A, Herrera C, Fajardo A, Montilla M, Vallejo GA, Guhl F. Haplotype identification within Trypanosoma cruzi I in Colombian isolates from several reservoirs, vectors and humans. Acta Trop. 2009;110:15-21. http://dx.doi.org/10.1016/j.actatropica.2008.12.003 [ Links ]
25. Virreira M, Torrico F, Truyens C, Alonso-Vega C, Solano M, Carlier Y, et al . Comparison of PCR methods for the diagnosis of congenital Trypanosoma cruzi infection. Rev Soc Bras Med Trop. 2005;38:65-7. [ Links ]
26. Piron M, Fisa R, Casamitjana N, López-Chejade P, Puig L, Vergés M, et al . Development of a real-time PCR assay for Trypanosoma cruzi detection in blood samples. Acta Trop. 2007;103:195-200. http://dx.doi.org/10.1016/j.actatropica.2007.05.019 [ Links ]
27. Duffy T, Bisio M, Altcheh J, Burgos JM, Díez M, Levin MJ, et al . Accurate real-time PCR strategy for monitoring bloodstream parasitic loads in Chagas disease patients. PLoS Negl Trop Dis. 2009;3:e419. http://dx.doi.org/10.1371/journal.pntd.0000419 [ Links ]
28. Alfonso AM, Ebell MH, Tarleton RL. A systematic review of high quality diagnostic tests for Chagas disease. PLoS Negl Trop Dis. 2012;6:e1881. http://dx.doi.org/10.1371/journal.pntd.0001881 [ Links ]
29. Orozco L, Camargo D, López M, Duque S, Gualdrón LE, Cáceres E, et al . Inmunodiagnóstico de la infección en humanos por Trypanosoma cruzi mediante ELISA utilizando sangre recolectada en papel filtro. Biomédica. 1999;19:164-8. [ Links ]
30. López M, Duque S, Orozco L, Camargo D, Gualdrón L, Cáceres E, et al . Inmunodiagnóstico de la infección chagásica por ELISA. Biomédica. 1999;19:159-63. [ Links ]
31. Gutiérrez R, Angulo VM, Tarazona Z, Britto C, Fernandes O. Comparison of four serological tests for the diagnosis of Chagas disease in a Colombian endemic area. Parasitology. 2004;129:439-44. http://dx.doi.org/10.1017/S0031182004005785 [ Links ]
32. Enciso C, Montilla M, Santacruz MM, Nicholls RS, Rodríguez A, Mercado M, et al . Comparación de inmunoflorescencia indirecta, un inmunoensayo enzimático y la prueba commercial Chagatek ® para la detección de anticuerpos anti- Trypanosoma cruzi. Biomédica. 2004;24: 104-8. [ Links ]
33. Beltrán M, Bermúdez MI, Forero MC, Ayala M, Rodríguez MJ. Control de la infección por Trypanosoma cruzi en donantes de sangre de Colombia, 2003. Biomédica. 2005; 25:527-32. [ Links ]
34. Gil J, Pavía P, Montilla M, Flórez AC, Quintero C, Mercado M, et al . Comparación de una prueba de PCR basada en los genes codificantes para la histona H2A/SIRE con pruebas serológicas convencionales para el diagnóstico de la enfermedad de Chagas crónica en pacientes colombianos. Biomédica. 2007;27:83-91. [ Links ]
35. Ramírez JD, Guhl F, Umezawa ES, Morillo CA, Rosas F, Marin-Neto JA, et al . Evaluation of adult chronic Chagas´ heart disease diagnosis by molecular and serological methods. J Clin Microbiol. 2009;47:3945-51. http://dx.doi.org/10.1128/JCM.01601-09 [ Links ]
36. Zafra G, Mantilla JC, Valadares HM, Macedo AM, González CI. Evidence of Trypanosoma cruzi II infection in Colombian chagasic patients. Parasitol Res. 2008;103:731-4. http://dx.doi.org/10.1007/s00436-008-1034-0 [ Links ]
37. Pavía PX, Montilla M, Flórez AC, Herrera-Amaya GM, Ospina-Díaz JM, Manrique-Abril FG, et al . Reporte del primer caso de enfermedad de Chagas transplacentaria analizado por AP-PCR en Moniquirá, Boyacá. Biomédica. 2009;29:513-22. [ Links ]
38. Zafra G, Mantilla JC, Jácome J, Macedo AM, González CI. Direct analysis of genetic variability in Trypanosoma cruzi populations from tissues of Colombian chagasic patients. Hum Pathol. 2011;42:1159-68. http://dx.doi.org/10.1016/j.humpath.2010.11.012 [ Links ]
39. González CI, Ortiz S, Solari A. Colombian Trypanosoma cruzi major genotypes circulating in patients: Minicircle homologies by cross-hybridization analysis. Int J Parasitol. 2010;40:1685-92. http://dx.doi.org/10.1016/j.ijpara.2010.07.008 [ Links ]
40. Mantilla JC, Zafra G, Macedo AM, González CI. Mixed infection of Trypanosoma cruzi I and II in a Colombian cardiomyopathic patient. Hum Pathol. 2010;41:610-3. http://dx.doi.org/10.1016/j.humpath.2009.11.005 [ Links ]
41. Sánchez LV, Bautista DC, Corredor AF, Herrera VM, Martínez LX, Villar JC, et al . Temporal variation of Trypanosoma cruzi discrete typing units in asymptomatic Chagas disease patients. Microbes Infect. 2013;15:745-8. http://dx.doi.org/10.1016/j.micinf.2013.06.008 [ Links ]
42. Villegas A, Pinazo MJ, Marañón C, Thomas MC, Posada E, Carrilero B, et al . Short-term follow-up of chagasic patients after benznidazole treatment using multiple serological markers. BMC Infect Dis. 2011;11:206. http://dx.doi.org/10.1186/1471-2334-11-206 [ Links ]
43. Olivera GC, Albareda MC, Álvarez MG, De Rissio AM, Fichera LE, Cooley G, et al . Trypanosoma cruzi- specific immune responses in subjects from endemic areas of Chagas disease of Argentina. Microbes Infect. 2010;12:359-63. http://dx.doi.org/10.1016/j.micinf.2010.01.011 [ Links ]
44. Caballero ZC, Sousa OE, Marques WP, Sáez-Alquézar A, Umezawa ES. Evaluation of serological tests to identify Trypanosoma cruzi infection in humans and determine cross-reactivity with Trypanosoma rangeli and Leishmania spp. Clin Vaccine Immunol. 2007;14:1045-9. http://dx.doi.org/10.1128/CVI.00127-07 [ Links ]
45. Umezawa ES, Bastos SF, Camargo ME, Yamauchi LM, Santos MR, González A, et al . Evaluation of recombinant antigens for serodiagnosis of Chagas´ disease in South and Central America. J Clin Microbiol. 1999;37:1554-60. [ Links ]
46. Tobar I, Parra F, Pérez CN, Rodríguez-Bonfante C, Useche F, Bonfante-Cabarcas R. Prevalence of Trypanosoma cruzi antibodies and inflammatory markers in uncompensated heart failure. Rev Soc Bras Med Trop. 2011;44:691-6. http://dx.doi.org/10.1590/S0037-86822011000600008 [ Links ]
47. O´Daly JA, Carrasco H, Fernández V, Rodríguez MB. Comparison of chagasic and non-chagasic myocardiopathies by ELISA and immunoblotting with antigens of Trypanosoma cruzi and Trypanosoma rangeli. Acta Trop. 1994;56:265-87. [ Links ]













