Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.34 no.3 Bogotá July/Sept. 2014
https://doi.org/10.7705/biomedica.v34i3.2236
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v34i3.2236
1 Laboratorio de Virología, Instituto Nacional de Salud, Bogotá, D.C., Colombia
2 Grupo de Gastrohepatología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
3 Laboratorio de Salud Pública de Antioquia, Secretaría Seccional de Salud y Protección Social de Antioquia, Medellín, Colombia
4 Grupo de Investigación e Innovación Biomédica, Facultad de Ciencias Exactas y Aplicadas, Instituto Tecnológico Metropolitano, Medellín, Colombia
5 Grupo de Epidemiología, Facultad Nacional de Salud Pública, Universidad de Antioquia, Medellín, Colombia
Contribución de los autores:
María Cristina Navas y Dioselina Peláez: diseño del estudio
María Cristina Hoyos y María Patricia Arbeláez: análisis estadístico
Martha Cecilia Ospina, Julio César Rendón, Carolina Mantilla, Olga Lucía Pérez, Lady Contreras y Yaneth Estepa: marcadores serológicos
María Cristina Navas y Carolina Mantilla: redacción del manuscrito
María Cristina Navas, Dioselina Peláez, Martha Cecilia Ospina y Fabián Cortés-Mancera: discusión de los resultados
Recibido: 13/01/14; aceptado: 31/03/14
Introducción. El virus de la hepatitis E (HEV), agente etiológico de casos esporádicos y epidemias de hepatitis, es un virus emergente de importancia global. En Colombia se desconoce la epidemiología de la infección causada por este virus.
Objetivo. Determinar la seropositividad para el virus de la hepatitis E en muestras de suero de pacientes con diagnóstico clínico de hepatitis viral en Colombia.
Materiales y métodos. Se estudiaron muestras de pacientes remitidas al Instituto Nacional de Salud en el periodo 2005-2010 provenientes de 15 departamentos de Colombia (grupo 1) y muestras remitidas al Laboratorio Departamental de Salud Pública de Antioquia en el periodo 2008-2009 (grupo 2). Las muestras de suero se analizaron por inmunoensayo con estuches comerciales.
Resultados. La frecuencia de seropositividad para el virus de la hepatitis E en las 344 muestras analizadas fue de 8,7 % (30/344); de estas, 1,74 % (6/344) presentó IgM anti-HEV y 7,5 % (26/344), IgG anti-HEV. Se observó una diferencia en el resultado positivo entre el grupo 1 (6,3 %) y el grupo 2 (15,3 %). Los casos provenían de nueve departamentos del país.
Conclusiones. Este es el primer estudio de infección por el virus de la hepatitis E en muestras de pacientes con diagnóstico de hepatitis en Colombia. La seropositividad descrita en esta población de pacientes es similar a la descrita en otros países de América Latina, como Brasil, Perú y Uruguay. Teniendo en cuenta estos resultados, se debe considerar la inclusión de los marcadores de la infección por el virus de la hepatitis E en el diagnóstico diferencial de la hepatitis viral en Colombia.
Palabras clave: hepatitis E, virus de la hepatitis, anticuerpos.
http://dx.doi.org/10.7705/biomedica.v34i3.2236
Hepatitis E virus infection in patients with clinical diagnosis of viral hepatitis in Colombia
Introduction: Hepatitis E virus (HEV) is an emergent virus of global importance; it is the etiological agent of sporadic cases and outbreaks of hepatitis. The epidemiology of this infection in Colombia is unknown.
Objective: To determine the seropositivity for hepatitis E virus in Colombia in cases with clinical diagnosis of viral hepatitis.
Materials and methods: Serum samples from patients that were sent to the Instituto Nacional de Salud during the period 2005-2010 (group 1) and samples sent to the Laboratorio Departamental de Salud Pública de Antioquia during the 2008-2009 period were included in this study (group 2). Serum samples were analyzed by immunoassay with commercial kits.
Results: From the 344 analyzed samples, 8.7% were positive for anti-HEV; the frequency of anti-HEV IgM was 1.74% (6/344) and the frequency of anti-HEV IgG was 7.5% (26/344). A difference in frequency of anti-HEV between group 1 (6.3%) and group 2 (1.3%) was observed. The cases were identified in nine departments of Colombia.
Conclusions: This is the first study of hepatitis E virus infection in patients with diagnosis of hepatitis in Colombia. The frequency of anti-HEV described in this population of patients in Colombia is similar to that described in other Latin American countries like Brazil, Perú and Uruguay. Considering the results of this study, it could be necessary to include hepatitis E virus infection serological markers in the differential diagnosis of viral hepatitis in Colombia.
Key words: Hepatitis E, hepatitis viruses, antibodies.
http://dx.doi.org/10.7705/biomedica.v34i3.2236
El virus de la hepatitis E (HEV) es un virus emergente de importancia global. Se estima que en el 2005 se presentaron 20,1 millones de casos de hepatitis E en África y en Asia, de los cuales 3,4 millones fueron casos sintomáticos, 70.000, casos fatales y 3.000, casos de aborto. Es de anotar que estos dos continentes representan 71 % de la población mundial y en ellos se encuentran los países endémicos para la infección por HEV (1,2).
La epidemiología de la infección por el HEV muestra dos patrones. El primero es un patrón epidémico que se presenta en regiones de alta endemia debido al consumo de agua contaminada con materia fecal, como es el caso de África y Asia. El segundo es un patrón esporádico asociado al consumo de agua contaminada y de carne cruda o mal cocida de animales infectados como el cerdo. Este patrón se describió inicialmente en países industrializados, pero también se ha descrito en países en vías de desarrollo (1-4).
El HEV está clasificado en la familia Hepeviridae como el único miembro del género Hepevirus (5); su genoma es una cadena sencilla de ARN de sentido positivo de 7,5 kb, aproximadamente, que codifica tres marcos de lectura abierta, ORF1, ORF2 y ORF3 ( Open Reading Frame , ORF) (6).
Con base en la caracterización molecular de aislamientos de HEV, específicamente de la secuencia ORF2 del genoma viral, se han identificado cuatro genotipos. Los genotipos 1 y 2 se han aislado exclusivamente de muestras de origen humano obtenidas frecuentemente durante epidemias. Los genotipos 3 y 4 se han aislado en casos esporádicos de hepatitis en humanos, así como de muestras de animales domésticos y salvajes (7-9).
El cuadro clínico de la hepatitis E es generalmente benigno, pero puede presentarse falla hepática en 1 a 2 % de los casos. Sin embargo, se ha descrito una mortalidad por HEV hasta de 40 % en mujeres en gestación con infección causada por el genotipo 1 del HEV (10-12). Por otro lado, se ha documentado el desarrollo de hepatitis crónica en pacientes inmunosuprimidos infectados con el genotipo 3 del HEV, como es el caso de aquellos sometidos a esquema de inmunosupresión por trasplante de órganos y de los tratados con quimioterapia (13,14).
Los estudios en poblaciones de países industrializados han encontrado una prevalencia de inmunoglobulina G (IgG) anti-HEV de entre 3 y 21,3 % (15-19). En los estudios epidemiológicos de América Latina se ha encontrado una seroprevalencia similar a la reportada en Europa, Japón y Estados Unidos. Aunque se documentaron dos epidemias de HEV en México entre 1986 y 1987, la seroprevalencia descrita en tres estudios correspondió a 1,6 % en mujeres gestantes, a 6,3 % en voluntarios y a 10,4 % en adultos jovenes y niños, lo que no difiere de lo reportado en otros países de la región. No se han reportado nuevos brotes en este país, sin embargo, en el contexto mundial, México sigue siendo considerado un país endémico para HEV (3,20).
En donantes de sangre de América Latina se ha reportado una frecuencia de anticuerpos de tipo IgG anti-HEV en un rango de 2 a 16,2 %, porcentajes discriminados por país así: 2 a 7,5 % en Brasil (21-25), 16,2 % en Bolivia (26), 8 % en Chile (27), 1,4 % en Cuba (28) y 1,2 % en Uruguay (29).
Por otra parte, en grupos de población rural de Brasil, Bolivia y Venezuela se han descrito prevalencias de entre 2,1 y 7,3 % (30-32), mientras que en la población general de Cuba y Brasil se han reportado prevalencias en un rango entre 3,3 y 5,3 % (25,33).
También se han hecho algunos estudios en población indígena en Bolivia, Venezuela y Chile, en los cuales se ha demostrado una seropositividad para HEV entre 5,4 y 20,1 % (27,32,34,35). En trabajos realizados en Chile y Perú en grupos de riesgo, como trabajadores de la salud, presidiarios y operarios del sistema de agua y alcantarillado, se detectaron anticuerpos anti-HEV en un rango de 7,5 a 12,5 % de las muestras (36).
En Colombia los casos con diagnóstico clínico de hepatitis basado en el criterio médico se someten a la detección de los marcadores de infección por el virus de la hepatitis A (HAV), el virus de la hepatitis B (HBV) y el virus de la hepatitis C (HCV). En un porcentaje variable de los casos, el diagnóstico clínico de la hepatitis viral no se ve confirmado por la detección de los marcadores serológicos, lo que genera problemas en el manejo de los pacientes y frente a la decisión sobre el tratamiento más adecuado.
Actualmente, la detección de marcadores para la infección por HEV no hace parte del protocolo de diagnóstico y manejo de las hepatitis virales establecido en los lineamientos de las autoridades de salud de Colombia, por lo cual los casos de infección por este virus nunca se han reportado en el país; por lo tanto, se desconoce la epidemiología de la infección por HEV. El único dato de que se dispone es un reciente estudio en muestras provenientes de 98 trabajadores de fincas porcinas del Valle de Aburrá, departamento de Antioquia, en el que se demostró la presencia de IgG anti-HEV en 11,25 % de las muestras (37).
Teniendo en cuenta las evidencias epidemiológicas y moleculares de la circulación del HEV en los países de la región, así como las condiciones socioeconómicas, el acceso limitado al agua potable y la baja cobertura de alcantarillado en ciertas regiones de Colombia, es imperativo llevar a cabo estudios en diferentes poblaciones del país para conocer la epidemiología de la infección por HEV, máxime cuando el diagnóstico y el manejo de las hepatitis virales en Colombia no incluye los marcadores de infección por HEV.
Considerando estos antecedentes, se hizo un estudio descriptivo con el objetivo de determinar las seropositividad de la inmunoglobulina de tipo M (IgM) y la de tipo G (IgG) anti-HEV, en muestras de pacientes con diagnóstico clínico de hepatitis viral atendidos en 16 departamentos del país y notificados a las instancias pertinentes del sistema oficial de salud. Las muestras bajo estudio fueron remitidas al Instituto Nacional de Salud y al Laboratorio de Salud Pública de Antioquia para la confirmación serológica del diagnóstico clínico de hepatitis viral.
Materiales y métodos
Tipo de estudio
Se hizo un estudio retrospectivo con muestras de suero previamente recolectadas y clasificadas en dos grupos. El grupo 1 incluyó las muestras de pacientes con diagnóstico clínico de hepatitis viral, remitidas al Instituto Nacional de Salud del 2005 al 2010 para la determinación de los marcadores serológicos de la infección por HAV, HBV y HCV. Las muestras se obtuvieron de pacientes atendidos en centros de salud y hospitales de los departamentos de Amazonas, Boyacá, Caldas, Caquetá, Casanare, Cauca, Córdoba, Cundinamarca, Meta, Putumayo, Risaralda, Sucre, Valle, Vaupés y Vichada durante el periodo en mención. El grupo 2 incluyó las muestras obtenidas de pacientes con diagnóstico clínico de hepatitis viral atendidos en centros de salud y hospitales del municipio de Medellín, departamento de Antioquia, y remitidas al Laboratorio Departamental en el periodo comprendido entre junio del 2008 y julio del 2009, para la detección de marcadores serológicos de infección por HAV, HBV y HCV.
Para la selección de las muestras se utilizaron dos criterios de inclusión: las muestras provenientes de pacientes con diagnóstico clínico de hepatitis viral basado en signos y síntomas como ictericia, náuseas, vómito, hepatomegalia y fiebre, y las muestras remitidas al Instituto Nacional de Salud o al Laboratorio Departamental para confirmación del diagnóstico de hepatitis viral por medio del análisis de los marcadores serológicos de infección por HAV, HBV y HCV. Para las muestras del grupo 2 se tuvo en cuenta un criterio adicional, que los pacientes tuvieran 15 años de edad o más.
Todos los métodos y procedimientos fueron revisados por los comités institucionales de ética del Instituto Nacional de Salud y de la Universidad de Antioquia.
Muestras
Se incluyeron 344 muestras de suero: en el grupo 1, las remitidas al Instituto Nacional de Salud (253 muestras), y en el grupo 2, las remitidas al Laboratorio Departamental de Salud Pública (91 muestras). Todas las muestras del grupo 1 dieron resultado negativo para los marcadores serológicos del HAV (Murex Anti-HAV IgM Annar Diagnostica, Hepavase MA-96 Anti-HAV IgM, Biotech Products), del HBV (VIDAS® HBs Ag Ultra y Confirmación) y del HCV (VIDAS® Anti-HBc Total II, Genedia® HCV ELISA 3.0).
De las muestras del grupo 2, todas tuvieron una serología negativa para el HCV (anti-HCV, inmunoensayo enzimático de micropartículas, AxSYM, Abbott) y para el HBV (HbsAg, inmunoensayo enzimático de micropartículas, AxSYM, Abbott). Con respecto al marcador de infección aguda por HAV, este dio negativo en 68,1 % (62/91) (IgM anti-HAV, inmunoensayo de micropartículas, AxSYM, Abbott) y positivo en 31,9 % (29/91) de las muestras.
Anticuerpos anti-HEV
Las muestras de suero se almacenaron en alícuotas a - 20 o C luego de su recepción en el Instituto Nacional de Salud y en el Laboratorio Departamental. Las muestras se analizaron por duplicado utilizando inmunoensayos para la detección de anticuerpos del tipo IgG anti-HEV e IgM anti-HEV (Dia.Pro, Milán, Italia); estos inmunoensayos comerciales utilizan antígenos sintéticos específicos del HEV de las regiones conservadas e inmunodominantes de las proteínas codificados por los ORF2 y ORF3 de aislamientos de los genotipos 1 y 2. Las muestras se consideraron reactivas cuando la razón entre la densidad óptica (DO=450 nm) y el valor de corte (M/Co) era mayor de 1,1; indeterminadas, cuando el valor se encontraba entre 0,9 y 1,1; y no reactivas, cuando era menor de 0,9, de acuerdo con los criterios de interpretación de la casa comercial.
Análisis estadístico
Se calculó la seropositividad de los anticuerpos IgM e IgG anti-VHE y se hicieron un análisis univariado y uno bivariado de las variables con el paquete estadístico SPSS, versión 18.
Resultados
En este estudio se incluyeron 344 muestras de suero provenientes de pacientes con diagnóstico clínico de hepatitis viral atendidos en 16 departamentos de Colombia; todas estas muestras habían sido remitidas al Instituto Nacional de Salud (grupo 1) o al Laboratorio Departamental de Salud Pública (grupo 2) para la confirmación serológica del diagnóstico de hepatitis viral (figura 1).

En el grupo 1 se incluyeron 253 muestras prove nientes de pacientes atendidos entre el 2005 y el 2010 en centros de salud y hospitales de los departamentos de Amazonas (n=13), Boyacá (n=20), Caldas (n=2), Caquetá (n=5), Casanare (n=9), Cauca (n=4), Córdoba (n=23), Cundinamarca (n=3), Meta (n=1), Putumayo (n=59), Risaralda (n=18), Sucre (n=36), Valle (n=7), Vaupés (n=1) y Vichada (n=52). Es de anotar que 67 % de las muestras provenía de pacientes atendidos en cuatro de estos departamentos: Putumayo (23 %), Vichada (21 %), Sucre (14 %) y Córdoba (9 %).
En el grupo 2 se incluyeron 91 muestras provenientes de pacientes atendidos en centros de salud y hospitales del municipio de Medellín entre junio del 2008 y julio del 2009, y remitidas al Laboratorio Departamental (figura 1).
La edad media de los pacientes fue de 25,2 años, con una mediana de 23 años y un rango intercuartílico de 16 a 33 años. Según la distribución por sexo, 54,8 % de los pacientes correspondió al sexo masculino y 41,8 %, al femenino, en tanto que 9,8 % de las muestras no contaba con la información sobre el sexo. Al discriminar estas cifras por grupo, en el grupo 1 se presentó un rango de edad de 5 a 84 años, con una mediana de 21 años, y un rango intercuartílico de entre 12 y 33, y en el grupo 2, un rango de edad de 15 a 79 años, con una mediana de 23 y un rango IC de entre 16 y 34.
Detección de anticuerpos anti-HEV
En 30 (8,7 %) muestras de las 344 analizadas, se detectaron anticuerpos anti-HEV; de estas, 1,74 % (6/344) presentó el marcador IgM anti-HEV, y 7,5 % (26/344), el marcador IgG anti-HEV (cuadro 1). El total de muestras analizadas provenía de pacientes con cuadro clínico indicativo de hepatitis viral; sin embargo, solo seis muestras presentaron el marcador de infección aguda por HEV (IgM anti-HEV) (cuadro 1).
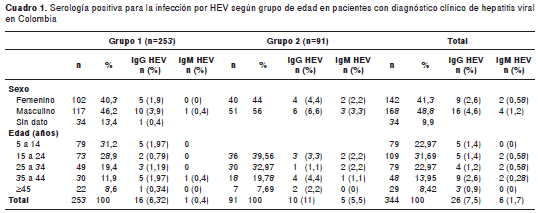
En el grupo 1 la frecuencia de IgG anti-HEV fue de 6,3 % (16/253) y, de IgM anti-HEV, de 0,4 % (1/253); la muestra positiva para IgM presentó también el marcador de tipo IgG. En el grupo 2 se demostró una frecuencia de IgG anti-HEV de 10,9 % (10/91), y de IgM anti-HEV, de 5,5 % (5/91); en estas muestras se incluyó un suero que presentó los dos marcadores anti-HEV: IgG e IgM (cuadro 1).
Los casos con marcadores positivos de infección por HEV se encontraron en nueve de los 16 departamentos de la población de estudio: Vichada, Putumayo, Sucre, Boyacá, Córdoba, Valle, Cauca, Risaralda y Antioquia (municipio de Medellín).
El rango de edad de los pacientes con marcadores de infección por HEV fue de 5 a 62 años, con un promedio de 29,8 años, mediana de 28,5 años y rango intercuartílico de 21 a 39 años (cuadro 2). En 11,5 % de las muestras del grupo 2 se demostró la presencia de los marcadores positivos para IgG anti-VHE e IgM anti-HAV (p=0,7). Ninguna de las muestras con marcador positivo para IgM anti-HEV presentó el marcador de infección aguda por HAV (p=0,6).
Al ajustar por edad y marcador serológico, se encontró una diferencia estadísticamente significativa en el marcador IgM anti-HEV entre el grupo 1 y el grupo 2; sin embargo, para el marcador IgG anti-HEV no se observaron diferencias. Aunque en principio no se esperaba encontrar diferencias en los factores de riesgo de los dos grupos, se debe tener en cuenta que el rango de edad fue diferente (grupo 1: 5 a 84 años, grupo 2: 15 a 79 años) y que 31,9 % (29/91) de las muestras del grupo 2 fueron positivas para el marcador de infección por HAV, mientras que 100 % de las muestras del grupo 1 fueron negativas para este marcador. Estas diferencias se debieron al sistema de muestreo de cada grupo.
Discusión
La hepatitis viral de transmisión entérica es una causa importante de morbilidad y mortalidad en el mundo. Según la Organización Mundial de la Salud (OMS), se estima en más de 100 millones la cifra anual de casos de hepatitis A y, en 20 millones, la de los casos de hepatitis E (1-4,38). Gracias a los programas de vacunación contra la hepatitis A y al mejoramiento de los sistemas de abastecimiento de agua y de saneamiento, se ha disminuido en forma ostensible el número de casos de infección por HAV a nivel mundial y se ha logrado establecer la evolución de los patrones de endemia (39).
El virus de las hepatitis E fue reconocido como agente etiológico en 1980 y, aunque existen numerosos estudios, la epidemiología de la infección no está bien documentada en todos los países. Las áreas del mundo con alta incidencia de infección por HEV son países en desarrollo, principalmente de Asia y África. América Latina se considera una región de baja endemia, con excepción de México. La infección por HEV se ha descrito en diferentes poblaciones de Brasil (21-25,30,38), Argentina (39,40), Venezuela (32,35,41), Bolivia (26,31,34,42), Chile (27,43), Cuba (28,33), Guatemala (44), Honduras (44), México (45,46), Nicaragua (47), Perú (36) y Uruguay (29); además, se han caracterizado aislamientos de HEV en muestras de origen humano y de origen animal en la región (48-53).
En el presente estudio se analizaron 344 muestras de suero de pacientes con diagnóstico clínico de hepatitis viral. Se detectaron anticuerpos IgG e IgM anti-HEV en 8,7 % (30/344) de las muestras, lo que permitió identificar casos de hepatitis E en nueve departamentos del país, es decir, en buena parte del territorio nacional.
La frecuencia de los marcadores serológicos de infección por HEV (IgM e IgG) difirió según el grupo, siendo de 6,3 % en el grupo 1 y de 15,3 % en el grupo 2. Esta diferencia puede deberse al perfil de los pacientes de cada grupo, ya que en el grupo 1 se incluyeron muestras de niños; la frecuencia de IgG anti-HEV en el grupo 1 fue de 2 % (5/79), y de 6,3 % (11/174) en las muestras de pacientes de 5 a 14 años y de 15 a 84 años, respectivamente.
Teniendo en cuenta el pico de incidencia de la infección por HEV en pacientes de 15 a 35 años de edad descrito en la literatura científica, en el grupo 2 se incluyeron muestras de pacientes con 15 años o más de edad (54,55). Una diferencia adicional entre los grupos consistió en que 31,9 % (29/91) de las muestras del grupo 2 fueron positivas para el marcador de infección aguda por HAV (IgM anti-HAV), muestras que no se excluyeron en el presente análisis. Es de anotar que las 253 muestras del grupo 1 correspondieron a casos de hepatitis no A, no B, no C; la diferencia en esta variable puede haber influido en la seropositividad para la infección por HEV.
Por último, las muestras del grupo 1 se obtuvieron entre 2005 y 2010, mientras que las muestras del grupo 2 se obtuvieron entre 2008 y 2009; en principio, estas ventanas de observación tienen los mismos criterios de notificación de la hepatitis viral establecidos por el Ministerio de Salud; sin embargo, puede haber diferencias en la calidad del sistema de notificación entre los diversos departamentos. Además, se deben tener en cuenta las condiciones de remisión de las muestras desde lugares remotos y el tiempo de conservación de más de cinco años de algunas de ellas.
El análisis de los datos sugiere que en Colombia la infección por HEV se presenta predominantemente en adultos jóvenes (menores de 30 años) y en menor proporción en los niños (34,4 Vs. 7,4 %). Estos resultados coinciden con los datos publicados sobre la seroprevalencia para la infección por HEV en niños menores de 10 años y en adultos. Arankalle, et al. , describieron una seroprevalencia de la infección por HEV de 8 % en niños menores de 10 años, comparada con 40 % en adultos mayores, en población asintomática de la India (54); por otra parte, Assis, et al. , demostraron la presencia del marcador IgG anti-HEV en el 4,5 % de los niños de 2 a 9 años de edad del municipio de Mato Grosso, Brasil (30). En otro estudio, Munne, et al. , encontraron una frecuencia de IgM anti-HEV de 8,5 % en niños argentinos con hepatitis viral aguda (51,52). Es de anotar que India es un país endémico, y que Argentina y Brasil son países con un patrón no endémico para la infección por HEV.
Si se analiza la seropositividad encontrada en el presente estudio, la frecuencia de anticuerpos anti-HEV (IgM e IgG) descrita en el grupo 1 (6,3 %) podría ser comparable con la frecuencia de marcadores de infección por HEV descrita en dos estudios en pacientes con hepatitis no A, no B, no C en Brasil (1,5 y 2,1 %) (24,53); es de anotar que en el estudio de Lopes de Santos se demostró la presencia de los dos marcadores de infección por HEV (IgM e IgG), además de la amplificación del genoma viral en 1/64 muestras de suero analizadas (53). Una frecuencia similar se describió en pacientes de la Policlínica de Nutrición y Digestivo en Uruguay (2,8 %) y en una cohorte de pacientes con diagnóstico de hepatitis no A, no B, no C atendidos en dos ciudades de Perú (2,53 %) (29,55).
De otra parte, el grupo 2 presentó una frecuencia de seropositividad para HEV de 15,1 %, similar a la reportada en pacientes con diagnóstico de hepatitis no A, no B, no C, en estudios llevados a cabo en Perú (15,1,% de IgG anti-HEV) (55) y en Brasil (17 % de IgG anti-HEV), siendo este último un estudio centinela de hepatitis (56).
Por último, en estudios de Cuba, Venezuela y Chile se han descrito frecuencias de marcadores de infección por HEV entre 29,1 y 66 %. La presencia del marcador IgM anti-HEV se buscó en muestras de casos esporádicos de hepatitis no A, no B, no C de diferentes regiones de Cuba; los autores describieron una seropositividad de 33,3 % (13/39) (57). Por su parte, Hurtado, et al. , analizaron 78 muestras de casos con diagnóstico presuntivo de hepatitis viral remitidas al Hospital Clínico Universidad de Chile, 66 % (35/53) de las cuales fueron positivas para el marcador IgG anti-HEV y, de estas, 34 % (12/35) presentaron, además, el marcador IgM anti-HEV (58). En un estudio en Venezuela, los autores demostraron la presencia de IgM anti-HEV en 29,7 % (22/74) de las muestras provenientes de pacientes con diagnóstico clínico de hepatitis viral aguda (59).
Según los datos de seroprevalencia descritos en los diferentes estudios llevados a cabo en pacientes con hepatitis no A, no B, no C en América Latina, se podrían considerar tres rangos de seropositividad: menor de 6,3 %, entre 15 y 17 % y mayor de 29 %. Los rangos en la frecuencia de seropositividad observados en los diferentes estudios en pacientes con diagnóstico clínico de hepatitis viral en países latinoamericanos, incluido el presente estudio en Colombia, puede deberse a diferencias en los criterios de inclusión, así como en los estuches de inmunoensayo utilizados en cada trabajo; también, se deben considerar diferencias epidemiológicas dentro y entre los países (3).
Es de anotar que los estudios realizados en diversos países del mundo han encontrado inconsistencias entre los ensayos de detección de anticuerpos IgM e IgG anti-HEV, y reflejan la controversia con respecto a la cinética de dichos anticuerpos tanto en pacientes provenientes de regiones endémicas como de regiones no endémicas (60-62). Estas incongruencias pueden atribuirse a la diversidad antigénica de las proteínas recombinantes utili zadas en los inmunoensayos, a la variabilidad genética de los aislamientos del HEV y, en algunos casos, a problemas de sensibilidad y especificidad de las técnicas comerciales para la detección de los anticuerpos contra el HEV.
Como se demostró en el estudio de Huang, et al . (63), una estrategia para resolver estas limitaciones es la detección de anticuerpos IgG anti-HEV de baja avidez, los cuales podrían ser marcadores de una infección primaria en casos positivos para anticuerpos IgM anti-HEV, mientras que demostrar el aumento en el título de anticuerpos IgG anti-HEV en ausencia de anticuerpos IgM anti-HEV e IgG de baja avidez, sugeriría la presencia de una reinfección; sin embargo, para un análisis de este tipo se requieren dos muestras del paciente obtenidas durante la fase aguda y la etapa de convalecencia, lo que no siempre es posible (63).
Además, varios autores han reportado resultados falsos positivos de IgM anti-HEV (64-66), lo que complica incluso más el panorama de la interpretación de estos marcadores. Lo ideal sería incluir el análisis para la detección del genoma del HEV en muestras de suero y de materia fecal para la confirmación del diagnóstico, pero no en todos los casos es posible. Recientemente se publicó un trabajo liderado por la OMS y el grupo de estudio colaborativo del HEV, cuyo objetivo había sido evaluar un control para las pruebas de reacción en cadena de la polimerasa con transcripción inversa ( Reverse Transcription Polymerase Chain Reaction, RT - PCR ) para la detección del genoma del HEV como confirmación del diagnóstico de casos de hepatitis E (67). Este control podría utilizarse en los laboratorios de diagnóstico para la detección del genoma viral.
Con respecto a la infección concomitante por HAV y HEV, no se logró demostrar la presencia simultánea de los marcadores de infección aguda de estos virus hepatotrópicos en ninguna de las 29 muestras del grupo 2. Sin embargo, en 11,5 % (3/29) de las muestras analizadas se detectaron marcadores IgM anti-HAV e IgG anti-HEV (cuadro 2). Este número de muestras posiblemente limitó la probabilidad de detectar casos de infección simultánea con estos dos virus hepatotrópicos de transmisión fecal y oral.
Un dato similar se describió en un estudio de casos esporádicos de hepatitis viral en Cuba; los autores reportaron una frecuencia de 12,8 % de infección concomitante (IgM anti-HEV y anti-HAV) (57). En el estudio de Gutiérrez, et al ., en Venezuela, la frecuencia de IgM anti-HEV fue muy similar entre el grupo de pacientes con marcador de infección aguda por HAV (IgM anti-HAV), con 31 %, y el grupo de negativos para este marcador de hepatitis A, con 29 % (59).
La seroprevalencia de la infección por HEV en muestras de pacientes con diagnóstico de hepatitis y con marcador de infección aguda por HAV, también se ha explorado en estudios en Brasil (56) y Chile (58); los autores detectaron marcadores de infección aguda por HAV y HEV en 10 y 20 % de las muestras analizadas, respectivamente. Además, en la investigación llevada a cabo en Brasil, un estudio centinela de hepatitis en la ciudad de Salvador de Bahia, se demostró una prevalencia de IgG anti-HEV de 38 % en las muestras de pacientes con hepatitis A (56).
La caracterización de aislamientos virales a partir de muestras de pacientes con diagnóstico de hepatitis viral, ha permitido demostrar la circulación del genotipo 3 del HEV en Brasil (53), Argentina (51), Uruguay (68,69), Bolivia (42) y Venezuela (59). Aunque el genotipo 3 del HEV predomina en la región, también se han identificado algunos aislamientos del genotipo 1. Los resultados preliminares de un estudio en pacientes con diagnóstico clínico de hepatitis viral atendidos en el municipio de Medellín, permitió la identificación de casos con el genotipo 3 del HEV, lo que coincide con lo hallado en otros países de la región. Ese estudio aporta evidencia adicional sobre la importancia del HEV como agente etiológico de la hepatitis en Colombia (Rendón JC, et al. Conference abstract: First report of Hepatitis E Virus (genotype 3) infection in Colombia. IUMS 2011. Sapporo, Japón).
La caracterización del genotipo 3 del HEV es de máxima importancia si se tiene en cuenta que también se ha identificado en muestras de origen animal, en particular en ganado porcino. Algunos estudios en Costa Rica (70), Brasil (71-73) y Argentina, aportan evidencia sobre la infección causada por el genotipo 3 del HEV en porcinos, tal como ya se ha descrito en Europa y en Norteamérica (74).
Los trabajadores de granjas porcinas constituyen una población de riesgo, como lo han señalado, entre otros, da Silva, et al . (75). El único estudio publicado en Colombia en este sentido, se refiere a la detección de anticuerpos IgG anti-HEV en trabajadores de fincas porcinas en el Valle de Aburrá, departamento de Antioquia. La presencia de este marcador de la infección por HEV se encontró en 11,25 % (11/98) de las muestras de individuos con este factor de exposición (37). Un hallazgo similar fue descrito por da Silva, et al ., en población rural de Mato Grosso, Brasil, con una frecuencia de 8,4 % (75).
El departamento de Antioquia es reconocido como el principal productor de ganado porcino en Colombia, pues cuenta con el mayor número de granjas porcinas del país (76). De alguna manera, este hecho podría tener relación con la mayor frecuencia de infección por HEV encontrada en el grupo 2, dado que en dicho grupo se incluyeron las muestras obtenidas de pacientes del municipio de Medellín. Sin embargo, se necesitan estudios adicionales para confirmar este hallazgo.
Este estudio representa el primer reporte de infección por HEV en pacientes con diagnóstico de hepatitis en Colombia. Con base en los resultados obtenidos, se confirmó la presencia de casos de hepatitis E en nueve departamentos del territorio colombiano. La seropositividad para HEV descrita en esta población de pacientes en Colombia, es similar a la descrita en otros países de América Latina, como Brasil, Perú y Uruguay. Estos hallazgos ameritan que las autoridades de salud del país consideren la inclusión de los marcadores de infección por HEV en el diagnóstico de la hepatitis viral en Colombia.
Los autores declaran que no tienen conflicto de intereses.
Este proyecto fue financiado por el Departamento Administrativo de Ciencia, Tecnología e Innovación, Colciencias (1115 408 20570), la Vicerrectoría de Investigación de la Universidad de Antioquia (Proyecto Sostenibilidad) y el Instituto Nacional de Salud.
Correspondencia: María Cristina Navas, Grupo de Gastrohepatología, Facultad de Medicina, Universidad de Antioquia, Calle 70 N° 52-21, Medellín, Colombia Teléfono: (574) 219 6573; fax: (574) 219 6565 maria.navas@udea.edu.co
1. Rein DB, Stevens GA, Theaker J, Wittenborn JS, Wiersma ST. The global burden of hepatitis E virus genotypes 1 and 2 in 2005. Hepatology. 2012;55:988-97. http://dx.doi.org/10.1002/hep.25505 [ Links ]
2. Aggarwal R, Jameel S. Hepatitis E. Hepatology. 2011;54: 2218-26. http://dx.doi.org/10.1002/hep.24674 [ Links ]
3. Echevarría JM, González JE, Lewis-Ximénez LL, Dos Santos DR, Munné MS, Pinto MA, et al . Hepatitis E virus infection in Latin America: A review. J Med Virol. 2013;85:1037-45. http://dx.doi.org/1037-45.10.1002/jmv.23526 [ Links ]
4. Kmush B, Wierzba T, Krain L, Nelson K, Labrique AB. Epidemiology of hepatitis E in low- and middle-income countries of Asia and Africa. Semin Liver Dis. 2013;33:15-29. http://dx.doi.org/10.1055/s-0033-1338111 [ Links ]
5. ICTV. Virus Taxonomy: 2009 Release: ICTV; 2010. Fecha de consulta: 7 de enero de 2011. Disponible en: http://www.ictvonline.org/virusTaxonomy.asp?version=2009. [ Links ]
6. Tam AW, Smith MM, Guerra ME, Huang CC, Bradley DW, Fry KE, et al . Hepatitis E virus (HEV): Molecular cloning and sequencing of the full-length viral genome. Virology. 1991;185:120-31. http://dx.doi.org/10.1016/0042-6822(91)90760-9 [ Links ]
7. Lu L, Li C, Hagedorn CH. Phylogenetic analysis of global hepatitis E virus sequences: Genetic diversity, subtypes and zoonosis. Rev Med Virol. 2006;16:5-36. http://dx.doi.org/10.1002/rmv.482 [ Links ]
8. Okamoto H. Genetic variability and evolution of hepatitis E virus. Virus Research. 2007;127:216-28. http://dx.doi.org/10.1016/j.virusres.2007.02.002 [ Links ]
9. Worm HC, van der Poel WH, Brandstatter G. Hepatitis E: An overview. Microbes Infect. 2002;4:657-66. http://dx.doi.org/10.1016/S1286-4579(02)01584-8 [ Links ]
10. Navaneethan U, Al Mohajer M, Shata MT. Hepatitis E and pregnancy: Understanding the pathogenesis. Liver Int. 2008;28:1190-9. http://dx.doi.org/10.1111/j.1478-3231.2008.01840.x [ Links ]
11. Rasheeda CA, Navaneethan U, Jayanthi V. Liver disease in pregnancy and its influence on maternal and fetal mortality: A prospective study from Chennai, Southern India. Eur J Gastroenterol Hepatol. 2008;20:362-4. http://dx.doi.org/10.1097/MEG.0b013e3282f246d6 [ Links ]
12. Strand RT, Franque-Ranque M, Bergström S, Weiland O. Infectious aetiology of jaundice among pregnant women in Angola. Scand J Infect Dis. 2003;35:401-3. [ Links ]
13. Haagsma EB, van den Berg AP, Porte RJ, Benne CA, Vennema H, Reimerink JH, et al . Chronic hepatitis E virus infection in liver transplant recipients. Liver Transpl. 2008;14:547-53. http://dx.doi.org/110.1002/lt.21480 [ Links ]
14. Kamar N, Izopet J, Rostaing L. Hepatitis E virus infection. Curr Opin Gastroenterol. 2013;29:271-8. http://dx.doi.org/10.1097/MOG.0b013e32835ff238. [ Links ]
15. Ding X, Li TC, Hayashi S, Masaki N, Tran TH, Hirano M, et al . Present state of hepatitis E virus epidemiology in Tokyo, Japan. Hepatol Res. 2003;27:169-73. [ Links ]
16. Boutrouille A, Bakkali-Kassimi L, Crucière C, Pavio N. Prevalence of anti-hepatitis E virus antibodies in French blood donors. J Clin Microbiol. 2007;45:2009-10. http://dx.doi.org/10.1128/JCM.00235-07 [ Links ]
17. Buti M, Domínguez A, Plans P, Jardí R, Schaper M, Espuñes J, et al . Community-based seroepidemiological survey of hepatitis E virus infection in Catalonia, Spain. Clin Vaccine Immunol. 2006;13:1328-32. http://dx.doi.org/10.1128/CVI.00255-06 [ Links ]
18. Mansuy JM, Legrand-Abravanel F, Calot JP, Peron JM, Alric L, Agudo S, et al . High prevalence of anti-hepatitis E virus antibodies in blood donors from South West France. J Med Virol. 2008;80:289-93. http://dx.doi.org/10.1002/jmv.21056 [ Links ]
19. Thomas DL, Yarbough PO, Vlahov D, Tsarev SA, Nelson KE, Saah AJ, et al . Seroreactivity to hepatitis E virus in areas where the disease is not endemic. J Clin Microbiol. 1997;35:1244-7. [ Links ]
20. Velázquez O, Stetler HC, Ávila C, Ornelas G, Álvarez C, Hadler SC, et al . Epidemic transmission of enterically transmitted non-A, non-B hepatitis in Mexico, 1986-1987. JAMA. 1990;263:3281-5. http://dx.doi.org/0.1001/jama.1990.03440240071018 [ Links ]
21. Bortoliero AL, Bonametti AM, Morimoto HK, Matsuo T, Reiche EM. Seroprevalence for hepatitis E virus (HEV) infection among volunteer blood donors of the Regional Blood Bank of Londrina, State of Parana, Brazil. Rev Inst Med Trop Sao Paulo. 2006;48:87-92. http://dx.doi.org/10.1590/S0036-46652006000200006 [ Links ]
22. Goncales NS, Pinho JR, Moreira RC, Saraceni CP, Spina AM, Stucchi RB, et al . Hepatitis E virus immunoglobulin G antibodies in different populations in Campinas, Brazil. Clin Diagn Lab Immunol. 2000;7:813-6. http://dx.doi.org/10.1128/CDLI.7.5.813-816.2000 [ Links ]
23. Parana R, Cotrim HP, Cortey-Boennec ML, Trepo C, Lyra L. Prevalence of hepatitis E virus IgG antibodies in patients from a referral unit of liver diseases in Salvador, Bahia, Brazil. Am J Trop Med Hyg. 1997;57:60-1. [ Links ]
24. Trinta KS, Liberto MI, de Paula VS, Yoshida CF, Gaspar AM. Hepatitis E virus infection in selected Brazilian populations. Mem Inst Oswaldo Cruz. 2001;96:25-9. http://dx.doi.org/10.1590/S0074-02762001000100004 [ Links ]
25. Carrilho FJ, Mendes Clemente C, Silva LC. Epidemiology of hepatitis A and E virus infection in Brazil. Gastroenterol Hepatol. 2005;28:118-25. [ Links ]
26. Konomi N, Miyoshi C, La Fuente Zerain C, Li TC, Arakawa Y, Abe K. Epidemiology of hepatitis B, C, E, and G virus infections and molecular analysis of hepatitis G virus isolates in Bolivia. J Clin Microbiol. 1999;37:3291-5. [ Links ]
27. Ibarra H, Riedemann S, Reinhardt G, Frieck P, Siegel F, Toledo C, et al . Prevalence of hepatitis E virus antibodies in blood donors and other population groups in southern Chile. Rev Med Chil. 1997;125:275-8. http://dx.doi.org/10.1046/j.1365-3156.1999.00457.x [ Links ]
28. Lemos G, Jameel S, Panda S, Rivera L, Rodríguez L, Gavilondo JV. Hepatitis E virus in Cuba. J Clin Virol. 2000;16:71-5. http://dx.doi.org/10.1016/S1386-6532(99)00062-1 [ Links ]
29. Cruells MR, Mescia G, Gaibisso R, Ramírez M, Gutiérrez M, Kohen S, et al . Epidemiological study of hepatitis A and E viruses in different populations in Uruguay. Gastroenterol Hepatol. 1997;20:295-8. [ Links ]
30. Assis SB, Souto FJ, Fontes CJ, Gaspar AM. Prevalence of hepatitis A and E virus infection in school children of an Amazonian municipality in Mato Grosso State. Rev Soc Bras Med Trop. 2002;35:155-8. http://dx.doi.org/10.1590/S0037-86822002000200005 [ Links ]
31. Bartoloni A, Bartalesi F, Roselli M, Mantella A, Arce CC, Paradisi F, et al . Prevalence of antibodies against hepatitis A and E viruses among rural populations of the Chaco region, south-eastern Bolivia. Trop Med Int Health. 1999;4:596-601. http://dx.doi.org/10.1046/j.1365-3156.1999.00457.x [ Links ]
32. Pujol FH, Favorov MO, Marcano T, Esté JA, Magris M, Liprandi F, et al . Prevalence of antibodies against hepatitis E virus among urban and rural populations in Venezuela. J Med Virol. 1994;42:234-6. [ Links ]
33. Quintana A, Sánchez L, Larralde O, Anderson D. Prevalence of antibodies to hepatitis E virus in residents of a district in Havana, Cuba. J Med Virol. 2005;76:69-70. http://dx.doi.org/10.1002/jmv.20324 [ Links ]
34. León P, Venegas E, Bengoechea L, Rojas E, López JA, Elola C, et al. Prevalence of infections by hepatitis B, C, D and E viruses in Bolivia. Rev Panam Salud Pública. 1999;5:144-51. http://dx.doi.org/10.1590/S1020-49891999000300002 [ Links ]
35. Blitz-Dorfman L, Monsalve F, Atencio R, Porto L, Monzón M, Favorov MO, et al . Serological survey of markers of infection with viral hepatitis among the Yukpa Amerindians from western Venezuela. Ann Trop Med Parasitol. 1996;90:655-7. [ Links ]
36. Vildosola H, Colichón A, Barreda M, Piscoya J, Palacios O. Hepatitis E IgG antibodies seroprevalence in a Peruvian risk group. Rev Gastroenterol Perú. 2000;20:111-6. [ Links ]
37. Betancur CA, Mejía MV, Portillo S. Seroprevalencia de hepatitis E en trabajadores de fincas porcícolas del Valle de Aburrá 2011-2012. Acta Médica Colombiana. 2013;38:68-70. [ Links ]
38. Pang L, Alencar FE, Cerutti C, Jr., Milhous WK, Andrade AL, Oliveira R, et al . Short report: Hepatitis E infection in the Brazilian Amazon. Am J Trop Med Hyg. 1995;52:347-8. [ Links ]
39. Rey JA, Findor JA, Daruich JR, Velazco CC, Igartua EB, Schmee E, et al . Prevalence of IgG Anti-HEV in Buenos Aires, a nonendemic area for hepatitis E. J Travel Med. 1997;4:100-1. http://dx.doi.org/10.1111/j.1708-8305.1997.tb00788.x [ Links ]
40. Fainboim H, González J, Fassio E, Martínez A, Otegui L, Eposto M, et al . Prevalence of hepatitis viruses in an anti-human immunodeficiency virus-positive population from Argentina. A multicentre study. J Viral Hepat. 1999;6:53-7. http://dx.doi.org/10.1046/j.1365-2893.1999.t01-1-6120135.x [ Links ]
41. Pujol FH, Rodríguez I, Martínez N, Borberg C, Favorov MO, Fields HA, et al . Viral hepatitis serological markers among pregnant women in Caracas, Venezuela: Implication for perinatal transmission of hepatitis B and C. GEN. 1994;48:25-8. [ Links ]
42. Dell'Amico MC, Cavallo A, Gonzáles JL, Bonelli SI, Valda Y, Pieri A, et al . Hepatitis E virus genotype 3 in humans and swine, Bolivia. Emerg Infect Dis. 2011;17:1488-90. http://dx.doi.org/10.3201/eid1708.100769 [ Links ]
43. Ibarra H, Riedemann S, Siegel F, Toledo C, Reinhardt G. Acute hepatitis caused by virus A, E and non A-E in Chilean adults. Rev Med Chil. 2001;129:523-30. http://dx.doi.org/10.4067/S0034-98872001000500008 [ Links ]
44. Gambel JM, Drabick JJ, Seriwatana J, Innis BL. Seroprevalence of hepatitis E virus among United Nations Mission in Haiti (UNMIH) peacekeepers, 1995. Am J Trop Med Hyg. 1998;58:731-6. [ Links ]
45. Álvarez-Muñoz MT, Torres J, Damasio L, Gómez A, Tapia-Conyer R, Muñoz O. Seroepidemiology of hepatitis E virus infection in Mexican subjects 1 to 29 years of age. Arch Med Res. 1999;30:251-4. http://dx.doi.org/10.1016/S0188-0128(99)00019-6 [ Links ]
46. Bernal R, Licona JE. Seroepidemiology of hepatitis E in the State of Hidalgo. Rev Gastroenterol Mex. 1996;61:233-8. [ Links ]
47. Pérez OM, Morales W, Paniagua M, Strannegard O. Prevalence of antibodies to hepatitis A, B, C, and E viruses in a healthy population in León, Nicaragua. Am J Trop Med Hyg. 1996;55:17-21. [ Links ]
48. García CG, Sánchez D, Villalba MC, Pujol FH, de Los Angeles Rodríguez Lay L, Pinto B, et al . Molecular characterization of hepatitis E virus in patients with acute hepatitis in Venezuela. Journal of Medical Virology. 2012;84: 1025-9. http://dx.doi.org/10.1002/jmv.23277 [ Links ]
49. Schlauder GG, Frider B, Sookoian S, Castaño GC, Mushahwar IK. Identification of 2 novel isolates of hepatitis E virus in Argentina. J Infect Dis. 2000;182:294-7. http://dx.doi.org/10.1086/315651 [ Links ]
50. Mirazo S, Ramos N, Russi JC, Gagliano G, Arbiza J. Detection and molecular characterization of sporadic cases of acute human hepatitis E virus infection in Uruguay. Arch Virol. 2011;156:1451-4. http://dx.doi.org/10.1007/s00705- 011-0991-2 [ Links ]
51. Munne MS, Altabert NR, Vladimirsky SN, Moreiro R, Mares LO, Soto SS, et al . Identifications of polyphyletic variants in acute hepatitis suggest an underdiagnosed circulation of hepatitis E virus in Argentina. J Clin Virol. 2011;52:138-41. http://dx.doi.org/10.1016/j.jcv.2011.06.015 [ Links ]
52. Munne MS, Vladimirsky S, Otegui L, Brajterman L, Castro R, Soto S, et al . Molecular characterization of hepatitis E virus in three acute liver failure cases in children in Argentina. Acta Gastroenterol Latinoam. 2006;36:125-30. [ Links ]
53. Lopes Dos Santos DR, Lewis-Ximénez LL, da Silva MF, de Sousa PS, Gaspar AM, Pinto MA. First report of a human autochthonous hepatitis E virus infection in Brazil. J Clin Virol. 2010;47:276-9. http://dx.doi.org/10.1016/j.jcv.2009.12.021 [ Links ]
54. Arankalle VA, Tsarev SA, Chadha MS, Alling DW, Emerson SU, Banerjee K, et al . Age-specific prevalence of antibodies to hepatitis A and E viruses in Pune, India, 1982 and 1992. J Infect Dis. 1995;171:447-50. http://dx.doi.org/10.1093/infdis/171.2.447 [ Links ]
55. Hyams KC, Yarbough PO, Gray S, Callahan J, Gotuzzo E, Gutiérrez J, et al . Hepatitis E virus infection in Peru. Clin Infect Dis. 1996;22:719-20. http://dx.doi.org/10.1093/clinids/22.4.719 [ Links ]
56. Lyra AC, Pinho JR, Silva LK, Sousa L, Saraceni CP, Braga EL, et al . HEV, TTV and GBV-C/HGV markers in patients with acute viral hepatitis. Braz J Med Biol Res. 2005;38:767-75. http://dx.doi.org/10.1590/S0100-879X2005000500015 [ Links ]
57. Rodríguez L, Quintana A, Villalba MC, Lemos G, Corredor MB, Moreno AG, et al . Dual infection with hepatitis A and E viruses in outbreaks and in sporadic clinical cases: Cuba 1998-2003. J Med Virol. 2008;80:798-802. http://dx.doi.org/10.1002/jmv.21147 [ Links ]
58. Hurtado C, Muñoz G, Brahm J. Detection of IgM antibodies against hepatitis E virus. Rev Med Chil. 2005;133:645-7. http://dx.doi.org/10.4067/S0034-98872005000600004 [ Links ]
59. García CG, Sánchez D, Villalba MC, Pujol FH, Rodríguez L, Pinto B, et al . Molecular characterization of hepatitis E virus in patients with acute hepatitis in Venezuela. J Med Virol. 2012;84:1025-9. http://dx.doi.org/10.1002/jmv.23277 [ Links ]
60. Bendall R, Ellis V, Ijaz S, Ali R, Dalton H. A comparison of two commercially available anti-HEV IgG kits and a re-evaluation of anti-HEV IgG seroprevalence data in developed countries. J Med Virol. 2010;82:799-805. http://dx.doi.org/10.1002/jmv.21656 [ Links ]
61. Drobeniuc J, Meng J, Reuter G, Greene-Montfort T, Khudyakova N, Dimitrova Z, et al . Serologic assays specific to immunoglobulin M antibodies against hepatitis E virus: Pangenotypic evaluation of performances. Clin Infect Dis. 2010;51:e24-7. http://dx.doi.org/10.1086/654801 [ Links ]
62. Rossi-Tamisier M, Moal V, Gerolami R, Colson P. Discrepancy between anti-hepatitis E virus immunoglobulin G prevalence assessed by two assays in kidney and liver transplant recipients. J Clin Virol. 2013;56:62-4. http://dx. doi.org/10.1016/j.jcv.2012.09.010 [ Links ]
63. Huang S, Zhang X, Jiang H, Yan Q, Ai X, Wang Y, et al . Profile of acute infectious markers in sporadic hepatitis E. PLoS One. 2010;5:e13560. http://dx.doi.org/10.1371/journal.pone.0013560 [ Links ]
64. Meky FA, Stoszek SK, Abdel-Hamid M, Selim S, Abdel-Wahab A, Mikhail N, et al . Active surveillance for acute viral hepatitis in rural villages in the Nile Delta. Clin Infect Dis. 2006;42:628-33. http://dx.doi.org/10.1086/500133 [ Links ]
65. Fogeda M, Avellón A, Cilla CG, Echevarría JM. Imported and autochthonous hepatitis E virus strains in Spain. J Med Virol. 2009;81:1743-9. http://dx.doi.org/10.1002/jmv.21564 [ Links ]
66. Kim HS, Jeong SH, Jang JH, Myung HJ, Kim JW, Bang SM, et al. Coinfection of hepatitis A virus genotype IA and IIIA complicated with autoimmune hemolytic anemia, prolonged cholestasis, and false-positive immunoglobulin M anti-hepatitis E virus: A case report. Korean J Hepatol. 2011;17:323-7. http://dx.doi.org/10.3350/kjhep.2011.17.4.323 [ Links ]
67. Baylis SA, Blümel J, Mizusawa S, Matsubayashi K, Sakata H, Okada Y, et al . World Health Organization International standard to harmonize assays for detection of hepatitis E virus RNA. Emerg Infect Dis. 2013;19:729-35. http://dx.doi.org/10.3201/eid1905.121845 [ Links ]
68. Mirazo S, Ramos N, Russi JC, Gagliano G, Arbiza J . Detection and molecular characterization of sporadic cases of acute human hepatitis E virus infection in Uruguay. Arch Virol. 2011;156:1451-4. http://dx.doi.org/10.1007/s00705-011-0991-2 [ Links ]
69. Mirazo S, Ramos N, Russi JC, Arbiza J. Genetic heterogeneity and subtyping of human hepatitis E virus isolates from Uruguay. Virus Res. 2013;173:364-70. http://dx.doi.org/10.1016/j.virusres.2013.01.005 [ Links ]
70. Kase JA, Correa MT, Luna C, Sobsey MD. Isolation, detection and characterization of swine hepatitis E virus from herds in Costa Rica. Int J Environ Health Res. 2008;18:165-76. http://dx.doi.org/10.1080/09603120701498311 [ Links ]
71. Vitral CL, Pinto MA, Lewis-Ximénez LL, Khudyakov YE, dos Santos DR, Gaspar AM. Serological evidence of hepatitis E virus infection in different animal species from the Southeast of Brazil. Mem Inst Oswaldo Cruz. 2005;100:117- 22. http://dx.doi.org/10.1590/S0074-02762005000200003 [ Links ]
72. dos Santos DR, Vitral CL, de Paula VS, Marchevsky RS, Lopes JF, Gaspar AM, et al . Serological and molec- ular evidence of hepatitis E virus in swine in Brazil. Vet J. 2009;182:474-80. http://dx.doi.org/10.1016/j.tvjl.2008.08.001 [ Links ]
73. Gardinali NR, Barry AF, Otonel RA, Alfieri AF, Alfieri AA. Hepatitis E virus in liver and bile samples from slaughtered pigs of Brazil. Mem Inst Oswaldo Cruz. 2012;107:935-9. http://dx.doi.org/10.1590/S0074-02762012000700016 [ Links ]
74. Scobie L, Dalton HR. Hepatitis E: Source and route of infection, clinical manifestations and new developments. J Viral Hepat. 2013;20:1-11. http://dx.doi.org/10.1111/jvh.12024 [ Links ]
75. Silva SM, Oliveira JM, Vitral CL, Vieira KeA, Pinto MA, Souto FJ. Prevalence of hepatitis E virus antibodies in individuals exposed to swine in Mato Grosso, Brazil. Mem Inst Oswaldo Cruz. 2012;107:338-41. http://dx.doi.org/10.1590/S0074-02762012000300007 [ Links ]
76. DANE. Ficha técnica del censo de la actividad porcícola tecnificada en Colombia. 2003. Fecha de consulta: 27 de febrero de 2014. Disponible en: http://www.dane.gov.co/files/investigaciones/agropecuario/ena/I-Censo_Porcicola_2003.pdf. [ Links ]













