Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.34 no.3 Bogotá July/Sept. 2014
https://doi.org/10.7705/biomedica.v34i3.2191
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v34i3.2191
1 Grupo de Investigación en Enfermedades Neurodegenerativas, Departamento de Salud Animal, Facultad de Medicina Veterinaria y Zootecnia, Universidad del Tolima, Ibagué, Colombia
2 Grupo de Investigación en Modelos Experimentales para las Ciencias Zoohumanas, Departamento de Biología, Facultad de Ciencias, Universidad del Tolima, Ibagué, Colombia
Contribución de los autores:
Lina María De los Reyes: realización de los experimentos y obtención de los datos
Ángel Enrique Céspedes: estandarización y realización del modelo de isquemia cerebral, revisión y análisis de los resultados
Ambos autores participaron en la discusión del documento y la escritura del manuscrito.
Recibido: 08/11/13; aceptado: 02/04/14
Introducción. El accidente cerebrovascular es la segunda causa de muerte y la primera de discapacidad en el mundo, y más de 85 % es de origen isquémico.
Objetivo. Evaluar en un modelo de infarto cerebral por embolia arterial el efecto de la atorvastatina y el meloxicam, administrados por separado y de forma conjunta, sobre la respuesta neuronal, los astrocitos y la microglia.
Materiales y métodos. Se sometieron ratas Wistar a embolia de la arteria carótida y a tratamiento con meloxicam y atorvastatina, administrados por separado y conjuntamente, a las 6, 24, 48 y 72 horas. Se evaluó la reacción de las proteínas COX-2, GFAP y OX-42 en las neuronas, los astrocitos y la microglia mediante inmunohistoquímica y estudios morfológicos y de densitometría. Los datos obtenidos se evaluaron por medio de un análisis de varianza y de pruebas no paramétricas de comparación múltiple.
Resultados. La isquemia cerebral por embolia arterial incrementó significativamente (p<0,001) la reacción de los astrocitos y la microglia, en tanto que la atorvastatina y el meloxicam, administrados por separado y de forma conjunta, la redujeron. La isquemia produjo acortamiento de las proyecciones de los astrocitos, engrosamiento celular, ruptura de las expansiones protoplásmicas (clasmatodendrosis) y cambios morfológicos en la microglia propios de diversas etapas de actividad. En las zonas circundantes del foco se incrementó la reacción inmunológica de la COX-2 y se redujo en el foco isquémico, en tanto que el meloxicam y la atorvastatina redujeron significativamente (p<0,001) la reacción inmunológica en la zona circundante del foco, restableciendo la marcación de la ciclooxigenasa en el foco isquémico.
Conclusión. La combinación de meloxicam y atorvastatina atenúa la respuesta de los astrocitos y la microglia en el proceso inflamatorio posterior a la isquemia cerebral por embolia arterial, reduciendo la degeneración neuronal y restableciendo el equilibrio morfológico y funcional del tejido nervioso.
Palabras clave: astrocitos, ciclooxigenasa, isquemia encefálica, microglia.
http://dx.doi.org/10.7705/biomedica.v34i3.2191
Atorvastatin-meloxicam association inhibits neuroinflammation and attenuates the cellular damage in cerebral ischemia by arterial embolism.
Introduction: Stroke is the second leading cause of death and the first cause of disability in the world, with more than 85% of the cases having ischemic origin.
Objective: To evaluate in an embolism model of stroke the effect of atorvastatin and meloxicam on neurons, astrocytes and microglia. This evaluation was done administering each medication individually and in association.
Materials and methods: Wistar rats were subjected to carotid arterial embolism and treatment with meloxicam and atorvastatin at 6, 24, 48 and 72 hours. Using immunohistochemistry, we evaluated the immunoreactivity of COX-2 protein, GFAP and OX-42 in neurons, astrocytes and microglia by densitometric and morphological studies. Data were evaluated by variance analysis and non-parametric multiple comparison.
Results: Cerebral ischemia by arterial embolism increased significantly the reactivity of microglia and astrocytes (p<0.001), whereas it was reduced by atorvastatin, meloxicam and their association. Ischemia produced astrocytic shortening, cellular thickening, protoplasmic rupture expansions (clasmatodendrosis) and microglial morphological changes characteristic of various activity stages. In perifocal areas, immunoreactivity of COX-2 was increased and in the ischemic focus it was reduced, while meloxicam and atorvastatin significantly reduced (p<0.001) perifocal immunoreactivity, restoring the marking of cyclooxygenase in the ischemic focus.
Conclusion: These results suggest that the meloxicam-atorvastatin association attenuates astrocytic and microglial response in the inflammatory process after cerebral ischemia by arterial embolism, reducing neurodegeneration and restoring the morphological and functional balance of nervous tissue .
Key words: astrocytes, cyclooxygenase, brain ischemia, microglia.
http://dx.doi.org/10.7705/biomedica.v34i3.2191
El accidente cerebrovascular es la segunda causa de muerte en el mundo (1,2), y más 85 % de los casos son de tipo isquémico (3,4). La isquemia cerebral es ocasionada por la oclusión de una arteria principal, lo que interrumpe el flujo de sangre al cerebro e instaura un fallo energético por disminución del aporte de oxígeno y glucosa, por la alteración en la producción del trifosfato de adenosina ( adenosine triphosphate , ATP) y de los gradientes iónicos, así como por la liberación de elevadas cantidades de glutamato. El glutamato liberado en exceso en el espacio extracelular lleva a la muerte neuronal por excitotoxicidad debido al estímulo de los receptores, al aumento del calcio intracelular y a la acidosis metabólica establecida, lo cual contribuye al daño isquémico y a la activación de proteínas y enzimas que participan en los procesos de la muerte celular (4-6).
En el proceso inflamatorio del cerebro diversos factores solubles pueden mediar, influenciar y regular la actividad de las neuroglias y las neuronas; además, en fases tempranas, se activan los astrocitos y la microglia, y esta última migra hacia el sitio del daño y libera citocinas proinflamatorias (7).
Los astrocitos son el tipo de célula más numeroso en el cerebro y se encuentran involucrados dinámicamente en la transmisión sináptica, la homeostasis iónica y metabólica, la respuesta inflamatoria, la producción de antioxidantes, el soporte trófico de las neuronas, así como en el establecimiento y mantenimiento de la barrera hematoencefálica; además, cumplen una función protectora mediante la captación de iones y neurotransmisores del espacio extracelular que ayudan a limitar el daño excitotóxico en las neuronas vecinas (6-9).
Los astrocitos responden activamente a las seña les enviadas por las neuronas, el endotelio y la microglia, siendo una característica prominente la gliosis reactiva en respuesta a un daño; los astrocitos reactivos experimentan cambios en su morfología y en la expresión de diversas moléculas, entre ellas, la proteína acídica fibrilar de la neuroglia ( Glial Fibrillary Acidic Protein , GFAP), la cual es sobrerregulada, coincidiendo con la hipertrofia celular (8-10).
Por otro lado, la microglia corresponde a la línea celular inmunoefectora del cerebro, cuya actividad se encuentra regulada por las condiciones del ambiente que la rodean. Normalmente, las células de la microglia se caracterizan por poseer un cuerpo celular pequeño desde el cual proyectan prolongaciones finas y ramificadas con una baja expresión de antígenos de superficie. Durante la lesión cerebral, la microglia experimenta cambios rápidos en su programa efector, transformando su morfología, proliferando y liberando componentes proinflamatorios, e incrementando la expresión de antígenos de superficie inmunomoduladores (7,11). Los cambios en el ambiente cerebral inducidos por la isquemia generan variadas respuestas fisiopatológicas en la microglia, las cuales se evidencian en la transformación de una microglia vigilante en una en estado reactivo; entre estas respuestas se encuentra el aumento de la expresión de algunas moléculas de superficie como la integrina CD11b (OX-42), la cual se considera un indicador de la activación de la microglia. Asimismo, en una primera etapa de activación, la microglia cambia morfológicamente sin llegar a ser fagocítica, pero en caso de presentarse degeneración neuronal, puede transformarse en una célula con estas características (7,11). Además de la activación de las células de la neuroglia, durante la isquemia cerebral se incrementa la liberación de factores solubles mediadores de la inflamación, entre estos las prostaglandinas, que son producidas por la actividad enzimática de la ciclooxigenasa (COX) a partir del ácido araquidónico (12).
Existen dos isoformas principales de la COX, la COX-1, que se expresa constitutivamente en la mayoría de los tejidos, y la COX-2, usualmente inducida por estímulos inflamatorios (forma inducible). En el cerebro, la COX-2 se expresa constitutivamente y representa la principal iso forma bajo condiciones fisiológicas (13,14). En condiciones basales se ha demostrado que la COX-2 es un importante mediador en la transmisión de las sinapsis excitadoras glutamatérgicas, la potenciación a largo plazo y la plasticidad sináptica; sin embargo, siendo una enzima inducible, la expresión y la actividad de la COX-2 aumentan mucho frente a los estímulos proinflamatorios y de activación de los receptores del N-metil-D- aspartato (NMDA) (14,15).
Aunque se ha logrado avanzar sustancialmente en el conocimiento de la fisiopatología de la isquemia cerebral, aún deben aclararse muchos de los eventos celulares y subcelulares que se suscitan en las neuronas, la neuroglia y la microglia. De otra parte, existen pocas alternativas terapéuticas aprobadas para el tratamiento de la isquemia cerebral, con excepción del factor activador del plasminógeno tisular recombinante ( Recombinant Tissue Plasminogen Activator, rt-PA) y ciertos fármacos trombolíticos de variada eficacia (16).
Por estas razones, es necesario buscar nuevas alternativas de tratamiento para la isquemia cerebral, entre las cuales la asociación farmacológica de un inhibidor selectivo de la COX-2 (meloxicam) y un fármaco inhibidor de una enzima pivote en la síntesis del colesterol (atorvastatina) ha demostrado favorecer la recuperación tisular y reducir el daño neuronal mediante diversos mecanismos (17).
Esta investigación tuvo como objetivo principal evaluar, en un modelo de infarto cerebral por embolia arterial, el efecto de la atorvastatina y el meloxicam, administrados por separado y de forma combinada, sobre la respuesta celular de las neuronas, los astrocitos y la microglia por medio de los biomarcadores COX-2, GFAP y OX-42, determinando los patrones de reacción inmunológica de estas proteínas en el tejido isquémico.
Materiales y métodos
Animales de experimentación
Se utilizaron 32 ratas Wistar hembra con 211±15 g de peso, mantenidas bajo condiciones controladas de bioterio a una temperatura de 22±2 °C, con 70±5 % de humedad relativa, ciclos de luz y oscuridad de 12 horas, agua ad libitum y ración diaria de alimento (15 g por animal). Los procedimientos experimentales se efectuaron siguiendo las normas internacionales de protección y manejo de animales de laboratorio (18) y atendiendo a lo señalado en la Ley 84 de 1989 sobre protección animal en Colombia y la Resolución 8430 de 1993. La investigación fue aprobada por el Comité Local de Ética de la Universidad del Tolima.
Diseño experimental
Los animales se distribuyeron aleatoriamente en cuatro grupos experimentales (n=20) y cuatro grupos de control (n=12). Los animales de los grupos experimentales (1 a 4) se sometieron a isquemia cerebral por embolia arterial y los controles (isquemia simulada) se intervinieron quirúrgicamente pero no fueron sometidos a embolia (grupos 5 a 8). A los animales de los grupos 1 y 5 se les administró meloxicam (2,5 mg/kg), a los de los grupos 2 y 6, atorvastatina cálcica (10 mg/kg) y a los de los grupos 3 y 7, una combinación de meloxicam (2,5 mg/kg) y atorvastatina (10 mg/kg), en tanto que a los de los grupos 4 y 8 se les administró carboximetilcelulosa como placebo. En todos los casos, las dosis se diluyeron en 2 ml de solución salina y se administraron mediante una sonda esofagogástrica curva abotonada N° 18 (para rata). Las dosis fueron administradas a las 6, 24, 48 y 72 horas después de la cirugía, tanto a los animales isquémicos como a aquellos con isquemia simulada.
Anestesia
Los procedimientos quirúrgicos se realizaron bajo anestesia somática profunda mediante la combinación de xilacina al 2 % (5 mg/kg) y ketamina al 5 % (90 mg/kg) por vía intraperitoneal; se suministró, además, sulfato de atropina 1:1000 (100 µ g/kg) por vía subcutánea, como vagolítico y protector del miocardio .
Modelo de isquemia cerebral
Los animales se intervinieron quirúrgicamente siguiendo el protocolo de Kudo, et al . (19), con algunas modificaciones propias de nuestro labo ratorio, las cuales se describen a continuación. Se expuso la arteria carótida común derecha y, en la bifurcación de la carótida interna y la externa, se colocó temporalmente una pinza microvascular de aneurisma (FST N° 00400-03) justo encima del origen de la carótida externa, y se dispuso una banda de látex alrededor de la carótida común, 15 mm por debajo de su bifurcación. A través de una microincisión en la carótida común se introdujo un catéter de poliestireno N° 24 en el cráneo a través de la carótida interna, dirigido hacia la bifurcación de la arteria cerebral media y la cerebral anterior, y en este sitio se inyectó el coágulo ya formado resuspendido en un volumen de 400 µl de solución salina isotónica (NaCl).
La preparación del coágulo se hizo in situ , siguiendo el método propuesto por Wang, et al. (20,21), con las siguientes modificaciones: se cargaron 50 µ l de sangre de la arteria carótida común mediante presión negativa con jeringuilla de 1 ml acoplada al catéter, el cual contenía 50 µ l de trombina bovina alfa (a-tb13NIH/U –HTI Lab, BCT 1020 ); después de tres minutos, se formó el coagulo, se resuspendió en 400 µl de solución salina y se inyectó lentamente por medio del catéter dirigido hacia la bifurcación arterial (cerebral media y cerebral anterior). Se retiró el catéter y se ligó la arteria carótida común craneal y caudalmente con polipropileno 4/0; luego se retiraron la pinza de aneurisma y la banda de látex, y a continuación se suturó la piel en un solo plano con nailon quirúrgico (prolene 4/0).
La temperatura corporal se controló con termómetro rectal digital durante la operación y los animales se colocaron en cajas de recuperación con agua y alimento ad libitum . El tiempo de la cirugía fue de 20 minutos, en promedio.
Perfusión y procesamiento de los cerebros
Pasadas 48 horas de la última dosis de tratamiento, los animales se sacrificaron bajo anestesia general con una mezcla de xilazina (10 mg/kg) y pentobarbital sódico (60 mg/kg), administrada por vía intraperitoneal; luego se perfundieron con solución salina isotónica (200 ml) por vía intracardiaca y avance aórtico y, posteriormente, con paraformaldehído al 4 % en solución tampón de fosfato 0,1 M pH 7,4 (200 ml). Los cerebros se extrajeron y se fijaron durante 48 horas en para-formaldehído al 4 % a 4 °C. Se obtuvieron cortes coronales de 50 µ m con vibrátomo (Vibratome 1500 ® ) y se mantuvieron en solución tampón de fosfato (PB 0,1M) a 4 °C o en preservación criogénica (-20 °C), hasta el montaje de las pruebas inmunohistoquímicas.
Pruebas inmunohistoquímicas
Como marcadores de la actividad de la neuroglia (astrocitos), se utilizó el anticuerpo contra la proteína acídica fibrilar de la neuroglia (Anti-GFAP Rabbit 1:500, Sigma), el CD11b (Anti-OX42 Mouse anti-Rat1:100 Millipore) para la microglia y anti-COX-2 (Rabbit 1:100 Abcam) como marcador de la actividad de la ciclooxigenasa 2. Se emplearon los bregmas comprendidos entre -2,8 y -3,8 para cada uno de los marcadores y las pruebas se montaron por duplicado.
La inmunohistoquímica convencional se realizó empleando la técnica del complejo avidina-biotina-peroxidasa. Los cortes se trataron con una solución de inhibición de la peroxidasa endógena durante 20 minutos (metanol: PB 0,1 M 1:1 y H 2 O 2 1 %), se lavaron tres veces con PB 0,1 M y se mantuvieron en solución de bloqueo (BSA 1 %, TritonX-1003 % y PB 0,1 M) durante 90 minutos a temperatura ambiente y, a continuación, se incubaron con el anticuerpo primario diluido en solución de incubación (Triton X-100 0,3 %, BSA 0,3 %, PB 0,1M) a 4 °C durante toda una noche; posteriormente, previo lavado con PB 0,1 M, se incubaron en los anticuerpos secundarios correspondientes (Goat anti-Rabbit 1:400 y Goat anti-Mouse 1:200 Thermo Scientific) por 120 minutos a temperatura ambiente y seguidamente con el complejo avidina-biotina-peroxidasa (1:250 A y 1:250 B) durante 120 minutos a temperatura ambiente, manteniéndolos protegidos de la luz y en agitación constante ( shaker ); después de tres lavados con PB 0,1 M, se reveló con el cromógeno diamino-bencidina (DAB 1,8 mg/ml - H 2 O 2 0,02 %).
Los cortes se montaron en láminas gelatinizadas, se secaron a temperatura ambiente durante 24 horas y se sometieron a deshidratación por gradiente creciente de alcoholes (70, 96, 100 %) y xileno; finalmente, se cubrieron con laminillas y sellante resinoso ( Consult mount ).
Obtención y procesamiento de las imágenes
Para la evaluación de la reacción de las células de la neuroglia (astrocitos y microglia) y de la enzima ciclooxigenasa 2, se tomaron fotografías de los cortes en el hemisferio ipsilateral. La reacción inmunológica se registró fotográficamente en microscopio óptico (Motic BA210 ® ) y cámara digital (Moticam 2000 ® ). Las imágenes digitales se proce saron con el software Fiji-Image J 1.45 (NIH) por densitometría y cuantificación en unidades relativas.
Análisis de los datos
Los datos se procesaron mediante análisis de varianza (ANOVA) no paramétrica y comparación múltiple entre medias de tratamientos (Dunns) una vez hechos la prueba de homogeneidad de varianzas y el test de normalidad. Los datos se analizaron con el programa Graph Pad (Prism v. 5.0) y se expresaron como la media ± error estándar. El nivel de significación se fijó en p<0,05 .
Resultados
Infarto por embolia arterial
La embolia de la arteria cerebral media, producida con el empleo de la trombina bovina alfa (a-tb), resultó en un infarto similar al de los modelos focales, que afectó principalmente la corteza cerebral y, en algunas ocasiones, el cuerpo estriado y el hipocampo. Las zonas infartadas se evaluaron en experimentos previos mediante la tinción con cloruro de trifenil-tetrazolio ( tryphenil tetrazolium chloride , TTC) (no se presentan los datos).
Reacción de los astrocitos
Se evaluó el efecto de la isquemia y de los tratamientos sobre la reacción de los astrocitos en diversos territorios encefálicos (zona CA1 del hipocampo, corteza somatosensorial y putamen caudado), 120 horas después de la cirugía. En la zona CA1 del hipocampo se encontró un aumento en la reacción de los astrocitos, aunque sin diferencias significativas entre los grupos de animales isquémicos y con isquemia simulada (no se presentan los datos).
Por el contrario, en la corteza somatosensorial la reacción inmunológica de la GFAP fue evidente en los animales isquémicos comparados con aquellos con isquemia simulada (figura 1A), mostrando una distribución diferencial de los astrocitos. En esta zona se encontraron diferencias significativas entre los grupos de animales con isquemia tratados con placebo (*p<0,05), los isquémicos tratados con meloxicam (**p<0,01), con atorvastatina (IA) (***p<0,001) y con la combinación de meloxicam y atorvastatina (***p<0,001), frente al grupo con isquemia simulada tratado con placebo (figura 1D). Además, se observaron cambios morfológicos en los astrocitos, con aumento del tamaño del cuerpo celular y retracción de las proyecciones; particularmente en aquellos con isquemia tratados con placebo, se evidenció la presencia de restos celulares (figura 1C, 1-2) .
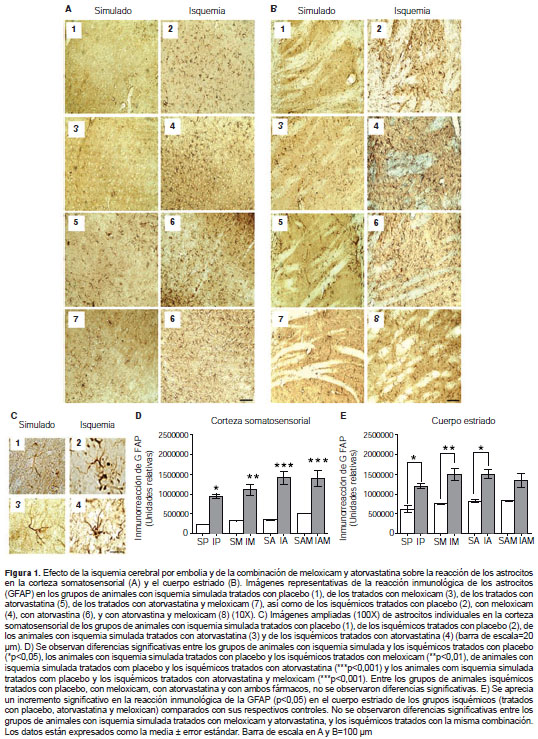
Por otro lado, los astrocitos de los grupos de animales con isquemia tratados con meloxicam, de los tratados con atorvastatina y de los tratados con la combinación de ambos fármacos, mantuvieron sus proyecciones con menor retracción y presentaron menos restos celulares (figura 1C, 3-4). Igualmente, en el cuerpo estriado se hallaron diferencias significativas entre los grupos de animales con isquemia tratados con placebo y de aquellos con isquemia simulada tratados con placebo (*p<0,05), entre los isquémicos y aquellos con isquemia simulada tratados con meloxicam (**p<0,01), y los grupos de animales con isquemia y con isquemia simulada tratados con atorvastatina (*p<0,05), excepto cuando se trató del grupo de isquémicos tratados con la combinación de atorvastatina y meloxicam (figura 1B,1E).
Reacción de la microglia
Aunque se evaluaron varios territorios encefálicos como la corteza somatosensorial, el hipocampo, el cuerpo estriado, los núcleos talámicos, la zona paraventricular, el tracto óptico y el cuerpo calloso, fue en la fimbria del hipocampo donde se evidenciaron cambios constantes en la reacción de la microglia 120 horas después de la isquemia, mientras que en las otras zonas evaluadas la distribución de la microglia varió entre los individuos y su activación dependió de si la zona era parte del foco isquémico (figura 2C). En esta zona se observó una acentuada reacción de la microglia en los grupos isquémicos (tratados con placebo, con meloxicam y con atorvastatina y meloxicam) comparados con los controles (figura 2A).
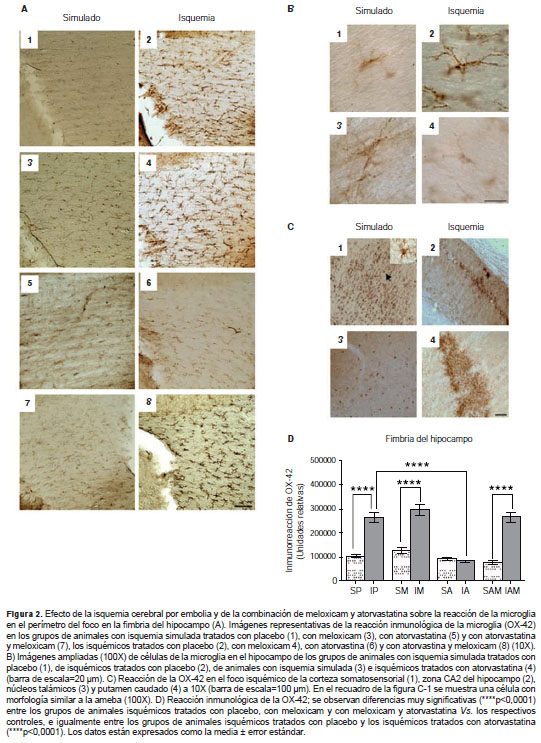
Asimismo, se hallaron diferencias muy significativas en la reacción de la microglia entre los isquémicos y aquellos con isquemia simulada tratados con placebo (****p<0,0001), entre los animales con isquemia simulada y los isquémicos tratados con meloxicam (****p<0,0001), entre los animales con isquemia simulada y los isquémicos tratados con la combinación de atorvastatina y meloxicam (****p<0,0001), y entre los isquémicos tratados con placebo y los tratados con atorvastatina (****p<0,0001) (figura 2D).
Contrariamente a lo observado en los grupos isquémicos tratados con meloxicam y con la combinación de meloxicam y atorvastatina, el tratamiento con atorvastatina disminuyó la marca ción inmunológica de la OX42, a tal punto que la reacción de la microglia en respuesta a la isquemia mostró un comportamiento similar al de los grupos de animales con isquemia simulada tratados con placebo (figura 2A1, A6). Además, se observaron cambios morfológicos representados en el acortamiento de las proyecciones y el aumento del cuerpo celular (figura 2, B2). En el foco isquémico y en las zonas limítrofes, se encontraron diferentes grados de transformación morfológica de la microglia, desde formas ramificadas y estados intermedios hasta formas similares a la ameba.
Reacción inmunológica de la ciclooxigenasa 2
Se encontró una distribución de la reacción inmunológica de la enzima COX-2 en todos los sectores y capas corticales, así como en el hipocampo (giro dentado y CA3), de los grupos de animales con isquemia simulada. Al comparar el grupo de animales isquémicos tratados con placebo y aquellos con isquemia simulada tratados con placebo, se observó una disminución de la reacción de la enzima en zonas muy definidas del foco y un incremento en las zonas limítrofes del foco isquémico y en las zonas de penumbra, tales como la corteza somatosensorial primaria y el giro dentado del hipocampo (figura 3A1-2, 3B 1-2).
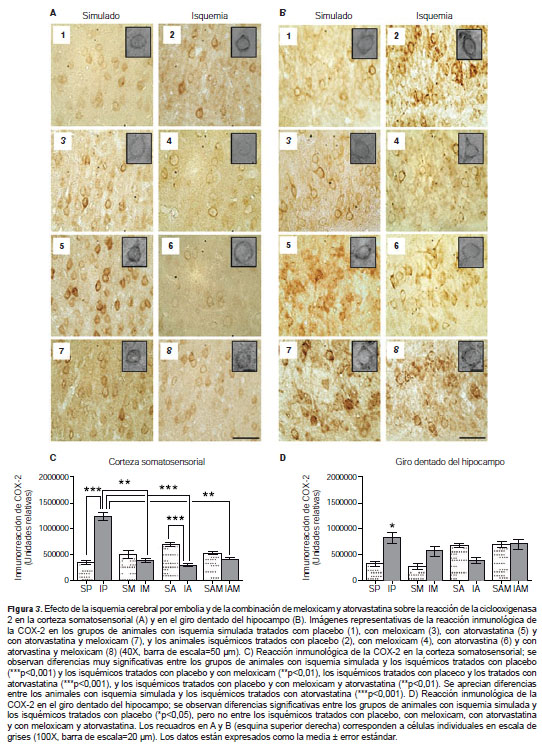
En la corteza somatosensorial primaria del grupo de isquémicos tratados con placebo, se observó reacción excesiva de la COX-2 con diferencias muy significativas en relación con el grupo con isquemia simulada tratado con placebo (***p<0,001). En los grupos tratados se evidenció una marcada reducción en la reacción inmunológica de la COX-2, lo que difiere sustancialmente de lo observado en el grupo de isquémicos tratados con placebo frente a los grupos de isquémicos tratados con meloxicam (**p<0,01), de isquémicos tratados con atorvastatina (***p<0,001) y de isquémicos tratados con la combinación de los dos fármacos (**p<0,01) (figura 3C). Igualmente, se observaron diferencias significativas entre los grupos con isquemia simulada y el de isquémicos tratados con atorvastatina (***p<0,001) (figura 3C), notándose una mayor reacción de la COX-2 en el grupo de animales con isquemia simulada tratados con atorvastatina que en el de isquémicos tratados con el mismo fármaco .
En el giro dentado del hipocampo solo se evidenciaron diferencias entre los grupos con isquemia simulada y de isquémicos tratados con placebo (*p<0,05) (figura 3D). Aunque no se advirtieron diferencias con respecto al placebo en los grupos tratados, sí se pudo observar una tendencia a la disminución de la reacción de la COX-2 en los grupos isquémicos tratados con meloxicam, atorvastatina y con la combinación de ambos fármacos (figura 3B 2, 4, 6, 8). Además, se observó que, al igual que en la corteza somatosensorial, el efecto de la atorvastatina en el giro dentado tendió a aumentar la reacción de la enzima en el grupo con isquemia simulada (figura 3B, 5 ).
Discusión
Los patrones de distribución de las lesiones observadas en la corteza y, ocasionalmente, en el cuerpo estriado y el hipocampo, fueron simila res a los descritos por otros autores en el modelo de isquemia por embolia arterial (21) y en el modelo focal de oclusión temporal de la arteria cerebral media (22,23). En ambos modelos, las lesiones concuerdan con las que se observan en humanos como resultado de la oclusión de la arteria cerebral media o de alguna de sus ramas (19), lo que coincide con lo descrito en esta investigación.
En este estudio se evidenciaron los cambios de la actividad en los astrocitos y la microglia subsiguientes a la isquemia cerebral, lo cual se relaciona con la modulación de las proteínas GFAP y OX-42. El aumento significativo en la reacción de la proteína GFAP en la corteza somatosensorial y en el cuerpo estriado coincide con lo descrito por Stoll, et al. (24), quienes manifiestan que la sobreexpresión de esta proteína es una de las características más relevantes de la respuesta de los astrocitos frente a la isquemia cerebral, junto con su hipertrofia e hiperplasia (24); además, el aumento del tamaño del cuerpo celular y del engrosamiento de las proyecciones de los astrocitos observados en el grupo de animales isquémicos tratados con placebo, con reacción positiva y astrocitos fragmentados, puede interpretarse como daño celular de la neuroglia (clasmatodendrosis) asociado a la pérdida de su integridad como consecuencia de la acidosis celular (25).
De otra parte, la sobreexpresión de GFAP en astrocitos reactivos (hipertróficos) se ha relacionado con la protección neuronal, dado que los astrocitos ayudan a regular el glutamato extracelular (10).
En un estudio de Ouyang, et al. (8), se demostró que ante la disminución de oxígeno y de glucosa, los astrocitos de la zona CA1 del hipocampo reducían su capacidad para captar glutamato extracelular, lo que desembocó en un descenso en la reacción de la GFAP y en la consecuente pérdida de la función del astrocito, lo cual, a su vez, se ha relacionado con la muerte neuronal (8).
Teniendo en cuenta que el presente estudio se realizó 120 horas después de la isquemia, se observó una población heterogénea de astrocitos (funcionales y no funcionales) en el grupo de animales isquémicos tratados con placebo y es probable que los astrocitos inmunorreactivos correspondieran a células hipertróficas en proceso de captación del glutamato extracelular para garan tizar la supervivencia neuronal. En los grupos de animales isquémicos tratados con meloxicam, con atorvastatina y con la combinación de ambos la reacción de la GFAP fue significativamente mayor (p<0,01) que en los controles, aunque la morfología de los astrocitos se mantuvo homogénea, lo cual sugiere que el meloxicam, administrado por separado o en combinación con la atorvastatina, favorece la supervivencia de los astrocitos que han reaccionado a la lesión, pero que mantienen su función. Es probable que los tratamientos modulen positivamente la respuesta de los astrocitos frente al daño, manteniendo su integridad celular y conservando su capacidad como reguladores de la homeostasis.
En cuanto a la reacción de la proteína OX-42 de la microglia, esta se incrementó significativamente en los animales isquémicos a las 120 horas de la embolia. Dicha reacción se ha documentado en los estudios de otros autores sobre la isquemia cerebral experimental (26-29). El incremento en la reacción de la OX-42 se ha relacionado directamente con el proceso de activación de la microglia (26), por lo cual se supone que la detectada en este estudio estaba activa. En otro estudio (27) también fue evidente la activación de la microglia en el hipocampo (CA1, CA3 y giro dentado) en momentos similares; sin embargo, en la presente investigación no se detectó reacción de la OX-42 en estas zonas (figura 2D, 2) sino únicamente en los casos en los que el foco isquémico se extendió a ese territorio, lo cual pudo obedecer a la migración de las células de la microglia hacia el área lesionada.
Otros autores (26,28) han descrito que, después de 24 horas de haberse producido la lesión, la mayoría de las células de la microglia se encontraban en las zonas limítrofes y en el centro de la lesión, exhibiendo diferentes estados de activación representados en cambios morfológicos (retracción de las proyecciones, aumento de tamaño del cuerpo celular y morfología redondeada de tipo similar a la ameba), tal como se presentó en este estudio (figura 2 C1). Con relación a las formas similares a la ameba, se ha demostrado en otros trabajos que la proteína ED-1 se expresa en las células de la microglia en proceso de fagocitosis en el mismo sitio de la proteína OX-42 y que la transformación de las muchas ramificaciones de la microglia en una forma similar a la ameba está relacionada con un cambio de actividad orientado a iniciar el proceso de fagocitosis (30,31) .
En la fimbria del hipocampo, el aumento significativo de la reacción de la OX-42 permitió establecer una morfología primordialmente ramificada, lo cual se ha relacionado en otros estudios con un fenotipo de protección neuronal (28) y como parte de los procesos de plasticidad neuronal (26,31) y remodelación sináptica, orquestando un equilibrio entre la formación de sinapsis y la muerte neuronal en los territorios lesionados (32,33). Esto puede indicar que la microglia ramificada probablemente es la responsable del mantenimiento de las sinapsis entre las redes neuronales que c onectan el hipocampo con otras zonas cerebrales. La ausencia de las formas similares a la ameba y la presencia de las formas ramificadas de la microglia representan una señal favorable para la integridad de los cordones axonales que cruzan hacia diversos territorios estableciendo la red sináptica.
Simultáneamente con el incremento en la reacción de la GFAP y la OX-42 por efecto de la isquemia cerebral, se aumentó significativamente la reacción de la enzima COX-2, principalmente en la corteza somatosensorial primaria y en el giro dentado del hipocampo, lo cual concuerda con lo reportado por otros autores, quienes encontraron una inducción dramática de la enzima COX-2 en las zonas aledañas al foco (34-37).
El aumento en la reacción de la COX-2 se ha asociado a la activación de la isoforma inducible de la enzima, vinculada a la elevación de prostaglandinas proinflamatorias como la PGE2 que median en los procesos de daño neuronal, plasticidad sináptica aberrante y respuestas inmunitarias e inflamatorias (34-38). Se ha demostrado que la activación de la isoforma inducible de la COX-2 se hace mediante la estimulación de los receptores NMDA, principalmente los extrasinápticos (37).
En el presente estudio el aumento en la reacción de la COX-2 a las 120 horas de la isquemia, probablemente correspondió a un estímulo sostenido de la activación de la isoforma inducible de la COX-2 concordante con un proceso inflamatorio persistente.
De otra parte, la actividad de la COX-2 se ha asociado a la proliferación de células progenitoras neurales bajo condiciones fisiológicas y en zonas de formación de neuronas, como la zona sub-granular del giro dentado del hipocampo, células éstas que en algunas circunstancias pueden desviarse de su vía normal hacia sitios de lesión como respuesta a un daño (39). Sasaki, et al. (40), comprobaron que la isquemia cerebral incrementa transitoriamente la formación de neuronas en el giro dentado del hipocampo y está unida a la actividad de la COX-2 en las neuronas y los astrocitos, los cuales probablemente actúan como moduladores de la proliferación de las células progenitoras neurales (40).
En el presente estudio se encontró un aumento significativo en la reacción de la COX-2 en el giro dentado en los animales isquémicos no tratados; sin embargo, en los grupos isquémicos tratados con meloxicam y atorvastatina también se encontró un incremento en la reacción de la COX-2 en esta zona, comparados con los controles pero sin diferencias entre ellos. Es posible que la persistente reacción de la COX-2 en el giro dentado en los grupos tratados se relacione con la capacidad del hipocampo para iniciar procesos de formación neuronal a partir de un estímulo lesivo, indicando, probablemente, que las células del giro dentado del hipocampo podrían favorecer los procesos de reparación tisular.
Contrariamente a lo encontrado en el hipocampo, se observó una reducción significativa en la reacción de la COX-2 en la corteza somatosensorial de los animales isquémicos tratados con meloxicam (p<0,01), con atorvastatina (p<0,001) y con la combinación de los dos fármacos (p<0,01), lo que concuerda con lo descrito por otros autores cuando se han empleado antiinflamatorios no esteroides como inhibidores selectivos y no selectivos de la enzima COX-2 (12,34). En el 2006, Gómez-Hernández, et al. (41), encontraron una disminución en la expresión de la COX-2, así como de la enzima responsable de la síntesis de la prostaglandina, la E2 (mPGE2), y de los receptores EP-1, EP-3 y EP-4 de la prostaglandina E2, en placas ateroescleróticas después del tratamiento con atorvastatina. Asimismo, en el 2010, Piermartiri, et al. (42), empleando un modelo in vitro de la enfermedad de Alzheimer, hallaron una disminución en la expresión de la COX-2 y señales de protección en las células del hipocampo frente a la peroxidación lipídica después del tratamiento con atorvastatina.
Algunos autores han señalado que la disminución en la reacción de la COX-2 durante un proceso patológico podría favorecer la supervivencia de las células neuronales y la plasticidad sináptica (12,33,40-43), y que la actividad prolongada de la COX-2 podría afectar el metabolismo del ácido araquidónico a nivel neuronal, desviando la síntesis de metabolitos benéficos hacia la producción de radicales libres (43).
En síntesis, la isquemia cerebral inducida por embolia arterial mostró patrones de reacción de los astrocitos y la microglia y focos de lesión isquémica distribuidos particularmente en la corteza somato- sensorial, el cuerpo estriado y ciertas regiones del hipocampo (CA1 y GD). Además de los cambios por reacción acentuada ya descritos, se observaron transformaciones celulares sugestivas de la sobrerregulación de las proteínas GFAP de los astrocitos y del CD11 (OX 42 de la microglia). Estos cambios se relacionan con la modificación propia de los diversos procesos de actividad de la neuroglia subsiguiente a la isquemia, incluida la reducción de dichos procesos, el incremento en la densidad de los cuerpos celulares y la transformación fenotípica, particularmente de la microglia reactiva, dejando en evidencia las formas propias de las diversas etapas de actividad de estas células implicadas en la respuesta inmunológica a las lesiones .
Simultáneamente con los cambios de reacción inmunológica de la GFAP y la OX 42, el incremento significativo en la reacción enzimática de la COX 2 ratifica los eventos fisiopatológicos ya descritos relativos a la respuesta inflamatoria a partir de la isoforma inducible. En el presente estudio, el incremento en la reacción inmunológica de la COX 2 concuerda con lo descrito por otros autores en relación con la marcación de membranas celulares activadas durante los eventos posteriores a la isquemia y la reperfusión; sin embargo, la reducción en la reacción de la COX-2 a nivel cortical por efecto de los tratamientos con meloxicam y atorvastatina, indica una respuesta propiciadora de la supervivencia en territorio isquémico, lo que concuerda con la reducción en la síntesis local de moléculas proinflamatorias como productos metabólicos potencialmente citotóxicos (38).
En conclusión, los tratamientos de la isquemia con atorvastatina y meloxicam, administrados por separado o conjuntamente, lograron reducir significativamente la reacción inmunológica de la microglia y de la forma inducible de la COX-2 y, aunque se evidenció un incremento en la reacción inmunológica de los astrocitos (positivos para GFAP), estos mantuvieron las características morfológicas típicas de las células de la neuroglia en diversas fases de su actividad en pro del equilibrio y la plasticidad celular, con lo cual se reduce el riesgo de muerte celular a las 120 horas de la isquemia y se confiere un efecto de protección neuronal al reducir la citotoxicidad en el tejido afectado y al favorecer la modulación en la actividad de la neuroglia.
Teniendo en cuenta lo expuesto, los autores consideran que la combinación de meloxicam y atorvastina favorece más la supervivencia y la modulación celular de los astrocitos y la microglia, así como la disminución de los procesos inflamatorios lesivos para el encéfalo, que su administración por separado.
Al Grupo de Investigación en Modelos Experi mentales para las Ciencias Zoohumanas, al Laboratorio de Toxicología de la Facultad de Medicina Veterinaria y Zootecnia, a los integrantes del Grupo de Investigación en Enfermedades Neurodegenerativas, END, y a la Facultad de Ciencias de la Universidad del Tolima, por su apoyo para el mantenimiento de la colonia y el uso de los laboratorios y los equipos necesarios en el desarrollo de este trabajo.
Los autores no tienen conflicto de intereses alguno relacionado con la publicación o con cualquier otro aspecto de la presente investigación.
Este trabajo fue financiado por la Oficina Central de Investigaciones y Desarrollo Científico de la Universidad del Tolima (código 150111).
Correspondencia: Ángel Enrique Céspedes, Facultad de Medicina Veterinaria y Zootecnia, Universidad del Tolima, Barrio Santa Helena Parte Alta, Ibagué, Colombia Telefax: (578) 277 1212, extensión 9220 aecesped@ut.edu.co
1. Arauz A, Ruiz-Franco A. Enfermedad vascular cerebral. Rev Fac Med Auton Mex. 2012;55:11-21. [ Links ]
2. Alwan A. Global status report on noncomunicable diseases 2010. Geneve: World Health Organization; 2011. p. 176. [ Links ]
3. Lapuente C, Rengifo C, Ávila M, Céspedes A. Regulatory effect of dimethyl sulfoxide (DMSO) on astrocytic reactivity in a murine model of cerebral infarction by arterial embolization. Colombia Médica. 2013;44:32-7. [ Links ]
4. Shen H, Wu X, Zhu Y, Sun H. Intravenous administration of Achyranthes bidentata polypeptides supports recovery from experimental ischemic stroke in vivo . PLoS One. 2013;8:e57055. http://dx.doi.org/10.1371/journal.pone.0057055 [ Links ]
5. Zhang Z-G, Sun X, Zhang Q-Z, Yang H. Neuroprotective effects of ultra-low-mol ecular-weight heparin on cerebral ischemia/reperfusion injury in rats: Involvement of apoptosis, inflammatory reaction and energy metabolism. Int J Mol Sci. 2013;14:1932-9. http://dx.doi.org/10.3390/ijms14011932 [ Links ]
6. Arango-Dávila C, Escobar-Betancourt M, Cardona- Gómez GP, Pimienta-Jiménez H. Fisiopatología de la isquemia cerebral focal: aspectos básicos y proyección a la clínica. Rev Neurol. 2004;39:156-65. [ Links ]
7. Weinstein JR, Möller T. Microglia in ischemic brain injury. Future Neurol. 2010;5:227-46. http://dx.doi.org/10.2217/fnl.10.1 [ Links ]
8. Ouyang YB, Voloboueva LA, Xu LJ, Giffard RG. Selective dysfunction of hippocampal CA1 astrocytes contribute to delayed neuronal damage after transient forebrain ischemia. J Neurosci. 2007;27:4253-60. http://dx.doi.org/10.1523/JNEUROSCI.0211-07.2007 [ Links ]
9. Li L, Lundkvist A, Andersson D, Wilhelmsson U, Nagai N, Pardo AC, et al . Protective role of reactive astrocytes in brain ischemia. J Cereb Blood Flow Metab. 2008;28:468-81. [ Links ]
10. Kang W, Héber JM. Signaling pathways in reactive astrocytes, a genetic perspective. Mol Neurobiol. 2011;43: 147-54. http://dx.doi.org/10.1007/s12035-011-8163-7 [ Links ]
11. Gehrmann J, Matsumoto Y, Kreutzberg GW. Microglia: Intrinsic immuneffector cell of the brain. Brain Res Rev. 1995;20:269-87. http://dx.doi.org/10.1016/0165-0173(94)00015-H [ Links ]
12. Hara K, Kong DL, Sharp FR, Weinstein PR. Effect of selective inhibition of cyclooxygenase 2 on temporary focal cerebral isquemia in rats. Neurosci Lett. 1998;256:53-6. http://dx.doi.org/10.1016/S0304-3940(98)00755-1 [ Links ]
13. Stefanovic B, Bosetti F, Silva AC. Modulatory role of cyclooxygenase-2 in cerebrovascular coupling. Neuro image. 2006;32:23-32. http://dx.doi.org/10.1016/j.neuroimage.2006.03.014 [ Links ]
14. Yang H, Chen C. Cyclooxygenase-2 in synaptic signaling. Curr Pharm Des. 2008;14:1443-51. http://dx.doi.org/10.2174/138161208784480144 [ Links ]
15. Chen C, Magee JC, Bazan N. Cyclooxygenase-2 regulates prostaglandin E 2 signaling in hippocampal long-term synaptic plasticity. J Neurophysiol. 2002;87:2851-7. [ Links ]
16. Fernández FJ, Hernández F, Argandoña L, Galindo MF, Segura T, Jordán J. Farmacología de la neuroprotección en el ictus isquémico agudo. Rev Neurol . 2008;47:253-60. [ Links ]
17. Céspedes A, Wandosell F, Cardona GP. P120 catenin/aN-catenin are molecular targets in the neuroprotection and neuronal plasticity mediated by atorvastatin after focal cerebral ischemia. J Neursci Res. 2010;88:3621-34. http://dx.doi.org/10.1002/jnr.22511 [ Links ]
18. National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the Care and Use of Laboratory Animals. 8th edition. Washington (DC): National Academies Press (US); 2011 . Fecha de consulta: 20 de abril de 2012. Disponible en : http://www.ncbi.nlm.nih.gov/books/NBK54050/. [ Links ]
19. Kudo M, Aoyama A, Ichimori S, Fukunaga N. An animal model of cerebral infarction. Homologous blood clot emboli in rats. Stroke. 1982;13:505-8. http://dx.doi.org/10.1161/01.STR.13.4.505 [ Links ]
20. Wang CX, Yang Y, Yang T, Shuaib A. A focal embolic model of cerebral ischemia in rats: Introduction and evaluation. Brain Research Protocols. 2001;7:115-20. http://dx.doi.org/10.1016/S1385-299X(01)00049-6 [ Links ]
21. Wang CX, Yang T, Shuaib A. An improved version of embolic model of brain ischemic injury in the rat. J Neurosci Methods. 2001;109:147-51. http://dx.doi.org/10.1016/S0165-0270(01)00408-3 [ Links ]
22. Liu F, Schafer D, McCullough L. TTC, flouro-jade B and NeuN staining confirm evolving phases of infarction induced by middle cerebral artery occlusion. J Neurosci Methods. 2009;179:1-8. http://dx.doi.org/10.1016/j.jneumeth.2008.12.028 [ Links ]
23. Popp A, Jaenisch N, Witte OW, Frahm C. Identification of ischemic regions in a rat model of stroke. PLoS One. 2009;4:e4764. http://dx.doi.org/10.1371/journal.pone.0004764 [ Links ]
24. Stoll G, Jander S, Schroeter M. Inflammation and glial responses in ischemic brain lesions. Prog Neurobiol. 1998;56:149-71. http://dx.doi.org/10.1016/S0301-0082(98)00034-3 [ Links ]
25. Hulse R, Winterfield J, Kunkler P, Kraig R. Astrocytic clasmatodendrosis in hipocampal organ culture. Glia. 2001;33:169-79. [ Links ]
26. Madinier A, Bertrand N, Mossi C, Prigent-Tessier A, Beley A, Marie C, et al . Microglial involvement in neuroplastic changes following focal brain ischemia in rats. PLoS One. 2009;4:e8101. http://dx.doi.org/10.1371/journal.pone.0008101 [ Links ]
27. Kim DH, Kim JM, Park SJ, Lee S, Yoon BH, Ryu JH. Early-activated microglia plays a role in transient forebrain ischemia-induced neural precursor proliferation in the dentate gyrus of mice. Neurosci Lett. 2010;475:74-9. http://dx.doi.org/10.1016/j.neulet.2010.03.046 [ Links ]
28. Wang J, Yang Z, Liu C, Zhao Y, Chen Y. Activated microglia provide a neuroprotective role by balancing glial cell-line derived neurotrophic factor and tumor necrosis factor-a secretion after subacute cerebral ischemia. Int J Mol Med. 2013;31:172-8. [ Links ]
29. Vinet J, van Weering H, Heinrich A, Kälin R, Wegner A, Brouner N, et al . Neuroprotective function for ramified microglia in hippocampal excitotoxicity. J Neuroinflammation. 2012;9:27. http://dx.doi.org/10.1186/1742-2094-9-27 [ Links ]
30. Jonas RA, Yuan TF, Liang YX, Jonas JB, Tay DK, Behnke E. The spider effect: Morphological and orienting classification of microglia in response to stimuli in vivo . PloS One. 2012;7:e30763. http://dx.doi.org/10.137/journal.pone.0030763 [ Links ]
31. Kettenmann H, Kirchhoff F, Verkhratsky A. Microglia: New roles for the synaptic stripper. Neuron. 2013;77:10-8. http://dx.doi.org/10.1016/j.neuron.2012.12.023 [ Links ]
32. Bessis A, Béchade C, Bernard D, Roumier A. Microglial control of neuronal death and synaptic properties. Glia. 2007;55:233-8. http://dx.doi.org/10.1002/glia.20459 [ Links ]
33. Thared P, Heldmann U, Gomes W, Gisler R, Darsalia U, Tancera J, et al . Long-term accumulation of microglia with proneurogenic phenotype concomitant with persistant neurogenesis in adult subventricular zone after stroke. Glia. 2009;57:835-49. http://dx.doi.org/10.1002/glia.20810 [ Links ]
34. Nakayama M, Uchimura K, Zhu RL, Nagayama T, Rose ME, Stetler RN, et al . Cyclooxygenase-2 inhibition prevents delayed death of CA1 hippocampal neurons following global ischemia. Proc Natl Acad Sci USA. 1998;95:10954-9. [ Links ]
35. Hirst WD, Young K, Newton R, Allport BC, Marriott DR, Wilkin GP. Expression of COX-2 by normal and reactive astrocytes in the adult rat central nervous system. Mol Cell Neurosci. 1999;13:57-68. http://dx.doi.org/10.1006/mcne.1998.0731 [ Links ]
36. Yocota C, Kaji T, Kuge Y, Inoue H, Tamaki N, Minematsu K. Temporal and topographic profiles of cyclooxygenase-2 profile during 24 h of focal brain ischemic in rats. Neurosci Lett. 2004;357:219-22. http://dx.doi.org/10.1016/j.neulet.2003.12.109 [ Links ]
37. Stark DT, Bazan NG. Synaptic and extrasynaptic NMDA receptors differentially modulate neuronal COX-2 function, lipid peroxidation, and neuroprotection. J Neurosci. 2011;31: 13710-21. http://dx.doi.org/10.1523/JNEUROSCI.3544-11.2011 [ Links ]
38. Yrjanheikki J, Tikka T, Keina R, Goldsteins G, Chan PH, Koistinaho J. A tetracycline derivative, minocycline, reduces inflammation and protects against focal cerebral ischemia with a wide therapeutic window. Proc Natl Acad Sci USA. 1999;96:13496-500. [ Links ]
39. Gonçalves MB, Willians EJ, Yip P, Yáñez-Muñoz RJ, Willians G, Doherty P. The COX-2 inhibitors, meloxicam and nimesulide suppress neurogenesis in the adult mouse brain. Br J Pharmacol. 2010;159:118-25. http://dx.doi.org/10.1111/j.1476-5381.2009.00618.x [ Links ]
40. Sasaki T, Kitagawa K, Sugiura S, Omura-Matsuoka E, Tanaka S, Yagita Y, et al . Implication of cyclooxygenase-2 on enhanced proliferation of neural progenitor cells in the adult mouse hippocampus after ischemia. J Neurosci Res. 2003;72:461-71. http://dx.doi.org/10.1002/jnr.10595 [ Links ]
41. Gómez-Hernández A, Sánchez-Galán E, Martín-Ventura JL, Vidal, C, Blanco-Colio LM, Ortego M, et al . Atorvastatin reduces the expression of prostaglandin E2 receptors in human carotid atherosclerotic plaques and monocytic cells. J Cardiovasc Pharmacol. 2006;47:60-9. http://dx.doi.org/10.1097/01.fjc.0000194252.38683.68 [ Links ]
42. Piermartiri TC, Figuereido CP, Rial D, Duarte FS, Bezerra SC, Mancini G, et al . Atorvastatin prevents hippocampal cell death, neuroinflammation and oxidative stress following amyloid- b 1–40 administration in mice: Evidence for dissociation between cognitive deficits and neuronal damage. Exp Neurol. 2010;226:274-84. http://dx.doi.org/10.1016/j.expneurol.2010.08.030 [ Links ]
43. Strauss KI. Antiinflammatory and neuroprotective actions of COX2 inhibitors in the injured brain. Brain Behav Immun. 2008;22:285-98. http://dx.doi.org/10.1016/j.bbi.2007.09.011 [ Links ]













