Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.34 no.3 Bogotá July/Sept. 2014
https://doi.org/10.7705/biomedica.v34i3.2121
REVISIÓN DE TEMA
doi: http://dx.doi.org/10.7705/biomedica.v34i3.2121
1 Programa de Estudio y Control de Enfermedades Tropicales, PECET, Universidad de Antioquia, Medellín, Colombia
2 Laboratorio de Biología y Sistemática de Insectos (Insectario), Grupo de Investigación en Sistemática Molecular, Facultad de Ciencias, Universidad Nacional de Colombia, Medellín, Colombia
3 Division of Parasitic Diseases and Malaria, Center for Global Health, Centers for Disease Control and Prevention (CDC), Atlanta, United States of America
Contribución de los autores:
María Angélica Contreras-Gutiérrez, Charles Porter y Sandra Inés Uribe: identificación entomológica, revisión de la colección de referencia, recopilación de la información bibliográfica y contenido de los cuadrosSandra Inés Uribe e Iván Darío Vélez: iniciativa del trabajo en zona cafetera y asesoría de la revisión, sugerencia de referencias, estilo, orden y estructura de los temas
Todos los autores participaron en el trabajo de campo y en la elaboración del manuscrito.
Recibido: 23/08/13; aceptado: 06/05/14
Se presenta una lista actualizada de especies de flebotomíneos en zonas cafeteras de la región andina colombiana. Con base en la revisión y verificación taxonómica, se registraron 53 especies presentes en 12 departamentos. Además de los registros obtenidos con base en un muestreo intensivo en cinco departamentos, se recopilaron los datos existentes en trabajos publicados y en la revision taxonómica de los especímenes de la zona pertenecientes a la colección entomológica del Programa de Estudio y Control de Enfermedades Tropicales (PECET). El listado comprende los géneros Brumptomyia (2 especies), Lutzomyia (50 especies) y Warileya (1 especie). Con base en este trabajo se confirmaron 11 nuevos registros de especies en la región cafetera colombiana, entre los cuales es relevante Lutzomyia panamensis , especie de importancia médica no registrada previamente en esta zona. En total, 18 especies de las registradas poseen hábitos antropofílicos o están relacionadas con la transmisión de Leishmania spp.
Palabras clave: leishmaniasis, Psychodidae, Lutzomyia , café, Colombia.
http://dx.doi.org/10.7705/biomedica.v34i3.2121
An updated checklist of Phlebotomine sand flies (Diptera: Psychodidae: Phlebotominae) from the Colombian Andean coffee-growing region
An updated list of phlebotomine sand flies species in coffee growing areas in the Colombian Andean region is presented. Fifty three species were reported from 12 departments. In addition, species distribution in the region was derived from specimens obtained during intensive field work in five departments, from previously published studies and from the taxonomic revision of specimens in the entomological collection of the Programa de Estudio y Control de Enfermedades Tropicales (PECET). The list includes the genera Brumptomyia (2 species), Lutzomyia (50 species) and Warileya (1 species). The updated list contains eleven new records in the region under study, including Lutzomyia panamensis , a species of medical importance not recorded previously in this zone. Eighteen of the species are considered to be anthropophilic, and many of them have been implicated in the transmission of leishmaniasis.
Key words: leishmaniasis, Psychodidae, Lutzomyia , coffee, Colombia.
http://dx.doi.org/10.7705/biomedica.v34i3.2121
Los flebotomíneos son dípteros hematófagos que pertenecen a la familia Psychodidae Newman, 1834, subfamilia Phlebotominae Rondani, 1840. Esta subfamilia es de distribución mundial e incluye especies reconocidas por su relevancia en salud pública y veterinaria. Sin duda, su mayor importancia radica en el papel que cumplen como vectores naturales de protozoos del género Leishmania Ross, 1903 (Euglenozoa: Trypanosomatidae), agente causal de la enfermedad tropical leishmaniasis (1,2), aunque también han sido relacionados como vectores de la bacteria Bartonella bacilliformis Barton, 1909, y de algunos virus de los géneros Phlebovirus (3), Vesiculovirus (4), Orbivirus (5) y Flavivirus (6).
De las cerca de 900 especies de flebotomíneos registradas en el mundo, alrededor de 70 han sido implicadas en la transmisión de la leishmaniasis (7,8). Aunque los flebotomíneos se han estudiado más que la mayoría de los demás grupos de insectos debido a su papel como vectores de agentes patógenos, el conocimiento taxonómico de estos insectos es aún incompleto. En América se han registrado alrededor de 500 especies de flebotomíneos, según los datos obtenidos a partir de tres revisiones importantes (8-10) y de la documentación electrónica producida por la Walter Reed Biosystematics Unit (WRBU, http://wrbu.si.edu/), las cuales constituyen herramientas imprescindibles en el estudio de la sistemática, la taxonomía y la distribución geográfica de este grupo de insectos.
En la primera mitad del siglo XX, Antunes (11) publicó la primera notificación en Colombia sobre la presencia de flebotomíneos. Posteriormente, se han llevado a cabo numerosos estudios taxonómicos, así como trabajos de recolección y recopilación de los registros en diferentes localidades, principalmente en focos de transmisión de leishmaniasis (12-15). Además, se dispone de trabajos como el publicado por Bejarano (16), quien presentó en el 2006 el listado de la familia Psychodidae para Colombia. A la fecha se registran en el país 163 especies de flebotomíneos: 153 del género Lutzomyia , ocho del género Brumptomyia y dos del género Warileya (17-21). Estas especies se encuentran distribuidas en diversos ecosistemas del país, que van desde el bosque muy húmedo tropical (bmh-t) hasta el bosque seco tropical (BsT), y muchas se registran en ambientes de influencia antrópica, como los sistemas agropecuarios y los ambientes urbanos (22,23).
Como es bien sabido, en el caso de la leishmaniasis el vector constituye un factor de gran importancia como indicador del riesgo y por su papel en la dinámica de la transmisión. Por lo tanto, los estudios que lo involucran deben considerar un sinnúmero de factores que inciden directamente en la presencia, composición y abundancia de las especies (24,25). En el caso de zonas como la cafetera, el cambio creciente en el uso del suelo, como consecuencia de la expansión de la frontera agrícola y el crecimiento demográfico, ha facilitado la rápida dispersión de especies de vectores y mamíferos silvestres a hábitats no selváticos, propiciando, así, un cambio en las dinámicas de la transmisión (focos urbanos y rurales), el cual justifica, entre otros, la realización de nuevos estudios sobre las especies vectoras (26-29).
Leishmaniasis y flebotomíneos en ecosistemas de influencia cafetera en Colombia
La Región Andina de Colombia es reconocida por tener una gran variedad de biotopos debido a su complejidad topográfica, lo que determina una gran diversidad de especies y presencia de endemismos (30-33). Esto es así también para los insectos flebotomíneos (34,35). Precisamente en los departamentos que conforman la Región Andina colombiana se registra el 51,9 % de los casos de leishmaniasis cutánea (en total 4.793 casos, Boletín de notificación obligatoria, 2012; 4.425 casos, Boletín de notificación obligatoria, 2013) (36). La principal actividad agrícola en esta región es el cultivo de café (Coffea arabica Linneo, 1737), la cual se desarrolla en el Eje Cafetero (departamentos de Caldas, Risaralda y Quindío) y en los departamentos de Antioquia, Cauca, Cundinamarca, Huila, Santander, Tolima, Norte de Santander y Valle del Cauca (37,38).
El cultivo de café representa el segundo renglón generador de divisas para el país y cerca de un tercio de todo el café todavía se cultiva a la sombra, en plantaciones relativamente pequeñas, con bajas densidades de siembra (<2.000 árboles/ha) de variedades tradicionales (Borbón, Típica). Esto contrasta con el otro 70 % de los cultivos de café, que se consideran intensivos (tecnificados) y usan hasta 10.000 plantas/ha, en especial de las variedades Caturra y Colombia, y en los que se recurre ampliamente al uso de insumos químicos y, poco o nada, al sombrío tradicional (32).
La relación entre el cultivo del café y la transmisión de Leishmania fue descrita por primera vez en Venezuela por Scorza, et al., en 1985 (39), y, posteriormente, por Montoya-Lerma (40), Montoya-Lerma, et al., (41) y Warburg, et al., (42) en Colombia. En el Programa de Estudio y Control de Enfermedades Tropicales (PECET), la relación de Lutzomyia spp. y el cultivo del café fue estudiada por primera vez en 1995 (43,44) en los municipios del oriente del departamento de Antioquia, al igual que el uso del hongo entomopatógeno Beauveria bassiana (Deuteromycotina: Hyphomycetes), recomendado para el control biológico de la broca del café, Hypothenemus hampei (Ferrari), cuyo uso se extendió con éxito a las poblaciones de Lutzomyia spp. en dichos municipios.
En muchos países de Latinoamérica la leishmaniasis cutánea se ha convertido en un grave problema de salud pública en las zonas de cultivo de café (45). En países como Colombia, Venezuela, México y Brasil, se presentan condiciones óptimas para dicho cultivo, generalmente en zonas montañosas entre los 1.000 y 2.100 msnm, y los casos de leishmaniasis cutánea usualmente se asocian con los complejos Leishmania braziliensis y L. mexicana, y con las especies. L. guyanensis y L. panamensis (35,39,42,46-51).
Es claro que en Colombia las plantaciones de café, en particular en las que se sigue utilizando el sistema tradicional de cultivo, ofrecen todas las condiciones favorables para el desarrollo y establecimiento de los flebotomíneos, incluidas las especies de importancia en la transmisión de la leishmaniasis. Los sitios ricos en materia orgánica pueden constituir microambientes adecuados para la cría de estos vectores y ofrecen numerosos lugares para el reposo diurno de los adultos, como la hojarasca, los troncos y las raíces de los árboles de sombrío (guamos, carboneros y otros cultivos como plátanos y cítricos), que pierden sus hojas durante la estación seca, lo cual aumenta la capa de hojarasca y genera un sustrato orgánico adecuado para su desarrollo. En términos de alimentación de los adultos, también hay una gran variedad de fuentes naturales de azúcar, que incluyen el fruto maduro del café y el guamo, lo que facilita el establecimiento de los parásitos del género Leishmania en los insectos vectores (39,52,53). Asimismo, las fuentes de ingestión sanguínea de los flebotomíneos pueden incluir roedores silvestres (Micoureus demerarae y Microryzomys minutus) y otros mamíferos, así como los animales domésticos y los residentes humanos que viven cerca o entre los cultivos del café (54,55).
Aunque en los agroecosistemas cafeteros colombianos se han llevado a cabo algunos estudios relacionados con la transmisión de la leishmaniasis y la presencia de fauna flebotomínea, y se dispone de algunos registros sobre las especies asociadas, dichos estudios son relativamente pocos y dispersos, no son sistemáticos en absoluto ni hacen énfasis particular en la zona cafetera o en el riesgo asociado a las especies presentes, aspectos estos que sí fueron considerados en la presente revisión.
En general, se conoce la presencia de especies del grupo verrucarum Theodor, 1965, de la serie townsendi Galati, 1995, de Lutzomyia spinicrassa Morales, Osorno-Mesa, Osorno, Muñoz, 1969; Lu. longiflocosa Osorno, Morales Osorno y Muñoz, 1970; Lu. youngi Feliciangeli y Murillo, 1987; Lu. torvida Young y Morales, 1994; Lu. quasitownsendi Osorno, Osorno y Morales, 1972, y Lu. townsendi (Ortiz, 1959), asociadas frecuentemente a focos de leishmaniasis cutánea causada por L. braziliensis, L. guyanensis y L. panamensis (35,40-42,49,50). En zonas cafeteras se observa la coexistencia de especies del grupo verrucarum con otras especies de los subgéneros Helcocyrtomyia Barretto, 1962, Psathyromyia Barretto, 1962 y Micropygomyia Barretto, 1962, y ocasionalmente se registra Lu. sordellii Shannon y Del Ponte, 1927, y especies del subgénero Lutzomyia França, 1924, y del subgénero Nyssomyia Barretto, 1962 (8,19,21,34,35,40-42,50-61) (Pardo R, Ferro C, Lozano G, Lozano C, Cabrera O, Davies C. Flebótomos (Diptera: Psychodidae) vectores de leishmaniasis cutánea y sus determinantes ecológicos en la zona cafetera del departamento del Huila. XXVI Congreso de la Sociedad Colombiana de Entomología, SOCOLEN, 1999).
En este trabajo se presenta la lista de las especies flebotomíneas cuya presencia ha sido registrada en zonas cafeteras de la Región Andina de Colombia. La lista se elaboró a partir de la integración de la información publicada en diversas fuentes bibliográficas y la revisión taxonómica de los especímenes disponibles para la zona en la Colección de Vectores y Hospedadores Intermediarios de Enfermedades Tropicales – (Unidad de Entomología Médica y Molecular, PECET); se consideraron, igualmente, los hallazgos derivados de los estudios de campo llevados a cabo por los autores. Se resaltan los nuevos registros para la zona y el país, así como las especies de importancia médica con información actualizada hasta el 2013.
Materiales y métodos
Fuente de los datos
Inicialmente, se reportan las especies de especímenes recolectadas en el trabajo de campo llevado a cabo por los autores durante los tres últimos años, en los departamentos de Antioquia, Caldas, Risaralda, Quindío y Valle del Cauca (cuadro 1). Los especímenes de los cuales se derivaron estos registros se recolectaron con capturadores bucales, trampas de luz de tipo Shannon y trampas CDC. Los especímenes recolectados se identificaron con las claves de Young y Duncan (8) y Galati (9), y se depositaron en la colección de Vectores y Hospedadores Intermediarios de Enfermedades Tropicales del PECET de la Universidad de Antioquia, con copia en el Museo Entomológico Francisco Luis Gallego de la Universidad Nacional de Colombia, sede Medellín.
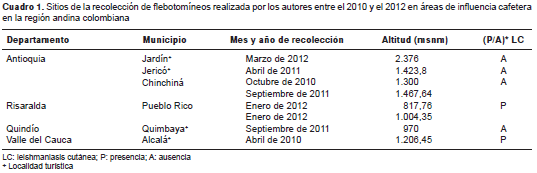
Además, se revisaron las publicaciones disponibles hasta la fecha sobre las especies de flebotomíneos recolectadas en zona cafetera colombiana. Por último, se revisó y se verificó la identidad taxonómica de los especímenes provenientes de la zona cafetera existentes en la colección de Vectores y Hospedadores Intermediarios de Enfermedades Tropicales.
Los especímenes depositados en la colección provienen del trabajo realizado durante años por la Unidad de Entomología Médica y Molecular del PECET y de algunos estudios de foco recientes llevados a cabo por la Unidad de Ecoepidemiología. Asimismo, en la colección se encuentra el material obtenido a partir de proyectos (Proyecto Microhábitats) y actividades colaborativas con diferentes líneas de investigación del PECET, como la Unidad de Biología Molecular, así como de otras instituciones de la región y el país. Estos trabajos, relacionados directamente con el estudio de la leishmaniasis en Colombia, han convertido la colección de referencia de Vectores y Hospedadores Intermediarios de Enfermedades Tropicales en una de las más completas y valiosas del país en lo que se refiere a especies flebotomíneas.
Estructuración de la lista
La lista está organizada alfabéticamente y de forma sistemática por géneros, subgéneros o grupos y especies. La clasificación y nomenclatura se hicieron siguiendo los esquemas propuestos para los flebotomíneos por Young y Duncan (8), y por Galati (9). Se especifican las localidades de cada especie y las referencias por departamento ordenadas alfabéticamente. Además, en lo concerniente a los nuevos registros, se detalla el método de recolección utilizado.
Resultados y discusión
Al incluir los registros de todas las fuentes de información, resultaron 53 especies en 12 departamentos de la zona cafetera: Antioquia, Boyacá, Caldas, Cauca, Cundinamarca, Huila, Nariño, Norte de Santander, Quindío, Risaralda, Tolima y Valle del Cauca (cuadro 2). El listado comprende los géneros Brumptomyia (2 especies), Lutzomyia (50 especies) y Warileya (1 especie).


Entre los subgéneros y grupos de especies del género Lutzomyia se destacan el grupo verrucarum Theodor, 1965, representado por 17 especies, dos de la serie evansi Galati, 1995, dos de la serie pia Galati, 1995, dos de la serie serrana Barretto, 1962, ocho de la serie townsendi, y dos de la serie verrucarum Fairchild, 1955, y Lu. nuneztovari Ortiz, 1954 (que no se ubica en serie según el esquema usado, Galati 2010).
El subgénero Helcocyrtomyia Barretto, 1962, está representado por dos series, osornoi Galati & Cáceres, 1994, y sanguinaria Barretto, 1962, con dos y seis especies, respectivamente, seguido por el subgénero Lu. França, 1924, con cuatro especies, el grupo migonei y los subgéneros Micropygomyia Barretto, 1962, Psathyromyia Barretto, 1962, y Psychodopygus Mangabeira, 1941, con tres especies cada uno. Los subgéneros Nyssomyia Barretto, 1962, y Trichopygomyia Barretto, 1962, están representados por dos especies, mientras que los subgéneros Dampfomyia Addis, 1945, Pressatia Mangabeira, 1942, Sciopemyia Barretto, 1962, Trichophoromyia Barretto, 1962, y los grupos aragaoi Theodor, 1965, y oswaldoi Theodor, 1965, están representados por una especie cada uno (cuadro 2).
Si se consideran los diversos aspectos que favorecen el contacto entre el ser humano y el vector en la zona cafetera, debe destacarse el registro de la presencia de especies antropofílicas, como Lu. columbiana, Lu. gomezi, Lu. evansi, Lu. hartmanni, Lu. lichyi, Lu. longiflocosa, Lu. longipalpis, Lu. nuneztovari, Lu. panamensis, Lu. pia, Lu. quasitownsendi, Lu. ovallesi, Lu. torvida, Lu. shannoni, Lu. spinicrassa, Lu. trapidoi, Lu. youngi y Lu. yuilli yuilli, las cuales, además, se han relacionado con la transmisión de los agentes causantes de la leishmaniasis cutánea y la visceral (cuadro 3).
Los resultados de la presente revisión confirman que la zona cafetera del país es, en efecto, un área de riesgo potencial, donde la presencia de especies vectores se suma a la evidencia de transmisión activa de la enfermedad dentro o alrededor de las casas o cerca a las plantaciones de café, lo que tiene un impacto directo sobre las poblaciones humanas que viven y trabajan en dichas plantaciones, por lo cual sería de suma importancia desarrollar actividades de vigilancia entomológica (39,40,41,54-56,61,65,66,75
Entre los nuevos registros de especies cuya presencia se suma a la lista conocida de especies para la zona cafetera, sobresalen las siguientes: Brumptomyia sp. cerca a guimaraesi, Lu. camposi, Lu. carrerai thula, Lu. dasymera, Lu. osornoi, Lu. panamensis, Lu. reburra, Lu. rosabali, Lutzomia sp. 1, Lutzomyia sp. cerca a dubitans y Lu. triramula (cuadro 2). La especie Lu. panamensis es el registro más importante en cuanto a la transmisión de la enfermedad. Esta especie se conoce como vector natural de L. panamensis (87) y se ha incriminado como vector de L. braziliensis en Venezuela y Guatemala (94). En Colombia fue registrada infectada naturalmente por L. panamensis por Santamaría, et al. (95) (cuadro 3).
Las posibles nuevas especies y nuevos registros de especies para los departamentos de Antioquia, Caldas y Quindío, se presentan en el cuadro 2. Entre estas, y con respecto a la transmisión de la leishmaniasis, es relevante Lu. gomezi, considerada como probable vector en varias regiones endémicas de leishmaniasis cutánea en Colombia (54,93,95,96) y la cual se ha detectado naturalmente infectada con L. panamensis; se le considera, además, como una especie con hábitos de picadura marcadamente antropofílicos (cuadro 3). Por otra parte, Lu. shannoni también tiene hábitos de picadura antropofílicos (124) y la capacidad de mantener la infección de, al menos, tres especies de Leishmania: L. mexicana Biagi 1953, L. panamensis Lainson y Shaw 1972 y L. infantum Nicolle 1908. En Estados Unidos, Lu. shannoni es un vector comprobado de la leishmaniasis visceral y del virus de la estomatitis vesicular serotipo New Jersey (4,110,125) (cuadro 3).
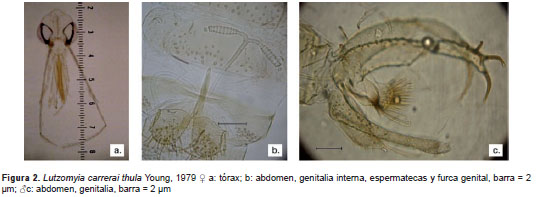
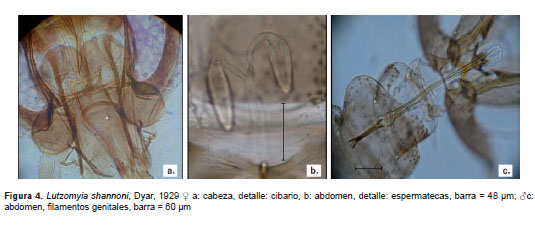
Se destaca el hallazgo de Brumptomyia sp. cerca a guimaraesi, que junto a Lutzomyia sp.1, representarían nuevas especies que en este momento se encuentran en proceso de descripción. Brumptomyia beapertuyi Ortiz, 1954, representa un nuevo registro para el departamento de Antioquia. En el departamento de Caldas se destaca B. beaupertuyi (figura 1), Lu. carrerai thula Young, 1979 (figura 2), Lu. carpenteri Fairchild & Hertig, 1953, Lu. dasymera Fairchild & Hertig, 1961, y Lu. walkeri Newstead, 1914. Por otro lado, se registraron Lu. gomezi Nitzulescu, 1931, (figura 3) y Lu. shannoni Dyar, 1929, (figura 4) en el departamento del Quindío.

Los detalles de la recolección y de la taxonomía de las posibles nuevas especies, así como los nuevos registros de distribución para el país y por departamento, se describen a continuación.
Brumptomyia sp. cerca a guimaraesi. CALDAS. km 4 vía Chinchiná-Manizales-Chinchiná. 04° 59´ N, 75° 35" O, 1.335,49 m, 9 de octubre de 2009, trampa CDC. Material examinado: 2 ?, 11 ?. Ubicación: VHET, recolectores: autores, UEMM, PECET. Probablemente es una nueva especie, que está en proceso de descripción.
Brumptomyia beaupertuyi. CALDAS. km 4 vía Chinchiná-Manizales-Chinchiná. 04° 59´ 32´ N, 75° 35´ 47" O, 1.335,49 m, 9 de octubre de 2009, trampa CDC. Material examinado: 4 ?. Ubicación: VHET, recolectores: autores, UEMM, PECET.
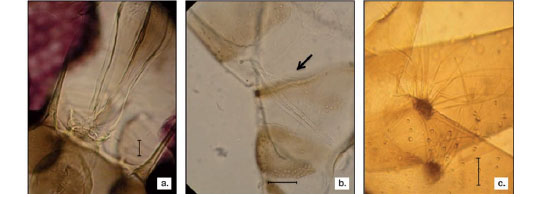
ANTIOQUIA, Jericó, 05° 48´ 49,17" N, 75° 47´ 58,141" O, 1.423,8 m, 1° de abril de 2011, trampa CDC. Material examinado: 1 ?. Ubicación: VHET, recolectores: autores, UEMM, PECET. B. beaupertuyi presenta en Colombia una distribución restringida, pues solo se ha reportado en Norte de Santander y Santander (16). Esta especie se diferencia morfológicamente de B. hamata Fairchild & Hertig, 1947, por la longitud de los conductos eyaculadores, los cuales son casi o tres veces más largos que la bomba genital (9) (figura 1).
Lutzomyia carrerai thula. CALDAS. km 4 vía Chinchiná-Manizales-Chinchiná. 04° 59´ 30" N, 75° 35´ 53" O, 1.341,83 m, 8 de octubre de 2009, trampa CDC. Material examinado: 94 ?, 68 ?. Ubicación: VHET, recolectores: autores, UEMM, PECET. CALDAS. Victoria. 04° 59´ 30" N, 75° 35´ 53" O, 1.341,83 m, 29 de julio de 2010, trampa CDC. Material examinado: 6 ?, 3 ?. Ubicación: VHET, recolectores: UEE, PECET.
CALDAS. Samaná. 04° 59´ 30" N, 75° 35´ 53" O, 1.341,83 m, 12 de octubre de 2010, trampa CDC. Material examinado: 4 ?, 2 ?. Ubicación: VHET, recolectores: UEE, PECET. La presencia de Lu. carrerai thula se ha documentado en los departamentos de Antioquia, Cauca, Chocó, Nariño y Valle del Cauca. Esta especie se distingue de la subespecie Lu. carrerai carrerai Barretto, 1946, solo por caracteres morfológicos en la hembra, como una longitud del labroepifaringe mayor de 300 µm o casi igual a la longitud de la cabeza en Lu. carrerai thula, ya que el macho es morfológicamente similar a Lu. carrerai carrerai (figura 2). Además, en Colombia estas especies presentan diferencias en la distribución geográfica; así, Lu. carrerai thula se encuentra en las Regiones Pacífica y Andina, y Lu. carrerai carrerai, al sur del país (8,9). Desde el punto de vista médico, Lu. carrerai thula no se ha relacionado con la transmisión de ningún patógeno (8).
Lutzomyia carpenteri. CALDAS. Victoria, 04° 59´ 30" N, 75° 35´ 53" O, 1.341,83 m, 29 de julio de 2010, trampa CDC. Material examinado: 2 ?. Ubicación: VHET, recolectores: UEE, PECET. La especie Lu. carpenteri está registrada en los departamentos de Antioquia, Chocó, Cundinamarca, Tolima y Sucre (16,61). Lu. carpenteri se ubica taxonómicamente en el grupo aragaoi. La hembra exhibe la típica espermateca globular de los miembros del grupo aragaoi, pero se diferencia de otros taxa por tener sutiles estrías transversales en las paredes de los conductos espermáticos individuales (8,9).
Lutzomyia dasymera. CALDAS. Victoria. 04° 59´ 30" N, 75° 35´ 53" O, 1.341,83 m, 28 de julio de 2010, trampa CDC. Material examinado: 1 ?, 1 ?. Ubicación: VHET, recolectores: UEE, PECET. Lu. dasymera ha sido registrada en los departamentos de Antioquia, Boyacá, Chocó, Nariño, Norte de Santander y Valle del Cauca (16). Los caracteres morfológicos exhibidos por los ejemplares de Lu. dasymera permitieron su identificación certera hasta el nivel de especie.
Lutzomyia gomezi. QUINDÍO. Quimbaya, vereda El Laurel, 04° 34´ 08" N, 75° 51 ´03" O, 970 m, 11 de septiembre de 2011. Búsqueda activa. Material examinado: 1 ?. Ubicación: VHET, recolectores: autores, UEMM, PECET. Lu. gomezi presenta una amplia distribución en el país y está registrada en 23 de los 32 departamentos (16). El macho de Lu. gomezi es morfológicamente similar a Lu. sherlocki Martins, Silva & Falcão, 1971, pero difieren en el ancho de los conductos eyaculadores, los cuales son más anchos que las cerdas del tufo basal del gonocoxito en Lu. sherlocki; el carácter ligeramente curvado hacia arriba del parámero permite diferenciarlas. Martins, et al., (126) distinguen los machos de estas dos especies por el número de setas en la base del gonocoxito (40 en Lu. sherlocki y 14 a 19 en Lu. gomezi). De acuerdo con Llanos, et al., (127), las espermatecas en Lu. sherlocki son más grandes que en Lu. gomezi y los conductos espermáticos individuales de Lu. sherlocki también son más amplios que los de Lu. gomezi (8,9) (figura 3).
Lutzomyia shannoni. QUINDÍO. Quimbaya, vereda El Laurel, 04° 34´ 08" N, 75° 51´ 03" O, 970 m, 11 de septiembre de 2011. Búsqueda activa. Material examinado: 1 ?, 1 ?. Ubicación: VHET, reco-lectores: autores, UEMM, PECET. Lu. shannoni presenta una amplia distribución y está registrada en 18 de los 32 departamentos del país (16). Morfológicamente, las hembras de Lu. shannoni no se diferencian; sin embargo, la morfología genital del macho permite la identificación a nivel de especie (8,128) (figura 4).
Lutzomyia sp. 1. ANTIOQUIA, Jardín, vereda Quebrada Bonita, Reserva Natural La Playa, 05° 35´ N, 75° 46´ 5,4 O, 2.376 m, 3 de febrero de 2012, trampa Shannon. Material examinado: 5 ?. Ubicación: VHET, recolectores: autores, UEMM, PECET. Probablemente es una nueva especie, que está en proceso de descripción.
Lutzomyia walkeri. CALDAS. Victoria. 04° 59´ 30" N, 75° 35´ 53" O, 1.341,83 m, 28 de julio de 2010, trampa CDC. Material examinado: 1 ?. Ubicación: VHET, recolectores: UEE, PECET. Esta especie se ha registrado en los departamentos de Amazonas, Antioquia, Boyacá, Caquetá, Casanare, Cundinamarca, Huila, Meta, Norte de Santander, Putumayo, Santander, Tolima y Vaupés (16). Los caracteres morfológicos exhibidos por el espécimen recolectado de Lu. walkeri permitieron identificarlo hasta el nivel de especie.
Consideraciones finales
En los últimos 10 años no se había realizado un estudio exhaustivo sobre la presencia de flebotomíneos en la zona cafetera. Con este trabajo se proporciona la lista actualizada y se reporta la presencia de 53 especies de flebotomíneos. Será necesario hacer observaciones continuas adicionales para completar la lista de las especies y contribuir con ello a la determinación del riesgo. Se espera que este trabajo sea útil en estudios epidemiológicos y como base para futuras investigaciones taxonómicas de las especies flebotomíneas presentes en la zona cafetera. En relación con la sistemática y taxonomía del grupo, se destacan los hallazgos de dos posibles nuevas especies, Lutzomyia sp. 1, recolectada en el municipio de Jardín (zona cafetera del suroeste antioqueño), y Brumptomyia sp. cerca a guimaraesi, recolectada en el municipio de Chinchiná, Caldas.
Los autores expresan sus agradecimientos al Centro Nacional de Investigaciones del Café (Cenicafé), al coordinador de Entomología, Pablo Benavides Machado, a la investigadora Marisol Giraldo y al auxiliar Jairo Henao, por su valiosa colaboración en la logística y desarrollo de las salidas de campo, así como al profesor Fernando Vallejo, de la Universidad de Caldas, por su acompañamiento y apoyo en el trabajo de campo; a las distintas comunidades y al personal de las seccionales de salud de los municipios visitados: Alcalá, Jardín, Jericó, Chinchiná, Quimbaya y Pueblo Rico, y a la Unidad de Ecoepidemiología y Entomología Médica y Molecular del PECET, por la recolección reciente de los especímenes que hoy hacen parte de la colección entomológica del PECET y que fueron revisados e incluidos en el presente estudio.
Los autores declaran que no existen conflictos de intereses.
Los trabajos de campo y de clasificación taxonómica fueron posibles gracias a la financiación de los proyectos colaborativos entre los Centers for Disease Control and Prevention (CDC) de Atlanta, el Programa de Estudio y Control de Enfermedades Tropicales (PECET) de la Universidad de Antioquia, y el Laboratorio de Biología y Sistemática de Insectos de la Universidad Nacional de Colombia, sede Medellín.
Correspondencia: María Angélica Contreras-Gutiérrez, Grupo de Investigación en Sistemática Molecular, Facultad de Ciencias, Universidad Nacional de Colombia, Autopista Norte, Calle 59A N° 63-20, bloque 16, laboratorio 112, Medellín, Colombia Teléfono: (574) 430 9394 maria.contreras@pecet-colombia.org
1. Killick-Kendrick R. Phlebotomine vectors of the leishmaniases: A review. Med Vet Entomol. 1990;4:1-24. http://dx.doi.org/10.1111/j.1365-2915.1990.tb00255.x [ Links ]
2. World Health Organization Expert Committee. Control of the leishmaniasis: Report of a meeting of the WHO Expert Committee on the Control of Leishmaniases. WHO Tech Rep Ser. 949. Geneva: OMS; 2010. p. 186. [ Links ]
3. Acevedo M, Arrivillaga J. Eco-epidemiología de flebovirus (Bunyaviridae, Phlebovirus) transmitidos por flebótomos (Psychodidae, Phlebotominae). Bol Malar Salud Ambient. 2008;48:3-16. [ Links ]
4. Comer J, Tesh R. Phlebotomine sand flies as vectors of vesiculoviruses: A review. Parassitologia. 1991;33:143-50. [ Links ]
5. Polly R. Orbiviruses. En: Knipe D, Howley P, editors. Field´s Virology. Fifth edition. Philadelphia: Lippincott, Williams and Wilkins; 2007. p. 1975-97. [ Links ]
6. Moureau G, Ninove L, Izri A, Cook S, De Lamballerie X, Charrel RN. Flavivirus RNA in phlebotomine sandflies. Vector-Borne Zoonot. 2010;10:195-7. http://dx.doi.org/10.1089/vbz.2008.0216 [ Links ]
7. Seccombe AK, Ready PD, Huddleston LM. A catalogue of Old World phlebotomine sandflies (Diptera: Psychodidae, Phlebotominae). Occ Pap Syst Entomol. 1993;8:1-57. [ Links ]
8. Young D, Duncan M. Guide to the identification and geographic distribution of Lutzomyia sand flies in Mexico, the West Indies, Central and South America (Diptera: Psychodidae). Mem Am Entomol Inst. 1994;54:1-881. [ Links ]
9. Galati EA. Apostila de bioecologia e identificação de Phlebotominae (Diptera, Psychodidae). São Paulo: Universidade de São Paulo; 2013. [ Links ]
10. Martins AV, Williams P, Falcão AL. American sand flies (Diptera: Psychodidae, Phlebotominae). Rio de Janeiro: Academia Brasileira de Ciencias; 1978. [ Links ]
11. Antunes PCA. Informe sobre una investigación realizada en Colombia. Rev Fac Med Bogotá. 1937;6:3-29. [ Links ]
12. Ferro C, Morales A. Flebótomos de Colombia: estudios realizados por el laboratorio de entomología 1966-1997. En: Toro G, Hernández CA, Raad J, editores. Instituto Nacional de Salud 1917-1997: una historia, un compromiso. Bogotá: Instituto Nacional de Salud; 1998. p. 219-33. [ Links ]
13. Montoya-Lerma J, Ferro C. Flebótomos (Diptera: Psychodidae) de Colombia. En: Amat G, Andrade MG, Fernández F, editores. Insectos de Colombia. Colección Jorge Álvarez Lleras No. 13. Bogotá: Academia Colombiana de Ciencias Exactas, Físicas y Naturales; 1999. p. 211-45. [ Links ]
14. Osorno-Mesa E, Morales-Alarcón A, Osorno F, Ferro-Vela C. Phlebotominae de Colombia (Diptera: Psychodidae) IX. Distribución geográfica de especies de Brumptomyia França y Parrot, 1921 y Lutzomyia França, 1924 encontradas en Colombia S.A. Rev Acad Colomb Cienc. 1972;14:45-68. [ Links ]
15. Young DG. A review of the bloodsucking psychodid flies of Colombia (Diptera: Phlebotominae and Sycoracinae). Tech Bull 806. Gainesville: Universidad de la Florida; 1979. [ Links ]
16. Bejarano EE. Lista actualizada de los psicódidos (Diptera: Psychodidae) de Colombia. Folia Entomol Mex. 2006;45:47-56. [ Links ]
17. Cabrera OL, Mosquera L, Santamaría E, Ferro C. Flebótomos (Diptera: Psychodidae) del departamento de Guaviare, Colombia, con nuevos registros para el país. Biomédica. 2009;29:73-86. http://dx.doi.org/10.7705/biomedica.v29i1.43 [ Links ]
18. Bejarano EE, Vivero R, Uribe S. Description of Lutzomyia velezi, a new species of phlebotomine sand fly (Diptera: Psychodidae) from the Department of Antioquia, Colombia. Mem Inst Oswaldo Cruz. 2010;105:322-25. http://dx.doi.org/10.1590/S0074-02762010000300014 [ Links ]
19. Contreras MA, Vivero RJ, Bejarano EE, Carrillo LM, Vélez ID. Nuevos registros de flebotomíneos (Diptera: Psychodidae) en el área de influencia del río Amoyá en Chaparral, Tolima. Biomédica. 2012;32:263-8. http://dx.doi.org/10.7705/biomédica.v32i2.438 [ Links ]
20. Carrasquilla MC, Munstermann L, Marín D, Ocampo C, Ferro C. Description of Lutzomyia (Helcocyrtomyia) tolimensis, a new species of phlebotomine sandfly (Diptera: Psychodidae) from Colombia. Mem Inst Oswaldo Cruz. 2012;107:993-7. http://dx.doi.org/10.1590/S0074-02762012000800005 [ Links ]
21. Ferro C, Marín D, Góngora R, Carrasquilla MC, Trujillo JE, Rueda NK, et al. Phlebotomine vector ecology in the domestic transmission of American cutaneous leishmaniasis in Chaparral, Colombia. Am J Trop Med Hyg. 2011;85:847-56. http://dx.doi.org/10.4269/ajtmh.2011.10-0560 [ Links ]
22. Tesh RB, Guzmán H. Sandflies and the agents they transmit. En: Marquardt W, Kondratieff B, editors. The biology of disease vectors. Boulder, CO: University Press of Colorado; 1996. p. 117-27. [ Links ]
23. Ready PD. Biology of Phlebotomine sand flies as vectors of disease agents. Annu Rev Entomol. 2013;58:227-50. http://dx.doi.org/10.1146/annurev-ento-120811-153557 [ Links ]
24. Travi BL, Montoya J, Gallego J, Jaramillo C, Llano R, Vélez ID. Bionomics of Lutzomyia evansi (Diptera: Psychodidae) vector of visceral leishmaniasis in northern Columbia. J Med Entomol. 1996;33:278-85. [ Links ]
25. Molina JA, Ortiz MI, Guhl F. Seasonality of Lutzomyia fairtigi (Diptera:Psychodidae: Phlebotominae), a species endemic to Eastern Colombia. Mem Inst Oswaldo Cruz. 2008;103: 477-82. http://dx.doi.org/10.1590/S0074-02762008000500012 [ Links ]
26. Ashford RW. The leishmaniases as emerging and reemerging zoonoses. Int J Parasitol. 2000;30:1269-81. http://dx.doi.org/10.1016/S0020-7519(00)00136-3 [ Links ]
27. Vélez ID, Hendrickx E, Robledo S, Agudelo S. Leishmaniosis cutánea en Colombia y género. Cad Saúde Pública. 2001;17:171-80. http://dx.doi.org/10.1590/S0102-311X2001000100018 [ Links ]
28. Travi BL, Ferro C, Cadena H, Montoya-Lerma J, Adler GH. Canine visceral leishmaniasis: Dog infectivity to sand flies from non-endemic areas. Res Vet Sci. 2002;72:83-6. http://dx.doi.org/10.1053/rvsc.2001.0527 [ Links ]
29. Agudelo LA, Uribe J, Sierra D, Ruiz F, Vélez ID. Presence of American cutaneous leishmaniasis vectors surrounding the city of Medellín, Colombia. Mem Inst Oswaldo Cruz. 2002;97:641-2. http://dx.doi.org/10.1590/S0074-02762002000500008 [ Links ]
30. Perfecto I, Rice RA, Greenberg R, van Der Voort ME. Shade coffee: A disappearing refuge for biodiversity. Bioscience. 1996;46:598-608. http://dx.doi.org/10.2307/1312989 [ Links ]
31. Perfecto I, Vandermeer J, Hansen P, Cartin V. Arthropod biodiversity loss and the transformation of tropical agro-ecosystem. Biodivers Conserv. 1997;6:935-45. http://dx.doi.org/10.1023/A:1018359429106 [ Links ]
32. Perfecto I, Vandermeer J. Spatial pattern and ecological process in the coffee agroforestry system. Ecology. 2008;89:915-20. http://dx.doi.org/10.1890/06-2121.1 [ Links ]
33. Etter A, van Wyngaarden W. Patterns of landscape trans-formation in Colombia, with emphasis in the Andean Region. Ambio. 2000;29:432-9. http://dx.doi.org/10.1579/0044-7447-29.7.432 [ Links ]
34. Alexander B, Ferro C, Young DG, Morales A, Tesh RB. Ecology of phlebotomine sand flies (Diptera: Psychodidae) in a focus of Leishmania (Viannia) braziliensis in northeastern Colombia. Mem Inst Oswaldo Cruz. 1992;87:387-95. http://dx.doi.org/10.1590/S0074-02761992000300009 [ Links ]
35. Alexander JB, Agudelo LA, Navarro F, Ruiz F, Molina J, Aguilera G, et al. Phlebotomine sandflies and leishmaniasis risks in Colombian coffee plantations under two systems of cultivation. Med Vet Entomol. 2001;15:364-73. http://dx.doi.org/10.1046/j.0269-283x.2001.00322.x [ Links ]
36. Instituto Nacional de Salud. Programa de Enfermedades de Transmisión Vectorial. Informe sobre leishmaniasis en Colombia. Sivigila semana 52. Bogotá D.C.: Instituto Nacional de Salud; 2012. [ Links ]
37. Arango O. Eco-región eje cafetero: una experiencia de desarrollo regional en Colombia. ACE. 2008;7:199-220. [ Links ]
38. Instituto Geográfico Agustín Codazzi. Atlas de la distribución de la propiedad rural en Colombia. Bogotá: Imprenta Nacional de Colombia; 2012. p. 80. [ Links ]
39. Scorza JV, Castillo I, Rezzano S, Márquez M, Márquez JC. El papel del cafeto en la endemicidad de la leishmaniasis cutánea en Venezuela. Bol Dir Malariol San Amb. 1985;25:82-8. [ Links ]
40. Montoya-Lerma J. Transmisión de leishmaniasis tegumentaria en zonas cafeteras de Colombia. Entomólogo. 1990;66:1-2. [ Links ]
41. Montoya-Lerma J, Jaramillo C, Palma G, Gómez T, Segura I, Travi B. Report of an epidemic outbreak of cutaneous leishmaniasis in a coffee-growing area of Colombia. Mem Inst Oswaldo Cruz. 1990;85:119-21. http://dx.doi.org/10.1590/S0074-02761990000100022 [ Links ]
42. Warburg A, Montoya-Lerma J, Jaramillo C, Cruz-Ruiz AL, Ostrovska K. Leishmaniasis vector potential of Lutzomyia spp. in Colombian coffee plantations. Med Vet Entomol. 1991;5:9-16. http://dx.doi.org/10.1111/j.1365-2915.1991.tb00514.x [ Links ]
43. Vallejo F, Uribe S, Vélez ID. Identification of entomo-pathogenic fungi for Lutzomyia spp. captured in a Colombian coffee plantation. Bol Dir Malariol San Amb. 1995;35:343-52. [ Links ]
44. Vallejo F, Uribe S, Vélez ID. Identificación de hongos patógenos para Lutzomyia spp. (Diptera: Psychodidae) vectores de leishmaniosis. Revista Colombiana de Entomología. 1996;22:13-7. [ Links ]
45. Organización Panamericana de la Salud. Leishmaniasis: actualización. 2009. Fecha de consulta: febrero 4 del 2013. Disponible en: http://www.cfsph.iastate.edu/Factsheets/es/leishmaniasis.pdf. [ Links ]
46. Sánchez-Tejeda G, Rodríguez N, Parra C, Hernández-Montes O, Barker DC, Monroy-Ostria A. Cutaneus leishmaniasis caused by members of Leishmania braziliensis complex in Nayarit, state of Mexico. Mem Inst Oswaldo Cruz. 2001;96:15-9. http://dx.doi.org/10.1590/S0074-02762001000100002 [ Links ]
47. Pérez J, Virgen A, Rojas JC, Rebollar-Téllez EA, Castillo A, Infante F, et al. Species composition and seasonal abundance of sandflies (Diptera: Psychodidae: Phlebotominae) in coffee agroecosystems. Mem Inst Oswaldo Cruz. 2014;109:80-6. http://dx.doi.org/10.1590/0074- 0276130224 [ Links ]
48. Saravia N, Weigle K, Navas C, Segura I, Valderrama l, Valencia AZ, et al. Heterogeneity, geographic distribution, and pathogenicity of serodemes of Leishmania (Viannia) in Colombia. Am J Trop Med Hyg. 2002;66:738-44. [ Links ]
49. Rodríguez-Barraquer I, Góngora R, Prager M, Pacheco R, Montero LM, Navas A, et al. Etiologic agent of an epidemic of cutaneous leishmaniasis in Tolima, Colombia. Am J Trop Med Hyg. 2008;78:276-82. [ Links ]
50. Alexander JB, Lozano C, Barker DC, McCann SH, Adler GH. Detection of Leishmania (Viannia) braziliensis complex in wild mammals from Colombian coffee plantations by PCR and DNA hybridization. Acta Trop. 1998;69:41-50. http://dx.doi.org/10.1016/S0001-706X(97)00114-9 [ Links ]
51. Young DG, Morales A, Kreutzer RD, Alexander B, Corredor A, Tesh RB, et al. Isolations of Leishmania braziliensis (Kinetoplastida: Trypanosomatidae) from cryopreserved Colombian sandflies (Diptera: Psychodidae). J Med Entomol. 1987;24:587-9. [ Links ]
52. Scorza JV, Spooner R. La leishmaniasis tegumentaria del piedemonte oriental de los Andes venezolanos. Bol Dir Malariol San Amb. 1982;19:34-44. [ Links ]
53. Alexander B, Usma MC. Potential sources of sugar for the phlebotomine sandfly Lutzomyia youngi (Diptera: Psychodidae) in a Colombian coffee plantation. Ann Trop Med Parasitol.1994;88:543-9. [ Links ]
54. Moore JS, Killick-Kendrick TB, Killick-Kendrick R, Wallbanks M, Molyneux DH. Honeydew sugars in wild caught Phlebotomus ariasi detected by high performance liquid chromatography (HPLC) and gas chromatography. Med Vet Entomol. 1987;1:427-34. http://dx.doi.org/10.1111/j.1365-2915.1987.tb00373.x [ Links ]
55. Vélez ID, Wolff M, Valderrama R, Escobar JP, Osorio L. Community and environmental risk factors associated with cutaneous leishmaniasis in Montebello, Antioquia, Colombia. En: IDRC, editors. Leishmaniasis control strategies: A critical evaluation of IDRC supported research. London: IDRC Publications; 1991. p. 261-74. [ Links ]
56. Alexander B, Jaramillo C, Usma MC, Quesada BL, Cadena H, Roa W, et al. An attempt to control phlebotomine sand flies (Diptera: Psychodidae) by residual spraying with deltamethrin in a Colombian village. Mem Inst Oswaldo Cruz. 1995;90:421-4. http://dx.doi.org/10.1590/S0074-02761995000300020 [ Links ]
57. Alexander B, Morales AL, Becerra J, Rojas CA. Entomological aspects of a leishmaniasis control project based on community participation in riverine communities of SW Colombia. Bol Dir Malariol San Amb. 1995;35:29-40. [ Links ]
58. Pardo RH, Farieta S, Munstermann LE, Ferro C. Estudio preliminar de los flebótomos de Villeta y Quebradanegra, Cundinamarca: sus implicaciones en salud pública. Biomédica. 1996;16:293-302. [ Links ]
59. Cárdenas R, Romo GM, Santamaría E, Bello F, Ferro C. Lutzomyia longiflocosa (Diptera: Psychodidae) posible vector en el foco de leishmaniasis cutánea del municipio de Planadas, zona cafetera del Tolima. Biomédica. 1999;19:239-44. [ Links ]
60. Bejarano EE, Sierra D, Vélez ID. Novedades en la distribución geográfica del grupo verrucarum (Diptera: Psychodidae) en Colombia. Biomédica. 2003;23:341-50. [ Links ]
61. Chaves LF, Pascual M. Climate cycles and forecasts of cutaneous leishmaniasis, a nonstationary vector-borne disease. PLoS Med. 2006. http://dx.doi.org/10.1371/journal.pmed.0040123 [ Links ]
62. Montenegro F, Arroyo C, Vivero R, Uribe SI. Presencia del género Lutzomyia (Diptera: Psychodidae: Phlebotominae) en focos históricos de bartonelosis en el departamento de Nariño – Colombia. Revista Facultad de Salud. 2013;5:33-6. [ Links ]
63. Tesh RB, Boshell J, Modi GB, Morales A, Young DG, Corredor A. Natural infection of humans, animals and phlebotomine sand flies with Alagoas serotype of vesicular stomatitis virus in Colombia. Am J Trop Med Hyg. 1987;36:653-61. [ Links ]
64. Galvis F, Espinosa Y, Fernández N, Gutiérrez R, Galati EA, Sandoval CM. The sandfly fauna, anthropophily and the seasonal activities of Pintomyia spinicrassa (Diptera: Psychodidae: Phlebotominae) in a focus of cutaneous leishmaniasis in northeastern Colombia. Mem Inst Oswaldo Cruz. 2013;108:297-302. http://dx.doi.org/10.1590/S0074-02762013000300007 [ Links ]
65. Alexander JB, Usma MC, Cadena H, Quesada BL, Solarte Y, Roa W, et al. Phlebotomine sandflies associated with a focus of cutaneous leishmaniasis in Valle del Cauca, Colombia. Med Vet Entomol. 1995;9:273-8. http://dx.doi.org/10.1111/j.1365-2915.1995.tb00133.x [ Links ]
66. Pardo RH, Cabrera OL, Becerra J, Fuya P, Ferro C. Lutzomyia longiflocosa, posible vector en un foco de leishmaniasis cutánea en la región subandina del departamento del Tolima, Colombia, y el conocimiento que tiene la población sobre este insecto. Biomédica. 2006;26:95-108. http://dx.doi.org/10.7705/biomedica.v26i1.1504 [ Links ]
67. Vergara D, Bejarano EE, Carrillo LM, Vélez ID. Primer Informe de Lutzomyia yuilli (Young & Porter 1972) y Lutzomyia triramula (Fairchild & Hertig 1952) (Diptera: Psychodidae) en el Departamento de Caldas, Colombia. Biota Neotropi. 2008;8:251-3. http://dx.doi.org/10.1590/S1676-06032008000300022 [ Links ]
68. Cárdenas R, Pabón E, Anaya H, Sandoval C. Presencia de Lutzomyia longiflocosa (Díptera: Psychodidae) en el foco de leishmaniasis tegumentaria americana del municipio de Ábrego, Norte de Santander. Primer registro para el departamento. Clon. 2005;3:7-14. [ Links ]
69. Acosta LA, Mondragón-Shem K, Vergara D, Vélez-Mira A, Cadena H, Carrillo L. Ampliación de la distribución de Lutzomyia longipalpis (Lutz & Neiva, 1912) (Diptera: Psychodidae) en el departamento de caldas: potencial aumento del riesgo de leishmaniasis visceral. Biomédica. 2013;33:319-25. http://dx.doi.org/10.7705/biomedica.v33i2.762 [ Links ]
70. Bejarano EE, Sierra D, Vélez ID. Dos nuevos registros de Lutzomyia (Diptera: Psychodidae) para el departamento de Risaralda, Colombia. Rev Col Entomol. 2007;33:43-4. [ Links ]
71. Barreto M, Burbano ME, Barreto P. Nuevos registros de flebotominos (Diptera: Psychodidae) y triatominos (Hemiptera: Reduviidae) para Risaralda, Cauca y Valle del Cauca, Colombia. Colomb Med. 1997;28:116-22. [ Links ]
72. Cárdenas E, Munstermann L, Martínez O, Corredor D, Ferro C. Genetic variability among populations of Lutzomyia (Psathyromyia) shannoni (Dyar 1929) (Diptera: Psychodidae: Phlebotominae) in Colombia. Mem Inst Oswaldo Cruz. 2001;96:189-96. http://dx.doi.org/10.1590/S0074-02762001000200010 [ Links ]
73. Sierra D, Vélez ID, Uribe S. Identificación de Lutzomyia spp. (Diptera: psychodidae) grupo verrucarum por medio de microscopía electrónica de sus huevos. Rev Biol Trop. 2000;48:615-22. [ Links ]
74. Barreto M, Burbano ME, Barreto P. Registros de Lutzomyia (Diptera: Psychodidae) en nuevas localidades de Colombia. Colomb Med. 2006;37:39-45. [ Links ]
75. Alexander B. Biology and control of sand flies in Colombian coffee plantations. Bol Dir Malariol San Amb. 1995;35:21-8. [ Links ]
76. Morales A, Osorno-Mesa E, de Osorno F, Muñoz de Hoyos P. Phlebotominae de Colombia (Diptera, Psychodidae) V. Descripción de una nueva especie de Lutzomyia. Rev Acad Colomb.Cienc. 1969;13:383-90. [ Links ]
77. Escovar J, Bello FJ, Morales A, Moncada L, Cárdenas E. Life tables and reproductive parameters of Lutzomyia spinicrassa (Diptera: Psychodidae) under laboratory conditions. Mem Inst Oswaldo Cruz. 2004;99:603-7. http://dx.doi.org/10.1590/S0074-02762004000600012 [ Links ]
78. Testa JM, Montoya-Lerma J, Cadena H, Oviedo M, Ready PD. Molecular identification of vectors of Leishmania in Colombia: Mitochondrial introgression in the Lutzomyia townsendi series. Acta Trop. 2002;84:205-18. http://dx.doi.org/10.1016/S0001-706X(02)00187-0 [ Links ]
79. Rozeboom LE. Flebotomus suis, a new Flebotomus from Panama (Diptera: Psychodidae). Am J Trop Med Hyg. 1940;32:8-11. [ Links ]
80. Kreutzer RD, Corredor A, Grimaldi G, GrogL GR, Rowton ED, Young DG, et al. Characterization of Leishmania colombiensis sp. n (Kinetoplastida: Trypanosomatidae), a new parasite infecting humans, animals, and phlebotomine sand flies in Colombia and Panama. Am J Trop Med Hyg. 1991;44:662-75. [ Links ]
81. Travi BL, Vélez ID, Brutus L, Segura I, Jaramillo C, Montoya J. Lutzomyia evansi, an alternate vector of Leishmania chagasi in a Colombian focus of visceral leishmaniasis. Trans R Soc Trop Med Hyg. 1990;84:676-7. http://dx.doi.org/10.1016/0035-9203(90)90142-2 [ Links ]
82. Feliciangeli MD, Rodríguez N, De Guglielmo Z, Rodríguez A. The re-emergence of American visceral leishmaniasis in an old focus in Venezuela. II. Vectors and parasites. Parasite. 1999;6:113-20. [ Links ]
83. Vivenes A, Oviedo M, Márquez JC, Montoya-Lerma J. Effect of a second bloodmeal on the oesophagus colonization by Leishmania mexicana complex in Lutzomyia evansi (Diptera: Psychodidae). Mem Inst Oswaldo Cruz. 2000;96:281-3. http://dx.doi.org/10.1590/S0074-02762001000300001 [ Links ]
84. Bejarano EE, Uribe S, Rojas W, Vélez ID. Phlebotomine sand flies (Diptera: Psychodidae) associated with the appearance of urban leishmaniasis in the city of Sincelejo, Colombia. Mem Inst Oswaldo Cruz. 2002;97:645-7. http://dx.doi.org/10.1590/S0074-02762002000500010 [ Links ]
85. Cochero S. Papel de Lutzomyia evansi (Diptera: Psychodidae) como vector de leishmaniasis visceral en un foco de Los Montes de María (tesis). Sincelejo: Universidad de Sucre; 2003. [ Links ]
86. Ibáñez-Bernal S, Rodríguez G, Gómez C, Ricardez J. First record of Lutzomyia evansi (Nuñez-Tovar, 1924) in Mexico (Diptera: Psychodidae, Phlebotominae). Mem Inst Oswaldo Cruz. 2004;99:127-9. http://dx.doi.org/10.1590/S0074-02762004000200002 [ Links ]
87. Christensen HA, Fairchild GB, Herrer A, Johnson CM, Young DG, De Vásquez AM. The ecology of cutaneous leishmaniasis in the Republic of Panama. J Med Entomol. 1983;20:463-84. [ Links ]
88. Morales A, Corredor A, Cáceres E, Ibagos AL, Rodríguez CI. Aislamiento de tres cepas de Leishmania a partir de Lutzomyia trapidoi en Colombia. Biomédica. 1981;4:37-41. [ Links ]
89. Gómez EA, Hashiguchi Y. Vector entomology 1. Natural infections of sand flies with Leishmania promastigotes. En: Hashiguchi Y, editor. Studies on New World leishmaniasis and its transmission, with particular reference to Ecuador. Kochi: Kyowa Printing; 1987. p. 70-8. [ Links ]
90. Walters LL, Chaplin GL, Modi GB, Tesh RB. Ultrastructural biology of Leishmania (Viannia) panamensis (= Leishmania braziliensis panamensis) in Lutzomyia gomezi (Diptera: Psychodidae): A natural host-parasite association. Am J Trop Med Hyg. 1989;40:19-39. [ Links ]
91. Feliciangeli MD, Rodríguez N, Bravo A, Arias F, Guzmán B. Vectors of cutaneous leishmaniasis in north-central Venezuela. Med Vet Entomol. 1994;8:317-24. http://dx.doi.org/10.1111/j.1365-2915.1994.tb00095.x [ Links ]
92. Jaramillo C, Travi BL, Montoya J. Vector competence of some neotropical sandflies for the Leishmania (Viannia) braziliensis complex. Med Vet Entomol. 1994;8:1-7. http://dx.doi.org/10.1111/j.1365-2915.1994.tb00375.x [ Links ]
93. Muñoz G. The sandfly vectors and epidemiology of cutaneous leishmaniasis in the Landázuri focus, Colombia (tesis). London: University of London; 1998. [ Links ]
94. Rodríguez N, Aguilar CM, Barrios MA, Barker DC. Detection of Leishmania braziliensis in naturally infected individual sand flies by the polymerase chain reaction. Trans R Soc Trop Med Hyg. 1999;93:47-9. [ Links ]
95. Santamaría E, Ponce N, Zipa Y, Ferro C. Presencia en el peridomicilio de vectores infectados con Leishmania (Viannia) panamensis en dos focos endémicos en el occidente de Boyacá, piedemonte del valle del Magdalena medio, Colombia. Biomédica. 2006;26:82-94. [ Links ]
96. Travi BL, Montoya J, Solarte Y, Lozano L, Jaramillo C. Leishmaniasis in Colombia. I. Studies on the phlebotomine fauna associated with endemic foci in the Pacific coast region. Am J Trop Med Hyg. 1988;39:261-6. [ Links ]
97. Furuya M, Shiraishi M, Akimaru Y, Mimori T, Gómez LE, Hashiguchi Y. Natural infection of Lutzomyia hartmanni with Leishmania (Viannia) equatorensis in Ecuador. Parasitol Int. 1998;47:121-6. http://dx.doi.org/10.1016/S1383-5769(98)00009-9 [ Links ]
98. Kato H, Uezato H, Gómez EA, Terayama Y, Calvopina M, Iwata H, et al. Establishment of a mass screening method of sand fly vectors for Leishmania infection by molecular biological methods. Am J Trop Med Hyg. 2007;77:324-9. [ Links ]
99. Santamaría E, Castillo M, Cárdenas R, Bello F, Ayala M, Ferro C. Competencia vectorial de las especies de Lutzomyia del grupo Verrucarum (Diptera: Psychodidae) en un foco endémico de Leishmania braziliensis en Reventones, Cundinamarca. Biomédica. 1999;19:115-26. [ Links ]
100. Casas M, Angulo VM, Fajardo E. Kala-Azar en Colombia. Acta Med Colom. 1983;8:302-9. [ Links ]
101. Ferro C, Morrison AC, Torres M, Pardo R, Wilson ML, Tesh RB. Species composition and relative abundance of sand flies of the genus Lutzomyia (Diptera: Psychodidae) at an endemic focus of visceral leishmaniasis in Colombia. J Med Entomol. 1995;32:527-37. [ Links ]
102. Zeledón R, Hidalgo H, Vásquez A, Urbina A. Atypical cutaneous leishmaniasis in a semiarid region of north-west Costa Rica. Trans R Soc Trop Med Hyg. 1989;83:786. [ Links ]
103. Torrez JM, Le Pont F, Mouchet J, Desjeux P, Richard A. Epidemiologie de la leishmaniose tegumentaire en Bolivie. 1. Description des zones d´etude et frequence de la maladie. Ann Soc Belge Med Trop. 1989;69:297-306. [ Links ]
104. Martínez E, Le Pont F, Torres M, Telleria J, Vargas F, Dujardin JC, et al. Lutzomyia nuñeztovari anglesi (Le Pont & Desjeux, 1984) as a vector of Leishmania amazonensis in a sub-Andean leishmaniasis focus of Bolivia. Am J Trop Med Hyg. 1999;61:846-9. [ Links ]
105. Bastrenta B, Buitrago R, Vargas F, Le Pont F, Torrez M, Flores M, et al. First evidence of transmission of Leishmania (Viannia) lainsoni in a sub-Andean region of Bolivia. Acta Trop. 2002;83:249-53. http://dx.doi.org/10.1016/S0001-706X(02)00129-8 [ Links ]
106. World Health Organization. The leishmaniasis. Technical Report Series: 793. Geneva: World Health Organization; 1984. [ Links ]
107. Rowton ED, De Mata M, Rizzo N, Porter CH, Navin TR. Isolation of Leishmania braziliensis from Lutzomyia ovallesi (Diptera:Psychodidae) in Guatemala. Am J Trop Med Hyg. 1992;46:465-8. [ Links ]
108. Barrios M, Rodríguez N, Feliciangeli DM, Ulrich M, Telles S, Pinardi ME, et al. Coexistence of two species of Leishmania in the digestive tract of the vector Lutzomyia ovallesi. Am J Trop Med Hyg. 1994;51:669-75. [ Links ]
109. Sandoval CM, Angulo VM, Gutiérrez R, Muñoz G, Ferro C. Especies de Lutzomyia (Diptera: Psychodidae) posibles vectores de leishmaniasis en la ciudad de Bucaramanga, Santander, Colombia. Biomédica. 1998;18:161-8. [ Links ]
110. Lawyer PG, Young DG. Experimental transmission of Leishmania mexicana to hamsters by bites of phlebotomine sand flies (Diptera: Psychodidae) from the United States. J Med Entomol. 1987;24:458-62. [ Links ]
111. Ferro C, Cárdenas E, Corredor D, Morales A, Munstermann LE. Life Cycle and fecundity analysis of Lutzomyia shannoni (Dyar) (Diptera: Psychodidae). Mem Inst Oswaldo Cruz. 1998;93:195-9. http://dx.doi.org/10.1590/S0074-02761998000200011 [ Links ]
112. Claborn DM, Rowton ED, Lawyer PG, Brown GC, Keep LW. Species diversity and relative abundance of phlebotomine sand flies (Diptera: Psychodidae) on three Army installations in the southern United States and susceptibility of a domestic sand fly to infection with Old World Leishmania major. Mil Med. 2009;174:1203-8. [ Links ]
113. Maingon R, Feliciangeli D, Ward R, Chance M, Adamson R, Rodríguez N, et al. Molecular approaches applied to the epidemiology of leishmaniasis in Venezuela. Arch Inst Pasteur Tunis. 1993;70:309-24. [ Links ]
114. Perruolo G, Rodríguez N, Feliciangeli MD. Isolation of Leishmania (Viannia) braziliensis from Lutzomyia spinicrassa (species group Verrucarum) Morales Osorno Mesa, Osorno and Hoyos 1969, in the Venezuelan Andean region. Parasite. 2006;13:17-22. http://dx.doi.org/10.1051/parasite/2006131017 [ Links ]
115. Carnevalli, M, Scorza JV. Infección experimental de la Lutzomyia townsendi Ortiz, 1959 con una cepa de Leishmania braziliensis de Venezuela. Bol Dir Malariol San Amb. 1976;16:333-43. [ Links ]
116. Scorza, JV, Delgado O. Morfometría amastigota y desarrollo de cuatro aislados de Leishmania mexicana pilfanoi de Venezuela en Lutzomyia townsendi. Mem Inst Oswaldo Cruz. 1982;77:217-27. [ Links ]
117. Scorza, JV, Anez N. Transmisión experimental de Leishmania garnhami al hámster por la picadura de Lutzomyia townsendi. Rev Cuba Med Trop. 1984;36:139-45. [ Links ]
118. Scorza, JV, Márquez JC, Márquez M. Hallazgo de Lutzomyia townsendi (Ortiz, 1959) naturalmente infectada con Leishmania braziliensis, en la área suburbana de Trujillo, Venezuela. Bol Dir Malariol San Amb. 1984;24:21-8. [ Links ]
119. Hashiguchi Y, Gómez EA, de Coronel VV, Mimori T, Kawabata M. Natural infections with promastigotes in man-biting species of sandflies in leishmaniasis-endemic areas of Ecuador. Am J Trop Med Hyg. 1985;34:440-6. [ Links ]
120. Molina JA. Determinación de la fauna flebotomínea en el noroccidente de Boyacá. Implicación de Lutzomyia trapidoi como especie vectora en el foco de leishmaniasis de la Zambera (tesis). Bogotá: Universidad de los Andes; 1995. [ Links ]
121. Lainson R, Ryan L, Shaw JJ. Infective stages of Leishmania in the sand fly vector and some observations on the mechanism of transmission. Mem Inst Oswaldo Cruz. 1987;82:421-41. http://dx.doi.org/10.1590/S0074-02761987000300015 [ Links ]
122. Arias JR, Miles MA, Naiff RD, Povoa MM, de Freitas RA, Biancardi CB, et al. Flagellate infections of Brazilian sand flies (Diptera: Psychodidae): Isolation in vitro and biochemical identification of Endotrypanum and Leishmania. Am J Trop Med Hyg. 1985;34:1098-108. [ Links ]
123. Rojas E, Scorza JV, Espinoza A. Excretion of promastigotes of Leishmania pifanoi by experimentally infected Lutzomyia youngi. Rev Saúde Pública. 1995;29:496-502. http://dx.doi.org/10.1590/S0034-89101995000600011 [ Links ]
124. Jiménez AE, Rojas JC, Vargas F, Herrero M. Temporal and spatial variation of phlebotomine (Diptera: Psychodidae) community diversity in a cutaneous leishmaniasis endemic area of Costa Rica. J Med Entomol. 2000;37:216-21. http://dx.doi.org/10.1603/0022-2585-37.2.216 [ Links ]
126. Comer JA, Irby WS, Kavanaugh DM. Hosts of Lutzomyia shannoni (Diptera: Psychodidae) in relation to vesicular stomatitis virus on Ossabaw Island, Georgia, U.S.A. Med Vet Entomol. 1994;8:325-30. http://dx.doi.org/10.1111/j.1365-2915.1994.tb00096.x [ Links ]
127. Martins AV, Silva E, Falçao AL. Lutzomyia sherlocki sp. n., do Estado de Mato Grosso, Brasil (Diptera, Psychodidae). Rev Brasil Biol. 1971;31:415-8. [ Links ]
128. Llanos BZ, Martins AV, da Silva J. Estudos sobre os flebotomíneos do Peru (Diptera, Psychodidae, Phlebotominae) 1. Departamento de Cuzco; 2. Descriçao das fèmeas de Lutzomyia campbelli e Lutzomyia sherlocki e redescriçao do macho e descriçao de fêmea de Lutzomyia octavioi. Rev Brasil Biol. 1975;35:655-64. [ Links ]
129. Florin, D. Morphometric and molecular analyses of the sand fly species Lutzomyia shannoni (Dyar 1929) Diptera:Psychodidae:Phlebotiminae) collected from seven different geographical areas in the Southeastern United States (tesis). Bethesda, Maryland, EUA: University of Health Sciences Bethesda; 2006. [ Links ]













