Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.34 no.4 Bogotá Oct./Dec. 2014
https://doi.org/10.7705/biomedica.v34i4.2312
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v34i4.2312
1 Línea de Investigación en Epidemiología, Diagnóstico y Control de Enfermedades causadas por Trematodos, GIEM, Facultad de Salud, Universidad Industrial de Santander, Bucaramanga, Colombia
2 Semillero de Investigación en Enfermedades Parasitarias y Parasitología (SIEPA), Facultad de Ciencias Básicas, Universidad de Pamplona, Pamplona, Colombia
3 Unidad de Malacología Médica y Trematodos, Programa de Estudio y Control de Enfermedades Tropicales (PECET), Universidad de Antioquia, Medellín, Colombia
Contribución de los autores:
Nelson Uribe: salidas de campo en Santander, estudios fenotípicos y moleculares preliminares
Wlda Margarita Becerra: salidas de campo en Norte de Santander y estudios fenotípicos
Luz Elena Velásquez: análisis morfológico y molecular de los ejemplares de Nariño, Norte de Santander y Santander
Todos los autores participaron en la escritura del artículo.Institución donde se ejecutó el trabajo: Programa de Estudio y Control de Enfermedades Tropicales, PECET, Unidad de Malacología Médica y Trematodos (UMMT), Sede de Investigación Universitaria, Universidad de Antioquia, Medellín, Colombia
Introducción. La fasciolosis es la enfermedad transmitida por vectores con mayor distribución latitudinal, longitudinal y altitudinal, debido a la capacidad colonizadora del parásito Fasciola hepatica y de sus huéspedes intermediarios, los moluscos limneidos. Estos caracoles se investigan por su importancia epidemiológica, pero su identificación taxonómica es difícil por la similitud fenotípica entre especies. En este sentido, con respecto a Lymnaea cousini , un huésped de F. hepatica en Colombia, existe incertidumbre en razón de su similitud morfológica con L. meridensis , descrita recientemente en Venezuela.
Objetivo. Confirmar con el marcador del gen de la citocromo oxidasa I en el ADN mitocondrial COI (ADNmt), el estatus taxonómico de ejemplares morfológicamente caracterizados como L. cousini provenientes de Nariño, Norte de Santander y Santander (Colombia), depositados en la Colección de Moluscos Vectores de la Universidad de Antioquia, VHET N° 37.
Materiales y métodos. Para la amplificación del COI mitocondrial, se extrajo ADN total del pie de cada ejemplar con el estuche DNeasy Blood and Tissue (Qiagen ® ). Los productos amplificados se enviaron a secuenciar a Macrogen Inc., Corea. Las 27 secuencias generadas en esta investigación se compararon con secuencias publicadas en el GenBank, incluidas las secuencias de la localidad tipo de L. cousini.
Resultados. Se encontraron dos nuevos haplotipos de L. cousini para Colombia. Los especímenes de Nariño correspondían al haplotipo A, referenciado en Ecuador, y los especímenes de Santander y Norte de Santander, a un nuevo haplotipo al que se denominó D.
Conclusión. Mediante el marcador mitocondrial del COI , se confirmó que los especímenes pertenecían a la especie L. cousini . Con el hallazgo se duplicó el número de haplotipos conocidos de la especie en Colombia y se amplió su distribución geográfica al suroeste y nordeste de la región altoandina colombiana.
Palabras clave: Lymnaea , Fasciola hepatica , bovinos, Colombia.
doi: http://dx.doi.org/10.7705/biomedica.v34i4.2312
Lymnaea cousini , intermediate host of Fasciola hepatica in the Colombian high tropical Andes, and its new haplotypes confirmed with the mitochondrial marker cytochrome oxidase I
Introduction: Fasciolosis is the disease transmitted by vectors with the highest latitudinal, longitudinal, and altitudinal distribution due to the colonizing capacity of the parasite Fasciola hepatica and its intermediate hosts, Lymnaeidae mollusks. These snails are under research due to their epidemiological importance, but their taxonomic identification is difficult given their interspecific phenotypical similarity. For this reason, there is uncertainty regarding Lymnaea cousini –a host of F. hepatica in Colombia– due to the morphological similarity it has with Lymnaea meridensis , recently described for Venezuela.
Objective: To confirm with the COI marker (ADNmt) the taxonomic status of individuals morphologically identified as L. cousini from Nariño, Norte de Santander, and Santander (Colombia), deposited in the Vector Mollusks Collection VHET No. 37 of Universidad de Antioquia.
Materials and methods: The amplification of the mitochondrial COI required total DNA extraction of each individual's foot using the DNeasy Blood and Tissue Kit (Qiagen®). Products amplified were sent for sequencing to Macrogen Inc., Korea. Twenty seven sequences generated in this research were compared to sequences published in the GenBank, including sequences of the type locality of L. cousini .
Results: Two new haplotypes of L. cousini were obtained for Colombia. Specimens from Nariño correspond to haplotype A, referenced for Ecuador, and specimens from Santander and Norte de Santander belong to a new haplotype we called haplotype D.
Conclusion : By using the mitochondrial COI marker, we confirmed that the species under study did correspond to L. cousini . The number of known haplotypes of the species for Colombia has been duplicated and its geographical distribution has been extended to the southwest and northeast of the Colombian high Andean region.
Key words: Lymnaea , Fasciola hepatica , cattle, Colombia.
doi: http://dx.doi.org/10.7705/biomedica.v34i4.2312
La fasciolosis se considera la enfermedad trans- mitida por vectores con más amplia distribución latitudinal, longitudinal y altitudinal. Su expansión se relaciona con la gran capacidad de colonización del parásito Fasciola hepatica (Trematoda: Digenea) y de sus huéspedes intermediarios, varias especies de moluscos dulciacuícolas asignados a la familia Lymnaeidae. Se la señala como una de las parasitosis que causa mayor detrimento en la economía pecuaria mundial debido al deterioro ocasionado en la salud de los bovinos y de los ovinos. También afecta a las personas, aunque en menor proporción (1).
En Colombia, F. hepatica prevalece en los bóvidos del hato lechero nacional porque las condiciones ambientales apropiadas para la producción láctea también son idóneas para el crecimiento de las poblaciones de los caracoles limneidos, que actúan co mo huéspedes intermediarios del parásito (2). En consecuencia, en los estudios de campo sobre fasciolosis en el país, se está incluyendo la búsqueda e identificación de los limneidos, al comprender que esa información se necesita para establecer los focos de la infección, su comportamiento a lo largo del tiempo y las zonas en riesgo (3). Sin embargo, la identificación de estos caracoles entraña resolver las dificultades planteadas por su variabilidad en la especie misma, dada la similitud fenotípica entre algunas especies de limneidos y la falta de información sobre las características morfológicas de la concha y de las partes blandas. Para resolver dicha dificultad, hoy se recurre al análisis de secuencias del ADN, lo que ha permitido clasificar las especies de limneidos, validarlas e, incluso, establecer las relaciones filogenéticas con grupos cercanos (4,5).
Lymnaea bogotensis (6) fue el primer molusco rese ñado como huésped de F. hepatica en Colombia, en focos de la enfermedad ubicados en el altiplano cundiboyacense (7). La sensibilidad del limneido a la infección por el digeneo se estableció bajo condiciones de laboratorio (8) y, con base en las características morfológicas del aparato reproductor, se determinó que L. bogotensis era una especie sinónimo de L. cousini (9,10), descrita en 1887, con localidad tipo en Ecuador. Posteriormente, la presencia de esta especie se registró en focos de fasciolosis ovina y bovina de Norte de Santander, localizados por encima de los 3.000 msnm (11,12) .
Las particularidades morfológicas del complejo peneal de L. cousini han facilitado su identificación taxonómica (13). Sin embargo, la descripción reciente de L. meridensis (14), con localidad tipo en Venezuela, ha generado incertidumbre sobre la validez del nombre asignado a los especímenes colombianos, debida a la gran similitud entre la morfología de ambas especies. Por lo tanto, el objetivo de esta investigación fue verificar el estatus taxonómico específico de los moluscos identificados como L . cousini a partir de sus rasgos morfológicos, en individuos depositados en la Colección de Moluscos Vectores de la Universidad de Antioquia, VHET N° 37, mediante el análisis de un fragmento del marcador molecular mitocondrial del gen de la citocromo oxidasa I ( COI ).
Materiales y métodos
El material biológico objeto de esta investigación correspondió a ejemplares de L. cousini deposi tados en la Colección de Moluscos Vectores de la Universidad de Antioquia, VHET N° 37, los cuales fueron recolectados en nueve fincas ubicadas en tres departamentos colombianos: una en Túquerres (Nariño), otra en Chitagá (Norte de Santander), y siete en la provincia de García Rovira (Santander ) (cuadro1). De las muestras de cada finca se tomaron tres ejemplares para el estudio de genética molecular. Las partes blandas de los ejemplares estaban conservadas en etanol al 96 %.

Del tejido del pie de cada uno de los 27 ejemplares se extrajo el ADN total con el estuche DNeasy Blood and Tissue (Qiagen ® ), siguiendo las especificaciones del fabricante. El ADN se cuantificó en un Nanodrop ® 1000 Thermo Scientific y el ADN extraído se almacenó a -20 °C.
El ADN se amplificó en la región de código de barras por reacción en cadena de la polimerasa ( Polymerase Chain Reaction , PCR) con los ceba dores universales desarrollados por Folmer, et al., (15) para el gen COI (ADNmt). La mezcla de reacción se hizo en un volumen final de 30 µl, los cuales contenían 3 µl de solución tampón 10X, 2 µl de MgCl 2 a 25 mM, 1 µl de cada dNTP a 5 mM, 1,8 µl de cada cebador a 5 µM, 0,2 µl de Taq polimerasa en 0,5 unidades por reacción y 3 µl de ADN. La PCR se hizo con una desnaturalización inicial a 94 °C durante cuatro segundos, seguida de 35 ciclos de desnaturalización a 92 °C durante dos segundos, hibridación de los cebadores a 45 °C durante un segundo y extensión a 72 °C durante un segundo, y se terminó con una extensión final a 72 °C durante 10 segundos. La amplificación se llevó a cabo en un termociclador C1000 de Biorad.
La amplificación del fragmento del COI se comprobó mediante electroforesis en gel de agarosa al 1 % (45 minutos a 100 V), teñido con bromuro de etidio y solución tampón TAE (tris, acetato, EDTA). Para determinar el tamaño del producto amplificado, se utilizó un marcador de peso molecular de Hyperladder®. Las bandas obtenidas se visualizaron y fotografiaron en el analizador de imágenes Geldoc ® (Bio-Rad).
Los productos amplificados se purificaron usando el sistema Wizard PCR Preps DNA Purification System Kit ® de Promega; para la secuenciación se enviaron 25 µl de los productos amplificados a Macrogen Inc., Corea (www.macrogen.com).
Los cromatogramas se editaron usando el programa BioEdit, versión 7.0.9 (16). Para determinar los porcentajes de identidad de estas secuencias, se utilizó la herramienta BLASTn en la base de datos GenBank (17). Los alineamientos múltiples se realizaron en ClustalX 2.0 (18); en el análisis se incluyeron las secuencias del COI obtenidas de nuestros especímenes, las disponibles en el GenBank de L. cousini y de Galba cousini , las de otras especies de limneidos hallados en Colombia, la de L. meridensis de Venezuela y una secuencia de Physa acuta como grupo externo (cuadro2).
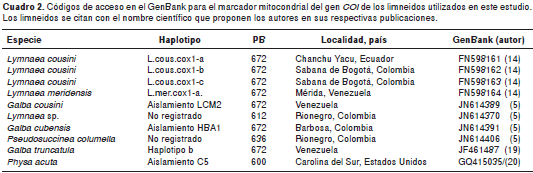
Las secuencias se analizaron por el método de neighbour-joining con corrección de distancias genéticas y bajo el modelo de sustitución de nucleótidos Kimura de dos parámetros ( Kimura 2-parameter model, K2P), así como mediante la técnica de bootstrapping con 10.000 réplicas mediante el programa MEGA, versión 4.02 (5,14).
Resultados
Los moluscos identificados como L. cousini en la colección VHET N° 37 reúnen las siguientes características morfológicas en el complejo peneal: la longitud de la bolsa del pene siempre es mayor que la longitud del prepucio y se observa un anillo de papilas alrededor de la bolsa del pene en el extremo donde se inserta el vaso deferente. Este círculo de papilas está ausente en los ejemplares de Venezuela descritos como L. meridensis (14) (cuadro 3).

Análisis de las secuencias del COI
Se obtuvo un fragmento amplificado de 674 pares de bases del gen COI de los 27 caracoles limneidos objeto de este estudio; dicho fragmento se redujo a 600 pb para hacer el análisis de homología con las secuencias publicadas en el GenBank. En el alineamiento de las secuencias se identificaron dos haplotipos a partir del análisis de las distancias intraespecíficas, el haplotipo A y el haplotipo D, que se diferencian en cinco pares de bases, con una variación de 0,8 %.
Los tres ejemplares de Túquerres (Nariño) presentaron una secuencia del COI que correspondió 100 % a la registrada como " L. cousini haplotipo L.cous.cox1-a, del Ecuador, localidad tipo" (14). Este haplotipo mostró la mayor divergencia intraespecífica, de 5,5 % (33/600), con G. cousini de Venezuela (cuadro 4, figura 1).
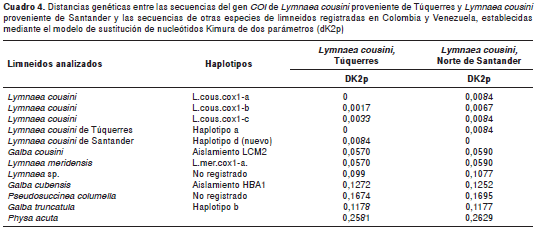
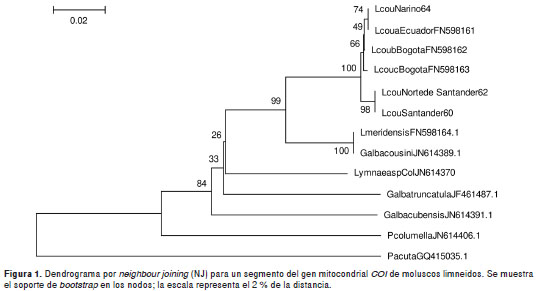
Los limneidos de Santander y de Norte de Santander se agruparon en un único haplotipo y presentaron una menor distancia intraespecífica con L. cousini haplotipo L.cous.cox1-b (0,8 %) de la sabana de Bogotá, en tanto que la mayor distancia intraespecífica, 5,6 % (34/600 ), se obtuvo con respecto a G. cousini de Venezuela (cuadro 4, figura 1).
Los especímenes de los departamentos de Norte de Santander y de Santander correspondieron a un nuevo haplotipo, el cual se designó como L. cousini D.
Los limneidos de los departamentos de Nariño, Norte de Santander y Santander quedaron incluidos en un clado que reúne los haplotipos A, B, C y D de L. cousini registrados en Colombia, y es independiente del clado de G. cousini de Venezuela (figura 1).
En cuanto a las distancias entre especies, nuestros ejemplares de L. cousini A y L. cousini D presentaron la menor divergencia con L. meridensis de Venezuela, 5,5 % (33/600) y 5,6 % (34/600), respectivamente, y la mayor divergencia con Pseudosuccinea columella de Rionegro, Colombia, 15,1 % (91/600) (figura 1).
Galba cousini y L. meridensis , de la misma loca lidad en Venezuela, presentaron un único haplotipo (analogía del 100 %), por lo que conformarían una sola especie según este marcador molecular (figura 1).
En el GenBank se depositó una secuencia de cada una de nuestras localidades. Los números de acceso son los siguientes: Norte de Santander, KJ495739 ; Santander, KJ495740, y Nariño, KJ495741 .
Discusión
El análisis del gen COI (ADNmt) confirma que los ejemplares estudiados y consignados en la colección de moluscos vectores de la Universidad de Antioquia, VHET N° 37, pertenecen a L. cousini , pues se convalidaron con especímenes de la localidad tipo en Ecuador (14).
Se encontró que L. cousini de Nariño comparte un único haplotipo con L. cousini de Ecuador. A su vez, la distancia intraespecífica entre estos ejemplares y los de L. cousini de Santander y de Norte de Santander es de 0,8 % (difieren en 5 pb). En contraste, nuestros especímenes presentaron una variación de 5,5 % (difieren en 33 pb) con G. cousini (= L. meridensis ) de Venezuela.
Con este estudio se aumenta en dos el número de los haplotipos del COI de L. cousini en Colombia, puesto que en el 2011 se registró la presencia de los haplotipos L.cous.cox1- b y L.cous.cox1-c para la sabana de Bogotá, a los que se agrega el nuevo haplotipo D obtenido en este estudio de los ejemplares provenientes de Norte de Santander y de Santander, y el haplotipo A, que se registró en los moluscos de Túquerres (Nariño), haplotipo este descrito en el 2011 para una localidad de Ecuador (14).
Estos resultados muestran que G. cousini y L. meridensis son conespecíficas; en futuros estudios se podrá establecer la sinonimia de estas dos especies, utilizando el principio de prioridad del Código Internacional de Nomenclatura Zoológica.
En cuanto a la importancia de L. cousini haplotipo L.cous.cox1-d como huésped intermediario de F. hepatica , destacamos el hecho de que los ejemplares de Norte de Santander se recolectaron en una finca durante un estudio longitudinal sobre fasciolosis en el que 6,81 % de los caracoles y 74,66 % de los óvidos estaban parasitados por digeneos (12). Asimismo, en un estudio transversal sobre la distomatosis hepática en fincas de Santander se estimó la prevalencia de la fasciolosis bovina (42, 7 %) y la ovina (39,4 %) en fincas donde sólo se recolectaron ejemplares de L. cousini , algunos de los cuales se incluyeron en la presente investigación (Uribe N, Velásquez L, Pointier JP, García C. Fasciolosis ovina y bovina en García Rovira, Colombia. Memorias del XXI Congreso Latinoamericano de Parasitología . FLAP, 2013. p. 151).
No podemos señalar a L. cousini haplotipo L.cous. cox1- a de Túquerres (Nariño) como huésped intermediario de F. hepatica , debido a que el hallazgo de los caracoles fue incidental, y estos se enviaron al PECET con el fin de determinar la especie. Sin embargo, no se descarta su importancia epidemiológica, pues en los bóvidos de ese municipio se registra fasciolosis (21). Además, en Ecuador se ha involucrado en focos de la infección (22).
Esta investigación reveló la amplia distribución geográfica de L. cousini en Colombia, la cual se ha incrementado en longitud y en latitud con los registros para la zona altoandina del noreste y del suroeste del país. Se amplió, igualmente, su distribución altitudinal hasta un rango entre los 2.600 y 3.800 msnm, hecho que era de esperarse para los limneidos en Colombia si se observa el mapa de riesgo de la fasciolosis, el cual se levantó con base en la información sobre la eva potranspiración, los rangos de temperatura y la precipitación necesarias para el desarrollo de estos moluscos (3).
Se considera que hay un riesgo de desarrollo de focos de fasciolosis en las áreas del territorio colombiano dedicadas a la producción ovina y bovina donde habitan los diferentes haplotipos de L. cousini . Además, los ecosistemas dulciacuícolas altoandinos, que integran hoyas hidrográficas y que se encuentran contaminados con el parásito, pueden contribuir a su dispersión. Por ello, no debe descartarse el peligro para la salud de quienes, aguas abajo, consumen el líquido sin tratamiento previo.
Todos los autores de este trabajo declaramos que no existe conflicto de intereses.
El estudio de los ejemplares de Norte de Santander y Nariño se financió con recursos propios de las investigadoras. Para el estudio de los ejemplares de Santander se contó con el apoyo económico de Colciencias mediante el proyecto de investigación No. 110252128902, convocatoria 521 de 2010.
Correspondencia: Luz Elena Velásquez, Unidad de Malacología Médica y Trematodos, PECET, Sede de investigación Universitaria, Universidad de Antioquia, Calle 62 N° 52-59, torre II, piso 7, laboratorio 730, Medellín, Colombia Teléfono: (574) 219 6514; fax: (574) 219 6511 luzelena333@yahoo.com
1. Mas-Coma S, Valero MA, Bargues MD. Fasciola , lymnaeids and human fascioliasis, with a global overview on disease transmission, epidemiology, evolutionary genetics, molecular epidemiology and control. Adv Parasitol. 2009;69:41-146. http://dx.doi.org/10.1016/S0065-308X(09)69002-3 [ Links ]
2. Becerra WM. Consideraciones sobre estrategias sostenibles para el control de Fasciola hepatica en Latinoamérica. Rev Colomb Cienc Pecu. 2001;14:28-35. [ Links ]
3. Valencia-López N, Malone JB, Gómez C, Velásquez LE. Climate-based risk models for Fasciola hepatica in Colombia. Geospatial Health. 2012;6:S75-85. [ Links ]
4. Bargues MD, Horák P, Patzner RA, Pointier JP, Jackiewicz M, Meier-Brook C, et al . Insights into the relationships of Palearctic and Nearctic lymnaeids (Mollusca: Gastropoda) by RDNA ITS-2 sequencing and phylogeny of Stagnicoline intermediate host species of Fasciola hepatica . Parasite. 2003;10:243-55. [ Links ]
5. Correa AC, Escobar JS, Noya O, Velásquez LE, González- Ramírez C, Hurtrez-Boussès S, et al . Morphological and molecular characterization of Neotropic Lymnaeidae (Gastropoda: Lymnaeoidea), vectors of fasciolosis. Infect Genet Evol. 2011;11:1978-88. http://dx.doi.org/10.1016/j.meegid.2011.09.003 [ Links ]
6. Pilsbry HA. South American land and freshwater mollusks. IX - Colombian species. Proc Acad Nat Sci Philadelphia . 1935;87:83-8. [ Links ]
7. Brumpt E, Velásquez J, Ucross H, Brumpt LCh. Découverte de l'hôte intermédiaire Limnaea bogotensis Pilsbry, de la grande douve Fasciola hepatica , en Colombie. Ann Parasit Paris . 1940;17:563. [ Links ]
8. Salazar L, Estrada VE, Velásquez L. Effect of the exposure to Fasciola hepatica (Trematoda: Digenea) on life history traits of Lymnaea cousini and Lymnaea columella (Gastropoda: Lymnaeidae). Exp Parasitol. 2006;114:77-83. http://dx.doi.org/10.1016/j.exppara.2006.02.013 [ Links ]
9. Jousseaume F. Mollusques nouveaux de la République de l'Équateur. Bull Soc Zool France. 1887;12:165-86. [ Links ]
10. Velásquez LE. Synonymy between Lymnaea bogotensis Pilsbry, 1935 and Lymnaea cousini Jousseaume, 1887 (Gastropoda: Lymnaeidae). Mem Inst Oswaldo Cruz. 2006;101:795-9. http://dx.doi.org/10.1016/j.exppara.2006.02.013 [ Links ]
11. Becerra W, López M, Robles Y. Determinación de especies de hospedadores intermediarios de Fasciola hepatica en la finca Tres Esquinas, Vereda Cocuyes del Municipio de Chitagá, Norte de Santander. Revista Clon. 2007;5:5-15. [ Links ]
12. Castro N, Becerra W. Determinación de focos de infección del tremátodo Fasciola hepatica en ovinos y en el hospedador intermediario de la hacienda El Palmar, vereda Presidente, Municipio de Chitagá, Norte de Santander, Colombia. Revista Bistua. 2011;9:64-72. [ Links ]
13. Paraense WL. Lymnaea cousini Jousseaume, 1887 from Ecuador (Gastropoda: Lymnaeidae). Mem Inst Oswaldo Cruz. 1995;90:605-9. http://dx.doi.org/10.1590/S0074-02762004000600005 [ Links ]
14. Bargues MD, Artigas P, Khoubbane M, Mas-Coma S. DNA sequence characterization and phylogeography of Lymnaea cousini and relat ed species, vectors of fascioliasis in northern Andean countries, with description of L. meridensis n. sp. (Gastropoda: Lymnaeidae). Parasit Vectors. 2011;4:132. http://dx.doi.org/10.1186/1756-3305-4-132 [ Links ]
15. Folmer O, Black M, Hoeh W, Lutz R, Vrijenhoek R. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates. Mol Mar Bi ol Biotechnol . 1994; 3:294-9. [ Links ]
16. Hall T. BioEdit: A user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic Acids Symp Ser (Oxf) . 1999; 41:95-8. [ Links ]
17. Benson DA, Clark K, Karsch-Mizrachi I, Lipman DJ, Ostell J, Sayers EW. GenBank. Nucleic Acids Res. 2013;41:D36-42. http://dx.doi.org/10.1093/nar/gkt1030 [ Links ]
18. Larkin M, Blackshields G, Brown N, Chenna R, Mcgettigan P, Mcwilliam H, et al . Clustal W and Clustal X version 2.0. Bioinformatics. 2007;23:2947-8. http://dx.doi.org/10.1093/bioinformatics/btm404 [ Links ]
19. Bargues MD, González LC, Artigas P, Mas-Coma S. A new baseline for fascioliasis in Venezuela: Lymnaeid vectors ascertained by DNA sequencing and analysis of their relationships with human and animal infection. Parasit Vectors . 2011;4:200. http://dx.doi.org/10.1186/1756-3305-4-200 [ Links ]
20. Wethington AR , Wise J, Dillon RT Jr . Genetic and morphological characterization of the Physidae of South Carolina (Gastropoda: Pulmonata: Basommatophora), with description of a new species. Nautilus. 2009;124:282-92. [ Links ]
21. Betancourt JA, Yépez B, Aristizábal D, Negrete EE, Valencia HF, Bravo E, et al . Seguimiento a problemas sanitarios en bovinos y fincas del departamento de Nariño asociadas con encharcamientos. Bogotá: CORPOICA; 2012. p. 1-17. [ Links ]
22. Villavicencio A, Carvalho de Vasconcellos M. First report of Lymnaea cousini Jousseaume, 1887 naturally infected with Fasciola hepatica (Linnaeus, 1758 ) (Trematoda: Digenea) in Machachi, Ecuador. Mem Inst Oswaldo Cruz. 2005;100:735-7 . http://dx.doi.org/10.1590/S0074-02762005000700010 [ Links ]













