Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157
Biomédica vol.34 no.4 Bogotá out.dez. 2014
https://doi.org/10.7705/biomedica.v34i4.2204
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v34i4.2204
Laboratorio de Investigaciones en Parasitología Tropical, Departamento de Biología, Facultad de Ciencias, Universidad del Tolima, Ibagué, Colombia
Contribución de los autores:
Todos los autores participaron activamente en la preparación del manuscrito y en los experimentos realizados para la genotipificación de las cepas y clones de T. cruzi .Recibido: 21/11/13; aceptado: 07/06/14
Durante la última década se han reportado numerosos casos de infección por Trypanosoma cruzi por vía oral, debidos a la contaminación de alimentos con heces de triatominos silvestres o con secreciones de reservorios en áreas donde los vectores domiciliados han sido controlados o no hay antecedentes de domiciliación.
Con base en criterios epidemiológicos, clínicos y socioeconómicos, la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) y la Organización Mundial de la Salud (OMS) establecieron una clasificación de los parásitos transmitidos por contaminación de alimentos en diferentes regiones del mundo, en la cual T. cruzi ocupó el décimo lugar de importancia en un grupo de 24 parásitos. Los cambios ambientales, como la deforestación y el calentamiento global, han afectado los ecotopos y el comportamiento de los vectores y de los reservorios de T. cruzi , de manera que estos se han desplazado a nuevas zonas, generando una nueva forma de transmisión por contaminación de alimentos que requiere su evaluación en el país.
La presente revisión aborda la transmisión oral de la enfermedad de Chagas con énfasis en los estudios orientados a identificar los factores de riesgo, las especies de triatominos involucrados, la fisiopatología de la infección oral y los genotipos del parásito que están implicados en esta forma de transmisión en Colombia y en otras regiones de América Latina, así como la necesidad de adoptar políticas para su control y vigilancia epidemiológica.
Palabras clave: Trypanosoma cruzi , enfermedad de Chagas, epidemiología, Colombia.
doi: http://dx.doi.org/10.7705/biomedica.v34i4.2204
Oral transmission of Trypanosoma cruzi : a new epidemiological scenario for Chagas´ disease in Colombia and other South American countries
Many cases of infection caused by the oral transmission of Trypanosoma cruzi have been reported during the last decade. These have been due to the contamination of food by faeces from sylvatic triatomines or by leakage from reservoirs in areas where domiciliated vectors have been controlled or where there has been no prior background of domiciliation.
The United Nations Food and Agriculture Organization (FAO) and the World Health Organization (WHO) have used epidemiological, clinical and socioeconomic criteria for ranking parasites transmitted by the contamination of food in different areas of the world; T. cruzi was placed tenth in importance amongst a group of 24 parasites in such ranking. Environmental changes such as deforestation and global warming have affected ecotopes and the behaviour of T. cruzi vectors and reservoirs so that these have become displaced to new areas, thereby leading to such new transmission scenario caused by the contamination of food, which requires evaluation in Colombia.
The current review deals with the oral transmission of Chagas´ disease, emphasising studies aimed at identifying the pertinent risk factors, the triatomine species involved, the physiopathology of oral infection, the parasite´s genotypes implicated in this type of transmission in Colombia and other Latin American regions, as well as the need for ongoing epidemiological surveillance and control policies.
Key words: Trypanosoma cruzi , Chagas´ disease, epidemiology, Colombia.
doi: http://dx.doi.org/10.7705/biomedica.v34i4.2204
Trypanosoma cruzi es el agente causal de la enfermedad de Chagas, la cual es endémica en 21 países del continente americano (1). En América Latina se estima que entre 7 y 10 millones de personas se encuentran infectadas, con una incidencia anual de 8 casos por 100.000 habitantes y una mortalidad de 10.000 casos al año, aproximadamente (1,2).
En Colombia, se calcula que entre 0,7 y 1,3 millones de personas están infectadas con T. cruzi , y de 3 a 4 millones se encuentran en riesgo de adquirir la infección. El parásito es prevalente a lo largo d el valle del río Magdalena, el altiplano cundiboyacense, la región del Catatumbo, la Sierra Nevada de Santa Marta, el piedemonte llanero y la Serranía de La Macarena ( 3,4 ). Los departamentos con las mayores tasas de infección son: Arauca (21,1 %), Casanare (10 %), Santander (6,3 %), Norte de Santander (5,2 %), Boyacá (3,7 %), Cundinamarca (1,9 %) y Meta (1,7 %) (5).
En la última década, la literatura científica internacional ha demostrado la aparición de numeroso s casos de infección con T. cruzi por vía oral debida a la contaminación de alimentos con heces de triatominos silvestres o con secreciones de reservorios, en regiones como el Amazonas y en áreas de diferentes países latinoamericanos en las cuales los triatominos domiciliados han sido controlados.
El objetivo del presente trabajo se enfocó en la revisión de este nuevo aspecto epidemiológico de la enfermedad de Chagas, haciendo énfasis en los estudios orientados a identificar los factores de riesgo y las especies de triatominos involucradas en la transmisión oral, así como los genotipos del parásito que estarían implicados en la transmisión en Colombia y otras regiones de América Latina, la fisiopatología de la infección oral y la necesidad de nuevas políticas para su control y vigilancia epidemiológica.
Modos de transmisión de Trypanosoma cruzi
Transmisión vectorial
La transmisión vectorial se considera el principal mecanismo de infección en los países endémicos (1). De las 141 especies de triatominos descritas a la fecha, aproximadamente, 125 son exclusivas de América, 26 se han reportado en Colombia y 15 se han encontrado naturalmente infectadas con T. cruzi (6-9).
Transmisión por transfusiones
La transmisión por transfusiones de sangre es el segundo modo de transmisión más frecuente. Su riesgo radica en que puede extenderse más allá de las áreas endémicas, debido a la migración de latinoamericanos hacia países de Norteamérica, Europa, Asia y Oceanía. Aunque se desconocen las cifras concretas, en los países europeos se estima que alrededor del 2 % de los inmigrantes latinos están infectados con T. cruzi y que podrían actuar como donadores de sangre (10). En Estados Unidos, se han documentado cinco casos de infección por T. cruzi asociados a transfusiones de sangre desde la década de los ochenta, y entre 2006 y 2011 se reportaron 1.459 donaciones seropositivas para T. cruzi (11). Con la tamización en bancos de sangre en Latinoamérica desde 1993, se ha disminuido la prevalencia de la infección por transfusiones (12).
Transmisión congénita
Es el principal modo de infección por T. cruzi en los lugares en los que la transmisión vectorial y por transfusión de sangre han sido controladas. Se estima una incidencia de más de 15.000 casos al año en Latinoamérica, principalmente en Argentina, Bolivia y Brasil. En Colombia, se calcula una incidencia anual de 1,04 casos de Chagas congénito por cada 1.000 nacidos (alrededor de 1.000 nuevos casos anuales) (1,13).
Transmisión por vía oral
Aunque sus antecedentes se remontan a la primera mitad del siglo XX, la transmisión oral es una forma de infección que ha recibido atención especialmente en la última década en varias regiones de América Latina, sobre todo en la Amazonia (14).
Después de un periodo de latencia de cinco días a partir de la ingestión, la infección oral se caracteriza por manifestaciones graves, como fiebre prolongada, miocarditis aguda, falla cardiaca y, en algunos casos, meningoencefalitis. También se han reportado gastritis graves, hemorragias digestivas y diarrea (15,16).
Otros estudios sobre la enfermedad de Chagas aguda de transmisión oral han informado la fre cuencia y la gravedad de los síntomas, los cuales varían en los diferentes brotes. Así, en un estudio de 233 pacientes en fase aguda en la Amazonia brasilera, se encontró que 78,5 % (183/233) de los pacientes había contraído la infección en brotes originados probablemente por transmisión oral, cuyas manifestaciones clínicas más frecuentes fueron: fiebre (100 %), cefalea (92,3 %), mialgia (84,1 %), palidez (67 %), disnea (58,4 %), edema de extremidades inferiores (57,9 %), edema de la cara (57,5 %), dolor abdominal (44,2 %), miocarditis (39,9 %) y exantema (27 %). Trece pacientes (5,6 %) murieron, diez de ellos por compromiso cardiovascular, dos por complicaciones de origen digestivo y uno por causa mal definida (17).
En otro estudio en Venezuela, se analizaron los signos y síntomas detectados en cinco pacientes con enfermedad de Chagas de una misma familia con infección oral, y el perfil clínico reveló 17 signos o síntomas, con un promedio por paciente de 12 ± 3 (rango: 9 a 10), ocho de los cuales se presentaron simultáneamente en todos los integrantes de la familia: fiebre, cefalea, edema facial (perimaleolar y carrillos), inflamación y parestesia lingual, vómito, hepatomegalia, esplenomegalia y dolor abdominal. Los demás signos y síntomas presentaron la siguiente distribución: mialgia (80 %), inapetencia (60 %), edema en miembros superiores (20 %), edema en miembros inferiores (40 %), anasarca (60 %), disnea (20 %), taquicardia (40 %), miocarditis (40 %) y derrame pericárdico (40 %). Un hecho sobresaliente de este estudio fue la descripción de edema facial con tumefacción y parestesia lingual, en ausencia del edema bipalpebral (signo de Romaña) y del chagoma de inoculación, frecuente-mente observados en la transmisión vectorial (18). La ausencia del signo de Romaña o chagoma de inoculación en los brotes de trasmisión oral, también ha sido señalada por otros autores (19).
En Colombia, en un estudio de 10 casos de enfer medad de Chagas aguda se reportó que el síntoma predominante en 90 % de los casos había sido la fiebre. Otros síntomas importantes fueron la cefalea, la astenia y la adinamia en 40 % de los casos. Los signos de puerta de entrada no fueron frecuentes, solo un paciente presentó un posible signo de Romaña, que no se pudo confirmar, y otro, un posible chagoma. El 30 % presentó miocarditis y el 20 % desarrolló falla cardiaca, uno de ellos con taponamiento cardiaco que requirió cirugía (ventana pericárdica) y manejo en cuidados intensivos (20).
En otro estudio reciente llevado a cabo en Turbo (Antioquia), se reportó un paciente con cuadro febril de un mes de evolución acompañado de escalofríos, cefalea, malestar general, tos, dificultad respiratoria y hepatomegalia (21). De los casos de transmisión oral se deduce que, además de la fiebre prolongada presente en el 100 % de los pacientes, el edema facial (perimaleolar y carrillos), la esplenomegalia y la hepatomegalia eran síntomas muy frecuentes que incluso superaban las miocarditis. En relación con la gravedad de los síntomas, el compromiso cardiovascular constituye el mayor porcentaje de la causa de muerte en los brotes de transmisión oral de T. cruzi .
La mayoría de los brotes se han asociado al consumo de bebidas preparadas a base de frutas u otros vegetales contaminados con las heces de triatominos o secreciones de mamíferos infectados. Tal es el caso del jugo de asaí ( Euterpe oleracea ) y caña de azúcar en Brasil, el vino de palma y el jugo de naranja en Colombia, el jugo de guayaba en Venezuela, el jugo de "comou" en la Guyana francesa y, recientemente, el jugo de palma de majo en Bolivia. Otra fuente de infección es el consumo de carne de animales mal cocida, o de sangre de algunos reservorios del parásito como el armadillo ( Dasypus spp.), la cual es consumida por algunas comunidades del continente debido a las supuestas propiedades medicinales que posee (22-26).
Por otro lado, con base en criterios epidemiológicos, clínicos y socioeconómicos, en el 2012 se ponderaron por importancia los parásitos transmitidos por contaminación de alimentos en diferentes regiones del mundo. En este estudio, T. cruzi ocupó el décimo lugar de importancia en un grupo de 24 parásitos (27,28).
Los datos anteriores demuestran la existencia de una nueva situación epidemiológica, en la cual la transmisión oral de T. cruzi está surgiendo en áreas con previo control de los vectores domiciliados o en regiones sin antecedentes de domiciliación del parásito. Los cambios ambientales, como la deforestación y el calentamiento global, han afectado los ecotopos y el comportamiento de los vectores y los reservorios de T. cruzi (29,30), de manera que se han desplazado a nuevas zonas, generando una nueva forma de transmisión oral por contaminación de ali mentos que debe valorarse para introducir cambios en las estrategias de control.
Mecanismos moleculares de la infección por Trypanosoma cruzi por vía oral
La invasión del epitelio gástrico por T. cruzi involucra la resistencia a la lisis proteolítica en el estómago, mediada por la presencia de proteínas de la forma tripomastigote específicas de estado, las cuales serían responsables de la adhesión y penetración de las células a la mucosa gástrica y de la pos terior proliferación del parásito en su estado de amastigote (31).
En varios estudios in vivo e in vitro se ha demostrado la resistencia de la proteína gp82 a la digestión péptica en pH ácido, así como su capacidad de unirse a la mucosa gástrica y a las células epiteliales blanco, induciendo la movilización por señalización de Ca +2 y, finalmente, la entrada del parásito a la célula. Otra glucoproteína, la gp30, tiene características similares a las de la gp82 in vitro , pero no tiene capacidad para la invasión celular in vivo (32-34) .
Además de la invasión de T. cruzi a través de la mucosa gástrica, Añez, et al. , describieron el edema facial o perimaleolar en la cara interna de los carrillos, así como la parestesia y el edema lingual, que sugieren una posible penetración y desarrollo del parásito en la cavidad bucal y el esófago (18), hecho aún por demostrarse.
Casos de transmisión oral de Trypanosoma cruzi en América Latina
En América Latina se han reportado alrededor de 1.000 casos de infección aguda por T. cruzi , de los cuales, aproximadamente, 900 se han relacio nado con la trasmisión por vía oral en diferentes regiones de Brasil, Venezuela, Colombia, Bolivia, Guyana Francesa, Argentina y Ecuador (35). Brasil registra el mayor número de casos, alrededor de 587, seguido de Venezuela con 199, Colombia con 49 casos confirmados y 31 casos sospechosos, Bolivia con 14, Guyana Francesa con 9 y Argentina con 2 (cuadro1).
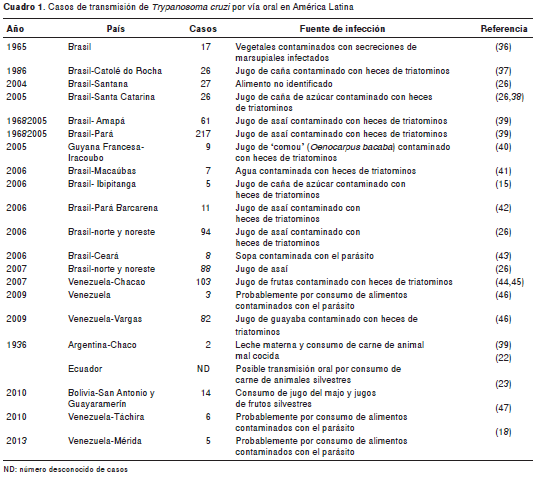
Casos de transmisión oral de Trypanosoma cruzi en Colombia
Entre 1992 y 2011, se registraron en Colombia diez brotes de enfermedad aguda de Chagas con posible transmisión oral de T. cruzi (figura 1). El primero se reportó en 1992 en el municipio de Tibú (Norte de Santander) en un grupo de 144 soldados provenientes de una zona selvática, en quienes se confirmaron seis casos positivos para T. cruzi con síntomas de miocarditis aguda (48,49).
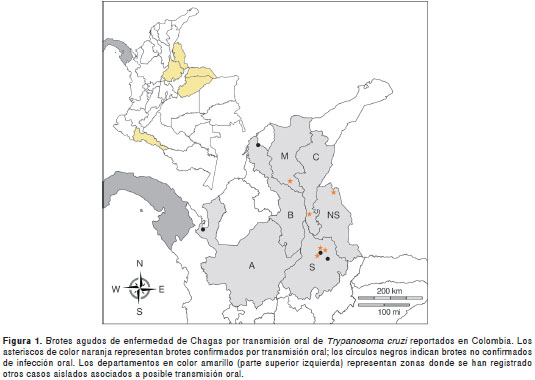
Posteriormente, en 1999, en el municipio de Guamal (Magdalena) se registraron 13 casos (cinco de ellos fatales) de enfermedad de Chagas aguda con cuadros febriles y miocarditis aguda, cuya transmisión se atribuyó al consumo de vino de palma (50).
En 2003, en Bucaramanga, se registraron otros tres casos de transmisión oral, todos fatales (51). Entre 2003 y 2005 se registraron 10 casos aislados de enfermedad de Chagas aguda en Putumayo, Arauca, Casanare, Santander y Norte de Santander. El síntoma predominante en estos casos fue la fiebre, tres pacientes presentaron miocarditis, dos desarrollaron falla cardiaca y, uno, taponamiento cardíaco. En esta serie de casos no se observaron signos de puerta de entrada, por lo cual se sospecha de una posible transmisión por vía oral (20).
Entre 2008 y comienzos de 2009, se registraron cuatro brotes de enfermedad de Chagas oral, tres de ellos en el departamento de Santander y uno en Bolívar. El primero ocurrió en el municipio de Lebrija en 2008, cuando se reportaron 10 casos de enfermedad de Chagas aguda. Se sos pecha que la posible fuente de contaminación con T. cruzi fue el jugo de naranja (52).
El segundo de estos brotes sucedió en una zona urbana de Bucaramanga, donde se confirmaron cinco casos y se reportó la captura de triato minos pertenecientes a los géneros Rhodnius y Panstrongylus, este último positivo para la infección con T. cruzi. El tercer foco se presentó en los municipios de Piedecuesta y Girón, donde se regis traron otros cinco casos de enfermedad de Chagas aguda, pero no se logró identificar una posible puerta de entrada. En esa ocasión, se capturarón P. geniculatus infectados con Trypanosoma sp. (53).
Finalmente, el cuarto brote se registró en el municipio de Villanueva (Bolívar) con dos casos fatales de Chagas agudo, una mujer de 27 años y su hijo de dos años. Se cree que la infección se produjo por consumo de alimentos contaminados con el parásito (Cucunubá ZM. Vigilancia de Chagas agudo de posible transmisión oral en Colombia. En: Memorias, XX Congreso Latinoamericano de Parasitología Tropical y XV Congreso Colombiano de Parasitología y Medicina Tropical, Bogotá, Colombia. Biomédica. 2011;31:117-9).
En 2010, se reportaron 11 casos de enfermedad de Chagas aguda en Turbo (Antioquia) con posible transmisión oral por ingestión de alimentos conta minados con T. cruzi proveniente de restos de triatominos o excrementos de marsupiales (21). Ese mismo año se registraron tres casos agudos asociados a posible transmisión oral en el municipio de San Vicente de Chucurí (Santander). De igual manera, la Secretaría de Salud de Santander notificó un brote en un grupo de familiares procedentes de la zona urbana de Aguachica (Cesar), en el cual se confirmaron 12 casos caracterizados por presentar fiebre prolongada (15 días a un mes de evolución), malestar general, dolor abdominal y edema facial. En este brote se logró la captura de 24 ninfas de Rhodnius pallescens , de las cuales siete fueron positivas para T. cruzi (54,55).
De los brotes agudos de enfermedad de Chagas anteriormente mencionados, el Instituto Nacional de Salud de Colombia atribuyó seis a transmisión por vía oral debida al consumo de bebidas y comidas contaminadas con el parásito (56): Tibú, Norte de Santander (1992), Guamal, Magdalena (1999), Lebrija, Santander (2008), Bucaramanga, Santander (2009), Aguachica, Cesar (2010) y San Vicente de Chucurí, Santander (2010).
Vectores silvestres y estado de la transmisión oral de la enfermedad de Chagas en Colombia
Como los brotes de transmisión oral de T. cruzi se presentan en áreas con ausencia de triatominos domiciliados, cualquier especie silvestre que ingrese a las viviendas humanas y contamine los alimentos podría estar involucrada en esta forma de transmisión. En varios brotes de Venezuela, se ha involucrado a P. geniculatus (25). En Colombia, se sospecha de P. geniculatus y R. pallescens (56). En nuestro país, los principales vectores silvestres asociados a palmeras son R. pallescens en la región norte y central, Rhodnius colombiensis en la región central y R. prolixus en los Llanos Orientales. Panstrongylus geniculatus se ha encontrado en menor proporción en palmeras, asociado a nidos o madrigueras de reservorios localizados en huecos de árboles. En varios trabajos se ha señalado la correlación entre la presencia de triatominos en las palmeras y el riesgo de invasión del domicilio humano, lo que facilita la aparición de la enfermedad de Chagas en diferentes regiones de Latinoamérica (57-59).
Nuestro grupo de investigación ha observado que la densidad de Rhodnius spp. silvestres es mayor en aquellas palmeras cercanas a los domicilios y a las áreas de cultivos de plátano, frutales, etc., que en las palmeras ubicadas en los bosques secundarios. Esto se debe a que, en las palmeras cercanas a las viviendas, los didélfidos, roedores, murciélagos y aves construyen sus nidos atraídos por la cercanía de los desperdicios domésticos y de los frutos de los cultivos, razón por la cual existe un mayor riesgo de intrusión de los triatominos silvestres en el domicilio humano.
En el municipio de Coyaima (Tolima) se observó una densidad promedio de 39,5 ± 31,8 de R. colombiensis por palmera entre las ubicadas en cultivos de Musa balbisiana (cachaco), mientras que, en las ubicadas en bosques secundarios, la densidad promedio fue de 1,4 ± 2,5 de R. colombiensis por palmera ( 60 ). En el departamento del Tolima se ha comprobado que R. colombiensis vuela desde las palmeras hacia los domicilios humanos, como pudo demostrarse con la captura de adultos en el interior de las viviendas en los municipios de Alvarado, Carmen de Apicalá, Coyaima, Coello, Guamo, Ibagué, Icononzo, Lérida, Líbano, Ortega, Prado, Purificación, Santa Isabel y San Luis (61). En el examen directo al microscopio de 100 ejemplares de R. colombiensis capturados en palmeras de Coyaima, se encontró que el 87 % de los insectos eran positivos para tripanosomas, en contraste con 10,7 % de 100 ejemplares de R. prolixus domiciliados que fueron capturados en el mismo municipio. Además, cuando se examinaron sola-mente adultos de R. colombiensis infectados naturalmente, la tasa de prevalencia para T. cruzi superó el 90 %, de manera que los adultos de este vector que vuelan hacia el domicilio tienen una gran probabilidad de estar infectados con T. cruzi y de contaminar los alimentos (62).
Un estudio llevado a cabo en los Llanos Orientales de Colombia reveló las altas tasas de infestación de R. prolixus en palmeras próximas a los domicilios y su frecuente visita a las viviendas humanas, observándose que las poblaciones de estos triato minos encontradas en domicilios y palmeras s e comportaban como una población panmíctica, lo que evidenc ió una nueva situación epidemiológica de la enfermedad de Chagas ya descrita en Venezuela (63) y que debe valorarse en Colombia (64).
De conformidad con los reportes anteriores, las comunidades rurales y periurbanas donde se sabe de la existencia de triatominos silvestres, deben estar informadas y atentas para prevenir el posible contacto entre parásito y alimentos, en el cual participarían las especies silvestres locales y, además, para establecer la asociación con cualquier signo o síntoma atribuible a la potencial infección chagásica, con el fin de considerarla en el manejo del paciente en las instituciones de salud de la región.
Genotipos de Trypanosoma cruzi detectados en los brotes de transmisión oral de la enfermedad de Chagas
Como es bien sabido, T. cruzi presenta una amplia diversidad genética, habiéndose reportado hasta la fecha seis poblaciones bien diferenciadas, conocidas como genotipos o unidades discretas de tipificación ( Discrete Typing Units, DTU) Tc I-VI, una población conocida como T. cruzi bat y T. cruzi marinkellei (65). Por otro lado, de T. cruzi I se han descrito cinco subpoblaciones, las cuales se han identificado en una gran variedad de huéspedes, vectores y reservorios (66,67).
En algunos países de Latinoamérica, se ha logrado identificar los genotipos involucrados en los brotes de transmisión oral, como es el caso de la Amazonia brasilera, donde se reportó la presencia de Tc I y Tc IV en humanos y primates (68). Andrade, et al ., identificaron los genotipos Tc I, Tc II y Tc VI en pacientes durante el brote de Santa Catarina (69). En Venezuela, se caracterizaron las cepas de cuatro brotes asociados a transmisión oral, identificándose predominantemente la subpoblación Tc Id, así como infecciones mixtas con Tc Ia, Tc Ib y Tc Id (70). Diaz-Bello, et al. , detectaron T. cruzi Id en tres pacientes infectados oralmente en un brote urbano en Caracas (71).
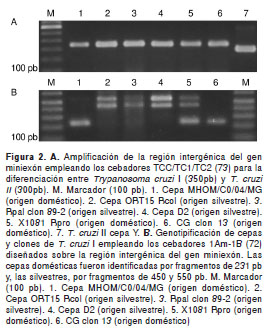
En Colombia, se ha encontrado una mayor prevalencia de Tc Id y, en menor grado de Tc IV, en brotes asociados a infección oral (56). Villa, et al. , detectaron dos grupos de T. cruzi I asociados a los ciclos doméstico y silvestre, utilizando una sola reacción en cadena de la polimerasa (PCR) para amplificar la secuencia SL- IR del gen mini-exón (72); dichos grupos se denominaron Tc I DOM y Tc I silvestre (figura 2). En este estudio, el Tc I silvestre se encontró asociado a tres casos agudos confirmados de transmisión oral de T. cruzi, provenientes de Santander. Sin embargo, es nece sario continuar la caracterización molecular de los aislamientos de brotes de la enfermedad de Chagas para confirmar o descartar la asociación de algunos genotipos de T. cruzi con la transmisión oral en las diferentes regiones de América Latina.
Conclusiones y recomendaciones
Las recomendaciones generales para controlar las infecciones transmitidas por alimentos incluyen, entre otras, la educación de las poblaciones en riesgo, la implementación de buenas prácticas en el procesamiento de los alimentos, desde la cosecha hasta su llegada al consumidor, la pasteurización de bebidas y alimentos o su tratamiento químico para la eliminación del agente infeccioso, y el desarrollo de nuevas técnicas para la detección temprana y la inhibición de la actividad del agente infeccioso antes de llegar al consumidor.
Para el caso de la transmisión oral de T. cruzi , la implementación de estas recomendaciones se dificulta por el complejo acceso a las áreas selvá ticas, rurales o periurbanas donde se generan los brotes. Por otro lado, se ha visto que los brotes de la enfermedad de Chagas por transmisión oral son impredecibles en el tiempo y en el espacio, aunque se debe esperar una mayor frecuencia cuando hay presencia de vectores silvestres; también, se ha comprobado que la frecuencia de la invasión de estos triatominos al domicilio humano varía de una región a otra, de manera que el control de la transmisión oral del parásito continúa siendo un desafío para los países endémicos.
En Colombia, se han registrado hasta la fecha seis brotes reconocidos de enfermedad de Chagas aguda asociados a transmisión oral. La atribución a este tipo de fenómeno ha sido posible gracias a las características epidemiológicas de los brotes y, sobre todo, a las manife staciones clínicas. Sin embargo, en la mayoría de los estudios no se determinó la fuente de contaminación ni el vector implicado.
Esta situación refleja la necesidad de nuevos estudios epidemiológicos que incluyan información más detallada de la fuente de contaminación y de los vectores silvestres presentes en los focos de infección, pues dicho conocimiento permitiría tomar medidas preventivas frente a una posible transmisión oral en un área determinada.
Asimismo, para contribuir al conocimiento de los genotipos involucrados en la trasmisión de T. cruzi por vía oral, se requieren estudios complementarios sobre el desarrollo de los diferentes genotipos del parásito en vectores silvestres que visitan el domicilio humano con frecuencia, para determinar su pot encial vectorial y el desarrollo de la carga parasitaria.
Los autores deseamos expresar nuestros agradecimientos a los evaluadores anónimos y a los revisores editoriales de Biomédica , por los comentarios y recomendaciones que mejoraron el documento final, y a Xiomara Alexandra Gaitán y a Sneider A. Gutiérrez, del Laboratorio de Investigaciones en Parasitología Tropical (LIPT) de la Universidad del Tolima, por el apoyo técnico para la identificación por PCR de los genotipos domésticos y silvestres de T. cruzi I.
Este trabajo fue financiado por Colciencias, proyecto 110551929038, y por el Fondo de Investigaciones de la Universidad del Tolima.
Los autores declaramos que no existieron conflictos de intereses con respecto al desarrollo y la publicación de este trabajo.
Correspondencia: Gustavo Adolfo Vallejo, Laboratorio de Investigaciones en Parasitología Tropical (LIPT), Facultad de Ciencias, Universidad del Tolima, Barrio Santa Helena Parte Alta, Ibagué, Colombia Telefax: (578) 277 0192 gvallejo@ut.edu.co
1. Organización Panamericana de la Salud. Estimación cuantitativa de la enfermedad de Chagas en las Américas. Montevideo: OPS; 2007. p. 6-17. [ Links ]
2. Organización Mundial de la Salud. La enfermedad de Chagas (Tripanosomiasis americana). Nota descriptiva N° 340. 2012. Fecha de consulta: 1 de agosto de 2013. Disponible en: http://www.who.int/mediacentre/factsheets/fs340/es/index.html. [ Links ]
3. Guhl F. Chagas disease in Andean countries. Mem Inst Oswaldo Cruz . 2007;102(Suppl.1):29-38. http://dx.doi.org/10.1590/S0074-02762007005000099 [ Links ]
4. Guhl F. Epidemiología de la enfermedad de Chagas en Latinoamérica y Colombia. En: Rosas F, Vanegas D, Cabrales M, editores. Enfermedad de Chagas. Bogotá: Sociedad Colombiana de Cardiología y Cirugía Cardiovascular; 2007. p. 7-14. [ Links ]
5. Moncayo A, Silveira AC. Current epidemiological trends for Chagas disease in Latin America and future challenges in epidemiology, surveillance and health policy. Mem Inst Oswaldo Cruz. 2009;104(Suppl.1):17-30. http://dx.doi.org/10.1590/S0074-02762009000900005 [ Links ]
6. Bargues MD, Schofield CJ, Dujardin JP. Classification and phylogeny of the triatominae. En: Telleria J, Tibayrenc M, editors. American trypanosomiasis Chagas disease, one hundred years of research. London: Elsevier; 2010. p. 117-48. [ Links ]
7. Guhl F, Aguilera G, Pinto N, Vergara D. Actualización de la distribución geográfica y ecoepidemiología de la fauna de triatominos (Reduviidae: Triatominae) en Colombia. Biomédica. 2007;27(Supl.1):143-62. [ Links ]
8. Sandoval CM. Belminus ferroae n. sp. from the Colombian north-east, with a key to the species. Zootaxa. 2007;1443: 55- 64. [ Links ]
9. Galvão C, Angulo V. Belminus corredori , a new species of Bolboderini (Hemiptera: Reduviidae: Triatominae) from Santander, Colombia. Zootaxa. 2006;1241:61-8. [ Links ]
10. Gascón J, Bern C, Pinazo MJ. Chagas disease in Spain, the United States and other non-endemic countries. Acta Trop . 2010;115:22-7. http://dx.doi.org/10.1016/j.actatropica.2009.07.019 [ Links ]
11. Bern C, Kjos S, Yabsley MJ, Montgomery SP. Trypanosoma cruzi and Chagas disease in the United States. Clin Microbiol Rev . 2011;24:655-81. http://dx.doi.org/10.1128/CMR.00005-11 [ Links ]
12. Schmunis G. Transmisión de Trypanosoma cruzi por transfusión sanguínea: condiciones para certificar su interrupción. En: Programa Regional para el Control de la Enfermedad de Chagas en América Latina - Iniciativa de bienes públicos regionales. Washington, D.C.: Organización Panamericana de Salud; 2010. p. 151-211. [ Links ]
13. Carlier Y, Torrico F, Sosa-Estani S, Russomando G, Luquetti A, Freilij H, et al . Congenital Chagas disease: Recommendations for diagnosis, treatment and control of newborns, siblings and pregnant women. PLoS Negl Trop Dis . 2011;5:e1250. http://dx.doi.org/10.1371/journal.pntd.0001250 [ Links ]
14. Yoshida N. Molecular mechanisms of Trypanosoma cruzi infection by oral route. Mem Inst Oswaldo Cruz. 2009;104 (Suppl.1):101-7. [ Links ]
15. Bastos C, Aras R, Mota G, Mota G, Reis F, Dias JP, et al . Clinical outcomes of thirteen patients with acute Chagas disease acquired through oral transmission from two urban outbreaks in northeastern Brazil. PLoS Negl Trop Dis . 2010;4:e711. http://dx.doi.org/10.1371/journal.pntd.0000711 [ Links ]
16. Pinto AY, Ferreira AG, Valente VD, Harada GS, Valente SA. Urban outbreak of acute Chagas disease in Amazon region of Brazil: Four-year follow-up after treatment with benzimidazole. Rev Panam Salud Pública. 2009;25:77-83. http://dx.doi.org/10.1590/S1020-49892009000100012 [ Links ]
17. Pinto AY, Valente SA, Valente VD, Ferreira AG, Coura JR. Fase aguda da doença de Chagas na Amazônia brasileira. Estudo de 233 casos do Pará, Amapá e Maranhão observados entre 1988 e 2005. Rev Soc Bras Med Trop. 2008;41:602-14. http://dx.doi.org/10.1590/S0037-86822008000600011 [ Links ]
18. Añez N, Crisante G, Rojas A, Dávila D. Brote de enfer medad de Chagas agudo de posible transmisión oral en Mérida, Venezuela. Bol Malariol Sal Amb. 2013;LIII:1-11. [ Links ]
19. Organización Panamericana de la Salud. Diagnóstico de la enfermedad de Chagas por transmisión oral. En: Guía para vigilancia, prevención, control y manejo clínico de la enfermedad de Chagas aguda transmitida por alimentos. Río de Janeiro: PANAFTOSA-VP/OPS/OMS; 2009. p. 35-41. [ Links ]
20. Nicholls RS, Cucunubá Z, Knudson A, Flórez A, Montilla M, Puerta C, et al . Enfermedad de Chagas aguda en Colombia, una entidad poco sospechada. Informe de 10 casos presentados en el periodo 2002 a 2005. Biomédica. 2007;27(Supl.1):8-17. [ Links ]
21. Ríos J, Arboleda M, Montoya AN, Alarcón E, Parra-Henao G. Probable brote de transmisión oral de enfermedad de Chagas en Turbo, Antioquia. Biomédica. 2011;31:185-95. http://dx.doi.org/10.7705/biomedica.v31i2.302 [ Links ]
22. Organización Panamericana de la Salud. Epidemiología de la enfermedad de Chagas por transmisión oral. En: Guía para vigilancia, prevención, control y manejo clínico de la enfermedad de Chagas aguda transmitida por alimentos. Río de Janeiro: PANAFTOSA - VP/OPS/OMS. 2009. p. 13-29. [ Links ]
23. Santalla J, Oporto P, Espinoza E, Ríos T, Brutus L. Primer brote reportado de la enfermedad de Chagas en la Amazonía Boliviana: reporte de 14 casos agudos por transmisión oral de Trypanosoma cruzi en Guayaramerín, Beni-Bolivia. BIOFARBO. 2011;19:52-8. [ Links ]
24. Organización Panamericana de la Salud/Organización Mundial de la Salud. Guía para la atención clínica integral del paciente con enfermedad de Chagas. Bogotá: OPS; 2010. p. 16-23. [ Links ]
25. Alarcón de Noya B, Díaz-Bello Z, Colmenares C, Zavala- Jaspe R, Mauriello L, et al. Transmisión urbana de la enfermedad de Chagas en Caracas, Venezuela: aspectos epidemiológicos, clínicos y de laboratorio. Rev Biomed. 2009;20:158-64. [ Links ]
26. Pereira KS, Schmidt FL, Guaraldo AM, Franco RMB, Dias VL, Passos LC. Chagas´ disease as a foodborne illness. J Food Prot . 2009;72:441-6. [ Links ]
27. Robertson LJ, van der Giessen JWB, Batz MB, Kojima M, Cahill S. Have foodborne parasites finally become a global concern? Trends Parasitol. 2013;29:101-3. 1 http://dx.doi.org/0.1016/j.pt.2012.12.004 [ Links ]
28. Food and Agriculture Organization/World Health Organization. Multicriteria -based ranking for risk management of foodborne parasites. Report of a joint FAO/WHO expert meeting, Rome, Italy. 2012 Oct. Fecha de consulta: 30 de septiembre de 2013 . Disponible en: http://www.fao.org/fileadmin/user_upload/agns/news_events/Parasite%20report%20final%20draft-25October2012.pdf. [ Links ]
29. Reyes-Lugo M. Panstrongylus geniculatus Latreille 1811 (Hemiptera: Reduviidae: Triatominae), vector de la enfer medad de Chagas en el ambiente domiciliario del centro- norte de Venezuela. Rev Biomed. 2009;20:180-205. [ Links ]
30. Abad-Franch F, Monteiro FA, Jaramillo ON, Gurgel-Gonçalves R, Dias FB, Diotaiuti L. Ecology, evolution, and the long-term surveillance of vector-borne Chagas disease: A multi-scale appraisal of the tribe Rhodniini (Triatominae). Acta Trop. 2009;110:159-77 . http://dx.doi.org/10.1016/j.actatropica.2008.06.005 [ Links ]
31. Yoshida N, Tyler KM, Llewellyn MS. Invasion mechanisms among emerging food-borne protozoan parasites. Trends Parasitol . 2011; 27:459-66. http://dx.doi.org/10.1016/j.pt.2011.06.006 [ Links ]
32. Staquicini DI, Martins RM, Macedo S, Sasso GRS, Atayde VD, Juliano M, et al . Role of gp82 in the selective binding to gastric mucin during oral infection with Trypanosoma cruzi . PLoS Negl Trop Dis. 2010;4:e613. http://dx.doi.org/10.1371/journal.pntd.0000613 [ Links ]
33. Cortez M, Neira I, Ferreira D, Luquetti AO, Rassi A, Atayde VD, et al . Infection by Trypanosoma cruzi metacyclic forms deficient in gp82 but expressing a related surface molecule, gp30. Infect Immun. 2003;71:6184-91. http://dx.doi.org/10.1128/IAI.71.11.6184–6191 [ Links ]
34. Neira I, Silva FA, Cortez M, Yoshida N. Involvement of Trypanosoma cruzi metacyclic trypomastigote surface molecule gp82 in adhesion to gastric mucin and invasion of epithelial cells. Infect Immun. 2003;71:557-61. http://dx.doi.org/10.1128/IAI.71.1.557 [ Links ]
35. Shikanai-Yasuda MA, Carvalho NB. Oral transmission of Chagas disease. Clin Infect Dis . 2012;54:845-52. http://dx.doi.org/10.1093/cid/cir956 [ Links ]
36. Silveira AC. Factores de riesgos implicados en la trans misión oral de la enfermedad de Chagas. En: Informe de la consulta técnica en epidemiología, prevención y manejo de la transmisión de la enfermedad de Chagas como enfermedad transmitida por alimentos. Río de Janeiro: Organización Panamericana de la Salud / Organización Mundial de la Salud; 2006. p. 16-9. [ Links ]
37. Shikanai-Yasuda MA. Transmissão da doença de Chagas aguda por vía oral: surto epidémico em Catolé do Rocha, Paraíba, 1986 . En: Informe de la consulta técnica en epidemiología, prevención y manejo de la transmisión de la enfermedad de Chagas como enfermedad transmitida por alimentos. Río de Janeiro: Organización Panamericana de la Salud-Organización Mundial de la Salud; 2006. p. 35-8. [ Links ]
38. Steindel M, Kramer L, Scholl D, Soares M, de Moraes MH, Eger I, et al. Characterization of Trypanosoma cruzi isolated from humans, vectors, and animal reservoirs following an outbreak of acute human Chagas disease in Santa Catarina State, Brazil. Diagn Microbiol Infect Dis . 2008;60:25-32. http://dx.doi.org/10.1016/j.diagmicrobio.2007.07.016 [ Links ]
39. Valente SA, Valente VC, Pinto AY. Epidemiologia e transmissão oral da doença de Chagas na Amaz ô nia Brasileira. En: Informe de la consulta técnica en epidemiología, prevención y manejo de la transmisión de la enfermedad de Chagas como enfermedad transmitida por alimentos. Río de Janeiro: Organización Panamericana de la Salud/Organización Mundial de la Salud; 2006. p. 21-6. [ Links ]
40. Organización Panamericana de la Salud. Quinta Reunión de la Iniciativa Intergubernamental de Vigilancia y Preven ción de la Enfermedad de Chagas en la Amazonía, AMCHA. Caracas: OPS: 2008. p. 19-21. Fecha de consulta: 30 de septiembre de 2013 . Disponible en: http://www.paho.org/hq/index.php?option=com_docman&task=doc_view&gid=15601&Itemid=. [ Links ]
41. Dias JP, Bastos C, Araújo E, Mascarenhas A, Netto E, Grassi F, et al . Acute Chagas disease outbreak associated with oral transmission. Rev Soc Bras Med Trop. 2008;41:296- 300. http://dx.doi.org/10.1590/S0037-86822008000300014 [ Links ]
42. Nóbrega A, García MH, Tatto E, Obara MT, Costa E, Sobel J, et al . Oral transmission of Chagas disease by consumption of açaí palm fruit, Brazil. Emerg Infect Dis . 2009;15:653-5. http://dx.doi.org/10.3201/eid1504.081450 [ Links ]
43. Cavalcanti L, Rolim DB, Neto R, Vilar D, Nogueira J, Pompeu M, et al . Microepidemics of acute Chagas´ disease by oral transmission in Ceará. Cad Saúde Colet. 2009;17:911-21. [ Links ]
44. Alarcón B, Díaz-Bello Z, Colmenares C, Ruiz R, Noya O. Enfermedad de Chagas de transmisión oral: vinculación del caso índice con una microepidemia urbana en Venezuela. Bol Malariol Sal Amb. 2010;60:135-8. [ Links ]
45. Alarcón de Noya B, Díaz-Bello Z, Colmenares C, Ruiz R, Noya O, Zavala-Jaspe R, et al . Large urban outbreak of orally acquired acute Chagas disease at a school in Caracas, Venezuela. J Infect Dis. 2010;201:1308-15. http://dx.doi.org/10.1086/651608 [ Links ]
46. Alarcón B, Díaz-Bello Z, Colmenares C, Ruiz R, Martínez J, Cabrera E, et al. Microepidemias de enfermedad de Chagas de transmisión oral en Venezuela. Biomédica. 2009;29(Supl.):97-103. [ Links ]
47. Benítez JA, Araújo B, Contreras K, Rivas M, Ramírez P, Guerra W, et al . Urban outbreak of acute orally acquired Chagas disease in Táchira, Venezuela. J Infect Dev Ctries. 2013;7:638-41. http://dx.doi.org/10.3855/jidc.3620.PubMed PMID:23949301 [ Links ]
48. Nicholls RS. Enfermedad de Chagas como enfermedad transmitida por alimentos: la experiencia colombiana. En: Informe de la consulta técnica en epidemiología, prevención y manejo de la transmisión de la enfermedad de Chagas como enfermedad transmitida por alimentos. Río de Janeiro: OPS /OMS; 2006. p.13-4. [ Links ]
49. Bohórquez RMB, Blanco M, Nicholls RS, Hernández CA, Gualdrón L. Estudio de una epidemia de carditis aguda en población adulta. Act Med Col. 1992;17:4. [ Links ]
50. Cáceres D, Nicholls RS, Corredor A, Gualdrón L, Slait E, Dib J, et al . Investigación de un brote de síndrome febril con miocarditis aguda en Guamal, Magdalena. Inf Quinc Epidemiol Nac. 1999;4:170-8. [ Links ]
51. Ministerio de la Protección Social, Centro Nacional de Enlace. Brote de enfermedad de Cha gas agudo como enfermedad transmitida por alimentos, Santander, Colombia, 2008-2009. Informe epidemiológico mensual. Reporte N° 4. Bogotá, D.C., 2009. [ Links ]
52. Hernández L, Ramírez A, Cucunubá Z, Zambrano P. Brote de Chagas agudo en Lebrija, Santander, 2008. Revista del Observatorio de Salud Pública de Santander. 2009;4:28-36. [ Links ]
53. Zambrano P, Cucunubá Z, Montilla M, Flórez C, Parra E, Cortés L, et al . Brotes de síndrome febril asociado a miocarditis aguda chagásica de posible transmisión oral en el departamento de Santander, diciembre de 2008 a mayo de 2009. Inf Quinc Epidemiol Nac. 2010;15:17-32. [ Links ]
54. Ramírez NA, Reyes JP, López L. Implementación del reglamento sanitario internacional en Santander. Informe Epidemiológico de Santander. 2010;4:1-8. [ Links ]
55. Departamento Administrativo de Salud de Aguachica. Boletín epidemiológico. Aguachica – Cesar. DASA. Fecha de consulta: 3 de agosto de 2013. Disponible en: http://aguachica-cesar.gov.co/apc-aa-files/64653062653265633962353161666439/BOLETIN_EPIDEMILOGICO_2010_1_.pdf. [ Links ]
56. Ramírez JD, Montilla M, Cucunubá ZM, Floréz AC, Zambrano P, Guhl F. Molecular epidemiology of human oral Chagas disease outbreaks in Colombia. PLoS Negl Trop Dis . 2013;7:e2041. http://dx.doi.org/10.1371/journal.pntd.0002041 [ Links ]
57. Ricardo-Silva AH, Lopes CM, Ramos LB, Marques WA, Mello CB, Duarte R, et al . Correlation between populations of Rhodnius and presence of palm trees as risk factors for the emergence of Chagas disease in Amazon region, Brazil. Acta Trop. 2012;123:217-23 . http://dx.doi.org/10.1016/j.actatropica.2012.05.008 [ Links ]
58. Abad-Franch F, Palomeque FS, Aguilar HM, Miles MA. Field ecology of sylvatic Rhodnius populations (Heteroptera, Triatominae): Risk factors for palm tree infestation in western Ecuador. Trop Med Int Health. 2005;10:1258-66. http://dx.doi.org/10.1111/j.1365-3156.2005.01511.x [ Links ]
59. Dias-Lima AG, Sherlock IA. Sylvatic vectors invading houses and the risk of emergence of cases of Chagas disease in Salvador, State of Bahia, Northeast Brazil. Mem Inst Oswaldo Cruz. 2000;95:611-3. http://dx.doi.org/10.1590/S0074-02762000000500004 [ Links ]
60. Vallejo GA, Lozano LE, Carranza JC, Sánchez JL, Jaramillo JC, Guhl F, et al . Ecología de los triatominos no domicliados en Colombia con especial referencia de Rhodnius colombiensis en el departamento del Tolima. En: Vallejo GA, Carranza JC, Jaramillo JC, editores. Curso Taller Internacional, Biología, epidemiología y control de la tripanosomosis americana y leishmaniosis. Ibagué: Lito ediciones Tolima; 2000. p. 22-8. [ Links ]
61. Carranza JC, Lozano LE, Vallejo GA. Laboratorio de Investigaciones en Parasitología Tropical de la Universidad del Tolima: actividades de investigación relacionadas con la enfermedad de Chagas. En: Guhl F, Jaramillo CA, editores. Curso Taller Internacional sobre Sistemas de información geográfica, sensores remotos y genética poblacional de vectores y parásitos aplicados al control de la enfermedad de Chagas. Bogotá, D.C.: Corcas Editores Ltda; 2002. p. 165-79. [ Links ]
62. Carranza JC. Aplicación de la reacción en cadena de la polimerasa (RCP) para el diagnóstico y la caracterización de Trypanosoma cruzi y T. rangeli en contenido intestinal de vectores naturalmente infectados en áreas endémicas de Colombia (tesis). Bogotá: Universidad de los Andes; 1999. p. 170. [ Links ]
63. Fitzpatrick S, Feliciangeli MD, Sánchez-Martín MJ, Monteiro FA, Miles MA. Molecular genetics reveal that silvatic Rhodnius prolixus do colonize rural houses. PLoS Negl Trop Dis. 2008;2:e210. http://dx.doi.org/10.1371/journal.pntd.0000210 [ Links ]
64. Angulo VM, Esteban L, Luna KP. Attalea butyracea próximas a las viviendas como posible fuente de infestación domiciliaria por Rhodnius prolixus (Hemiptera: Reduviidae) en los Llanos Orientales de Colombia. Biomédica. 2012; 32:277-85. http://dx.doi.org/10.7705/biomedica.v32i2.430 [ Links ]
65. Zingales B, Miles M, Campbell D, Tibayrenc M, Macedo AM, Teixeira MM, et al . The revised Trypanosoma cruzi subspecific nomenclature: Rationale, epidemiological relevance and research applications. Infect Genet Evol . 2012; 12:240-53. http://dx.doi.org/10.1016/j.meegid.2011.12.009 [ Links ]
66. Herrera C, Bargues MD, Falla A, Fajardo A, Montilla M, Vallejo GA, et al . Genetic variability and phylogenetic relationships within Trypanosoma cruzi I isolates in Colombia based on miniexon gene sequences. J Parasitol Res. 2009; 897364:1-9. http://dx.doi.org/10.1155/2009/897364 [ Links ]
67. Cura CI, Mejía-Jaramillo AM, Duffy T, Burgos JM, Rodriguero M, Cardinal MV, et al . Trypanosoma cruzi I genotypes in different geographical regions and transmission cycles based on a microsatellite motif of the intergenic spacer of spliced-leader genes. Int J Parasitol. 2010;40:1599-607. http://dx.doi.org/10.1016/j.ijpara.2010.06.006 [ Links ]
68. Marcili A, Valente VC, Valente S, Junqueira AC, da Silva FM, Pinto AY, et al . Trypanosoma cruzi in Brazilian Amazonia : Lineages TCI and TCIIa in wild primates, Rhodnius spp. and in humans with Chagas disease associated with oral transmission. Int J Parasitol . 2009;39:615-23. http://dx.doi.org/10.1016/j.ijpara.2008.09.015 [ Links ]
69. Andrade SG, Campos RF, Steindel M, Guerreiro ML, Magalhães JB, Almeida MC, et al. Biological, biochemical and molecular features of Trypanosoma cruzi strains isolated from patients infected through oral transmission during a 2005 outbreak in the state of Santa Catarina, Brazil: Its correspondence with the new T. cruzi taxonomy consensus. Mem Inst Oswaldo Cruz. 2011;106:948-56. http://dx.doi.org/10.1590/S0074-02762011000800009 [ Links ]
70. Muñoz-Calderón A, Díaz-Bello Z, Valladares B, Noya O, López MC, Alarcón B, et al . Oral transmission of Chagas disease: Typing of Trypanosoma cruzi from five outbreaks occurred in Venezuela shows multiclonal and common infections in patients, vectors and reservoirs. Infect Genet Evol. 2013;17:113-22. http://dx.doi.org/10.1016/j.meegid.2013.03.036 [ Links ]
71. Díaz-Bello Z, Thomas MC, López MC, Zavala-Jaspe R, Noya O, Alarcón B, et al . Trypanosoma cruzi genotyping supports a common source of infection in a school-related oral outbreak of acute Chagas disease in Venezuela. Epidemiol Infect. 2014 ;142:156-62. http://dx.doi.org/10.1017/S0950268813000757 [ Links ]
72. Villa LM, Guhl F, Zabala D, Ramírez JD, Urrea DA, Hernández DC, et al . The identification of two Trypanosoma cruzi I genotypes from domestic and sylvatic transmission cycles in Colombia based on a single polymerase chain reaction amplification of the spliced-leader intergenic region. Mem Inst Oswaldo Cruz. 2013;108:932-5 . http://dx.doi.org/10.1590/0074-0276130201 [ Links ]
73. Souto RP, Fernandes O, Macedo AM, Campbell DA, Zingales B. DNA markers define two major phylogenetic lineages of Trypanosoma cruzi . Mol. Biochem Parasitol . 1996;83:141-52. http://dx.doi.org/1010.1016/S0166-6851(96)02755-7 [ Links ]













