Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157
Biomédica vol.35 no.1 Bogotá jan./mar. 2015
https://doi.org/10.7705/biomedica.v35i1.2343
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v35i1.2343
1 Grupo de Entomología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
2 Grupo de Genética Molecular, Instituto de Biología, Universidad de Antioquia, Medellín, Colombia
Contribución de los autores:
Jorge Mario Cadavid, Guillermo Rúa, Gabriel Bedoya, Winston Rojas: contribución con materiales, reactivos y herramientas analíticas
Jorge Mario Cadavid y Winston Rojas: escritura del manuscrito
Winston Rojas: supervisión del análisis de datos
Todos los autores concibieron y diseñaron los experimentos.
Recibido: 28/03/14; aceptado: 03/10/14
Introducción. Las poblaciones de Aedes aegypti pueden experimentar cambios en cuanto a su abundancia y diversidad genética y, con ello, su potencial evolutivo para responder al control vectorial. El conocimiento de los cambios en la variación genética a escala espacio-temporal, permite entender mejor la epidemiología del dengue y contribuye al diseño adecuado y oportuno de estrategias antivectoriales.
Objetivo. Evaluar los cambios genéticos, la diversidad y el flujo génico en seis poblaciones microgeográficas de Ae. aegypti en Medellín en diferentes períodos epidemiológicos del dengue.
Materiales y métodos. En 255 especímenes provenientes de seis barrios de Medellín, se evaluó la variación en la composición de los haplotipos mtDNA CO1 , así como la diversidad y la diferenciación genética en un período epidémico (2010) y en otro endémico (2012).
Resultados. Se detectaron dos grupos de haplotipos muy diferenciados entre sí en ambos períodos, al igual que un haplotipo de alta frecuencia presente en todos los barrios. La mayor diversidad de haplotipos se registró en el 2012, pero la mayor diversidad de nucleótidos se presentó en el 2010. No se observó correlación significativa entre las distancias genéticas y geográficas.
Conclusión. La composición genética de Ae. aegypti varía temporalmente sin un patrón predecible. La presencia de un haplotipo de gran frecuencia en ambos períodos podría ser indicio de una variación persistente adaptada al control vectorial. Sin embargo, la circulación simultánea de haplotipos CO1 muy diferenciados y compatibles con múltiples introducciones, sugiere que diversos acervos genéticos serían aptos para la transmisión. Estos resultados son compatibles con la dispersión del mosquito por efecto de actividades antrópicas, lo cual posibilitaría la diseminación rápida del virus durante epidemias en Medellín.
Palabras clave: Aedes aegypti , genoma mitocondrial, haplotipos, Colombia.
doi: http://dx.doi.org/10.7705/biomedica.v35i1.2343
Microgeographic and temporal genetic changes of Aedes aegypti from Medellín, Colombia
Introduction: Aedes aegypti populations may experience changes in abundance and genetic diversity in addition to changes in their evolutionary capability to respond to vector control. The knowledge on the changes in genetic variation on a spatio-temporal scale improves the epidemiological understanding of dengue and supports the appropriate and timely design of vector control strategies.
Objective: To assess the genetic changes, diversity and gene flow in six microgeographical populations of Ae. aegypti in Medellín for different epidemiological periods of dengue.
Materials and methods: A total of 255 specimens from six different neighborhoods in Medellín were used to assess variations in the CO1 mtDNA haplotype composition, diversity and genetic differentiation for an epidemic period (2010) and an endemic period (2012).
Results: Two groups of highly differentiated haplotypes were present in both periods, and a high-frequency haplotype was assessed for all neighborhoods. The highest haplotype diversity was recorded in 2012, but the maximum nucleotide diversity was recorded in 2010. No significant correlation between genetic and geographic distances was observed.
Conclusions: The genetic composition of Ae. aegypti varies over time without a predictable pattern. In addition, the presence of a high-frequency haplotype in both periods could indicate a persistent variation adapted to vector control. However, the simultaneous movement of highly differentiated CO1 haplotypes compatible with multiple introductions suggests that different gene pools would be suitable for transmission. These results are consistent with mosquito dispersion due to human activities, which would enable the rapid spread of the virus during epidemics in Medellin.
Key words: Aedes aegypti , genome, mitochondrial; haplotypes, Colombia.
doi: http://dx.doi.org/10.7705/biomedica.v35i1.2343
El dengue es una enfermedad viral emergente, con un patrón endemo-epidémico en muchas áreas de la región tropical y subtropical (1), lo que en parte se debe a la expansión y adaptación de su vector primario, Aedes aegypti (Diptera, Culicidae), en centros urbanos y periurbanos (2,3). Tanto la transmisión de la enfermedad como las densidades del mosquito varían en el tiempo y pueden correlacionarse con el cambio climático (4,5). Dado que el mosquito constituye el principal factor de riesgo para la transmisión de la enfermedad, los esfuerzos se han enfocado hacia la prevención o reducción de la transmisión del virus por medio del control de las densidades del mosquito (6).
Desde 1980 el número de casos de dengue ha aumentado 4,5 veces solo en las Américas (1). A partir de la reaparición del dengue clásico en la década de 1970, y del surgimiento de la forma grave en los años noventa, la transmisión del dengue en Colombia se ha intensificado y se ha expandido a todo el territorio, evidenciando un patrón endemo-epidémico y ciclos fluctuantes cada dos o tres años (véanse los casos totales de dengue entre 2009 y 2012 en los boletines epidemiológicos del Instituto Nacional de Salud disponibles en: http://www.ins.gov.co/lineas-de-accion/Subdireccion-Vigilancia/ sivigila/Paginas/vigilancia-rutinaria.aspx). Como consecuencia del fenómeno de El Niño, los brotes de dengue en el país se recrudecieron desde comienzos del 2010, con un incremento notable en el número de casos comparado con el 2009 (figura 1a). Este patrón también fue evidente en Medellín, donde en algunas localidades existe una aparente relación entre el número de casos de dengue y la densidad del mosquito estimada a través de los índices de Breteau (figura 1b).

En el valle de Aburrá, Antioquia, el primer brote de dengue se notificó en 1980, año en el que se informó también la presencia del mosquito al norte de esta región, en el municipio de Bello, a donde ingresó a través de rutas comerciales por carretera y ferrocarril (7).
Aedes aegypti es un insecto holometábolo, con un rango de vuelo limitado (8) y un ciclo de vida muy modulado por variables climáticas y ecológicas y otras generadas por el hombre (9-11). Se espera que, dadas estas características, las poblaciones del mosquito experimenten cambios intermitentes a lo largo del tiempo en cuanto a su abundancia y diversidad genética, y con ello se pueda afectar su potencial evolutivo. Por ejemplo, si las poblaciones experimentan disminuciones temporales por efecto del clima o del control químico, además de la dispersión activa o pasiva propiciada por el movimiento de personas entre localidades, la superposición entre generaciones, los hábitos de oviposición de las hembras y la resistencia a la desecación de sus huevos, todo ello puede llevar a cambios en las densidades y en la diversidad genética de las poblaciones, lo que afectaría su potencial para res ponder al control químico, a la infección por el virus y a su dispersión. Para recrear estos escenarios es importante profundizar en el conocimiento de los patrones de variación genética, distribución y dispersión de Ae. aegypti, con el fin de entender con mayor claridad la epidemiología de la enfermedad y contribuir al diseño adecuado y oportuno de estra tegias de control vectorial, incluida la vigilancia activa en los períodos entre epidemias (12).
En este estudio se propuso evaluar los cambios genéticos, la diversidad y el flujo génico en poblaciones del vector del dengue en localidades microgeográficas de Medellín mediante las secuencias de ADN del gen citocromo oxidasa mitocondrial (CO1) durante un período de brote epidémico (2010) y un período endémico de la enfermedad (2012).
Materiales y métodos
Poblaciones de estudio
Se estudiaron poblaciones de Ae. aegypti prove nientes de seis barrios ubicados en dos transectos longitudinales en dirección norte-sur a lo largo del río Medellín, incluidos tres barrios en el oriente y tres en el occidente de la ciudad (figura 2a), con distancias entre 2,3 y 10,9 km entre los barrios.

Los mosquitos fueron recolectados en dos períodos: entre enero y abril de 2010, tiempo en el que se presentó un aumento en el número de casos de dengue en la ciudad (brote epidémico), y entre octubre y diciembre de 2012 (período endémico).
De acuerdo con la metodología implementada en el Laboratorio de Entomología Médica de la Univer sidad de Antioquia, en cada barrio se instalaron 20 ovitrampas hechas de láminas de balso sobre recipientes plásticos con agua, distribuidas en forma de zigzag a lo largo del barrio, con una distancia no mayor a 100 m entre ellas. Las ovitrampas se revisaron cada período durante seis semanas en dos recorridos semanales. Debido a que cada barrio constituyó la unidad de población de análisis, todos los huevos recolectados durante las seis semanas se dejaron eclosionar en bandejas plásticas individualizadas por barrio y bajo condiciones controladas de temperatura y humedad en el insectario del Laboratorio de Entomología Médica de la Universidad de Antioquia.
Las pupas producidas en cada bandeja se llevaron a jaulas etiquetadas por barrio y los adultos emergidos se alimentaron con sangre de ratón mediante alimentadores artificiales. Estos adultos se cruzaron para obtener una población (F 1 ) de mosquitos adultos recién emergidos y sin alimentar, los cuales se individualizaron en tubos de 1 ml y se guardaron a 4 °C hasta el momento de los ensayos de extracción de ADN.
Para tener una idea de la diversidad y diferenciación genética de las poblaciones bajo estudio comparadas con una población de control, se incluyeron ejemplares de Ae. aegypti de la generación F 1 recolectados y preservados durante el período de brote del 2010 en el municipio de Necoclí, región de Urabá, a 420 km de Medellín. El estudio contó con la aprobación del Comité de Ética para experimentación con animales de laboratorio de la Universidad de Antioquia.
Extracción de ADN genómico y análisis de secuencias del gen CO1
Se extrajo ADN de las patas y el abdomen de especímenes machos y hembras adultos de la generación F 1 con un estuche comercial (DNeasy®) y según las recomendaciones del proveedor. Las muestras de ADN se almacenaron a 4 °C. Con oligonucleótidos previamente reportados (5´-TCAGGGTGACCAAAAAATCA-3´ y 5´-CAAAT CATAAAGATATTGG-3´) (13), se amplificó una región del gen CO1 en un termociclador Perkin-Elmer 9600 y se utilizó un volumen final de 50 µl (0,2 mM de cada dNTPs, 0,2 µM de cada cebador, 0,5 U de Taq polimerasa, 1,5 mM de MgCl 2 , 2 µl de solución de ADN) obtenido bajo los siguientes parámetros: un ciclo de desnaturalización a 94 °C durante 5 minutos seguido de 35 ciclos de amplificación (94 °C/30 s, 55 °C/45 s, 72 °C/60 s) y un ciclo final a 72 °C durante 10 minutos.
Los productos de amplificación se verificaron en geles de agarosa al 1 %. Se contrató un servicio privado para las purificaciones de los amplicones de ADN (tamaño esperado de 658 pb) y las reac ciones de secuenciación. A través del programa Clustalw ( EMBL-EBI: http://www.ebi.ac.uk/clustalw/), las secuencias de la región CO1 se alinearon usando como referencia la secuencia de Ae. aegypti Liverpool, código de acceso AY056596; después de descartar posiciones ambiguas a ambos lados de la secuencia, la región analizada correspondió a la posiciones 145-678 de dicha secuencia de referencia.
Las secuencias diferenciadas por uno o más sitios polimorfos se definieron como haplotipos y los estimativos de diversidad (polimorfismo, diversidad de haplotipos, diversidad de nucleótidos y número promedio de diferencias en ellos), se calcularon con el programa DNAsp, v. 5.10 (14). Con el programa Arlequin, v. 3.1.1 (15) se obtuvieron estimativos de Fst pareados como una medida de la distancia genética entre poblaciones, y se comparó la variación entre los siguientes grupos: períodos epidemiológicos (epidémico y endémico); localidades durante un mismo período, y diferentes períodos en una misma localidad.
Para evaluar la hipótesis de aislamiento por distancia entre las poblaciones microgeográficas de Ae. aegypti , se analizó la divergencia genética con relación a la distancia geográfica ( Fst /[1 - Fst ]=a + b[Ln distancia]) mediante una prueba de Mantel (16). Las relaciones filogenéticas entre haplotipos portados por más de dos individuos se infirió con el método median joining en el programa Network, v. 4.2.0.1. (16).
Resultados
En una muestra de 255 individuos se analizó un fragmento de 534 pb del ADN mitocondrial del COI , en el cual se observaron 19 sitios polimórficos y 33 haplotipos, 15 de los cuales se encontraron en más de un individuo, en tanto que solo dos haplotipos (H1 y H4) se hallaron en ambos períodos (cuadro 1). Nueve haplotipos estaban presen tes exclusivamente en el 2010 y 23 en el 2012. Los tres haplotipos más frecuentes estaban muy diferenciados entre sí: 10 diferencias entre H1 y H2; 11 entre H1 y H3, y 5 entre H2 y H3. El haplotipo H1 (38,5 %), además de estar presente en ambos períodos (46,7 y 40,6 % en el 2010 y el 2012, respectivamente), se encontró en todas las localidades, incluida Necoclí. La frecuencia del otro haplotipo común a ambos períodos (H4) fue muy baja (7,2 y 1,9 % en el 2010 y el 2012, respectivamente). Los haplotipos H2 (29,0 %) y H3 (9,9 %) solo se encontraron en el período epidémico del 2010 (figura 2b) y el primero de ellos tanto en Medellín como en Necoclí. El haplotipo H3 tuvo 100 % de similitud con la secuencia reportada en la cepa Liverpool.

Entre los haplotipos presentes en la muestra fue posible distinguir dos grupos de haplotipos defi nidos por los polimorfismos en las posiciones 207 (G/A), 273 (T/C) y 276 (C/T). El primero de ellos (GTC) incluyó los haplotipos H2 y H3 y sus derivados (el H3 coincidió con la secuencia de la cepa Liverpool); el otro grupo (ACT) incluyó el haplotipo H1 y sus derivados (este grupo es más cercano filogenéticamente a la secuencia de la cepa Formosus) (figura 3). La diversidad del linaje GTC es mayor que la del linaje ACT (0,00435 y 0,00283, respectivamente).
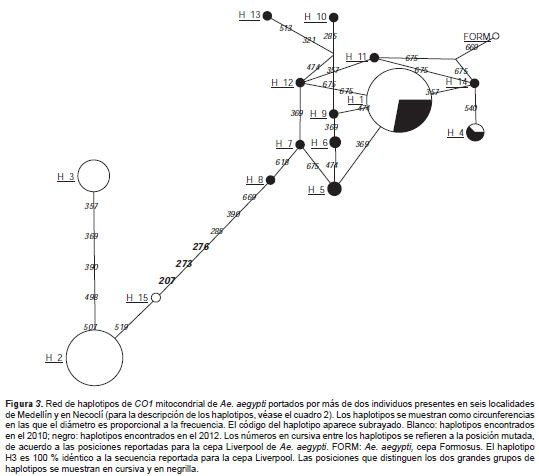
En el cuadro 2 se muestran los resultados relativos a la diversidad genética en los diferentes barrios y períodos. Para la serie completa de datos, la diversidad de haplotipos y nucleótidos estimada fue de 0,744 ± 0,019 y de 0,01 ± 0,00025, respectiva mente. Aunque se observó mayor diversidad de haplotipos en el 2012 (0,826) que en el 2010 (0,675), la diversidad de nucleótidos fue 2,3 veces mayor en el 2010, excepto en los barrios de Caicedo y Santa Cruz. Tanto la diversidad de haplotipos como la de nucleótidos de la muestra del 2010 fue muy similar cuando se incluyó la población de Necoclí (0,662 comparada con 0,675 y 0,011 comparada con 0,012). La población de Tejelo en el 2012 presentó la menor diversidad genética.

Se evidenció una diferenciación muy significativa en la composición de los haplotipos de los dos períodos epidemiológicos (Fst =0,33504 , p< 0,0001), así como en las mismas poblaciones en los dos períodos, aunque fue mayor entre los dos períodos en Santa Cruz (0,66) y menor en Caicedo (0,08). Al comparar las poblaciones en un mismo período, se encontró una mayor diferenciación genética en el 2010 (Fst entre 0,06 y 0,66), más marcada en los barrios Santa Cruz y Velódromo y Santa Cruz y Caicedo; en el periodo 2012 se encontró una menor diferenciación genética en los barrios (Fst máximo de 0,06 en Poblado y Velódromo). No se encontró una correlación significativa entre las distancias genéticas y las distancias geográficas (no se presentan los datos).
Con las secuencias de los haplotipos más frecuen tes y la herramienta Blast (www.ncbi.nlm.nih.gov), se hizo una búsqueda considerando solo las secuen cias reportadas para Ae. aegypti y se encontró que el haplotipo H1 se ha reportado en Martinica, México y Bolivia (17) y que se diferencia solo por dos pasos de mutación de la cepa de laboratorio Formosus ( AeCOI, AY05659 7) reportada por Morlais y Severson en el 2002 (18). El haplotipo H2 también se ha reportado en Bolivia, Tanzania y Nueva Guinea, mientras que el H3, idéntico al reportado en la cepa Liverpool (AeCOI, AY056596) (19), se ha reportado en Bolivia y Camboya (17).
Discusión
Mediante el análisis de una región del gen mitocon drial CO1 , se determinaron los cambios genéticos en dos períodos epidemiológicos en seis poblaciones microgeográficas de Ae. aegypti en Medellín. Los resultados del análisis de la diversidad de estas poblaciones mostraron que cada una de las seis poblaciones del mosquito se diferenció en los dos períodos, lo que indica que la composición genética de Ae. aegypti cambió sin un patrón predecible en un período no mayor de dos años (2010 a 2012).
Debido al aumento de la prevalencia de dengue en Medellín, en el 2010 se intensificaron las actividades de control vectorial en las comunas más afectadas, incluidos los barrios seleccionados en este estudio. Como resultado, se eliminaron y controlaron alre dedor de 4.656 criaderos, se fumigaron 276.250 viviendas con malatión y se llevaron a cabo 158 jornadas de fumigación extradomiciliaria en toda la ciudad (comunicación personal, Secretaría de Salud de Medellín, 2010). En este período de brote epidémico, y antes de las actividades de control, se encontró una mayor diversidad de nucleótidos y una mayor diferenciación genética entre las poblaciones, lo cual sugiere que el tamaño efectivo de las poblaciones del mosquito era mayor antes de dichas actividades.
Por otro lado, en el 2012 se observó una mayor diversidad de haplotipos expresada como un exceso de haplotipos de poca frecuencia derivados del haplotipo H1 y una filogenia con un linaje central y muchos haplotipos derivados. Esto sugiere que las poblaciones de Ae. aegypti en la región experime ntaron una recuperación en los mismos sitios evaluados debida al flujo desde otras áreas después de las actividades de control llevadas a cabo en el 2010.
Si bien las medidas de control en ese año pudieron disminuir la diversidad genética observada en el 2012, y con ello el tamaño efectivo potencial de las poblaciones del mosquito, en este último año se encontró una mayor diversidad de haplotipos, la cual es compatible con una expansión de la población. De allí la importancia de hacerle segui miento a la diversidad genética y al flujo génico entre poblaciones naturales de Ae. aegypti, ya que pueden influir en la velocidad de propagación de la resistencia a los insecticidas.
A pesar de que el mosquito es una variable clave para la transmisión del dengue, aún no se ha establecido una relación clara entre ella y la densidad de las poblaciones del vector, y mucho menos entre la diversidad genética de las poblaciones locales y las variaciones epidemiológicas de la transmisión. En este estudio se encontró mayor diversidad genética y la circulación simultánea de haplotipos de CO1 muy diferenciados (haplotipos H1, H2 y H3) en el período de alta transmisión (2010). Aunque se requerirá de un muestreo más detallado a lo largo del tiempo, estos resultados sugieren que la vigilancia de la diversidad genética de las poblaciones naturales de Ae. aegypti puede ser un complemento útil de las actividades de vigilancia entomológica y epidemiológica del dengue antes y después de las actividades de control entomológico.
Otro aspecto importante es que en Medellín no se encontró una relación entre las distancias genéticas y geográficas de las poblaciones del mosquito, lo que sumado a la presencia de un haplotipo prevalente en dos regiones distantes (valle de Aburrá y Urabá), es compatible con la dispersión del mosquito debida a la actividad del hombre, por ejemplo, el intercambio comercial o el movimiento de personas, factor que cobra importancia al posibilitar la diseminación rápida del virus durante brotes epidémicos en la ciudad.
La presencia de un haplotipo muy frecuente (H1), que también se encontró en la subregión de Urabá, durante un período de gran transmisión y otro de transmisión endémica dos años después, sugiere que se trata de una variación persistente adaptada al control vectorial después de la implementación de medidas de control con malatión. Esto plantea la necesidad de evaluar la relación entre este haplotipo y la sensibilidad al virus del dengue y a los insecticidas.
La circulación de haplotipos modales altamente diferenciados muestra que las poblaciones de Ae. aegypti de esta región son genéticamente diversas y, aunque no se puedan plantear conclusiones sobre su origen genético ni sus rutas de entrada, su presencia en México, Martinica y Bolivia (17) respaldaría el planteamiento de que ha habido múltiples introducciones del mosquito desde otras regiones de América.
Los datos actuales apuntan a que el origen de Ae. aegypti como cepa domiciliada tuvo lugar en el norte de África a partir de un ancestro selvático, del cual una población se dividió alopátricamente y se dispersó por el mundo, llegando a América con la trata de esclavos (2,3). Esto ha llevado a la definición de dos grupos divergentes de Ae. aegypti , que corresponden a las descripciones de Ae. aegypti formosus en África y de Ae. aegypti aegypti , que se distribuye en todo el trópico (2). Los haplotipos más comunes encontrados en este estudio se han reportado en otros países de América; sin embargo, también están a pocos pasos de mutaciones de aquellos reportados en África (19), lo cual sugiere que las poblaciones de Ae. aegypti introducidas en América durante la trata de esclavos han persistido a pesar de las intensas campañas de erradicación.
En cuanto a futuras medidas de control vectorial, se viene promoviendo a Bello, ciudad limítrofe de Medellín, como una localidad candidata para la liberación de adultos de Ae. aegypti infectados con Wolbachia pipientis Hertig, con el objeto de reemplazar las poblaciones silvestres y con ello reducir la capacidad de transmisión del virus del dengue (20). Sin embargo, esta estrategia se verá afectada por el tamaño, la diversidad y la estructura de las poblaciones silvestres, así como por las tasas de flujo génico entre ellas, por lo que es recomendable continuar el seguimiento de estos parámetros en la ciudad.
A la Secretaría de Salud de Medellín, por suministrar la información epidemiológica y de índices entomológicos del 2010 y el 2012.
Los autores declaramos que no existe ningún conflicto de intereses.
Este estudio fue parcialmente financiado por el Centro de Extensión de la Facultad de Medicina de la Universidad de Antioquia y se desarrolló como parte del proyecto 111556934549 financiado por Colciencias, así como por el Programa de Sostenibilidad del Grupo de Genética Molecular, 2013–2014.
Correspondencia: Winston Rojas, Universidad de Antioquia, Sede de Investigación Universitaria, Calle 62 N° 52-59, torre 2, laboratorio 430, Medellín, Colombia Teléfono: (574) 219 6467; fax: (574) 219 6469
winstonrojas@yahoo.com
1. San Martín JL, Brathwaite O, Zambrano B, Solórzano JO, Bouckenooghe A, Dayan GH, et al . The epidemiology of dengue in the Americas over the last three decades: A worrisome reality. Am J Trop Med Hyg. 2010;82:128-35. http://dx.doi.org/10.4269/ajtmh.2010.09-0346 [ Links ]
2. Brown JE, McBride CS, Johnson P, Ritchie S, Paupy C, Bossin H, et al . Worldwide patterns of genetic differentiation imply multiple ´domestications´ of Aedes aegypti , a major vector of human diseases . Proc Biol Sci. 2011;278:2446-54. [ Links ]
3. Tabachnick WJ. Evolutionary genetics and insect borne disease. The yellow fever mosquito, Aedes aegypti . Am Entomol. 1991;37:14-24. [ Links ]
4. Tabachnick WJ. Challenges in predicting climate and environmental effects on vector-borne disease episystems in a changing world. J Exp Biol. 2010;213;6:946-54. http://dx.doi.org/10.1242/jeb.037564 [ Links ]
5. Gubler DJ, Reiter PM, Ebi KL, Yap W, Nasci R, Patz JA. Climate variability and change in the United States: Potential impacts on vector- and rodent-borne diseases. Environ Health Perspect. 2001;109:223-33. [ Links ]
6. World Health Organization. Global strategy for dengue prevention and control 2012-2020. Geneva: WHO; 2012. [ Links ]
7. Groot H. The reinvasion of Colombia by A. aegypti : Aspects to remember. Am J Trop Med Hyg. 1980;29:330-8. [ Links ]
8. Russell RC, Webb CE, Williams CR, Ritchie SA. Mark-release-recapture study to measure dispersal of the mosquito Aedes aegypti in Cairns, Queensland, Australia. Med Vet Entomol. 2005;19:451-7. http://dx.doi.org/10.1111/j.1365-2915.2005.00589.x [ Links ]
9. Hopp MJ. Foley JA. Global-scale relationships between climate and the dengue fever vector, Aedes aegypti . Climatic Change. 2001;48:441-63. http://dx.doi.org/10.1023/A:1010717502442 [ Links ]
10. Barrera R, Amador M, Clark GG. Ecological factors influencing Aedes aegypti (Diptera: Culicidae) productivity in artificial containers in Salinas, Puerto Rico. J Med Entomol. 2006;43:484-92. [ Links ]
11. Spiegel JM, Bonet M, Ibarra AM, Pagliccia N, Ouellette V, Yassi A. Social and environmental determinants of Aedes aegypti infestation in Central Havana: Results of a case-control study nested in an integrated dengue surveillance programme in Cuba. Trop Med Int Health. 2007;12:503-10. http://dx.doi.org/10.1111/j.1365-3156.2007.01818.x [ Links ]
12. Urdaneta-Márquez L, Failloux AB. Population genetic structure of Aedes aegypti , the principal vector of dengue viruses. Infect Genet Evol. 2011;11:253-61. http://dx.doi.org/10.1016/j.meegid.2010.11.020 [ Links ]
13. Folmer O, Black M, Hoeh W, Lutz R, Vrijenhoek R. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates. Mol Mar Biol Biotechnol. 1994;3:294-9. [ Links ]
14. Librado P, Rozas J. DnaSP v5: A software for compre hensive analysis of DNA polymorphism data. Bioinformatics. 2009;25:1451-2. http://dx.doi.org/10.1093/bioinformatics/btp187 [ Links ]
15. Excoffier L, Lischer HE. Arlequin suite version 3.5: A new series of programs to perform population genetics analyses under Linux and Windows. Mol Ecol Resour. 2010;10:564-7. http://dx.doi.org/10.1111/j.1755-0998.2010.02847.x [ Links ]
16. Bandelt HJ, Forster P, Röhl A. Median-joining networks for inferring intraspecific phylogenies. Mol Biol Evol. 1999; 16:37-48. [ Links ]
17. Paupy Ch, Le Goff G, Brengues C, Guerra M, Revollo J, Barja Z, et al . Genetic structure and phylogeography of Aedes aegypti , the dengue and yellow-fever mosquito vector in Bolivia. Infect Genet Evol. 2012;12:1260-9. http://dx.doi.org/10.1016/j.meegid.2012.04.012 [ Links ]
18. Morlais I, Severson DW. Complete mitochondrial DNA sequence and amino acid analysis of the cytochrome c oxidase subunit I (COI) from Aedes aegypti . DNA Seq. 2002;13:123-7. [ Links ]
19. Mousson L, Dauga C, Garrigues T, Schaffner F, Vazeille M, Failloux AB. Phylogeography of Aedes ( Stegomyia ) aegypti (L.) and Aedes ( Stegomyia ) albopictus (Skuse) (Diptera: Culicidae) based on mitochondrial DNA variations. Genet Res. 2005;86:1-11. http://dx.doi.org/10.1017/S0016672305007627 [ Links ]
20. Noticias de la Ciencia y la Tecnología (NCYT). Probarán en Colombia un nuevo método para el control del dengue. Fecha de consulta: 22 de enero de 2014. Disponible en: http://noticiasdelaciencia.com/not/8115/probaran_en_colombia_un_nuevo_metodo_para_el_control_del_dengue/. [ Links ]













