Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.35 no.2 Bogotá Apr./June 2015
https://doi.org/10.7705/biomedica.v35i2.2404
REVISIÓN DE TEMA
doi: http://dx.doi.org/10.7705/biomedica.v35i2.2404
1 Grupo de Epidemiología y Salud Poblacional, Escuela de Salud Pública, Facultad de Salud, Universidad del Valle, Cali, Colombia
1 Centro Internacional de Entrenamiento e Investigaciones Médicas, Cali, Colombia
Recibido: 09/06/14; aceptado: 28/01/15
Cada vez son más los países que adoptan las guías de buenas prácticas clínicas como parte de la reglamentación de los estudios clínicos para el registro de productos farmacéuticos y de otros relacionados con la salud. Por ello, todos los involucrados en la investigación y el desarrollo de dichos productos tienen la obligación de conocerlas, implementarlas y velar por su cumplimiento. Sin embargo, las buenas prácticas clínicas son solo una de las iniciativas que buscan alcanzar los más altos estándares éticos y científicos en la investigación en salud y en otras áreas en las que los seres humanos son sujetos de investigación.
En esta revisión se definen las buenas prácticas clínicas y su objetivo, se presenta en forma práctica su marco legal en Colombia, se aclara su aplicación en estudios con intervenciones sin medicamentos, o en aquellos que no son ensayos clínicos, y se discuten los retos para lograr que contribuyan a la protección de los participantes en investigaciones, a la formación de profesionales íntegros y a una cultura de respeto por el ser humano.
Palabras clave: investigación biomédica, evaluación de medicamentos, ensayos clínicos, ética en investigación, gestión del conocimiento para la investigación en salud, manuales y guías para la gestión de la investigación, investigación científica y desarrollo tecnológico.
doi: http://dx.doi.org/10.7705/biomedica.v35i2.2404
What everybody should know about good clinical practices
An increasing number of countries are adopting good clinical practices guidelines as part of the regulation of clinical studies to register pharmaceutical products and other health-related products. Consequently, all parties involved in the research and development of these products should know them, implement them and ensure their compliance. However, good clinical practices guidelines are just one of the initiatives seeking to achieve the highest ethical and scientific standards in health research and in other areas where humans are research subjects.
This review defines such practices and their objectives presenting in a practical manner their legal framework in Colombia, and clarifying their application in studies where interventions use no medications or those that are not clinical trials. Finally, the work discusses the challenges to ensure that good clinical practices contribute to the protection of research participants, the education of trustworthy health professionals, and a culture of respect for human beings.
Key words: Biomedical research, drug evaluation, clinical trials, ethics research, knowledge management for health research, manuals and guidelines for research management, scientific research and technological development.
doi: http://dx.doi.org/10.7705/biomedica.v35i2.2404
Según los métodos de investigación actualmente aceptados, la generación de nuevos productos para la salud requiere casi ineludiblemente de estudios de investigación con seres humanos. Asimismo, las investigaciones en el campo de las llamadas ciencias de la vida´ o en otras ciencias, tienen al ser humano como sujeto de estudio o requieren de su participación. La evidencia histórica de abusos cometidos en la investigación con seres humanos y de fraude en los resultados de investigación ha planteado la necesidad de incrementar la regulación para el desarrollo de productos farmacéuticos y las normas éticas que guían la investigación en seres humanos (1-4).
Las guías de buenas prácticas clínicas hacen parte de estas iniciativas a escala internacional (5). Aunque su alcance original se restringe a la investigación con medicamentos en seres humanos, su conocimiento por parte de estudiantes, académicos, investigadores, miembros de comités de ética y directivos de instituciones involucradas en la investigación, entre otros, promueve la reflexión sobre los aspectos éticos y científicos de la investigación con seres humanos aplicables a un amplio rango de estudios en las ciencias naturales y sociales y en otros campos que contemplen la investigación con seres humanos.
De igual manera, el conocimiento de las buenas prácticas clínicas por parte de los pacientes y sus organizaciones contribuye a motivar su participación activa, no solo como potenciales sujetos de investigación, sino como asesores directos en la concepción de los estudios y en las diferentes etapas de la investigación, y el desarrollo y la innovación de medicamentos y otros productos para la salud (6). Esta consideración es pertinente para Colombia, donde se percibe un gran interés de la sociedad por la ciencia y la tecnología en el área de la salud y la medicina, pero el conocimiento de la opinión en torno a estas materias es limitado (7).
Por lo tanto, es necesario sensibilizar a la comunidad en general y a la comunidad científica de todos los campos, sobre los principios de las buenas prácticas clínicas y considerar las diferentes perspectivas de quienes tienen la función reguladora, la misión de desarrollar productos farmacéuticos, de contribuir al avance de la ciencia, así como de velar por la salud pública y proteger los derechos y el bienestar de los voluntarios en las investigaciones, y de prestar servicios de salud.
Esta revisión tiene como objetivo dar una visión de los aspectos transversales de las buenas prácticas clínicas que todas las personas interesadas en la investigación con seres humanos deben saber. Se incluye el contexto en el cual se enmarcan dichas prácticas, algunos de los temas clave en su implementación en estudios con medicamentos y en otros estudios, y algunos de los retos que deben superarse en su aplicación, con el fin de alcanzar los más altos estándares éticos y científicos.
Definición y objetivo de las buenas prácticas clínicas
Una buena práctica se define como el conjunto de procedimientos en el ámbito comercial o profesional que se consideran correctos o más efectivos (8). Las guías de buenas prácticas clínicas reúnen los principios y requisitos que buscan garantizar la integridad ética y científica de las investigaciones que prueban productos farmacéuticos en seres humanos; por lo tanto, dichas prácticas atañen al diseño, la conducción, la implementación, el análisis, la supervisión, la auditoría y la divulgación de las investigaciones clínicas en las diferentes fases de desarrollo de los productos farmacéuticos: desde la primera prueba en humanos hasta los estudios posteriores al registro (fases I a IV), incluidos los estudios de biodisponibilidad y bioequivalencia (9).
Las buenas prácticas clínicas surgieron como parte del proceso de estandarización internacional de la regulación de productos farmacéuticos y de la necesidad de fortalecer las normas éticas para la investigación con seres humanos (10). En la actualidad, las buenas prácticas clínicas se basan en dos documentos internacionales, uno publicado por la Organización Mundial de la Salud (OMS) en 1995 (9), y otro publicado por la International Conference of Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH), en 1996 (11). Además, la OMS publicó en el 2005 un manual de guía para la implementación de las buenas prácticas clínicas, en el que se describe cómo se aplican los principios que las rigen en actividades que incluyen estudios clínicos (12).
En términos generales, las guías de buenas prácticas clínicas publicadas por la OMS y la ICH son similares; sin embargo, se diferencian en que la OMS menciona 14 principios y la ICH, 13, ya que los principios 5 y 6 de la OMS se unieron en uno solo, el principio 6, en el documento de la ICH (cuadro 1). Otra diferencia es el propósito con el cual fueron desarrollados. El documento de la OMS busca que las guías de buenas prácticas clínicas se conviertan en referencia para los países que no cuentan con regulación en esta área, o en un estándar complementario a las regulaciones ya existentes en los países miembro de esta organización, independientemente de si los productos son desarrollados o no por compañías farmacéuticas; por su parte, el documento de la ICH tiene como propósito mejorar la calidad y eficiencia del proceso de desarrollo y registro de productos farmacéuticos, facilitando la aceptación de los aspectos científicos y procedimientos tanto por parte de las compañías farmacéuticas como de las agencias reguladoras de Estados Unidos ( US Food and Drug Administration , FDA), Europa ( European Medicines Agency , EMA) y Japón ( Ministry of Health, Labour and Welfare , MHLW). Por lo anterior, las buenas prácticas clínicas estipuladas en el documento de la ICH se utilizan sobre todo en estudios patrocinados por la industria farmacéutica internacional para el registro de los productos ante estas agencias. De hecho, una iniciativa internacional importante de la organización TransCelerate BioPharma Inc., constituida por un grupo creciente de compañías farmacéuticas, incluye el reconocimiento mutuo de la capacitación de los investigadores en buenas prácticas clínicas, siempre y cuando estos cursos cumplan con los requisitos mínimos de contenido establecidos en el documento de la ICH. El propósito de este reconocimiento es agilizar el proceso de certificación de los sitios de estudio, lo que redunda en una mayor eficiencia en el desarrollo de sus investigaciones (13).

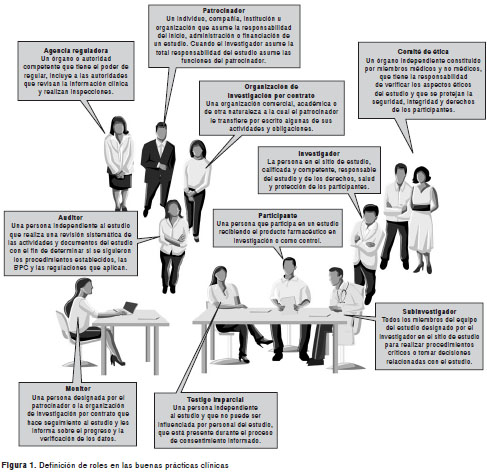
En todo caso, el objetivo de las buenas prácticas clínicas en ambos documentos es la protección de los participantes en las investigaciones y la calidad de los datos que se obtienen, de tal manera que su cumplimiento garantice que los estudios con seres humanos satisfagan los estándares internacionales de ética en la investigación y de credibilidad en los resultados (9,11). Hoy en día, las buenas prácticas clínicas, ya sean las consignadas por la OMS o las estipuladas por la ICH, han sido adoptadas parcial o totalmente por diversos países. La responsabilidad de aplicarlas le corresponde, entonces, a todos los actores involucrados en la investigación, incluidos los investigadores, los patrocinadores, el personal del sitio de estudio, las organizaciones de investigación por contrato u organizaciones académicas de investigación ( Academic Research Organization , ARO), los comités de ética de la investigación, las autoridades reguladoras y los participantes (figura 1).
La Organización Panamericana de la Salud (OPS) publicó en el 2005 el "Documento de las Américas" en buenas prácticas clínicas, a partir de una conferencia organizada por la Red Panamericana para la Armonización de la Reglamentación Farmacéutica (Red PARF). Además de describir las buenas prácticas clínicas, el documento incluye un programa de vigilancia para su cumplimiento a cargo de las agencias reguladoras nacionales e implementado mediante inspecciones a centros, instituciones o investigadores clínicos para verificar si los estudios se hacen observando dichas prácticas y se cumple con los requisitos de regulación (14). Dicho programa está en concordancia con el énfasis que la Red pone en el fortalecimiento de las autoridades reguladoras nacionales de la región. La Red PARF ha logrado la inclusión de las buenas prácticas clínicas en el marco legal de regulación de varios países de las Américas, incluido Colombia.
Marco legal de las buenas prácticas clínicas en Colombia
En Colombia, la función de agencia reguladora nacional de productos farmacéuticos le corresponde al Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) (15). Quien quiera realizar un estudio con medicamentos en seres humanos, sea persona natural o jurídica, nacional o internacional, debe solicitar la autorización correspondiente ante este organismo, siguiendo los pasos establecidos en el trámite denominado "Evaluación de protocolos de investigación de medicamentos en fase de precomercialización" (16). A pesar de que el nombre del trámite se refiere a los medicamentos en dicha fase, este aplica para vacunas, productos biológicos, estudios de biodisponibilidad y bioequivalencia, y estudios en los cuales se evalúe una nueva indicación de medicamentos ya registrados.
Entre los documentos que se someten a consideración del Invima, se incluye la carta de aprobación del protocolo de investigación por parte de un comité de ética de la investigación. Dicho comité también debe contar con la aprobación del Invima; si quien va a realizar el estudio no cuenta con un comité institucional de ética de la investigación registrado ante este organismo, puede someter la carta del comité de otra institución que sí esté registrado en el Invima (17). Más aun, desde la expedición de la Resolución 2378 de 2008, por la cual se adoptan las buenas prácticas clínicas en el país, solo las instituciones prestadoras de servicios de salud incluidas en el registro único de habilitación podrán ser autorizadas legalmente para llevar a cabo estudios con medicamentos en seres humanos (18). Esta autorización la otorga el Invima, mediante un certificado de cumplimiento de las buenas prácticas clínicas que se emite después de practicar una visita de inspección. Las instituciones prestadoras de servicios de salud que deseen obtener dicho certificado deben solicitar al Invima la visita de inspección mediante el trámite denominado "Certificación de buenas prácticas clínicas en instituciones donde se lleva a cabo investigación con seres humanos, mediante la aplicación y uso de medicamentos" (19).
En el 2009, el Invima publicó el documento denominado "ABC Buenas Prácticas Clínicas", en el cual se describe en forma sencilla y sintética en qué consiste el proceso de certificación y los componentes de la evaluación (cuadro 2) (20). Sin embargo, quien esté considerando certificarse en buenas prácticas clínicas debe conocer, como mínimo, la Resolución 2378 de 2008 ya mencionada (18), la Resolución 8430 de 1993, por la cual se establecen las normas científicas, técnicas y administrativas para la investigación en salud (21), la Resolución 1995 de 1999, por la cual se establecen normas para el manejo de la historia clínica (22), el Decreto 2200 de 2005, por la cual se reglamenta el servicio farmacéutico y se dictan otras disposiciones (23), la Resolución 1403 de 2007, por la cual se determina el modelo de gestión del servicio farmacéutico y se adopta el manual de condiciones esenciales y procedimientos (24), la Resolución 20764 de 2011, por la cual se establece el reglamento relativo al contenido y la periodicidad de los reportes de reacciones adversas (25), y el documento "Buenas Prácticas en el Laboratorio Clínico (BPLC)" (26). Una vez se emite el certificado de buenas prácticas clínicas, este tiene una vigencia de cinco años renovables mediante una nueva solicitud que debe enviarse tres meses antes del vencimiento de la vigencia de la certificación.

Un punto adicional que se debe tener en cuenta es que la aprobación por parte del Invima de los protocolos de investigación, así como la verificación del cumplimiento de las buenas prácticas clínicas, incluye como requisito una póliza contractual o extracontractual para reacciones adversas asociadas y atribuibles al producto de investigación, lo que se exige en todo estudio que se realice con medicamentos en seres humanos. De acuerdo con las buenas prácticas clínicas internacionales, el patrocinador, o quien asuma sus funciones, debe aportar la póliza de seguro y cubrir cualquier daño relacionado con la participación en el estudio, no solo los asociados con el medicamento (11).
Buenas prácticas clínicas en estudios con intervenciones sin medicamentos y otro tipo de estudios
Si bien los objetivos de las guías de buenas prácticas clínicas son aplicables prácticamente a cualquier investigación que se lleve a cabo con seres humanos, se argumenta que algunos prerrequisitos no son directamente extrapolables a otras intervenciones o a los estudios no experimentales (por ejemplo, los observacionales). Se ha argumentado, igualmente, que en la evaluación de dispositivos médicos, las buenas prácticas clínicas deben considerar el papel que juegan otros profesionales de la salud diferentes de médicos y odontólogos, y las diferencias en los objetivos de los estudios y en la evaluación de las reacciones adversas, entre otros. Debe tenerse en cuenta, asimismo, que las agencias reguladoras suelen exigir por separado los requisitos de la regulación para dispositivos médicos. En este sentido, la Organización Internacional de Normalización ( International Standard Organization , ISO) ha liderado el proceso de armonización de la investigación clínica relativa a dispositivos médicos para sujetos humanos y, recientemente, publicó las buenas prácticas para la investigación clínica de dispositivos médicos en humanos, ISO 14155:2011, que aún no se ha aceptado globalmente y que no incluye las pruebas de diagnóstico in vitro (27).
Otra consideración es que la aprobación de dispositivos médicos por parte de las agencias reguladoras no exige que se lleven a cabo estudios con seres humanos y, con frecuencia, se aceptan datos de seguridad y desempeño de los dispositivos médicos obtenidos en el laboratorio. Los datos clínicos relativos a los dispositivos médicos se requieren para su registro, dependiendo del tipo de dispositivo, su indicación, el riesgo para el paciente o usuario y su grado de innovación. Los dispositivos ya registrados requieren datos clínicos cuando se trata de ciertas modificaciones o de nuevas aplicaciones. Esta situación ha evolucionado en los últimos años, y hoy hay una regulación más estricta y mayores exigencias para demostrar su seguridad y su eficacia o el desempeño mediante estudios clínicos, como lo reflejan los cambios en la regulación para dispositivos médicos y pruebas de diagnóstico in vitro presentadas a la Comisión Europea (28,29). Además, la FDA de los Estados Unidos ha incluido el requisito de buenas prácticas clínicas para los estudios con dispositivos médicos llevados a cabo por fuera de Estados Unidos, y ha publicado una serie de recomendaciones para la planeación y realización de estudios clínicos esenciales ( pivotal studies ) dirigidas a productores de dispositivos médicos, investigadores y comités de ética (30,31). Se espera que los cambios continúen y se logre una mayor armonización entre los países con la conformación del International Medical Device Regulators Forum , IMDRF) (32). En Colombia, la regulación de dispositivos médicos también está evolucionando y se espera la publicación de la normatividad relativa a las buenas prácticas clínicas en los estudios sobre este tipo de productos. En la actualidad, los protocolos de investigación sobre dispositivos médicos con seres humanos deben ser revisados por la sala especializada del Invima, tal como ocurre con los protocolos para medicamentos.
Otras intervenciones físicas, sicológicas, conductuales, ambientales o relacionadas con la prestación de los servicios de salud que se hacen con seres humanos, o que los afectan indirectamente, no están necesariamente sujetas a los requisitos legales de las agencias reguladoras y, por lo tanto, no existe un estándar internacional de buenas prácticas clínicas específico para estos estudios, aparte de los requisitos establecidos internamente por las instituciones que llevan a cabo la investigación o por las agencias financiadoras, a los cuales debe acogerse el investigador (33). El investigador que lleva a cabo estudios con este tipo de intervenciones, debe verificar si está obligado por la regulación o no y, en caso de estarlo, debe cumplir con los requisitos establecidos con relación a las buenas prácticas clínicas y los demás que sean pertinentes. De igual manera, los estudios no experimentales (es decir, observacionales) podrían ser objeto de regulación por parte de las agencias nacionales si se aportan como parte del proceso de registro de productos farmacéuticos o de farmacovigilancia, en cuyo caso estos deberán cumplir con los requisitos establecidos por las agencias correspondientes (34,35).
Si la intervención o el estudio observacional no está sujeto a los requisitos de las agencias reguladoras nacionales, la institución o agencia financiadora podría considerar la implementación de las buenas prácticas clínicas, o al menos de los principios y los prerrequisitos que considere relevantes, así como de un programa de entrenamiento, al menos para el personal que hace parte del equipo de investigación y del comité de ética de investigación, puesto que tal tipo de entrenamiento y el respeto por los principios de las buenas prácticas clínicas contribuyen a garantizar ante la opinión pública la protección de los participantes en estas investigaciones y la credibilidad de los datos. En la mayoría de las ocasiones, las guías de buenas prácticas clínicas son aplicables parcialmente, o deben adaptarse, de manera que no se necesiten guías específicas para cada tipo de intervención o estudio. Sin embargo, existen iniciativas en este sentido para ciertas disciplinas y cierto tipo de estudios, por ejemplo, las guías de buenas prácticas para la investigación en sicología (36) y para los estudios cualitativos (37), entre otros.
De igual manera, se han publicado guías para la investigación preclínica y básica: las buenas prácticas de laboratorio, que son los estándares internacionales aplicados en los estudios preclínicos para la evaluación de las propiedades o la toxicidad ( in vitro y en animales) de productos que deben ser aprobados por las agencias reguladoras (38,39), y las prácticas de calidad en la investigación básica biomédica aplicables a estudios de investigación básica in vitro y en animales que no se contemplan en la regulación de las buenas prácticas de laboratorio (40).
En cuanto a los estudios observacionales, más que el hecho de contar con guías de buenas prácticas clínicas, se ha discutido la necesidad de armonizar los criterios para la revisión ética de este tipo de estudios debido a las diferencias en la normatividad de los países, lo que afecta la publicación de estudios observacionales multi-céntricos (41). Como estándar internacional, se han propuesto las Pautas Internacionales para la Revisión Ética de Estudios Epidemiológicos del Council for International Organizations of Medical Sciences , CIOMS (42). Sin embargo, estas guías están siendo revisadas a la luz de las modificaciones introducidas en la Declaración de Helsinki del 2013 (43). Entre dichos cambios, el CIOMS propone incluir la guía de revisión ética de estudios epidemiológicos en las "Guías internacionales de ética para la investigación biomédica en seres humanos" (44).
Retos en la implementación de las buenas prácticas clínicas
Si bien no existe una evaluación formal, se espera que el esfuerzo de armonizar, implementar y vigilar el cumplimiento de las buenas prácticas clínicas, garantice de forma plena la veracidad de los resultados de las investigaciones y la protección de los derechos, la seguridad y el bienestar de los participantes en estas investigaciones, permitiendo una reducción del tiempo y los costos de los estudios clínicos que se exigen para registrar un nuevo producto. Con ello, en últimas, se facilitará la disponibilidad oportuna de productos farmacéuticos seguros y eficaces para quienes los necesitan.
Tal vez una manera objetiva de evaluar el impacto de las buenas prácticas clínicas, sea verificando el número y el tipo de hallazgos mediante inspecciones de las agencias reguladoras. Una revisión de las cartas de advertencia emitidas por la División de Investigaciones Científicas de la FDA, responsable de verificar el cumplimiento de las buenas prácticas clínicas, muestra un incremento en el número de cartas y un cambio de enfoque de los investigadores en lo concerniente a los patrocinadores y las organizaciones de investigación por contrato (45). Aunque el hecho de que aún se detecten situaciones en las que no se ha obtenido el consentimiento informado, o no se ha observado el protocolo, indica que todavía no se cumplen las buenas prácticas clínicas en su totalidad, el incremento en el número de cartas de advertencia podría explicarse por el fortalecimiento de la labor de inspección, lo que constituye por sí mismo un resultado positivo.
También es positiva la identificación de los puntos que deben mejorarse, como el entrenamiento y los procesos de vigilancia clínica, así como un papel más activo del patrocinador para garantizar el cumplimiento de las buenas prácticas clínicas (45). Este último punto es particularmente importante, debido a la tendencia que se avizora de reemplazar la supervisión tradicional en el sitio con la revisión de la totalidad de los datos a través de un proceso centralizado o de otras alternativas enfocadas en los procesos y los datos considerados como críticos en cada estudio, lo que se conoce como supervisión basada en el riesgo ( risk-based monitoring ) (46). Si este tipo de supervisión fortalece o no la capacidad del patrocinador para garantizar el cumplimiento de las buenas prácticas clínicas, es algo que está aún por evaluarse.
El impacto de las guías del ICH, incluidas las de buenas prácticas clínicas, en los países que no son sus miembros, fue analizado en el 2001 por la OMS. Como aspectos positivos de su implementación, se mencionaron la mejoría en el proceso de desarrollo de nuevos productos farmacéuticos, y la simplificación y facilitación de la armonización del proceso regulador en países de otras regiones; como motivo de preocupación, se señaló que las guías representan la opinión, las necesidades y las prioridades de una minoría de países, por lo que hace falta la participación más amplia de la sociedad.
Se mencionó, igualmente, que el enfoque de dichas guías es el de la industria y no responde a la agenda de salud pública, y que la industria local de productos farmacéuticos y genéricos podría verse afectada y, con ella, el acceso a medicamentos esenciales; además, se podría estar presionando a los países a emplear sus recursos en áreas que no son necesariamente su prioridad, como es la adopción de requisitos costosos (47). En algunas evaluaciones hechas en la Comunidad Europea, se ha encontrado que la adopción de las buenas prácticas clínicas como parte de la reglamentación nacional tiene un impacto notable en los estudios clínicos académicos (es decir, los que no son patrocinados por la industria), por lo cual ha sido necesario un acompañamiento gubernamental para minimizar el efecto negativo, revisar la situación y tomar las medidas correctivas necesarias (48).
En Colombia, sería relevante analizar el impacto que la Resolución 2378 del 2008, por la cual se adoptan las buenas prácticas clínicas en el país, ha tenido sobre la capacidad de respuesta del Invima, así como sobre la cantidad y la calidad de los estudios clínicos patrocinados por la industria farmacéutica y aquellos que no lo son, y sobre la capacidad de respuesta de la industria farmacéutica nacional y la capacidad nacional para realizar investigaciones clínicas que den respuesta a los problemas prioritarios de salud pública. La necesidad urgente de generar una política nacional que fortalezca la capacidad del país para realizar investigaciones clínicas en beneficio de la salud pública y la industria farmacéutica nacional, ya se ha señalado (49).
Por último, los desafíos que enfrentan los investigadores y las instituciones para llevar a la práctica los conceptos teóricos de las buenas prácticas clínicas, son evidentes, principalmente cuando los recursos son limitados (50). Por lo tanto, se requiere una visión más amplia que la de ofrecer un curso o tener una certificación para responder realmente al desafío que enfrentan los profesionales de la salud, los equipos de investigación clínica y las instituciones prestadoras de servicios de salud para cumplir en su práctica diaria con los principios de las buenas prácticas clínicas y de la ética de la investigación. Las tensiones, dilemas y conflictos que se generan al tratar de articular la práctica clínica diaria y la investigación clínica, deben considerarse en la formación de los profesionales de la salud y reflejarse en el establecimiento de programas institucionales que generen una cultura de integridad profesional y científica, que vele por la protección de los participantes en la investigación y el fortalecimiento de los procesos de revisión ética de las investigaciones, y faciliten el cumplimiento de los más altos estándares de la investigación clínica (51).
A Herney Andrés García, Jackeline Bravo, Ricardo Palacios y Viviana Garay, por sus valiosos comentarios.
Lyda Osorio se encontraba bajo entrenamiento en Glaxo Smith Kline durante la elaboración de este manuscrito, pero Glaxo Smith Kline no participó directa ni indirectamente en la decisión de elaborarlo o someterlo a publicación. No se declaran otros potenciales conflictos de intereses.
Este trabajo fue financiado por una beca en investigación clínica del Programa de Investigación en Enfermedades Tropicales de la Organización Mundial de la Salud, adelantada en Glaxo Smith Kline (GSK), Londres, Reino Unido, y una comisión posdoctoral de la Universidad del Valle.
Correspondencia:
Lyda Osorio, Calle 4B No 36-00, edificio 118, Universidad del Valle, campus San Fernando, Cali, Colombia Teléfono: (572) 554 2458; fax: (572) 557 0425
1. Markman JR, Markman M. Running an ethical trial 60 years after the Nuremberg Code. Lancet Oncol. 2007;8:1139-46. http://dx.doi.org/10.1016/S1470-2045(07)70381-9 [ Links ]
2. Rothman DJ. Ethics and human experimentation. Henry Beecher revisited. N Engl J Med. 1987;317:1195-9. http://dx.doi.org/10.1056/NEJM198711053171906 [ Links ]
3. Office for Human Research Protection (OHRP). Protection of human subjects; Belmont Report: Notice of report for public comment. Fed Regist. 1979;44:23191-7. [ Links ]
4. Rits IA. Declaration of Helsinki. Recommendations guiding doctors in clinical research. World Med J. 1964;11:281. [ Links ]
5. Vogel D. The globalization of pharmaceutical regulation. Governance. 1998;11:1-22. http://dx.doi.org/10.1111/0952-1895.551998055 [ Links ]
6. European Patient´s Academy on Therapeutic Innovation (EUPATI). La academia de los pacientes: un cambio de paradigma en la comprensión pública de la I+D farmacéutica. Fecha de consulta: 15 de enero de 2015. Disponible en: http://www.patientsacademy.eu/index.php/es/about-eupati. [ Links ]
7. Observatorio Colombiano de Ciencia y Tecnología. III Encuesta Nacional de Percepción Pública de la Ciencia y la Tecnología, Colombia 2012 - Resumen ejecutivo. Fecha de consulta: 15 de enero de 2015. Disponible en: http://encuestaapropiacion.ocyt.org.co/. [ Links ]
8. Oxford University Press. The Oxford Dictionaries. Fecha de consulta: 10 de marzo de 2014. Disponible en: http://www.oxforddictionaries.com/. [ Links ]
9. World Health Organization (WHO). Guidelines for good clinical practice (GCP) for trials on pharmaceutical products. Technical report Series No. 850. Geneva: WHO; 1995. [ Links ]
10. Otte A, Maier-Lenz H, Dierckx RA. Good clinical practice: Historical background and key aspects. Nucl Med Commun. 2005;26:563-74. [ Links ]
11. International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH) . Guideline for good clinical practice E6(R1). Geneva: ICH Harmonised Tripartite Guideline; 1996. [ Links ]
12. World Health Organization (WHO). Handbook for good clinical research practice (GCP): Guidance for implementation. Geneva: WHO; 2005. [ Links ]
13. TransCelerate Biopharma Inc. Training provider attestation of ICH E6 GCP Investigator Site Personnel Training. Fecha de consulta: 8 de mayo de 2014. Disponible en: http://www.transceleratebiopharmainc.com/external-training-provider-attestation/. [ Links ]
14. Red Panamericana para la Armonización de la Reglamentacion Farmacéutica. Buenas Prácticas Clínicas: Documento de las Américas. Grupo de trabajo en Buenas Prácticas Clínicas (GT/BPC). República Dominicana: OPS; 2005. [ Links ]
15. República de Colombia. Decreto 1290 de junio 22 de 1994. "Por el cual se precisan las funciones del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) y se establece su organización básica". Diario oficial No. 41.406 del 24 de junio de 1994. [ Links ]
16. Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima). Evaluación de protocolos de investigación en medicamentos en fase de precomercialización. Fecha de consulta: 19 de enero de 2015. Disponible en: https://www.gobiernoenlinea.gov.co/web/guest/home/-/government-services/T225/maximized. [ Links ]
17. Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima). ABC Guía Comité de Etica e Investigación. Fecha de consulta: 19 de enero de 2015. Disponible en: https://www.invima.gov.co/images/pdf/tecnovigilancia/buenas_practicas/ABC%20Comites%20de%20etica.pdf. [ Links ]
18. Ministerio de la Protección Social. Resolución 2378 de 2008 por la cual se adoptan las Buenas Prácticas Clínicas para las instituciones que conducen investigación con medicamentos en seres humanos. Fecha de consulta: 19 de enero de 2015. Disponible en: https://www.invima.gov.co/images/pdf/tecnovigilancia/buenas_practicas/normatividad/resolucion_2378_de_2008.pdf. [ Links ]
19. Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima). Certificación de BPC en instituciones donde se llevan a cabo investigación con seres humanos, mediante la aplicación y uso de medicamentos. Fecha de consulta: 19 de enero de 2015. Disponible en: https://www.gobiernoenlinea.gov.co/web/guest/home/-/government-services/T414/maximized. [ Links ]
20. Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima). ABC Buenas Prácticas Clínicas. Fecha de consulta: 19 de enero de 2015. Disponible en: https://www.invima.gov.co/images/pdf/tecnovigilancia/buenas_practicas/ABCBPCultima_version.pdf. [ Links ]
21. Ministerio de Salud de Colombia. Resolución 8430 de octubre 4 de 1993 por la cual se establecen las normas científicas, técnicas y administrativas para la investigación en salud. Fecha de consulta: 19 de enero de 2015. Disponible en: https://www.invima.gov.co/images/pdf/tecnovigilancia/buenas_practicas/normatividad/Resolucion_8430_de_1993.pdf. [ Links ]
22. Ministerio de Salud de Colombia. Resolución 1995 de julio 8 de 1999 por la cual se establecen normas para el manejo de la historia clínica. Fecha de consulta: 19 de enero de 2015. Disponible en: https://www.invima.gov.co/images/pdf/tecnovigilancia/buenas_practicas/normatividad/Resoluci%C3%B3n_1995_de_1999-hc_0.pdf. [ Links ]
23. Ministerio de la Protección Social de Colombia. Decreto 2200 de junio 28 de 2005 por el cual se reglamenta el servicio farmacéutico y se dictan otras disposiciones. Fecha de consulta: 19 de enero de 2015. Disponible en: https://www.invima.gov.co/images/pdf/medicamentos/decretos/decreto_2200_2005.pdf. [ Links ]
24. Ministerio de la Protección Social de Colombia. Resolución 1403 de mayo 14 de 2007 por el cual se determina el Modelo de Gestión del Servicio Farmacéutico, se adopta el Manual de Condiciones Esenciales y Procedimientos y se dictan otras disposiciones. Fecha de consulta: 19 de enero de 2015. Disponible en: https://www.invima.gov.co/images/pdf/medicamentos/resoluciones/resolucion_1403_2007.pdf. [ Links ]
25. Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima). Resolución 20764 de junio 10 de 2011 por la cual se establece el reglamento relativo al contenido y la periodicidad de los reportes de eventos adversos. Fecha de consulta: 19 de enero de 2015. Disponible en: https://www.invima.gov.co/images/pdf/tecnovigilancia/buenas_practicas/reportes-eventos/Resolucion_2011020764_Junio_10_de_2011.pdf. [ Links ]
26. World Health Organization/Special Programme for Research & Training in Tropical Diseases (WHO/TDR). Good Clinical Laboratory Practice (GCLP). Fecha de consulta: 15 de enero de 2015. Disponible en: http://www.who.int/tdr/publications/documents/gclp-web.pdf. [ Links ]
27. International Standard Organization (ISO). Clinical investigation of medical devices for human subjects - Good clinical practice ISO 14155:2011. Fecha de consulta: 20 de diciembre de 2014. Disponible en: http://www.iso.org/iso/catalogue_detail?csnumber=45557. [ Links ]
28. European Commission Directorate for General Health & Consumers. Clinical investigation and evaluation of medical devices. Fecha de consulta: 2 de abril de 2014. Disponible en: http://ec.europa.eu/health/medical-devices/dialogue-parties/working-groups/cie_wg_index_en.htm. [ Links ]
29. European Commission Directorate for General Health & Consumers. Revision of the medical device directives. Fecha de consulta: 2 de abril de 2014. Disponible en: http://ec.europa.eu/health/medical-devices/documents/revision/index_en.htm. [ Links ]
30. US Food and Drug Administration (FDA). Acceptance of data from clinical studies for medical devices 21 CFR Parts 807, 812, and 814. Fecha de consulta: 2 de abril de 2014. Disponible en: http://www.gpo.gov/fdsys/pkg/FR-2013-02-25/pdf/2013-04201.pdf. [ Links ]
31. US Food and Drug Administration (FDA). Design considerations for pivotal clinical investigations for medical devices - guidance for industry, clinical investigators, institutional review boards and food and drug administration staff. Fecha de consulta: 2 de abril de 2014. Disponible en: http://www.fda.gov/medicaldevices/deviceregulationandguidance/guidancedocuments/ucm373750.htm. [ Links ]
32. International Medical Device Regulators Forum (IMDRF). About IMDRF. Fecha de consulta: 24 de enero de 2014. Disponible en: http://www.imdrf.org/about/about.asp. [ Links ]
33. US National Institutes of Health Office of Extramural Research. Grants and Funding: Regulations, policies and guidance. Fecha de consulta: 24 de enero de 2014. Disponible en: http://grants.nih.gov/grants/policy/hs/hs_policies.htm. [ Links ]
34. US Food and Drug Administration (FDA). Code of Federal Regulations CFR - Title 21, subpart B - Investigational New Drug Application (IND). Fecha de consulta: 8 de mayo de 2014. Disponible en: http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?CFRPart=312&showFR=1&subpartNode=21:5.0.1.1.3.2. [ Links ]
35. US Food and Drug Administration (FDA). Guidance for industry: Postmarketing studies and clinical trials implementation of section 505(o)(3) of the Federal Food, Drug, and Cosmetic Act. Fecha de consulta: 8 de mayo de 2014. Disponible en: http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM172001.pdf. [ Links ]
36. The British Psychological Society. Good practice guidelines for the conduct of psychological research within the NHS. Fecha de consulta: 24 de enero de 2014. Disponible en: http://www.psy.ed.ac.uk/psy_research/documents/BPS%20Guidelines%20for%20the%20Conduct%20of%20Research%20within%20the%20NHS.pdf. [ Links ]
37. Reynolds J, Kizito J, Ezumah N, Mangesho P, Allen E, Chandler C. Quality assurance of qualitative research: A review of the discourse. Health Res Policy Syst. 2011;9:43. http://dx.doi.org/10.1186/1478-4505-9-43 [ Links ]
38. Organization for Economic Cooperation and Development (OECD). OECD Series on Principles of Good Laboratory Practice (GLP) and compliance monitoring. Fecha de consulta: 24 de enero de 2014. Disponible en: http://www.oecd.org/env/ehs/testing/oecdseriesonprinciplesofgoodlaboratorypracticeglpandcompliancemonitoring.htm. [ Links ]
39. World Health Organization/Special Programme for Research and Training in Tropical Diseases (WHO/TDR). Handbook: Good laboratory practice (GLP): Quality practices for regulated non-clinical research and development. Fecha de consulta: 24 de enero de 2014. Disponible en: http://www.who.int/tdr/publications/documents/glp-handbook.pdf. [ Links ]
40. World Health Organization/Special Programme for Research and Training in Tropical Diseases (WHO/TDR). Handbook: Quality practices in basic biomedical research. Fecha de consulta: 24 de enero de 2014. Disponible en: http://www.who.int/tdr/publications/documents/quality_practices.pdf. [ Links ]
41. Cuttini M, Saracci R. Commentary: Can we facilitate the ethical approval of international observational studies? Int J Epidemiol. 2009;38:1108-9. http://dx.doi.org/10.1093/ije/dyp238 [ Links ]
42. Council for International Organizations of Medical Sciences (CIOMS). International Ethical Guidelines for Epidemiological Studies. Fecha de consulta: 24 de enero de 2014. Disponible en: http://www.ufrgs.br/bioetica/cioms2008.pdf. [ Links ]
43. World Medical Association (WMA). World Medical Association Declaration of Helsinki: Ethical principles for medical research involving human subjects. JAMA. 2013;310:2191-4. http://dx.doi.org/10.1001/jama.2013. 281053 [ Links ]
44. Council for International Organizations of Medical Sciences ( CIOMS). CIOMS working group of the revision of the 2002 CIOMS ethical guidelines for biomedical research. Fecha de consulta: 19 de enero de 2015. Disponible en: http://www.cioms.ch/index.php/component/content/article/12-newsflash/232-cioms-working-group-of-the-revision-of-the-2002-cioms-ethical-guidelines-for-biomedical-research. [ Links ]
45. Shah K. Trends in food and drug administration inspection: A warning for the industry! Perspect Clin Res. 2011;2:81-2. http://dx.doi.org/10.4103/2229-3485.83220 [ Links ]
46. US Food and Drug Administration (FDA). Guidance for industry: Oversight of clinical investigations - A risk-based approach monitoring. Fecha de consulta: 2 de abril de 2014. Disponible en: http://www.fda.gov/downloads/Drugs/Guidances/UCM269919.pdf. [ Links ]
47. World Health Organization (WHO). The impact of implementation of ICH guidelines in non-ICH countries. Regulatory Report Series No. 9 WHO/EDM/QSM/2002.3. Fecha de consulta: 8 de mayo de 2014. Disponible en: http://apps.who.int/medicinedocs/pdf/h2993e/h2993e.pdf. [ Links ]
48. Hartmann M. Impact assessment of the European Clinical Trials Directive: A longitudinal, prospective, observational study analyzing patterns and trends in clinical drug trial applications submitted since 2001 to regulatory agencies in six EU countries. Trials. 2012;13:53. http://dx.doi.org/10.1186/1745-6215-13-53 [ Links ]
49. Palacios M. Las buenas prácticas clínicas en Colombia. Colombia Médica. 2008;39:312-3. [ Links ]
50. Tinto H, Noor RA, Wanga CL, Valea I, Mbaye MN, D´Alessandro U, et al . Good clinical practice in resource-limited settings: Translating theory into practice. Am J Trop Med Hyg. 2013;88:608-13. http://dx.doi.org/10.4269/ajtmh.12-0330 [ Links ]
51. Grunberg SM, Cefalu WT. The integral role of clinical research in clinical care. N Engl J Med. 2003;348:1386-8. http://dx.doi.org/10.1056/NEJMsb025342 [ Links ]













