Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157
Biomédica vol.35 no.3 Bogotá jul./set. 2015
https://doi.org/10.7705/biomedica.v35i3.2417
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v35i3.2417
1 Grupo de Alergología Clínica y Experimental, Universidad de Antioquia, Medellín, Colombia
2 Grupo de Inmunología Celular e Inmunogenética, Universidad de Antioquia, Medellín, Colombia
Contribución de los autores: María Dulfary Sánchez: concepción y diseño del estudio, reclutamiento de los pacientes, recolección de muestras, aplicación de encuestas y análisis de los datos Julián Cuervo, Deisi Rave y Gustavo Clemen: recolección de muestras, aplicación de encuestas, desarrollo de los experimentos y recolección de los datos Juan José Yepes-Núñez: evaluación de los pacientes, análisis de los datos, participación en la escritura del manuscrito
Blanca Ortiz-Reyes: supervisión de experimentos y revisión crítica del manuscrito
Sara Sus y Ricardo Cardona: evaluación de los pacientes y revisión crítica del manuscrito
Recibido: 20/06/14; aceptado: 11/05/15
Introducción. El angioedema hereditario es una inmunodeficiencia primaria de carácter autosómico dominante, debida a un déficit en la proteína inhibidora del factor C1 y caracterizada por episodios recurrentes de edema subcutáneo y de las mucosas. Las impredecibles y frecuentes crisis de angioedema afectan la calidad de vida de los individuos que las padecen.
Objetivo. Analizar las características clínicas de una familia con un caso índice de angioedema hereditario y determinar el impacto de la enfermedad en la calidad de vida.
Materiales y métodos. En el estudio se incluyeron 26 miembros de la familia, a 25 de los cuales se les midieron los niveles sanguíneos del factor C4 del complemento y del inhibidor de C1 antigénico y funcional. Se utilizaron dos instrumentos, el SF-36 para evaluar la salud del adulto y el KIDSCREEN-27 para la calidad de vida de niños y adolescentes.
Resultados. El 83 % de los individuos que reportaron síntomas cumplían con los criterios serológicos del angioedema hereditario de tipo I: valores bajos del factor C4 del complemento y del inhibidor de C1 cuantitativo (antigénico) y cualitativo (funcional). Se encontró que la calidad de vida en cuanto al bienestar psicológico y el desempeño emocional de los pacientes, se veía considerablemente afectada por los síntomas de la enfermedad.
Conclusión. Este estudio provee información sobre la primera familia caracterizada con angioedema hereditario de tipo 1 en el Valle de Aburrá, Colombia. Aunque para ello se usó un instrumento genérico, se confirmó, además, el efecto negativo de la enfermedad en la calidad de vida de los individuos que la padecen.
Palabras clave: angioedema hereditario de tipos I y II, inactivadores del complemento, complemento C1, complemento C4, proteína inhibidora del complemento C1, calidad de vida.
doi: http://dx.doi.org/10.7705/biomedica.v35i3.2417
Hereditary angioedema in Medellín (Colombia): Clinical evaluation and quality of life appraisal
Introduction: Hereditary angioedema is an autosomal dominant primary immunodeficiency caused by a deficiency of the C1 inhibitor protein and characterized by recurrent episodes of subcutaneous and mucosal edema. Unpredictable and frequent crisis of angioedema affect the quality of life of individuals suffering this kind of disorder.
Objective: To analyze the clinical characteristics of a family with an index case of hereditary angioedema and to determine the impact of this disease on their quality of life.
Materials and methods: Twenty six members of the family were included in the trial; 25 of them were analyzed for C4 complement and antigenic and functional C1 inhibitor blood levels. Two instruments (SF-365 and KIDSCREEN-27) were used to evaluate adult health quality and children and teenagers quality of life, respectively.
Results: Eighty three percent (83%) of individuals reporting symptoms of the condition exhibited serological criteria of hereditary angioedema type I: low levels of both C4 complement and quantitative (antigenic) and qualitative (functional) C1 inhibitor. In relation to patients´ psychological and emotional performance, their quality of life was significantly affected by the symptoms of hereditary angioedema.
Conclusion: This study provides evidence of the first family in Valle de Aburrá (Colombia) characterized as having hereditary angioedema type I. Despite the use of a generic instrument, the negative impact on the quality of life of individuals suffering this disease was also confirmed.
Key words : Hereditary angioedema types I and II, complement inactivating agents, complement C1 , complement C4 , complement C1- inhibitor protein, quality of life.
doi: http://dx.doi.org/10.7705/biomedica.v35i3.2417
El angioedema hereditario es una inmunodefi ciencia primaria poco frecuente que se presenta como consecuencia de un déficit cuantitativo (concentración) o cualitativo (funcional) de una proteína de 478 aminoácidos perteneciente a la familia de inhibidores de las proteasas de serina (serpinas), llamada inhibidor de C1 esterasa (C1-INH) y también conocida como SERPING1 (1). El déficit funcional y el que se evidencia en la concentración de la proteína, se debe a mutaciones a lo largo del gen SERPING1 , lo cual resulta en un mal plegamiento de la proteína, lo que evita que esta sea secretada eficientemente (2).
El C1-INH es sintetizado principalmente por los hepatocitos y es un regulador negativo de la calicreína, una enzima del sistema de contacto (calicreína-cinina) que escinde el cininógeno de alto peso molecular generando bradicinina, el mediador responsable del angioedema, debido a su papel en el incremento de la permeabilidad vascular y el edema del tejido subcutáneo y de las mucosas. El C1-INH regula la actividad de las proteasas del complemento C1r y C1s y del factor Hageman (factor de coagulación XII), e inhibe la plasmina y el factor de coagulación XIa (figura 1) (3). Debido a la gran variedad de sustratos de esta esterasa, su ausencia o la disminución de su actividad enzimática, resultan en la activación no controlad a de la vía clásica del complemento y del sistema de calicreína y, por lo tanto, generan bajo s niveles séricos del factor C4 del complemento, así como péptidos vasoactivos del tipo de la cinina, marcadores que se han utilizado para identificar esta condición (4,5).
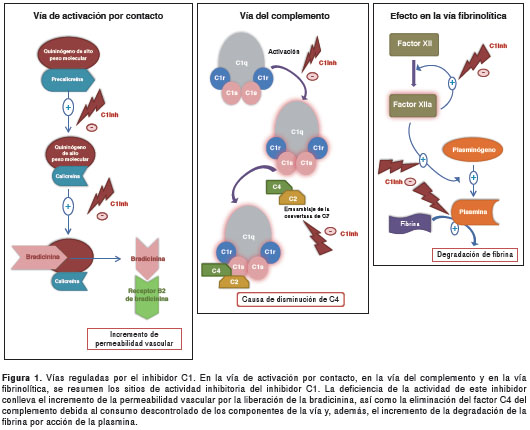
El angioedema hereditario se clasifica en tres tipos: el I (que se presenta en el 80 % de los casos, aproximadamente) se caracteriza por la disminución en los niveles de C1-INH en la sangre sin causar alteración de su función. En el tipo II (que corresponde al 20 % de los casos, aproximadamente), los niveles de C1-INH son normales o incluso elevados, pero la función es anormal. El tipo III tiene una presentación clínica similar a los tipos I y II, pero no se debe a la deficiencia o alteración funcional de C1-INH. Algunos pacientes con angioedema hereditario de tipo III presentan mutaciones en el gen del factor de coagulación XII que no alteran los niveles plasmáticos de dicho factor, pero sí incrementan significativamente su actividad (6).
El tratamiento del angioedema hereditario se centra en la estabilización del paciente afectado por un ataque agudo de angioedema (7). En esta circunstancia, es esencial determinar el factor desencadenante para prevenir futuros ataques y, en pacientes con riesgo de ede ma laríngeo, es importante vigilar la permeabilidad de la vía aérea. Cuando existe riesgo de desarrollar el cuadro clínico, como en los procedimientos dentales, los exámenes invasivos y las cirugías, se debe considerar la profilaxis a corto plazo mediante la administración del concentrado de C1-INH 30 minu- tos antes de la intervención (8), o de andrógenos atenuados en los días previos al procedimiento (9). La profilaxis a largo plazo se debe considerar en los casos con más de un episodio agudo por mes y en aquellos pacientes con síntomas cuya frecuencia o intensidad afectan su calidad de vida (8).
En cuanto al tratamiento farmacológico, existen diversas opciones terapéuticas para el angioedema hereditario, entre ellas, la reconstitución del C1-INH con plasma fresco congelado o C1-INH recombinante humano (Cinryze® o Berinert®, por ejemplo), la administración de andrógenos atenuados (danazol, estanozolol, metiltestosterona y oxandrolona), la inhibición de la calicreína plasmática (con ecallantide, DX-88, por ejemplo) y el uso de agentes antifibrinolíticos (ácido tranexámico, ácido epsilón aminocaproico) o del bloqueador del receptor beta 2 de la bradicinina (icatibant) (10). Según Longhurst, et al. (11), los pacientes aptos para la prescripción del C1- INH como tratamiento del angioedema hereditario son aquellos en quienes se ha confirmado la disminución de C4 y la deficiencia cuantitativa y cualitativa del C1-INH, preferentemente, mediante estudios genéticos. Estos programas son una realidad en Europa; sin embargo, en Colombia aún no se cuenta con el inhibidor de C1 terapéutico.
La prevalencia de la enfermedad en Colombia es desconocida. En el mundo se ha calculado que afecta aproximadamente entre 1 en 10.000 y 1 en 150.000 individuos (12) . Debido a que la enfermedad es poco frecuente, y que entre el 6,1 y el 13,7 % de los pacientes son asintomáticos o presentan un inicio retardado de los síntomas, la sospecha médica es muy baja, lo que conlleva, lamentablemente, a un diagnóstico tardío (13).
Algunos factores, como el dolor y la impredecibilidad de los ataques, afectan notablemente la calidad de vida relacionada con la salud en los individuos que sufren de angioedema hereditario. Dado que esta es una enfermedad potencialmente fatal, los pacientes viven con el constante temor de una oclusión repentina de la vía aérea (14), lo que afecta su estado emocional y el de sus familiares. Además, la enfermedad afecta negativamente el desempeño social, la productividad laboral de los adultos, así como el rendimiento escolar de niños y jóvenes, como consecuencia del aislamiento social y la suspensión de actividades producto de la incapacidad física durante los recurrentes ataques edematosos.
A partir de un caso índice se identificó a toda una familia con antecedentes de episodios de angio edema no diagnosticados como tal en ninguno de los integrantes de las diferentes generaciones, por lo que se planteó hacer un estudio que describiera las características clínicas y los marcadores de laboratorio del angioedema hereditario, así como su impacto en la calidad de vida relacionada con la salud en esta familia colombiana.
Materiales y métodos
Tipo de estudio
Entre enero y diciembre del 2012 se hizo un estudio descriptivo prospectivo, a partir de una serie de casos.
Sujetos
La población de estudio estuvo constituida por 26 sujetos de una misma familia, cuyo caso índice fue un menor de 3 años de edad que fue llevado a consulta al Servicio de Alergología de la sede ambulatoria de la IPS Universitaria de la Universidad de Antioquia, por eventos recurrentes de angioedema. El diagnóstico de angioedema hereditario se estableció de acuerdo con los criterios clínicos y de laboratorio establecidos internacionalmente (15). Todos los 26 sujetos fueron entrevistados y para la evaluación de los parámetros de laboratorio se tomaron muestras séricas a 25 de ellos. No fue posible obtener la muestra de un participante debido a su estado clínico en el momento del estudio.
Calidad de vida relacionada con la salud
Para esta valoración se usaron dos instrumentos previamente validados en Colombia (16,17), que se aplicaron según la edad de los sujetos: el instrumento SF-36 en aquellos mayores de 18 años y el KIDSCREEN-27 en niños y jóvenes entre los 8 y los 18 años de edad. En ambos cuestionarios la puntuación se basa en la gradación de las respuestas de 0 hasta 100, donde 0 corresponde a la peor percepción del estado de salud y 100 a la mejor percepción de la calidad de vida relacionada con la salud.
Factor C4 del complemento
La fracción C4 del complemento se determinó mediante inmunoturbidimetría con el estuche Tina- Quant Complement C4-2 en el analizador auto-mático Roche/Hitachi Cobas® c del Laboratorio Docente, Asistencial e Investigativo de la Escuela de Microbiología, sede ambulatoria de la IPS Universitaria de la Universidad de Antioquia. Como intervalo de referencia normal se tomó una concentración entre 10 y 40 mg/dl, según lo establecido por el laboratorio.
C1-INH antigénico (cuantitativo)
Los niveles de C1-INH antigénico se determina-ron mediante la prueba de inmunodifusión radial Bindarid ® del inactivador C1 humano (Binding Site Ltd., Birmingham, Reino Unido). El intervalo de referencia para la prueba fue de 100 a 250 mg/L, como lo sugieren los proveedores del estuche.
C1-INH funcional (cualitativo)
La determinación de los niveles de C1-INH funcio nal se hizo mediante la prueba ELISA MicroVue Complement C1 inhibitor (Quidel Corporation, Santa Clara, CA). Los valores de referencia usados fueron los sugeridos por los proveedores del estuche: valor normal, cuando el porcentaje de actividad del C1-INH es mayor o igual al 68 %; valor cuestionable, cuando se encuentra un porcentaje de actividad de C1-INH entre 41 y 67 %, y actividad disminuida cuando el valor es menor o igual al 40 %.
Análisis estadístico
Para las variables sociodemográficas, inmunológicas y clínicas, además de los dominios correspondientes de los instrumentos SF-36 y KIDSCREEN-27, se describieron las medidas de tendencia central y de dispersión. Para la comparación de los valores promedio entre los niveles séricos del factor C4 del complemento y el C1-INH en sujetos sintomáticos (aquellos que habían llegado a padecer, al menos, un episodio de angioedema en los seis meses previos al estudio) y en no sintomáticos, se utilizó la prueba t de Student. Se estableció un nivel de confiabilidad del 95 % con un error alfa de 5 % y una significancia estadística de p<0,05. Los programas estadísticos utilizados fueron STATA 12,1 (StataCorp LP, Texas, USA) y GraphPad Prism, versión 5 (GraphPad Software, Inc., La Jolla, CA).
Aspectos éticos
La participación de los pacientes fue voluntaria y se avaló con la firma del consentimiento informado, el cual se diseñó según los principios para la experimentación humana descritos en la Declaración de Helsinki, e incluyó la declaración de un representante legal o familiar de los meno-res de 18 años participantes en el estudio. Dicho consentimiento fue previamente aprobado por el Comité de Ética del Instituto de Investigaciones Médicas de la Facultad de Medicina de la Universidad de Antioquia.
Resultados
Características sociodemográficas
Se elaboró el árbol genealógico de 69 miembros de la familia (programa GenoPro, versión gratuita de prueba) con base en la información obtenida de los individuos entrevistados para el estudio (figura 2). Se incluyeron 26 sujetos en el estudio (indicados en la figura 2 con color rojo). Las características sociodemográficas y clínicas se describen en el cuadro 1. La mayoría de los participantes eran mujeres (52 %). Los adultos tenían entre 23 y 70 años de edad y, los niños, entre 3 y 17 años.
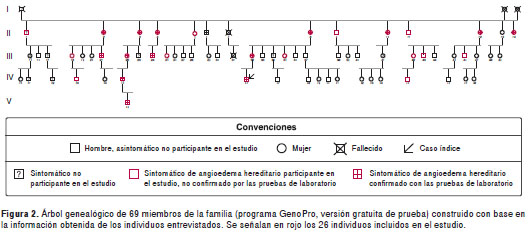
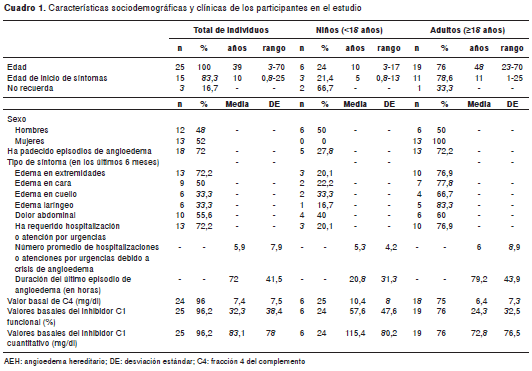
De los 26 participantes, siete señalaron que nunca habían presentado síntomas relacionados con el angioedema hereditario; 18 sujetos (72 %) refirieron síntomas en los seis meses previos al estudio; la edad media de aparición de los síntomas en ellos fue a los 10 años. Cinco de los individuos sintomáticos eran menores de edad (<18 años).
Con respecto al sitio anatómico de aparición del edema, en 18 de los individuos que refirieron síntomas, el edema en las extremidades y en el cuello o la cara fue la forma más frecuente de presentación (33,3 %), seguida del edema en las extremidades únicamente (27,7 %). El edema asociado con dolor abdominal fue reportado por 10 personas (55,6 %) y, el edema laríngeo, por seis individuos (33,3 %). El 72,2 % de los sujetos con antecedentes de angioedema mencionaron haber estado hospitalizados o haber recurrido al servicio de urgencias debido a la crisis de angioedema, por lo menos, una vez en los seis meses anteriores al estudio. Estos individuos refirieron que el trata-miento prescrito en el servicio de urgencias o durante la hospitalización, se centró en tratar el episodio como si se tratara de una crisis alérgica o un ataque anafiláctico.
Se identificaron diversos factores desencadenantes de los ataques edematosos. Los más frecuentes fueron las contusiones (72,2 %), los procedimientos dentales (55,5 %), así como el esfuerzo físico y la práctica de deportes (44,4 %). Otros factores asociados fueron la exposición al frío (27,7 %) y el estrés emocional (16,7 %). Es importante resaltar que algunos individuos asociaron la crisis de edema a picaduras de insectos (38,8 %) y a la ingestión de medicamentos (27,7 %) o alimentos (5,6 %), motivo por el cual los episodios de angioedema atendidos en los servicios médicos pudieron haberse confundido con casos de alergia.
En cuanto al tratamiento profiláctico de los ataques, solo cuatro sujetos respondieron haber estado recibiendo ácido acetilsalicílico, antihistamínicos o diclofenaco. El quinto era el caso índice, para quien se estaba considerando el inicio del tratamiento con ácido tranexámico en el momento del estudio.
Factor C4 del complemento, C1-INH funcional y C1-INH antigénico
En los sujetos sintomáticos, el valor promedio para el factor C4 del complemento y el C1-INH antigénico y funcional fue de 4,34 mg/dl (rango de 0,4 a 20,4 mg/dl), de 45,2 mg/l (rango de 1 a 198,9 mg/l) y de 18,2 % (rango de 0,7 a 93,4 %), respectivamente, mientras que, en los asintom á ticos, fue de 15 mg/dl (0,2 a 21,4 mg/dl), 158,3 mg/l (2 a 234,9 mg/l) y 57,8 % (1,08 a 109,2 %), respectivamente (figura 3).
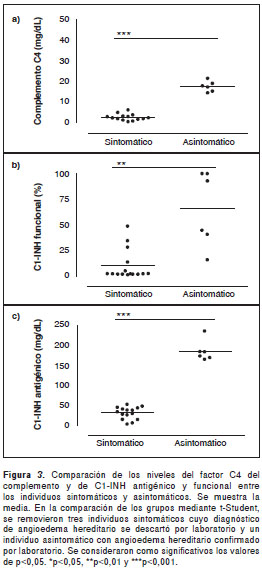
Un hallazgo interesante del estudio fue una mujer identificada en la genealogía como II5, quien presentó muy baja concentración en plasma del factor C4 del complemento (0,2 mg/dl) y de C1-INH antigénico (2,02 mg/l) y funcional (1,08 %), a pesar de que durante la entrevista señaló no haber presentado episodios de angioedema en los seis meses previos al estudio. Asimismo, se identificaron tres sujetos (III42 y su hijo IV65, y el niño III46) con valores normales de C4 (promedio de 14,1 mg/dl), de C1-INH antigénico (promedio de 176,1 mg/l) y funcional (promedio de 82,5 %), a pesar de que refirieron haber padecido síntomas de la enfermedad en los seis meses anteriores al estudio.
Calidad de vida relacionada con la salud
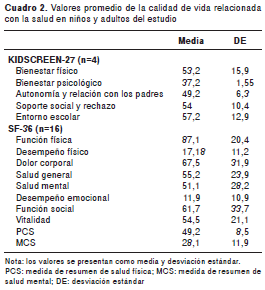
En el cuadro 2 se presentan los valores promedio de la calidad de vida relacionada con la salud en los niños (KIDSCREEN-27) y en los adultos (SF- 36) con angioedema hereditario. En los niños la puntuación más baja fue en el dominio de bienestar psicológico" (37,2±1,55), y la más alta se obtuvo en el dominio de entorno escolar" (57,2±12,9). En los adultos la puntuación más alta se observó en el dominio de función física" (87,1±20,4) y la más baja en el dominio de desempeño emocional" (11,9±10,9). Con respecto a los valores promedio en las medidas de resumen físico y mental en adultos, la puntuación más baja fue para el dominio de salud mental" (28,1±11,9).
Discusión
Este es el primer estudio que incluye la evaluación clínica y serológica de sujetos con angioedema hereditario de una misma familia en Colombia. El 82 % de los individuos que reportaron síntomas de la enfermedad, presentaron niveles disminuidos del C4 del complemento y de C1-INH antigénico y funcional, lo que se correlaciona con los marcadores de angioedema hereditario y permitió su clasificación plena como pacientes con angioedema hereditario de tipo I (15).
Se estima que la enfermedad afecta entre 1 en 10.000 y 1 en 150.000 individuos en todo el mundo, pero la poca frecuencia de la enfermedad dificulta la estimación exacta de la prevalencia (18). En los Estados Unidos la prevalencia estimada se encuentra entre 1 por 10.000 y 1 por 50.000 (19); en Noruega es de 1,75 por cada 10.000 habitantes (20), y en España se ha detectado una prevalencia mínima de 1,09 por 100.000 (21). Por otra parte, los reportes del Servicio de Inmunología y Alergia del Centro Médico Nacional del Noreste, centro de referencia en México, indican una incidencia de 1 por cada 2.400 pacientes que ingresan por primera vez a este centro (22). Lamentablemente, en Colombia no contamos con datos epidemiológicos de la enfermedad debido principalmente a que los médicos no saben reconocerla. Además, la falta de conocimiento sobre el angioedema hereditario se refleja en el retraso de un diagnóstico apropiado (hasta de 13 años en promedio según un estudio español) (21) y a la prolongación del manejo terapéutico inadecuado.
Generalmente, los episodios de angioedema se desencadenan debido a la ansiedad, los traumas físicos (8,23) , los procedimientos quirúrgicos y dentales (24), el permanecer de pie durante largo tiempo y, en algunos casos, por fluctuaciones hormonales (25,26). En este estudio, los princi- pales factores desencadenantes de edema, principalmente en las extremidades, el cuello y la cara, fueron las contusiones, los procedimientos dentales y el esfuerzo físico. La ansiedad y el estrés son factores que también provocan los ataques. La paciente II5, quien presentó bajos niveles plasmáticos de los marcadores séricos, refirió no haber sufrido ningún episodio edematoso en los seis meses previos al estudio, aunque su último episodio había ocurrido casi un año antes cuando se sometió a un procedimiento odontológico. Al indagar detalladamente sobre su estado emocional, indicó que los meses previos a la entrevista habían transcurrido sin mayores alteraciones de tipo emocional, social o familiar, lo que permitió confirmar que el estrés es un factor desencadenante de los episodios de angioedema.
La asfixia por la obstrucción de la vía área superior provocada por el edema laríngeo, puede llegar a causar la muerte en pacientes con angioedema hereditario (27) y se ha reportado una mortalidad de hasta 30 % en aquellos pacientes no diagnosticados (25). Aunque en la familia estudiada no se reportaban muertes por angioedema, seis de los participantes en el estudio indicaron haber padecido de edema laríngeo, por lo menos, una vez en su vida.
Es sabido que el angioedema tiene un gran impacto negativo en la calidad de vida relacionada con la salud de quienes lo padecen (28-30), lo que se evidencia principalmente en síntomas depresivos y de ansiedad, que también se manifiestan en los pacientes que tienen la forma hereditaria de la enfermedad (31). Los episodios depresivos se presentan debido a la persistencia de los síntomas edematosos recurrentes, producto de un diagnóstico inexacto y de tratamientos inefectivos y procedimientos médicos innecesarios. Con respecto a las crisis de ansiedad, estas se explican por la incertidumbre con respecto a la aparición de un nuevo ataque y al potencial riesgo de muerte que estas crisis conllevan (32-34). Cabe resaltar que la afectación mental de la enfermedad no solo se da en los individuos que sufren la enfermedad sino en toda la familia, incluidos sus integrantes sanos .
En este estudio se encontraron tres individuos que reportaron haber padecido síntomas de angioedema en los últimos seis meses, entre ellos, una madre y su hijo de siete años, que, sin embargo, no fueron diagnosticados con angioedema hereditario con base en los marcadores de laboratorio usados en este estudio. La discrepancia entre los antecedentes personales y las pruebas de laboratorio en estas personas, podría explicarse por el temor inconsciente a padecer la enfermedad asociado a lo que han presenciado en los demás integrantes de la familia. Es pertinente anotar que el antecedente familiar de angioedema recurrente afecta sicológicamente a los integrantes de la familia, pues los episodios ajenos a la enfermedad se catalogan inmediatamente como propios de esta. Sin embargo, para confirmar que los eventos de angioedema reportados por los participantes en el estudio no hayan sido desencadenados por factores no asociados con el angioedema hereditario , se requiere el estudio genético de las mutaciones en el gen SERPING1 .
Comparados con la población general, los pacien tes con angioedema hereditario que presentan síntomas como dolor, así como incapacidad causada por la enfermedad, sufren los efectos negativos tanto en su salud física como mental (30,34). Gomide, et al . (35), evaluaron el impacto de la calidad de vida relacionada con la salud en una población brasilera con angioedema hereditario mediante el cuestionario SF-36. En dicho estudio se reportó una puntuación significativamente baja en los dominios de vitalidad y entorno social", pero los autores expresaron que tales hallazgos debían interpretarse con precaución debido a que el SF-36 es un cuestionario genérico y los hallaz gos reportados pueden ser menos específicos según la enfermedad que se esté evaluando. Recientemente, Lumry, et al . (36), usando el mismo cuestionario en pacientes con angioedema hereditario en Estados Unidos, informaron que estos presentaban una disminución en su salud física y mental, comparados con la población general. Los resultados del presente estudio también permiten afirmar que ambos dominios se ven comprometidos de forma negativa.
Al comparar los resultados obtenidos con el instrumento SF-36 en este estudio con los de otros que también lo aplicaron pero en sujetos sanos o con enfermedades crónicas como lupus eritematoso sistémico (LES) (37), urticaria crónica (UC) (38) y asma (39), se detectó un mayor deterioro de la calidad de vida relacionada con la salud en los pacientes con angioedema hereditario (AEH) que en estas poblaciones en los dominios de desempeño emocional" (11,9: AEH; 90,4: sanos; 60,3: LES; 62,4: UC, y 75: asma) y de desempeño físico" (17,2: AEH; 87: sanos; 56,1: LES; 55,7: UC, y 71,9: asma). Esto implicaría limitaciones y dificultades en la ejecución de las labores diarias y en la interacción social (24).
En cuanto a los pacientes menores de 18 años, a quienes se evaluó con el instrumento KIDSCREEN- 27, los resultados del estudio también se compararon con los de otros que involucraron sujetos sanos (40), con asma (39), con secuelas de maltrato (41) o con problemas de salud mental (42). A diferencia de los adultos, en los menores de 18 años no se observaron diferencias entre los perfiles de estas distintas enfermedades. Probablemente dichos hallazgos evidencian el impacto global que el proceso de la enfermedad genera en la población infantil.
Uno de los principales resultados del estudio fue el diagnóstico de angioedema hereditario en otros miembros de esta familia, a partir del caso índice. Este es el primer reporte de la enfermedad en el Valle de Aburrá, Colombia. Cabe resaltar que los resultados no solamente satisfacen un interés académico, sino que, además, contribuyeron significativamente al bienestar de la familia afectada, ya que varios de sus integrantes desconocían la enfermedad responsable de sus recurrentes episodios de angioedema y dolores abdominales, y del conse cuente deterioro de la salud física y mental de toda la familia. En el marco del estudio se les brindó la información pertinente sobre la causa de la enfermedad, las medidas preventivas para disminuir los episodios edematosos y la ayuda para solicitar el tratamiento adecuado en la respectiva entidad prestadora de servicios de salud. El seguimiento de estos individuos y la evaluación de su reacción al tratamiento será objeto de futuros estudios.
El presente estudio presentó algunas limitaciones. La primera se refiere al uso de cuestionarios genéricos, lo cual pudo haber reducido la sen sibilidad de los resultados; sin embargo, cabe destacar que en Colombia no se cuenta con instrumentos específicos para evaluar la calidad de vida relacionada con la salud en los casos de angioedema hereditario que estén adaptados a las características culturales del país. Otra limitación fue el reducido número de sujetos analizados para medir la calidad de vida relacionada con la salud. No obstante, los resultados pueden ser válidos dada la poca información que actualmente se tiene sobre esta enfermedad en nuestro medio.
En conclusión, el impacto negativo de la enfermedad en la calidad de vida relacionada con la salud, así como en las actividades escolares, laborales, familiares y sociales, y el tiempo de atención en los servicios de urgencias y durante la hospitalización de los pacientes, justifican la necesidad de reconocer la enfermedad en el ámbito médico local y nacional y la búsqueda activa de casos mediante los marcadores séricos descritos en este trabajo. Es indispensable que se lleven a cabo estudios adicionales en Colombia para complementar los hallazgos de esta investigación .
Al Grupo de Alergología Clínica y Experimental, al Servicio de Alergología de la IPS Universitaria, y al Centro de Extensión de la Facultad de Medicina de la Universidad de Antioquia, así como a cada uno de los miembros de la familia que participó en el estudio.
Los autores no tienen conflicto de intereses.
Este estudio fue financiado con recursos propios del Grupo de Alergología Clínica y Experimental de la Universidad de Antioquia.
Correspondencia: María Dulfary Sánchez, Stanley S. Scott Cancer Center, Health Science Center, Louisiana Cancer Research Center (LCRC), Louisiana State University, 1700 Tulane Ave, 9th floor, Laboratory 945, New Orleans, LA 70112, USA Teléfono: +1 (504) 875 9653 mdsanchezp@gmail.com
1. Lang DM, Aberer W, Bernstein JA, Chng HH, Grumach AS, Hide M, et al . International consensus on hereditary and acquired angioedema. Ann Allergy Asthma Immunol. 2012;109:395-402. http://dx.doi.org/10.1016/j.anai.2012.10.008 [ Links ]
2. Ferraro MF, Moreno AS, Castelli EC, Donadi EA, Palma MS, Arcuri HA, et al . A single nucleotide deletion at the C1 inhibitor gene as the cause of hereditary angioedema: Insights from a Brazilian family. Allergy. 2011;66:1384-90. http://dx.doi.org/10.1111/j.1398-9995.2011.02658.x [ Links ]
3. Kaplan AP. Enzymatic pathways in the pathogenesis of hereditary angioedema: The role of C1 inhibitor therapy. J Allergy Clin Immunol. 2010;126:918-25. http://dx.doi.org/10.1016/j.jaci.2010.08.012 [ Links ]
4. Frazer-Abel A, Giclas PC. Update on laboratory tests for the diagnosis and differentiation of hereditary angioedema and acquired angioedema. Allergy and asthma proceedings. Allergy Asthma Proc. 2011;32(Suppl.1):S17-21. http://dx.doi.org/10.2500/aap.2011.32.3472 [ Links ]
5. Canonica GW, Rossi O. Diagnosis and treatment of hereditary angioedema. Panminerva Med. 2012;54:241-53. [ Links ]
6. Bork K. Hereditary angioedema with normal C1 inhibitor activity including hereditary angioedema with coagulation factor XII gene mutations. Immunol Allergy Clin North Am. 2006;26:709-24. http://dx.doi.org/10.1016/j.iac.2006.09.003 [ Links ]
7. Cocchio C, Marzella N. Cinryze, a human plasma- derived C1 esterase inhibitor for prophylaxis of hereditary angioedema. P T. 2009;34:293-328. [ Links ]
8. Velasco-Medina AA, Cortés-Morales G, Barreto-Sosa A, Velázquez-Samano G. Pathophysiology and advances in the treatment of hereditary angioedema. Rev Alerg Mex. 2011;58:112-9. [ Links ]
9. Pasto-Cardona L, Bordas-Orpinell J, Mercadal-Orfila G, Pérez-de la Vara A, Jodar-Massanes R. Prophylaxis and treatment of hereditary and acquired angioedema at HUB; use of the C1-esterase inhibitor. Farm Hosp. 2003;27:346-52. [ Links ]
10. Davis-Lorton M. An update on the diagnosis and management of hereditary angioedema with abnormal C1 inhibitor. J Drugs Dermatol. 2015;14:151-7. [ Links ]
11. Longhurst HJ, Carr S, Khair K. C1-inhibitor concentrate home therapy for hereditary angioedema: A viable, effective treatment option. Clin Exp Immunol. 2007;147:11-7. http://dx.doi.org/10.1111/j.1365-2249.2006.03256.x [ Links ]
12. Lumry WR. Overview of epidemiology, pathophysiology, and disease progression in hereditary angioedema. Am J Manag Care. 2013;19:s103-10. [ Links ]
13. Bygum A, Aygoren-Pursun E, Caballero T, Beusterien K, Gholizadeh S, Musingarimi P, et al . The hereditary angioedema burden of illness study in Europe (HAE-BOIS- Europe): Background and methodology. BMC Dermatol. 2012;12:4. http://dx.doi.org/10.1186/1471-5945-12-4 [ Links ]
14. Bewtra AK, Levy RJ, Jacobson KW, Wasserman RL, Machnig T, Craig TJ. C1-inhibitor therapy for hereditary angioedema attacks: Prospective patient assessments of health-related quality of life. Allergy Asthma Proc. 2012;33: 427-31. http://dx.doi.org/10.2500/aap.2012.33.3597 [ Links ]
15. Bowen T, Cicardi M, Farkas H, Bork K, Longhurst HJ, Zuraw B, et al . 2010 International consensus algorithm for the diagnosis, therapy and management of hereditary angioedema. Allergy Asthma Clin Immunol. 2010;6:24. http://dx.doi.org/10.1186/1710-1492-6-24 [ Links ]
16. Lugo LH, García HI, Gómez C. Confiabilidad del cuestionario de calidad de vida en salud SF-36 en Medellín, Colombia. Rev Fac Nac Salud Pública. 2006;24:37-50. [ Links ]
17. Quintero CA, Luo LH, García HI, Sánchez A. Validación del cuestionario KIDSCREEN-27 de calidad de vida relacionada con la salud en niños y adolescentes de Medellín, Colombia. Revista Colombiana de Psiquiatría. 2011;40:470-87. [ Links ]
18. Lunn ML, Santos CB, Craig TJ. Is there a need for clinical guidelines in the United States for the diagnosis of hereditary angioedema and the screening of family members of affected patients? Ann Allergy Asthma Immunol. 2010;104:211-4. http://dx.doi.org/10.1016/j.anai.2009.12.004 [ Links ]
19. Craig T, Riedl M, Dykewicz MS, Gower RG, Baker J, Edelman FJ, et al . When is prophylaxis for hereditary angioedema necessary? Ann Allergy Asthma Immunol. 2009;102:366-72. http://dx.doi.org/10.1016/S1081-1206(10)60506-6 [ Links ]
20. Stray-Pedersen A, Abrahamsen TG, Froland SS. Primary immunodeficiency diseases in Norway. J Clin Immunol. 2000;20:477-85. [ Links ]
21. Roche O, Blanch A, Caballero T, Sastre N, Callejo D, López-Trascasa M. Hereditary angioedema due to C1 inhibitor deficiency: Patient registry and approach to the prevalence in Spain. Ann Allergy Asthma Immunol. 2005;94:498-503. http://dx.doi.org/10.1016/S1081-1206(10)61121-0 [ Links ]
22. Becerra AL, Morales DV. Hereditary angioedema: A case series and bibliographic update. Rev Alerg Mex. 2009;56: 48- 55. [ Links ]
23. Bowen T, Cicardi M, Bork K, Zuraw B, Frank M, Ritchie B, et al . Hereditary angiodema: A current state-of-the- art review, VII Canadian Hungarian 2007 International Consensus Algorithm for the Diagnosis, Therapy, and Management of Hereditary Angioedema. Ann Allergy Asthma Immunol. 2008;100(Suppl.2):S30-40. [ Links ]
24. Fernández-Romero DS, Di Marco P, Malbrán A. Angioedema hereditario: historia familiar y manifestaciones clínicas en 58 pacientes. Medicina (B Aires). 2009;69:601-6. [ Links ]
25. Alonso M, Branco-Ferreira M, Spínola-Santos A, Pedro E, Palma-Carlos A. Caso clínico. Angioedema hereditario: formas infrecuentes de presentación. Alergol Inmunol Clin. 1999;14:228-31. [ Links ]
26. Agostoni A, Cicardi M. Hereditary and acquired C1- inhibitor deficiency: Biological and clinical characteristics in 235 patients. Medicine (Baltimore). 1992;71:206-15. [ Links ]
27. Bork K, Siedlecki K, Bosch S, Schopf RE, Kreuz W. Asphyxiation by laryngeal edema in patients with hereditary angioedema. Mayo Clin Proc. 2000;75:349-54. http://dx.doi.org/10.4065/75.4.349 [ Links ]
28. Banerji A. The burden of illness in patients with hereditary angioedema. Ann Allergy Asthma Immunol. 2013;111:329- 36. http://dx.doi.org/10.1016/j.anai.2013.08.019 [ Links ]
29. Bouillet L, Launay D, Fain O, Boccon-Gibod I, Laurent J, Martin L, et al . Hereditary angioedema with C1 inhibitor deficiency: Clinical presentation and quality of life of 193 French patients. Ann Allergy Asthma Immunol. 2013;111: 290-4. http://dx.doi.org/10.1016/j.anai.2013.07.012 [ Links ]
30. Nordenfelt P, Dawson S, Wahlgren CF, Lindfors A, Mallbris L, Bjorkander J. Quantifying the burden of disease and perceived health state in patients with hereditary angioedema in Sweden. Allergy Asthma Proc. 2014;35:185-90. http://dx.doi.org/10.2500/aap.2014.35.3738 [ Links ]
31. Fouche AS, Saunders EF, Craig T. Depression and anxiety in patients with hereditary angioedema. Ann Allergy Asthma Immunol. 2014;112:371-5. http://dx.doi.org/10.1016/j.anai.2013.05.028 [ Links ]
32. Caballero T, Aygoren-Pursun E, Bygum A, Beusterien K, Hautamaki E, Sisic Z, et al . The humanistic burden of hereditary angioedema: Results from the Burden of Illness Study in Europe. Allergy Asthma Proc. 2014;35:47-53. http://dx.doi.org/10.2500/aap.2013.34.3685 [ Links ]
33. Bernstein JA. HAE update: Epidemiology and burden of disease. Allergy Asthma Proc. 2013;34:3-6. http://dx.doi.org/10.2500/aap.2013.34.3623 [ Links ]
34. Lumry WR, Castaldo AJ, Vernon MK, Blaustein MB, Wilson DA, Horn PT. The humanistic burden of hereditary angioedema: Impact on health-related quality of life, productivity, and depression. Allergy Asthma Proc. 2010;31:407-14. http://dx.doi.org/10.2500/aap.2010.31.3394 [ Links ]
35. Gomide MA, Toledo E, Valle SO, Campos RA, Franca AT, Gómez NP, et al . Hereditary angioedema: Quality of life in Brazilian patients. Clinics (Sao Paulo). 2014;68:81-3. http://dx.doi.org/10.6061/clinics/2013(01)OA13 [ Links ]
36. Lumry WR, Miller DP, Newcomer S, Fitts D, Dayno J. Quality of life in patients with hereditary angioedema receiving therapy for routine prevention of attacks. Allergy Asthma Proc. 2014;35:371-6. http://dx.doi.org/10.2500/aap.2014.35.3783 [ Links ]
37. García-Carrasco M, Mendoza-Pinto C, Cardiel MH, Méndez-Martínez S, García-Villaseñor A, Jiménez- Hernández C, et al . Health related quality of life in Mexican women with systemic lupus erythematosus: A descriptive study using SF-36 and LupusQoL(C). Lupus. 2012;21:1219- 24. http://dx.doi.org/10.1177/0961203312456749 [ Links ]
38. Ue AP, Souza PK, Rotta O, Furlani W de J, Lima AR, Sabbag DS. Quality of life assessment in patients with chronic urticaria. An Bras Dermatol. 2011;86:897-904. http://dx.doi.org/10.1590/S0365-05962011000500006 [ Links ]
39. Yepes-Núñez JJ, Gómez-García C, Espinosa-Herrera Y, Cardona-Villa R. Health-related quality of life in children and adults with respiratory allergy in Colombia: Prospective study. Allergol Immunopathol (Madr). 2012;40:379-84. http://dx.doi.org/10.1016/j.aller.2011.11.008. [ Links ]
40. Ravens-Sieberer U, Auquier P, Erhart M, Gosch A, Rajmil L, Bruil J, et al . The KIDSCREEN-27 quality of life measure for children and adolescents: Psychometric results from a cross-cultural survey in 13 European countries. Qual Life Res. 2007;16:1347-56 . http://dx.doi.org/10.1007/s11136-007-9240-2 [ Links ]
41. Jud A, Landolt MA, Tatalias A, Lach LM, Lips U. Health-related quality of life in the aftermath of child maltreatment: Follow-up study of a hospital sample. Qual Life Res. 2013;22:1361-9. http://dx.doi.org /10.1007/s11136-012-0262-z [ Links ]
42. Dey M, Mohler-Kuo M, Landolt MA. Health-related quality of life among children with mental health problems: A population-based approach. Health Qual Life Outcomes. 2012;10:73. http://dx.doi.org/10.1186/1477-7525-10-73 [ Links ]













