Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Biomédica
versión impresa ISSN 0120-4157
Biomédica vol.35 no.4 Bogotá oct./dic. 2015
https://doi.org/10.7705/biomedica.v35i4.2572
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v35i4.2572
1 Grupo de Microbiología Molecular, Grupo de Microbiología Básica y Aplicada, Escuela de Microbiología, Universidad de Antioquia, Medellín, Colombia
2 Clínica CardioVid, Medellín, Colombia
Contribución de los autores:
Johanna M. Vanegas, Érika Rodríguez, Judy Natalia Jiménez, Astrid V. Cienfuegos y Gustavo Roncancio: diseño y experimentos
Todos los autores participaron en la recolección de datos, el análisis de la información y en la elaboración del manuscrito.
Recibido: 10/10/14; aceptado: 27/05/15
Introducción. Acinetobacter baumannii es una bacteria oportunista que infecta a pacientes gravemente enfermos, principalmente con neumonía asociada al uso del respirador y bacteriemia. La aparición de resistencia a los carbapenémicos limita las opciones terapéuticas para el manejo de las infecciones ocasionadas por esta bacteria.
Objetivo. Describir las características clínicas y moleculares de las infecciones ocasionadas por A. baumannii resistente a carbapenémicos en hospitales de Medellín.
Materiales y métodos. Durante dos años se llevó a cabo un estudio descriptivo de corte transversal en cinco hospitales de Medellín. La información clínica provenía de las historias clínicas. La presencia de carbapenemasas se evaluó mediante el test tridimensional y la técnica de reacción en cadena de la polimerasa. La tipificación molecular se hizo con electroforesis en gel de campo pulsado y tipificación de secuencias de múltiples locus.
Resultados. Se incluyeron 32 pacientes, 13 de los cuales presentaban infecciones de la piel y los tejidos blandos (n=7, 21,9 %), y osteomielitis (n=6, 18,7 %). Los porcentajes de resistencia fueron superiores a 80 % para todos los antibióticos evaluados, excepto para la colistina y la tigecilina. Las carbapenemasas OXA-23 y OXA-51, así como la secuencia de inserción IS Aba1 , se detectaron en todos los aislamientos. La electroforesis en gel de campo pulsado reveló una gran diversidad genética en los aislamientos, y la tipificación de secuencias de múltiples locus evidenció la circulación de los clones ST229 y ST758 en la ciudad.
Conclusión. Contrario a lo reportado previamente, los resultados del estudio revelaron que la osteomielitis y las infecciones de la piel y los tejidos blandos eran los principales cuadros clínicos causados por A. baumannii resistente a carbapenémicos en instituciones de Medellín, y resaltan su importancia como agente etiológico de este tipo de infecciones.
Palabras clave: Acinetobacter baumannii, carbapenémicos, farmacorresistencia microbiana, infecciones de los tejidos blandos, osteomielitis.
doi: http://dx.doi.org/10.7705/biomedica.v35i4.2572
Carbapenem-resistant Acinetobacter baumannii causing osteomyelitis and infections of skin and soft tissues in hospitals of Medellín, Colombia
Introduction: Acinetobacter baumannii is an opportunistic bacterium which infects seriously ill patients, particularly those with ventilator-associated pneumonia and bacteremia. The emergence of resistance to carbapenem limits the options for the treatment of infections caused by this bacterium.
Objective: To describe the clinical and molecular characteristics of infections caused by carbapenem-resistant A. baumannii in Medellín hospitals.
Materials and methods: A cross-sectional descriptive study was carried out in five Medellín hospitals over a 2-year period. Clinical information was obtained from medical histories of patients. The presence of carbapenemases was evaluated by three-dimensional test and PCR. Molecular typing was performed using PFGE and MLST.
Results: The study included 32 patients, 13 of whom presented skin and soft tissue infections (n=7, 21.9%) or osteomyelitis (n=6, 18.7%). Resistance rates of the isolates exceeded 80% for all the antibiotics evaluated except colistin and tigecycline. Carbapenemases OXA-23 and OXA-51, as well as the insertion sequence IS Aba1 , were detected in all the isolates. PFGE revealed high genetic diversity in the isolates and MLST showed clones ST229 and ST758 are circulating in the city.
Conclusion: In contrast to previous reports, the results of the present study showed osteomyelitis and infections of skin and soft tissues to be the main infections caused by carbapenem-resistant A. baumannii in Medellín hospitals and revealed its importance as an etiological agent for this type of infections.
Key words: Acinetobacter baumannii , carbapenems, drug resistance, microbial; soft tissue infections, osteomyelitis.
doi: http://dx.doi.org/10.7705/biomedica.v35i4.2572
Acinetobacter baumannii es un patógeno cada vez más frecuente en los hospitales como causa de infecciones de las vías urinarias y del abdomen, y más comúnmente de neumonía y bacteriemia (1). Su presencia en las unidades de cuidados intensivos reviste especial gravedad, pues afecta pacientes con varias enfermedades concomitantes, inmunocomprometidos o sometidos a procedimientos invasivos, lo que origina altos porcentajes de mortalidad (1).
El manejo de las infecciones causadas por A. baumannii es complejo debido a que presentan diversos mecanismos de resistencia intrínsecos y adquiridos, como son la producción de betalactamasas, la poca permeabilidad y las bombas de expulsión (2,3).
Los carbapenémicos han sido el tratamiento de elección para las infecciones ocasionadas por A. baumannii multirresistente; sin embargo, la bacteria ha desarrollado resistencia a dichos antibióticos, lo que complica aún más el tratamiento de las infecciones que ocasiona (4). La resistencia de A. baumannii a los carbapenémicos está mediada principalmente por enzimas que degradan el antibiótico llamadas carbapenemasas, específicamente las carbapenemasas de clase D u oxacilinasas, como OXA-23, OXA-24, OXA-51 y OXA-58, algunas de las cuales están asociadas con elementos de inserción, como el IS Aba1, que actúan como promotores de la transcripción (5).
La aparición de resistencia a los carbapenémicos reduce las opciones terapéuticas. Además, la utilización de tratamientos empíricos inapropiados ejerce una presión selectiva que favorece la eliminación de las bacterias sensibles y el crecimiento y la diseminación de las resistentes, lo que resulta en períodos de hospitalización prolongados, tasas de mortalidad altas y mayores costos en la atención hospitalaria (6,7).
En Colombia, han venido aumentando de forma significativa los niveles de resistencia de A. baumannii a los carbapenémicos desde 2009, hasta alcanzar 37,1 % de resistencia a imipenem y 98,8 % a meropenem en aislamientos provenientes de unidades de cuidados intensivos en 2012 (8). En Medellín, también se observó un aumento de 28 a 35 % en la resistencia a meropenem y de 27 a 34 % a imipenem entre 2010 y 2012 (9). Así mismo, se ha reportado la circulación en el país del gen bla OXA-23, relacionado con una resistencia elevada de A. baumannii a los carbapenémicos (10).
A pesar de los altos porcentajes de resistencia a carbapenémicos en A. baumannii , todavía se sabe poco sobre el comportamiento de las infecciones ocasionadas por este microorganismo. Además, si se considera que la epidemiología de estas infecciones varía dependiendo de la región geográfica, e incluso de las instituciones, en este trabajo se propuso describir las características clínicas y moleculares de las infecciones ocasionadas por A. baumannii resistente a carbapenémicos en cinco hospitales de alto nivel de complejidad de Medellín, Colombia.
Materiales y métodos
Población de estudio
Se hizo un estudio descriptivo de corte transversal en cinco hospitales de alto nivel de complejidad de Medellín, entre junio de 2012 y junio de 2014. Los hospitales A y B son hospitales universitarios de 662 y 700 camas, respectivamente. Los hospitales C y D son hospitales de un tamaño menor, con 286 y 300 camas, respectivamente, y el hospital E es un hospital especializado en cardiología con 140 camas.
En cada una de las instituciones participantes se incluyeron todos los pacientes con diagnóstico de infección por A. baumannii con resistencia
intermedia o total a carbapenémicos según los puntos de corte establecidos por el Clinical and Laboratory Standards Institute (CLSI), 2012, durante el periodo de estudio (11). Las pruebas fenotípicas y moleculares se hicieron en el primer aislamiento recuperado de cada paciente durante la hospitalización.
Información clínica y epidemiológica
La información clínica y epidemiológica se obtuvo a partir de la revisión de la historia clínica de cada paciente, utilizando un formulario diseñado para tal fin. Las variables incluían las características sociodemográficas, el uso previo de antibióticos, la estancia en unidades de cuidados intensivos en el momento del aislamiento causante de la infección, el tipo de infección, las enfermedades concomitantes y la condición final de los pacientes. Las infecciones se clasificaron como adquiridas en la comunidad o asociadas a la atención en salud, de acuerdo con las definiciones establecidas por los Centers for Disease Control and Prevention (CDC) (12).
Identificación y pruebas de sensibilidad
La identificación y las pruebas de sensibilidad se hicieron utilizando el sistema automatizado VITEK-2 (BioMérieux, Marcy l´Etoile, France). Los antibióticos evaluados fueron ampicilina-sulbactam, piperacilina-tazobactam, ceftazidima, cefotaxime, cefepime, imipenem, meropenem, gentamicina, amikacina, ciprofloxacina, tigeciclina y colistina. La interpretación de la sensibilidad se ajustó a los puntos de corte establecidos por el CLSI, 2012 (11), excepto la de la tigeciclina, para la cual se tomaron los puntos de corte establecidos por la U.S. Food and Drug Administration (FDA) (13).
Detección fenotípica y molecular de las carbapenemasas
La detección fenotípica de las carbapenemasas se hizo utilizando una variación del test tridimensional (14), en tanto que la detección molecular se hizo mediante la amplificación por reacción en cadena de la polimerasa (PCR) de los genes bla KPC, bla VIM, bla IMP, bla NDM, bla OXA-48, bla OXA-51, bla OXA-23, bla OXA-24 y bla OXA- 58, con base en protocolos previamente descritos (15-17). Además, se detectó la secuencia de inserción IS Aba-1 y su presencia "corriente arriba" de los genes bla OXA-51 y bla OXA-23 (18). La amplificación del gen bla OXA-51 se empleó como marcador de especie (17) .
Electroforesis en gel de campo pulsado
Para la electroforesis en gel de campo pulsado ( Pulsed-field Gel Electrophoresis , PFGE), se utilizó la enzima Apa I (Thermo Scientific, United States) durante un tiempo de restricción de dos horas a una temperatura de 37 °C. Los patrones electroforéticos se normalizaron utilizando el marcador lambda (New England Biolabs, UK). Para la separación electroforética, se utilizó el sistema Chef-DR III (Bio-Rad Laboratories, Hercules, CA), bajo las siguientes condiciones: temperatura, 11,3 °C; pulso inicial, 1 segundo; pulso final, 50 segundos; tiempo de corrida, 21 horas; ángulo, 120°, y 6 v/cm de gradiente de voltaje. El grado de relación de los aislamientos se analizó mediante el programa BioNumerics, versión 3.0 (Applied Maths), usando el coeficiente de similitud de Dice. Se consideró un punto de corte mayor o igual a 80 % para determinar los aislamientos genéticamente relacionados. Los dendrogramas se generaron usando el logaritmo del Unweighted Pairs Geometric-Matched Analysis (UPGMA), con 1 % de tolerancia y 0,5 % de optimización.
Tipificación de secuencias de múltiples locus
La tipificación de secuencias de múltiples locus ( Multilocus Sequence Typing , MLST) se hizo en siete aislamientos seleccionados; se tuvo en cuenta el número de muestras aportadas por cada institución y se incluyó, al menos, un aislamiento por hospital de acuerdo con el protocolo descrito por Bartual, et al . (19). Los tipos de alelos y los tipos de secuencias se asignaron de acuerdo con la base de datos de http://pubmlst.org/abaumannii/.
Análisis estadístico
Para el análisis de la información, se utilizaron frecuencias absolutas y relativas utilizando el programa SPSS ®, versión 20.0 (SPSS Inc., Chicago, USA).
Consideraciones éticas
El protocolo de estudio fue avalado por el comité de ética e investigación de cada hospital participante y por el Comité de Bioética de la Universidad de Antioquia (CBE-SIU) (aprobación N o 11-35-415).
Resultados
Características clínicas y epidemiológicas
En el periodo de estudio se registraron 32 pacientes con infección por A. baumannii resistente a carbapenémicos, la mayoría de los cuales provenía de los hospitales A (44 %, n=14) y C (28 %, n=9), seguidos de los hospitales B (16 %, n=5), D (9 %, n=3) y E (3 %, n=1). Todos los pacientes eran adultos, la mitad de ellos mayor de 55 años y, en su mayoría, hombres. Los antecedentes clínicos más frecuentes fueron la hospitalización previa, la cirugía y el uso de antibióticos en los últimos seis meses. El uso de antibióticos se registró en 78,1 % (n=25) de los pacientes; los más utilizados fueron piperacilina-tazobactam y los carbapenémicos (48 %, n=12 cada uno). Los tipos de infección más frecuentes fueron las infecciones de la piel y los tejidos blandos (21,9 %, n=7), la osteomielitis (18,8 %, n=6) y la infección abdominal (18,8 %, n=6). Más de la mitad de los pacientes se encontraban hospitalizados en salas diferentes a la unidad de cuidados intensivos en el momento de la toma de la muestra. La mortalidad por cualquier causa fue de 28,1 % (cuadro 1).

Porcentajes de resistencia y detección de carbapenemasas
Los aislamientos de A. baumannii resistente a carbapenémicos presentaron porcentajes de resistencia superiores a 80 % para todos los betalactámicos evaluados (incluidos ampicilina-sulbactam, piperacilina-tazobactam, ceftazidima y cefepime) y para otros antibióticos, como ciproflo-xacina y gentamicina. En contraste, la resistencia a la tigeciclina y la colistina fue de 3,4 y 3,2 %, respectivamente. El porcentaje de resistencia a meropenen e imipenem fue de 100 % (figura 1).
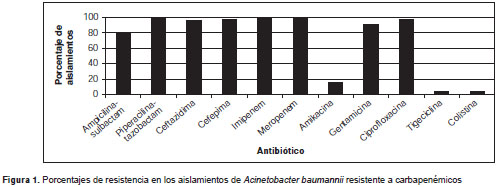
El test tridimensional fue positivo en 24 aislamientos (75 %) y negativo en ocho (25 %). Sin embargo, los genes bla OXA-51, bla OXA-23 e IS Aba 1 se detectaron en todas las cepas, independientemente del resultado del test tridimensional. La amplificación de la secuencia de inserción IS Aba 1 , se detectó "corriente arriba" de los genes bla OXA-23 y bla OXA-51 en 62,5 % (n=20) y 3,1 % (n=1) de los casos, respectivamente. La presencia simultánea de esta secuencia "corriente arriba" de ambos genes se encontró en 31,2 % (n=10) de los aislamientos.
Tipificación molecular
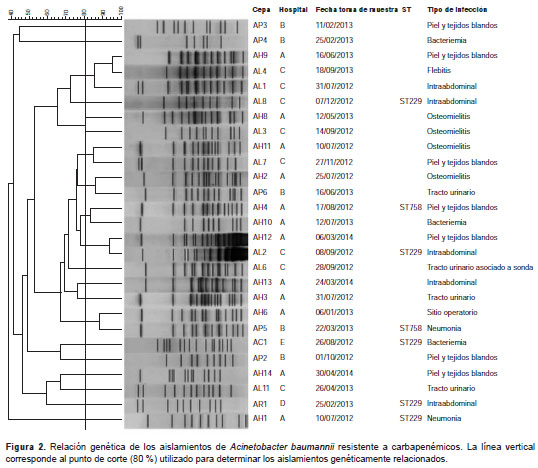
La PFGE reveló una gran diversidad genética en los aislamientos evaluados, con porcentajes de similitud inferiores a 80 % para la mayoría de ellos (figura 2). Por su parte, con la MLST se evidenció la presencia del clon ST229 en los hospitales A, C, D y E, y del clon ST758, en los hospitales A y B (figura 2).
Discusión
A pesar de que A. baumannii es un patógeno que con frecuencia causa infecciones como la neumonía asociada al respirador y la bacteriemia (1), los resultados de este estudio evidenciaron la presencia de A. baumannii resistente a carbapenémicos en infecciones de la piel y de los tejidos blandos y en la osteomielitis. En las infecciones de la piel el papel de A. baumannii ha generado controversia debido a que la colonización de este órgano por parte del microorganismo es frecuente.
Sin embargo, algunos autores han reportado cuatro características comunes en los pacientes con este cuadro clínico:
1) condiciones subyacentes como diabetes y trauma;
2) infección acompañada de bacteriemia;
3) multirresistencia e infección con varios microorganismos en la mayoría de los casos, y
4) necesidad de tratamiento quirúrgico, y aumento de la mortalidad (20).
En este estudio, la mayoría de estas características se evidenciaron en los pacientes con infecciones de la piel y los tejidos blandos, lo que sugiere la presencia de A. baumannii resistente a carbapenémicos como agente causal de este tipo de infección (cuadro 2).
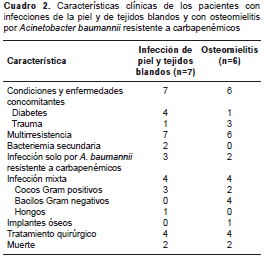
La osteomielitis fue otra infección frecuente en la población de estudio y, aunque esta usualmente se atribuye a bacterias Gram positivas, en un estudio reciente se reportó un aumento de casos ocasionados por bacilos Gram negativos, entre los cuales A. baumannii fue la segunda bacteria más frecuentemente detectada después de Enterobacter spp. en este tipo de infección (21). Además, tres de los seis pacientes con osteomielitis habían sufrido trauma, característica que se ha descrito en las infecciones por bacilos Gram negativos, y en dos de ellos A. baumannii fue el único agente causal encontrado (cuadro 2).
Los resultados del presente estudio difieren de lo reportado por otros grupos en el país. En primer lugar, llamó la atención que en Medellín A. baumannii tuviera menor incidencia como causa de infección que otros bacilos Gram negativos. La recopilación del grupo GERMEN reportó 253 aislamientos de esta bacteria en 26 instituciones hospitalarias y laboratorios de la ciudad en el 2013, lo que ni siquiera la sitúa entre los diez principales microorganismos encontrados en hospitales o unidades de cuidados intensivos (22). La situación reportada por el Instituto Nacional de Salud en 2013 revela un panorama diferente, pues sitúa a A. baumannii como el noveno micro-organismo más frecuente en las unidades de cuidados intensivos en Colombia, en tanto que en su boletín de 2013, el grupo GREBO ubicó al microorganismo como el décimo más frecuente en las unidades de cuidados intensivos, el sexto más detectado en muestras de sangre en dichas unidades y el séptimo asociado a la bacteriemia durante la hospitalización (23,24).
También, cabe destacar las diferencias en torno a la frecuencia con que el microorganismo se asocia a infecciones. En el presente estudio se relacionó más con infecciones de la piel, los tejidos blandos y el hueso, mientras que en otros estudios llevados a cabo en el país, A. baumannii se ha registrado con mayor frecuencia como agente causal de neumonía y bacteriemia (25,26).
En este trabajo, las infecciones por A. baumannii resistente a carbapenémicos presentaron un comportamiento similar a lo descrito en los estudios de epidemiología a nivel mundial, en lo que se refiere al predominio de esta bacteria en pacientes con enfermedades concomitantes, antecedentes de hospitalización y uso previo de antibióticos (1,27), específicamente de carbapenémicos en casi la mitad de los pacientes. Teniendo en cuenta que esta característica se considera un factor de riesgo independiente para la infección por A. baumannii resistente a carbapenémicos (OR, 6,1; IC 95% : 2,2 - 17,1; p=0,001), es necesario establecer políticas sobre el uso de antibióticos para controlar la aparición de cepas resistentes (28).
Aunque la hospitalización en la unidad de cuidados intensivos también es frecuente en los pacientes con A. baumannii resistente a carbapenémicos (27,29), en este estudio más de la mitad de los pacientes se encontraba hospitalizada en otras salas, lo que evidencia la importancia de fortalecer la vigilancia de las infecciones ocasionadas por esta bacteria en servicios diferentes a la unidad de cuidados intensivos.
Todas las infecciones fueron ocasionadas por aislamientos con porcentajes elevados de resistencia a la mayoría de los antibióticos disponibles, lo que limita sustancialmente las opciones terapéuticas y hace necesario emplear tratamientos combinados que puedan tener un efecto sinérgico para el control de la infección que, sin embargo, no siempre tienen éxito.
La carbapenemasa OXA-23 se detectó en todos los aislamientos recuperados, incluso en aquellos provenientes de infecciones de la piel y los tejidos blandos y de la osteomielitis. Esta enzima puede aparecer codificada en plásmidos fácilmente trasmisibles de una bacteria a otra y está implicada en diferentes brotes hospitalarios en todo el mundo (30). En Suramérica, la OXA-23 se ha reportado en países como Brasil y Argentina, y en Colombia, se la considera como el mecanismo más importante de resistencia a carbapenémicos en A. baumannii (10,31). La presencia simultánea de la secuencia de inserción IS Aba1 como promotor de la transcripción de la OXA-23 y de la carbapenemasa cromosómica OXA-51, no se había observado antes en el país y refleja la versatilidad y la gran capacidad de diseminación de estos elementos genéticos, tal como se ha registrado en bacterias de la familia Enterobacteriaceae (10,32,33).
La gran diversidad genética evidenciada por la PFGE contrasta con lo reportado en estudios previos llevados a cabo en Colombia, en los cuales se han observado conglomerados o grupos predominantes mediante esta técnica (10,33). Dicha diversidad puede explicarse por la presión antibiótica ejercida con el uso de diferentes esquemas de tratamiento anti-microbiano cuya consecuencia es la aparición de cepas resistentes más que la diseminación clonal. De ahí la importancia de establecer y fortalecer las políticas relativas al uso adecuado de los antibióticos, como estrategia para prevenir la aparición y la diseminación de A. baumannii resistente a carbapenémicos en las instituciones de salud.
Independientemente del tipo de infección, los resultados de la MLST evidenciaron la circulación de dos clones en la ciudad: ST229 y ST758. El primero de ellos corresponde al complejo clonal CC110, clon internacional detectado en Estados Unidos, Argentina y Corea que puede portar resistencia inclusive a la colistina (27,34). El clon ST758 se reportó en México en aislamientos de A. baumannii portadores de una variante de la OXA-23 llamada OXA-239 (35). En este estudio se hace uno de los primeros reportes de los clones de A. baumannii resistente a carbapenémicos circulantes en las ciudades del país.
Una de las principales limitaciones de este trabajo es su carácter descriptivo, ya que no hubo un grupo de comparación y solo se utilizó el VITEK-2 para evaluar la sensibilidad a antibióticos como la tigeciclina y la combinación de ampicilina- sulbactam.
En conclusión, es importante considerar A. baumannii resistente a carbapenémicos como agente etiológico de infecciones de la piel y los tejidos blandos y de la osteomielitis en hospitales. Es claro que en algunas ocasiones este microorganismo puede ser un contaminante; sin embargo, dada la dificultad del tratamiento y la facilidad con que se disemina, el personal de laboratorio y los profesionales clínicos deben prestar especial atención al hallazgo de este patrón fenotípico y orientar sus esfuerzos hacia el diagnóstico clínico adecuado, el tratamiento óptimo y las medidas de prevención de brotes, especialmente en lo relacionado con el uso de antibióticos. Por otra parte, las carbapenemasas OXA-23 y OXA-51 y la secuencia de inserción IS Aba 1 aparecen como los mecanismos que están mediando la resistencia a carbapenémicos en los aislamientos de A. baumannii en el país.
Gustavo Roncancio ha sido conferencista de MSD y Pfizer. Los demás autores no declaran conflicto de intereses.
Este trabajo fue financiado por el Departamento Administrativo de Ciencia, Tecnología e Innovación, Colciencias (proyecto 111554531404), y por el Comité para el Desarrollo de la Investigación, CODI, de la Universidad de Antioquia (proyecto CIMB-068-12).
Correspondencia:
Judy Natalia Jiménez, Escuela de Microbiología, Universidad de Antioquia, Calle 67 N° 53-108, bloque 5, oficina 5-135, Medellín, Colombia
Teléfono: (574) 219 5497
nataliajiudea@gmail.com
1. Torres HA, Vázquez EG, Yagüe G, Gómez JG. Multidrug resistant Acinetobacter baumanii : Clinical update and new highlights. Rev Esp Quimioter. 2010;23:12-9. [ Links ]
2. Coyne S, Courvalin P, Périchon B. Efflux-mediated antibiotic resistance in Acinetobacter spp. Antimicrob Agents Chemother. 2011;55:947-53. http://dx.doi.org/10.1128/AAC. 01388-10 [ Links ]
3. Gordon NC, Wareham DW. Multidrug-resistant Acinetobacter baumannii: Mechanisms of virulence and resistance. Int J Antimicrob Agents. 2010;35:219-26. http://dx.doi.org/10.1016/j.ijantimicag.2009.10.024 [ Links ]
4. Boucher HW, Talbot GH, Bradley JS, Eduards JE, Gilbert D, Rice LB, et al . Bad bugs, no drugs: No ESKAPE! An update from the Infectious Diseases Society of America. Clin Infect Dis. 2009;48:1-12. http://dx.doi.org/10.1086/595011 [ Links ]
5. Niranjan DK, Singh NP, Manchanda V, Rai S, Kaur IR. Multiple carbapenem hydrolyzing genes in clinical isolates of Acinetobacter baumannii. Indian J Med Microbiol. 2013;31:237-41. http://dx.doi.org/10.4103/0255-0857.115626. [ Links ]
6. Patel G, Huprikar S, Factor SH, Jenkins SG, Calfee DP. Outcomes of carbapenem-resistant Klebsiella pneumoniae infection and the impact of antimicrobial and adjunctive therapies. Infect Control Hosp Epidemiol. 2008;29:1099-106. http://dx.doi.org/10.1086/592412. [ Links ]
7. Woodford N, Turton JF, Livermore DM. Multiresistant Gram-negative bacteria: The role of high-risk clones in the dissemination of antibiotic resistance. FEMS Microbiol Rev. 2011;35:736-5. http://dx.doi.org/10.1111/j.1574-6976.2011.00268.x [ Links ]
8. Hernández C, Blanco V, Motoa G, Correa A, Maya JJ, de la Cadena E, et al . Evolución de la resistencia antimicrobiana de bacilos Gram negativos en unidades de cuidados intensivos en Colombia. Biomédica. 2014;34:91-100. http://dx.doi.org/10.1590/S0120-41572014000500011 [ Links ]
9. Grupo para el Estudio de la Resistencia a Antibióticos de Medellín. Acinetobacter baumannii . Fecha de consulta: 6 de octubre de 2014. Disponible en: http://www.grupogermen.org/pdf/Acinetoacter.pdf. [ Links ]
10. Villegas MV, Kattan JN, Correa A, Lolans K, Guzmán AM, Woodford N, et al . Dissemination of Acinetobacter baumannii clones with OXA-23 carbapenemase in Colombian hospitals. Antimicrob Agents Chemother. 2007;51:2001-4. http://dx.doi.org/10.1128/AAC.00226-07 [ Links ]
11. Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing: Twenty-second Informational Supplement. CLSI document M100-S22. Wayne: Clinical and Laboratory Standards Institute; 2012. [ Links ]
12. Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care-associated infection and criteria for specific types of infections in the acute care setting. Am J Infect Control. 2008;36:309-32. http://dx.doi.org/10.1016/j.ajic.2008.03.002 [ Links ]
13. Esparza G, Ariza B, Bedoya AM, Bustos I, Castañeda CR, De la Cadena E, et al . Estrategias para la implementación y reporte de los puntos de corte CLSI vigentes y pruebas fenotípicas confirmatorias para BLEE y carbapenemasas en bacilos Gram negativos en laboratorios clínicos de Colombia. Infectio. 2013;17:80-9. [ Links ]
14. Thomson KS, Mejglo ZA, Pearce GN, Regan TJ. 3-dimensional susceptibility testing of beta-lactam antibiotics. J Antimicrob Chemother. 1984;13:45-54. http://dx.doi.org/10.1093/jac/13.1.45 [ Links ]
15. Ellington MJ, Kistler J, Livermore DM, Woodford N. Multiplex PCR for rapid detection of genes encoding acquired metallo-beta-lactamases. J Antimicrob Chemother. 2007;59:321-2. http://dx.doi.org/10.1093/jac/dkl48 [ Links ]
16. Poirel L, Walsh TR, Cuvillier V, Nordmann P. Multiplex PCR for detection of acquired carbapenemase genes. Diagn Microbiol Infect Dis. 2011;70:119-23. http://dx.doi.org/10.1016/j.diagmicrobio.2010.12.002 [ Links ]
17. Woodford N, Ellington MJ, Coelho JM, Turton JF, Ward ME, Brown S, et al . Multiplex PCR for genes encoding prevalent OXA carbapenemases in Acinetobacter spp. Int J Antimicrob Agents. 2006;27:351-3. http://dx.doi.org/10.1016/j.ijantimicag.2006.01.004 [ Links ]
18. Turton JF, Ward ME, Woodford N, Kaufmann ME, Pike R, Livermore DM, et al . The role of IS Aba1 in expression of OXA carbapenemase genes in Acinetobacter baumannii. FEMS Microbiol Lett. 2006;258:72-7. http://dx.doi.org/10.1111/j.1574-6968.2006.00195.x [ Links ]
19. Bartual SG, Seifert H, Hippler C, Luzon MA, Wisplinghoff H, Rodríguez-Valera F. Development of a multilocus sequence typing scheme for characterization of clinical isolates of Acinetobacter baumannii. J Clin Microbiol. 2005;43:4382-90. http://dx.doi.org/10.1128/JCM.43.9.4382-4390.2005 [ Links ]
20. Guerrero DM, Pérez F, Conger NG, Solomkin JS, Adams MD, Rather PN, et al . Acinetobacter baumannii -associated skin and soft tissue infections: Recognizing a broadening spectrum of disease. Surg Infect (Larchmt). 2010;11:49-57. http://dx.doi.org/10.1089/sur.2009.022 [ Links ]
21. Carvalho VC, Oliveira PR, Dal-Paz K, Paula AP, Felix C da S, Lima AL. Gram-negative osteomyelitis: Clinical and microbiological profile. Braz J Infect Dis. 2012;16:63-7. http://dx.doi.org/10.1590/S1413-86702012000100011 [ Links ]
22. Grupo para el Estudio de la Resistencia a Antibióticos de Medellín. Frecuencias de microorganismos. Fecha de consulta: 23 de marzo de 2015. Disponible en: http://www.grupogermen.org/pdf/frecuencia.pdf [ Links ]
23. Grupo GREBO. Mayo 5, Día mundial de lavado de manos dedicado a la contención de la resistencia bacteriana. Boletín Informativo GREBO. 2014;6. Fecha de consulta: 23 de marzo de 2015. Disponible en: http://www.grebo.org/grebo_site/jgrebo/documentos/Boletin_Grebo_2014.pdf. [ Links ]
24. Instituto Nacional de Salud. Vigilancia de resistencia bacteriana a través de las bases de datos Whonet, agosto 2014. Fecha de consulta: 23 de marzo de 2015. Disponible en: http://www.ins.gov.co/tramites-y-servicios/examenes-de-inter%C3%A9s-en-salud-publica/Microbiologa/Informe%20de%20resistencia%20Bacteriana%20a%C3%B1o%20%202013.pdf. [ Links ]
25. Lemos EV, De la Hoz-Restrepo F, Alvis N, Quevedo E, Cañón O, León Y. Acinetobacter baumannii - related mortality in intensive care units in Colombia. Rev Panam Salud Pública. 2011;30:287-94. http://dx.doi.org/10.1590/S1020-49892011001000001 [ Links ]
26. Prado A, Arias NL, Chávez M, Cabrera CE, Gómez RF. Caracterización fenotípica de aislamientos de Acinetobacter baumannii en una institución de alta complejidad de la ciudad de Cali. Biomédica. 2014;34:101-7. http://dx.doi.org/10.7705/biomedica.v34i0.1666 [ Links ]
27. Karah N, Sundsfjord A, Towner K, Samuelsen Ø. Insights into the global molecular epidemiology of carbapenem non-susceptible clones of Acinetobacter baumannii . Drug Resist Updat. 2012;15:237-47. http://dx.doi.org/10.1016/j.drup.2012.06.001 [ Links ]
28. Aydemir H, Celebi G, Piskin N, Oztoprak N, Keskin AS, Aktas E, et al . Mortality attributable to carbapenem-resistant nosocomial Acinetobacter baumannii infections in a Turkish university hospital. Jpn J Infect Dis. 2012;65: 66-71. [ Links ]
29. Alavi-Moghadam M, Miri M, Mokhtari M, Kouchek M, Goharani R, Sistanzad M, et al . Incidence of imipenem-resistant Acinetobacter baumannii in a general intensive care unit (ICU). Caspian J Intern Med. 2014;5:186-7. [ Links ]
30. Mosqueda N, Espinal P, Cosgaya C, Viota S, Plasensia V, Álvarez-Lerma F, et al . Globally expanding carbapenemase finally appears in Spain: Nosocomial outbreak of Acinetobacter baumannii producing plasmid-encoded OXA-23 in Barcelona, Spain. Antimicrob Agents Chemother. 2013;57:5155-7. http://dx.doi.org/10.1128/AAC.01486-13 [ Links ]
31. Opazo A, Domínguez M, Bello H, Amyes SG, González-Rocha G. OXA-type carbapenemases in Acinetobacter baumannii in South America. J Infect Dev Ctries. 2012;6: 311-6. http://dx.doi.org/10.3855/jidc.2310 [ Links ]
32. Leski TA, Bangura U, Jimmy DH, Ansumana R, Lizewski SE, Li RW, et al . Identification of bla OXA-51-like, bla OXA-58, bla DIM-1, and bla VIM carbapenemase genes in hospital Enterobacteriaceae isolates from Sierra Leone. J Clin Microbiol. 2013;51:2435-8. http://dx.doi.org/10.1128/JCM.00832-13 [ Links ]
33. Martínez P, Mattar S. Imipenem-resistant Acinetobacter baumannii carrying the IS Aba1 - bla OXA-23,51 and IS Aba1 - bla ADC-7 genes in Monteria, Colombia. Braz J Microbiol. 2012;43:1274-80. http://dx.doi.org/10.1590/S1517-83822012000400006 [ Links ]
34. Hong SB, Shin KS, Ha J, Han K. Co-existence of bla OXA-23 and arm A in multidrug-resistant Acinetobacter baumannii isolated from a hospital in South Korea. J Med Microbiol. 2013;62:836-44. http://dx.doi.org/10.1099/jmm.0.055384-0 [ Links ]
35. Tamayo-Legorreta EM, Garza-Ramos U, Barrios-Camacho H, Sánchez-Pérez A, Galicia-Paredes A, Meza-Chávez A, et al . Identification of OXA-23 carbapenemases: Novel variant OXA-239 in Acinetobacter baumannii ST758 clinical isolates in México. New Microbes New Infect. 2014;2;173-4. http://dx.doi.org/10.1002/nmi2.60 [ Links ]













