Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.36 no.1 Bogotá Jan./Mar. 2016
https://doi.org/10.7705/biomedica.v36i1.2617
doi: http://dx.doi.org/10.7705/biomedica.v36i1.2617
1 Grupo de Parasitología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
2 Instituto de Química, Universidad de Antioquia, Medellín, Colombia
Contribución de los autores:
Ana M. Olave, Jairo A. Mesa, Gisela M. García: desarrollo de experimentos
Jorge H. Botero: asesoría en el análisis estadístico
Edwin B. Patiño: asesoría en la purificación de proteínas
Juan F. Alzate: coordinación general del proyecto
Todos los autores participaron en la escritura del manuscrito.
Recibido: 20/11/14; aceptado: 21/07/15
Introducción. Toxocara canis es un nematodo patógeno de cánidos que accidentalmente puede ser transmitido a los humanos. A pesar de la importancia de la serología para el diagnóstico de esta zoonosis, los kits diagnósticos usan antígenos crudos de excreción-secreción, en su mayoría glucoproteínas que no son específicas de especie, por lo cual pueden presentarse reacciones cruzadas con anticuerpos generados contra otros parásitos.
Objetivos. Producir el antígeno recombinante TES-30 de T. canis y evaluarlo para el inmunodiagnóstico de la toxocariasis.
Materiales y métodos. Se clonó el gen que codifica TES-30 en el vector de expresión pET28a (+), usando oligonucleótidos de cadena sencilla unidos mediante reacción en cadena de la polimerasa (PCR). La proteína rTES-30 se purificó por cromotografia de afinidad (Ni 2+ ). La reacción serológica de rTES-30 se evaluó mediante immunoblot . Teniendo en cuenta que no existe una prueba de referencia , se observó el comportamiento del antigeno en comparación con la prueba de rutina para el inmunodiagnóstico de la toxocariasis, es decir, la técnica ELISA convencional con antígenos de excreción-secreción.
Resultados. El rTES-30 se produjo a partir de un cultivo de Escherichia coli LB, con un rendimiento de 2,25 mg/l y 95 % de pureza. La concordancia de la reacción entre el immunoblot rTES-30 y la ELISA convencional, fue de 73 % (46/63) y de 100 % con los 21 sueros no reactivos. De los 21 sueros con diagnóstico de otras parasitosis, 19 fueron reactivos con ELISA, mientras que tan solo siete fueron positivos con el immunoblot rTES-30. La concordancia entre la ELISA y el immunoblot fue moderada (índice kappa de 0,575; IC 95% 0,41-0,74).
Conclusiones. Los datos presentados respaldan la utilidad del immunoblot r TES-3 0 para la confirmación de los posibles positivos por ELISA, no solo en los estudios epidemiológicos, sino también, como candidato para el desarrollo de pruebas diagnósticas de la toxocariasis ocular en Colombia.
Palabras clave: Toxocara canis , toxocariasis/diagnóstico, antígeno, pruebas inmunológicas.
doi: http://dx.doi.org/10.7705/biomedica.v36i1.2617
Production and evaluation of the recombinant antigen TES-30 of Toxocara canis for the immunodiagnosis of toxocariasis
Introduction: Toxocara canis is a pathogenic nematode of canines which can be accidentally transmitted to humans. Although serology is the most important diagnostic tool for this zoonosis, diagnostic kits use crude excretion/secretion antigens, most of them being glycoproteins which are not species-specific and may cross-react with antibodies generated against other parasites.
Objectives: To produce the rTES-30 recombinant antigen of Toxocara canis and evaluate it in the immunodiagnosis of toxocariasis.
Materials and methods: The gene that codes for TES-30 was cloned in the expression vector pET28a (+) using single-stranded oligonucleotides united by PCR. The protein rTES-30 was purified by Ni 2+ affinity chromotography. Seroreactivity of rTES-30 was evaluated by immunoblot. Given that there is no gold standard test, the behaviour of the antigen was compared with the method that is routinely used to immunodiagnose toxocariasis, i.e., the conventional ELISA technique using excretion/secretion antigens.
Results: The rTES-30 was produced from an Escherichia coli LB culture which yielded 2.25 mg/L of the antigen with a purity of 95%. The results obtained showed 73% (46/63) concordance of reactivity between the rTES-30 immunoblot and the conventional ELISA, and 100% concordance with the non-reactive sera (21). Nineteen of the 21 sera positive for other parasitoses reacted with ELISA, while only seven of these were positive with the rTES-30 immunoblot. Concordance between the ELISA and the immunoblot was moderate (kappa coefficient: 0.575; 95% CI: 0.41- 0.74).
Conclusions: The data presented show the potential of the rTES-30 inmunoblot for confirmation of possible ELISA positives, not only in epidemiological studies, but also as a candidate for the development of diagnostic tests for ocular toxocariasis in Colombia.
Key words: Toxocara canis, toxocariasis/diagnosis, antigen, immunologic tests.
doi: http://dx.doi.org/10.7705/biomedica.v36i1.2617
La toxocariasis es una infección parasitaria cuyo agente etiológico es un nematodo perteneciente al género Toxocara , el cual incluye más de 30 especies descritas. Como especies con potencial patógeno para el humano, se han descrito Toxocara canis (Werner 1782) y T. cati (Schrank 1788), las cuales parasitan perros y gatos, respectivamente. La especie de mayor importancia epidemiológica es T. canis por varias razones: i) la mayoría de las larvas encontradas en casos humanos se han identificado como T. canis ; ii) los huevos de T. canis se recuperan con mayor frecuencia en las muestras de tierra que los huevos de T. cati , y iii) los estudios epidemiológicos indican que el contacto con los perros es un importante factor de riesgo, lo que no sucede con el contacto con los gatos (1).
El ser humano es un huésped accidental (paraté nico) del parásito si ingiere los huevos larvados de Toxocara spp. Los niños están especialmente en riesgo, ya que están más expuestos a los huevos larvados del parásito al jugar en cajas de arena o parques públicos potencialmente contaminados debido al manejo inadecuado en estos sitios de las heces de perros y gatos infectados (2). Otro mecanismo de dispersión de los huevos es por aguas contaminadas que luego son consumidas directamente o al ingerir vegetales contaminados (3-5).
Una vez ingeridos, las enzimas digestivas ayudan a disolver la cubierta de los huevos larvados de Toxocara spp., lo que permite la eclosión de las larvas en el intestino. Estas larvas penetran la mucosa intestinal y migran por vía sanguínea a diferentes órganos, generalmente, el hígado, el pulmón, el cerebro o el ojo, en cuyos tejidos las lar vas permanecen latentes y quedan encapsuladas, dando origen a la formación de granulomas. La reac ción inflamatoria asociada genera eosinofilia e inflamación, hemorragia y necrosis localizada alrededor del granuloma. Aunque algunas de las larvas pueden ser eliminadas por el sistema inmunitario, la mayoría solo detiene su creci miento, pero permanece metabólicamente activa. Cabe resaltar que, a diferencia de lo que ocurre en el perro, los humanos no desarrollan los parásitos adultos, ya que el parásito no es capaz de continuar con las siguientes fases de desarrollo (6-8).
Existen dos síndromes que han sido bien documentados en la literatura científica internacional desde el primer reporte en los años 50: el síndrome de larva migrans visceral, que se manifiesta en forma generalizada, y el síndrome de larva migrans ocular (actualmente denominado toxocariasis ocular), que se manifiesta en forma localizada, es el más frecuente y puede derivar en ceguera en 64 % de los casos (3,9,10). Sin embargo, el espectro de la patogenia de la toxocariasis humana ha dado lugar a la descripción de otras formas clínicas que, aunque menos conocidas, han cobrado importancia clínica en los últimos años (3,9-12).
En Colombia, al igual que a nivel internacional, la prevalencia y la incidencia de la toxocariasis son difíciles de estimar debido a que sus manifestaciones clínicas son inespecíficas, a la inexistencia de una prueba diagnóstica definitiva que, además, pueda utilizarse en estudios epidemiológicos a gran escala, así como a la escasa formación del personal de atención en salud humana y veterinaria en el manejo de esta parasitosis, y la ausencia de un sistema nacional de registro y control. Esta situación pone en evidencia el riesgo actual que ofrece el nematodo patógeno T. canis para la salud pública colombiana. La infección por T. canis en perros es de distribución mundial y su prevalencia varía entre 0 y 99,4 %, dependiendo de la ubicación geográfica (11,13,14). Las tasas de seroprevalencia en humanos en América Latina oscilan entre 2,5 y 63,2 % (15-20).
En Colombia se han realizado estudios puntuales de toxocariasis; el primer caso confirmado de larva migrans visceral fue descrito por Correa, et al. , en 1966 (21). Uno de los pocos estudios seroepidemiológicos hechos en el país fue el de Agudelo, et al ., de la Universidad Nacional, sede Bogotá, en 1990, en una población de bajos recursos económicos de la capital colombiana. En este estudio se utilizó la prueba ELISA con antígenos de excreción-secreción y se encontró que 47,5 % de las personas presentaban títulos de anticuerpos positivos para Toxocara spp. (22). En otro estudio llevado a cabo en el 2000 en la localidad de Ciudad Bolívar de Bogotá, se demostró 7,3 % de seropositivos en un grupo de 193 niños entre 4 y 14 años de edad, procedentes de establecimientos educativos (23).
En otro estudio en la ciudad de Medellín, se reportó una seroprevalencia de 63,3 % en un grupo de 30 individuos entre los 0 y 17 años de edad con manifestaciones oculares relacionadas con larva migrans ocular, remitidos de los centros oftalmológicos de Medellín. Sin embargo, de acuerdo con los criterios clínicos, epidemiológicos y serológicos, la frecuencia de toxocariasis ocular fue de 20 %. En este estudio se utilizó la técnica ELISA con antígenos de excreción-secreción (2). Entre los años 1996 y 2002, se reportó una seroprevalencia de IgG anti- T. canis de 16,2 % en suero y de 10 % en humor vítreo, en pacientes remitidos al Instituto Nacional de Salud con sospecha de larva migrans ocular y visceral, de toxocariasis o toxoplasmosis. Del total de muestras positivas en suero, 15,9 % correspondió a pacientes con impresión diagnóstica de toxocariasis ocular; 50 %, de toxocariasis visceral; 25 %, de toxoplasmosis; 11,6 %, de toxocariasis o toxoplasmosis, y 11,6 % correspondió a pacientes que ingresaron sin datos (24). Estas pruebas ELISA se hicieron tam bién con antígeno de excreción-secreción de larvas L 2 de T. canis.
El diagnóstico de la toxocariasis se basa en la sospecha clínica, teniendo en cuenta los antecedentes de geofagia y de contacto con perros, y un cuadro clínico de leucocitosis y eosinofilia, y, principalmente, reacción serológica a antígenos de T. canis. La técnica serológica más utilizada actualmente es la ELISA con antígenos de excreción-secreción (25-27), los cuales se originan en los órganos secretorios del parásito (la glándula esofágica y el poro secretor); dado que generalmente corresponden a glucoproteínas que no son específicas de especie, pueden presentarse reacciones cruzadas con anticuerpos generados por otras enfermedades o contra otros parásitos (28).
En los estudios moleculares de los antígenos de excreción-secreción, se han podido caracterizar e identificar los genes que codifican varias de sus proteínas más importantes. Es así como los antígenos TES-26, TES-30 y TES-120 se han convertido en la alternativa recombinante para este antígeno. El TES-30 se ha evaluado exitosamente en varios países (29-31), incluido Brasil. Sin embargo, en Colombia aún no se ha evaluado ninguno de estos antígenos en su función de proteínas recombinantes alternativas a los antígenos de excreción-secreción. En este trabajo se produjo y se purificó el antígeno recombinante rTES-30 de T. canis y se evaluó su reacción con sueros de individuos sanos (parasitológicamente negativos), pacientes con otras parasitosis y pacientes con sospecha clínica de toxocariasis ocular. Asimismo, se compararon estos resultados con los obtenidos mediante la prueba convencional ELISA con antígeno de excreción-secreción.
Materiales y métodos
Diseño del gen sintético que codifica la proteína rTES-30
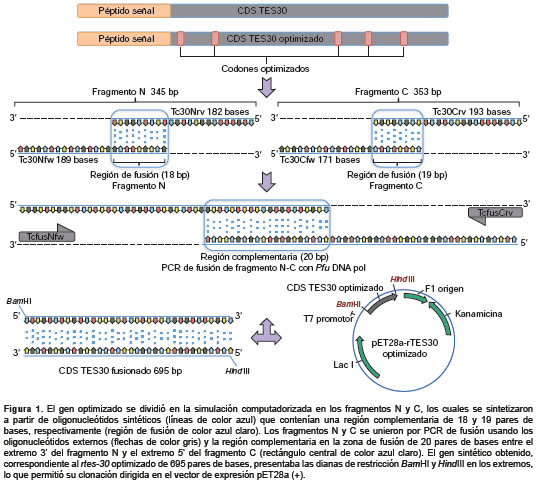
El diseño del gen sintético que codifica para la proteína rTES-30 de T. canis , se hizo a partir de la secuencia del gen tes30 reportada en el GenBank (número de acceso AB009305). Inicialmente, se identificó un péptido de señalización putativo de 21 aminoácidos en la región N-terminal de tes30 (signal P 4.1). Esta secuencia se conservó inicialmente en el gen sintético y, posteriormente, se optimizó la región codificante para la expresión recombinante en Escherichia coli . Utilizando el algoritmo del Graphical Codon Usage Analyser (GCUA), se identificaron los codones de baja frecuencia (según la tabla de uso de co dones de E. coli ). En la secuencia original de tes30 , los codones AGG, CAA, TGT, AGG, AGA, poco frecuentes en E. coli , se reemplazaron por los codones CGC, CAG, TGC, CGT, CGC, respectivamente (codones sinónimos y de mayor frecuencia).
Una vez optimizada la región de codificación, se diseñó la estrategia para la síntesis y el ensamblaje del gen sintético que codifica para tes30 . Para ello, se diseñaron seis oligonucleótidos de ADN de cadena sencilla, a partir de los cuales se ensamblaría el gen sintético completo. Inicialmente, la secuencia optimizada se dividió mediante simulación computacional en los fragmentos principales N y C, para facilitar el diseño de los oligonucleótidos. Para la síntesis de cada frag mento, N o C, se sintetizaron dos oligonucleótidos correspondientes a las cadenas complementarias (Tc30Nfw-Tc30Nrv para el fragmento N y Tc30Cfw-Tc30Crv para el fragmento C), los cuales contenían una región de solapamiento y una complementaria de 18 y 19 pares de bases, respectivamente (región de alineamiento), que permitiría el alineamiento y síntesis por elongación con la Taq ADN polimerasa. Ambos fragmentos serían posteriormente fusiona dos mediante reacción en cadena de la polimerasa (PCR) con los oligonucleótidos externos TcfusNfw- Bam HI y TcfusCrv- Hind III.
La construcción del gen sintético se llevó a cabo de la siguiente forma: el fragmento N se sintetizó por elongación con Taq ADN polimerasa a partir de los oligonucleótidos alineados Tc30Nfw en sentido 5´-ACCCCAACAACCACACGGCGCATGATCGCCGCAATCGTCGTTTTGTTATGTCTCCACCTCTCCGCCACCAATGCTTGCGCCACCAACAATGACTGTGGTATTTTCCAAGTGTGCGTTAACAACGTCTGCGTTGCCAATAACCAAGGATGCAATCCGCCTTGTGTGCCTCCGCAGGTTTGCGTTGCACCA-3´ y Tc30Nrv en antisentido 5´-GTGCACCAGTCGCTAGCCTGGTTGAAAAGGAAGCGTCCAGGTAGAGAGGCGATATAGCAATTGTTGTTGAACGGCGTCCAATTGGGTGGGCAGGCACGTGGTCTTGTAGTTGTAACGCCTGGAGCTGCAGTTGTAGTGGCTGCCGGTGGAGGGGCGACACACATTGGT GCAACGCAAACCTG-3´ de 189 y 182 bases, respectivamente. Ambos oligonucleótidos se mezclaron con una concentración final de 0,08 µM en la reacción de elongación con las siguientes condiciones: 1 minuto a 95 °C, 20 segundos a 55 °C y 2 minutos a 72 °C (0,05 mM de dNTP, 1,5 mM de MgCl2, 2,5 U/100 µl de Taq pol). De la misma forma, la síntesis del fragmento C se hizo usando los oligonucleótidos Tc30Cfw en sentido 5`-CAGGCTAGCGACTGGTGCACACAGACTGGCTCAAGAGTTGTGTGGTTCGACCAGTCGACTGTAGGAAACTTCGGCAGCGAACTGAACTTCGTCAACAGTTTCGCTCTCGGTCGTGGAGTAACCCGTTACTGGATAGGAGTGAACAGACAGTT CGGCCAGTGGGTGTTTACG-3´, de 171 bases, y Tc30Crv en antisentido 5´-GAGAGGGCGCTT GCATACGAAGCCTTGTGGAGTCGTAAACAAACTTCCGCATGGGGCATCATCCCATTGGCCGAGGAAGTTCGCGTAATTAACGAACGCACACGTGACGTTGGAACCACAGCATCCGTCCGGTTGACTAGGACGCCAGTTCGAAAATATCACTGGA CTTCCATTCGTAAACACCCACTGGCCG-3´, de 193 bases, mediante un ciclo de elongación con Taq ADN polimerasa y bajo las mismas condiciones en las que se hizo la elongación del fragmento N.
Por último, se hizo una de fusión con Pfu ADN polimerasa usando como molde 1 µl de la mezcla de los fragmentos N y C elongados en la reacción anterior con las siguientes condiciones: 1 ciclo durante 1 minuto a 95 °C, 25 ciclos durante 40 segundos a 94 °C, 40 segundos a 55 °C, 1 minuto a 72 °C y un ciclo de 5 minutos a 72 °C (0,2 mM de dNTP, solución tampón Pfu 1X, 0,2 µM de TcfusNfw- Bam HI, 0,2 µM de TcfusCrv- Hind III, 2U/50 µl de Pfu ADN polimerasa, 1 µl de ADN). En la PCR de fusión se utilizaron los oligonucleótidos TcfusNfw- Bam HI 5´- CCGGATCCACCCCAACAACCACACGGC-3´, de 27 bases y TcfusCrv- Hind III 5´- CCC AAGCTTGAGAGGGCGCTTGCATACGA-3´, de 29 bases, los cuales contenían las dianas de restricción Bam HI y Hind III para facilitar la clonación en el vector de expresión pET28a (+).
Todos los oligonucleótidos de cadena sencilla de ADN fueron sintetizados por la empresa IDT (Skokie, Illinois, USA). Tras la clonación inicial en el vector de expresión pET28a, se generó una segunda versión del gen sintético rTES-30 que excluía la región del péptido de señaliza ción previamente identificado. Esto se logró al ´subclonar´ en el mismo vector de expresión el fragmento amplificado mediante PCR con el oligonucleótido interno TcfusN-NSP-fw- Bam HI 5´- CCCGGATCCGCCACCAATGCTTGCGCCA-3´ y el previamente descrito TcfusCrv- Hind III. El constructo definitivo del rTES-30 sin péptido de señalización se denominó pET28a-rTES-30- NSP. Los constructos sintetizados se verificaron mediante secuenciación capilar según el método de Sanger (Macrogen).
Expresión y evaluación de la solubilidad de la proteína rTES-30 en diferentes cepas de Escherichia coli
Para la expresión de la proteína recombinante se utilizó la cepa de E. coli BL21(DE3) de la empresa Novagen (Darmstadt, Alemania), transformada con protocolos estándar de choque térmico y cloruro de calcio (32). Los cultivos para la inducción se hicieron en medio líquido Luria Bertani (LB) con suplemento de 50 µg/ml de kanamicina durante 15 horas a 37 °C, con agitación constante de 240 rpm. Pasadas las 15 horas, se cambió el medio, posteriormente, se diluyó el cultivo a 1:50 con medio fresco y las bacterias se cultivaron hasta alcanzar una densidad óptica de 0,5 a 0,7 medida a 600 nm, y garantizando que las bacterias se encontraran en fase logarítmica de crecimiento. Después, se añadió el inductor isopropil- b -D-1-tiogalacto-piranósido (IPTG) (Fermentas, Lituania), en una concentración final de 0,5 mM.
Para evaluar la inducción, se tomaron alícuotas de 500 µl en los tiempos indicados en cada experimento: bacterias de control sin inducir (0 horas), lisado de bacterias a las 2 horas de inducción y a las 5 horas de inducción, las cuales se centrifugaron a 4.000 RCF durante 5 minutos. Los sedimentos de bacterias se suspendieron de nuevo en 100 µl de solución tampón desnaturalizante proteínas (2,5 ml de tris 0,5M pH 6,8, 5 ml de glicerol a 36 %, 0,4 g de SDS, 0,4 ml de azul de bromofenol al 0,4 %, 0,1 ml de beta-mercaptoetanol y 0,2 ml de agua ultrapura). La muestra se sometió a ebullición a 100 °C durante 5 minutos y, finalmente, se separó mediante electroforesis en gel de poliacrilamida con dodecilsulfato sódico ( Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis, SDS-PAGE) al 12 %.
Para evaluar la solubilidad de la proteína recombinante, las bacterias inducidas se centrifugaron a 4.000 RCF durante 25 minutos; luego se descartó el sobrenadante, se pesó el sedimento r esultante y se agregó solución tampón de lisis en una relación de 15 ml de solución tampón de sonicación (50 mM de NaH 2 PO 4, 300 mM de NaCl, 10 mM de imidazol, pH de 8,0 ajustado con NaOH) por gramo de bacterias. La sonicación se hizo con una amplitud de 70 % y pulsos de 59 segundos a intervalos de 10 segundos de descanso, para un tiempo final de 35 minutos. El lisado de bacterias se mantuvo en hielo durante el procedimiento efectuado en el sonicador VibraCell Sonics® (130 Watts). El lisado se centrifugó a 10.000 RCF y 4 °C durante 20 minutos. Posteriormente, se separó el sobrenadante del sedimento y estos productos se evaluaron mediante SDS-PAGE con gel separador al 12 % .
Solubilidad de los cuerpos de inclusión y purificación de la proteína rTES-30
Los cuerpos de inclusión con la rTES-30 se sometieron a tres lavados, así: en el primero, con una solución de 100 mM de NaH 2 PO 4, 10 mM de tris HCl, 10 mM de imidazol, un pH de 8,0 y centrifugación a 4.500 rpm y 4 °C durante 20 minutos; en el segundo, con 100 mM de NaH 2 PO 4, 10 mM de tris HCl, 10 mM de imidazol, 4 M de urea, 10 mM de 2-mercaptoetanol, tritón X100 al 1 %, pH de 8,0 y centrifugación a 4.500 rpm y 4 °C durante 20 minutos; y en el tercero, con 100 mM de NaH 2 PO 4, 10 mM de tris HCl, 10 mM de imidazol, pH de 8,0 y centrifugación a 4.500 rpm y 4 °C durante 20 minutos. Para hacer el seguimiento entre cada lavado, se tomó una alícuota que se analizó mediante SDS-PAGE con gel separador al 12 %. Al final, la solubilidad de los cuerpos de inclusión se hizo con una solución tampón desnaturalizante que contenía 10 mM de tris HCl, 10 mM de imidazol y 8 M de urea con un pH de 8,0.
La muestra se dejó así durante toda la noche a 25 °C y 90 rpm y, al cabo de este tiempo, se le sometió a centrifugación a 8.000 RCF e incubación durante 20 minutos a 4 °C. El sobrenadante y el sedimento se evaluaron mediante SDS-PAGE con gel separador al 12 %. La proteína solubilizada con la urea (sobrenadante) se cuantificó por absorción a 280 nm, usando un espectrofotómetro NanoDrop 2000c ® . La purificación de la rTES-30 se hizo mediante cromatografía de afinidad por metales inmovilizados con Ni 2+ ( Immobilized Metal-Ion Affinity Chromatography, IMAC), en un cromatógrafo Biologic Duoflow System ® de BioRad, usando columnas Bio-Scale Mini Profinity (BioRad, CAT#732-4610) de 1 ml. Este experimiento se desarrolló bajo condiciones desnaturalizantes con 8 M de urea y se eluyó con cambios de pH. Las fracciones obtenidas en la purificación se evaluaron mediante SDS-PAGE con gel separador al 12 % y mediante electroforesis capilar en un sistema Experion-BioRad ®, para determinar la pureza de las fracciones proteicas obtenidas. Las fracciones seleccionadas se congelaron para su posterior uso en el immunoblot .
Immunoblot
Para la evaluación de la proteína recombinante mediante immunoblot comparada con la prueba ELISA (TES), se utilizaron sueros que se encontraban almacenados a -80 °C desde el 2007, así:
Grupo 1: 63 sueros de pacientes remitidos al Grupo de Parasitología de la Universidad de Antioquia, con sospecha clínica de toxocariasis ocular, entre 2007 y 2013, y que habían resultado reactivos mediante la técnica ELISA (Ag TES nativos). Estos sueros se etiquetaron como sueros reactivos.
Grupo 2: 21 sueros de personas asintomáticas cuyo estudio coprológico y parasitológico seriado resultó negativo. Estos sueros se analizaron, además, mediante ELISA en el Grupo de Parasitología y se les etiquetó como sueros negativos.
Grupo 3: 21 sueros de pacientes con parasitosis intestinales como ascariasis, tricocefalosis, estrongiloidiasis y teniasis, y otras infecciones no intestinales como la toxoplamosis ocular. Estos sueros se analizaron también mediante la prueba ELISA implementada en el Grupo de Parasitología.
La SDS-PAGE se hizo en minigeles según el método descrito por Laemmli en 1970 (33), usando 10 µg de proteína total. La transferencia de proteínas a la membrana de nitrocelulosa se ajustó al método convencional (Mini-Transblot de Bio-Rad). Finalizada la transferencia, la membrana de nitrocelulosa se tiñó con rojo de Ponceau para observar su eficiencia. El gel se tiñó con azul de Coomassie para verificar si la transferencia había sido completa.
La reacción inmunoenzimática se hizo con una primera incubación de una hora y media a 37 °C y con ligera agitación de 1,5 ml de suero diluido a 1:50 con tris salino más leche al 1 %. Luego, se hizo una segunda incubación con 1,5 ml de anti-IgG humana peroxidasa (Sigma) diluida a 1:500 en tris salino más leche al 1 % durante una hora y con ligera agitación. Para revelar la reacción, se añadió el sustrato diaminobencidina mejorada con metal ( Pierce). La interpretación se basó en la observación de una banda en la membrana de nitrocelulosa de aproximadamente 28 kDa, correspondiente a rTES-30, y el resultado se expresó en términos de reacción: reactivo o no reactivo, según la presencia o ausencia de la banda, respectivamente.
Prueba ELISA con antígeno TES
El antígeno TES se preparó en el Grupo de Parasitología diluyéndolo en solución tampón de carbonato-bicarbonato con pH de 9,6 hasta alcanzar una concentración de 1 µg/ml, y con este se sensibilizaron las placas de ELISA. Se incubó toda la noche a 37 °C en agitación. Al siguiente día, las placas se lavaron tres veces y luego se bloqueó con PBS-T más leche descremada (Colanta ® ) al 5 % (PBST-L) durante 90 minutos a 37 °C. Posteriormente, se añadieron en tres ocasiones los sueros diluidos a 1:20 en PBST y leche descremada (1 % p/v). El suero se incubó durante una hora a 37 °C en agitación. A continuación, se repitieron los tres lavados con PBST y se agregó a cada pozo anti-IgG humana marcada con peroxidasa (Sigma) diluida a 1:8.000 en PBS-T-L al 2,5 % y se incubó durante una hora a 37 °C. Se lavó y se agregó a cada pozo sustrato de ortofenilendiamina (OPD) y se incubó durante 20 minutos más a 37 °C. La reacción se detuvo con la adición de 2,5 M de H 2 SO 4 . Por último, se midió la absorbancia en un lector de placas de ELISA a una densidad óptica de 490 nm.
Resultados
Síntesis y clonación del gen sintético que codifica la proteína rTES-30 de Toxocara canis
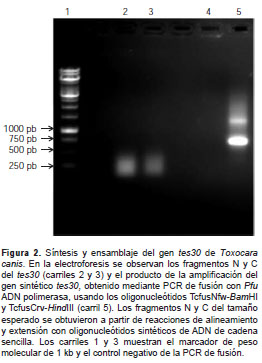
De acuerdo con la estrategia descrita en la metodología y resumida en la figura 1, se sintetizó la región codificante del gen de la proteína rTES- 30. La figura 2 muestra el resultado de una electroforesis en gel de agarosa con los productos de la hibridación y elongación de los fragmentos N (353 bp) y C (345 bp), al igual que el producto final de la PCR de fusión en la que se observó claramente la secuencia codificadora de ADN sintética de 695 bp. Esta se clonó en el vector pET28a en los sitios de restricción Bam HI y Hind III.
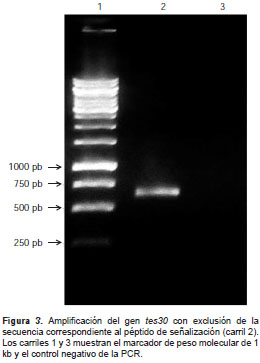
En la versión inicial, el gen se sintetizó y se clonó completo, incluidos los codones que codifican el péptido de señalización. Los péptidos de señalización en eucariotas pueden afectar negativamente la expresión heteróloga en E. coli , razón por la cual se hizo una PCR con el oligonucleótido interno TcfusN-NSP-fw- Bam HI y el ya descrito TcfusCrv- Hind III, para amplificar la versión del gen tes30, excluyendo la secuencia correspondiente al péptido de señalización (figura 3). El fragmento amplificado, de 633 pb sin el péptido de señalización, sésubclonó´ en el pET28a (pET28-rTES-30-NSP), el cual se utilizó en todas las etapas de este trabajo.
Expresión y purificación del rTES-30
Para la expresión de la rTES-30 se utilizó la cepa bacteriana BL21 (DE3) y el vector pET28a. Este sistema permitió agregar dos colas de histidina a la proteína blanco para su posterior purificación en columnas de Ni 2+ inmovilizado, y para hacerla inducible con el análogo de la lactosa IPTG. La inducción de la rTES-30 a una temperatura de 37 °C y una concentración de inductor de 0,5 mM, expresó, a partir de la primera hora, una banda de aproximadamente 29,5 kDa, correspondiente a la masa molecular relativa esperada para la rTES-30. La acumulación de la proteína recombinante continuó durante las siguientes horas del experimento y a las cinco horas se observó una acumulación aceptable para la recolección (figura 4). Los análisis posteriores de la solubilidad de la rTES-30 mostraron que la proteína se encontraba toda en el sedimento, lo que indicaba su acumulación insoluble en cuerpos de inclusión (figura 4).

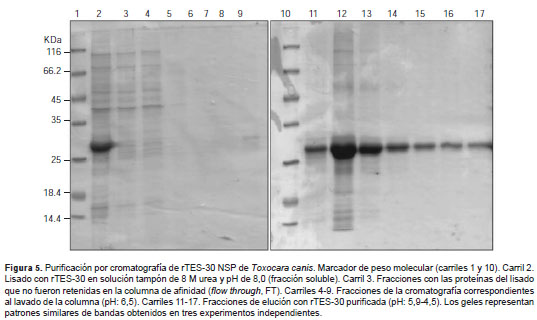
Dada la naturaleza insoluble de la rTES-30 en este sistema, se procedió a aplicar un protocolo de purificación por cromatografía en condiciones desnaturalizantes, utilizando urea y columnas de afinidad con Ni-NTA. La elución de la proteína se hizo mediante cambios en el pH en diferentes pasos. Los resultados obtenidos de la separación electroforética de las diferentes fracciones de la cromatografía en geles SPS-PAGE teñidos con azul de Coomassie, mostraron una unión eficiente de la rTES-30 a la columna. Además, se observó una gran pureza de la proteína recombinante en estos mismos geles (figura 5). Los resultados de la cuantificación demostraron un rendimiento en la purificación de 2,25 mg de rTES-30 por litro de LB cosechado. Los análisis detallados de las fracciones purificadas de la rTES-30 mediante electroforesis capilar de proteínas, mostraron un grado de pureza de 95 % y una masa molecular relativa observada de 28,7 kDa (figura 6).
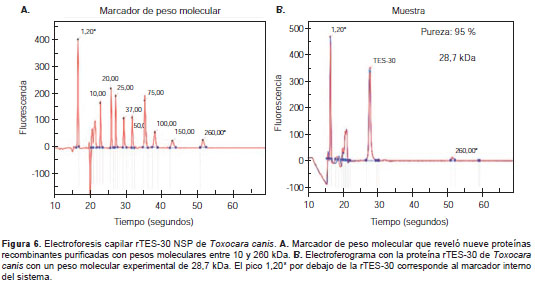
Evaluación serológica: comparación del immunoblot rTES-30 con ELISA (TES)
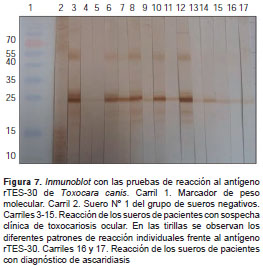
Una vez obtenida la proteína recombinante rTES-30 de T. canis , se procedió a hacer los ensayos de immunoblot . La observación de una banda de alrededor de 25 kDa en las membranas de nitrocelulosa, confirmó la reacción de los sueros ensayados frente al antígeno rTES-30 (figura 7). En esta figura se observaron en la membrana unas bandas adicionales que podrían corresponder a proteínas contamina ntes de E. coli purificadas de manera simultánea en la cromatografía, o a fragmentos truncados de rTES-30. Alrededor de los 55 kDa se observó, igualmente, la reacción de los sueros, la cual podría corresponder a otra proteína contaminante o a dímeros de la rTES-30 no desnaturalizados apropiadamente. No se observó reacción en el suero del paciente que hacía parte del grupo de controles negativos. Se observaron diferentes patrones de reacción en cada uno de los sueros de los pacientes con sospecha clínica de toxocariasis ocular evaluados, así como en aquellos con diagnóstico parasitológico de ascariasis. En el caso de esta última parasitosis, no se pudo establecer con certeza que se tratara de una reacción cruzada, debido a que el estudio se llevó a cabo en una zona endémica de varios parasitismos.
Actualmente, no existe una prueba de referencia para confirmar la toxocariasis; por lo tanto, se recurrió a una aproximación estadística comparando el immunoblot de la rTES-30 presentado en este estudio con el ELISA-TES, cuyos resultados se expresaron en términos de reacción: reactivo o no reactivo.
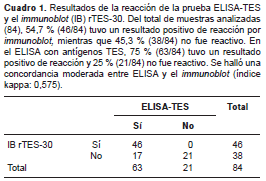
Después de analizar los resultados obtenidos, se encontró que de los 63 pacientes con sospecha clínica y reactivos según la prueba ELISA-TES (criterio de inclusión en el estudio), 46 fueron reactivos por immunoblot . Además, todos los sueros de los pacientes de control negativos con resultado de ELISA no reactivo, también fueron no reactivos por immunoblot. De los 21 sueros de pacientes con diagnóstico de otras parasitosis, 19 tuvieron resultado reactivo en ELISA, y solo siete de ellos en el immunoblot . En este último grupo, había cinco sueros de pacientes con diagnóstico de toxoplasmosis, y tres de ellos resultaron reactivos en la prueba ELISA, en tanto que el immunoblot en la rTES-30 no presentó reacción con ninguno de los cinco sueros.
Para el análisis estadístico comparativo, se tuvieron en cuenta los dos primeros grupos: 1) sueros de pacientes con sospecha clínica de toxocariasis ocular, y 2) sueros de pacientes de control negativos. Se analizaron 84 muestras, de las cuales 54,7 % (46/84) tuvo un resultado reactivo por immunoblot , mientras que 45,3 % (38/84) no fue reactivo. Con ELISA, 75 % (63/84) tuvo un resultado reactivo y 25 % (21/84) no fue reactivo (cuadro 1). Se halló una concordancia moderada entre el ELISA y el immunoblot , con un índice kappa de 0,57 5 (IC 95% 0,41-0,74).
Discusión
En este estudio se logró producir localmente y de forma recombinante en E. coli la proteína rTES-30 de T. canis a partir de un gen sintético. La implementación del método para producir genes sintéticos demostró ser una herramienta rápida y costo-efectiva para la síntesis de genes eucariotas de menos de 1 kb, dado que su síntesis requiere una infraestructura de poca complejidad.
Igualmente, se logró desarrollar un protocolo de purificación eficiente para dicha proteína recombinante. El protocolo de purificación por afinidad de tipo IMAC aplicado en este estudio, permitió la purificación eficiente de la proteína recombinante antigénica rTES-30. Para la elución de las proteínas retenidas en las columnas de afinidad, se puede utilizar un competidor de la interacción con el metal, el cual puede ser histidina o imidazol, o un cambio en el pH de la solución tampón de cromatografía. En este caso, se lograron buenos resultados haciendo uso del cambio de pH en las soluciones tampón, ya que la proteína se eluye eficientemente al bajar el pH de la solución tampón a 4,5.
Con este trabajo se demostró que la rTES-30 de T. canis es un antígeno promisorio en los estudios de inmunodiagnóstico de la toxocariasis ocular humana en Colombia. Además, es un antígeno que puede presentar menos falsos positivos que la prueba ELISA-TES empleada actualmente para el diagnóstico y es una herramienta comple mentaria para el diagnóstico diferencial frente a la toxoplasmosis ocular.
Diversos autores han determinado, clonado y secuenciado los genes que codifican diferentes antígenos de las larvas de T. canis (29-31,34-36). En ese sentido, se han publicado trabajos acerca de la producción de proteínas recombinantes deri vadas de los antígenos de excreción-secreción (rTES), con el fin de utilizarlos en nuevas pruebas diagnósticas. En estos estudios se han reportado altos valores de sensibilidad (>90 %) al hacer uso del antígeno recombinante. En el 2000, Yamasaki, et al. , desarrollaron una prueba con 100 % (9/9) de sensibilidad (IgG-ELISA-rTES-30). En 2009, Mohamad, et al. , encontraron una sensibilidad de 92,3 % (24/26) al detectar IgG4, y en 2009, estos mismos autores encontraron una sensibilidad de 93,3 % (28/30) con la prueba IgG4-ELISA-rTES-30USM. En este estudio se encontró que 73 % (46/63) de los pacientes reactivos en el ELISA- TES, lo fueron también en el immunoblot rTES-30 (29,30).
Es importante resaltar que nuestros datos no son comparables porque los sueros analizados como reactivos mediante ELISA para toxocariasis no eran casos confirmados de pacientes con la enfermedad, lo que constituye una debilidad de las investigaciones sobre esta enfermedad a nivel mundial.
Wickramasinghe, et al. , desarrollaron una prueba ELISA IgG-rTES-30 y la compararon con la ELISA IgG (TES), y reportaron 13,4 % (19/142) de reacción cruzada con el antígeno recombinante, y 55,6 % (79/142), con el antígeno TES. Las reacciones cruzadas se presentaron por casos de gnatostomiasis, paragonimiasis y espirometriosis, en los que se detectaron niveles elevados de anticuerpos. Además, con el antígeno recombi nante hubo reacciones negativas de muestras de suero de pacientes infectados con Ascaris spp. y Ancylostoma spp. (37).
A pesar de la reacción encontrada en los sueros de pacientes con estrongiloidiasis y ascariasis, no se puede afirmar categóricamente que sea una reacción cruzada, debido a que estos sueros eran de pacientes provenientes de zonas endémicas para la toxocariasis, por lo que no se puede descartar de forma categórica una reacción contra este parásito.
Otros autores han reportado un aumento en la especificidad al hacer uso de los antígenos recombinantes frente al antígeno TES. En el 2000, Yamasaki, et al. , reportaron 55,6 % (79/142) de reacción cruzada con el antígeno TES, reacción que disminuyó a 3,4 % (19/142) cuando se hizo uso del recombinante. Resultados similares fueron reportados por Norhaida, et al., en 2008, quienes encontraron 44,3 % (51/115) de reacción cruzada con el antígeno TES y una reacción de 10,4 % (12/115) con el antígeno recombinante (29,38).
Uno de los hallazgos más importante de este estudio fue la ausencia de reacción cruzada con Toxoplasma gondii. De los cinco sueros de pacientes con diagnóstico de toxoplasmosis, ninguno presentó reacción con el immunoblot - rTES-30, mientras que con ELISA (TES) se presentó reacción con tres de los cinco sueros evaluados. Dado que la toxoplasmosis es uno los diagnósticos diferenciales más importantes con respecto a la toxocariasis ocular, el immunoblot - rTES-30 ofrece la posibilidad de discriminar con más precisión entre ambas enfermedades en nuestro medio.
Los resultados obtenidos en los pacientes con helmintiasis, correspondieron a 17 sueros reactivos con la técnica ELISA-TES que no lo fueron con el immunoblot rTES-30. Este fenómeno posiblemente se debió a reacciones cruzadas con los antígenos TES de Toxocara y debe estudiarse con mayor profundidad.
En 1999, Loukas, et al ., demostraron que la proteína TES-32 (sinónimo de la TES-30), que corresponde a la lectina de tipo C-1, fue reconocida en nueve sueros de pacientes con sospecha de toxocariasis (39). En una evaluación posterior, en 12 % (26/215) de los sueros de niños de Pernambuco, Brasil, se reconoció el antígeno Tc-CTL-1 (TES-32) (40). Cabe señalar que en ambos estudios el antígeno recombinante utilizado (Tc-CTL-1) se expresó en los cuerpos de inclusión de bacterias y requirió la solubilidad con 8 M de urea. Este mismo comportamiento de la proteína recombinante se observó en este estudio, ya que se logró su expresión por haberse acumulado exitosamente en los cuerpos de inclusión en E. coli .
A la profesora Sonia del Pilar Agudelo, por las asesorías, y a la bacterióloga María Cenelia Orozco, por el apoyo en el laboratorio.
Declaramos no tener conflicto de intereses.
Esta investigación fue financiada por el Comité para el Desarrollo de la Investigación - CODI, Vicerrectoría de Investigación, Universidad de Antioquia, proyecto CPT-1005, y por Colciencias (proyecto 111551928778).
Correspondencia: Juan Fernando Alzate, Departamento de Microbiología y Parasitología, Facultad de Medicina, Universidad de Antioquia, Calle 51D N° 62-29, Medellín, Colombia Teléfono: (574) 219 6055; fax: (574) 219 6050 jfernando.alzate@udea.edu.co
1. Schantz PM, Glickman LT. Ascarids of cats and dogs: A public health and veterinary medicine problem. Bol Of Sanit Panam. 1983;94:571-86. [ Links ]
2. Botero JHM, Cañas L, Bravo JD, Lopera MON. Frecuencia de toxocarosis ocular en menores de edad remitidos al servicio de parasitología intestinal - Facultad de Medicina, Universidad de Antioquia; 2000-2001. Estudio piloto. Acta Médica Colomb. 2001;26:11-20. [ Links ]
3. Despommier D. Toxocariasis: Clinical aspects, epidemiology, medical ecology, and molecular aspects. Clin Microbiol Rev. 2003;16:265-72. http://dx.doi.org/10.1128/CMR.16.2.265-272.2003 [ Links ]
4. Doligalska M, Donskow K. Environmental contamination with helminth infective stages implicated in water and foodborne diseases. Acta Microbiol Pol. 2003;52 (Suppl.): 45- 56. [ Links ]
5. Schwartzbrod J, Banas S. Parasite contamination of liquid sludge from urban wastewater treatment plants. Water Sci Technol. 2003;47:163-6. [ Links ]
6. Sprent JF. Observations on the development of Toxocara canis (Werner, 1782) in the dog. Parasitology. 1958;48: 184- 209. [ Links ]
7. Sprent JF. On the migratory behavior of the larvae of various Ascaris species in white mice. I. Distribution of larvae in tissues. J Infect Dis. 1952;90:165-76. [ Links ]
8. Nichols RL. The etiology of visceral larva migrans. I. Diagnostic morphology of infective second-stage Toxocara larvae. J Parasitol. 1956;42:349-62. [ Links ]
9. Magnaval JF, Glickman LT, Dorchies P, Morassin B. Highlights of human toxocariasis. Korean J Parasitol. 2001;39:1-11. http://dx.doi.org/10.3347/kjp.2001.39.1.1 [ Links ]
10. Pawlowski Z. Toxocariasis in humans: Clinical expression and treatment dilemma. J Helminthol. 2001;75:299-305. http://dx.doi.org/10.1017/S0022149X01000464 [ Links ]
11. Schantz PM, Glickman LT. Toxocaral visceral larva migrans. N Engl J Med. 1978;298:436-9. http://dx.doi.org/10.1056/NEJM197802232980806 [ Links ]
12. Minvielle MC, Niedfeld G, Ciarmela ML, Basualdo JA. Toxocariasis caused by Toxocara canis: Clinico-epidemiological aspects. Enferm Infecc Microbiol Clin. 1999;17:300-6. [ Links ]
13. Barriga OO. A critical look at the importance, prevalence and control of toxocariasis and the possibilities of immunological control. Vet Parasitol. 1988;29:195-234. http://dx.doi.org/10.1016/0304-4017(88)90126-4 [ Links ]
14. Macpherson CN. The epidemiology and public health importance of toxocariasis: A zoonosis of global importance. Int J Parasitol. 2013;43:999-1008. http://dx.doi.org/10.1016/j.ijpara.2013.07.004 [ Links ]
15. Berrocal J. Prevalence of Toxocara canis in babies and in adults as determined by the ELISA test. Trans Am Ophthalmol Soc. 1980;78:376-413. [ Links ]
16. Cancrini G, Bartoloni A, Zaffaroni E, Guglielmetti P, Gamboa H, Nicoletti A, et al. Seroprevalence of Toxocara canis -IgG antibodies in two rural Bolivian communities. Parassitologia. 1998;40:473-5. [ Links ]
17. Alonso JM, Bojanich M V, Chamorro M, Gorodner JO. Toxocara seroprevalence in children from a subtropical city in Argentina. Rev Inst Med Trop Sao Paulo. 2000;42:235-7. http://dx.doi.org/10.1590/S0036-46652000000400010 [ Links ]
18. García-Pedrique ME, Díaz-Suárez O, Estévez J, Cheng NR, Araújo- Fernández M, Castellano J, et al . Prevalencia de infección por Toxocara en pre-escolares de una comu- nidad educativa de El Moján, estado Zulia, Venezuela. Resultados preliminares. Invest Clin. 2004;45:347-54. [ Links ]
19. Fillaux J, Santillán G, Magnaval JF, Jensen O, Larrieu E, Sobrino-Becaria CD. Epidemiology of toxocariasis in a steppe environment: The Patagonia study. Am J Trop Med Hyg. 2007;76:1144-7. [ Links ]
20. Espinoza YA, Huapaya PE, Roldán WH, Jiménez S, Abanto EP, Rojas CA, et al . Seroprevalence of human toxocariasis in Andean communities from the Northeast of Lima, Perú. Rev Inst Med Trop Sao Paulo. 2010;52:31-6. http://dx.doi.org/10.1590/S0036-46652010000100005 [ Links ]
21. Correa M, González M, D´Alessandro A. Primer caso colombiano de toxocariasis. Breve actualización del síndrome de la larva migrans visceral. Antioquia Méd. 1966;16:489-97. [ Links ]
22. Agudelo C, Villareal E, Cáceres E, López C, Eljach J, Ramírez N, et al . Human and dogs Toxocara canis infection in a poor neighborhood in Bogotá. Mem Inst Oswaldo Cruz. 1990;85:75-8. http://dx.doi.org/10.1590/S0074-02761990000100012 [ Links ]
23. Acero M, Muñoz M, Flórez A, Nicholls R. Seroprevalencia de anticuerpos contra Toxocara canis y factores de riesgo en niños. Ciudad Bolívar, Bogotá, DC, 2001. Biomédica. 2001;21:256-63. http://dx.doi.org/10.7705/biomedica.v21i3.1116 [ Links ]
24. Flórez A, Correa M. Situación de la toxocariasis en Colombia, enero de 1996, enero de 2002. Inf Quinc Epidemiol Nac. 2002;7:375-84. Fecha de consulta: 10 de julio de 2015. Disponible en: http://www.ins.gov.co/iqen/IQUEN/IQEN%20vol%2007%202002%20num%2020.pdf. [ Links ]
25. Fillaux J, Magnaval JF. Laboratory diagnosis of human toxocariasis. Vet Parasitol. 2013;193:327-36. http://dx.doi.org/10.1016/j.vetpar.2012.12.028 [ Links ]
26. Roldán WH, Espinoza YA, Huapaya PE, Jiménez S. Diagnóstico de la toxocarosis humana. Rev Peru Med Exp Salud Pública. 2010;27:613-20. http://dx.doi.org/10.1590/S1726-46342010000400019 [ Links ]
27. Moreira GMSG, Telmo P de L, Mendonça M, Moreira ÂN, McBride AJA, Scaini CJ, et al . Human toxocariasis: Current advances in diagnostics, treatment, and inter-ventions. Trends Parasitol. 2014;30:456-64. http://dx.doi.org/10.1016/j.pt.2014.07.003 [ Links ]
28. Lee S-U, Yu J-R, Huh S. Ultrastructural localization of Toxocara canis larval antigen reacted with a seropositive human serum. Korean J Parasitol. 2009;47:65-8. http://dx.doi.org/10.3347/kjp.2009.47.1.65 [ Links ]
29. Yamasaki H, Araki K, Lim PK, Zasmy N, Mak JW, Taib R, et al. Development of a highly specific recombinant Toxocara canis second-stage larva excretory-secretory antigen for immunodiagnosis of human toxocariasis. J Clin Microbiol. 2000;38:1409-13. [ Links ]
30. Mohamad S, Azmi NC, Noordin R. Development and evaluation of a sensitive and specific assay for diagnosis of human toxocariasis by use of three recombinant antigens (TES-26, TES-30USM, and TES-120). J Clin Microbiol. 2009;47:1712-7. http://dx.doi.org/10.1128/JCM.00001-09 [ Links ]
31. Noordin R, Smith HV, Mohamad S, Maizels RM, Fong MY. Comparison of IgG-ELISA and IgG4-ELISA for Toxocara serodiagnosis. Acta Trop. 2005;93:57-62. http://dx.doi.org/10.1016/j.actatropica.2004.09.009 [ Links ]
32. Sambrook J, W Russell D. Molecular cloning: A laboratory manual. Cold Spring Harbor, NY: Cold Spring Harb Lab Press; 2001. p. 999. [ Links ]
33. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970;227:680-5. http://dx.doi.org/10.1038/227680a0 [ Links ]
34. Maizels RM, de Savigny D, Ogilvie BM. Characterization of surface and excretory-secretory antigens of Toxocara canis infective larvae. Parasite Immunol. 1984;6:23-37. [ Links ]
35. Badley JE, Grieve RB, Bowman DD, Glickman LT, Rockey JH. Analysis of Toxocara canis larval excretory-secretory antigens: Physicochemical characterization and antibody recognition. J Parasitol. 1987;73:593-600. http://dx.doi.org/10.2307/3282142 [ Links ]
36. Tetteh KK, Loukas A, Tripp C, Maizels RM. Identification of abundantly expressed novel and conserved genes from the infective larval stage of Toxocara canis by an expressed sequence tag strategy. Infect Immun. 1999;67:4771-9. [ Links ]
37. Wickramasinghe S, Yatawara L, Nagataki M, Takamoto M, Watanabe Y, Rajapakse RP, et al . Development of a highly sensitive IgG-ELISA based on recombinant arginine kinase of Toxocara canis for serodiagnosis of visceral larva migrans in the murine model. Parasitol Res. 2008;103:853-8. http://dx.doi.org/10.1007/s00436-008-1067-4 [ Links ]
38. Norhaida A, Suharni M, Liza AT, Tuda J, Rahmah N. rTES-30USM: Cloning via assembly PCR, expression, and evaluation of usefulness in the detection of toxocariasis. Ann Trop Med Parasitol. 2008;102:151-60. http://dx.doi.org/10.1179/136485908X252250 [ Links ]
39. Maizels RM, Kennedy MW, Meghji M, Robertson BD, Smith HV. Shared carbohydrate epitopes on distinct surface and secreted antigens of the parasitic nematode Toxocara canis . J Immunol. 1987;139:207-14. [ Links ]
40. Meghji M, Maizels RM. Biochemical properties of larval excretory-secretory glycoproteins of the parasitic nematode Toxocara canis. Mol Biochem Parasitol. 1986;18:155-70. http://dx.doi.org/10.1016/0166-6851(86)90035-6 [ Links ]













