Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.36 no.1 Bogotá Jan./Mar. 2016
https://doi.org/10.7705/biomedica.v36i1.2795
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v36i1.2795
1 Facultad de Medicina, Universidad Militar Nueva Granada, Bogotá, D.C., Colombia
2 Grupo Insight, Universidad Militar Nueva Granada, Bogotá, D.C., Colombia
Contribución de los autores:Ricardo A. Cifuentes: concepción del proyecto, genotipificación y análisis de datos
Todos los autores participaron en la captación de los pacientes, la recolección de datos, la interpretación de los resultados y la escritura del manuscrito.
Recibido: 13/04/15; aceptado: 31/07/15
Introducción. La validación de los factores predictores de la sensibilidad a la warfarina es importante para evitar las hemorragias asociadas con la terapia anticoagulante. En los estudios previos hechos en Colombia con polimorfismos de los genes VKORC1 y CYP2C9 , se reportaban algoritmos con rendimientos diferentes para explicar la variación de las dosis, pero no se evaluaba la predicción de la sensibilidad a la warfarina.
Objetivo. Determinar la exactitud del análisis farmacogenético de los polimorfismos *2 y *3 en el gen CYP2C9 y 1639G>A en el gen VKORC1 para predecir la sensibilidad a la warfarina en pacientes del Hospital Militar Central, un centro de referencia que atiende pacientes de diferentes lugares de Colombia.
Materiales y métodos. Se recopilaron los datos demográficos y clínicos de 130 pacientes que habían recibido una dosis estable de warfarina durante más de dos meses. Se obtuvieron sus genotipos mediante un análisis de curvas de fusión , y, después de verificar el equilibrio de Hardy-Weinberg de los polimorfismos, se hizo un análisis estadístico con enfoque multivariado y predictivo.
Resultados. Se construyó un modelo farmacogenético que explicó el 52,8 % de la variación de la dosis (p<0,001), solo 4 % por encima del rendimiento obtenido con los mismos datos usando el algoritmo del International Warfarin Pharmacogenetics Consortium . El modelo predictivo de sensibilidad logró 77,8 % de exactitud e incluyó como factores la edad (p=0,003), los polimorfismos *2 y *3 (p=0,002) y el polimorfismo 1639G>A (p<0,001).
Conclusiones. Estos resultados en una población mestiza colombiana respaldan la validez de la predicción de la sensibilidad a la warfarina basada en los polimorfismos de los genes VKORC1 y CYP2C9.
Palabras clave: farmacogenética, warfarina, algoritmos, pruebas genéticas, validez de las pruebas, origen étnico y salud.
doi: http://dx.doi.org/10.7705/biomedica.v36i1.2795
Prediction of sensitivity to warfarin based on VKORC1 and CYP2C9 polymorphisms in patients from different places in Colombia
Introduction: In the search to prevent hemorrhages associated with anticoagulant therapy, a major goal is to validate predictors of sensitivity to warfarin. However, previous studies in Colombia that included polymorphisms in the VKORC1 and CYP2C9 genes as predictors reported different algorithm performances to explain dose variations, and did not evaluate the prediction of sensitivity to warfarin.
Objective: To determine the accuracy of the pharmacogenetic analysis, which includes the CYP2C9 *2 and *3 and VKORC1 1639G>A polymorphisms in predicting patients´ sensitivity to warfarin at the Hospital Militar Central , a reference center for patients born in different parts of Colombia.
Materials and methods: Demographic and clinical data were obtained from 130 patients with stable doses of warfarin for more than two months. Next, their genotypes were obtained through a melting curve analysis. After verifying the Hardy-Weinberg equilibrium of the genotypes from the polymorphisms, a statistical analysis was done, which included multivariate and predictive approaches.
Results: A pharmacogenetic model that explained 52.8% of dose variation (p<0.001) was built, which was only 4% above the performance resulting from the same data using the International Warfarin Pharmacogenetics Consortium algorithm. The model predicting the sensitivity achieved an accuracy of 77.8% and included age (p=0.003), polymorphisms *2 and *3 (p=0.002) and polymorphism 1639G>A (p<0.001) as predictors.
Conclusions: These results in a mixed population support the prediction of sensitivity to warfarin based on polymorphisms in VKORC1 and CYP2C9 as a valid approach in Colombian patients.
Key words: Pharmacogenetics, warfarin, algorithms, genetic testing, validity of tests, ethnicity and health.
doi: http://dx.doi.org/10.7705/biomedica.v36i1.2795
La warfarina es el anticoagulante más extensamente empleado para la prevención de episodios de trom boembolia (1,2). Actúa disminuyendo la activación de los factores de coagulación dependientes de la vitamina K al inhibir su enzima epóxido reductasa (3). Se caracteriza por una amplia variación en la respuesta individual y por tener un índice terapéutico estrecho que implica un riesgo significativo de tromboembolia, si las dosis son inferiores a la adecuada, o de sangrado, en caso de sobredosis (4). En consecuencia, la dosis que puede generar efectos adversos como los mencionados es cercana a la dosis terapéutica efectiva, la cual se establ ece al obtener una razón normalizada internacional ( International Normalized Ratio , INR) entre dos y tres (2).
El proceso de degradación de los factores de coagulación activados con la warfarina toma de cinco a siete días, por lo que cuando se requiere un efecto anticoagulante rápido se administra también heparina durante cuatro o más días (5). En contraste, el control del alto riesgo de hemorragia debido a la anticoagulación excesiva constituye un reto, y se ha reportado sangrado abundante en, aproximadamente, 12 % de los pacientes tratados con warfarina (6) y una frecuencia de sangrado con consecuencias fatales en 10 % de ellos (7 ). Los efectos de la hemorragia cerebral asociada con el uso de anticoagulantes son devastadores, pues ocasionan la muerte en la mitad de los pacientes y discapacidad permanente en la mayoría de los que sobreviven (8).
Dado que al administrar el tratamiento con una dosis fija de warfarina es difícil predecir el nivel de anticoagulación, se ha buscado optimizar su manejo (9), para lo cual se han propuesto algoritmos basados en parámetros clínicos como la edad, el peso y la talla, pero estos son inexactos y explican únicamente de 12 a 22 % de la variación de la dosis (10). Por este motivo, se ha recurrido a la evaluación de factores genéticos, principalmente en los genes que codifican la isoforma 2C9 del citocromo P450 en el gen CYP2C9 y la epóxido reductasa de la vitamina K en el gen VKORC1 , los cuales afectan las propiedades farmacocinéticas y farmacodinámicas de la warfarina (11).
El gen CYP2C9 tiene más de 30 variantes alélicas. Los individuos homocigóticos para el alelo de referencia ( CYP2C9*1 ) tienen un "metabolismo normal" de la S-warfarina, la forma más potente de este medicamento. Los dos alelos más frecuentes, el *2 (polimorfismo rs1799853) y el *3 (rs1057910), tienen una actividad enzimática reducida para la excreción del medicamento, lo que conlleva una disminución de alrededor del 30 y 80 %, respectivamente (2). Por otra parte, la enzima codificada por el VKORC1 cataliza la reducción del epóxido de la vitamina K a vitamina K, paso necesario para activar los factores de coagulación. Su polimorfismo -1639G>A (rs9923231) se asocia con la sensibilidad a la warfarina y la disminución de la cantidad requerida (2). Se ha observado una asociación preferencial con la cromatina activa del alelo G en la posición -1639 del VKORC1 , mientras que el alelo menor A en esta misma posición genera un sitio de unión E-box de tipo supresor, lo que resulta en una menor síntesis de ARN (12).
En este contexto, la US Food and Drug Adminis-tration (FDA) aprobó la inclusión en el inserto del medicamento de un cuadro de dosificación que recomienda tener en cuenta los polimorfismos -1639G>A en el gen VKORC1 y *2 y *3 en el gen CYP2C9 , para fijar la dosis inicial (13). También, se han propuesto algoritmos farmacogenéticos que tienen en cuenta tanto los polimorfismos genéticos como las variables clínicas para predecir la dosis, los cuales parecen tener una mayor exactitud que las tablas (14). Estos algoritmos explican alrededor de 50 % de la variación de la dosis (10,14), con mayor beneficio en los extremos de la dosificación, es decir, los pacientes sensibles, que requieren dosis de 21 mg por semana o menos, y los resistentes, que requieren 49 mg por semana o más (15).
Sin embargo, algoritmos como el del International Warfarin Pharmaceutical Consensus , IWPC, no siempre predicen con exactitud, a pesar de haberse formulado con base en información de diversas poblaciones de Asia, Europa, Norteamérica y Brasil en Latinoamérica (15). Un ejemplo de ello fue la menor exactitud de predicción del algoritmo del IWPC en una muestra de pacientes egipcios (16). Incluso en grupos étnicos como los han de China, ha sido necesario incluir otras variables predictoras como el gen CYP4F2 (17). La situa ción se complica en poblaciones muy mezcladas, como la latinoamericana, en la cual la contribución relativa de africanos, amerindios y europeos varía de acuerdo con circunstancias históricas (18). No parece haber, entonces, una única fórmula idónea, por lo que deben considerarse los factores locales a la hora de escoger el algoritmo farmacogenético más apropiado (19). En dos estudios en Colombia, por ejemplo, se han reportado algoritmos que explican un porcentaje diferente de la variación de la dosis: 38,2 % (20) y 47,4 % (21), y cuyo rendimiento predictivo no se evaluó en una muestra diferente de aquella en la que fueron generados.
Dada la creciente necesidad de mejorar la detec ción de pacientes que requieren dosis bajas de warfarina antes de iniciar su administración, y de minimizar la incidencia de efectos adversos serios como las hemorragias (22) y sus graves consecuencias individuales y socioeconómicas, y considerando, además, la falta de un análisis predictivo y de las diferencias en los porcentajes de variación de la dosis, el propósito del presente estudio fue determinar la exactitud de la predicción de la sensibilidad a la warfarina en pacientes colombianos que asistían a la consulta externa del Hospital Militar Central, el cual es un centro de referencia nacional que atiende pacientes nacidos en diferentes lugares del país.
Materiales y métodos
Pacientes
Con la aplicación Stat Calc de EpiInfo se determinó una muestra de 130 pacientes con poder suficiente para detectar la asociación entre el gen VKORC1 y la sensibilidad a la warfarina. Se tuvo en cuenta un nivel de confianza de 95 %, un poder de 80 %, y con base en datos previos sobre la población colombiana (21), una razón de 0,58 entre expuestos y no expuestos a genotipos con mutación en la posición -1639 del VKORC1 , la cual predispone a la sensibilidad (prevalencia de 64 %), y una diferencia en el porcentaje de la varianza de la dosis de warfarina de 22,8 % en los casos en los que se presentaba un reemplazo de guanina por adenina en la posición -1639 del VKORC1 .
Una vez verificada la ausencia de criterios de exclusión (menor de 18 años, embarazo, enfer medad renal, hepática o tiroidea causante de descompensación, síndrome de malabsorción intestinal, alcoholismo o cáncer), y una vez firmado el consentimiento informado, se incluyeron en orden consecutivo los pacientes que asistían al servicio de consulta externa del Hospital Militar Central en Bogotá y que presentaban valores de INR que permitían una dosificación estable durante más de dos meses con el mismo tipo de warfarina (de marca o genérica). El consentimiento informado fue aprobado previamente por el Comité de Ética independiente del Hospital Militar Central.
Recolección de datos
Los pacientes fueron entrevistados durante su visita al servicio de consulta externa del Hospital Militar Central para obtener sus datos demo gráficos y clínicos. El registro de cada paciente incluía la edad, el sexo, el origen, la dosis y el tipo de warfarina (genérica o de marca), los valores de INR, la razón para el uso de la warfarina, las enfermedades concomitantes, otros medicamentos prescritos, y el peso y la talla, datos estos que fueron verificados revisando la historia clínica. Estos registros se almacenaron en una base de datos elaborada en MySQL, lo que permitió el anonimato del paciente al asignar automáticamente un número a cada uno.
Genotipificación
Se obtuvo el ADN a partir de 5 ml de sangre completa de cada paciente mediante el método de extracción por columnas High Pure PCR Template Preparation Kit ® de Roche. Luego se detectaron el polimorfismo -1639G>A en el gen VKORC1 y los polimorfismos 430C>T (*2) y 1075A>C (*3) en el gen CYP2C9 mediante PCR en tiempo real, utilizando el sistema fluores cente LightMix ® de Roche, como se ha descrito previamente (23,24). En resumen, durante la amplificación de fragmentos específicos de 289 pares de bases para el VKORC1 y de 374 y 180 pares de bases para el CYP2C9 , se logró la hibridación de las sondas fluorogénicas . Los polimorfismos se detectaron como un cambio en la temperatura de fusión de la sonda hibridada. Posteriormente, los genotipos obtenidos se evaluaron mediante el análisis del equilibrio de Hardy-Weinberg utilizando para ello la prueba de ji al cuadrado. Los datos de la genotipificación se almacenaron bajo el número generado automáticamente por la base de datos.
Análisis estadístico
Se generó un archivo de cada paciente (sin los datos de identificación) y se hizo su análisis con el programa estadístico SPSS ® . Para la descripción general de las variables demográficas, clínicas y de los polimorfismos genéticos, se utilizaron frecuencias y porcentajes en el caso de variables cualitativas, en tanto que, para las variables cuantitativas, se emplearon la media, la mediana y los percentiles 25 a 75.
Se evaluó en la muestra de pacientes la posibilidad de encontrar una asociación entre la sensibilidad a la warfarina ( dosis semanal de 21 mg o menos), y la presencia de genotipos con la mutación -1639G>A en el VKORC1 mediante la obtención de la razón de momios ( odds ratio , OR) con un intervalo de confianza de 95 % (IC 95% ). Luego, se evaluó la asociación de las variables cualitativas dicotómicas con la dosis semanal de warfarina mediante la prueba t de Student para muestras independientes.
En el caso de las variables cualitativas con más de dos valores, se utilizó el ANOVA de un factor y la prueba de correlación coincidente de Bonferroni. Para la evaluación de la asociación entre las variables cuantitativas y la dosis semanal de warfarina, se hizo un análisis de regresión lineal simple. Para el análisis multivariado de los factores que influyen sobre la dosis de warfarina, se generó un modelo explicativo mediante una regresión lineal múltiple con el método de pasos sucesivos, y se validó el modelo ob tenido mediante bootstrap .
Por último, se hizo un análisis predictivo de la sensibilidad mediante un análisis ´discriminante´ según se ha descrito previamente (25). En resumen, inicialmente se seleccionaron las variables mediante la función CfsSubsetEval del programa Weka ® (26), la cual escoge el grupo de mayor correlación con sensibilidad a la warfarina, pero con la más baja correlación entre ellas. Con las variables seleccionadas se utilizó la función de análisis ´discriminante´, método de inclusión por pasos, del programa estadístico SPSS®, y así se construyó un modelo predictivo con el 70 % de los datos y se escogió aquel con mayor exactitud de acuerdo con la validación cruzada del tipo de "dejar-uno-afuera". El desempeño del modelo se evaluó en el 30 % restante de los datos para determinar su exactitud de predicción, sensibilidad, especificidad, y valor predictivo positivo y negativo.
Resultados
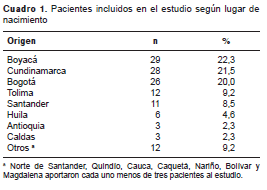
La mayoría de los pacientes eran oriundos de los departamentos de la región Andina de Colombia (cuadro 1). Su edad oscilaba entre los 28 y los 88 años, y 75 % era mayor de 58 años. El índice de masa corporal (IMC) fue indicativo de sobrepeso y 40 % de los pacientes correspondían a mujeres. El porcentaje de warfarina de origen genérico era similar al del medicamento de marca original, y la dosis era de alrededor de 25 mg por semana. El motivo más frecuente para la medicación fue la prótesis valvular cardiaca, seguida de trombosis venosa y fibrilación auricular. Además, los pacientes presentaron un alto porcentaje de enfermedades cardiovasculares y endocrino-metabólicas concomitantes (cuadro 2). Se observó más de una indicación de warfarina como en el caso de pacientes con trombosis venosa profunda y tromboembolia pulmonar; en algunos se presentó más de una enfermedad concomitante.

Algunas variables demográficas y clínicas mostra ron una asociación estadísticamente significativa con la dosis semanal de warfarina. Se observó la necesidad de una mayor dosis de warfarina cuanto mayor fuera la talla ( b =0,307; R 2 =0,047; p<0,01) y el peso ( b =0,156; R 2 =0,025; p=0,04). Por el contrario, a mayor edad se requirió una menor dosis de warfarina ( b =-0,29; R 2 =0,099; p<0,01). También, se observó que se requería una menor dosis en pacientes medicados debido a fibrilación auricular (dosis promedio de 22,2 Vs . 29,59 mg/semana; p=0,01).
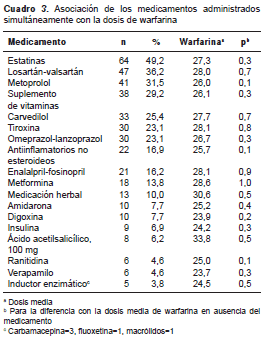
No hubo una asociación estadísticamente significativa entre la dosis de warfarina y los medicamentos administrados simultáneamente (cuadro 3). De estos, los más frecuentemente administrados fueron las estatinas, cuya acción altera la concentración de fármacos como la warfarina (27). La mayoría de los pacientes tomaban atorvastatina (no se presentan los datos), con la cual no se ha documentado el típico efecto potenciador de otras estatinas como la rosuvastatina, la lovastatina y la fluvastatina (28,29). Por otra parte, se observó que se requería una menor dosis de warfarina con la administración simultánea de amiodarona, medicamento inhibidor de su destrucción, pero dicha asociación no alcanzó la significancia estadística (promedio semanal de 25,2 mg Vs. 28,3 mg; p=0,4).
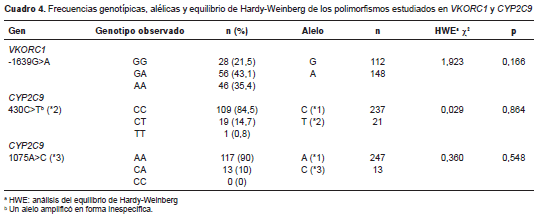
Con respecto a los genotipos estudiados, la distribución de su frecuencia no difirió de lo esperado según el equilibrio de Hardy-Weinberg, como se apreció con el resultado de la prueba de ji al cuadrado (cuadro 4), lo que permitió el análisis de los tres polimorfismos propues tos . Además, la muestra de 130 pacientes fue suficiente para detectar la sensibilidad a la warfarina asociada a los genotipos con la mutación -1639G>A en VKORC1 (OR=8,04; IC 95% 1,8-35,8).
El análisis de la asociación de los genotipos con la dosis de warfarina evidenció que los pacientes homocigóticos para el alelo AA en la posición -1639 del VKORC1 necesitaban una menor dosis promedio (19,3 mg/semana) que los heterocigótic os GA (31,3 mg/semana; p<0,01), y estos, a su vez, una menor dosis que los homocigóticos para el alelo silvestre GG (37,5 mg/semana; p=0,018).
Con respecto al gen CYP2C9 , los pacientes con el genotipo heterocigótico CA (*1*3) en la posición 1075 necesitaron una menor dosis promedio de warfarina que quienes tenían el genotipo silvestre AA (21,1 Vs . 29,2 mg/semana, p=0,019); en la muestra no hubo pacientes con genotipo doble mutado CC (*3*3). En el caso del polimorfismo en la posición 430 del CYP2C9 , solo un paciente era homocigótico TT (*2*2) para el alelo mutado, y aquellos heterocigóticos CT (*1*2) no requirieron una dosis significativamente diferente a la de los pacientes con el genotipo silvestre CC (27,2 Vs . 28,6 mg/semana; p=0,632). Sin embargo, la presencia simultánea de mutación en la posición 430 (*2) y en la 1075 (*3) del CYP2C9 , se asoció a una menor dosis promedio de warfarina en comparación con la presencia de una sola mutación (9,7 Vs . 27,2 mg por semana; p=0,04).
Al analizar los dos genes en conjunto, se apreció que la dosis de warfarina disminuyó a medida que aumentaba el número de mutaciones en el VKORC1 , y que los pacientes que tenían mutaciones en las dos posiciones analizadas del CYP2C9 (*2 y *3) simultáneamente, requerían las menores dosis. Igualmente, hubo una tendencia a menores dosis en presencia de mutación en una de las dos posiciones del CYP2C9 además de la mutación en la posición -1639 del VORC1 , especialmente en el caso del genotipo homocigó tico mutado AA (figura 1).
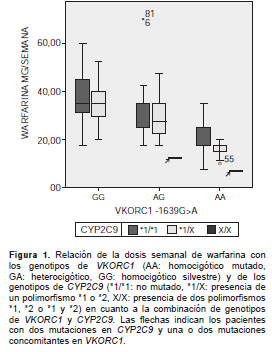
Se observaron, igualmente, algunos casos extremos ( outliers ), que evidenciaron que los polimorfismos no explican la totalidad de la variación en la dosis. Hubo dos individuos que recibían una dosis alta de 70 mg a la semana de warfarina y presentaban los alelos silvestres en las dos posiciones en el CYP2C9 , pero una mutación en el VKORC (señalados con asterisco en el figura 1). Se trataba de pacientes con edades por debajo del promedio del grupo estudiado, sin medicación concomitante inductora o inhibidora del procesamiento de la warfarina, uno con trombosis venosa por hiper-coagulabilidad de base y otro con una prótesis valvular cardiaca .
El análisis multivariado permitió obtener un modelo que explicaba 52,8 % de la variación de la dosis (R 2 =0,528; p<0,001). Como variable dependiente se tomó la raíz cuadrada de la dosis, pues se ajustaba mejor que la dosis no transformada a la distribución normal. Como variables indepen dientes, la trombosis venosa como indicación y el peso aumentaban la dosis de warfarina, mientras que otras, como la edad en años y los polimorfismos en los genes VKORC1 y CYP2C9 , la disminuían (el bootstrap de 1.000 replicaciones ratificó la significancia estadística de los coeficientes obtenidos) (cuadro 5). Las variables de talla y fibrilación auricular no fueron tenidas en cuenta por el modelo, pues en conjunto no influían de forma significativa sobre la dosis de warfarina, aunque sí lo hacían consideradas individualmente.
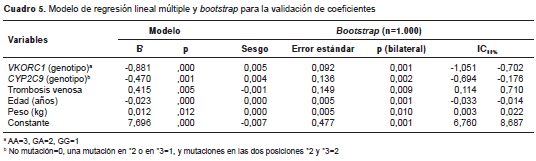
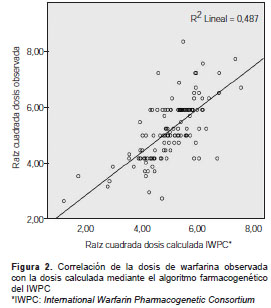
En la comparación con el algoritmo que explicaba el mayor porcentaje de la variación de la dosis en Colombia (21) y con la predicción del IWPC (obtenida mediante validación cruzada y evaluada con datos no utilizados para generar el algoritmo) (15), el modelo incluyó también las variables de edad y de los polimorfismos en los genes VKORC1 y CYP2C9, pero no las variables de inductor enzimático, inhibidor enzimático y talla (esta última solo presente en el algoritmo del IWPC). La raza es una variable incluida por el IWPC, pero no se calificó en la presente investigación debido a la alta posibilidad de error por tratarse de una población tan mezclada. Se evalúo la capacidad de predicción del algoritmo del IWPC comparando las dosis calculadas con las reales. Se encontró que, a pesar de haber sido desarrollado para otras poblaciones, en la muestra de pacientes de este estudio el algoritmo del IWPC predijo un valor solo cuatro puntos porcentuales por debajo del máximo obtenido mediante el modelo explicativo con mayor rendimiento (R2=0,48; p<0,001) (figura 2).
Por último, se generó un modelo predictivo de sensibilidad a la warfarina con una exactitud de predicción de 77,8 %, que incluyó tres variables: la edad (p=0,003), los polimorfismos *2 y *3 del CYP2C9 (p=0,002), y el polimorfismo 1639G>A en el VKORC1 ( p<0,001). El modelo comprendió dos algoritmos: sensible = 0,555, edad + 8,839, VKORC1 + 6,154, CYP2C9 - 35,052; y no sensible = 0,468, edad + 5,942, VKORC1 + 3,457, CYP2C9 - 21,447.
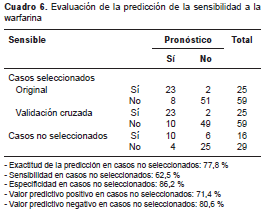
Cada sujeto se asignó al grupo para el cual obtuvo un mayor puntaje. La edad se midió en años, y se asignó un puntaje según el genotipo del VKORC1 (AA=3, GA=2, GG=1) y un puntaje para cada una de las combinaciones de mutaciones en el CYP2C9 (0=no mutación; 1=una mutación en *2 o en *3; y 2=mutaciones en las dos posiciones, *2 y *3). De acuerdo con el valor de sensibilidad obtenido con este algoritmo, 62,5 % de los pacientes sensibles que recibiría la dosis estándar se beneficiaría de una dosis menor, con lo que disminuiría el riesgo de un mayor efecto adverso serio, es decir, la hemorragia (cuadro 6).
Discusión
En el presente estudio se encontró que en pacientes nacidos en diversos lugares del país, principalmente en la región Andina, el análisis farmacogenético basado en los polimorfismos 430C>T, 1075A>C en el gen CYP2C9 y -1639G>A en el VKORC1 , permitió explicar un porcentaje de la variación en la dosis de warfarina similar al encontrado con el IWPC en poblaciones de cinco continentes, con una exactitud de predicción de la sensibilidad a este medicamento de 77,8 %.
La presente investigación respalda la aplicabilidad del análisis farmacogenético para el manejo de la warfarina en un gran porcentaje de la población colombiana. La región Andina se caracteriza por el predominio de individuos caucásicos mestizos (30), que según las estimaciones corresponden a 85,9 % de los habitantes de Colombia (31). Por otra parte, a pesar de pequeñas diferencias, el porcentaje de genotipos con el polimorfismo en forma heterocigótica u homocigótica en la posición -16 39 del VKORC1 , fue similar al publicado en estudios llevados a cabo en población colombiana de Bogotá, Risaralda (21), y Antioquia (20 ). Lo mismo se observó con los polimorfismos en el gen CYP2C9 . Cabe mencionar que estas frecuencias fueron también similares a las reportadas en el estudio del IWPC (15).
Considerando que el inicio de la medicación con warfarina se asocia con respuestas muy variables según los individuos, y que pueden producirse efectos adversos (32), en la presente investigación se confirmó la validez del algoritmo del IWPC para ajustar la dosis de warfarina en pacientes colombianos. Debe recordarse que el algoritmo del IWPC demostró un mejor desempeño en los extremos de la dosificación: sensibilidad o resistencia (15). Sin embargo, el hecho de que explica apenas la mitad de la variación de la dosis de warfarina, aproximadamente, deja un amplio margen de error, por lo que deberá considerarse la inexactitud si se decide usar el genotipo para ajustar la dosis cuando comienza la administración de warfarina.
En estas circunstancias, el enfoque encaminado a detectar pacientes sensibles al medicamento, permitiría un manejo más adecuado, con la consecuente disminución del riesgo de hemorragia en 62,5 % de ellos , los cuales, de otra manera, r ecibirían una dosis estándar del medicamento. No obstante, teniendo en cuenta que el valor predictivo positivo alcanzó 71,4 % (cuadro 6), en la predicción de la sensibilidad deben considerarse medidas como el uso simultáneo de anticoagulantes de otro tipo, como la heparina, al iniciar el tratamiento con dosis bajas. Por otra parte, dado el valor predictivo negativo de 80,6 % (cuadro 6), cuando la prueba determina que no hay sensibilidad, se justifica un seguimiento estricto de la INR al comienzo del tratamiento.
Debe mencionarse que el algoritmo obtenido para predecir la sensibilidad a la warfarina coincidió con el de publicaciones previas en el sentido de que, a mayor edad o mayor número de mutaciones en el VKORC1 o el CYP2C9, mayor es la probabilidad de encontrar sensibilidad. Un estudio similar en una cohorte de 4.272 pacientes, cuyo objetivo era minimizar la incidencia de sangrado, identificó las mismas características asociadas a la sensibilidad a la warfarina, además del uso de amiodarona (22).
Debe recordarse que en esta investigación la amiodarona se asoció con menores dosis de warfarina, pero sin lograr niveles significativos. La muestra analizada, diseñada para detectar la asociación entre la sensibilidad y los genotipos del VKORC1 , parece tener poco poder para detectar asociaciones significativas entre otros medicamentos administrados y la dosis de warfarina. Además, el número mucho mayor de prescripciones que de pacientes evidenció el típico uso de múltiples medicamentos en estos casos y, en algunos, la prescripción simultánea de inductores de la destrucción de la warfarina, como la carbamacepina, y de potenciadores de su acción, como la propafenona (33), lo que hace más difícil la detección del efecto específico de algunos fármacos.
Con este panorama, a pesar de que el VKORC1 se considera el principal modulador genético de las diferencias étnicas en la reacción a la warfarina, y se conoce su utilidad para explicar la reacción a este medicamento en pacientes con diferentes ancestros (34,35), no debe descartarse la posibilidad de mejorar la predicción teniendo en cuenta aspectos específicos de cada población.
Reportes recientes indican que la utilidad de los algoritmos farmacogenéticos podría ser mayor si se logra un mejor control de las variables clínicas. En sujetos sanos, con menos variables clínicas, los polimorfismos en los genes CYP2C9 y VKORC1 han permitido explicar un mayor porcentaje de variación en la dosis, alrededor de 62 % (36). Debe recordarse que la inclusión de la trombosis venosa mejoró el desempeño del algoritmo explicativo en la presente investigación, lo que demuestra la importancia de considerar la razón de la medicación con warfarina cuando se fija su dosis. Tampoco deben olvidarse la dieta, los suplementos dietéticos y la medicación simultánea con posibles o probables inhibidores y potenciadores (37). El aumento del riesgo de hemorragia con fármacos de uso común, como la aspirina, los antiinflamatorios no esteroideos, la penicilina en altas dosis (5,38) e, incluso, las interacciones con medicamentos de tipo herbal (39), debe tomarse en cuenta para mejorar la predicción cuando se trata de un paciente medicado con warfarina en un ámbito clínico local.
En resumen, los resultados de la presente inves tigación demuestran una vez más la utilidad de los genotipos estudiados en la predicción de la sensibilidad a la warfarina en Colombia, especialmente si el propósito es disminuir los efectos adversos de tipo hemorrágico al iniciar el tratamento. Actualmente hay estudios en diversas poblaciones que han demostrado una reducción de efectos adversos serios (40), una menor incidencia de anticoagulación excesiva (INR=4) (9,40), un menor porcentaje de INR fuera del rango (40) e, incluso, la disminución del tiempo para alcanzar la dosis terapéutica con la consecuente reducción del riesgo de tromboembolia (9,40,41).
Al Hospital Militar Central, por la aprobación del proyecto, y a su equipo de laboratorio, farmacia, cardiología y enfermeras de consulta externa, por su apoyo en la ejecución. Al Instituto de Biotecnología de la Universidad Nacional de Colombia, por facilitar el uso del equipo de PCR en tiempo real para la presente investigac ión.
Los autores declaran no tener conflicto de intereses .
Este trabajo se llevó a cabo en el marco del proyecto MED-1329 financiado por la Universidad Militar Nueva Granada.
Correspondencia: Ricardo Antonio Cifuentes, Transversal 3 N° 49-00, Facultad de Medicina, Universidad Militar Nueva Granada, Bogotá, D.C., Colombia
Teléfono: (571) 650 0000, extensión 2033 ricardo.cifuentes@unimilitar.edu.co
1. Carlquist JF, Horne BD, Muhlestein JB, Lappe DL, Whiting BM, Kolek MJ, et al . Genotypes of the cytochrome p450 isoform, CYP2C9 , and the vitamin K epoxide reductase complex subunit 1 conjointly determine stable warfarin dose: A prospective study. J Thromb Thrombolysis. 2006;22: 191-7. http://dx.doi.org/10.1007/s11239-006-9030-7 [ Links ]
2. Johnson JA, Gong L, Whirl-Carrillo M, Gage BF, Scott SA, Stein CM, et al . Clinical Pharmacogenetics Implementation Consortium Guidelines for CYP2C9 and VKORC1 genotypes and warfarin dosing. Clin Pharmacol Ther. 2011;90:625-9. http://dx.doi.org/10.1038/clpt.2011.185 [ Links ]
3. Stehle S, Kirchheiner J, Lazar A, Fuhr U. Pharmacogenetics of oral anticoagulants: A basis for dose individualization. Clin Pharmacokinet. 2008;47:565-94. [ Links ]
4. Kamali F, Wynne H. Pharmacogenetics of warfarin. Annu Rev Med. 2010;61:63-75. http://dx.doi.org/10.1146/annurev.med.070808.170037 [ Links ]
5. Hirsh J, Fuster V, Ansell J, Halperin JL. American Heart Association/American College of Cardiology Foundation guide to warfarin therapy. Circulation. 2003;107:1692-711. http://dx.doi.org/10.1161/01.CIR.0000063575.17904.4E [ Links ]
6. Li T, Lange LA, Li X, Susswein L, Bryant B, Malone R, et al . Polymorphisms in the VKORC1 gene are strongly associated with warfarin dosage requirements in patients receiving anticoagulation. J Med Genet. 2006;43:740-4. http://dx.doi.org/10.1136/jmg.2005.040410 [ Links ]
7. Bilen O, Teruya J. Complications of anticoagulation. Dis Mon. 2012;58:440-7. http://dx.doi.org/10.1016/j.disamonth.2012.04.002 [ Links ]
8. Goldstein JN, Rosand J, Schwamm LH. Warfarin reversal in anticoagulant-associated intracerebral hemorrhage. Neurocrit Care. 2008;9:277-83. http://dx.doi.org/10.1007/s12028-008-9049-z [ Links ]
9. Pirmohamed M, Burnside G, Eriksson N, Jorgensen AL, Toh CH, Nicholson T, et al . A randomized trial of genotype- guided dosing of warfarin. N Engl J Med. 2013;369:2294-303. http://dx.doi.org/10.1056/NEJMoa1311386 [ Links ]
10. Gage BF, Eby C, Johnson JA, Deych E, Rieder MJ, Ridker PM, et al . Use of pharmacogenetic and clinical factors to predict the therapeutic dose of warfarin. Clin Pharmacol Ther. 2008;84:326-31 . http://dx.doi.org/10.1038/clpt.2008.10 [ Links ]
11. Wadelius M, Pirmohamed M. Pharmacogenetics of warfarin: Current status and future challenges. Pharmacogenomics J. 2007;7:99-111. http://dx.doi.org/10.1038/sj.tpj.6500417 [ Links ]
12. Wang D, Chen H, Momary KM, Cavallari LH, Johnson JA, Sadee W. Regulatory polymorphism in vitamin K epoxide reductase complex subunit 1 ( VKORC1 ) affects gene expression and warfarin dose requirement. Blood. 2008;112:1013-21. http://dx.doi.org/10.1182/blood-2008-03-144899 [ Links ]
13. Dean L. Warfarin therapy and the genotypes CYP2C9 and VKORC1 . Medical genetics summaries. Bethesda, MD: National Center for Biotechnology Information; 2013. [ Links ]
14. Finkelman BS, Gage BF, Johnson JA, Brensinger CM, Kimmel SE. Genetic warfarin dosing: Tables versus algorithms. J Am Coll Cardiol. 2011;57:612-8. http://dx.doi.org/10.1016/j.jacc.2010.08.643 [ Links ]
15. Klein TE, Altman RB, Eriksson N, Gage BF, Kimmel SE, Lee MT, et al . Estimation of the warfarin dose with clinical and pharmacogenetic data. N Engl J Med. 2009;360:753-64. http://dx.doi.org/10.1056/NEJMoa0809329 [ Links ]
16. Bazan NS, Sabry NA, Rizk A, Mokhtar S, Badary O. Validation of pharmacogenetic algorithms and warfarin dosing table in Egyptian patients. Int J Clin Pharm. 2012;34:837-44. http://dx.doi.org/10.1007/s11096-012-9678-3 [ Links ]
17. Liang R, Li L, Li C, Gao Y, Liu W, Hu D, et al . Impact of CYP2C9 *3, VKORC1 -1639, CYP4F2rs2108622 genetic polymorphism and clinical factors on warfarin maintenance dose in Han-Chinese patients. J Thromb Thrombolysis. 2012;34:120-5. http://dx.doi.org/10.1007/s11239-012-0725-7 [ Links ]
18. Salzano FM. Interethnic variability and admixture in Latin America--social implications. Rev Biol Trop . 2004;52:405-15. [ Links ]
19. Roper N, Storer B, Bona R, Fang M. Validation and comparison of pharmacogenetics-based warfarin dosing algorithms for application of pharmacogenetic testing. J Mol Diagn. 2010;12:283-91 . http://dx.doi.org/10.2353/jmoldx.2010.090110 [ Links ]
20. Palacio L, Falla D, Tobón I, Mejía F, Lewis JE, Martínez AF, et al . Pharmacogenetic impact of VKORC1 and CYP2C9 allelic variants on warfarin dose requirements in a hispanic population isolate. Clin Appl Thromb Hemost. 2010;16:83-90. http://dx.doi.org/10.1177/1076029608330472 [ Links ]
21. Isaza C, Beltrán L, Henao J, Porras G, Pinzón A, Vallejos A, et al . Factores genéticos y ambientales asociados con la respuesta a warfarina en pacientes colombianos. Biomédica. 2010;30:410-20 . http://dx.doi.org/10.7705/biomedica.v30i3.275 [ Links ]
22. Saleh MI. Clinical predictors associated with warfarin sensitivity . Am J Ther. 2015. http://dx.doi.org/10.1097/MJT.0000000000000248 [ Links ]
23. Burian M, Grosch S, Tegeder I, Geisslinger G. Validation of a new fluorogenic real-time PCR assay for detection of CYP2C9 allelic variants and CYP2C9 allelic distribution in a German population. Br J Clin Pharmacol. 2002;54:518-21. http://dx.doi.org/10.1046/j.1365-2125.2002.01693.x [ Links ]
24. Veenstra DL, You JH, Rieder MJ, Farin FM, Wilkerson HW, Blough DK, et al . Association of vitamin K epoxide reductase complex 1 ( VKORC1 ) variants with warfarin dose in a Hong Kong Chinese patient population. Pharmacogenet Genomics. 2005;15:687-91. [ Links ]
25. Cifuentes RA, Barreto E. Supervised selection of single nucleotide polymorphisms in chronic fatigue syndrome. Biomédica. 2011;31:613-21 . http://dx.doi.org/10.1590/S0120-41572011000400017 [ Links ]
26. Frank E, Hall M, Trigg L, Holmes G, Witten IH. Data mining in bioinformatics using Weka. Bioinformatics. 2004;20:2479- 81. http://dx.doi.org/10.1093/bioinformatics/bth261 [ Links ]
27. Williams D, Feely J. Pharmacokinetic-pharmacodynamic drug interactions with HMG-CoA reductase inhibitors. Clin Pharmacokinet. 2002;41:343-70. http://dx.doi.org/10.2165/00003088-200241050-00003 [ Links ]
28. Andrus MR. Oral anticoagulant drug interactions with statins: Case report of fluvastatin and review of the literature. Pharmacotherapy. 2004;24:285-90. http://dx.doi.org/10.1592/phco.24.2.285.33137 [ Links ]
29. McKenney JM. Efficacy and safety of rosuvastatin in treatment of dyslipidemia. Am J Health Syst Pharm. 2005;62:1033-47. [ Links ]
30. Yunis JJ, Acevedo LE, Campo DS, Yunis EJ. Geno- geographic origin of Y-specific STR haplotypes in a sample of Caucasian-Mestizo and African-descent male individuals from Colombia. Biomédica. 2013;33:459-67. http://dx.doi.org/10.7705/biomedica.v33i3.807 [ Links ]
31. Departamento Administrativo Nacional de Estadística . Colombia una nación multicultural. Su diversidad étnica - 2007. Fecha de consulta: 14 de julio de 2015. Disponible en: https://www.dane.gov.co/files/censo2005/etnia/sys/colombia_nacion.pdf. [ Links ]
32. Flockhart DA, O´Kane D, Williams MS, Watson MS, Gage B, Gandolfi R, et al . Pharmacogenetic testing of CYP2C9 and VKORC1 alleles for warfarin. Genet Med. 2008;10:139- 50. http://dx.doi.org/10.1097/GIM.0b013e318163c35f [ Links ]
33. Holbrook AM, Pereira JA, Labiris R, McDonald H, Douketis JD, Crowther M, et al . Systematic overview of warfarin and its drug and food interactions. Arch Intern Med. 2005;165:1095-106. http://dx.doi.org/10.1001/archinte.165.10.1095 [ Links ]
34. Geisen C, Watzka M, Sittinger K, Steffens M, Daugela L, Seifried E, et al . VKORC1 haplotypes and their impact on the inter-individual and inter-ethnical variability of oral anticoagulation. Thromb Haemost. 2005;94:773-9. http://dx.doi.org/10.1160/TH05-04-0290 [ Links ]
35. Rieder MJ, Reiner AP, Gage BF, Nickerson DA, Eby CS, McLeod HL, et al . Effect of VKORC1 haplotypes on transcriptional regulation and warfarin dose. N Engl J Med. 2005;352:2285-93. http://dx.doi.org/10.1056/NEJMoa044503 [ Links ]
36. Kadian-Dodov DL, van der Zee SA, Scott SA, Peter I, Martis S, Doheny DO, et al . Warfarin pharmacogenetics: A controlled dose-response study in healthy subjects. Vasc Med. 2013;18:290-7. http://dx.doi. org/10.1177/1358863X13503193 [ Links ]
37. Nutescu E, Chuatrisorn I, Hellenbart E. Drug and dietary interactions of warfarin and novel oral anticoagulants: An update. J Thromb Thrombolysis. 2011;31:326-43. http://dx.doi.org/10.1007/s11239-011-0561-1 [ Links ]
38. Chan TY. Adverse interactions between warfarin and nonsteroidal antiinflammatory drugs: Mechanisms, clinical significance, and avoidance. Ann Pharmacother. 1995;29: 1274-83. [ Links ]
39. Izzo AA, Ernst E. Interactions between herbal medicines and prescribed drugs: An updated systematic review. Drugs. 2009;69:1777-98. http://dx.doi.org/10.2165/11317010-000000000-00000 [ Links ]
40. Motsinger-Reif AA, Wagner MJ. Clinical trial evidence of the promise of pharmacogenomics warfarin dosing algorithms. Pharmacogenomics. 2012;13:861-3. http://dx.doi.org/10.2217/pgs.12.65 [ Links ]
41. Wang M, Lang X, Cui S, Fei K, Zou L, Cao J, et al . Clinical application of pharmacogenetic-based warfarin-dosing algorithm in patients of Han nationality after rheumatic valve replacement: A randomized and controlled trial. Int J Med Sci. 2012;9:472-9. http://dx.doi.org/10.7150/ijms.4637 [ Links ]













