Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.36 no.2 Bogotá Apr./June 2016
https://doi.org/10.7705/biomedica.v36i2.2686
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v36i2.2686
1 Unidad de Investigaciones Biomédicas, Universidad de Ciencias Médicas de Villa Clara, Santa Clara, Cuba
2 Departamento de Anatomía Patológica, Hospital Universitario "Arnaldo Milián Castro", Santa Clara, Cuba
3 Departamento de Ciencias Morfológicas, Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón", La Habana, Cuba
Contribución de los autores:
Leticia Bequer y Tahiry Gómez: dirección de la investigación, protocolo de trabajo, trabajo de experimentación, análisis estadístico e informe de la investigación
José L. Molina: supervisión del trabajo de experimentación animal desde el punto de vista bioético y práctico, eutanasias y recolección de las muestras biológicas
Daniel Artiles y Rosa Bermúdez: estudio histopatológico de los páncreas
Sonia Clapés: interpretación de los resultados y revisión crítica del manuscrito
Recibido: 03/02/15; aceptado: 19/10/15
Introducción. El estudio de la diabetes mediante modelos experimentales es fundamental para entender los mecanismos fisiopatológicos de la enfermedad.
Objetivos. Comparar en ratas Wistar adultas la acción de inducción de la diabetes de la estreptozotocina según el momento y la vía de inoculación del fármaco durante el periodo neonatal mediante la evaluación de variables bioquímicas, metabólicas e histológicas.
Materiales y métodos. Se conformaron ocho grupos con ratas Wistar hembras recién nacidas (n=10). Se evaluó la inducción con estreptozotocina (100 mg/kg de peso corporal) según el día (segundo y quinto después del nacimiento) y la vía de inoculación (subcutánea o intraperitoneal). Los controles se inyectaron con solución tampón de citrato sódico. Durante 12 semanas se evaluaron la glucemia, el peso, y la cantidad de alimento y de agua consumida. Se hicieron pruebas de tolerancia a la glucosa oral, se evaluó la hemoglobina ´glicosilada´, y se hizo el estudio morfométrico e histopatológico del páncreas.
Resultados. Casi todos los animales inoculados con estreptozotocina en el quinto día murieron, en tanto que todos los inoculados en el segundo día sobrevivieron. La administración subcutánea de estreptozotocina en el segundo día produjo hiperglucemia, polifagia, polidipsia y disminución de la ganancia de peso corporal, así como alteración de los valores de hemoglobina ´glicosilada´ y en la prueba de tolerancia a la glucosa. Las lesiones histopatológicas del páncreas, así como la disminución del número de islotes, se observaron con mayor frecuencia con la estreptozotocina aplicada de forma subcutánea en el segundo día, lo cual corroboró que el efecto de este agente inoculado de forma subcutánea causa mayor daño.
Conclusiones. La inyección subcutánea de una dosis de 100 mg/kg de estreptozotocina en el segundo día después del nacimiento logró mayor efectividad en la inducción de diabetes moderada en ratas Wistar adultas.
Palabras clave: diabetes mellitus experimental, hiperglucemia, estreptozotocina, glucosa, ratas, islotes pancreáticos.
doi: http://dx.doi.org/10.7705/biomedica.v36i2.2686
Streptozotocin diabetogenic action in an experimental neonatal induction model
Introduction: The use of experimental models is essential to study the pathophysiological mechanisms of diabetes.
Objectives: To compare in adult Wistar rats the diabetogenic action of streptozotocin according to the moment and route of administration during the neonatal period by evaluating biochemical, metabolic and histological variables.
Materials and methods: Eight groups of neonatal female Wistar rats (n=10) were formed. We evaluated the induction with streptozotocin (100 mg/kg of body weight) on days 2 and 5 after birth, as well as the administration routes (subcutaneous or intraperitoneal). Controls were injected with sodium citrate buffer. Blood glucose level, body weight, food and water intake were monitored for 12 weeks. We also performed tolerance tests for oral glucose and glycosylated hemoglobin, and a histopathological pancreas morphometric study.
Results: The mortality rate was about 100% among rats given streptozotocin on their fifth day of life. All rats receiving the drug on day 2 of life survived, and they showed a marked hyperglycemia, polyphagia, polydipsia and decreased body weight gain in addition to increased glycosylated hemoglobin rates and impaired results in the oral glucose tolerance test. Histopathological lesions of the pancreas as well as a decreased number of islets were significantly more frequent in rats receiving the drug subcutaneously on day 2, which confirms that streptozotocin administered subcutaneously produces greater damage.
Conclusions: Subcutaneous injection of streptozotocin in a dose of 100 mg/kg of body weight in the second day after birth induced moderate diabetes in adult Wistar rats more effectively.
Key words: Diabetes mellitus, experimental, hyperglycemia, streptozotocin, glucose, rats, islets of Langerhans.
doi: http://dx.doi.org/10.7705/biomedica.v36i2.2686
La diabetes se ha convertido en un problema mundial de salud en este nuevo siglo. Se caracteriza por elevados niveles de glucosa en sangre debido a complejos procesos que involucran defectos en la secreción de insulina causados por la destrucción autoinmunitaria de las células β del páncreas (diabetes mellitus de tipo 1), así como el desarrollo progresivo de resistencia a la insulina en el hígado y los tejidos periféricos asociada a la disminución en la secreción de la hormona por parte de las células β pancreáticas (diabetes mellitus de tipo 2). Existen, además, otras formas frecuentes de diabetes como la de la gestación (1-3).
La diabetes de tipo 2 es la forma más común de la enfermedad. En el 2011, la Federación Internacional de Diabetes reportó que en ese momento cerca de 336 millones de personas sufrían la enfermedad, la cual, además de provocar aproximadamente 4,6 millones de fallecimientos cada año, disminuye considerablemente la calidad y la expectativa de vida de los pacientes, sin mencionar los elevados costos de los tratamientos (4). Como resultado de la hiperglucemia, las personas con diabetes de tipo 2 tienen un alto riesgo de complicaciones cardiovasculares, neurológicas y microvasculares. Estas últimas incluyen la pérdida de visión, la falla renal y la neuropatía periférica (4,5).
A pesar de que en la última década ha habido una ´explosión´ de información científica sobre los factores genéticos y ambientales que desencadenan los mecanismos bioquímicos involucrados en la enfermedad, así como sobre las complicaciones y los tratamientos, es mucho lo que aún queda por dilucidarse. En este sentido, los modelos animales desempeñan un papel fundamental en el estudio de los mecanismos fisiopatológicos y en la evaluación de las estrategias de diagnóstico y tratamiento que limiten el desarrollo de la enfermedad y sus complicaciones.
Existen numerosos modelos biológicos en animales que reproducen varias de las manifestaciones clínicas de la diabetes humana mediante diversos métodos, entre los cuales se destaca la inducción química con estreptozotocina en roedores. Este fármaco provoca la destrucción selectiva de las células β de los islotes pancreáticos, única fuente de insulina en el organismo (1,3,6).
La sensibilidad al fármaco puede variar según la cepa, el sexo, la edad, el estado nutricional y, por supuesto, la especie animal. El momento, la dosis y la vía de administración resultan determinantes para el tipo de diabetes que se desee inducir. En la rata adulta la inoculación de diferentes dosis de este agente causa una deficiencia casi total de insulina y, por lo tanto, niveles elevados de hiperglucemia que simulan la diabetes de tipo 1 (1,3,7). Sin embargo, varios autores refieren que una única dosis elevada de estreptozotocina (100 mg/kg), administrada durante los primeros días de vida del conejo, provoca un déficit de insulina moderado y valores medios de hiperglucemia semejantes a los de la diabetes de tipo 2 en el transcurso de las siguientes semanas (1,2,6,8).
Desde hace muchos años el modelo neonatal con estreptozotocina se considera una herramienta confiable para esclarecer los mecanismos asociados a la regeneración de las células pancreáticas y a las complicaciones a largo plazo de la diabetes de tipo 2. En numerosos estudios se plantean diferentes momentos (días 0, 2 o 5 de nacidos) y vías de inoculación (subcutánea, intraperitoneal o intravenosa) del fármaco (3,6,8,9), sin embargo, no existen informes sobre las ventajas de uno u otro protocolo con relación a las características de la enfermedad una vez se desarrolla en el animal adulto.
En este contexto, en el presente estudio se propuso comparar en ratas Wistar adultas la acción diabetogénica de la estreptozotocina según el momento y la vía de inoculación del fármaco durante el periodo neonatal, evaluando para ello algunas variables bioquímicas, metabólicas e histológicas.
Aunque ningún modelo experimental recrea totalmente las particularidades de la enfermedad en humanos, es necesario trabajar en su caracterización para que los resultados obtenidos sean lo más valiosos posibles.
Materiales y métodos
Animales y grupos de experimentación
Se obtuvieron ratas Wistar hembras y machos del Centro de Producción de Animales de Laboratorio (CENPALAB) en La Habana, Cuba, las cuales fueron apareadas para obtener animales recién nacidos. El día del nacimiento se determinó el sexo de las crías y se distribuyó a las hembras aleatoriamente en ocho grupos de experimentación, de 10 animales cada uno.
Inducción de la diabetes
La diabetes fue inducida en cuatro de los grupos mediante la administración de 100 mg/kg de estreptozotocina (STZ) disuelta en 0,1 M de solución tampón de citrato (pH 4,5). Se ensayaron dos vías y dos momentos de inoculación: subcutánea (sc) e intraperitoneal (ip), a los dos y cinco días del nacimiento. Por cada grupo tratado (STZ-2-sc, STZ-2-ip, STZ-5-sc, STZ-5-ip) se estableció un grupo de control (Cont-2-sc, Cont-2-ip, Cont-5-sc, Cont-5-ip), al cual se le administró solución tampón de citrato en iguales condiciones.
Cuidado y mantenimiento de los animales
Tanto los padres como sus crías se mantuvieron en un ambiente estrictamente controlado: temperatura de 20 ± 2 o C, humedad de 40 %, ciclos alternados de luz y oscuridad de 12 horas y libre acceso a agua y comida. Las crías permanecieron con sus madres durante 21 días hasta el destete, momento a partir del cual se midió semanalmente su peso y el consumo diario de agua y comida.
Determinación de las variables bioquímicas
Para confirmar la inducción de la diabetes, semanalmente se determinaron los valores de glucosa en sangre (glucosa oxidasa) con glucómetro y biosensores SUMA a partir de la sexta semana de vida, según lo establecido en ensayos previos llevados a cabo en nuestro laboratorio. Los animales se sometieron a ayunos de 12 horas y la muestra de sangre se extrajo de la cola del animal. En la semana 12 se hicieron pruebas de tolerancia a la glucosa (PTGO) con la misma metodología luego de administrar por vía oral una sobrecarga de glucosa (dextrosa monohidratada) de 2 g/kg de peso corporal. Las mediciones se hicieron en ayunas a los 30, 60 y 120 minutos de la administración de la sobrecarga. En la misma semana se extrajo sangre del plexo retroorbitario para determinar la hemoglobina ´glicosilada´ (Hb A1c) mediante el método de aglutinación.
Sacrificio de los animales y toma de muestras para los estudios morfométricos e histológicos
Al final de las 12 semanas de vida, se practicó la eutanasia bajo anestesia (50-60 mg/kg de tiopental sódico), por extracción total de la sangre mediante punción de la vena cava inferior. Se extrajo el páncreas y se pesó libre de grasa y ganglios. Las muestras se procesaron histológicamente con tinción de hematoxilina y eosina. Las observaciones se llevaron a cabo en microscopio óptico binocular marca Olympus BX51, con objetivos de 4, 10, 20, 40 y 100. Se determinaron las principales lesiones en el páncreas endocrino. Para su cuantificación, los islotes pancreáticos se contaron en cuatro campos con lente de menor aumento (4 x 10, panorámico) y el resultado se expresó como número de islotes por mm 2 de páncreas.
Procesamiento estadístico
Las comparaciones cuantitativas se hicieron mediante la prueba no paramétrica U de Mann-Whitney teniendo en cuenta la distribución de los datos. Los resultados se presentan como media ± error estándar. La prueba de ji al cuadrado se utilizó para la comparación de proporciones, y los datos se expresaron en valores absolutos y porcentajes. En ambos casos las diferencias se consideraron significativas con valores de p<0,05.
Aspectos éticos
Los animales se trataron según las recomendaciones de la guía de los National Institutes of Health para el trabajo con animales de experimentación. La investigación fue aprobada por el Consejo Científico y el Comité de Ética de la Unidad de Investigaciones Biomédicas de la Universidad de Ciencias Médicas de Villa Clara.
Resultados
El agente de inducción de la diabetes se administró a 40 animales; aquellos inoculados con el agente al quinto día de nacidos tuvieron un índice de mortalidad de 95 % (solo sobrevivió un animal del grupo STZ-5-ip), es decir que se analizaron exclusivamente los animales inoculados en el segundo día de vida (STZ-2). En el resto de los grupos inoculados con el agente, así como en todos los de control, la supervivencia fue de 100 %.
En la medición semanal del peso de los animales inoculados en el segundo día de nacidos (figura 1, a y b), no se registraron diferencias importantes entre las dos formas de administración de la estreptozotocina, aunque en el grupo inoculado por vía subcutánea se observó una menor ganancia en el peso corporal que en el respectivo grupo de control. En este mismo grupo de animales se registró una acentuada tendencia al aumento del consumo de agua y alimento (figura 1, c-f) con respecto al grupo control, mientras que en el grupo de animales inoculados por vía intraperitoneal se presentó un comportamiento similar al de sus controles.
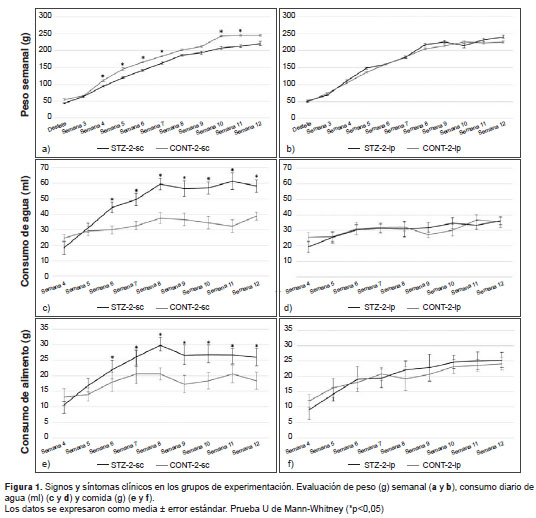
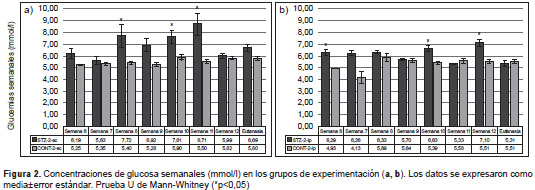
Los resultados de la determinación semanal de glucemia se presentan en la figura 2, a y b. En el grupo STZ-2-sc se registraron valores superiores de hiperglucemia moderada, y más estables en el tiempo del experimento que los del grupo STZ-2-ip.
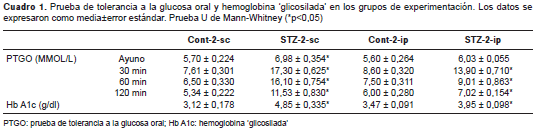
En las pruebas de tolerancia a la glucosa se observó que ambos grupos control tuvieron una recuperación total de sus niveles de glucosa a los 120 minutos de la sobrecarga. Sin embargo, en los grupos tratados con estreptozotocina, fundamentalmente en el STZ-2-sc, se registraron valores muy superiores a los 30 y 60 minutos, con muy poca recuperación a los 120 minutos. Los valores de la hemoglobina ´glicosilada´ en los cuatro grupos confirmaron un peor control glucémico en el STZ-2-sc, aunque este parámetro fue significativamente mayor que el de los respectivos controles con ambas vías de administración del agente de inducción de la diabetes (cuadro 1).
El estudio morfométrico del páncreas evidenció que la relación entre el peso del órgano y el peso corporal no se modificó de manera significativa en ninguno de los grupos tratados, en comparación con sus controles: STZ-2-sc (0,68 g ± 0,039 g) Vs . Cont-2-sc (0,77 g ± 0,066 g) y STZ-2-ip (0,75 g ± 0,118 g) Vs . Cont-2-ip (0,80 g ± 0,055 g).
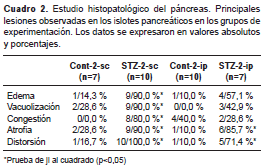
El análisis histopatológico reveló un número de islotes por mm 2 de páncreas significativamente menor (p<0,05) en los grupos tratados que en los de control: STZ-2-sc (0,03 ± 0,002) Vs . Cont-2-sc (0,12 ± 0,016) y STZ-2-ip (0,05 ± 0,006) Vs . Cont-2-ip (0,12 ± 0,015). Las principales lesiones observadas en los islotes pancreáticos se presentan en el cuadro 2 y en la figura 3, a y b. No se encontraron diferencias significativas entre los grupos en cuanto a la presencia de linfocitos, fibroblastos y fibrosis; en ningún caso se constató la presencia de necrosis.
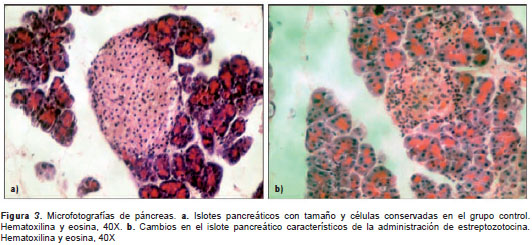
Discusión
En el presente estudio se logró obtener un modelo animal empleando estreptozotocina como agente de inducción de la diabetes, en el cual se evidenciaron características del síndrome diabético humano. Entre los fármacos conocidos que inducen la diabetes experimentalmente este agente es el más utilizado por su mayor estabilidad y efectividad con respecto a otros. Es un antibiótico derivado de Streptomyces achromogenes que se emplea, además, como antineoplásico por su acción citotóxica altamente selectiva para las células β de los islotes pancreáticos (2,10).
En el experimento se inoculó este agente a ratas Wistar en los días dos y cinco de nacidas; en las ratas inoculadas en el día cinco hubo 95 % de mortalidad, a pesar de que en la literatura científica se ha reportado su uso en el quinto día de vida sin que se produjera la muerte (6,10). Se sabe que el momento de la inyección del compuesto es un factor crítico para la regeneración de las células del páncreas endocrino (1,6). Varios autores han reportado signos de regeneración evidentes a las dos semanas de evolución en ratas inoculadas en el mismo día del nacimiento y en el día dos, mientras que las inyectadas en el quinto día mostraban alteraciones en el patrón histológico en ese mismo tiempo. La capacidad de regeneración de las células β del páncreas en ratas Wistar disminuye rápidamente durante la primera semana a partir del nacimiento y es insignificante en los roedores adultos (1,6,11,12), de ahí que el momento de la administración determine el tipo de diabetes que se induce experimentalmente.
Es posible que en este caso las crías inyectadas en el día cinco, con la capacidad regenerativa de sus células β disminuida, no hayan tolerado los cambios metabólicos que se producen inmediatamente después de la administración del fármaco, sobre todo con dosis de 100 mg/kg de peso corporal. En estudios en los que se administró la estreptozotocina en dosis de 70 mg/kg, se ha logrado la supervivencia de todos los especímenes en el modelo (9,13).
Los animales inoculados en el segundo día de nacidos, principalmente los inoculados por vía subcutánea, sobrevivieron a la etapa de inducción de la diabetes y presentaron los signos y síntomas clásicos de la enfermedad: hiperglucemia en ayunas, intolerancia a la glucosa, polidipsia, polifagia y disminución del peso corporal.
A partir de la sexta semana de vida los grupos enfermos presentaron hiperglucemia moderada, la cual no fue permanente durante el tiempo de experimentación; sin embargo, a las 12 semanas exhibieron intolerancia a la glucosa, fundamentalmente el grupo inyectado por vía subcutánea. En las ratas y en los humanos, una elevación prolongada (>120 minutos) de la glucosa en plasma refleja alteraciones en la tolerancia a la glucosa oral, lo que puede utilizarse en el diagnóstico de la diabetes de tipo 2, conjuntamente con la hiperglucemia en ayunas (14). Estos hallazgos concuerdan con lo referido por algunos autores sobre modelos de inducción de la diabetes de tipo 2, en los cuales se ha visto que, inmediatamente después de inocular a los animales con estreptozotocina, estos presentan una hiperglucemia que dura pocos días; sin embargo, a las tres semanas de edad los niveles de insulina y glucosa son normales, aunque a las ocho semanas las ratas muestran una hiperglucemia leve y alteraciones en la tolerancia a la glucosa (11,15).
La medición de la hemoglobina ´glicosilada´ al final del experimento confirmó la presencia de diabetes en los grupos tratados. Este parámetro es un importante marcador del estado metabólico a largo plazo en pacientes con diabetes (16) y ya se emplea como método apropiado para su diagnóstico (17). Es el producto de una reacción lenta, no enzimática e irreversible, que está directamente relacionada con las concentraciones de carbohidratos circulantes en sangre y la vida media del eritrocito (de 90 a 120 días en el humano y de 45 a 50 días en la rata) (18). Teniendo esto en cuenta, los valores de hemoglobina ´glicosilada´ obtenidos reflejaron un mal control glucémico de los animales en los que la enfermedad se indujo.
La pérdida de peso corporal y el aumento en el consumo de agua y comida en los animales enfermos, principalmente en los inyectados subcutáneamente, puede explicarse desde el punto de vista fisiológico, pues la exposición del organismo a una hiperglucemia persistente puede provocar un desequilibrio osmótico y traer como consecuencia la polidipsia y, por ende, la poliuria. La falta de glucosa intracelular se refleja en un cansancio generalizado, mientras que el mecanismo de la polifagia aún no está muy claro, aunque se ha encontrado que es un efecto compensador de la pérdida de glucosa por la orina (19). Todos estos trastornos metabólicos se relacionan con una gluconeogénesis anormal a partir de aminoácidos, lo cual se traduce clínicamente en atrofia muscular y pérdida de peso (20).
En la presente investigación el estudio morfométrico del páncreas no mostró modificaciones en el peso del órgano en los animales con diabetes inducida, comparados con los controles. Sin embargo, el análisis histopatológico reveló una disminución del número de islotes pancreáticos en los animales diabéticos, en comparación con los sanos. Resultados similares se han encontrado en estudios en roedores (21-24), conejos (25) y perros (26), independientemente del fármaco (estreptozotocina o aloxano) y el momento de la inducción.
Aunque en los grupos de animales inoculados con estreptozotocina se observaron diversas lesiones histológicas concordantes con daños en la arquitectura pancreática, no se encontró necrosis en el tejido, lesión que debió aparecer en el momento de la inoculación del fármaco y que demuestra su toxicidad inmediata.
Las lesiones percibidas son la evidencia histológica de la regeneración parcial del páncreas endocrino a las 12 semanas de inoculación de la estreptozotocina. En los animales tratados los islotes pancreáticos se observaron atróficos y con bordes distorsionados, congestivos, con edema y presencia de vacuolas intracitoplásmicas. A pesar de que la acción de la estreptozotocina es específica contra las células β, el resto del islote se ve afectado por los posibles mecanismos de regeneración ya demostrados en modelos experimentales similares al empleado en este trabajo. La generación de nuevas células β puede ocurrir a partir de células indiferenciadas (neogénesis), de células ya diferenciadas que se convierten en otro tipo celular (transdiferenciación) y de la replicación de las propias células β remanentes (proliferación) (1,12).
Los hallazgos concuerdan con el mecanismo de acción de la estreptozotocina inoculada durante el periodo neonatal en roedores. En ratas, específicamente de la línea Wistar, se ha comprobado que los daños causados al páncreas en dicho periodo se van reparando, pero los animales llegan a la edad adulta con una capacidad disminuida de producir insulina, por lo que presentan dificultades en el metabolismo de la glucosa (1,11).
Los aspectos analizados evidenciaron que en los animales de este experimento, especialmente los del grupo STZ-2-sc, se lograron reproducir algunas características fundamentales del síndrome diabético en el hombre; sin embargo, existen diferencias obvias en la etiología de la enfermedad humana y la inducida farmacológicamente en un modelo animal. Un modelo experimental ideal de la diabetes de tipo 2 debe presentar resistencia a la insulina y alteraciones en la respuesta pancreática a dicha resistencia. Los modelos químicos se basan en la destrucción de las células β del páncreas; no obstante, en ellos se logra simular la enfermedad humana, provocando reducción y disfunción de células β, así como insuficiencia en la secreción de insulina, elementos que traen consigo un déficit en los mecanismos de compensación de la célula, y generan un estado de intolerancia a la glucosa y otras alteraciones fundamentales en la patogenia de la diabetes moderada (7).
Con base en el análisis de los resultados experimentales, se concluyó de forma indiscutible que la vía de inoculación subcutánea fue más efectiva para lograr un estado diabético en el animal lo más semejante posible a la enfermedad en humanos. En otros estudios en el mismo modelo animal llevados a cabo por nuestro equipo de investigación, se ha corroborado esta conclusión, pues en el grupo inoculado por vía subcutánea se encontraron alteraciones en los parámetros oxidativos y metabólicos (principalmente en el perfil renal) (27). Sin embargo, en la literatura científica se ha registrado la presencia de diabetes moderada con la inoculación intraperitoneal de estreptozotocina en animales durante el periodo neonatal, aunque con variaciones en las dosis, los momentos y las cepas utilizadas (9,13,28,29), lo cual corrobora que el modelo debe seleccionarse en función del propósito y las condiciones de la investigación (1,7), por lo cual estudios como este son el primer paso imprescindible antes de efectuar pesquisas con objetivos más precisos.
Desde el punto de vista del procedimiento en animales de experimentación, la inyección subcutánea es sencilla y en general bien tolerada, aunque la absorción de sustancias por esta vía es relativamente lenta. Por otra parte, la administración intraperitoneal conlleva riesgo de lesión en los órganos abdominales, pues el punto de inyección se localiza en el cuadrante inferior derecho del animal, lateral a la línea media (para evitar el compromiso de la vejiga urinaria) y caudal con respecto a la última costilla (para evitar inyectar en el hígado o el estómago). Si no se hace adecuadamente, la inoculación intraperitoneal de estreptozotocina puede aumentar la mortalidad y disminuir el efecto de inducción de la diabetes, a pesar de ser una vía de administración rápida y fácil, principalmente en animales adultos (30). La inyección intraperitoneal en crías de dos días de nacidas es difícil y conlleva riesgos. Esto se añade a los resultados obtenidos con la inoculación por esta vía, lo que convierte la inyección subcutánea de 100 mg/kg de estreptozotocina en el segundo día después del nacimiento en el tratamiento de elección para inducir diabetes moderada en ratas Wistar adultas.
Esta investigación se inscribe en el proyecto institucional "Estandarización de un modelo de inducción neonatal de diabetes experimental", contratado y financiado por el Ministerio de Salud Pública de Cuba.
Los autores expresan no tener ningún tipo de conflicto de intereses.
Correspondencia:
Leticia Bequer, Universidad de Ciencias Médicas de Villa Clara, Carretera al Acueducto y Circunvalación, Santa Clara, Villa Clara, Cuba Teléfono: (042) 273 436 leticiabm@ucm.vcl.sld.cu
1. Damasceno DC, Netto AO, Iessi IL, Gallego FQ, Corvino SB, Dallaqua B, et al . Streptozotocin-induced diabetes models: Pathophysiological mechanisms and fetal outcomes. Biomed Res Int. 2014;2014:819065. http://dx.doi.org/10.1155/2014/819065 [ Links ]
2. Srinivasan K, Ramarao P. Animal models in type 2 diabetes research: An overview. Indian J Med Res. 2007;125:451-72. [ Links ]
3. Casado M. Modelos animales en el estudio de la diabetes. Av Diabetol. 2007;23:432-8. [ Links ]
4. Ashcroft FM, Rorsman P. Diabetes mellitus and the beta cell: The last ten years. Cell. 2012;148:1160-71. http://dx.doi.org/10.1016/j.cell.2012.02.010 [ Links ]
5. Comité Ejecutivo de la Asociación Latinoamericana de Diabetes. Guías de diagnóstico, control y tratamiento de la diabetes mellitus tipo 2 con medicina basada en evidencia. Rev ALAD. 2013;1-142. [ Links ]
6. Arulmozhi DK, Veeranjaneyulu A, Bodhankar SL. Neonatal streptozotocin-induced rat model of type 2 diabetes mellitus: A glance. Indian J Pharmacol. 2004;36:217-21. [ Links ]
7. Jawerbaum A, White V. Animal models in diabetes and pregnancy. Endocr Rev. 2010;31:680-701. http://dx.doi.org/10.1210/er.2009-0038 [ Links ]
8. Kiss AC, Woodside B, Sinzato YK, Bernardi MM, Kempinas WG, Anselmo-Franci JA, et al . Neonatally induced mild diabetes: Influence on development, behavior and reproductive function of female Wistar rats. Diabetol Metab Syndr. 2013;5:2-10. http://dx.doi.org/10.1186/1758-5996-5-61 [ Links ]
9. Kiss AC, Lima PH, Sinzato YK, Takaku M, Takeno MA, Rudge MV, et al. Animal models for clinical and gestational diabetes: Maternal and fetal outcomes. Diabetol Metab Syndr. 2009;1:1-7. http://dx.doi.org/10.1186/1758-5996-1-21 [ Links ]
10. Junod A, Lambert A, Stauffacher W, Renold A. Diabetogenic action of streptozotocin: Relationship of dose to metabolic response. J Clin Invest. 1969;48:2129-39. [ Links ]
11. Portha B, Picolon L, Rosselin G. Chemical diabetes in the adult rat as the spontaneous evolution of neonatal diabetes. Diabetologia. 1979;17:371-7. [ Links ]
12. Damasceno DC, Sinzato YK, Bueno A, Netto AO, Dallaqua B, Gallego FQ, et al . Mild diabetes models and their maternal-fetal repercussions. J Diabetes Res. 2013:2013;473575. http://dx.doi.org/10.1155/2013/473575 [ Links ]
13. Sinzato YK, Lima PH, de Campos KE, Kiss AC, Rudge MV, Damasceno DC. Neonatally-induced diabetes: Lipid profile outcomes and oxidative stress status in adult rats. Rev Assoc Med Bras. 2009;55:384-8. http://dx.doi.org/10.1590/S0104-42302009000400010 [ Links ]
14. Ernsberger P, Koletsky R. The glucose tolerance test as a laboratory tool with clinical implications. In: Chackrewarthy S, editor. Glucose tolerance. Rijeka: InTech; 2012. p. 3-14. http://dx.doi.org/10.5772/54785 [ Links ]
15. Ishii Y, Ohta T, Sasase T. Non-obese type 2 diabetes animals models. In: Chackrewarthy S, editor. Glucose tolerance. Rijeka: InTech; 2012. p. 224-42. http://dx.doi.org/10.5772/54785 [ Links ]
16. Weykamp C, John WG, Mosca A. A review of the challenge in measuring hemoglobin A1c. J Diabetes Sci Technol. 2009; 3:439-45. http://dx.doi.org/10.1177/193229680900300306 [ Links ]
17. American Diabetes Association. Standards of medical care in diabetes-2014. Diabetes Care. 2014;37(Supl.1):s5-13. http://dx.doi.org/10.2337/dc14-S005 [ Links ]
18. Rosales A. Determinación de hemoglobina glicada (HbA1) en ratas con diabetes inducida con estreptozotocina. México, DF: Universidad Autónoma Metropolitana Unidad Iztapalapa; 1994. [ Links ]
19. Del Toro M. Efecto de la cocarboxilasa sobre la glucemia en ratas Wistar inducidas a diabetes (tesis). Colima, México: Universidad de Colima; 2001. [ Links ]
20. Ciobotaru E. Spontaneous diabetes mellitus in animals. In: Oguntibeju OO, editor. Diabetes mellitus - Insights and perspectives. Rijeka: InTech; 2013. p. 271-96. http://dx.doi.org/10.5772/48170 [ Links ]
21. Xuesong X, Zhu W, Yuming Z, Lihua B, Yuexin Y. Dosage of streptozocin in inducing rat model of type 2 diabetes mellitus. Wei Sheng Yan Jiu. 2010;39:138-42. [ Links ]
22. Ahimadi S, Karimian SM, Sotoudeh M, Bahadori M. Histological and immunohistochemical study of pancreatic islet beta cells of diabetic rats treated with oral vanadyl sulphate. MJIRI. 2002;16:173-8. [ Links ]
23. Alimohammadi S, Hobbenaghi R, Javanbakht J, Kheradmand D, Mortezaee R, Tavakoli R, et al . Protective and antidiabetic effects of extract from Nigella sativa on blood glucose concentrations against streptozotocin (STZ)-induced diabetic in rats: An experimental study with histopathological evaluation. Diagn Pathol. 2013;8:137-44. http://dx.doi.org/10.1186/1746-1596-8-137 [ Links ]
24. Abunasef SK, Amin HA, Abdel-Hamid GA. A histological and immunohistochemical study of beta cells in streptozotocin diabetic rats treated with caffeine. Folia Histochem Cytobiol. 2014;52:42-50. http://dx.doi.org/10.5603/FHC.2014.0005 [ Links ]
25. Mir SH, Baqui A, Bhagat RC, Darzi MM, Shah AW. Biochemical and histomorphological study of streptozotocin-induced diabetes mellitus in rabbits. Pak J Nut. 2008; 7:359-64. [ Links ]
26. Cubillos V, López C, Alberdi A. Estudio histopatológico e inmunohistoquímico de páncreas en perros diabéticos inducidos con aloxano. Arch Med Vet. 2008;40:169-77. [ Links ]
27. Bequer L, Gómez T, Molina JL, López F, Gómez CL, Clapés S. Inducción de hiperglicemias moderadas en ratas Wistar por inoculación neonatal de estreptozotocina. ¿Inyección subcutánea o intraperitoneal? Rev Argent Endocrinol Metab. 2014;51:178-84. [ Links ]
28. Figueroa MC, Pérez IH, Mejía R. Caracterización de un modelo de diabetes tipo 2 en ratas Wistar hembra. Rev MVZ Córdoba. 2013;18:3699-707. [ Links ]
29. Bonner-Weir S, Trent DF, Honey RN, Weir GC. Responses of neonatal rat islets to streptozotocin: Limited beta -cell regeneration and hyperglycemia. Diabetes. 1981;30:64-9. http://dx.doi.org/10.2337/diab.30.1.64 [ Links ]
30. Deeds MC, Anderson JM, Armstrong AS, Gastineau DA, Hiddinga HJ, Jahangir A, et al . Single dose streptozotocin-induced diabetes: Considerations for study design in islet transplantation models. Lab Anim. 2011;45:131-40. http://dx.doi.org/10.1258/la.2010.010090 [ Links ]














