Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.36 no.2 Bogotá Apr./June 2016
https://doi.org/10.7705/biomedica.v36i3.2752
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v36i3.2752
1 Departamento de Medicina Interna, Fundación Cardioinfantil-Instituto de Cardiología, Bogotá, D.C., Colombia
2 Programa de Postgrado en Medicina Interna, Facultad de Medicina, Universidad del Rosario, Bogotá, D.C., Colombia
3 Departamento de Epidemiología Clínica y Bioestadística, Facultad de Medicina, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
Contribución de los autores:
Henry Vargas: redacción del protocolo del estudio, coordinación de la depuración de la información y manejo de la base de datos
Martín Rondón: análisis de la información y diseño de las tablas
Rodolfo Dennis: concepción del estudio, colaboración en la elaboración del protocolo del estudio, y en el análisis y la discusión de resultados
Todos los autores participaron en la escritura del manuscrito.
Recibido: 30/03/15; aceptado: 05/11/15
Introducción. La relación de la diabetes mellitus de tipo 2 con el deterioro de la función pulmonar no es clara, como tampoco si el tipo de tratamiento modifica los parámetros espirométricos e inflamatorios.
Objetivo. Comparar la función pulmonar de pacientes con diabetes mellitus de tipo 2 tratados con un agente de sensibilización a la insulina (metformina) y de los tratados con secretagogos, así como de estos combinados con insulinas, y evaluar las diferencias en los biomarcadores de inflamación de los grupos.
Materiales y métodos. Se hizo un estudio analítico de corte transversal en 196 pacientes con diabetes mellitus de tipo 2. Se midieron las variables espirométricas y la concentración sanguínea de biomarcadores de inflamación (ferritina, fibrinógeno, proteína C reactiva, interleucina 6 y factor de necrosis tumoral alfa). Se analizaron los valores residuales (valores observados menos valores predichos) para la capacidad vital forzada y el volumen espiratorio forzado en los diferentes tipos de tratamiento. También, se compararon las diferencias en las medianas de las concentraciones de los biomarcadores, según los tipos de tratamiento.
Resultados. Después de ajustar según los factores determinantes de la función pulmonar y el control y la duración de la diabetes mellitus de tipo 2, los valores esperados de la capacidad vital forzada de los pacientes tratados con agentes de sensibilización a la insulina fue menor que los de aquellos tratados con secretagogos (-212,1 ml Vs. -270,2 ml; p=0,039), y lo mismo se registró en el volumen espiratorio forzado durante el primer segundo (-133,2 ml Vs. -174,8 ml; p>0,05), aunque dichas diferencias no fueron estadísticamente significativas. En el grupo de pacientes tratados con agentes de sensibilización a la insulina, las concentraciones de ferritina y del factor de necrosis tumoral alfa fueron menores (p<0,01).
Conclusión. Los resultados de este estudio respaldan la hipótesis de que los agentes de sensibilización a la insulina estarían asociados con un menor deterioro de la función pulmonar y una menor inflamación sistémica en los pacientes diabéticos. Asimismo, sirve como base para la formulación de nuevas hipótesis y trabajos de investigación.
Palabras clave: diabetes mellitus, pulmón, inflamación, metformina, insulinas, espirometría.
doi: http://dx.doi.org/10.7705/biomedica.v36i3.2752
Pharmacological treatment and impairment of pulmonary function in patients with type 2 diabetes: a cross-sectional study
Introduction: There is no clear relationship between type 2 diabetes mellitus and lung function decline; it is also unclear whether the type of treatment can modify spirometric variables and levels of inflammatory biomarkers.
Objectives: To compare pulmonary function in patients with type 2 diabetes treated with an insulin-sensitizing agent (metformin) and in those treated with secretagogues, as well as combined with insulin, and to evaluate differences in inflammatory biomarkers between treatment groups.
Material and methods: We conducted a cross-sectional analytic study in 196 diabetic patients with type 2 diabetic mellitus. Spirometric variables and levels of inflammatory biomarkers (ferritin, fibrinogen, C-reactive protein, interleukin 6, tumor necrosis factor-alpha), were obtained. Residual values (observed minus expected) for forced vital capacity and for forced expiratory volume were calculated and compared between treatment types. Differences in median levels of biomarkers were also compared.
Results: After adjustment by known determinants of lung function, and by the control and duration of type 2 diabetes, patients treated with the insulin-sensitizing agent had statistically significant lower differences against expected values for forced vital capacity compared with secretagogues (-212.1 ml vs 270.2 ml, p=0.039), as well as for forced expiratory volume , but without statistical significance (-133.2 mL vs -174.8 mL, p>0.05). In the group of patients treated with the insulin-sensitizing agent, ferritin and tumor necrosis factor-alpha levels were lower (p<0.01).
Conclusion: This study supports the hypothesis that insulin-sensitizing agents appear to be associated with less deterioration of lung function and less systemic inflammation in type 2 diabetes. The present study serves to formulate new hypothesis and research projects.
Key words: Diabetes mellitus, lung, inflammation, metformin, insulins.
doi: http://dx.doi.org/10.7705/biomedica.v36i3.2752
La información sobre la diabetes mellitus de tipo 2 abunda y cada día se registran nuevos hallazgos sobre su relación con los efectos sistémicos y con la aparición de otras enfermedades. Sin embargo, aunque la función pulmonar puede ser anormal en 60 % de los pacientes adultos asintomáticos con diabetes mellitus de tipo 2 (1), son relativamente pocos los reportes que se centran en los cambios en la función pulmonar asociados con esta enfermedad; asimismo, es poco conocido el papel de la inflamación crónica propia de la diabetes en el pulmón. En el estudio de Litonjua, et al. (2), se encontró que la función pulmonar medida por el volumen espiratorio forzado durante el primer segundo (VEF 1 ) y la capacidad vital forzada (CVF), disminuía proporcionalmente. En este estudio y en otro más reciente (3), se demostró que las personas que aún no han desarrollado la diabetes, o cuyo nivel de hemoglobina ´glucosilada´ está en el límite normal alto, ya tienen su función pulmonar disminuida con respecto a los que no han desarrollado la enfermedad, lo cual respalda la hipótesis de que la sola resistencia a la insulina predispone a un declive más temprano de dicha función.
En otros reportes, como el Fremantle Diabetes Study (4), se ha observado que la función pulmonar es menor en pacientes con diabetes mellitus de tipo 2. Asimismo, en el estudio ulterior de la cohorte de Framingham (5), el cual contó con 3.254 participantes, 2.974 sin diabetes y 280 con la enfermedad, se encontró que los pacientes con diabetes mellitus de tipo 2 tenían menor VEF 1 y CVF que los individuos del grupo de control (sanos), diferencia que se mantenía en los distintos grupos de fumadores (activos, exfumadores, no fumadores). Hallazgos similares se reportaron con base en el estudio ARIC (6) y en el British Women´s Heart and Health Study en 2004 (7).
La patogénesis de la diabetes mellitus de tipo 1 se ha relacionado con los procesos inflamatorios y otros mecanismos inmunitarios, y en recientes estudios epidemiológicos se ha demostrado la asociación entre la diabetes mellitus de tipo 2 y el incremento acusado de la concentración de los marcadores de inflamación sistémica (8-10). Por ejemplo, la alta concentración de ferritina se ha asociado con un mayor riesgo de desarrollar diabetes (11). Asimismo, en la patogénesis de la enfermedad pulmonar obstructiva crónica (EPOC) se han asociado varios mediadores inflamatorios, como las interleucinas 1 y 6 y el factor de necrosis tumoral alfa (TNF-α), así como la resistencia a la insulina (12). En este contexto, se puede postular que la reducción de la resistencia de los tejidos a la insulina podría disminuir el estado de glucosilación no enzimática de las proteínas y la actividad inflamatoria, y, consecuentemente, mejorar la función pulmonar en los pacientes diabéticos.
El principal objetivo de este estudio fue evaluar si existe asociación entre el uso de un agente de sensibilización a la insulina, o de la combinación de varios de ellos y el tratamiento con insulina, y la función pulmonar. El objetivo secundario fue evaluar si se puede demostrar la asociación entre el tipo de tratamiento de los pacientes diabéticos y la disminución de la concentración de los marcadores y mediadores de la inflamación.
Materiales y métodos
Se hizo un estudio observacional, analítico, de corte transversal, con base en los datos obtenidos en estudios previos de Dennis, et al . (13-15). Se seleccionó una muestra no probabilística de 495 pacientes que asistían a consulta en la Asociación Colombiana de Diabetes entre julio de 2005 y septiembre de 2007, y se incluyeron de forma consecutiva los casos de diabetes mellitus de tipo 2.
Los criterios de inclusión del estudio base fueron los siguientes: pacientes de ambos sexos entre 35 y 65 años de edad con diagnóstico médico de diabetes mellitus de tipo 2 según la definición de la Asociación Latinoamericana de Diabetes (glucemia casual igual o mayor de 200 mg/dl, o glucemia en ayunas igual o mayor de 126 mg/dl, o glucemia igual o mayor de 200 mg/dl dos horas después de una carga de glucosa en una prueba de tolerancia oral a la glucosa) (16).
Se excluyeron los pacientes con diagnóstico previo de artritis reumatoide u otra enfermedad del colágeno, las mujeres en embarazo, aquellos con antecedentes de heridas o traumatismo en el tórax o de procedimientos como pleurodesis o toracostomía, así como quienes tuvieran diagnóstico previo de traqueomalacia, fibrosis quística, cáncer de pulmón, tuberculosis pulmonar, cirugías del tórax, corazón o pulmón, y deformidades de la boca u otra limitación para realizar apropiadamente las pruebas de función pulmonar.
El tamaño de la muestra (495 sujetos) se basó en el promedio de los valores residuales esperados del VEF 1 en los participantes diabéticos y los sujetos de control, el cual debía ser de 60 ml o más, con desviación estándar entre 100 y 250 ml en adultos mayores de 21 años, y con una probabilidad de error de tipo I de 5 % y un poder de 80 %.
Se excluyeron del análisis los pacientes que recibían simultáneamente secretagogos y agentes de sensibilización a la insulina, al igual que aquellos que estaban tratados únicamente con insulina y otros medicamentos como los análogos del receptor PPAR ( Peroxisome Proliferator-Activated Receptor) y los inhibidores de la dipeptidil peptidasa-4 (DPP-4).
Para determinar los grupos de comparación, se definieron como expuestas a la insulina a aquellas personas que, cumpliendo con la definición de diabetes mellitus de tipo 2, informaran al momento de ingreso al estudio estar recibiendo insulina inyectable subcutánea; de igual forma, se definió como expuestos a un agente de sensibilización a la insulina a aquellos pacientes con diabetes mellitus de tipo 2 que estuviesen recibiendo tratamiento oral con metformina, y como pacientes expuestos a hipoglucemiantes orales del tipo de los secretagogos a aquellos pacientes que estuviesen recibiendo tratamiento solo con glibenclamida. Se analizó, además, la combinación de dos tratamientos de la siguiente forma: insulinas con metformina o insulinas con secretagogos. No se logró recopilar información sobre el tiempo de uso de uno u otro hipoglucemiante.
Después de verificar que los pacientes que asistían a la Asociación Colombiana de Diabetes cumplían con los criterios de inclusión, se procedió a solicitarles la firma del consentimiento informado para participar en el estudio. Si el paciente aceptaba participar, se le hacía una encuesta a cargo del personal del grupo de investigación mediante un cuestionario diseñado especialmente para la recolección de las variables de interés en este estudio. Para la recolección de la información, se utilizó un cuestionario de enfermedades respiratorias previamente traducido al español de uso en Colombia, con preguntas adicionales para las variables relacionadas con la función pulmonar.
Manejo y procesamiento de las muestras
Los pacientes elegibles con base en la encuesta fueron citados a una segunda visita para medir la glucemia en ayunas, la hemoglobina ´glucosilada´, el fibrinógeno, la ferritina, el TNF-α, la interleucina 6 y la proteína C reactiva. Las muestras de sangre se tomaron después de un mínimo de seis horas de ayuno utilizando tubos de vacío, los cuales se centrifugaron en el laboratorio siguiendo los procedimientos estándar. Un grupo de muestras se almacenó a -20 °C durante un máximo de dos meses para el análisis posterior. Las concentraciones de TNF-α, interleucina 6 y proteína C reactiva de alta sensibilidad, se midieron con un método inmunométrico enzimático secuencial en fase sólida por quimioluminiscencia usando el analizador Immulite 1000 ™ (EURO/DPC Ltd, Llanberis, UK). Cada medición de proteína C reactiva, TNF-α e interleucina 6 (alta y baja), se procesó por duplicado para cumplir con el estándar de control de ensayos específicos del fabricante, y la de la proteína C reactiva se hizo por triplicado (alta, intermedia y baja).
Personal entrenado en el uso del espirómetro portátil se encargó de practicar las pruebas de función pulmonar (curva de flujo de volumen) a los participantes, para determinar la CVF y el VEF 1 . El control de calidad de estas mediciones se basó en las recomendaciones de la American Thoracic Society y en la calibración periódica de los neumotacógrafos (17).
Análisis estadístico
La base de datos se elaboró en el programa ACCES/Office 2000, y los análisis estadísticos se hicieron con el programa STATA ® , versión 10.0. Después de filtrar los datos en la base original de 495 pacientes, se encontraron 64 que habían estado recibiendo solamente agentes de sensibilización a la insulina (metformina) y 47 tratados con secretagogos. Se hizo un análisis adicional de las mismas variables del estudio con los resultados de la combinación de los medicamentos hipoglucemiantes orales y las insulinas (un grupo recibía metformina y, otro, secretagogos), con el fin de confirmar que, si se registraban diferencias, estas se debieran principalmente al tipo de hipoglucemiante oral utilizado y no al efecto de la insulina, y analizar el efecto de la insulina en las variables estudiadas. Por esta razón, el número de pacientes se amplió así: en el grupo que recibía agentes de sensibilización a la insulina más insulinas, se incluyeron 118 pacientes y, en el grupo que recibía secretagogos más insulinas, 78 pacientes.
En los análisis comparativos ajustados, las variables dependientes fueron el VEF1, la CVF, la relación entre estos, las concentraciones de proteína C reactiva, de ferritina, de fibrinógeno, de interleucina 6 y de TNF-α, en tanto que la variable independiente fue el tipo de tratamiento de la diabetes. Se definió como un mal control de la diabetes una concentración de hemoglobina ´glucosilada´ mayor de 7 %. Las diferencias estadísticas en las variables categóricas (tabaquismo, antecedentes de enfermedad) entre los pacientes que recibían secretagogos o agentes de sensibilización a la insulina, o una combinación de secretagogos e insulinas, o agentes de sensibilización e insulinas, se evaluaron mediante la prueba de ji al cuadrado o el test exacto de Fisher (dependiendo del número de eventos), y en las variables continuas (VEF 1 , CVF), mediante pruebas para establecer las diferencias entre promedios (t de Student) o medianas (U de Mann-Whitney).
La función pulmonar se evaluó a partir del valor de la diferencia entre los resultados obtenidos y los esperados, es decir, el valor residual entre el valor observado del VEF 1 , la CVF, y la relación entre uno y otra, y el resultado esperado o predicho. Se obtuvieron los valores esperados de VEF 1 , CVF y de uno y otra ajustados por edad, sexo y estatura para cada sujeto mediante las ecuaciones de predicción obtenidas por Hankinson, et al ., para sujetos mexicano-americanos, validadas para Colombia (18,19).
La asociación entre los resultados de las pruebas de función pulmonar y los tipos de tratamiento ajustados según variables conocidas que son determinantes de la función pulmonar, se analizó mediante regresión lineal múltiple. Después se hizo un análisis adicional entre las distintas combinaciones de tratamiento de los pacientes. Para el análisis de las concentraciones de los marcadores inflamatorios con respecto al tipo de tratamiento, se utilizó la prueba t de Student o su equivalente no paramétrico cuando se juzgó necesario después de verificar la distribución en la muestra, y lo mismo se hizo para el análisis de los biomarcadores de inflamación en cada grupo de tratamiento.
Consideraciones éticas
El protocolo del estudio fue aprobado por el Comité de Ética de la Fundación Cardioinfantil, el cual se ajusta a lo dispuesto en la declaración de la iniciativa STROBE ( Strengthening the Reporting of Observational Studies in Epidemiology ) para la comunicación de estudios observacionales de corte transversal (20).
Resultados
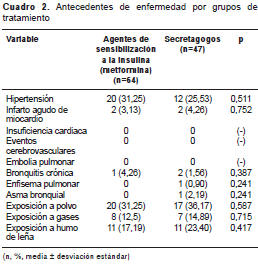
Los dos grupos estudiados se diferenciaron en algunas características como sexo, peso, concentración de hemoglobina ´glucosilada´ y control de la diabetes. Los pacientes que utilizaban el agente de sensibilización a la insulina tenían un nivel más bajo de hemoglobina ´glucosilada´ y, por lo tanto, un mejor control de la diabetes, que los pacientes que utilizaban secretagogos. En el caso del peso, en el grupo que recibía tratamiento con agentes de sensibilización a la insulina había pacientes con mayor peso (cuadro 1). En cuanto a las enfermedades y antecedentes de exposición de los pacientes, no se encontraron diferencias estadísticamente significativas entre los dos grupos de tratamiento (cuadro 2).
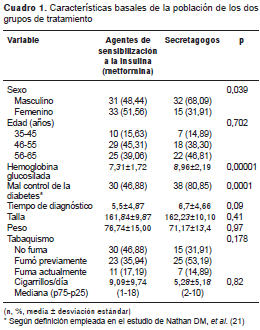
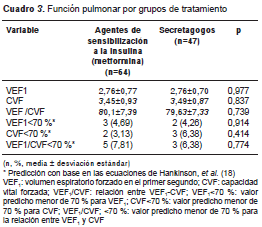
Al comparar a los pacientes tratados con metformina con aquellos que recibían secretagogos, no se encontraron diferencias en cuanto a las variables de la función pulmonar o los valores esperados menores de 70 % para la CVF, el VEF 1 y la relación entre una y otro (cuadro 3).
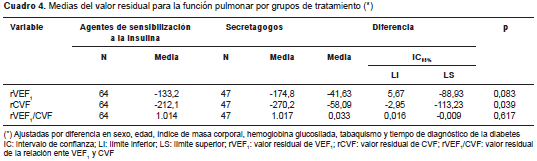
En el análisis de los valores residuales, y después de ajustar según variables determinantes de la función pulmonar ya conocidas (sexo, edad, talla, tabaquismo, exposición a humo de leña), control de la diabetes (hemoglobina ´glucosilada´) y tiempo transcurrido desde el diagnóstico de la enfermedad, los pacientes tratados con metformina tuvieron valores residuales de CVF mayores que los tratados con agentes secretagogos (-212,1 ml Vs . -270,2 ml; p=0,039) (cuadro 4). También, se encontraron menores valores residuales en el VEF 1 , pero sin significación estadística (-133,2 Vs. -174,8 ml; p>0,05). No se registraron cambios en los valores residuales de las variables de la función pulmonar cuando se compararon los grupos de tratamiento combinados, es decir, en el análisis del grupo que recibía insulinas y metformina comparado con el que recibía secretagogos más insulinas (cuadro 5).
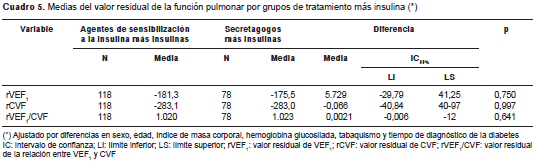
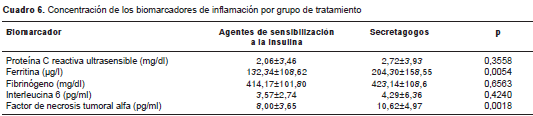
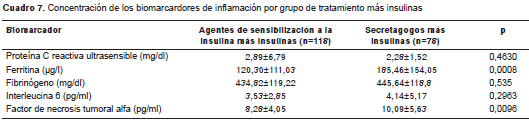
Con respecto a los valores promedio de los biomarcadores de inflamación, estos fueron uniformemente más bajos en el grupo de pacientes tratados con agentes de sensibilización a la insulina, sin embargo, solo alcanzaron significación estadística los de la ferritina (132,34 µg/l Vs . 204,30; p=0,0027) y los del TNF-α (8,00±3,65 Vs. 10,62; p=0,009) (cuadro 6). Esta diferencia se mantuvo incluso después de comparar la combinación de grupos de tratamiento, es decir, el uso simultáneo de agentes de sensibilización a la insulina e insulinas comparado con el uso de secretagogos e insulinas (cuadro 7).
Discusión
Los datos presentados en este estudio respaldan la hipótesis de que el uso de agentes de sensibilización a la insulina comparado con el uso de secretagogos en pacientes diabéticos, parece disminuir el deterioro de la función pulmonar, como se evidencia en el menor valor residual de la CVF, incluso después de ajustar los resultados según variables conocidas que afectan la función pulmonar, y según el control de la diabetes, los valores de hemoglobina ´glucosilada´ y la duración de la enfermedad. Además, se evidenció una tendencia no significativa a registrar un menor valor residual del VEF 1 en el grupo de pacientes tratados con agentes de sensibilización a la insulina del tipo de la metformina. Estos resultados confirman un informe previo (22). Asimismo, el presente estudio es el único que simultáneamente ha registrado las diferencias en los biomarcadores de inflamación.
En el único estudio de comparación del efecto de los agentes de sensibilización a la insulina y el de otros medicamentos en la función pulmonar de los pacientes diabéticos, llevado a cabo por Kim, et al ., se observó que los valores residuales de la CVF eran menores que los del VEF 1 en pacientes tratados con agentes de sensibilización a la insulina (22). Por otro lado, en el reporte del Copenhagen City Heart Study , un estudio de corte transversal, se evidenció que el VEF 1 y la CVF en los pacientes diabéticos tratados con insulinas era menor que en aquellos tratados con hipoglucemiantes orales (23). Este hallazgo explicaría por qué al agregar insulinas a los dos grupos de tratamiento en el presente estudio (metformina Vs . secretagogos), se perdieron los beneficios relacionados con un menor deterioro del VEF 1 y la CVF. Aunque no hay una explicación fisiopatológica que tenga un respaldo científico válido, podría tratarse de un efecto mitogénico de la insulina sobre el endotelio y sobre la pared alveolar, mediado por varias vías intracelulares como las cinasas de proteína activadas por mitógenos ( Mitogen-Activated Protein Kinases, MAPK) (24).
Se han postulado diversas teorías sobre la fisiopatología del daño pulmonar de los pacientes diabéticos. Los hallazgos en las autopsias de estos pacientes y de ratas con la enfermedad revelan el compromiso microangiopático de los capilares alveolares de los tabiques y de las arterias pleurales, incluido el engrosamiento de la membrana basal epitelial y de la capilar, la hialinosis vascular, la fibrosis nodular intraseptal, los granulomas y la proteinosis focal (1). Dichos cambios anatómicos parecen deberse a la alteración bioquímica de los constituyentes del tejido conjuntivo causada por una glucosilación no enzimática de los péptidos y de proteínas como la elastina, y de las fibras de colágeno, las cuales se encuentran principalmente en la matriz extracelular pulmonar y son constitutivas de la membrana alvéolo-capilar, lo que es, a su vez, resultado de la elevación crónica de la concentración de glucosa (1).
Una de las teorías sobre la génesis de esta condición plantea que está relacionada con el estado inflamatorio crónico que provoca una mayor producción y actividad de los mediadores de inflamación, como el factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas (NF-kB), el cual actúa principalmente en el endotelio, y de otras citocinas (interleucinas 1 y 6, TNF-α). También, se han postulado otros factores como el estrés oxidativo, el cual cumple una función patogénica en el daño de las células beta y, además, contribuye al desarrollo de la vasculopatía y la disfunción endotelial (9,10). También se ha descrito que la ferritina y las altas concentraciones de hierro pueden alterar el correcto funcionamiento celular, ya que se asocian con un aumento de la producción de radicales del tipo hidroxilo, que lesionan los lípidos de la membrana celular, de las proteínas y los ácidos nucleicos (11).
En este sentido, resulta interesante plantear que, si el principal mecanismo de alteración pulmonar está mediado por la resistencia a la insulina y la inflamación, la utilidad de los agentes de sensibilización a la insulina sería mayor en pacientes con sobrepeso, y constituirían marcadores de la resistencia a la insulina mucho antes de que se haga el diagnóstico de diabetes. En algunos estudios longitudinales se ha encontrado que mucho antes del diagnóstico de la enfermedad los pacientes ya acusaban cambios en la función pulmonar (3,25,26). Los valores elevados de los biomarcadores pueden estar relacionados con la fisiopatología de las enfermedades cardio-vasculares, renales y pulmonares, e incluso del cáncer, en los pacientes diabéticos (27,28). Esto también respaldaría el planteamiento de que, a largo plazo, el uso de los agentes de sensibilización a la insulina podría ayudar a disminuir la incidencia de las enfermedades cardiovasculares y pulmonares e, incluso, la probabilidad de desarrollar cáncer y de aumentar la supervivencia en pacientes con resistencia a la insulina (29-32).
Las limitaciones del presente estudio responden al hecho de que no es de naturaleza experimental y, dado que no se hizo asignación aleatoria, pudo producirse confusión debida a la prescripción de un tratamiento específico por parte del médico tratante, así como una confusión residual después del ajuste por las variables de control glucémico y de menor duración de la evolución de la diabetes. Otras limitaciones del estudio incluyen su carácter transversal y no longitudinal, lo cual no permitió hacer inferencias sobre la evolución en el tiempo, así como el tamaño de la muestra, que pudo haber influido en la poca precisión de algunos de los estimativos obtenidos, y los posibles sesgos de memoria sobre el uso previo de otros medicamentos, el uso concomitante de uno u otro agente farmacológico, y la efectiva toma de los medicamentos en el momento del estudio. Por ello, los hallazgos deben considerarse estímulos para el planteamiento de hipótesis con miras a futuras investigaciones.
En conclusión, la importancia del presente estudio radica en que se encontró una asociación entre el uso de agentes de sensibilización a la insulina del tipo de la metformina y un menor deterioro de la CVF en los pacientes diabéticos; además, el uso de este medicamento se correlacionó con valores más bajos de los biomarcadores de inflamación en sangre, específicamente el TNF-α y la ferritina. Aunque por sí solos estos resultados no podrían llevar a modificar las guías actuales de práctica clínica, sirven como base para la formulación de nuevas hipótesis, el desarrollo de trabajos longitudinales de investigación e, incluso, ensayos clínicos para evaluar el efecto económico del uso más temprano de agentes de sensibilización a la insulina en caso de comprobarse su relación con un menor deterioro de la función pulmonar en pacientes con signos de hiperinsulinismo, y las ventajas a más largo plazo frente a enfermedades como el cáncer.
A María Ximena Rojas, a Pablo Aschner, al personal y a la dirección de la Asociación Colombiana de Diabetes y de la Fundación Neumológica Colombiana, por su colaboración en el diseño y la ejecución del estudio inicial. A María Sacramento Esguerra, auxiliar de enfermería, quien actuó como coordinadora local del estudio inicial; a Andrea Fonseca, terapeuta respiratoria, quien hizo las espirometrías del estudio; a Rubby Guanes y Martha Ríos, bacteriólogas, quienes tomaron y procesaron las muestras, y a Héctor Restrepo, epidemiólogo, por garantizar la calidad de la base de datos. Sin ellos el estudio no hubiera sido posible.
Ninguno de los autores declara la existencia de conflictos de intereses relacionados con el tema del estudio.
Este estudio fue posible gracias a la financiación del Programa de Ciencia y Tecnología de la Salud de Colciencias (código del proyecto: 2239-04-16300).
Correspondencia: Rodolfo J. Dennis, Departamento de Investigaciones, Fundación Cardioinfantil, Calle 163B N° 28-14, 5° piso, Bogotá, D.C., Colombia Telefax: (571) 679 1236 rdennis@cardioinfantil.org
1. Kaparianos A, Argyropoulu E, Sampsonas F, Karkoulias K, Tsiamita M, Spiropoulos K. Pulmonary complications in diabetes mellitus. Chron Respir Dis. 2008;5:101-8. http://dx.doi.org/10.1177/1479972307086313 [ Links ]
2. Litonjua A, Lazarus R, Sparrow D, DeMollesc D, Weiss S. Lung function in type 2 diabetes: The Normative Aging Study. Respir Med. 2005;9:1583-90. http://dx.doi.org/10.1016/j.rmed.2005.03.023 [ Links ]
3. Oh IH, Park JH, Lee CH, Park JS . The association of normal range glycated hemoglobin with restrictive lung pattern in the general population. PLoS One. 2015;10:e0117725. http://dx.doi.org/10.1371/journal.pone.0117725 [ Links ]
4. Davis TM, Knuiman M, Kendall P, Vu H, Davis WA. Reduced pulmonary function and its associations in type 2 diabetes: The Fremantle Diabetes Study. Diabetes Res Clin Pract. 2000;50:153-9. http://dx.doi.org/10.1016/S0168-8227(00)00166-2 [ Links ]
5. Walter RE, Beiser A, Givelber RJ, O´Connor GT, Gottlieb DJ. Association between glycemic state and lung function: The Framingham Heart Study. Am J Respir Crit Care Med. 2003;167:911-6. http://dx.doi.org/10.1164/rccm.2203022 [ Links ]
6. Yeh HC, Punjabi NM, Wang NY, Pankow JS, Duncan BB, Cox CE, et al . Cross-sectional and prospective study of lung function in adults with type 2 diabetes. The Atherosclerosis Risk in Communities (ARIC) study. Diabetes Care. 2008;31:741-6. http://dx.doi.org/10.2337/dc07-1464 [ Links ]
7. Lawlor DA, Ebrahim S, Smith GD. Associations of measures of lung function with insulin resistance and type 2 diabetes: Findings from the British Women´s Heart and Health Study. Diabetología. 2004;47:195-203. http://dx.doi.org/10.1007/s00125-003-1310-6 [ Links ]
8. Hsia CC, Raskin P. Lung involvement in Diabetes: Does it matter? Diabetes Care. 2008;31:828-9. http://dx.doi.org/10.2337/dc08-0103 [ Links ]
9. García C, Feve B, Ferre P, Halimi S, Baizri H, Bordier L, et al . Diabetes and inflammation: Fundamental aspects and clinical implications. Diabetes Metab. 2010;36:327-38. http://dx.doi.org/10.1016/j.diabet.2010.07.001 [ Links ]
10. Tiengo A, Fadini GP, Avogaro A. The metabolic syndrome, diabetes and lung dysfunction. Diabetes Metab. 2008;34: 447-54. http://dx.doi.org/10.1016/j.diabet.2008.08.001 [ Links ]
11. Jiang R, Manson J, Meigs J, Ma J, Rifai N, Hu FB. Body iron stores in relation to risk of type 2 diabetes in apparently healthy women. JAMA. 2004;291:711-7. http://dx.doi.org/10.1001/jama.291.6.711 [ Links ]
12. Klein OL, Krishnan JA, Glick S, Smith LJ. Systematic review of the association between lung function and type 2 diabetes mellitus. Diabet Med. 2010;27:977-87. http://dx.doi.org/10.1111/j.1464-5491.2010.03073.x [ Links ]
13. Dennis R, Restrepo H, Rondón M, Rojas MX, Torres Y, Aschner P. Comparación de las pruebas de función pulmonar de pacientes con DM tipo 2 sometidos a tratamiento con insulina inyectada vs. tratamiento con hipoglucemiantes orales. Acta Med Colomb. 2010;35:113-8. [ Links ]
14. Dennis R, Maldonado D, Rojas MX, Aschner P, Rondón M, Charry L, et al . Diabetes mellitus tipo 2 y deterioro de la función pulmonar. Acta Med Colomb. 2008;33:105-10. [ Links ]
15. Dennis R, Maldonado D, Rojas MX, Aschner P, Rondón M, Charry L, et al . Inadequate glucose control in type 2 diabetes is associated with impaired lung function and, systemic inflamation: A cross-sectional study. BMC Pulm Med. 2010;10:38-42. http://dx.doi.org/10.1186/1471-2466-10-38 [ Links ]
16. Asociacio´n Latinoamericana de Diabetes . Guías ALAD 2000. Revista de la Asociación Latinoamericana de Diabetes. 2000;¿Volumen?(Supl.1):101-67. [ Links ]
17. American Thoracic Society. Lung function testing: Selection of reference values and interpretative strategies. Am Rev Respir Dis. 1991;144:1202-18. http://dx.doi.org/10.1164/ajrccm/144.5.1202 [ Links ]
18. Hankinson JL, Odencrantz JR, Fedan KB. Spirometric reference values from a sample of the general US population. Am J Respir Crit Care Med. 1999;159:179-87. http://dx.doi.org/10.1164/ajrccm.159.1.9712108 [ Links ]
19. Rojas MX, Dennis R. Valores de referencia para parámetros espirométricos en la población adulta residente en Bogotá, DC, Colombia. Biomédica. 2010;30:82-94. http://dx.doi.org/10.7705/biomedica.v30i1.156 [ Links ]
20. Kim HJ, Lee JY, Jung HS, Kim DK, Lee SM, Yim JJ, et al . The impact of insulin sensitisers on lung function in patients with chronic obstructive pulmonary disease and diabetes. Int J Tuber Lung Dis. 2010; 4:362-7. [ Links ]
21. Nathan DM, Buse JB, Davidson MB, Ferranini E, Holman RR, Shewin R, et al . Medical management of hyperglycemia in type 2 diabetes: A consensus algorithm for the initiation and adjustment of therapy: A consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care. 2009;32:193-203. http://dx.doi.org/10.2337/dc08-9025. [ Links ]
22. von Elm E, Altman DG, Egger M, Pocock SJ, Gøtzsche PC, Vandenbroucke JP. STROBE Initiative. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: Guidelines for reporting observational studies. J Clin Epidemiol. 2008;61:344-9. http://dx.doi.org/10.1016/j.jclinepi.2007.11.008 [ Links ]
23. Lange P, Groth S, Kastrup J, Mortensen J, Appleyard M, Nyboe J, et al. Diabetes mellitus, plasma glucose and lung function in a cross-sectional population study. Eur Respir J. 1989;2:14-9. [ Links ]
24. Goalstone ML, Carel K, Leitner J, Draznin B. Insulin stimulates the phosphorylation and activity of farnesyl-transferase via the Ras-mitogen-activated protein kinase pathway. Endocrinology. 1997;138:5119-23. http://dx.doi.org/10.1210/endo.138.12.5621 [ Links ]
25. McKeever TM, Weston PJ, Hubbard R, Fogarty A. Lung function and glucose metabolism: An analysis of data from the Third National Health and Nutrition Examination Survey. Am J Epidemiol. 2005;101:546-56. http://dx.doi.org/10.1093/aje/kwi076 [ Links ]
26. Hickson DA, Burchfiel CM, Liu J, Petrini MF, Harrison K, White WB, et al . Diabetes, impaired glucose tolerance, and metabolic biomarkers in individuals with normal glucose tolerance are inversely associated with lung function: The Jackson Heart Study. Lung. 2011;189:311-21. http://dx.doi.org/10.1007/s00408-011-9296-1 [ Links ]
27. Guo Y, Xu F, Lu T, Duan Z, Zhang Z. Interleukin-6 signaling pathway in targeted therapy for cancer. Cancer Treat Rev. 2012;38:904-1010. http://dx.doi.org/10.1016/j.ctrv.2012.04.007 [ Links ]
28. Kang X, Kong F, Wu X, Ren Y, Wu S, Wu K, et al . High glucose promotes tumor invasion and increases metastasis-associated protein expression in human lung epithelial cells. Cell Physiol Biochem. 2015;35:1008-22. http://dx.doi.org/10.1159/000373928 [ Links ]
29. Lin JJ, Gallagher EJ, Sigel K, Mhango G, Galsky MD, Smith CB, et al . Survival of patients with stage IV lung cancer with diabetes treated with metformin. Am J Respir Crit Care Med. 2015;191:448-54. http://dx.doi.org/10.1164/rccm.201407-1395OC [ Links ]
30. Mahmood K, Naeem M, Rahimnajjad N. Metformin: The hidden chronicles of a magic drug. Euro J Intern Med. 2013;24:20-6. http://dx.doi.org/10.1016/j.ejim.2012.10.011 [ Links ]
31. DeCensi A, Matteo P, Goodwin P, Cazzaniga M, Gennari A, Bonanni B, et al . Metformin and cancer risk in diabetic patients: A systematic review and meta-analysis. Cancer Prev Res (Phila). 2010;3:1451-61. http://dx.doi.org/10.1158/1940-6207.CAPR-10-0157 [ Links ]
32. Sakoda LC, Ferrara A, Achacoso NS, Peng T, Ehrlich SF, Quesenberry CP Jr, et al . Metformin use and lung cancer risk in patients with diabetes. Cancer Prev Res. 2015;8:174-9. http://dx.doi.org/10.1158/1940-6207.CAPR-14-0291 [ Links ]














