La enfermedad de cadenas ligeras afecta de diferentes formas el funcionamiento renal, y puede manifestarse como nefropatía por cilindros (riñón de mieloma), cadenas ligeras detectadas por inmunofluorescencia sin evidencia morfológica de daño renal, enfermedad por depósito de cadenas ligeras, síndrome de Fanconi por cadenas ligeras, nefritis intersticial por cadenas ligeras y lesiones glomerulares asociadas a cadenas ligeras o cadenas pesadas con patrones de lesión glomerular del tipo proliferativo de membranas o membranoso, glomeruloesclerosis nodular y amiloidosis (1), así como por la formación de estructuras organizadas ya identificadas como glomerulopatía inmunotactoide, fibrilar o por crioglobulinas. Dado que se trata de una enfermedad de gran variabilidad histológica, los pacientes deben someterse a estudios hematológicos para poder confirmar el diagnóstico, establecer el pronóstico y, por supuesto, ofrecer el mejor tratamiento posible.
El mieloma múltiple es una enfermedad maligna poco frecuente, con una incidencia de tres a cuatro casos por 100.000 personas al año; los riñones suelen ser los órganos más comprometidos en el momento del diagnóstico (aproximadamente, en 50 % de los pacientes), y es la neoplasia que más frecuentemente desencadena la enfermedad renal crónica terminal, la cual es un factor independiente de riesgo de mayor mortalidad (2). En los últimos años, se han documentado mejores resultados con el trasplante renal en pacientes con enfermedad renal crónica terminal causada por mieloma múltiple en remisión clínica (2,3); sin embargo, persiste el riesgo de recurrencia de la enfermedad en el injerto o, con menor frecuencia, su reaparición, caso en el cual las estrategias de tratamiento son un reto para el clínico, ya que en la mayoría de los casos no se recupera la función renal (4).
En el Hospital Pablo Tobón Uribe de Medellín se habían llevado a cabo 812 trasplantes de riñón hasta el 31 de marzo de 2016, y en tres de ellos hubo compromiso renal como manifestación inicial de mieloma múltiple no diagnosticado antes. A continuación se presentan los tres casos.
Caso 1
Se trata de un paciente de 55 años con antecedentes de enfermedad renal crónica terminal de causa desconocida, por lo cual se le hizo trasplante renal en el 2012. Como parte de los exámenes previos al trasplante, se hizo electroforesis de proteínas con resultado normal, y el paciente recibió inducción con 30 mg de alemtuzumab, pulsos de metilprednisolona e inmunosupresión con ciclosporina, micofenolato y prednisona, con lo cual se logró la función adecuada del injerto renal.
Un mes después del trasplante el paciente tuvo una infección por citomegalovirus tratada con valganciclovir, de la cual se recuperó completamente. A los ocho meses presentó disfunción del injerto con elevación de la creatinina hasta 1,8 mg/dl, por lo cual se sospechó que había rechazo o toxicidad por anticalcineurínicos o una infección viral.
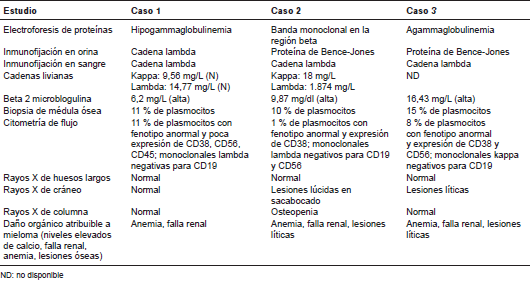
Se hizo una biopsia renal con la cual se confirmó el diagnóstico de nefropatía por cilindros (figura 1) y, por ello, se solicitaron nuevos estudios con los cuales se diagnosticó mieloma múltiple (cuadro 1). El paciente recibió quimioterapia con bortezomib y dexametasona, con lo cual entró en remisión y, seis meses después, se le hizo el trasplante autólogo de médula ósea con éxito, pues se logró la estabilización de su función renal y niveles de creatinina basal de 1,5 mg/dl que persistían tres años y medio después del diagnóstico de mieloma múltiple.
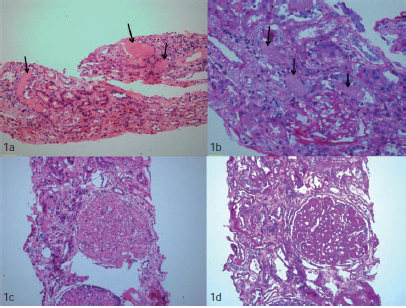
Figura 1. a. Los cortes muestran parénquima renal con presencia de cilindros de aspecto hialino, uniformes, cuya coloración es hipereosinófila (flechas). Además, se observan cambios por fibrosis intersticial e inflamación mononuclear. Hematoxilina y eosina, 20X. b. Con la coloración de ácido peryódico de Schiff, el color de los cilindros es pálido (flechas), lo cual es característico de la nefropatía por cilindros. Ácido peryódico de Schiff, 40X. c. Los cortes muestran un glomérulo con lesión de patrón nodular mesangial y marcado engrosamiento de las asas capilares glomerulares. Hematoxilina y eosina 40X. d. La coloración con ácido peryódico de Schiff reveló reacción en los componentes glomerulares del tipo de asas glomerulares y el mesangio, resaltando el aspecto nodular. A pesar de tratarse de un material reactivo a esta coloración, y de que la microscopía de luz no evidenció los cilindros, los hallazgos de la inmunofluorescencia demostraron la intensa reacción de las cadenas ligeras kappa en las asas glomerulares y en el fondo del tejido, lo cual obligó a hacer más estudios hematológicos para llegar al diagnóstico. Ácido peryódico de Schiff, 40X.
Caso 2
Se trata de un paciente de 68 años con diagnóstico de enfermedad renal crónica terminal asociada a nefropatía hipertensiva, quien llevaba dos años en hemodiálisis. En el protocolo para el trasplante renal se documentó la presencia de trombocitosis confirmada por hematología; finalmente, se determinó que era una trombocitemia esencial en la médula ósea, lo cual no constituía una contraindicación para el procedimiento.
En el 2013, el paciente fue sometido a trasplante de donante fallecido, y recibió inducción con basiliximab más metilprednisolona y tratamiento de mantenimiento con ciclosporina, micofenolato y prednisona. Veinte días después del trasplante, el paciente presentó rechazo celular agudo, el cual se trató inicialmente con bolos de esteroides y, posteriormente, con tacrolimus, con lo cual se recuperó la función del injerto y se alcanzaron niveles de creatinina basal de 1,2 mg/dl.
Quince meses después, presentó elevación aguda de la creatinina hasta alcanzar 5,7 mg/dl, por lo cual se sospechó un nuevo rechazo agudo del injerto. Se le administraron bolos de esteroides y se le hizo una biopsia renal, en la cual se detectó una nefropatía por cilindros; en consecuencia, se practicaron estudios de hematología complementarios, los cuales confirmaron la existencia de mieloma múltiple (cuadro 1). El paciente recibió tratamiento con bortezomib y dexametasona con buen resultado terapéutico, y recuperó la función renal hasta los valores basales. Transcurridos dos años desde el diagnóstico de mieloma múltiple, el paciente se ha mantenido estable y sin recaídas.
Caso 3
Se trató de un paciente de 75 años, con enfermedad renal crónica terminal de etiología desconocida según los estudios previos, quien llevaba tres años en hemodiálisis cuando recibió el trasplante renal de donante fallecido en el 2007. En la electroforesis contemplada en el protocolo previo al trasplante, se registraron valores normales de proteínas, y el paciente recibió inducción con alemtuzumab más metilprednisolona, y tratamiento de mantenimiento con ciclosporina, azatioprina y esteroides. Posteriormente, se cambió a tacrolimus por intolerancia a la ciclosporina y sus niveles de creatinina quedaron en 0,7 mg/dl.
A los cuatro meses del trasplante, el paciente presentó meningitis tuberculosa, para la cual recibió tratamiento, pero hubo secuelas neurológicas graves. Durante su evolución, el paciente desarrolló, además, falla cardiaca isquémica, la cual se manejó en forma conservadora.
Ocho años después, presentó una elevación aguda de la creatinina (2 mg/dl) y proteinuria. En la biopsia renal se reportó glomeruloesclerosis nodular, a pesar de que el paciente no era diabético (figura 1 c y d), en tanto que, mediante otros estudios, se estableció el diagnóstico de enfermedad linfoproliferativa del tipo de mieloma múltiple después del trasplante, pues su aparición fue muy tardía con respecto al trasplante renal (cuadro 1). Dadas las múltiples enfermedades descritas y el delicado estado funcional del paciente, se decidió un manejo paliativo sin quimioterapia y dos meses después falleció.
Discusión
Se presentan tres casos clínicos de pacientes con trasplante de riñón que tuvieron disfunción aguda del injerto renal atribuida inicialmente a otras causas, como rechazo, toxicidad por la acción de medicamentos inhibidores de la calcineurina o infección viral, y en quienes la biopsia renal hizo sospechar un mieloma múltiple como nuevo diagnóstico, el cual se confirmó con los estudios complementarios. Con el tratamiento se lograron restablecer los valores hematológicos y recuperar la función renal, sin necesidad de recurrir a diálisis en dos de los pacientes, en tanto que en el paciente del caso 3, se decidió administrar el tratamiento conservador debido a la presencia simultánea de diversas enfermedades que finalmente llevaron a su muerte.
El mieloma múltiple es una neoplasia de células plasmáticas productoras de proteínas monoclonales o paraproteínas, el cual se manifiesta con un comportamiento ineficiente de las inmunoglobulinas, compromiso de la función de la médula ósea y destrucción del tejido óseo. Representa el 1 % de todos los cánceres, tiene una incidencia anual de 4 por 100.000 habitantes, la mediana de edad en el momento del diagnóstico es de 65 años y es más frecuente en afroamericanos. Los síntomas más frecuentes en el momento del diagnóstico son dolor óseo, astenia, adinamia, pérdida de peso y parestesias; se encuentra hipercalcemia en el 28 % de los pacientes, anormalidades en los rayos X hasta en el 80 %, lesiones líticas en el 57 % y, en menor frecuencia, osteoporosis, fracturas patológicas y compresión de la médula espinal.
El compromiso renal es frecuente y muchas veces se requiere diálisis, ya que el trasplante renal está contraindicado en los pacientes en quienes se presenta. El mieloma múltiple continúa siendo incurable en la mayoría de los casos, con una mediana de supervivencia de tres años (2,3).
La manifestación renal más común del mieloma múltiple es la nefropatía por cilindros de cadenas livianas (riñón de mieloma) (4), la cual resulta de la acumulación y depósito de paraproteínas monoclonales en el riñón, con el consecuente efecto tóxico directo sobre el epitelio tubular y la formación de cilindros con obstrucción secundaria y deterioro progresivo de su función (4,5).
En las imágenes en el microscopio de luz, se observan cambios indicativos de lesiones localizadas, en su mayoría, en el compartimiento intersticial entre los túbulos, con túbulos distales dilatados y conductos colectores cuyos cilindros no se tiñen con ácido peryódico de Schiff, y que resultan en atrofia y fibrosis intersticial (5,6). Mediante inmunofluorescencia se confirma el diagnóstico con base en la expresión intensa de una de las cadenas ligeras lambda o kappa y, con menor frecuencia, de alguna de las cadenas pesadas, tanto en el fondo del tejido como en los cilindros (4-6). Precisamente esta fue la manifestación que se presentó en dos de los casos aquí estudiados, confirmada luego como nefropatía por cilindros en la biopsia, lo cual condujo, a su vez, a la confirmación del diagnóstico de mieloma múltiple en ambos casos (figura 1 a y b).
El efecto en los capilares glomerulares y el mesangio es menos frecuente; sin embargo, estos son sitios de preferencia para el depósito anormal de proteínas. El compromiso glomerular puede presentarse en tres categorías reconocidas:
1) enfermedades con formación de fibrillas, tales como amiloidosis o glomerulonefritis fibrilar, así como enfermedades con formación de estructuras organizadas que sugieren microtúbulos, como glomerulonefritis crioglobulinémica, glomerulonefritis inmunotactoide o glomerulonefritis con depósitos de inmunoglobulina monoclonal microtubular organizada;
2) enfermedades con depósitos granulares electrodensos, como la de depósito de inmunoglobulina monoclonal, la de depósito de cadenas ligeras y la de depósito de cadenas pesadas; y
3) las glomerulopatías, cuyos mecanismos fisiopatológicos no se han dilucidado totalmente en el mieloma múltiple, entre ellas, la glomerulonefritis membranoproliferativa, la púrpura de Henoch-Schölein, la nefropatía por IgA, la enfermedad de cambios mínimos, la glomeruloesclerosis focal y la segmentaria, la enfermedad antimembrana basal glomerular y la poliangitis microscópica asociada a los ANCA (Anti-Neutrophil Cytoplasmic Antibodies) (7).
La forma más frecuente es la amiloidosis, seguida por la enfermedad por depósito de inmunoglobulina monoclonal (7,8). En el caso 3 aquí reportado, la biopsia reveló glomerulesclerosis nodular sin presencia de amiloide (figura 1 c y d), el cual es un hallazgo histológico infrecuente de la enfermedad por depósito de inmunoglobulina monoclonal, que se caracteriza por no presentar afinidad por el rojo Congo ni birrefringencia al ser expuesto a luz polarizada, lo cual la diferencia de la amiloidosis; sin embargo, es una de las lesiones cuyo diagnóstico diferencial es la nefropatía diabética o glomeuloesclerosis nodular en grandes fumadores. El paciente del caso 3 no tenía estos antecedentes y en su biopsia renal se detectó una diferencia importante en la expresión de las cadenas ligeras kappa, tanto en el fondo como en la membrana basal glomerular, por lo cual se hicieron estudios adicionales y se logró diagnosticar el mieloma múltiple. De allí, la importancia de considerar esta condición y de hacer una biopsia con las tinciones adecuadas para evitar diagnósticos erróneos.
Otros tipos de compromiso renal asociados al mieloma múltiple son la hipercalcemia, la sepsis, la nefrotoxicidad por medicamentos o medios de contraste, los estados de hiperviscosidad por el acúmulo de inmunoglobulinas, el síndrome de lisis tumoral o compromiso posrrenal por litiasis, pero estos son menos frecuentes y no ocurrieron en los casos reportados (6,7).
Resulta complicado diferenciar el mieloma múltiple de nuevo diagnóstico de una recaída después del trasplante, porque muchas veces se trata de formas subclínicas de la enfermedad presentes antes del trasplante que no se detectan con los exámenes del protocolo (9). Además, en los pacientes con enfermedad renal crónica terminal de etiología idiopática diagnosticada antes del trasplante (30,8 % de los casos aquí presentados), no se hace biopsia renal porque no aporta información útil por tratarse de riñones con fibrosis y, en cambio, sí implica un mayor riesgo de complicaciones.
En dos de los tres casos que se describen hubo seguridad de que se trataba de un mieloma múltiple de nuevo diagnóstico (casos 2 y 3), ya que en uno se presentó ocho años después del trasplante, tiempo de evolución improbable para un mieloma múltiple de lenta evolución que hubiera estado presente antes del trasplante, y dado el antecedente de trombocitosis en el otro paciente, se contaba con los resultados de los estudios hematológicos previos al trasplante, los cuales descartaban la enfermedad en ese momento (biopsia de médula ósea, inmunofijación en sangre y orina, serie de huesos largos).
En el tercer caso, el mieloma múltiple se diagnosticó ocho meses después del trasplante; antes del procedimiento quirúrgico, se había practicado electroforesis de proteínas en suero y orina, como parte del protocolo previo al trasplante, para la tamización de mieloma múltiple, sin que se demostrara pico monoclonal. No obstante, debe tenerse en cuenta que estos estudios no detectan el mieloma múltiple no secretor, para lo cual se requieren estudios adicionales. Por esta razón, es probable que el mieloma ya estuviera presente con evolución lenta. Así, la incidencia global calculada después del trasplante en este grupo de pacientes fue de 0,36 %.
Hasta donde se pudo constatar en los artículos consultados, se han descrito siete casos de mieloma múltiple de nuevo diagnóstico después de trasplante. En dichos casos, el diagnóstico fue tardío y se requirieron dos biopsias del injerto, la primera de las cuales evidenció cambios intersticiales inusuales entre los túbulos, pero, posteriormente, los hallazgos típicos permitieron el diagnóstico definitivo sin que se registraran valores anormales en los estudios hematológicos previos al trasplante (4-11). La mayoría de los pacientes fueron tratados con esteroides, melfalán y talidomida; en dos casos se administró bortezomib, pero solo en uno de ellos se pudo recuperar la función renal; en los demás hubo una recuperación de los valores hematológicos, pero también, se requirió nefrectomía del injerto o terapia de reemplazo renal.
El tratamiento del riñón afectado por el mieloma se basa en la corrección de factores reversibles que favorecen la precipitación de los cilindros, como son la deshidratación, la infección y la hipercalcemia, así como la disminución de la producción de cadenas livianas con la quimioterapia, su disminución rápida con plasmaferésis, y la terapia de reemplazo renal en caso de ser necesaria (4,5,8). El bortezomib, un inhibidor del proteosoma, ha demostrado ser efectivo para mejorar las tasas de mejoría y lograr la remisión completa, la supervivencia libre de progresión, la supervivencia global y la recuperación de la función renal antes y después del trasplante renal (12).
Los tres casos que se describen aquí confirman la necesidad y la importancia de efectuar un estudio minucioso antes del trasplante, y determinar tan pronto como sea posible la etiología de la falla renal para descartar el compromiso por mieloma múltiple. En caso de que el resultado de los exámenes sea negativo, debe seguir sospechándose la presencia de esta condición después del trasplante, cuando la causa del deterioro de la función renal no sea clara, puesto que el tratamiento oportuno evita las complicaciones renales y las hematológicas (9).
En la mayoría de los pocos casos de mieloma múltiple primario después del trasplante descritos hasta ahora, no se logró la recuperación del injerto renal y se requirió nuevamente diálisis y, en algunos casos, nefrectomía. En dos de los casos que se presentan aquí, hubo una evolución satisfactoria, con estabilización de la función renal y recuperación de los valores hematológicos; en el tercer caso, el desenlace fatal se debió a las múltiples enfermedades concomitantes, lo cual constituía un mal pronóstico por no poder tratarse con quimioterapia. Esto confirma la necesidad de sospechar siempre esta condición, ya que las opciones de tratamiento con quimioterapia y el trasplante de médula ósea son la única alternativa con un eventual efecto a largo plazo.
Conclusión
El compromiso renal por mieloma múltiple es una condición clínica infrecuente en el periodo posterior al trasplante renal; sin embargo, debe sospecharse cuando la causa de disfunción del injerto no es clara y en la biopsia se reportan hallazgos indicativos de esta neoplasia hematológica. El tratamiento oportuno puede mejorar el pronóstico y propiciar la supervivencia del paciente.