El interés por los efectos de la picadura de insectos en la salud humana se centra en la transmisión de enfermedades infecciosas como el chikungunya y el dengue. No obstante, hay otras condiciones médicas de hipersensibilidad a sus antígenos que son frecuentes, sobre todo en los países tropicales. La urticaria papular, también llamada prurigo estrófulo, es una de las enfermedades dermatológicas más comunes en los niños. Aunque se describió ya hace dos siglos, su relación con la picadura de insectos no siempre fue evidente. En los años 50, Shaffer, et al., fueron los primeros en describir en sus estudios científicos la relación causal entre la enfermedad y la exposición al agente (1,2).
La urticaria papular se relaciona claramente con factores geográficos y climáticos, pues depende de la exposición a ciertos agentes causales y, en algunas ocasiones, a condiciones socioeconómicas asociadas con la pobreza (3,4). En el caso de Colombia, en las regiones de clima frío predominan las especies de pulga causantes de la enfermedad (García E, Halpert E. Inmunopatogénesis del prúrigo estrófulo causado por la picadura de pulga en humanos. Informe Técnico Final. 1998. Código 6221-04-030-93) (5), en tanto que en las zonas más cálidas, se asume que las especies de mosquito, tan comunes en el clima tropical y en ambientes tanto urbanos como rurales, son las transmisoras, aunque no hay publicaciones sobre las características de la enfermedad ni sobre su importancia epidemiológica. En estas regiones del país, el contacto de la población con los insectos vectores se evidencia en las epidemias de infecciones como el dengue, el chikunguya y el zika (6). Sin embargo, no se puede descartar que la urticaria papular sea causada por otros agentes, como los chinches.
El objetivo de la presente revisión fue profundizar en los aspectos epidemiológicos e inmunológicos de la urticaria papular, principalmente en los países de Latinoamérica. Se hizo una revisión no sistemática mediante la búsqueda electrónica en PubMed, OvidSP, Scielo y Google académico de estudios sobre la epidemiología de la enfermedad, las características entomológicas de los agentes causales y los mecanismos inmunológicos asociados, sin fijar límites de fecha, idioma o tipo de artículo.
Espectro clínico de las reacciones causadas por picaduras de mosquitos y pulgas
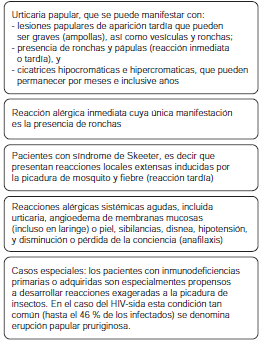
Las manifestaciones de hipersensibilidad causadas por la picadura de insectos, principalmente mosquitos, incluyen un amplio espectro de condiciones que van desde reacciones inflamatorias locales de tipo inmediato hasta las sistémicas, como la anafilaxia. En la figura 1 se presenta una propuesta de clasificación de condiciones clínicas asociadas a la hipersensibilidad a la picadura de insectos que deben tenerse en cuenta para entender las particularidades de la urticaria papular, la cual, probablemente, constituye la de mayor importancia médica en el trópico.
En los países de la zona templada, la aparición estacional de los mosquitos marca una situación diferente para el reconocimiento inmunológico de sus antígenos, en comparación con el que determina el contacto permanente con ellos de los habitantes de la zona tórrida. Ya sea porque este contexto de exposición antigénica tiene realmente un efecto inmunomodulador en las manifestaciones clínicas, o porque simplemente no se han reportado los casos respectivos, el hecho es que no se conoce la incidencia de las reacciones sistémicas a la picadura de estos insectos en nuestros países. Por ello, y dado que se hizo una buena caracterización clínica, la recopilación de las reacciones sistémicas de hipersensibilidad más importantes incluyó casos de varios países del mundo (Japón, Canadá, Suiza y Alemania), todos ellos países de clima templado, en los cuales hay evidencia de que la IgE específica de la saliva del mosquito tiene relación con la enfermedad (7).
Los problemas dermatológicos asociados a la picadura de pulga son de presentación menos cosmopolita. En algún momento sus infestaciones en algunas zonas de Norteamérica fueron un problema (8), de ahí el interés por entender la respuesta inmunológica frente a sus antígenos, pero ahora, dada la mejoría de las condiciones higiénicas en estos países, es más común que se presente en los países en desarrollo con climas fríos, como los localizados en las altitudes andinas. Conocemos poco sobre las manifestaciones clínicas asociadas a la picadura de la pulga en humanos aparte de la urticaria papular, y no se conocen casos de reacciones sistémicas secundarias a su picadura.
La urticaria papular es una enfermedad inflamatoria crónica causada por la exposición a la picadura de artrópodos, siendo los mosquitos y las pulgas los agentes causales más comunes, aunque se sabe de otros insectos capaces de producir una reacción cutánea similar (9). Esta reacción de hipersensibilidad se puede manifestar más comúnmente con pápulas, pero también, con ronchas, vesículas, ampollas y costras. Ocasionalmente, los pacientes pueden desarrollar cicatrices hipocrómicas o hipercrómicas en la piel; la enfermedad también produce prurito e infecciones graves (figura 2).
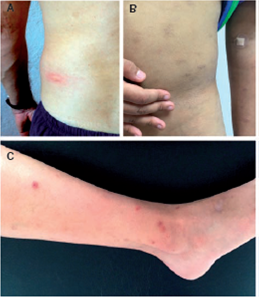
Figura 2 Lesiones típicas que se presentan en la urticaria papular. A. Roncha que aparece como reacción inmediata a la picadura de mosquito. B. Cicatrices hipercromáticas crónicas en el abdomen debidas a la picadura de mosquito C. Lesiones papulares en la extremidad inferior por picadura de pulga (reacción tardía).
En el diagnóstico de la urticaria papular se tiene en cuenta principalmente la aparición de la reacción de hipersensibilidad tardía tras la picadura del insecto. El problema principal en regiones donde los agentes causales son permanentes es que las lesiones son recurrentes y se pueden presentar todas las ya mencionadas en un mismo cuadro clínico.
En la valoración clínica de un paciente con urticaria papular, normalmente no se observa la evolución completa desde sus inicios, razón por la cual se destacan los estudios experimentales que han permitido conocer la evolución natural de la reacción inmunitaria a la picadura de insectos en la urticaria papular y su relación con las manifestaciones clínicas. Llama la atención que, en humanos y en modelos animales, se han apreciado manifestaciones y patrones inmunológicos similares.
Hudson, et al., analizaron a un grupo de pacientes con urticaria papular y los expusieron a la picadura de tres especies de pulga diferentes (Ctenocephalides felis, Pulex irritans y P. simulans) en el antebrazo. En un periodo de seguimiento de 15 días observaron eritema en el sitio de la picadura. Luego de 20 minutos, aparecía un habón que catalogaron como reacción de hipersensibilidad inmediata. Al cabo de 24 horas, se desarrollaba una pápula o induración, o vesículas, en lo que se conoce como reacción tardía. La respuesta a las tres especies de pulga fue similar. Además, los autores observaron que la gran mayoría de los pacientes presentaba una reacción tardía, aunque no siempre habían tenido una reacción inmediata (10). Oka, et al., observaron, por su parte, un patrón similar de reacción en un seguimiento clínico de la picadura del mosquito Aedes albopictus en un grupo de individuos japoneses entre uno y 68 años de edad (n=162). Observaron que una proporción sustancial de pacientes (65 %) presentaba reacción tardía, acompañada en algunos casos de una reacción inmediata, cuya intensidad disminuía significativamente con la edad (11).
Epidemiología de la urticaria papular
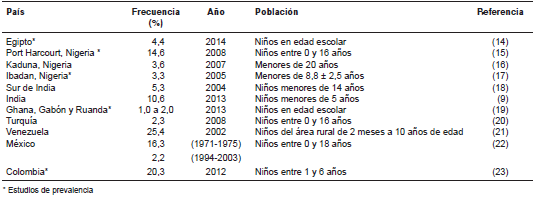
Es común que la urticaria papular se presente en niños de 2 a 10 años, aunque los adultos también pueden verse afectados (12,13). En el cuadro 1 se presenta la frecuencia de la enfermedad en distintos lugares del mundo, principalmente en las regiones intertropical y subtropical. Son pocos los estudios diseñados para determinar la prevalencia de la enfermedad, y la mayoría de la información se refiere a su frecuencia en series de casos atendidos en centros médicos. El único estudio de prevalencia de urticaria papular en Latinoamérica se hizo en Bogotá. Se trató de un estudio de diseño transversal con un muestreo aleatorio estratificado que incluyó a 2.437 niños de 1 a 6 años de edad que asistían a instituciones educativas de la ciudad. Se encontró que la prevalencia fue de 20,3 %, la cual es mayor que las registradas previamente en otros países (23). La disminución en las cifras de presentación en la adultez podría explicarse por los mecanismos de tolerancia asociados a la exposición continua en un ambiente constante. No obstante, se ha observado que si hay una alta exposición en la edad adulta, las cifras de presentación son tan altas como en los niños.
Los factores de riesgo para desarrollar la enfermedad dependen en gran medida de la población analizada. En Bogotá, por ejemplo, fueron la presencia de pulgas en la vivienda (razón de probabilidad - odds ratio, OR=1,72; IC95% 1,32-2,24) y otros de tipo ambiental que facilitarían el contacto con estos vectores, como el uso de transporte público y los relacionados con la pobreza (viviendas con piso de tierra y colchón de mota) (5). En una población rural de Venezuela, se encontró que las parasitosis intestinales eran más frecuentes en niños con urticaria papular que en los controles (25).
Desde el punto de vista genético, habría varios factores que determinan la predisposición a padecer la enfermedad, entre ellos, la predisposición atópica asociada a enfermedades de la piel y a ser picado por insectos. La urticaria papular no está asociada con los antecedentes personales o familiares de alergia respiratoria (asma y rinitis alérgica) (11,26), pero sí se ha encontrado una asociación con los antecedentes de dermatitis atópica en hermanos (Halpert E, enviado para publicación).
En algunos artículos se sugiere que existe una predisposición genética a ser picado por insectos que variaría según la especie. Este factor ha suscitado bastante interés en el caso de los mosquitos por su condición de vectores de varias enfermedades tropicales de gran morbimortalidad. Se ha demostrado la gran importancia de la herencia en el rasgo de la atracción de los mosquitos, la cual se relaciona con la liberación de compuestos volátiles que son detectados por los insectos mediante el olfato (27).
Hay algunas pruebas sobre el papel del antígeno leucocitario humano (human leukocyte antigen, HLA) en la determinación de los olores que atraen a los mosquitos (28), hipótesis que también se sustenta en la identificación de un receptor de olor en el mosquito asociado con su preferencia por picar humanos (29).
Agentes etiológicos
La ubicación en el trópico y los accidentes montañosos hacen que Colombia tenga varios pisos térmicos, lo cual influye en la distribución ecológica de los insectos. En cuanto a los insectos relacionados con la urticaria papular, se sabe que los mosquitos predominan en los pisos térmicos más cálidos y, las pulgas, en las regiones más frías del país. La ausencia de estaciones en el trópico permite un clima constante durante todo el año, lo cual determina que la exposición a determinado agente causal sea permanente (9).
En Colombia, solo hay información epidemiológica sobre la asociación estadística entre la presencia domiciliaria de la pulga y la urticaria papular en la población bogotana (OR=1,72, IC95% 1,32-2,24) (García E, Halpert E. Inmunopatogénesis del prúrigo estrófulo causado por la picadura de pulga en humanos. Informe Técnico Final. 1998. Código 6221-04-030-93), (Torres M, García E, Halpert E, Borrero E, Chaparro P, Ibáñez MM, et al. Siphonaptera (Pulicidae) en viviendas de Bogotá, Colombia. Biomédica. 2011;31(Supl. 3): 76-7. Memorias, XX Congreso Latinoamericano de Parasitología y XV Congreso Colombiano de Parasitología y Medicina Tropical). No obstante, cabe plantearse que en climas y condiciones ambientales similares haya presencia domiciliaria de la pulga.
Pulga
Estos insectos pertenecen al orden Siphonaptera que comprende alrededor de unas 2.574 especies agrupadas en 16 familias (30). Son pocas las especies que se asocian con los humanos. La familia Pulicidae incluye las especies de pulgas más cercanas al hombre, entre las cuales las de mayor importancia médica (31) son P. irritans, C. felis, C. canis y Tunga penetrans. Pulex irritans tiene la especificidad más baja por el huésped y puede atacar diferentes especies, incluidos los seres humanos (32). La pulga del gato, C. felis, es la especie más común entre los animales domésticos de todo el mundo (33). Ctenocephalides canis se conoce generalmente como la pulga del perro, pero también, puede atacar a animales salvajes, domésticos y a los seres humanos (31). Tunga penetrans causa una ectoparasitosis bastante frecuente en algunos países de Latinoamérica y el Caribe, que se propaga por la postura de huevos de la hembra en la piel de huéspedes infectados (34,35). Los patrones de distribución geográfica de las pulgas pueden ser diferentes en función de las condiciones ambientales específicas (36).
En Colombia, las especies C. felis y P. irritans son las más frecuentes y se encuentran principalmente en animales domésticos y en ratas (37,38). En un estudio exploratorio en Bogotá, en el 50 % de 30 casas de personas con urticaria papular se encontraron pulgas, principalmente en aquellas donde había perro, pero no se encontraron otros artrópodos (García E, Halpert E. Inmunopatogénesis del prurigo estrófulo causado por la picadura de pulga en humanos. Informe Técnico Final. 1998. Código 6221-04-030-93). Posteriormente, en un estudio aleatorio (casas de niños con urticaria papular y casas de niños sanos en zonas urbanas de Bogotá), se detectaron pulgas, principalmente de las dos especies mencionadas, en alrededor de 11 % de las viviendas (Torres M, García E, Halpert E, Borrero E, Chaparro P, Ibáñez MM, et al. Siphonaptera (Pulicidae) en viviendas de Bogotá, Colombia. Biomédica. 2011;31(Supl. 3): 76-7. Memorias, XX Congreso Latinoamericano de Parasitología y XV Congreso Colombiano de Parasitología y Medicina Tropical).
Desde el punto de vista de la alergología, la pulga más estudiada ha sido C. felis. En estudios en perros se han identificado tres alérgenos de pulga (39). También, hay estudios en humanos en los cuales se ha demostrado que los pacientes con urticaria papular generan IgE con varios componentes del extracto de pulga (26,40).
Mosquitos
Los mosquitos pertenecen al orden Diptera y las especies más comunes son de la familia Culicidae; la mayoría son hematófagos. Aunque se han descrito alrededor de 3.000 especies de mosquitos, solo unas pocas tienen importancia inmunológica por su contacto con el humano y los efectos de su picadura en la salud. Entre estas, las más importantes por su amplia distribución en el mundo son A. aegypti, A. vexans, A. albopictus, Culex pipiens y C. quinquefasciatus (41,42). La clasificación más completa de las especies en Colombia data de 1955 y en ella se registraron 164 especies de mosquito, la mayoría de los géneros Culex, Anopheles y Aedes (43), de los cuales Aedes y Culex han sido los más estudiados desde el punto de vista alergológico como fuentes de antígenos asociadas a reacciones de hipersensibilidad inmediata y tardía en el humano (44). Sin embargo, en pocos estudios se ha explorado su relación con la urticaria papular (45).
Aedes aegypti predomina en los climas tropicales y su distribución en el país está limitada por la altitud. Aedes albopictus es otra especie de mosquito registrada en Colombia, la cual se ha adaptado a pisos térmicos más templados, como el de Medellín (46). En cuanto al género Culex, C. quinquefasciatus es la especie más abundante en el trópico, a diferencia de C. pipiens, la cual se distribuye en otras latitudes del mundo (Viejo Mundo y Norteamérica). El cambio climático ha permitido la supervivencia de mosquitos en altitudes inesperadas de Colombia (47). Al aumentar la temperatura, los culícidos se tornan más activos, las larvas de los mosquitos tardan menos en madurar y se adaptan más fácilmente a otros ecosistemas (48), por lo cual en el país, C. quinquefasciatus se ha registrado en el rango de 0 hasta 2.600 metros sobre el nivel del mar (49).
En diferentes países de América, especialmente en México, se ha evidenciado la migración de diferentes especies de mosquito debido al cambio climático y se han desarrollado modelos que buscan reproducir las consecuencias del aumento de la temperatura en el ciclo biológico de este vector. En este contexto, el panel intergubernamental sobre cambio climático y la Organización Panamericana de la Salud concluyeron que el cambio climático, que deja fuertes lluvias, altas temperaturas y sequía, propicia el aumento de las enfermedades infecciosas transmitidas por mosquitos, como el dengue (50-54). Por ello, además de las enfermedades infecciosas transmitidas por estos vectores, la mayoría de la población latinoamericana puede desarrollar reacciones de hipersensibilidad a su picadura.
Reacción inmunológica asociada a la urticaria papular
Hallazgos histológicos
Los estudios histopatológicos de las lesiones por urticaria papular apuntan a la presencia de un componente alérgico en su patogenia, pues es común observar un infiltrado inflamatorio rico en eosinófilos y linfocitos (55). García, et al., también encontraron un predominio de estas poblaciones celulares en biopsias de lesiones dérmicas causadas por picadura de pulga; no obstante, llama la atención el hecho de que el 80 % de los pacientes estudiados obtuvo resultados negativos en una prueba epicutánea con extracto de pulga (26), lo cual puede deberse al tipo de extracto alergénico utilizado (somático), pues la mayoría de los alérgenos involucrados en la hipersensibilidad a la picadura de insectos se encuentran en la saliva del animal, a partir de la cual es dispendioso producir un extracto natural (56). En el estudio citado, también se observó una variación en la proporción de células CD8+/CD4+ según el tiempo de evolución de las lesiones. En las fases más tempranas, fueron más abundantes los linfocitos T CD8+, lo cual podría generar una mayor actividad de necrosis y citotoxicidad, y causar reacciones graves más características al inicio del cuadro clínico (26).
Respuesta humoral
Se ha observado que algunos componentes del extracto de pulga son reconocidos con mayor frecuencia en niños con urticaria papular que en niños sanos. En un estudio, la reacción de la IgE a bandas en el rango de 31 a 35 kDa fue alrededor de dos veces más frecuente en los casos de urticaria papular que en los controles. Por otra parte, las bandas de 16 a 20 kDa fueron reconocidas por 33,4 % de los pacientes, pero por ninguno de los sujetos de control (40). Cuando se hicieron pruebas de activación de basófilos con fracciones de distinto peso molecular del extracto de cuerpos de pulga, se encontró que, en las bandas de menos de 50 kDa y en las de 50 a 100 kDa, el promedio de expresión del marcador de activación CD63 era mayor en los niños con urticaria papular (57).
En algunos estudios se ha evaluado el papel de la IgE en la urticaria papular inducida por mosquito. Reunala, et al., encontraron frecuencias similares de unión a la IgE entre pacientes con urticaria papular y controles provenientes de zonas tropicales (Kenia y México), a diferencia de lo que observaron en pacientes con hipersensibilidad a la picadura de mosquito de un país con un clima entre templado y frío (Finlandia), en donde sí fue clara la diferencia estadística entre sanos y enfermos (45). Al igual que en este estudio, en otros se ha demostrado que en latitudes no tropicales se registraba una clara diferencia en la reacción de la IgE entre sanos y pacientes con hipersensibilidad (58,59). En contraste, en Egipto, otro país ubicado principalmente en el trópico, no se encontraron diferencias significativas entre el reconocimiento de la IgE de las bandas del extracto de pulga o del de mosquito (60). Según estos hallazgos, pueden existir otros factores determinantes en la patogenia de la enfermedad. Es posible que en los países tropicales en los que la exposición a la picadura de insectos es continua, la presencia de la IgE contra alérgenos de la saliva de insectos no sea determinante para la aparición de la enfermedad.
La reacción de la IgE varía según el tiempo de evolución de la enfermedad (40). Así, en los pacientes con dos a cinco años de evolución, la IgE reconoce un mayor número de bandas que en aquellos con una evolución menor de dos años o mayor de cinco. Este mismo periodo coincide con la etapa clínica, en la cual se presenta de manera más intensa la enfermedad. En el estudio de Peng, et al., se encontró una correlación entre los niveles de IgE específica para el extracto de saliva del mosquito y el tamaño de la induración inmediata o tardía inducida por una prueba epicutánea con la misma preparación (61).
De todas las subclases de IgG, la IgG3 parece relacionarse con la protección frente a la enfermedad, pues la frecuencia general de reconocimiento de bandas por parte de este isotipo fue significativamente mayor en el grupo de control. No obstante, el perfil de la respuesta humoral al parecer cambia según el tiempo de evolución de la enfermedad. Los pacientes con más de cinco años desde la aparición de los síntomas tienen tasas de reacción con IgG3 similares a las del grupo de control, especialmente a las proteínas de 31 a 35 kDa, lo cual sugiere que en esta etapa de la enfermedad los pacientes están insensibilizándose frente a los antígenos de la pulga, como es de esperarse por la historia natural de esta condición (40).
Se ha descrito que el HIV-sida puede cursar con una potenciación de la reacción de Th2 e IgE. En este sentido, llama la atención que, en pacientes de países tropicales con esta inmunodeficiencia, aparezca frecuentemente una erupción papular pruriginosa que parece estar relacionada con la picadura de artrópodos. En la mayoría de las lesiones de piel examinadas, su estudio por histopatología evidenció señales características de una picadura de insecto (62). En otro estudio se encontró una asociación significativa entre el antecedente de picaduras diarias de mosquitos y el desarrollo de esta condición dermatológica (63). Se ha encontrado que los pacientes con urticaria papular y HIV tienen resultados positivos en la prueba cutánea con mayor frecuencia que los controles sanos, lo cual sugiere la presencia evidente de un componente atópico mediado por la IgE en esta condición (64).
Respuesta celular
En un estudio de pacientes con urticaria papular inducida por picadura de pulga, se observó una reacción afín con el perfil Th2, pues tras la estimulación policlonal de células mononucleares periféricas, se detectó un porcentaje de linfocitos T CD4+ IL-4+ mayor que en los controles sanos, mientras que la proporción de linfocitos T IFNγ + fue significativamente menor (65).
En otro estudio, la exposición de células dendríticas aisladas de pacientes con urticaria papular al extracto de pulga y al lipopolisacárido aumentó significativamente la expresión de moléculas de membranas, como las CD83, CD86 y el HLA-DR (Human Leukocyte Antigen - antigen D Related), e indujo una disminución en la producción de interleucinas reguladoras, como la IL-10 (66). Otro hallazgo importante relacionado con esta población celular fue su menor cantidad en pacientes que en controles sanos, lo cual sugiere que cumplen un papel en la patogenia de la enfermedad (67).
Domínguez-Amorocho, et al., analizaron la producción de citocinas por parte de los linfocitos T CLA+ (antígeno leucocitario cutáneo, un receptor de "atracción" [homing] hacia la piel) y encontraron un alto porcentaje de linfocitos CD4+ CLA+ que producían IL-4, IL-10 e IL-17, además de un gran número de células CLA- que producían IFNγ. Por otro lado, en pacientes con más de cinco años de evolución, la población de linfocitos CD4+ con mayor producción de IL-10 e IFNγ - fueron los CLA-, mientras que los CLA+ mostraron mayores niveles de IL-17. Estos datos demuestran la importancia de los linfocitos CD4+ IL-4 en la reacción inflamatoria local en la piel, y sugieren, además, que los síntomas más graves al comienzo de la enfermedad pueden estar asociados con la reacción de la Th2 en el tejido cutáneo (67).
Modelos animales
En otros mamíferos, la pulga también produce reacciones de hipersensibilidad en la piel. En perros, se producen reacciones dérmicas de hipersensi-bilidad, en las cuales están presentes marcadores inmunológicos de respuesta de la Th2 (68). Esta condición se denomina dermatitis alérgica por picadura de pulga, y es una de las afecciones más comunes en los perros y gatos que viven en áreas endémicas. Los animales propensos presentan prurito intenso cuando son picados por las pulgas y, tratando de calmarlo, se lastiman la piel, con la consecuente aparición de excoriaciones, alopecia e infecciones secundarias por bacterias y hongos.
En un estudio, las pruebas histopatológicas de las lesiones mostraron que la respuesta inmediata concordaba con un patrón de hipersensibilidad de tipo I y se caracterizaba principalmente por la presencia de edema y eosinófilos. Por otro lado, en la respuesta tardía se apreció un mayor número de linfocitos T, característico de la reacción de hipersensibilidad de tipo IV, así como un infiltrado de basófilos, los cuales alcanzaron su pico máximo a las 24 horas. Además, se encontró que los eosinófilos persistían en el inicio de esta fase, lo cual sugiere que la IgE tiene un papel en la respuesta tardía (69).
Se ha encontrado que los niveles de IgE e IgG en los perros con dermatitis alérgica por picadura de pulga son mayores que en los que nunca han estado en contacto con las pulgas (70). Sin embargo, en un estudio de McKeon, et al,, se encontró que los anticuerpos presentes en el suero de ambos grupos de perros identificaron una gran variedad de antígenos, pero no se observó ningún patrón de reacción que distinguiera entre los perros alérgicos y los no alérgicos (71). Estos resultados sugieren que quizá existe poca asociación entre la respuesta particular de los anticuerpos y la reacción alérgica en los perros con pulgas.
Utilizando un modelo experimental de dermatitis alérgica por picadura de pulga en el que se estudiaron dos grupos de perros, los expuestos continuamente versus los expuestos episódica-mente, se encontró que aquellos con exposición continua tenían niveles más altos de IgE que los expuestos episódicamente. Además, se halló una correlación entre las manifestaciones clínicas y los niveles de IgE específica en el grupo de los expuestos continuamente. Sin embargo, en el grupo de expuestos episódicamente no se encontró relación e incluso algunos perros pre-sentaron manifestaciones clínicas con títulos de IgE negativos (68). Estos resultados sugieren que quizá los niveles de IgE no se correlacionan con la gravedad de las manifestaciones clínicas y es posible que otros mecanismos estén involucrados. En conclusión, la respuesta de tipo 2 parece ser esencial en la aparición de la enfermedad, no obstante, no en todos los casos la IgE es un mecanismo efector de la reacción inflamatoria.
Alérgenos
La IgE es necesaria pero no suficiente en el desarrollo de distintas manifestaciones alérgicas. En el caso de las enfermedades de hipersensibilidad asociadas a la reacción inmunológica de tipo 2 con predominio de la respuesta tardía, como el caso de la urticaria papular, incluso se discute su necesidad. Entre los agentes causales asociados se han descrito varios alérgenos, algunos asociados con las manifestaciones clínicas en la piel de humanos y otros en perros. No existen datos sobre su participación en la urticaria papular, aunque constituyen buenos candidatos antigénicos para el estudio molecular de las causas de esta condición, frecuente en el trópico, pero tan poco estudiada. Dichas investigaciones deben incluir el estudio de los efectos en la respuesta de tipo celular, al ser una condición en la cual predomina la hipersensibilidad tardía. A continuación se describen características de los alérgenos conocidos derivados de la pulga y el mosquito.
Pulga
Cte f 1: es una proteína de 18 kDa de identidad bioquímica desconocida. Se ha descrito como alérgeno en perros con dermatitis alérgica, encon-trándose que alrededor del 80 % de estos animales presentan IgE específica para esta molécula (39).
Cte f 2: la secuencia de esta proteína se informó en el GenBank (I3VPB0) y se le asignó la denominación de alérgeno en perros, aunque no hay información detallada sobre su importancia alergénica. Esta molécula de 30 kDa pertenece a la familia de proteínas con un dominio similar al de la proteína transportadora de esteroles (SCP-like), en la cual se encuentran otros alérgenos de insectos como la avispa (Ves v 5) y la hormiga (Sol i 3) (72,73). Los datos preliminares de nuestras investigaciones indican que esta molécula también es alergénica en humanos (Sabogal P, et al., datos no publicados).
Mosquitos
Aedes aegypti
En la saliva de A. aegypti, la especie de mosquito más común en todo el mundo, se han encontrado ocho antígenos (74). En la actualidad solo se cuenta con tres recombinantes bien caracterizados (Aed a 1, Aed a 2 y Aed a 3). Estas proteínas provocan una respuesta de predominio de la IgE en personas con alergia a la picadura de mosquito, pero no se tiene información sobre su relación propiamente dicha con la urticaria papular.
Aed a 1: es una apirasa de alto peso molecular (75) y uno de los principales alérgenos en la saliva del mosquito. En algunas poblaciones ha inducido una reacción positiva en 43 % de pacientes con hipersensibilidad a la picadura de mosquito (76). En otro estudio se demostró que el 29 % de los pacientes con respuesta inmediata a la picadura de mosquito reaccionaban a la exposición al rAed a 1. De igual forma, 18 % de las personas con un respuesta tardía tuvieron un resultado positivo (75).
Aed a 2: es una proteína de 37-kDa que hace parte de la familia de la proteína D7 cuya función bioló-gica es desconocida (77). En un estudio, el 10 % de los sujetos con hipersensibilidad a la picadura de mosquito tuvieron resultados positivos a la rAed a 2. Se ha demostrado que tiene reacción cruzada con otros extractos de saliva de diferentes especies de mosquito, entre los que figuran A. vexans, A. communis, A. togi, Ochlerotatus triseriatus y C. quinquefasciatus (78).
Aed a 3: es una proteína de 30 kDa cuya identidad bioquímica se desconoce; 32 % de los pacientes con resultado positivo a la picadura de mosquito también tuvieron resultados positivos frente a la exposición a este alérgeno (76).
Culex
En un estudio se detectaron dos proteínas en la saliva de C. quinquefasciatus con homología con Aed a 2 reconocidas en 73,1 % de los sueros de pacientes con reacción de la IgE para C. quinquefasciatus. Tienen homología estructural con la proteína THP12 de la hemolinfa del Tenebrio molitor, la cual pertenece a la familia de las proteínas de unión a feromonas y sustancias odorantes que transportan moléculas hidrofóbicas (79).
Se han observado alérgenos en la saliva de C. quinquefasciatus con pesos moleculares de 35,5, 32,5 y 22,5 kDa, con una frecuencia de reacción a la IgE de 41, 28 y 24 %, respectivamente, en el momento de evaluar el suero de individuos alérgicos (80).
Reacción cruzada
La hematofagia ha evolucionado de manera independiente varias veces en los insectos, lo cual implica que también ha habido variaciones importantes en el secretoma de la saliva como adaptación al proceso de coespeciación con su huésped (7). Sin embargo, a pesar de estas particularidades, también hay moléculas comunes en los insectos con un importante grado de con-servación, las cuales causan reacción cruzada. Ya se ha demostrado que esta se da entre mosquitos de los géneros Aedes y Culex de importancia alergológica (78).
Por otra parte, a pesar de que los mosquitos y las pulgas tienen diferencias importantes en cuanto a su ecobiología y distribución geográfica, su picadura induce manifestaciones clínicas similares; por lo tanto, resulta interesante saber si existen moléculas comunes asociadas a la patogenia de la enfermedad. En el cuadro 2 se presenta un análisis bioinformático para la búsqueda de proteínas homólogas con alérgenos descritos en especies de pulga y mosquito de interés en el trópico. Aunque las pulgas y los mosquitos son filogenéticamente distantes (figura 3), según estos análisis, el alérgeno Cte f 2 de la pulga tiene potencial de reacción cruzada con una proteína de A. aegypti denominada antígeno 5 que está presente en su saliva (81). Por otra parte, ningún alérgeno conocido de mosquito tiene homología con secuencias publicadas de proteínas derivadas de la pulga.
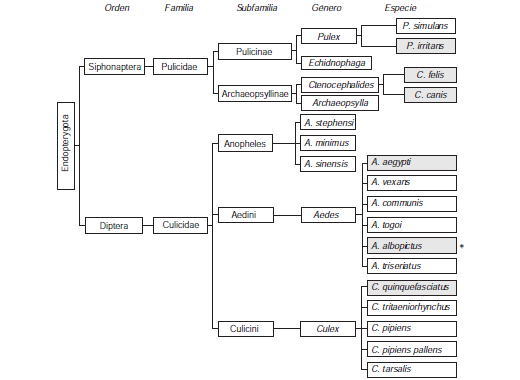
Figura 3 Filogenia de las especies de insectos (superorden: Endopterygota) relacionadas con la urticaria papular. Se resaltan las especies predominantes en Colombia.
*: Especie con capacidad de adaptación climática a diferentes temperaturas
Tratamiento
La urticaria papular rara vez implica complicaciones serias y en muchos casos se produce la desensibilización después de una exposición prolongada a la picadura de insectos. Por ello, el tratamiento se centra en los síntomas mediante la administración de antihistamínicos (82). Los esteroides tópicos también se usan con frecuencia en la práctica clínica, aunque no hay certeza sobre su eficacia dada la falta de estudios con casos y controles. Se ha tratado de inducir la desensibilización oral en niños con urticaria papular, pero no ha habido diferencias significativas en las variables clínicas ni en las inmunológicas de los niños tratados con las vacunas orales de saliva de insectos y los del grupo tratado con placebo (83).
La inmunoterapia con extractos de mosquitos o alérgenos recombinantes se ha sugerido como un tratamiento definitivo para enfermedades alérgicas inducidas por la picadura de insectos, pues se ha encontrado que el incremento de la subclase IgG4 puede tener un papel protector ante posteriores exposiciones a los insectos. En un estudio realizado en un grupo de 20 individuos alérgicos a la pica-dura de mosquito con prueba cutánea positiva e IgE específica para A. communis, se evidenció que con la aplicación subcutánea del extracto de mosquito durante 18 meses se obtenía una mejoría de las lesiones cutáneas, así como de los síntomas respiratorios después de la picadura del mosquito, efectos que no se observaron en el grupo de control (84).
Conclusiones
La urticaria papular se presenta con gran frecuencia en los países del trópico y es una de las enfermedades de la piel más importantes en la infancia. No hay una información precisa sobre la historia natural de la enfermedad y los factores asociados a su persistencia hasta la adultez. Los agentes causales cambian de acuerdo con los pisos térmicos de los países y continentes, siendo la pulga el principal agente en regiones de clima frío, en donde la exposición domiciliaria se asocia a condiciones de pobreza. Hay varios estudios sobre la respuesta inmunológica a este insecto, en los cuales se resalta el predominio de la reacción local de la Th2. Sin embargo, es necesario estudiar los estímulos antigénicos más idóneos (antígenos purificados) para resolver algunos interrogantes como el papel de la IgE en la reacción.
En cuanto a los mosquitos, tan comunes en los pisos térmicos cálidos del país, se conoce menos sobre su asociación epidemiológica con la enfermedad y sobre la respuesta inmunológica específica en
pacientes con urticaria papular. Hasta el momento no se han publicado estudios sobre la reacción inmunológica de pacientes con urticaria papular a los antígenos purificados de estos insectos. La producción de moléculas recombinantes es una forma sencilla de obtenerlos y permitiría conocer con más detalle los mecanismos inmunológicos de la enfermedad.