Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.36 supl.1 Bogotá Dec. 2016
https://doi.org/10.7705/biomedica.v36i0.3068
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v36i0.3068
Contribución de los autores:
Vanessa Gómez: desarrollo experimental
Moisés Wasserman: asesoría en el desarrollo experimental y revisión del manuscrito final
Recibido: 25/09/15; aceptado: 25/03/16
Introducción. Giardia intestinalis es un organismo tempranamente divergente en el que recientemente se demostró la presencia de intrones. La maquinaria responsable de la remoción de intrones en organismos eucariotas superiores es el empalmosoma, el cual está conformado por cinco ribonucleoproteínas, cada una de las cuales tiene un ARN pequeño nuclear, un set de siete proteínas Sm (B, D1, D2, D3, E, F y G) y varias proteínas específicas. En G. intestinalis se han identificado los genes de algunas proteínas del empalmosoma por bioinformática. Aunque se asume que este es el responsable del empalme en el parásito, su caracterización bioquímica no se ha hecho.
Objetivo. Inhibir dos genes que codifican para proteínas del empalmosoma de G. intestinalis con el fin de determinar si esta inhibición afecta el crecimiento o el enquistamiento del parásito.
Materiales y métodos. En un vector específico para G. intestinalis se clonaron secuencias antisentido de los genes que codifican para las proteínas SmB y SmD3 del empalmosoma del parásito. Posteriormente, se transfectó G. intestinalis con los vectores recombinantes y se seleccionaron aquellos parásitos que lo incorporaron. Se confirmó la disminución del mensajero mediante reacción en cadena de la polimerasa (PCR) en tiempo real, y se evaluaron el crecimiento y el enquistamiento en parásitos silvestres y transfectados.
Resultados. Se observó una disminución de 40 y 70 % en el ARNm de SmB y SmD3, respectivamente. El crecimiento y el enquistamiento no se vieron afectados en estos parásitos.
Conclusión. La disminución de SmB y SmD3 no afectó al parásito, lo que indica que el empalmosoma sigue siendo funcional, o que el empalme no es una función vital del parásito.
Palabras clave: Giardia lamblia , organismos eucariotas unicelulares, parásitos, transfección, empalme del ARN, empalmosomas.
doi: http://dx.doi.org/10.7705/biomedica.v36i0.3068
Partial inhibition of two genes that encode spliceosomal proteins in Giardia intestinalis
Introduction. Giardia intestinalis is an early divergent organism that was recently shown to have introns. The machinery responsible for the removal of introns in higher eukaryotes is the spliceosome, which consists of five ribonucleoproteins. Each of these ribonucleoproteins has a small nuclear RNA, a set of seven Sm proteins (B, D1, D2, D3, E, F and G) and several specific proteins. Some genes that encode spliceosome proteins have been bioinformatically identified in the parasite genome. Although it is assumed that the spliceosome is responsible for splicing in this parasite, biochemical characterization is lacking.
Objective. To inhibit two G. intestinalis spliceosome protein genes in order to determine whether this inhibition affects parasite growth or encystation.
Materials and methods. Antisense sequences of the genes encoding the spliceosomal parasite proteins SmB and SmD3 were cloned into a specific G. intestinalis vector. G. intestinalis individuals were subsequently transfected with the recombinant vectors and those parasites that incorporated the vector were selected. A decrease in mRNA levels by real-time PCR was confirmed and the growth and encystation in wild and transfected parasites was assessed.
Results. A decrease of 40% and 70% of SmB and SmD3 mRNA levels, respectively, was observed. Growth and encystation in these parasites were not affected.
Conclusion. Decrease of SmB and SmD3 mRNA levels does not affect the parasite, indicating that the spliceosome remains functional or that splicing is not essential for parasite viability.
Key words: Giardia lamblia , unicellular eukaryotic organisms, parasites, transfection, RNA splicing, spliceosomes.
doi: http://dx.doi.org/10.7705/biomedica.v36i0.3068
Giardia intestinalis es un parásito protozoario que causa una enfermedad conocida como giardiasis. Esta se presenta principalmente en niños que habitan zonas donde las condiciones sanitarias no son adecuadas. Los síntomas de la enfermedad incluyen la diarrea, la malabsorción de nutrientes y la pérdida de peso. Se estima que alrededor de 280 millones de personas se infectan cada año en el mundo (1). En Estados Unidos se reportaron, en promedio, 16.000 casos de giardiasis por año en 2011 y 2012, es decir, alrededor de 6,1 casos por cada 100.000 habitantes (2), lo cual es una cifra baja. Por el contrario, en países de Suramérica, en zonas rurales de India, en los países del sudeste asiático y en otros países en desarrollo, la prevalencia puede fluctuar entre 6 y 50 % en niños menores de 12 años (3).
El parásito presenta dos estadios de vida: el quiste, que es la forma transmisible, y el trofozoíto, que es la forma vegetativa. La infección se inicia cuando el huésped ingiere quistes presentes en agua o alimentos contaminados. En el estómago el quiste inicia el proceso de ´exquistamiento´, pero el trofozoíto emerge en el intestino delgado. Los trofozoítos colonizan el duodeno, donde se adhieren y se multiplican. Algunos trofozoítos pueden pasar de nuevo al estadio de quiste debido a la exposición a secreciones biliares que disminu-yen la concentración de colesterol, lo que induce la diferenciación del parásito (4). Los nuevos quistes salen del huésped y así se completa el ciclo de transmisión. El proceso de enquistamiento se puede simular in vitro sometiendo los trofozoítos al medio normal de crecimiento con suplemento de bilis y con un pH de 7,8 (4).
Además de su importancia médica, G. intestinalis es un modelo de estudio interesante dada su condición de eucariota tempranamente divergente. Esta clasificación se estableció con base en estudios filogenéticos de secuencias del ARNr, subunidad 18S (5), y de varias proteínas (6). Asimismo, su genoma, ya secuenciado, muestra una estructura y un contenido compactos, y tiene maquinarias simplificadas para la replicación de ADN, la transcripción, el procesamiento del ARNm y la mayoría de las rutas metabólicas (7).
Aunque en principio se creía que al igual que otros organismos divergentes G. intestinalis no atra-vesaba por un proceso tan elaborado, complejo y dinámico como el empalme ( splicing ), se han encontrado intrones en algunos de sus transcritos, cuyo número ha ido en aumento en los últimos años. Hasta hoy se han reportado ocho intrones, siete de los cuales tienen sitios canónicos de empalme (7-12). Además, se encontró un suceso tan extraño como inesperado en G. intestinalis: el transempalme ( trans-splicing ) de ARNm transcrito desde genes independientes observado en los genes HSP90 y la cadena pesada de la dineína β (13,14).
Aunque se asume que la remoción de intrones y el transempalme se dan mediante el empalmosoma, las proteínas de esta maquinaria y su incidencia en el ciclo de vida de G. intestinalis no se han estudiado en el parásito; por lo tanto, su estudio en este organismo divergente es importante.
El empalmosoma es el complejo encargado de la remoción de intrones en la célula eucariota. Esta maquinaria se compone de cinco ribonucleo-proteínas pequeñas nucleares ( small nuclear Ribonucleoproteins , snRNP) llamadas U1, U2, U4, U5 y U6. Cada una de ellas está formada por un ARN pequeño nuclear ( small nuclear RNA , snRNA) que se caracteriza por ser rico en uridina y está asociado con un anillo heptamérico de proteínas Sm (B/B´, D1, D2, D3, E, F y G) y con varias proteínas específicas. Por ser comunes para todas las ribonucleoproteínas y ser el centro del empalmosoma, las proteínas Sm se seleccionaron como blanco del presente estudio.
En los organismos eucariotas, la familia de proteínas Sm se caracteriza por tener el dominio Sm, el cual consta de dos zonas conservadas, los motivos Sm1 y Sm2, cuyos residuos conservados son, en su mayoría, aminoácidos hidrofóbicos (15). Una de las características importantes de esta familia es que una proteína puede asociarse con otra igual o diferente de la misma familia e, incluso, con más proteínas, mediante lo cual forma, en el caso del empalmosoma, heterooligómeros de siete miembros. La biosíntesis del empalmosoma en organismos eucariotas superiores involucra la conformación de un anillo heteroheptamérico con todas las proteínas Sm. En ese paso de biosíntesis, las dos últimas proteínas que se incorporan son las proteínas SmB y SmD3 (16), las cuales deben expresarse para que el empalmosoma sea funcional, y se eligieron para evaluar si la disminución de la expresión de sus genes afecta al parásito, pues están presentes en su secuencia primaria.
En G. intestinalis se han hecho estudios con simulación computacional y se han encontrado algunas proteínas de la maquinaria de empalme como las Prp8, Prp11, Prp28 y Prp31, un gran número de helicasas, varias proteínas específicas de las snRNP, cinco proteínas LSm y seis de las siete proteínas Sm de eucariotas (B, D1, D2, D3, E y F) (17). Cabe resaltar que dicho hallazgo se hizo mediante simulación computacional y poco se sabe de la existencia y expresión de estas proteínas en el parásito.
Los hallazgos indican que G. intestinalis tiene, al parecer, un empalomosoma funcional, pero hasta el momento no hay estudios bioquímicos de él. Puesto que G. intestinalis es un organismo divergente, sería de gran interés la caracterización de los componentes de la maquinaria de empalme. En este estudio se evaluó el efecto de la inhibición parcial de dos proteínas Sm sobre el crecimiento y el enquistamiento del parásito, como primera medida para comprender su importancia en G. intestinalis .
Materiales y métodos
Cultivo y enquistamiento de Giardia intestinalis
Los trofozoítos de la cepa WB, clon 6, se cultivaron a 34 °C en el medio TYI-S-33 con suplemento de suero bovino al 10 % y 0,5 mg/ml de bilis bovina (18). Para el ensayo de enquistamiento in vitro , los trofozoítos se cultivaron a 37 °C en medio de enquistamiento o en medio TYI-S-33 pH 7,8 con suplemento de 5,0 mg/ml de bilis bovina según el procedimiento descrito por Kane, et al. (19).
Clonación en el vector pTub
Se diseñaron oligonucleótidos que amplifican una parte de la secuencia de los genes SmB y SmD3 (códigos XM_001709117.1 y XM_001703943.1 en el GeneBank). Estos oligonucleótidos tienen secuencias reconocidas por enzimas de restricción, de modo que cuando se clonan en el vector, quedan las secuencias antisentido. El vector utilizado fue el específico para G. intestinalis , el pTubHApacNT (donado por Hugo Luján, Universidad Católica de Córdoba, Argentina). Este vector tiene el promotor del gen tubulina del parásito y contiene un casete de resistencia al medicamento puromicina. La aplicación de puromicina al medio de cultivo una vez se ha realizado la transfección, permite seleccionar aquellos trofozoítos que han incorporado el vector recombinante, ya que el medicamento es letal para G. intestinalis .
Los oligonucleótidos usados fueron los siguientes: SmBI S 5´-ataagaat GCGGCCGC TACGTTTACACA GGGACG-3´, SmBI AS 5´-cgc GGATCC GCAGG CTTTACTCTTTGG-3´, SmD3I S 5´-ataagaat GCGGCCGC TGATATGTGTGTGTCCGT-3´ y SmD3I AS 5´-cgc GGATCC AGTCTACGAGGGCATTAG-3´ (las zonas subrayadas muestran los sitios de reconocimiento por parte de NotI y BamHI ). Con estos oligonucleótidos se hizo la amplificación mediante PCR a una temperatura media de 55 °C con la enzima Pfx ADN polimerasa (Invitrogen). Los productos purificados de 227 pb (SmB) y 221 pb (SmD3) se digirieron con las enzimas Bam HI (Promega) y Not I (Invitrogen) al igual que el vector pTubHApacNT. Ya purificados, los dos productos digeridos se ligaron al vector y los nuevos vectores recombinantes se introdujeron por choque térmico en bacterias DH5a. Se seleccionaron colonias positivas y se hizo la extracción de plásmidos, los cuales se enviaron para su secuenciación al Instituto de Genética de la Universidad Nacional de Colombia, para después hacer el análisis de la secuenciación con el programa Blast disponible en http://blast.ncbi.nlm.nih.gov/.
Transfección de trofozoítos de Giardia intestinalis
Para la transfección, los parásitos cultivados se enfriaron a 4 °C durante 10 minutos. Luego se centrifugaron y el sedimento de cada tubo se resuspendió en 300 µl de medio TYI-S-33 estéril sin suero y se los transfirió a cubetas previamente enfriadas para la electroporación (Bio-Rad). Se agregaron alrededor de 20 µg del plásmido de interés y se mantuvieron las cubetas en hielo. Las transfecciones se hicieron en el electroporador Bio-Rad gene pulserTM 165-2076 bajo las siguientes condiciones: 960 microfaradios, 350 voltios y 800 ohmios. Después de la electroporación, los parásitos se pusieron en tubos de cultivo con medio completo TYI-S-33. A las 24 horas se inició un esquema de aplicación de puromicina en una concentración final de 100 µM (Sigma). Como control se utilizaron parásitos no transfectados.
Evaluación de la inhibición mediante PCR con transcripción inversa
Mediante PCR con transcripción inversa (RT-PCR) convencional se evaluó la presencia de fragmentos sentido y antisentido de los genes SmB y SmD3 en parásitos transfectados con los fragmentos antisentido para estos genes (parásitos SmB I y SmD3 I). Como controles del experimento se incluyeron la evaluación para el gen de calmo-dulina, además de los controles negativos para cada gen (sin transcriptasa inversa). Para el experimento se recolectaron parásitos WB, SmB I y SmD3 I y se les hizo extracción de ARN por el método de trizol. Posteriormente, se hizo la RT-PCR usando en el primer paso de hibridación el oligonuléotido antisentido para evaluar el ARN sentido, y el oligonucleótido sentido para evaluar el ARN antisentido. Las condiciones de la reacción en la RT-PCR fueron las siguientes: 0,5 µM de los oligonucleótidos, 5,0 mM dNTP ( nucleoside triphosphates containing deoxyribose ), 3,0 mM de MgCl 2, 1 U de M-MLV-RT (Promega) y 0,5 U de Taq polimerasa en solución tampón con 50 mM de Tris-HCl con un pH de 8,3, 75 mM de KCl, 3 mM de MgCl 2 y 10 mM de DTT. La transcripción inversa se hizo según el procedimiento descrito por el productor de la enzima.
PCR cuantitativa para la confirmación de la disminución del ARNm de SmB y SmD3
Se diseñaron oligonucleótidos para la PCR en tiempo real sobre las siguientes secuencias de los genes SmB y SmD3 : SmBrtS 5´-GGAGG TGGCATTCTTTAC-3´, SmBrtAS 5´-CCTGGAATG ACAAACGAG-3´, SmD3rtS 5´-CTCCGATTCAGC TTCTTT-3´, y SmD3rtAS 5´-TCAGCATAACCGTT TGTG-3´. La PCR en tiempo real se hizo por cuantificación absoluta en el equipo CFX96™ Real-Time PCR (Bio-Rad) del Departamento de Química de la Universidad Nacional y con el kit DyNAmo™SYBR® Green qPCR (Finnzymes). Para ello, se elaboraron curvas de amplificación con diferentes diluciones de concentración conocida de los plásmidos SmB-pGEMT y SmD3-pGEMT.
Las condiciones para la amplificación fueron las recomendadas por el fabricante del kit. Se usaron 0,5 µM de cada oligonucleótido y diluciones de 10 7 a 10 1 copias del ADN plasmídico. La reacción se llevó a cabo en un volumen total de 10 µl completado con agua DEPC (dietil-pirocarbonato). El programa de temperatura fue el siguiente: des-naturalización a 95 °C durante 10 minutos, 35 ciclos a 94 °C durante 15 segundos, a 55 °C (SmB) y 57 °C (SmD3) durante 30 segundos, a 72 °C durante 30 segundos y curva de fusión de 65 a 95 °C en 5 segundos. Los datos se recolectaron y procesaron en el programa CFX Manager versión 1.6 (Bio-Rad). El ARN de las muestras evaluadas se extrajo utilizando el método de trizol desde parásitos WB (62 millones), SmB I (58 millones) y SmD3 I (72 millones), y se les hizo transcripción inversa para obtener ADNc. Después de optimizado el ciclo, se corrieron las curvas por duplicado junto con las muestras por triplicado.
Evaluación del crecimiento y el enquistamiento
Se evaluó el crecimiento en parásitos normales WB y transfectados SmB I y SmD3 I. Para ello, en tubos de 7 ml se dispuso una cantidad de un millón de parásitos que se completó con el medio normal TYI-S-33. Para el conteo se usó el hemocitómetro a las 24, 48 y 72 horas. Para cada punto y para cada uno de los tipos de parásitos, el proceso en los tubos se hizo por triplicado.
El enquistamiento se evaluó tanto en parásitos normales como en los transfectados SmB I y SmD3 I. Para ello, se dispuso un inóculo de un millón de parásitos en tubos de 7 ml con medio normal TYI-S-33. A las 72 horas se retiró el medio y se añadió medio de enquistamiento o PBS para los tubos de las 0 horas. A las 24 horas se retiró el medio de enquistamiento y se reemplazó con medio normal TYI-S-33. A las 48 horas se retiró el medio y se reemplazó por agua estéril, con el fin de romper los trofozoítos remanentes y dejar solo los quistes. Al final se procedió a contar los quistes usando el hemocitómetro.
Resultados
Obtención de parásitos transfectados con secuencias antisentido contra los genes que codifican para las proteínas SmB y SmD3
Los fragmentos antisentido contra los genes que codifican para las proteínas SmB y SmD3, se clonaron en el vector pTubHApacNT. Los fragmentos insertados se verificaron mediante secuenciación y se obtuvo 100 % de identidad en ambos casos (figura 1). Se han reportado varios casos en los cuales la transfección de secuencias antisentido contra genes blanco causa la muerte de los trofozoítos y, en esos casos, se dice que el gen es esencial para la supervivencia del parásito (20). Después de la transfección y la selección con puromicina, en este estudio se obtuvieron trofozoítos vivos con capacidad para multiplicarse.
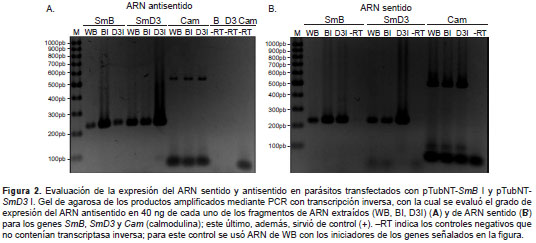
Se evaluó la cantidad relativa del mensajero sentido y del antisentido para el fragmento introducido, con el fin de verificar mediante PCR con transcrip-ción inversa si el primero disminuía y el segundo aumentaba en los parásitos transfectados en comparación con los parásitos silvestres. Se encontró que la cantidad de ARN antisentido de los genes SmB y SmD3 aumentó en los parásitos transfectados con respecto a los silvestres (figura 2). Sin embargo, vale la pena anotar que incluso en los parásitos silvestres se encuentra ARN antisentido (21), lo que se diferencia de lo que ocurre en organismos eucariotas más evolucio-nados, en los cuales no hay ARN antisentido de genes codificantes.
En cuanto al ARNm sentido de SmB y SmD3, sorpresivamente, la cantidad fue mayor en los parásitos transfectados con la respectiva secuencia antisentido al usar los mismos oligonucleótidos con los cuales se clonaron las secuencias (figura 2). Debido a ello, se diseñaron nuevos oligonucleótidos, de modo que uno anillara dentro de la secuencia antisentido insertada y, el otro, fuera de ella pero dentro del gen. Además, estos oligonucleótidos se usaron posteriormente para la PCR en tiempo real. Se observó que en la RT-PCR con estos oligonucleótidos, la cantidad de ARN sentido disminuyó en los parásitos transfectados con la respectiva secuencia antisentido, en com-paración con los parásitos silvestres. Por lo tanto, se obtuvieron parásitos transfectados con ARN antisentido que hacían disminuir la expresión de los genes SmB y SmD3 , a los cuales se les llamó SmB I y SmD3 I, respectivamente.
Confirmación por PCR en tiempo real de la disminución del ARNm de SmB y SmD3
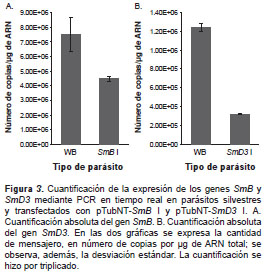
La cuantificación absoluta se hizo mediante PCR en tiempo real, con el fin de determinar el grado de disminución en los transcritos SmB y SmD3 en los parásitos transfectados con los respectivos ARN antisentido. La concentración se expresó en número de copias/µg de ARN.
En la figura 3 se muestra que el mensajero para ambos genes no se silenció totalmente, sino solo en forma parcial. Para SmB , el porcentaje de disminución del mensajero fue de 40 % (figura 3A) y para SmD3 es más drástico, 74 % (figura 3B). Al disminuir la expresión de estos genes, disminuyó consecuentemente la expresión de las respectivas proteínas. Debido a que los parásitos siguieron creciendo, se puede decir que el porcentaje de disminución no resultó letal para ellos, aunque se estudiaron otros parámetros que pudieran verse afectados por dicha disminución. Además, los trofozoítos transfectados evidenciaron una mor-fología similar a la de los parásitos silvestres, al observarlos en el microscopio.
Efecto de la disminución de los mensajeros para las proteínas SmB y SmD3 del empalmosoma en el crecimiento y enquistamiento de Giardia intestinalis
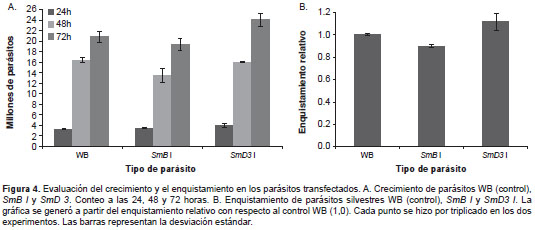
Se evaluó el crecimiento de los parásitos trans-fectados en comparación con los silvestres (figura 4A). Se observó que a las 24 horas, la cantidad de todos los parásitos era de 3 a 4 millones. A las 48 horas ocurrió lo mismo y la cantidad de todos los parásitos fue de 14 a 16 millones. A las 72 horas, que es cuando las células alcanzan la fase estacionaria, la cantidad de los parásitos WB y de los SmB I era de alrededor de 20 millones. Por el contrario, los parásitos SmD3 I mostraron un crecimiento ligeramente mayor, pero el aumento no fue significativo.

Con base en estos datos se concluyó que el crecimiento no fue una variable que se viera afectada cuando disminuyó la expresión de las proteínas SmB y SmD3 del empalmosoma.
Con el fin de evaluar si el ciclo de vida de G. intestinalis se veía afectado al disminuir la expresión de proteínas del empalmosoma, se hicieron experimentos de enquistamiento con los parásitos normales y los transfectados, según el procedimiento explicado en la sección de materiales y métodos (figura 4B).
El número de quistes generados por el proceso de enquistamiento en los parásitos silvestres y en los transfectados, fue similar, de alrededor de 3,5 millones. En términos del enquistamiento relativo, al normalizar el control a 1,0 (parásitos silvestres), este fue de 0,9 a 1,1 en los parásitos transfectados, lo que es una diferencia poco significativa com-parada con la registrada en estudios previos en nuestro laboratorio, en los cuales se incrementaba el porcentaje de enquistamiento cinco y seis veces en los parásitos que sobreexpresaban la enzima activadora de ubicuitina E1 (20). En consecuencia, la reducción de SmB y SmD3 no tuvo efecto sobre el proceso de enquistamiento.
Discusión
Además de su importancia médica, G. intestinalis ha demostrado tener características que lo con-vierten en un modelo interesante para el estudio de procesos biológicos fundamentales en los organismos eucariotas. Hace poco más de una década, se creía que este parásito no tenía intrones, pero surgió información que contradijo esa posición. Hasta hoy, se han reportado ocho intrones para el parásito (7-12), en el cual se verifican procesos de transempalme (13,14), y muchas de las proteínas del empalmosoma se han descrito mediante herramientas de bioinformática (17). Sin embargo, no se han hecho estudios bioquímicos de caracterización de la maquinaria del empalmosoma. De las muchas proteínas que lo conforman, quizá las más importantes son las proteínas Sm, que constituyen el centro del andamiaje sobre el cual se monta la maquinaria de empalme.
Este estudio se centró en los genes que codifican para las proteínas SmB y SmD3. La estrategia usada fue la obtención de parásitos transfectados con secuencias antisentido de una región de los genes que codifican para estas dos proteínas. Después de la transfección se observó que los parásitos sobrevivían en puromicina, hecho que confirmó la incorporación del vector recombinante. Se evaluó si la cantidad de ARN antisentido aumentaba, ya que la disminución en la expresión de un gen mediante esta técnica depende de la generación de ARN antisentido.
En diversos experimentos hechos mediante PCR de transcripción inversa, se ha demostrado que, efectivamente, la cantidad de ARN antisentido aumenta en los parásitos transfectados, aunque, por otro lado, la cantidad de ARN sentido también se incrementa cuando se usan los mismos oligonu-cleótidos con los cuales se diseñaron las secuencias antisentido de una zona del gen (figura 2).
Vale la pena anotar que estas secuencias sentido correspondían solo a un fragmento del gen y, por ende, no producirían proteína. Este experimento demostró que, incluso en parásitos silvestres, hay una concentración basal de ARN antisentido, lo cual no es del todo extraño, ya que se ha visto que G. intestinalis genera gran cantidad de ARN antisentido estéril debido a la transcripción bidireccional que se da en el parásito (21).
Aunque hay un caso excepcional en el que la generación de ARN antisentido regula la expresión de las proteínas variantes de superficie del parásito (22), esto no es lo común. Por ejemplo, en otros genes como el Cam , que codifica para la proteína calmodulina, una proteína abundante y constante durante el ciclo de vida del parásito (23), se han registrado cantidades escasas pero constantes de ARN antisentido para los ARN de parásitos WB, SmB I y SmD3 I. Esto demuestra que el silenciamiento de los genes SmB y SmD3 no afecta el parásito y, por el contrario, sirve como control y confirma la especificidad de la técnica.
¿Por qué, entonces, aumentó la cantidad del ARN sentido para SmB I y SmD3 I? Esto puede explicarse por el hecho de que las PCR con transcripción inversa se hicieron con los mismos oligonucleótidos que sirvieron para clonar el ARN antisentido y, dado que la transcripción bidireccional es algo común en G. intestinalis (21), muy seguramente se generaron secuencias antisentido del antisentido clonado; es decir, tales secuencias corresponderían a una parte del sentido del gen. Se ha propuesto que la generación de secuencias antisentido estériles también puede deberse a un escaso control de la transcripción en G. intestinalis , ya que el parásito posee pocos promotores y los sitios de inicio de la transcripción son cortos (8 pb) y no son muy específicos (24). Cuando en el mismo experimento de PCR con transcripción inversa se usaron oligo-nucleótidos diferentes contra el ARNm, se encontró que la cantidad de ARN sentido disminuía de acuerdo con lo esperado y, por lo tanto, la técnica logró disminuir la concentración del transcrito para SmB y SmD3. Esto se observó y se confirmó en la PCR en tiempo real que se muestra en la figura 3. Por lo tanto, se obtuvieron parásitos transfectados con expresión reducida de los genes SmB (reducción de 40 %) y SmD3 (reducción de 75 %). La supervivencia de estos parásitos indicó que la disminución en la expresión de los genes que codifican para las proteínas SmB y SmD3 del empalmosoma, no fue letal para G. intestinalis .
En organismos eucariotas, los defectos en el ensamblaje del empalmosoma muestran efectos drásticos y nocivos para las células. Tal es el caso de la atrofia muscular espinal, en la que las neuronas se degeneran por la biogénesis ineficiente del centro del empalmosoma (25). Por ello, se quiso evaluar en G. intestinalis si el crecimiento o la diferenciación se veían afec-tados al disminuir la expresión de los genes que codifican para las proteínas SmB y SmD3 del empalmosoma. En la observación en el microscopio, se encontró que los trofozoítos transfectados se veían morfológicamente iguales a los silvestres y que su movimiento también era similar. En cuanto al crecimiento, en la figura 4A se observa que los trofozoítos transfectados crecieron en igual proporción que los silvestres. En cuanto al enquistamiento, se demostró que los parásitos transfectados lo hacen de forma prácticamente igual que los silvestres (figura 4B). Esto demuestra, por primera vez, que la disminución en la expre-sión de los genes codificantes para proteínas del empalmosoma no afecta el normal desarrollo de G. intestinalis .
La ausencia de efectos en la morfología, el crecimiento o el enquistamiento, podría indicar que, independientemente de la cantidad de pro-teína, el empalmosoma siguió desempeñando su función. Otra posibilidad que plantea preguntas para un futuro estudio, sería que otra proteína Sm sustituyera la carencia de alguna de ellas, ya que son similares y cualquiera podría ocupar el lugar de otra.
En conclusión, la reducción en la expresión de los genes que codifican para dos proteínas del empalmosoma no afectó el ciclo de vida de G. intestinalis , por lo menos en su fase de enquistamiento. Es probable que los genes correspondientes a las proteínas que participan en este proceso no tengan intrones y, por ende, no se vean afectados si hay disminución en las proteínas del empalmosoma. Podría también especularse que para un gen con intrones, incluso sin empalme, se producen proteínas funcionales diferentes a las generadas por este, lo que generaría vías alternativas. Sin embargo, lo más probable es que, dado que no se observaron cambios en el crecimiento, la reproducción y o el enquistamiento, el empalme no es esencial en la vida de G. intestinalis y solo se produce en algunas pocas funciones no vitales, lo cual estaría respaldado por el bajo número de intrones que posee el parásito.
A Hugo Luján, por la donación del vector usado para este estudio.
Los autores declaran que no existe conflicto de intereses en torno al manuscrito.
Este proyecto fue apoyado por la División de Investigación, Sede Bogotá (DIB) de la Universidad Nacional de Colombia y por el Fondo Nacional de Financiamiento - Contrato de Recuperación Contingente FP44842-334-2014 (2014-0401 Colciencias).
Correspondencia:
Moisés Wasserman, Laboratorio de Investigaciones Básicas en Bioquímica, Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Calle 44 N° 45-67, Bloque 10, nivel 4, Unidad Camilo Torres, Bogotá, D.C., Colombia Teléfono: 316 5000, extensión 10617 mwassermannl@unal.edu.co
1. Ankarklev J, Jerlström-Hultqvist J, Ringqvist E, Troell K, Svärd SG. Behind the smile: Cell biology and disease mechanisms of Giardia species. Nat Rev Microbiol. 2010;8:413-22. http://dx.doi.org/10.1038/nrmicro2317 [ Links ]
2. Painter JE, Gargano JW, Collier SA, Yoder JS, Centers for Disease Control and Prevention. Giardiasis surveillance – United States, 2011-2012. MMWR. 2015;64(Suppl):15-25. [ Links ]
3. Esch KJ, Petersen CA. Transmission and epidemiology of zoonotic protozoal diseases of companion animals. Clin Microbiol Rev. 2013;26:58-85. http://dx.doi.org/10.1128/CMR.00067-12 [ Links ]
4. Lujan HD, Mowatt MR, Byrd LG, Nash TE. Cholesterol starvation induces differentiation of the intestinal parasite Giardia lamblia . Proc Natl Acad Sci. 1996;93:7628-33. http://dx.doi.org/10.1073/pnas.93.15.7628 [ Links ]
5. Sogin M, Gunderson J, Elwood H, Alonso R, Peattie D. Phylogenetic meaning of the kingdom concept: An unusual ribosomal RNA from Giardia lamblia . Science. 1989;243:75-7. http://dx.doi.org/10.1126/science.2911720 [ Links ]
6. Best AA. Evolution of eukaryotic transcription: Insights from the genome of Giardia lamblia . Genome Res. 2004; 14:1537-47. http://dx.doi.org/10.1101/gr.2256604 [ Links ]
7. Morrison HG, McArthur AG, Gillin FD, Aley SB, Adam RD, Olsen GJ, et al . Genomic minimalism in the early diverging intestinal parasite Giardia lamblia . Science. 2007;317:1921-6. http://dx.doi.org/10.1126/science.1143837 [ Links ]
8. Nixon JE, Wang A, Morrison HG, McArthur AG, Sogin ML, Loftus BJ, et al . A spliceosomal intron in Giardia lamblia . Proc Natl Acad Sci USA. 2002;99:3701-5. http://dx.doi.org/10.1073/pnas.042700299 [ Links ]
9. Russell AG, Shutt TE, Watkins RF, Gray MW. An ancient spliceosomal intron in the ribosomal protein L7a gene (Rpl7a) of Giardia lamblia . BMC Evol Biol. 2005;5:45. http://dx.doi.org/10.1186/1471-2148-5-45 [ Links ]
10. Roy SW, Hudson AJ, Joseph J, Yee J, Russell AG. Numerous fragmented spliceosomal introns, AT-AC splicing, and an unusual dynein gene expression pathway in Giardia lamblia . Mol Biol Evol. 2012;29:43-9. http://dx.doi.org/10.1093/molbev/msr063 [ Links ]
11. Franzén O, Jerlström-Hultqvist J, Einarsson E, Ankarklev J, Ferella M, Andersson B, et al . Transcriptome profiling of Giardia intestinalis using strand-specific RNA-Seq. PLoS Comput Biol. 2013;9:e1003000. http://dx.doi.org/10.1371/journal.pcbi.1003000 [ Links ]
12. Kamikawa R, Inagaki Y, Hashimoto T. Secondary loss of a cis-spliced intron during the divergence of Giardia intestinalis assemblages. BMC Res Notes. 2014;7:413. http://dx.doi.org/10.1186/1756-0500-7-413 [ Links ]
13. Kamikawa R, Inagaki Y, Tokoro M, Roger AJ, Hashimoto T. Split introns in the genome of Giardia intestinalis are excised by spliceosome-mediated trans-splicing. Curr Biol. 2011;21:311-5. http://dx.doi.org/10.1016/j.cub.2011.01.025 [ Links ]
14. Nageshan RK, Roy N, Hehl AB, Tatu U. Post-transcriptional repair of a split heat shock protein 90 gene by mRNA trans-splicing. J Biol Chem. 2011;286:7116-22. http://dx.doi.org/10.1074/jbc.C110.208389 [ Links ]
15. Kambach C, Walke S, Young R, Avis JM, de la Fortelle E, Raker VA, et al . Crystal structures of two SM protein complexes and their implications for the assembly of the spliceosomal snRNPs. Cell. 1999;96:375-87. http://dx.doi.org/10.1016/S0092-8674(00)80550-4 [ Links ]
16. Raker VA, Plessel G, Lührmann R. The snRNP core assembly pathway: Identification of stable core protein heteromeric complexes and an snRNP subcore particle in vitro . EMBO J. 1996;15:2256-69. [ Links ]
17. Collins L, Penny D. Complex spliceosomal organization ancestral to extant eukaryotes. Mol Biol Evol. 2005;22: 1053-66. http://dx.doi.org/10.1093/molbev/msi091 [ Links ]
18. Keister DB. Axenic culture of Giardia lamblia in TYI-S-33 medium supplemented with bile. Trans R Soc Trop Med Hyg. 1983;77:487-8. http://dx.doi.org/10.1016/0035-9203(83)90120-7 [ Links ]
19. Kane AV, Ward HD, Keusch GT, Pereira ME. In vitro encystation of Giardia lamblia : Large-scale production of in vitro cysts and strain and clone differences in encystation efficiency. J Parasitol. 1991;77:974. http://dx.doi.org/10.2307/3282752 [ Links ]
20. Niño CA, Prucca CG, Chaparro J, Luján HD, Wasserman M. The ubiquitin-activating enzyme (E1) of the early-branching eukaryote Giardia intestinalis shows unusual proteolytic modifications and play important roles during encystation. Acta Trop. 2012;123:39-46. http://dx.doi.org/10.1016/j.actatropica.2012.03.012 [ Links ]
21. Teodorovic S, Walls CD, Elmendorf HG. Bidirectional transcription is an inherent feature of Giardia lamblia promoters and contributes to an abundance of sterile antisense transcripts throughout the genome. Nucleic Acids Res. 2007;35:2544-53. http://dx.doi.org/10.1093/nar/gkm105 [ Links ]
22. Prucca CG, Slavin I, Quiroga R, Elías E V, Rivero FD, Saura A, et al . Antigenic variation in Giardia lamblia is regulated by RNA interference. Nature. 2008;456:750-4. http://dx.doi.org/10.1038/nature07585 [ Links ]
23. Alvarado ME, Wasserman M. Calmodulin expression during Giardia intestinalis differentiation and identification of calmodulin-binding proteins during the trophozoite stage. Parasitol Res. 2012;110:1371-80. http://dx.doi.org/10.1007/s00436-011-2637-4 [ Links ]
24. Elmendorf HG. The abundance of sterile transcripts in Giardia lamblia . Nucleic Acids Res. 2001;29:4674-83. http://dx.doi.org/10.1093/nar/29.22.4674 [ Links ]
25. Wan L, Battle DJ, Yong J, Gubitz AK, Kolb SJ, Wang J, et al . The survival of motor neurons protein determines the capacity for snRNP assembly: Biochemical deficiency in spinal muscular atrophy. Mol Cell Biol. 2005;25:5543-51. http://dx.doi.org/10.1128/MCB.25.13.5543 [ Links ]














