Escherichia coli y Staphylococcus aureus constituyen especies bacterianas relevantes en salud pública debido a la alta prevalencia y complejidad de las enfermedades que causan 1, así como por su capacidad para desarrollar resistencia a los antibióticos 2. Las infecciones ocasionadas por la cepa enterohemorrágica de E. coli O157:H7 producen complicaciones gastrointestinales que ocasionalmente conducen al síndrome urémico hemolítico, principalmente en la población infantil. El cuadro clínico se caracteriza por trombocitopenia, deficiencia renal y anemia 3.
El primer brote epidémico causado por E. coli O157:H7 se registró en Estados Unidos en 1982 debido al consumo de hamburguesas contaminadas con este agente, lo cual produjo diarrea con sangre y dolor abdominal grave entre las personas afectadas 4. En la década de los noventa, también se presentaron brotes en Canadá, Reino Unido, Bélgica, Irlanda, África y Nueva Zelanda 5-8. Dos de los mayores brotes se han registrado en Japón e Inglaterra. En 1996, en un comedor escolar de Japón, se diagnosticaron 7.966 casos, en 106 de los cuales se presentó el síndrome urémico hemolítico 9. Asimismo, en el brote en Inglaterra en el 2009, hubo 95 personas afectadas, 17 de las cuales desarrollaron un cuadro clínico más grave con deficiencia renal y anemia 10.
En Suramérica hay menos información sobre los brotes causados por E. coli O157:H7 debido a la falta de un sistema riguroso de vigilancia epidemiológica para este agente. No obstante, Argentina es uno de los países con mayor número de casos de niños con diarrea con sangre (alrededor de 7 %) asociados a infecciones con esta cepa bacteriana 11. Del mismo modo, en algunas investigaciones en Colombia se ha encontrado una prevalencia de 4,7 % en niños afectados por E. coli O157:H7 causante de diarrea. Recientemente, esta condición ha sido categorizada como "enfermedad humana en progreso" por los organismos de vigilancia 12.
En cuanto a S. aureus, desde los años sesenta se han venido identificando cepas con resistencia a los antibióticos betalactámicos, como la penicilina y la meticilina causantes de infecciones, principalmente en hospitales. Las cepas de S. aureus resistente a la meticilina (SARM) son responsables de enfermedades graves como la sepsis y la neumonía necrosante 13,14. La enfermedad infecciosa causada por SARM puede ser letal en pacientes inmunosuprimidos que se hayan contagiado mediante el contacto directo con un individuo portador o con dispositivos médicos contaminados, lo cual contribuye en gran medida a la colonización e invasión bacteriana 15.
En 1999, la causa de más de 25 % de las enfermedades registradas en Europa fue SARM 16, especialmente en Italia, con una incidencia de 35 % 17. Asimismo, 25 % de las enfermedades registradas en Estados Unidos se atribuyeron a cepas de S. aureus resistente a los antibióticos betalactámicos 18. En Latinoamérica ha habido un continuo incremento de las enfermedades infecciosas asociadas a SARM. Así, en el 2004, la prevalencia de S. aureus como agente infeccioso fue de 80 a 82 % en Perú y Chile, en tanto que en México fue de 52 %, en Colombia de 47 %, en Argentina de 42 % y en Venezuela de 25 % 19-21.
Hoy en día, los tratamientos disponibles para combatir las enfermedades infecciosas causadas por E. coli O157:H7 se centran en el uso de antibióticos del tipo de las quinolonas, por ejemplo, la ofloxacina, y en las causadas por SARM, se emplean los glucopéptidos, como la vancomicina. A pesar de que ya hay cepas resistentes a estos antibióticos, se continúan prescribiendo para afecciones causadas por cepas sensibles, aunque desencadenan efectos secundarios (cefalea, anemia, trombocitopenia, diarrea) y, además, se sabe que son poco eficaces, principalmente por su baja solubilidad y la dificultad para llegar hasta su blanco terapéutico 13,22-24.
De allí la necesidad de alternativas que permitan contrarrestar las infecciones bacterianas causadas por E. coli O157:H7 y SARM. Una de las opciones promisorias para mejorar la eficacia y la biodisponibilidad de los antibióticos convencionales es su incorporación en polímeros biodegradables.
Los antibióticos incorporados en una partícula polimérica de tamaño nanométrico tienen mejor solubilidad, distribución en los tejidos y penetración celular, con menor citotoxicidad y efectos secundarios, entre otras ventajas 1,24,25.
Las investigaciones en nanotecnología sobre el transporte de compuestos biológicamente activos hacia sitios de interés han resultado en el desarrollo de sistemas nanoestructurados con fines terapéuticos, como las nanopartículas poliméricas 26. Los polímeros biodegradables más empleados para la síntesis de nanopartículas han sido el ácido poliláctico y el ácido poliláctico coglicólico (polylactic-co-glycolic acid, PLGA) debido a que son materiales biocompatibles y presentan una liberación controlada del principio activo. Además, han sido aprobados por la Food and Drug Administration (FDA) para la elaboración de sistemas de liberación de fármacos y otros usos biomédicos 27,28.
En este contexto, el objetivo de este trabajo fue sintetizar y caracterizar nanopartículas de ácido poliláctico (PLA) cargadas con ofloxacina (PLAofloxacina) y vancomicina (PLA-vancomicina) según su tamaño, forma, carga superficial neta y concentración de antibiótico en el polímero. Además, se determinó la actividad bacteriostática y bactericida in vitro de la ofloxacina y la vancomicina en ácido poliláctico frente a E. coli O157:H7 y SARM, respectivamente.
Materiales y métodos
Reactivos y cepas bacterianas
El ácido poliláctico (con peso molecular, PM, de 85 a 160 kDa), la ofloxacina (OFLX, PM: 361,37 g/mol), la vancomicina (VCM, PM: 1485,71 g/mol), el poloxámero 407 (PM: 12,5 kDa) y la polietilenimina (PM: 2 kDa) se adquirieron de Sigma-Aldrich. El acetonitrilo de máximo grado de pureza (High Purity Liquid Chromatoghaphy, HPLC) y el metanol en grado HPLC (MetOH) se obtuvieron de J.T. Baker. El diclorometano y el medio de cultivo de Mueller-Hinton (MH) se adquirieron de Merck. El medio de cultivo de infusión de cerebro y corazón (Brain Heart Infusion, BHI) se obtuvo de Oxoid. La cepa E. coli O157:H7 fue donada por la Escuela de Microbiología de la Pontificia Universidad Javeriana y la cepa de S. aureus resistente a la meticilina (SARM) fue donada por la Escuela de Microbiología de la Universidad Industrial de Santander. Las dos cepas bacterianas se mantuvieron en medio de cultivo BHI.
Síntesis de nanopartículas de ácido poliláctico cargadas con ofloxacina
Las nanopartículas de ofloxacina en ácido poliláctico se sintetizaron mediante el método de emulsión y evaporación de solvente descrito por Jeffery, et al. 29,30. Inicialmente, se preparó una solución de ofloxacina en ácido poliláctico en una relación de 1 a 5 en diclorometano. Esta primera solución se homogeneizó en un vórtex a 300 rpm durante 20 minutos y se la agregó a una fase acuosa formada por un agente estabilizante, el poloxámero (0,5 % p/v), y un agente catiónico, la polietilenimina (0,0025 % p/v). Posteriormente, la mezcla se homogeneizó utilizando un homogeneizador Ultra-Turrax(r) (IKA) a 15.500 rpm durante cinco minutos. El solvente orgánico se evaporó a presión de 120 mbar a 23 °C en un rotoevaporador Heidolph. Las nanopartículas se purificaron mediante centrifugación a 6.000 rpm durante 20 minutos, y se lavaron con agua desionizada. La emulsión blanquecina obtenida se almacenó bajo refrigeración a una temperatura entre 4 y 8 °C.
Síntesis de nanopartículas de ácido poliláctico cargadas con vancomicina
Las nanopartículas de vancomicina en ácido poliláctico se sintetizaron según el método de doble emulsión y evaporación de solvente 31-33. Se preparó la primera emulsión de vancomicina en ácido poliláctico, usando diclorometano con una relación de medicamento y polímero de 1 a 5, y esta emulsión se añadió a la fase acuosa que contenía el poloxámero (0,5 % p/v) y la polietilenimina (0,0025 % p/v). Estas dos fases se sometieron a emulsión utilizando el homogeneizador Ultra-Turrax(r) (IKA). El diclorometano se evaporó a presión reducida y las nanopartículas de vancomicina en ácido poliláctico se purificaron mediante centrifugación y posteriormente se lavaron con agua desionizada. La emulsión final fue almacenada bajo refrigeración a temperaturas entre 4 y 8 °C.
Caracterización de las nanopartículas poliméricas
Se caracterizó el tamaño hidrodinámico de las nanopartículas mediante dispersión de luz dinámica. La carga superficial se determinó mediante el potencial zeta, utilizando un equipo Malvern Zetasizer Nano Series Nano-zs90, equipado con un láser operado a 633 nm, 25 °C y un ángulo de dispersión fijo de 90°. Las muestras se diluyeron diez veces con agua desionizada y cada medición se hizo por triplicado. También, se empleó la técnica de microscopía electrónica de barrido para determinar la morfología y el tamaño de las nanopartículas. Para ello, se usó el microscopio FEI Quanta 650 del Laboratorio de Microscopía del Parque Tecnológico de la Universidad Industrial de Santander. La concentración de antibiótico se determinó utilizando cromatografía líquida de alta eficiencia (High-Performance Liquid Chromatography, HPLC).
Determinación de la concentración del antibiótico cargado en las nanopartículas de ácido poliláctico
Para determinar la cantidad de ofloxacina o vancomicina cargada en la matriz polimérica, las nanopartículas se centrifugaron durante 40 minutos a 12.000 rpm. El precipitado se disolvió en 1 ml de diclorometano, se añadieron 4 ml de solución tampón fosfato (pH 3) y se agitó durante 20 minutos con el fin de extraer el antibiótico de la solución tampón a partir de la solución orgánica. Después de separar las dos fases mediante decantación durante 30 minutos, la solución tampón se filtró y la concentración del medicamento se determinó mediante HPLC 34,35.
Determinación de la concentración inhibitoria mínima y la concentración bactericida mínima
La actividad antibacteriana se evaluó mediante la metodología de microdilución en caldo 36,37. Inicialmente, se prepararon el preinóculo de E. coli O157:H7 en caldo de Luria-Bertani (LB) y el de SARM en caldo de Muller-Hilton (MH) durante 12 a 14 horas a 37 °C y a 200 rpm. El inóculo final para cada cepa se ajustó a la escala 0,5 de McFarland (108 UFC/ml). La cinética de crecimiento de cada microorganismo se determinó mezclando una parte de suspensión bacteriana con una parte de suspensión de nanopartículas en diferentes concentraciones, utilizando los 96 pozos de microplacas de la prueba ELISA, y se incubaron a 37 °C en agitación orbital a 200 rpm durante ocho horas. Se tomaron muestras cada hora y se analizaron en un espectrofotómetro lector de microplaca ELISA (Bio Rad, iMarck(tm)) a 595 nm.
Los ensayos se hicieron por triplicado con los respectivos controles de esterilidad del medio de cultivo (éste únicamente), el control de antibiótico (en ausencia de nanopartículas) y el control de crecimiento para cada bacteria (medio de cultivo más inóculo bacteriano). Las concentraciones inhibitorias mínimas de 50 % (CIM50) y de 90 % (CIM90) se definieron como la menor concentración del nanomaterial capaz de reducir la concentración bacteriana en un 50 y 90 %, respectivamente, en relación con el control de crecimiento y en ausencia de los inhibidores. Asimismo, se evaluó la actividad antibacteriana de los polímeros empleados en la síntesis de las nanopartículas (polietilenimina 0,00 25 % p/v y poloxámero 0,5 % p/v).
Para determinar la concentración bactericida mínima (CBM), se tomaron alícuotas 100 μl a partir de la CIM50 determinada para cada bacteria, y para las concentraciones de nanopartículas cargadas con medicamento en las cuales no se evidenció crecimiento, se tomó una alícuota de 100 μl que se agregó a 900 μl de caldo de cultivo BHI, con el fin de revitalizar las células bacterianas existentes. Los cultivos se incubaron a 37 °C durante 24 horas. Los cultivos líquidos obtenidos se sembraron en superficies utilizando agar BHI en cajas de Petri durante 24 horas a 37 °C, con el fin de corroborar la ausencia de crecimiento bacteriano. Se definió la CBM como la menor concentración de nanopartículas que produjo una reducción de unidades formadoras de colonias (UFC) mayor de 99,9 % en comparación con el inóculo sin tratamiento.
Resultados
Caracterización fisicoquímica de las nanopartículas de ofloxacina y vancomicina en ácido poliláctico
Las nanopartículas poliméricas obtenidas se caracterizaron mediante dispersión de luz dinámica, electroforesis Doppler con láser y microscopía electrónica de barrido (S-TEM) (figura 1 y figura 2). El análisis mediante dispersión de luz dinámica (figura 1A y figura 2A) y electroforesis Doppler con láser (figura 1B y 2B), evidenció la obtención de nanopartículas de tamaños hidrodinámicos de 348 a 379 nm y carga superficial máxima de +21 mV. La carga positiva de las nanopartículas se debió a la presencia del agente catiónico polietilenimina, el cual también estabilizó la emulsión mediante repulsiones electrostáticas. Los tamaños menores de 379 nm y la carga superficial de las nanopartículas obtenidas fueron comparables e, incluso, mejores que las obtenidas por otros autores 38,39. En las microfotografías S-TEM se evidencian las nanopartículas monodispersas, sin agregados y de morfología esférica (figura 1, C-D y 2, C-D). En el cuadro 1 se presenta un resumen de las propiedades fisicoquímicas de las nanopartículas de ácido poliláctico cargadas con los medicamentos.
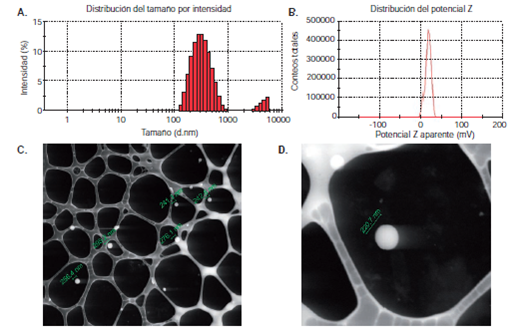
Figura 1 Caracterización de nanopartículas de ofloxacina en ácido poliláctico. A. Dispersión de luz dinámica. B. Potencial zeta. C. y D. Imágenes en microscopía electrónica de barrido (S-TEM)
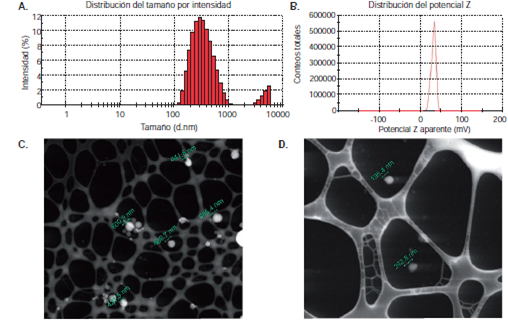
Figura 2 Caracterización de nanopartículas de vancomicina en ácido poliláctico. A. Dispersión de luz dinámica. B. Potencial zeta.C. y D. Imágenes en microscopía electrónica de barrido (S-TEM)
Determinación de la concentración del antibiótico cargado en las nanopartículas
Mediante HPLC en fase inversa se determinó una concentración de la vancomicina en las nanopartículas de ácido poliláctico de 0,090 μg del medicamento por mg de polímero. Para la ofloxacina, se obtuvo una mayor concentración, de 0,73 μg de medicamento por mg de polímero (cuadro 1).
Actividad antibacteriana de las nanopartículas de ácido poliláctico cargadas con antibióticos
En la figura 3 y figura 4 se presentan la CIM50, la CIM90 y la CBM de la ofloxacina y la vancomicina en ácido poliláctico, y de los medicamentos libres para las cepas patógenas estudiadas. Las nanopartículas de ofloxacina en ácido poliláctico inhibieron el 50 % de las células de E. coli O157:H7 en una concentración de 0,001 μg/ml, concentración 40 veces menor que la requerida por el antibiótico libre (CIM50=0,04 μg/ml). En cuanto a SARM, la CIM50 obtenida de las nanopartículas de vancomicina en ácido poliláctico fue de 0,005 μg/ml, la cual es 100 veces menor que la necesaria para que el antibiótico libre alcance el mismo efecto de inhibición (CIM50=0,5 μg/ml). En el cuadro 2 se presenta el resumen de todos los resultados de actividad antibacteriana obtenidos. Los polímeros empleados en la síntesis de las nanopartículas, polietilenimina (0,0025 % p/v) y poloxámero 407 (0,5 % p/v), no tuvieron ningún efecto inhibitorio contra E. coli O157:H7 y SARM.
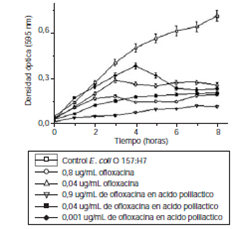
Figura 3 Actividad antibacteriana de ofloxacina libre y nanopartículas de ofloxacina en ácido poliláctico frente a E. coli O157:H7 (ofloxacina libre, CIM50=0,04 μg/ml, CIM90>3,2 μg/ml; nanopartículas de ofloxacina en ácido poliláctico, CIM50=0,001 μg/ml, CIM90>0,9 μg/ml). Todos los ensayos se hicieron por triplicado.
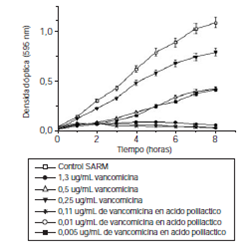
Figura 4 Actividad antibacteriana de vancomicina libre y nanopartículas de vancomicina en ácido poliláctico frente a SARM (vancomicina libre, CIM50>0,5 μg/ml, CIM90=1,3 μg/ml; nanopartículas de vancomicina en ácido poliláctico CIM50=0,005 μg/ml, CIM90: 0,01 μg/ml). Todos los ensayos se hicieron por triplicado.
Discusión
Uno de los objetivos del empleo de nanopartículas poliméricas como dispositivos de entrega de medicamentos es optimizar su eficacia terapéutica. Se ha demostrado que los sistemas nanoestructurados son una alternativa en el tratamiento de enfermedades infecciosas; por ejemplo, las nanopartículas de rifampicina en alginato mejoraron la eficacia del medicamento contra Mycobacterium turberculosis, las nanoesferas de anfotericina en policaprolactona contra Candida albicans disminuyeron la toxicidad in vivo de la anfotericina, y las nanopartículas de ciprofloxacina en poliacrilato 'glicosilado' contra S. aureus mejoraron la biodisponibilidad de la ciprofloxacina 24.
En cuanto a los medicamentos de naturaleza hidrofóbica, el principal método empleado para la síntesis de nanopartículas poliméricas es el de emulsión y evaporación del solvente 13,40,41. Utilizando este método, las nanopartículas de ofloxacina en ácido poliláctico presentaron forma esférica y un tamaño promedio de 379 nm ( figura 1, cuadro1). Un posible mecanismo de formación de las nanopartículas poliméricas es la progresiva disminución del tamaño de las gotas de emulsión durante la evaporación del solvente (en este caso, diclorometano), hasta la obtención de las nanopartículas que se estabilizan debido a la presencia de agentes como la gelatina, el polivinilalcohol o los poloxámeros 42-44.
En este estudio se usó poloxámero 407 como agente emulsionante, el cual estabiliza las nanopartículas al absorberse en la superficie de las partículas formadas mediante interacciones hidrofóbicas por medio del bloque de óxido de polipropileno y el bloque hidrofílico (óxido de polietileno), los cuales se extienden hacia el medio acuoso. De esta manera, se forma una capa hidrofílica que estabiliza las nanopartículas de ácido poliláctico 45.
Algunos autores han empleado la técnica de emulsión y evaporación del solvente para encapsular medicamentos hidrofóbicos y han obtenido tamaños entre 0,2 y 8 μm 46,47. Sin embargo, son pocos los estudios en los cuales se ha implementado para la encapsulación de ofloxacina; por ejemplo, Abazinge, et al., obtuvieron partículas entre 37 μm y 425 μm 38; Cheow, et al., prepararon nanopartículas de alrededor de 360 nm 48, tamaños comparables con los obtenidos en este trabajo (<379 nm) (cuadro 1).
Por otro lado, las nanopartículas de vancomicina en ácido poliláctico sintetizadas mediante el método de doble emulsión y evaporación del solvente, también se estabilizaron empleando poloxámero 49. Se ha descrito que la formación de las nanopartículas mediante esta técnica, se presenta en el momento de evaporación del solvente orgánico, proceso mediante el cual se acelera la precipitación del polímero atrapando el principio activo (antibiótico) y formando las partículas nanométricas 31. Algunos autores han obtenido nanopartículas y micropartículas poliméricas cargadas con vancomicina con tamaños entre 466 nm y 11,8 μm 33,50. Sin embargo, en este trabajo se obtuvieron nanopartículas esféricas con un tamaño promedio de 348 nm, resultados comparables e incluso mejores que los obtenidos en las investigaciones antes mencionadas.
Se considera que la técnica más adecuada para la preparación de nanopartículas de vancomicina en ácido poliláctico y para la encapsulación de otras moléculas hidrosolubles como péptidos, proteínas y vacunas, es el método de síntesis de doble emulsión agua-aceite-agua (water-oilwater, W/O/W) y evaporación del solvente 51,52.
Con esta técnica se han encapsulado diferentes sustancias de carácter hidrofílico, como la albúmina de suero bovino 35, así como la insulina y la lisozima 53, y los tamaños obtenidos fluctuaron entre 200 nm y 1.200 nm 39.
Con respecto a la concentración de la vancomicina en nanopartículas de ácido poliláctico (0,09 μg de vancomicina por mg de ácido), esta fue suficiente para evaluar el efecto antibacteriano. Sin embargo, fue difícil alcanzar una concentración mayor del medicamento, porque en la mayoría de moléculas hidrofílicas se presenta una rápida difusión en la fase acuosa durante la emulsión 54-56. La liberación rápida de vancomicina en ácido poliláctico se ve favorecida durante el proceso de evaporación del solvente, pues la sustancia encapsulada puede liberarse en la fase acuosa a través de poros presentes en las nanopartículas 31,39. Además, la baja concentración de antibiótico encapsulado podría deberse a la localización del medicamento en la superficie de las nanopartículas 57, el cual se elimina en el momento de la purificación 41.
Es importante mencionar que la cantidad de medicamento incorporada en el polímero depende de las interacciones entre este y la presencia de grupos funcionales como los ésteres o los carboxilos 58. En este contexto, para las nanopartículas de ofloxacina en ácido poliláctico se obtuvo una mayor concentración de antibiótico (0,73 μg de medicamento por mg de polímero), probablemente debido a una mayor interacción electrostática entre las cargas negativas de los grupos carboxilos terminales del ácido poliláctico 59 y las cargas positivas generadas en el nitrógeno de la piperazina presente en la ofloxacina (con valores de pH inferiores a pKa1<6,08) 60.
Por otra parte, en los últimos años se ha demostrado una mayor eficacia de los antibióticos al estar incorporados en las nanopartículas poliméricas 25,61. En este trabajo, las nanopartículas de ofloxacina en ácido poliláctico como agente antibacteriano contra E. coli O157:H7 exhibieron un efecto 40 veces mayor que la CIM50 del antibiótico libre (cuadro 2 y figura 3). El aumento de la actividad antibacteriana in vitro puede haberse debido a una mayor interacción entre la superficie de las nanopartículas y la membrana biológica 62. El aumento en la capacidad inhibitoria de la ofloxacina y de otras fluoroquinolonas ha sido objeto de las investigaciones de Jeong, et al., quienes determinaron un incremento del 30 % en el efecto antibacteriano de la ciprofloxacina encapsulada en PLGA contra E. coli63. De igual manera, se encontró que la ofloxacina encapsulada en liposomas aumentó dos veces la inhibición (CIM=0,0525 μg/ml) contra E.coli ATCC 25922, en comparación con el medicamento libre (CIM=0,12 μg/ml) 62. También, se evidenció la potencialización del efecto inhibitorio contra E. coli ATCC 35218 en más de 200 veces al emplear nanopartículas de ofloxacina en polietilencianoacrilato (CIM=0,0005 μg/ml), en comparación con la ofloxacina (CIM=0,12 μg/ml) 64.
Cabe destacar que se han hecho pocos estudios empleando nanopartículas poliméricas de vancomicina contra SARM. En algunas investigaciones se ha observado una disminución de la eficacia antibacteriana contra S. aureus de la vancomicina en nanopartículas de ácido PLGA y polietilenglicol (CIM=128 μg/ml), en comparación con el antibiótico libre (CIM=32 μg/ml) 33. En otros casos, se ha reportado un aumento en la eficacia del medicamento al conjugarlo con vancomicina en nanopartículas de quitosano, cuya CIM contra S. aureus resistente a vancomicina disminuyó hasta 97 % 65. Resultados similares se encontraron al usar nanopartículas de vancomicina conjugadas con oro y probadas frente a SARM, con una CIM50 de 8 μg/ml, en comparación con los 64 μg/ml de la vancomicina libre 66. En esta investigación, el uso de nanopartículas de vancomicina en ácido poliláctico redujo la CIM50 contra SARM hasta en 100 veces comparada con la del antibiótico libre (cuadro 2; figura 4). En este caso, la mayor actividad antibacteriana de la vancomicina cargada en nanopartículas de ácido poliláctico se debió, posiblemente, a una mayor biodisponibilidad y entrega del medicamento 61. Asimismo, el incremento en la potencia del antibiótico puede responder a la penetración de las nanopartículas poliméricas de vancomicina en la membrana celular 65.
La actividad de los antibióticos mejoró ostensiblemente cuando se incorporaron en la matriz polimérica del ácido poliláctico. Los controles de polietilenimina y de poloxámero 407 en las concentraciones empleadas en la síntesis (0,0025 % p/v y 0,5 % p/v, respectivamente), no tuvieron ningún efecto inhibitorio contra E. coli O157:H7 y SARM. Una de las principales características de las nanopartículas sintetizadas favorable para la actividad antibacteriana es la carga superficial positiva por la presencia de polietilenimina 67 (cuadro 1). Se ha comprobado que la carga positiva en la superficie de las nanopartículas es un parámetro importante en el anclaje inicial sobre la superficie bacteriana, ya que genera uniones electrostáticas con la superficie negativa de las bacterias 68,69. Debe recordarse que la superficie de las bacterias Gram negativas y Gram positivas presenta una carga neta negativa, ya sea por la presencia de ácidos lipoteicoicos o ácidos teicoicos, o por los lipopolisacáridos y fosfolípidos que conforman la estructura celular 25,58.
Los resultados del presente trabajo demostraron que características tales como un tamaño inferior a 380 nm y la carga superficial positiva de las nanopartículas de ácido poliláctico, mejoraron la potencia farmacológica de los medicamentos contra E. coli O157:H7 y SARM, por lo cual se plantean como una importante alternativa en la inhibición del crecimiento de este tipo de cepas patógenas multirresistentes. Además, es importante destacar que no se han publicado otros estudios sobre el tipo de nanoestructuras sintetizadas empleadas en este trabajo, por lo cual estos resultados constituyen una base para continuar el desarrollo de sistemas de entrega de medicamentos en nanopartículas de ácido poliláctico.