La tuberculosis es un problema de salud pública a nivel mundial frente al cual la Organización Mundial de la Salud (OMS) ha puesto en marcha diferentes estrategias y ha llamado a los estados miembros a comprometerse en su implementación. En 1994, comenzó a promoverse la estrategia de tratamiento acortado supervisado, reemplazada posteriormente por la campaña denominada "Alto a la tuberculosis", cuya metodología se conjugaba con los objetivos de desarrollo del milenio para lograr el control de la tuberculosis como problema de salud pública. En 2014, se lanzó la estrategia "Post 2015" en el marco del cumplimiento de los objetivos de desarrollo sostenible con la meta de alcanzar la eliminación de la enfermedad en el 2050 1-3.
Durante el 2014, la OMS estimó en 9,6 millones los casos nuevos de tuberculosis y una incidencia de 133 casos por 100.000 habitantes en el mundo, de los cuales solo se reportaron 6,3 millones. En ese mismo año, se estimaron 480.000 casos nuevos de tuberculosis multirresistente, definida como la resistencia simultánea a isoniacida y rifampicina, de los cuales solo se notificaron 190.000. En los últimos años la notificación de casos de tuberculosis y de tuberculosis multirresistente se ha mantenido estable, al igual que la brecha entre los casos estimados y los diagnosticados 4.
La tuberculosis extremadamente resistente corresponde a casos multirresistentes con resistencia, por lo menos, a una quinolona y a un fármaco inyectable de segunda línea, los cuales equivalieron a 9,7 % de los casos de tuberculosis multirresistente notificados en el mundo en 2014. Este porcentaje está por debajo de la cifra real, pues no todos los países cuentan con un laboratorio que realice las pruebas de sensibilidad a estos fármacos 4.
Durante los últimos diez años, la incidencia de tuberculosis en Colombia ha sido estable y ha oscilado entre 23 y 25 casos por 100.000 habitantes; en 2014, el Sistema de Vigilancia en Salud Pública (Sivigila) reportó 12.824 casos en total 5, la mayoría provenientes de Antioquia, Valle del Cauca y Bogotá.
Entre 2010 y 2014, se diagnosticaron, en promedio, 150 casos por año de tuberculosis multirresistente y 250 con resistencia a isoniacida o rifampicina no catalogados como multirresistentes 6.
Desde 2009, el Laboratorio Nacional de Referencia del Instituto Nacional de Salud hace pruebas de sensibilidad a los fármacos de segunda línea y, a partir de 2011, se estableció que en todos los casos con resistencia a isoniacida, rifampicina o a ambas se debía determinar el patrón de resistencia a fármacos inyectables y quinolonas. Con este procedimiento, se confirmaron 37 casos de tuberculosis extremadamente resistente entre el 2009 y el 2014, así como varios casos con resistencia a quinolonas o fármacos inyectables 4,6.
La situación de la resistencia a los fármacos antituberculosos en el país no parece alarmante, aunque el número de casos de multirresistencia estimado por la OMS es de 350 y solo el 40 % de ellos se diagnostica 4.
A nivel mundial se busca garantizar el acceso a una prueba de sensibilidad que permita evaluar la resistencia a quinolonas y fármacos inyectables en todos los casos de tuberculosis multirresistente, pues esta prueba solo se hace en 24 % de los casos 4. En Colombia, el Laboratorio Nacional de Referencia estableció que los laboratorios de salud pública deben enviar los aislamientos de todos los casos de tuberculosis resistente diagnosticados, con el fin de evaluar su resistencia a fármacos de segunda línea; sin embargo, solo se ha logrado una cobertura del 60 %.
El objetivo de este estudio fue determinar la prevalencia de la resistencia de Mycobacterium tuberculosis a la kanamicina, la amicacina, la capreomicina y la ofloxacina en casos de tuberculosis resistentes a isoniacida, rifampicina, o a ambas, recibidos en el Laboratorio Nacional de Referencia del Instituto Nacional de Salud en 2012 y 2013.
Materiales y métodos
Tipo de estudio
Se hizo un estudio retrospectivo descriptivo de corte transversal.
Se analizaron 489 aislamientos de M. tuberculosis remitidos por los laboratorios de salud pública del país y se seleccionaron aquellos que presentaban resistencia a isoniacida, rifampicina o a ambas.
Se excluyeron los que tenían repetida la prueba de sensibilidad y no presentaban cambio en el patrón de resistencia, así como aquellos en los cuales, a pesar de la resistencia a isoniacida, rifampicina o a ambas, no fue posible obtener un resultado debido a la contaminación o a resultados que no se podían interpretar.
Pruebas de sensibilidad
Los aislamientos se recibieron en medio de cultivo sólido y se sometieron a la prueba de sensibilidad con la técnica semiautomatizada Bactec MGITTM, siguiendo las instrucciones del fabricante; en esta prueba se emplea un tubo que contiene caldo Middlebrook 7H9 y un compuesto de rutenio fluorescente incluido en silicona. La prueba opera mediante la acción de consumo de oxígeno por parte de la micobacteria, que libera la fluorescencia del compuesto y permite detectar su viabilidad al ser expuesta a los fármacos y determinar si es sensible o resistente.
Las concentraciones críticas usadas fueron las siguientes: isoniacida, 0,1 y 0,4 μg/ml; rifampicina, 1 μg/ml; kanamicina, 2,5 μg/ml; amicacina, 1,0 μg/ml; capreomicina, 2,5 μg/ml, y ofloxacina, 2,0 μg/ml. La interpretación de los resultados se hizo con el programa TB-eXISTTM, facilitado por la casa comercial 7-9.
Los resultados obtenidos en las pruebas se remitieron por correo electrónico a los laboratorios de salud pública de donde provenían los aislamientos.
Análisis estadístico de los datos
Se utilizaron tres fuentes de información: la primera, el formato único de vigilancia de las micobacterias, documento establecido en el Instituto Nacional de Salud para el procesamiento de las pruebas de sensibilidad, con el cual se remiten los aislamientos, y contiene la información sobre el sexo, la edad, la forma clínica de la enfermedad, el ente territorial remitente y los antecedentes de tratamiento con fármacos antituberculosos, datos que deben ser recopilados por el personal de salud en la institución donde se atiende al paciente; la segunda, los resultados de las pruebas de sensibilidad sobre los patrones de resistencia a los fármacos, y la tercera, la base de datos de resultados de las pruebas de sensibilidad del Laboratorio Nacional de Referencia del Instituto.
Para el análisis de la información, los casos se clasificaron como resistentes a isoniacida, rifampicina o a ambas, o como multirresistentes, y se agruparon según si los pacientes habían recibido tratamiento con medicamentos de segunda línea. La definición de pacientes sin tratamiento y previamente tratados se ajustó al formato único o a los datos de la base de datos de las pruebas de sensibilidad del Laboratorio Nacional de Referencia.
Se empleó el programa Epidat 3.1 para calcular la proporción de resistencia a cada fármaco y a diferentes combinaciones, así como la resistencia global, con un intervalo de confianza del 95 %. Se utilizó la prueba de diferencia de proporciones entre la resistencia global para quinolonas y fármacos inyectables de los pacientes no tratados y de los previamente tratados con fármacos de segunda línea, con un intervalo de confianza de 95 % y una significación estadística de p<0,05.
Se determinó la procedencia de los aislamientos según el ente territorial, el tipo de tuberculosis (pulmonar, extrapulmonar), la edad, el sexo y la presencia de infección por HIV.
Resultados
Los casos se agruparon como no tratados (438; 89,5 %) y como previamente tratados con medicamentos de segunda línea (51; 10,5 %).
En los 438 aislamientos de casos no tratados, se encontró una resistencia global a kanamicina de 7,1 % (IC95% 4,6-9,6), seguida por una resistencia a amicacina, capreomicina y ofloxacina de 1,8 % (IC95% 0,4-3,2) para cada uno de estos fármacos. No se detectaron casos de tuberculosis extremadamente resistente en este grupo, pero sí 22 (5 %) de tuberculosis resistente a la quinolona o a alguno de los fármacos inyectables evaluado (cuadro 1).
Cuadro 1 Comportamiento de la resistencia de M. tuberculosis a las quinolonas y fármacos inyectables en los casos de tuberculosis resistente
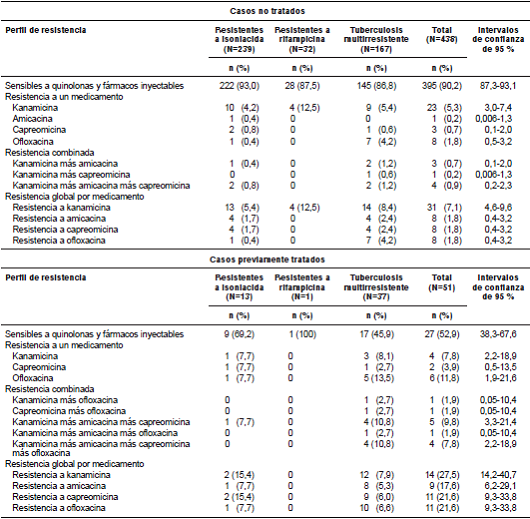
Los casos con resistencia a isoniacida fueron 239, de los cuales 222 (93,0 %) eran sensibles a los medicamentos de segunda línea evaluados, 10 (4,2 %) presentaron resistencia solo a kanamicina, uno (0,4 %) a amicacina, dos (0,8 %) a capreomicina y uno (0,4 %) a ofloxacina; además, se encontró un (0,4 %) caso con resistencia combinada a kanamicina y amicacina, y dos (0,8 %) resistentes a los tres fármacos inyectables evaluados (cuadro 1).
Se encontraron 32 casos resistentes a rifampicina, de los cuales 28 (87,5 %) fueron sensibles a los medicamentos de segunda línea evaluados, cuatro (12,5 %) tenían resistencia solo a kanamicina, y ninguno a los otros medicamentos (cuadro 1).
Se registraron 167 casos de tuberculosis multirresistente, de los cuales 145 (86,8 %) eran sensibles a los medicamentos evaluados, nueve (5,4 %) eran resistentes solo a kanamicina, siete (4,2 %) a ofloxacina y uno (0,6 %) a capreomicina; además, se identificaron dos (1,2 %) casos con resistencia combinada a kanamicina y a amicacina, uno (0,6 %) a kanamicina y capreomicina y dos (1,2 %) a los fármacos inyectables evaluados (cuadro 1).
Entre los 51 casos considerados como previamente tratados, se encontró una resistencia global a la kanamicina de 27,5 % (IC95% 14,2-40,7), seguida por la ofloxacina y la capreomicina con 21,6 % (IC95% 9,3-33,8) para cada una; la resistencia a la amicacina fue de 17,6 % (IC95% 6,2-29,1). Se identificaron siete (13,7 %) casos de tuberculosis extremadamente resistente y 13 (25,5 %) de tuberculosis resistente (cuadro 1).
Los casos con resistencia a isoniacida fueron 13; de ellos, nueve (69,2 %) eran sensibles a los medicamentos de segunda línea evaluados; solo se encontró uno (7,7 %) resistente a kanamicina, otro a amicacina y uno más a ofloxacina. Además, se encontró un (7,7 %) caso con resistencia combinada a los tres fármacos inyectables evaluados. Solo hubo un caso resistente a rifampicina, pero sensible a los fármacos evaluados (cuadro 1).
Se estudiaron 37 casos multirresistentes, 17 (45,9 %) de los cuales eran sensibles a los medicamentos evaluados. Solo se encontraron tres (8,1 %) casos resistentes únicamente a kanamicina, uno (2,7 %) a capreomicina y cinco (13,5%) a ofloxacina; además, se detectó uno (2,7 %) con resistencia combinada a kanamicina y ofloxacina, otro a capreomicina y ofloxacina, y cuatro (10,8 %) resistentes a todos los fármacos inyectables evaluados (cuadro 1).
La resistencia global a quinolonas y fármacos inyectables en los casos nuevos fue de 9,8 % (IC95% 6,9-12,7) y en los previamente tratados fue de 47,0 % (IC95% 32,3-61,7), con diferencias estadísticamente significativas (p<0,001) entre ellos.
Los 489 casos provenían de 29 entes territoriales, la mayoría de Antioquia con 137 (28 %) y Valle del Cauca con 102 (20,9 %), seguidos por 30 (6,1 %) de Santander, 28 (5,7 %) de Bogotá y 27 (5,5 %) de Atlántico (cuadro 2). Durante este periodo no se encontraron casos de tuberculosis resistente en los departamentos de Guainía, Vichada, Vaupés ni Amazonas.
Cuadro 2 Descripción de las variables sociodemográficas de los casos de tuberculosis farmacorresistente

Se registraron 430 (87,9 %) casos de tuberculosis pulmonar; la mediana de edad fue de 42 años (rango, 1 a 92 años), y 51,9 % de los pacientes tenía entre 15 y 44 años; 327 (66,9 %) eran de sexo masculino y la infección concomitante con el HIV se evidenció en 66 (13,5 %), pero no se contó con dicha información en 181 (37,0 %) (cuadro 2).
Discusión
Este estudio constituye la línea de base para determinar la prevalencia de la resistencia de M. tuberculosis a las quinolonas y fármacos inyectables en el país, entre 2012 y 2013.
Se encontró una mayor resistencia en los casos con antecedente de tratamiento que en los no tratados. Se evidenciaron casos de tuberculosis extremadamente resistente, la cual es una forma grave de la enfermedad en términos de epidemiología y salud pública. Aunque se desconoce si estos individuos tuvieron interrupciones en sus esquemas de tratamiento, es posible que estos hallazgos estén relacionados con las dificultades que se presentan en la administración de las dosis de medicamentos, las cuales deben darse, aproximadamente, durante 24 meses en los casos de resistencia. En muchas ocasiones, la continuidad del tratamiento se ve afectada por los trámites del sistema de salud y el compromiso del paciente para cumplirlo 10-12.
El fármaco con mayor resistencia en los casos de tuberculosis no tratados fue la kanamicina, que es el fármaco inyectable de elección en el manejo de los casos con multirresistencia, según lo establecido en la guía de manejo programático del Programa Nacional de Tuberculosis 12,13.
La presencia de casos con resistencia a quinolonas o fármacos inyectables, constituye una alerta frente a la intensificación de la resistencia a los fármacos, por lo cual es importante garantizar un adecuado seguimiento de estos pacientes para lograr su curación y evitar que aumente el perfil de resistencia 10-12.
Al revisar la literatura científica sobre la resistencia a quinolonas y fármacos inyectables, se encontraron estudios de casos de tuberculosis multirresistente en los cuales no se diferenció entre los previamente tratados con estos medicamentos y aquellos no tratados. El reporte global de tuberculosis para 2014 indica que de los 83 países con estrategias de vigilancia de la resistencia a estos medicamentos en casos de multirresistencia, en 40 se diagnosticaron más de 10 casos anuales de multirresistencia; la proporción de resistencia a las quinolonas (ofloxacina, moxifloxacina y levofloxacina) fue de 21 % (IC95% 8,3-34), porcentaje similar a lo observado en el presente trabajo en casos previamente tratados 4.
En varios trabajos se ha documentado la presencia de resistencia a quinolonas y fármacos inyectables en regiones con alta prevalencia de tuberculosis resistente. Li, et al., evaluaron la presencia de resistencia a trece medicamentos de primera y segunda línea en 92 aislamientos de pacientes con tuberculosis en la provincia de Guizhou en China, y encontraron que 41,3 % presentaba resistencia a quinolonas, principalmente a ciprofloxacina, y 18,4 % a los fármacos inyectables. China presenta una alta prevalencia de resistencia a los fármacos antituberculosos, lo cual explica los altos porcentajes en comparación con los datos del presente estudio 14.
En un hospital de Pakistán, Nafes, et al., estudiaron la sensibilidad a quinolonas y fármacos inyectables en 243 pacientes con tuberculosis multirresistente, y encontraron que la resistencia a ofloxacina fue del 52,7 %, a capreomicina de 1,2 %, y a kanamicina y amicacina de 0,8 % en cada una, datos que no se analizaron considerando el antecedente de tratamiento previo con estos medicamentos. Al compararlos con los obtenidos en Colombia, se evidenció que la resistencia a la ofloxacina fue mucho mayor en todos los grupos conformados en este estudio, lo cual podría explicarse porque Pakistán es uno de los países con mayor carga de tuberculosis y tuberculosis multirresistente 15,16.
Dalal, et al., evaluaron el porcentaje de resistencia a fármacos inyectables y quinolonas en 340 casos multirresistentes, durante un periodo de ocho años, en Mumbai, India, y encontraron 16,5 % de resistencia a kanamicina, 14 % a amicacina, 12,4 % a capreomicina y 61,9 % a ofloxacina. Al igual que en los trabajos ya mencionados, estos datos son reflejo de la epidemia de tuberculosis resistente a la que se enfrentan otras regiones del mundo, y difieren de los reportados en el presente estudio en términos de prevalencia. A pesar de esto, los datos que aquí se presentan deben alertar al programa nacional para mejorar las acciones de control de la enfermedad y, así, evitar una emergencia por resistencia a fármacos 17.
En Georgia, Kempeker, et al., evaluaron 158 pacientes con tuberculosis multirresistente y encontraron que el 44 % había recibido tratamiento previo con medicamentos antituberculosos y había resistencia a kanamicina y amicacina en 33 % de ellos, y a ofloxacina en el 6 %, porcentajes similares a los de este estudio en el caso de los fármacos inyectables, aunque aquí se analizó la resistencia total sin diferenciar según los antecedentes de tratamiento con fármacos de segunda línea 18.
En un estudio de Asencios, et al., se evaluó la prevalencia de la resistencia a fármacos de segunda línea en casos de tuberculosis multirresistente durante 2005 y 2006, en el Perú. Se estudiaron 2.169 casos, de los cuales 36,2 % presentaba resistencia, por lo menos, a un fármaco, principalmente a la etionamida y a la kanamicina; aunque no se analizó el antecedente de exposición a medicamentos de segunda línea, se encontró resistencia a la ciprofloxacina en 10,1 % de los casos 19. Con estos datos debidamente actualizados, Castillo, et al., elaboraron un documento con algunas pautas para el control de esta forma de la enfermedad en un país donde la prevalencia de la resistencia es la más alta de la región 20.
Estos hallazgos se asemejan a los de este estudio en el caso de los fármacos inyectables, pues se encontró mayor porcentaje de resistencia a las quinolonas y se estableció que la exposición previa a estas se relaciona con mayores tasas de resistencia, especialmente en los pacientes previamente tratados (21,6 %). Además, el 3,4 % de los casos multirresistentes estudiados en Colombia presentaron tuberculosis extremadamente resistente, porcentaje alto si se tiene en cuenta que el total de casos evaluados y el periodo de análisis de los datos fueron menores que los del estudio de Perú, donde la prevalencia de este tipo de tuberculosis en 10 años fue de 6,4 % 19,20.
En un trabajo de Cegielski, et al., que buscaba establecer la relación entre el resultado de la enfermedad y el esquema de tratamiento en 1.244 casos de tuberculosis multirresistente, también en Perú, se encontró que en aquellos casos en los que se habían hecho estas pruebas, el éxito del tratamiento había sido de 85,8 % en los sensibles, de 69,7 % en aquellos con resistencia inicial a alguna quinolona, de 37,5 % en casos de tuberculosis resistente y de 29,3 % en los casos extremadamente resistentes. Estos datos evidencian la necesidad de mejorar el acceso de los pacientes a dichas pruebas, en especial, porque proporcionan información clínicamente útil para orientar la selección de los esquemas de tratamiento, aunque las posibilidades de curación disminuyen con la presencia de formas de resistencia más graves 21,22. En Colombia, la curación de los casos multirresistentes no supera el 50 %, pero no se sabe si ello está relacionado con la ausencia de pruebas de sensibilidad o con la efectividad de los esquemas de tratamiento 4.
Dado que los fármacos antituberculosos de segunda línea se emplean en el manejo de otras enfermedades, es importante conocer el comportamiento de la resistencia. En este sentido, Ho, et al., evaluaron en Australia el perfil de resistencia a los medicamentos de primera línea y a las quinolonas en 357 casos nuevos, y encontraron 0,3 % de resistencia a isoniacida, 11 % de tuberculosis multirresistente y 0,6 % de resistencia a quinolonas en casos sensibles a los fármacos de primera línea. Australia es un país donde las tasas de resistencia a los medicamentos antituberculosos son bajas; sin embargo, este tipo de hallazgos alerta sobre la necesidad de mejorar la vigilancia en casos nuevos, especialmente, cuando las quinolonas se proponen como una alternativa terapéutica para reducir el tiempo actual de los esquemas de tratamiento 23.
Para el Programa Nacional de Control de la Tuberculosis es primordial fortalecer la vigilancia por el laboratorio de la resistencia a estos medicamentos en todos los casos que presenten resistencia a isoniacida, rifampicina o a ambas, pues los datos aquí analizados indican tasas altas en algunos casos, lo que, sumado a la ausencia de nuevos medicamentos y a la duración actual del tratamiento, constituye una amenaza para el control de la enfermedad. A pesar de que las nuevas metas de eliminación de la tuberculosis establecidas por la OMS consideran la implementación de nuevos esquemas de tratamiento, se ha emitido la recomendación de usar otros medicamentos en los casos multirresistentes, bajo la premisa fundamental de evaluar la resistencia a quinolonas y fármacos inyectables mediante métodos rápidos de detección del ADN con la técnica de reacción en cadena de la polimerasa, los cuales deben confirmarse mediante los métodos convencionales como el Bactec MGITTM. Estas recomendaciones también incluyen las acciones de seguimiento del paciente y sus contactos 24,25.
El uso indiscriminado de antibióticos es una práctica que debe ser controlada en términos de salud pública. En este contexto, la resistencia y el desarrollo de otros mecanismos de defensa de los microrganismos patógenos disminuyen la efectividad de los medicamentos disponibles. En el caso específico de la tuberculosis, es necesario que se fortalezcan las actividades de vigilancia y se analice periódicamente la información, así como el manejo adecuado de los esquemas de tratamiento en los casos sensibles y resistentes para disminuir las probabilidades de extender la resistencia. Asimismo, es necesario mantener actualizadas las guías y los protocolos de manejo de los pacientes 15,26,27.














