El cáncer constituye uno de los mayores problemas de salud pública a nivel mundial, y una de las enfermedades de más difícil diagnóstico y tratamiento. A pesar de los grandes avances de las últimas décadas en su comprensión y estudio, su control continúa siendo esquivo 1, en gran medida, debido a que es una enfermedad notablemente compleja en la que un gran número de rutas moleculares y celulares se ven alteradas, lo cual se traduce en múltiples fenotipos 2. En el caso específico del cáncer de cuello uterino, a pesar de la reducción en las tasas de incidencia y mortalidad debido a la implementación de programas de prevención, especialmente en los países en desarrollo, este sigue siendo una de las principales causas de muerte en la población femenina mundial. Aunque se espera que el reporte de casos disminuya con la implementación de la vacunación contra el principal agente causante de la enfermedad, esto no será posible antes de 20 a 30 años. Por lo tanto, la búsqueda de nuevas y mejores formas de tratamiento sigue siendo válida, más aún cuando la cobertura de la vacuna se restringe a ciertos tipos virales 3.
La comprensión de los mecanismos bioquímicos y genéticos del desarrollo de los tumores es fundamental para detectar, clasificar, vigilar y tratar este tipo de enfermedades, como lo demuestran los nuevos métodos de diagnóstico y los medicamentos basados en moléculas que inhiben o revierten su crecimiento 4.
Entre los factores que afectan el comportamiento biológico de las células cancerosas, los microambientes tumorales han cobrado gran interés.
El tejido tumoral es un complejo entramado de células tumorales y de otras no tumorales, entre las cuales se cuentan los fibroblastos del estroma, los adipocitos, las células del sistema inmunológico como macrófagos y neutrófilos, y las células del endotelio de los vasos sanguíneos. Además de las condiciones ambientales que cumplen funciones críticas para el desarrollo del fenotipo tumoral, existen otros factores biológicos, químicos y físicos, como las moléculas de la matriz extracelular, así como las condiciones ambientales de oxigenación, la presión intersticial y el pH, que afectan el comportamiento tumoral 5.
Uno de los factores críticos de la viabilidad de las células tumorales y de las adyacentes al tumor, son las concentraciones tisulares de oxígeno 6.
Dado que solo un número limitado de células puede recibirlo por difusión directa a partir de un vaso sanguíneo (60-100 μm por vaso), estas sufren condiciones de estrés metabólico como la hipoxia y la falta de nutrientes, las cuales hacen evidente la heterogeneidad tumoral 7. En el tejido tumoral la tasa de consumo de oxígeno de las células neoplásicas y del estroma excede su disponibilidad, ya de por sí limitada, lo que resulta en áreas con concentraciones de oxígeno inferiores al 5 % 8, con la consecuente alteración en la expresión génica y proteica en estos tejidos 9.
Hay información que evidencia la asociación de la hipoxia tumoral con los resultados clínicos desfavorables en el carcinoma de cuello uterino, y con la resistencia a la radioterapia y la quimioterapia. En varios estudios se ha reportado el aumento de marcadores metabólicos relacionados con la hipoxia, como el lactato, el transportador de glucosa (Glut1) y la anhidrasa carbónica (CAXIV), todos ellos relacionados con la actividad de transcripción del factor inducible por hipoxia, HIF-1α 10.
Las rutas de señalización celular determinan la forma en que la célula incorpora los estímulos del medio ambiente, y reacciona frente a estos mediante diferentes tipos de modificaciones en su expresión génica y en la regulación de la actividad enzimática. La vía JAK/STAT ha demostrado tener un importante papel entre las rutas de señalización implicadas en este proceso; las proteínas que hacen parte de esta vía son capaces de detectar una gran variedad de señales del entorno y hacer su transducción al núcleo, lo cual afecta directamente la regulación de la expresión génica 11. Mientras la activación de estas proteínas es rápida, el tiempo en que permanecen activas es reducido debido a mecanismos específicos de realimentación negativa. La activación aberrante y sostenida de esta vía se ha asociado con múltiples condiciones, como la inflamación crónica, las reacciones inmunitarias anormales o el cáncer 12. Aunque no se han observado mutaciones en los genes que codifican para las proteínas de la familia STAT en el cáncer, sí se ha encontrado su activación persistente y aberrante en diversos tipos de cánceres humanos 13.
En el cáncer de cuello uterino se ha reportado la expresión exagerada y la activación constitutiva de la vía, especialmente mediante la proteína STAT3, tanto en biopsias de pacientes 14 como en estudios in vitro con células de carcinoma de cuello uterino, como las HeLa 15, C33a, SiHa y CaSki 16. Se ha sugerido que esta activación aberrante tiene un papel prominente en el desarrollo y la progresión de la enfermedad, y se la ha relacionado con el mal pronóstico y la poca supervivencia de los pacientes; sin embargo, los mecanismos que la explican no se han aclarado completamente.
A partir de los resultados reportados se puede inferir que existen otras vías de señalización o condiciones ambientales que afectan su activación. De hecho, diversos factores, como el estrés mecánico o el oxidativo, se han relacionado con la activación no canónica de esta vía 17, y en varios estudios se ha sugerido que la adaptación a las condiciones de hipoxia en varias líneas tumorales estaría asociada a la estimulación de la vía JAK/STAT, hecho que la convierte en un factor crítico en el desarrollo, la supervivencia y la expansión de las células malignas 18. Sin embargo, a diferencia de otras vías de señalización oncogénicas, esta no se ha explorado completamente en condiciones de hipoxia, por lo cual la importancia de su activación podría estar subestimada. Por ello, resulta de gran interés ahondar en la comprensión de los factores que conducen a su activación aberrante y su efecto en el proceso de oncogénesis y desarrollo tumoral 19.
De las siete proteínas de la familia STAT, la STAT3 y la STAT5 han sido las más ampliamente vinculadas a procesos de desarrollo tumoral 20.
La STAT3 es una oncoproteína que se encuentra activa de manera constitutiva en cerca del 70 % de los tumores sólidos y hematológicos, incluidos el mieloma múltiple, varios tipos de linfoma y leucemia, el cáncer de seno, cabeza y cuello, el cáncer de próstata, el carcinoma de ovario, el melanoma, el carcinoma renal, el colorrectal y los tumores del epitelio del timo 21. Aunque existen formas mutantes constitutivamente activas disponibles para la investigación, como la STAT3C, la aparición de estas formas es extremadamente rara en cultivos in vitro22.
Se ha observado que las células obtenidas a partir de tejidos tumorales que muestran activación constitutiva de STAT3 in vivo pierden rápidamente la fosforilación una vez se ponen en cultivo sin células del estroma o del sistema inmunológico 23, lo cual lleva a plantear que, a menudo, la activación de STAT3 en el cáncer es el resultado de la estimulación crónica producida por los estímulos extracelulares presentes en el microambiente tumoral, como la hipoxia, la presencia de diversas citocinas o factores de crecimiento 24,o de células sanas adyacentes como las del sistema inmunológico o las del tejido endotelial responsable de la creación de nuevos vasos sanguíneos 25.
En algunos estudios se ha reportado la asociación de las STAT3 con la adaptación de las células tumorales a condiciones de hipoxia cuando interactúan físicamente con el HIF-1α y activan la transcripción completa de genes regulados por este factor 26. Esta adaptación se relaciona con el cambio metabólico dependiente de las condiciones de oxígeno en las células sanas y en las transformadas 27.
Entre los componentes del microambiente tumoral, el tejido endotelial ha cobrado especial interés por su amplia relación con el desarrollo y el crecimiento de los tumores de cuello uterino, no solo porque facilita el acceso del oxígeno mediante la angiogénesis, sino por la secreción de citocinas y factores de crecimiento que promueven el desarrollo del neoplasma de cuello uterino. En la activación de estos procesos, se ha evidenciado el papel protagónico de la proteína STAT3 en las células tumorales y en las del tejido endotelial adyacente durante la reacción a los estímulos autocrinos y paracrinos de estos tipos celulares 10,28.
El conocimiento sobre el estado de los diferentes procesos en los tipos celulares que componen el microambiente, en especial de las vías de señalización que los hacen posibles, es de gran relevancia en la interpretación de la reacción de las células tumorales a los estímulos externos, sobre todo a las condiciones cambiantes de las concentraciones de oxígeno.
En este contexto, el objetivo del presente estudio fue evaluar el estado de expresión o activación de la vía de señalización JAK/STAT en dos modelos in vitro, uno endotelial y otro tumoral, sometidos a condiciones de hipoxia semejantes a las encontradas en el microambiente tumoral.
Materiales y métodos
Cultivo celular
Para la recreación in vitro de los componentes del microambiente tumoral, se escogió como modelo la línea celular HeLa (adenocarcinoma de cuello uterino humano) y, como modelo de las células adyacentes sanas, la línea endotelial EA.hy926 (línea endotelial humana fusionada con la línea A549 de carcinoma de pulmón). Las células se cultivaron en medio de cultivo Eagle modificado de Dulbecco (DMEM), con suplemento de suero fetal bovino (SFB) al 10 %, en atmosfera húmeda, con 5 % de CO2 y a 37 °C.
Condiciones de hipoxia
La hipoxia física se logró mediante una cámara aislada C-Chamber de BioSpherix(r) y un controlador de la concentración de oxígeno y dióxido de carbono ProOx C-21 de BioSpherix(r), con una composición de gases de 1 % de O2 y 5 % de CO2, equilibrado con N2 al 99,9 %, a 37 °C 29. La hipoxia química se consiguió mediante la adición de 100 μM de mesilato de deferoxamina (DFO, Sigma) 29,30). Las células se mantuvieron en estas condiciones de cultivo durante todos los experimentos.
Ensayo de citotoxicidad mediante el ensayo de MTT
Se sembraron, aproximadamente, 25.000 células en cajas de cultivo celular de 96 pozos y se incubaron durante 24 horas a 37 °C y 5 % de CO2 para permitir su adherencia. Posteriormente, los cultivos se sometieron a condiciones de normoxia, hipoxia física (1 % de O2) e hipoxia química (100 μM de DFO), durante dos, seis y 24 horas. Al finalizar este periodo, se descartó el medio y se agregaron 100 μl de medio DMEM sin suero con MTT a una concentración de 1 mg/ml (Invitrogen), se dejó en incubación durante cuatro horas a 37 °C y 5 % de CO2. Se eliminó el sobrenadante y se añadieron 100 μl de isopropanol y 0,05 de solución normal de ácido clorhídrico para permitir la disolución de los cristales de formazán, luego se dejó en incubación durante una hora a temperatura ambiente y en agitación sobre una plataforma balanceante y, finalmente, se hizo la lectura en espectrofotómetro a una longitud de onda de 595 nm.
Extracción de proteínas totales
Después de los diferentes estímulos, las células se lavaron tres veces con solución tampón fosfato salino (PBS) y se les adicionaron 500 µl de solución tampón: 50 mM de TrisCl, pH 7,4; 15 mM de cloruro de sodio (NaCl); 5 mM de EDTA, y Triton(tm) X-100 al 0,5 % (RIPA) (Sigma) con suplemento de 5 µl/ml de una mezcla de inhibidor de proteasas (AEBSF, aprotinina, bestatina, E-64, leupeptina y pepstatina A) (Sigma), 1 mM de fluoruro de fenilmetilsulfonilo (PMSF) (Sigma) y 1 mM de ortovanadato de sodio (Na3VO4) (Sigma). Los cultivos celulares se cosecharon utilizando un raspador de células; la suspensión se recolectó y se sometió a lisis con solución tampón RIPA utilizando una jeringa con aguja de calibre 21, se incubó en hielo durante 15 minutos y se centrifugó durante otros 15 a 14.000 rpm a 4 °C. El sobrenadante con las proteínas se recolectó y almacenó a -80 °C para su posterior uso.
Extracción de proteínas nucleares
Para la extracción de las proteínas nucleares, se empleó el estuche Nuclear Extract Kit(r) (Active Motif). Las células con confluencia del 95 % se lavaron con PBS e inhibidor de fosfatasas, se les añadieron 500 μl de solución tampón hipotónica y se las incubó durante 15 minutos a 4 °C. Posteriormente, se agregaron 25 μl de detergente y se mezcló en un agitador durante 10 segundos. La suspensión se centrifugó durante 30 segundos a 14.000 rpm y a 4 °C, y el sobrenadante con las proteínas citoplasmáticas se transfirió a un tubo Eppendorf y almacenó a -80 °C.
El material sedimentado resultante, correspondiente a la fracción nuclear enriquecida, se suspendió de nuevo en solución tampón de lisis que contenía 1 mM de ditiotreitol (DTT) y la mezcla de inhibición de proteasas. La suspensión se incubó durante 30 minutos sobre hielo en plataforma balanceante y, posteriormente, se homogeneizó en un agitador durante 30 segundos. Se centrifugó durante 10 minutos a 4 °C y el sobrenadante con las proteínas nucleares se almacenó en varias alícuotas a -80 °C hasta su uso. Las proteínas se cuantificaron mediante el método del ácido bicinconínico (BCA) (Thermo), según las instrucciones del fabricante. La pureza de las proteínas nucleares se verificó por Western blot, utilizando anticuerpos contra lámina A (proteínas nucleares) y actina beta (proteínas citoplásmicas).
Activación del factor de transcripción HIF-1α
La activación del factor de transcripción HIF-1α se comprobó utilizando el sistema TransAM(tm) HIF-1 (Active Motif). Para el ensayo se utilizaron 10 µg de extractos nucleares por pozo y se incubaron con la secuencia correspondiente al elemento de respuesta a la hipoxia (ERH) provista en el estuche, según las instrucciones del fabricante. La actividad del HIF-1 presente en los extractos nucleares se comprobó mediante lecturas en un espectrofotómetro a una longitud de onda de 450 nm y 655 nm.
Detección de proteínas mediante Western blot
La separación de las proteínas se hizo mediante electroforesis en gel de poliacrilamida con dodecilsulfato sódico (SDS-PAGE) en geles de poliacrilamida al 8 %. Se utilizaron 40 µg de proteína por pozo. Las muestras se calentaron durante 5 minutos a 96 °C, se centrifugaron a 14.000 rpm a 4 °C durante cinco minutos y se sembraron en cada uno de los pozos.
La electroforesis se hizo durante dos horas a un voltaje constante de 120 V y las proteínas se transfirieron a membranas de fluoruro de polivinilideno (PVDF) (GE Healthcare), utilizando el sistema de transferencia húmeda Mini Trans-Blot(r) Electrophoretic Transfer Cell (Bio-Rad) en solución tampón de transferencia (15 mM de tris, 120 mM de glicina, metanol al 15 %) (Merck) a 100 V durante dos horas.
Las membranas se mantuvieron en solución salina amortiguadora TBS con Tween-20 (TBS-T) (20 mM de tris con pH de 7,6; 137 mM de NaCl, Tween(r) 20 al 0,1 %) (Sigma), hasta su uso. Posteriormente, se bloquearon durante dos horas con leche descremada al 5 % en TBS-T para STAT3 o con albúmina de suero bovino (BSA) al 1 % en TBS-T para actina beta, y se incubaron toda la noche a 4 °C con anti-STAT3 en una proporción de 1:500 (STAT3 (C-20), Santa Cruz Bioctechnology) diluido en leche descremada al 5 % o con el anticuerpo primario monoclonal producido en ratón anti-actina beta en proporción de 1:5.000 para el control de carga (Sigma). Se lavaron tres veces con TBS-T en agitación durante 10 minutos cada vez y se incubaron con el anticuerpo secundario conjugado en peroxidasa de rábano (HRP), durante dos horas a temperatura ambiente y en agitación continua.
Las proteínas se detectaron con quimioluminiscencia acentuada (ECL Plus) (GE Healthcare) y se documentó mediante películas de alto rendimiento para quimioluminiscencia (GE Healthcare). Las películas se digitalizaron a una resolución de 600 dpi y se analizaron por densitometría con el programa de análisis de imágenes Image J, versión 1.44.
Inmunoprecipitación de proteínas fosforiladas en tirosinas
Se utilizaron perlas de proteína G sefarosa (Sigma), las cuales se lavaron inicialmente tres veces con 500 µl de PBS y 5 µl/ml de la mezcla de inhibidores de proteasas, 1mM de PMSF y 1 mM de Na3VO4, y se centrifugaron en cada lavado a 14.000 rpm durante un minuto.
Para formar el complejo de anticuerpo y polisacárido, se utilizaron 70 µl de perlas a las cuales se le añadió el anticuerpo antifosfotirosina (Millipore) en una concentración de 0,03 µg/µl y se incubaron toda la noche a 4°C en agitación constante. Posteriormente, las muestras se centrifugaron a 14.000 rpm durante un minuto y se retiró el exceso de anticuerpos presente en el sobrenadante.
Se hicieron tres lavados con PBS e inhibidores de proteasas y fosfatasas, se agregaron 500 µg de proteínas totales y se llevaron a un volumen de 500 µl con PBS e inhibidores de proteasas y fosfatasas; después, se incubaron a 4 °C durante dos horas en agitación constante y se lavaron tres veces en las condiciones ya descritas. Las perlas se suspendieron de nuevo en 60 µl de solución tampón de carga 4X para SDS-PAGE, y se calentaron a 96 °C para permitir la disociación de las proteínas de interés del complejo de anticuerpo y polisacárido. La muestra se centrifugó durante cinco minutos a 14.000 rpm y 4 °C, y el sobrenadante se recolectó y se sometió a electroforesis mediante Western blot como se describió anteriormente.
Inmunocitoquímica con anticuerpos inmunofluorescentes
Las células se sembraron sobre cubreobjetos dispuestos en cajas de cultivo celular de 24 pozos, en una densidad de 30.000 células por pozo con 500 µl de medio DMEM y 10 % de suplemento de suero fetal bovino (SFB), y se cultivaron durante 24 horas para permitir su adherencia. Posteriormente, se lavaron tres veces con PBS, y las células se fijaron con paraformaldehído al 4 % (PFA, Sigma) durante 30 minutos a temperatura ambiente y en agitación continua. Después, se retiró el PFA y se hicieron otros tres lavados con PBS a temperatura ambiente.
Las células se hicieron permeables con 0,3 % de Triton(tm) X100 (Sigma) en PBS durante cinco minutos a temperatura ambiente y en agitación constante. Se lavaron de nuevo tres veces con PBS y se incubaron con 50 mM de cloruro de amonio (NH4Cl) fresco para evitar la autofluorescencia de los grupos aldehído por la fijación con PFA.
A continuación, las células se lavaron tres veces con PBS y se incubaron con solución tampón de bloqueo (1 % de BSA en PBS) durante 30 minutos a temperatura ambiente. Se incubó con anticuerpo anti-STAT3 diluido en solución tampón de bloqueo a una concentración de 1:100 durante toda la noche a 4 °C; se hicieron seis lavados con PBS y se incubaron durante dos horas con el anticuerpo secundario Alexa Fluor(r) 568 Goat Anti-RabbitIgG (Life Technologies) en dilución de 1:1000 en solución tampón de bloqueo.
Para la detección de los núcleos, se hicieron tres lavados adicionales, se tiñó con 0,2 μg/ml de colorante Hoechst 33342 (LifeTechnologies) y se incubó durante 30 minutos.
Por último, los cubreobjetos se lavaron tres veces con PBS y se fijaron sobre portaobjetos utilizando el medio de montaje Fluoromount (Sigma). Para cuantificar la translocación de la proteína al núcleo, se utilizó un microscopio de fluorescencia y se contabilizó en 100 células la incorporación de proteína STAT3 al núcleo utilizando el programa ImageJ (versión 1.44).
Análisis estadístico
Los experimentos se hicieron por triplicado y los datos obtenidos se expresaron como promedios y su desviación estándar. Se hicieron pruebas t para medias de dos muestras pareadas, con el fin de determinar las diferencias estadísticamente significativas en las condiciones de hipoxia comparadas con las de normoxia. Los análisis estadísticos se llevaron a cabo con el programa Graph Pad Prism (v. 6, GraphPad Software, Inc., La Jolla, CA).
Resultados
Inducción de hipoxia y activación de HIF-1
Las condiciones de hipoxia física y química se comprobaron mediante la activación de HIF-1 y su migración al núcleo en extractos nucleares de células HeLa y EA.hy926. La absorbancia obtenida permitió ratificar que los cultivos celulares expuestos a condiciones de hipoxia física con concentraciones de oxigeno del 1 % y de hipoxia química utilizando100 μM de DFO presentaron concentraciones más altas de HIF-1 en el núcleo, comparados con las células en condiciones de normoxia (figura 1).
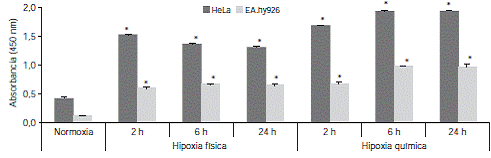
Figura 1 Activación de HIF-1 en células HeLa y EA.hy926 bajo condiciones de hipoxia física y química. Para la hipoxia física las células se sometieron a concentraciones de O2 de 1 % y para la hipoxia química se utilizaron 100 μM de DFO. Se extrajeron las proteínas nucleares, y el HIF-1 se detectó por ELISA con el kit TransAM(tm). Se hizo la prueba t para medias de dos muestras pareadas entre el control en condiciones de normoxia y cada una de las condiciones de experimentación.
La hipoxia física activó el HIF-1 tempranamente, a partir de las dos horas, con una ligera tendencia a disminuir a las 24 horas, en tanto que su activación tras la exposición a la hipoxia química se inició a las dos horas y continuó en aumento durante el experimento. Se observó, además, un incremento más pronunciado de HIF-1 en las células HeLa y ligeramente mayor bajo condiciones de hipoxia química en las dos líneas celulares.
La determinación de la activación del HIF-1 permitió confirmar que las concentraciones de oxígeno de 1 % y las utilizadas con el agente quelante del hierro, DFO, inducían las condiciones de estrés celular, y sus valores registraron diferencias estadísticamente significativas al compararlos con los obtenidos en condiciones de normoxia. Dichas condiciones de hipoxia, excepto a las 24 horas de hipoxia física en las células HeLa (p<0,05), no tuvieron efectos citotóxicos para las células HeLa y EA.hy926 en los periodos analizados (no se presentan los datos).
La hipoxia no modificó la expresión constitutiva de STAT3 en las células HeLa y EA.hy926
Para valorar la expresión de STAT3 con respecto al tipo y la duración del evento estresante, las células se sometieron a un ambiente de 1 % de O2 durante dos, seis y 24 horas. Después de aplicar el estímulo, no se registró ningún cambio en la expresión constitutiva de la proteína STAT3 de la línea tumoral HeLa ni de la línea endotelial EA.hy926 en condiciones de normoxia e hipoxia, siendo mayor la expresión de STAT3 en las células endoteliales (figura 2).
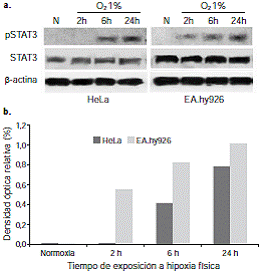
Figura 2 Inmunodetección de STAT3 fosforilada en células HeLa y EA.hy926 expuestas a hipoxia física. a. Activación de STAT3 en células HeLa y EA.hy926 expuestas a hipoxia física. Para la detección de pSTAT3 en cada una de las muestras, se inmunoprecipitaron 500 μg de extractos totales con proteína G-sefarosa y anti-fosfotirosina, clon PY20, y posteriormente se hizo la inmunodetección mediante Western blot con anti-STAT3. b. Densidad óptica relativa de la forma fosforilada de STAT3 en células HeLa y EA.hy926 expuestas a hipoxia física. Los resultados obtenidos en la inmunodetección de pSTAT3 se escanearon y procesaron con el programa ImageJ, Version 1.44. Los resultados obtenidos se normalizaron con base en la expresión de STAT
La hipoxia indujo la activación de STAT3 en las líneas HeLa y EA.hy926
La inmunoprecitación de las proteínas fosforiladas permitió establecer que la hipoxia física indujo cambios en la activación de la proteína STAT3 de las dos líneas celulares estudiadas. En las células HeLa se observó fosforilación de STAT3 a partir de las seis horas del estímulo, mientras que, en las células EA.hy926, la fosforilación se detectó a las dos horas. Se confirmó que bajo las mismas condiciones no hubo cambio en la expresión de la proteína total STAT3. El análisis por densidad óptica relativa evidenció un incremento progresivo de la forma fosforilada de la proteína STAT3, es decir, su forma activa, dependiente del tiempo (figura 2).
La activación de STAT3 por hipoxia física se confirmó mediante inmunocitoquímica usando anticuerpos fluorescentes. En las células HeLa, la translocación nuclear de STAT3 se observó con una intensidad moderada a las dos horas y con mayor intensidad a las seis y 24 horas. En las células EA.hy926, la translocación de STAT3 se inició tempranamente, desde las dos horas, con un pico de mayor intensidad a las seis horas, y permaneció de forma más leve hasta las 24 horas. La translocación nuclear de STAT3 no fue tan evidente bajo condiciones de hipoxia química con 100 μM de DFO en las células HeLa y EA.hy926 en los tiempos de estudio. Los resultados fueron compatibles con el porcentaje de células con translocación nuclear de STAT3, y se encontró una diferencia significativa entre la hipoxia química y la hipoxia física en todas las condiciones analizadas (figura 3).
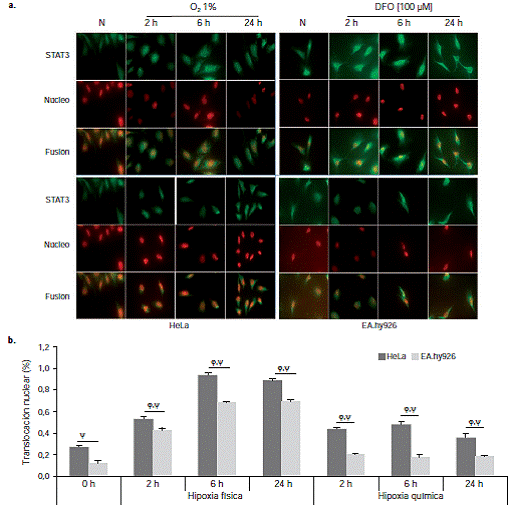
Figura 3 a. Sublocalización celular de STAT3 en células HeLa y EA.hy926 tras la exposición a hipoxia física y química (100 μM de DFO). Las células se cultivaron en portaobjetos y se sometieron durante dos, seis y 24 horas a hipoxia química. Se fijaron y se hicieron permeables; posteriormente, se detectó la proteína STAT3 mediante inmunocitoquímica con anticuerpos fluorescentes, usando anti-STAT3 y Hoescht 33342. b. Porcentaje de translocación nuclear de la proteína STAT3 en células HeLa y EA.hy926 tras la exposición a hipoxia física y química. Se contaron las células que presentaron translocación nuclear de la proteína STAT: 100 células por triplicado para cada una de las condiciones. Se hizo la prueba t para medias de dos muestras pareadas entre el control en condiciones de normoxia y cada una de las condiciones de experimentación (ϕ); se compararon, además, las dos líneas en los diferentes tiempos para los dos tipos de hipoxia (ψ), con p<0,05, respectivamente.
Los resultados de la inmunofluorescencia indirecta permitieron confirmar la translocación nuclear de la proteína tras el estímulo con hipoxia física en las células HeLa y EA.hy926. Resulta interesante que la translocación nuclear fuera menos acentuada en condiciones de hipoxia química con DFO, aunque siguió mostrando diferencias significativas con respecto a su control en condiciones de normoxia (p<0,05).
Discusión
Los microambientes tumorales y su reacción ante diferentes estímulos estresantes y agentes terapéuticos han cobrado una gran importancia en la comprensión del desarrollo del tumor 31. Frente a un estímulo ambiental como la hipoxia, las células reaccionan con diversos mecanismos de adaptación, que incluyen la activación de rutas de señalización implicadas en la proliferación, la angiogénesis y la regulación metabólica.
El papel del HIF-1α en condiciones de hipoxia se ha considerado crítico para iniciar la respuesta celular en tales situaciones 32, lo que podría estar relacionado con la activación de otras vías de señalización que buscan que la célula se adapte a las condiciones cambiantes de su ambiente. Las condiciones de hipoxia establecidas en el estudio se comprobaron al evaluar la activación del HIF-1 por su unión a la secuencia de ADN correspondiente al elemento de respuesta a la hipoxia, tanto física como química. Las condiciones de hipoxia física y de hipoxia química no desencadenaron efectos citotóxicos para las células en estudio, lo que concuerda con estudios anteriores en los que estos efectos se han descrito después de exposiciones crónicas durante intervalos de tiempo superiores a las 24 horas 33. Las condiciones de hipoxia física y química analizadas durante el estudio indujeron la estabilización temprana del HIF-1 y su translocación nuclear a partir de las dos horas de inicio de las condiciones de hipoxia en las dos líneas celulares, dando comienzo a toda la reacción metabólica dependiente de HIF-1.
La expresión de STAT3 está presente en un gran número de líneas celulares y se ha reportado en aquellas de fibroblastos, NIH3T3, cáncer hepático, Hep3B, cáncer de riñón, Caki-1 34 y cáncer de cuello uterino, como las HeLa, C33a, SiHa y CaSki 16. Se ha señalado que la activación de STAT3, al igual que la de otros miembros de esta familia, no requiere la degradación inducida por un regulador 35, por lo cual un estímulo que afecte esta vía puede mantener sin modificaciones la cantidad de proteína expresada, lo cual explicaría los resultados observados y plantearía la necesidad de analizar en el futuro su comportamiento en la expresión génica. En estudios anteriores se ha incrementado experimentalmente la expresión de la proteína inactiva en su forma silvestre y se ha demostrado que carece de efectos sobre la progresión tumoral 36.
Los resultados obtenidos muestran que las dos líneas celulares en estudio presentaron una expresión constitutiva de la proteína STAT3 que no varió en las condiciones de hipoxia recreadas. No obstante, se observó una mayor expresión en el modelo endotelial, lo que puede deberse a que esta línea es un híbrido de células de adenocarcinoma de pulmón A549 37 y de células endoteliales HUVEC, en las cuales se ha observado de manera independiente una expresión constitutiva de esta proteína 34,38. Sin embargo, harían falta más datos experimentales para concluir que esta variación en la expresión es producto del fenotipo endotelial, del tumoral o de la sinergia entre los dos.
La activación de STAT3 in vitro como reacción a la hipoxia física se observó tanto en la línea celular tumoral como en la endotelial, lo cual sugiere que el estrés por hipoxia podría proveer una señal común de inducción de un incremento en la expresión de factores de angiogénesis, la migración de las células endoteliales y la angiogénesis durante el proceso de formación del tumor 7,39.
La activación de STAT3 es producto de la fosforilación de un residuo crítico de tirosina en la posición 705 (Y705), la cual induce la dimerización de STAT a través del dominio de interacción SH2-fosfotirosina 40. Además de este residuo, se ha planteado que la actividad de transcripción y unión al ADN son reguladas por otras modificaciones posteriores a la transducción, como la fosforilación de las serinas (S727) 41 y la acetilación reversible del residuo 685 de lisina 42.
La inmunoprecipitación de proteínas con residuos de tirosina fosforilada mostró que, tras la estimulación por hipoxia física, hay un incremento de las formas fosforiladas de la proteína STAT3, la cual se inicia tempranamente tras el estímulo estresante, alrededor de las seis horas en las células HeLa y a las dos horas en las células EA.hy926, y sugiriere que el estrés por hipoxia activa esta vía de señalización presuntamente mediante la fosforilación de la Y705 de la proteína STAT3, tanto en células tumorales como en el modelo endotelial en estudio.
Aunque en la proteína STAT3 se ha observado que la importación al núcleo puede ocurrir de manera independiente a la fosforilación de tirosinas en diferentes tipos celulares, mediante la importina alfa 3 sin estímulos externos 34, los resultados de este estudio demuestran que la translocación de STAT3 se ve afectada por el tipo de línea celular utilizado, pues se observó una mayor translocación en las células tumorales que en las endoteliales (p<0,05), y por el tipo de hipoxia, prevaleciendo la física sobre la química (p<0,05). Estos resultados indican que la hipoxia física fue un importante estímulo estresante en las dos líneas celulares en estudio, el cual indujo la fosforilación de la proteína STAT3 y su migración al núcleo.
En el estudio de Jung, et al.43, se reportó un incremento significativo de la fosforilación del residuo Y705 de la proteína STAT3 y su posterior translocación nuclear en células de carcinoma renal humano Caki-1, datos que apoyan los resultados obtenidos. En cuanto a la localización de la proteína en la hipoxia física y química, esta podría ser producto de diferencias en la interacción entre el HIF-1α y la STAT3 frente a los estímulos estresantes aplicados, o de la existencia de mecanismos de regulación de STAT3 en la hipoxia independientes de HIF-1 que estimulan su activación, lo cual deberá ampliarse en estudios posteriores.
En diversos estudios se ha evidenciado la importante relación existente entre HIF-1α y STAT3 44,45, pues la forma fosforilada de STAT3 se une de manera directa a HIF-1α y aumenta su estabilidad al impedir su unión a la proteína VHL, su posterior marcación con ubicuitina y su degradación 46. El mecanismo de acción del DFO, el agente quelante del hierro que se utilizó en este estudio como inductor de la hipoxia física, consiste en bloquear la degradación de HIF-1α inducida por la proteína VHL, con lo cual se provoca su acumulación y la imitación de la reacción celular producida bajo un ambiente de hipoxia 47, lo cual favorece, asimismo, la estabilidad del complejo HIF-1/STAT3 fosforilado.
Resultados recientes han demostrado que la inducción cooperativa de STAT3 y HIF-1 está funcionalmente asociada a la adquisición de resistencia tumoral bajo condiciones de hipoxia; de hecho, STAT3 trabaja de manera sinérgica con HIF-1 para activar y dirigir mediante la activación de genes blanco, el desarrollo del tumor dependiente de HIF-1 bajo condiciones de hipoxia, aunque también se ha demostrado que la STAT3 tiene una actividad independiente de HIF-1 en células en condiciones de normoxia e hipoxia 26. En estudios en los que se ha utilizado un inhibidor dual de HIF-1 y STAT3, derivado del perileno y conocido como TEL03, se ha demostrado su efecto sobre la expresión de oncogenes (entre ellos, Bcl-2, VEGF, Glut1) regulados por estas dos proteínas en células cancerosas, con lo cual induce la apoptosis en ellas 48.
Hay datos que sugieren que la STAT3 contribuye a la transformación maligna y a la progresión tumoral por transactivación de genes blanco involucrados en eventos críticos del desarrollo tumoral, incluidas la proliferación, la supervivencia, la propia renovación, la invasión y la angiogénesis 49. La proteína STAT3 parece tener un papel crítico en todos estos procesos en el cáncer de cuello uterino, ya que su inhibición puede reducir e inhibir la progresión tumoral en modelos in vivo e in vitro, mientras que su activación ha demostrado inhibir la apoptosis e inducir un fenotipo más agresivo mediante rutas de señalización específicas 15,50.
Más recientemente, se ha observado que la elevada concentración de especies reactivas de oxígeno (ROS) puede ser responsable de la activación de STAT3 en la hipoxia en células de glioblastoma, y una alternativa más a la hora de determinar los blancos terapéuticos contra el cáncer 51.
En este estudio, se corroboró la importancia de la hipoxia como un estímulo que modifica la activación de la proteína STAT3 en las células HeLa y EA.hy926, por lo cual constituye un factor importante que debe tenerse en cuenta en el diseño de estrategias terapéuticas contra el cáncer basadas en esta proteína. De igual forma, los resultados del estudio amplían la comprensión de la activación de STAT3 como reacción a estímulos estresantes del microambiente tumoral, lo cual podría constituir una estrategia más efectiva para el tratamiento del cáncer.














