La infección urinaria es la más frecuente en pacientes con diagnóstico de diabetes mellitus (1) y, hasta en 24 % de ellos, es posible detectar infecciones asintomáticas (2,3). La diabetes mellitus es un factor definitorio de las infecciones complicadas de las vías urinarias, con características como una mayor dificultad para el éxito de los tratamientos y, por ende, la necesidad de tratamientos prolongados, así como una mayor frecuencia de microorganismos resistentes (4), entre ellos, las enterobacterias positivas para betalactamasas de espectro extendido y productoras de carbapenemasas, así como bacterias resistentes a fluoroquinolonas (5).
La diabetes mellitus es un factor de riesgo importante para las complicaciones inusuales de las infecciones urinarias, como la cistitis enfisematosa, los abscesos renales, la necrosis papilar renal, la pielonefritis xantogranulomatosa y la enfisematosa, una condición con una mortalidad mayor de 40 % (6).
Los resultados de los exámenes microbiológicos evidencian que el microorganismo más común en pacientes diabéticos con infección urinaria es Escherichia coli, con 64 % (1), una frecuencia menor a la de la población general, en tanto que las infecciones causadas por Klebsiella pneumoniae son más comunes en los pacientes diabéticos que en la población general. Otros microorganismos involucrados son Proteus spp., Enterobacter spp. y estafilococos negativos para coagulasa. Los pacientes con diabetes mellitus presentan con mayor frecuencia infecciones de las vías urinarias causadas por bacterias inusuales, comoAcinetobacterspp. y estreptococos delgrupo B (6); además, dicha enfermedad es uno de los factores de riesgo principales para infecciones urinarias de origen fúngico, especialmente las causadas porCandida spp. (7).
Dada la gran morbilidad de dichas infecciones en los pacientes diabéticos, y las eventuales complicaciones que implican una mortalidad considerable, es necesario conocer el perfil de sensibilidad a los antimicrobianos para su manejo apropiado. En Colombia, sin embargo, la información sobre este grupo especial de pacientes es escasa y, por ello, el objetivo de este estudio fue determinar y caracterizar molecularmente los perfiles de sensibilidad a los agentes antimicrobianos comúnmente utilizados en el manejo de las infecciones urinarias adquiridas en la comunidad por pacientes diabéticos que consultaron en los servicios de urgencias de algunos hospitales de tercer nivel de atención de Colombia.
Materiales y métodos
Pacientes
En este estudio se analizó el subgrupo de pacientes diabéticos del proyecto de Leal, et al., hecho en pacientes adultos (8). Se trató de un estudio descriptivo a lo largo de 12 meses en nueve hospitales generales de tercer nivel de complejidad (dos públicos y siete privados) en tres ciudades de Colombia y en pacientes con infección de las vías urinarias adquirida en la comunidad, la mayoría de ellos admitidos por el servicio de urgencias.
Todos los pacientes incluidos en el estudio inicial eran adultos y para el presente análisis se seleccionaron todos los pacientes diabéticos con diagnóstico de infección urinaria adquirida en la comunidad en el momento de ingreso. La condición objeto del análisis se definió como la de aquellos pacientes cuyos síntomas hubieran iniciado, por lo menos, 48 horas antes de su ingreso al hospital, que no usaran sonda vesical permanente, no tuvieran antecedentesde procedimientos quirúrgicos de las vías urinarias en la semana previa, ni hospitalizaciones en los siete días anteriores. Como caso nuevo, se consideró la aparición de infección urinaria después de, por lo menos, un mes a partir del alta hospitalaria previa.
Los pacientes con diabetes mellitus incluidos en el estudio fueron aquellos que requirieron manejo hospitalario por orden médica, en cuyo aislamiento microbiológico se encontraran las enterobacterias E. coli, Klebsiella spp. o P. mirabilis.
Determinación de microorganismos y métodos microbiológicos
Con base en los diagnósticos de ingreso y el resultado de los aislamientos microbiológicos en cada uno de los hospitales, se hizo una búsquedaactiva de los pacientes. La información se obtuvo de manera directa o a partir de sus historias clínicas y se registró en un formato que incluía las variables de edad, sexo, enfermedades concomitantes, presencia previa de infección urinaria (uno o más episodios en los últimos tres meses), así como de síntomas, y antecedentes quirúrgicos, uso previo de antibióticos (en los últimos tres meses), y tipo y duración del tratamiento.
Todos los aislamientos de E. coli, Klebsiella spp. y P. mirabilisobtenidos de los urocultivos fueron enviados al Laboratorio de Microbiología de la Facultad deMedicina de la Universidad Nacional de Colombia, para confirmarmediante el método automatizado(BD Phoenix(tm), Estados Unidos) su identificación y sensibilidad a amoxicilina-ácido clavulánico, amika-cina, cefepima, cefazolina, cefotaxima, ceftazidima, ceftriaxona, ciprofloxacina, gentamicina, ertapenem, meropenem, imipenem, piperacilina-tazobactam, trimetoprim-sulfametoxazol y cefoxitina.
Se determinó la sensibilidad a ampicilina-sulbac-tam mediante difusión en agar y el gradiente de Etest(tm) (bioMèrieux, Francia). Se utilizó el método de doble disco para confirmar la presencia de betalactamasas de espectro extendido (BLEE), y, la prueba de Hodge, para la revalidación de la producción de carbapenemasas.
Como control de calidad de las pruebas de sensibilidad, se utilizaron las cepas de ATCC 25922 deE. coli, ATCC 27853 de Pseudomonas aeruginosa y ATCC 700603 de K. pneumoniae. Las pruebas de sensibilidad se hicieron según las recomendaciones de los fabricantes de los paneles (BD Phoenix(tm), Estados Unidos) y la interpretación de la concentración inhibitoria mínima se hizo siguiendo los estándares delClinical and Laboratory Standards Institute (CLSI), 2014 (9).
Para evaluar la presencia de los genesblaTEM, blaSHV y blaCTX-M, se empleó el método de PCR múltiple en los aislamientos productores de BLEE (10), y los aislamientos positivos para CTX-M se sometieron a una amplificaciónadicional para la detección de los grupos 1, 2, 8, 9 y 25 (11). Se utilizaron los siguientes iniciadores para la detección de betalactamasas AmpC de plásmidos en los aislamientos con fenotipo AmpC: MOX, CIT, DHA, ACC, EBC y FOX (12); y la presencia de los genes que codifican para carbapenemasas en los aislamientos con resistencia acarbapenémicos se detectó mediante PCR en los genesblaKPC, blaIMP, blaVIM (13) y blaNDM (14). Los productos de amplificación obtenidos fueron secuenciados y analizados con el programa BLAST.
El grupo filogenético (A, B1, B2 o D) se determinó mediantela amplificación de los geneschuA, yjaA y TspE4en los aislamientos deE. coliproductores de CTX-M-15, utilizando los iniciadores descritos por Clermont, et al. (15).Se seleccionaron los siguientes factores de virulencia para su detección: FimG/H, papC, usp, SfaD/sfaE, hly y cnf. Larelación genética de los aislamientos deE. colicon el clon ST131 se determinó siguiendo la metodología publicada por Dhanji, et al., (16) y se confirmó por secuenciación directa de los productos de amplificación.
La relación genética de los aislamientos deK. pneumoniaeproductores de KPC, CTX-M y SHV,se estableció mediante la amplificación de secuencias intergénicas de consenso repetitivas de entero-bacterias (Enterobacterial Repetitive Intergenic Consensus-PCR, ERIC-PCR) y las de E. coli productores de enzimas CTX-M, SHV y AmpC plasmídicas se hizo mediante la amplificación de secuencias repetidas (Repeated Element Sequence-based-PCR, rep-PCR) (17).
Los patrones electroforéticos obtenidos se analizaron con el programaFingerprinting II (Bio-Rad), y, para el análisis de agrupamientos, se usó el algoritmo UPGMA (Unweighted Pair-Group Method with Arithmetic Averages), con 1 % de optimización y de tolerancia; los aislamientos con más de 85 %de similitud se consideraron del mismo genotipo.
En cuanto a la determinación de la resistencia a quinolonas, sulfonamidasy tetraciclinas, se utilizó la PCR paradetectar la presencia de los genesqnrA, qnrB y qnrS; sul1, sul2 y sul3, y tetA, tetB y tetC, respectivamente.
Análisis estadístico
Se describieron las variables clínicas y microbiológicas; estas últimas se interpretaron como la proporción de aislamientos sensibles, intermedios o resistentes de acuerdo con las normas del CLSI de 2014. Los resultados se reportaron en valores absolutos y medidas de tendencia central.
Consideraciones éticas
Las nueve instituciones participantes aprobaron el protocolo de investigación. La confidencialidad de los pacientes se garantizó. No se requirió el consentimiento informado, ya que no hubo intervenciones, lo cual fue autorizado por todos los comités de investigación, con excepción del de la Clínica Universitaria Colombia, donde se obtuvo el consentimiento de todos los pacientes incluidos.
Resultados
Características de los pacientes
Se recolectaron 68 aislamientos de pacientes diabéticos, de los cuales 51 (75 %) eran mayores de 50 años, 11 (19 %) eran hombres y 57 (81 %) mujeres. El síntoma más común fue la disuria, informada por 41 (60,3 %) de los pacientes, seguido por la polaquiuria en 26 (38,2 %) casos. Los cambios macroscópicos de la orina referidos por los pacientes fueron: turbidez en 18 (26,5 %), fetidez en 14 (20,6 %), y hematuria en nueve (11,8 %).
La muestra se recolectó por micción espontánea en 40 (58,9 %) de los pacientes, con sonda vesical en 18 (26,5 %) y con cateterismo intermitente en nueve (13,2 %); 18 (26,5 %) pacientes refirieron, al menos, un episodio previo de infección urinaria en los tres meses anteriores, 12 (17,7 %) habían tenido un episodio, siete (10,9 %) dos, y dos (3 %), tres episodios.
El uso de antibióticos en los tres meses anteriores fue referido por 14 (20,6 %) pacientes. Se encontró que los pacientes usaban una amplia variedad de agentes antimicrobianos: cuatro (5,9 %) informaron el uso previo de una cefalosporina de primera generación y cuatro (5,9 %),de ciprofloxacina; los demás refirieron el uso de algún agente antimicrobiano diferente, como ceftriaxona, ampicilina-sulbactam, nitrofurantoína o gentamicina.
Sensibilidad antimicrobiana
La sensibilidad a los antibióticos de los aislamientos de E. coli yKlebsiella spp. se presenta en el cuadro 1. Se obtuvosolamente un aislamiento de P. mirabilis, el cual presentó resistencia a ampicilina-sulbactam, cefazolina, imipinem y nitroflurantoína, pero fue sensible a los demás antibióticos probados.
Resistencia a cefalosporinas de tercera generación
De los 58 aislamientos deE. coli, ocho (13,8 %) presentaron resistencia a cefalosporinas de tercera generación y, deestos, cuatro (6,9 %) expresaron BLEE y dos (3,4 %) de ellos pertenecían al grupo filogenético B2 y al clon ST131 y en ellos se detectaron las betalactamasas TEM-1 y CTM-X-15. En cuatro (6,9 %) aislamientos, se encontró el fenotipo AmpC, y tres de ellos produjeron las betalactama-sas TEM-1 y CMY-2. Todas las características de estosaislamientos se encuentran en el cuadro 2. Un aislamiento de K. pneumoniae expresó la carbapenemasa KPC-3 y la bectalactamasa TEM-1.
Cuadro 2 Características de los aislamientos de Escherichia coli resistentes a cefalosporinas de tercera generación
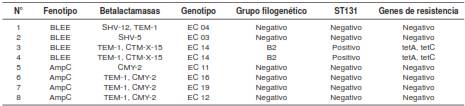
Dos aislamientos deE. coli demostraron sensibilidad intermedia a ertapenem, y, aunque no se detectaroncarbapenemasas, pertenecían al fenotipo AmpC y expresaron las betalactamasas TEM-1 y CMY-2.
Discusión
En este estudio se confirmó la aparición de cepas de enterobacterias productoras de BLEE y AmpC en aislamientos de pacientes diabéticos con infección urinaria adquirida en la comunidad. La presencia de tales microorganismos se consideraba un problema netamente hospitalario hasta hace muy poco tiempo. Otro hallazgo importante fue la detección de unaislamiento productor de carbapenemasas en estos pacientes; la resistencia a carbapenémicos también se consideraba una situaciónexclusiva de los hospitales. Estos resultados alertan sobre la importancia de este tipo de estudio en pacientes diabéticos, con el fin de propiciar el uso apropiado de antibióticos en el tratamiento de la infección urinaria adquirida en la comunidad.
La existencia de cepas resistentes a cefalosporinas de tercera generación fuera del ambiente hospitalario es una emergencia global, cuya causa se relaciona con la difusión deE. coli productora de CTX-M15, la cual se ha asociado con la resistencia a fluoroquinolonas (18). En este estudio, se encontraron dos cepas con esta característica, pertenecientes al grupo filogenético B2 del clon pandémico ST131, el cual circula en Colombia conjuntamente con el ST405 desde el 2010 (19,20). Las enzimasAmpC del tipo CMY, las BLEE de tipo TEM y las SHV, detectadas en cuatro (5,9 %), seis (8,8 %) y dos (2,9 %) aislamientos, respectivamente, se han descrito en estudios sobre la aparición de la resistencia a cefalosporinasde tercera generación (21), lo cual confirma la presencia de cepas productoras de una amplia variedad de enzimas responsables de este fenómeno en la comunidad. La tipificación delos aislamientos de E. coli que expresaron CMY-2 en este estudio no evidenció relación clonal, quizá por su carácteresporádico. No puede desconocerse, sin embargo, que este tipo de aislamientos se ha encontrado en estudios en animales (22).
La diseminación de cepas de K. pneumoniae productoras de carbapenemasas del tipo KPC en la comunidad es un problema mundial, especialmente la KPC-3, encontrada en un aislamiento en este estudio, lo que ratifica la presencia de cepas de este tipo en la comunidad en Colombia, en donde el primer reporte de un brote hospitalario causado por KPC-3 fue en el 2008 (23). Hasta el momento se tenía poca información sobre su presencia fuera de los hospitales, en los cuales la segunda carbapenemasa más frecuente es la KPC-2 (24). Es aún más escasa la documentación sobre el tema en el caso específico de los pacientes diabéticos, una población muy vulnerable frente a las bacterias con expresión de estas enzimas.
No se pudo encontrar información de estudios en Colombia y en el área andina sobre la sensibilidad de los microorganismos involucrados en las infecciones urinarias de origen comunitario en diabéticos. En África, Jha, et al., informaron de una resistencia a ceftriaxona de hasta 62,1 % en E. coli y de 46,4 %en K. pneumoniae en diabéticos con infección urinaria en un hospital de tercer nivel de atención, pero no especificaron el número de pacientes con infección adquirida en la comunidad (25). En Sudán, Hamdan, et al., en una muestra pequeña de pacientes con infección adquirida en la comunidad, documentaron la ausencia de resistencia a cefalosporinas de tercera generación, con cifras menores para otros antibióticos comparadas con las encontradas en este estudio; la resistencia a ampicilina enE. coli fue de 6 %, a amoxicilina-clavulonato, de 9 % y a nitroflurantoína, de 3 %; enK. pneumoniae la resistencia a cefalexina fue de 11,1 % y a ampicilinade 22,2 % (26). En Latinoamérica, González, et al., en aislamientos de E. coli en Cuba, encontraron una resistencia de 5,7 % a ceftriaxona, de 2,9 % a ceftazidima y de 11,4 % a cefuroxima, es decir, la mitad de la encontrada en el presente estudio; en aislamientos de K. pneumoniae la resistencia fue de 14,3 % para ceftriaxona y cefatizima y de28,6 % para cefuroxima, valores cercanos a los informados en este trabajo, en tanto que no se reportó ninguna resistencia a carbapenémicos (27).
Se han señalado diferentes factores de riesgo para la infección de vías urinarias adquirida en la comunidad y causada por cepas BLEE, como el sexo masculino, la edad mayor de 65 años, el uso previo de cefalosporinas de tercera generación y fluoroquinolonas, y la diabetes mellitus (28,29), enfermedad que también aumenta la probabilidad de pielonefritis aguda (30), por lo cual en los pacientes diagnosticados con la enfermedad debe sospecharse la infección de vías urinarias y la presencia de BLEE. En algunos estudios sobre los factores de riesgo de la presencia de bacterias resistentes a cefalosporinas de tercera generación en pacientes diabéticos con infección de las vías urinarias adquirida en la comunidad, estos no se evidenciaron, por lo cual es necesario seguir explorando el tema para establecer los factores determinantes; asimismo, debe sospecharse tempranamente este diagnóstico, con el fin de ofrecer el manejo apropiado.
Las cefalosporinas de primera generación, como la cefazolina, se utilizan a menudo en el tratamiento empírico de las infecciones de vías urinarias, lo cual explicaría la detección de una gran resistencia a este antibiótico en el presente estudio; sin embargo, todavía no son claros los valores de concentración inhibitoria mínima en pacientes con esta infección, pues los primeros trabajos que se hicieron son antiguos y este antibiótico se concentra bien en la orina, por lo que dichos resultados deben interpretarse con cautela.
En cuanto a las fluroquinolonas, en este estudio se registró un porcentaje de 32,8 de aislamientos de E. coli resistentes a ciprofloxacina y de 11,1 en el caso de K. pneumoniae, cifras menores a las encontradas por González, et al., quienes informaron una resistencia a la ciprofloxacina de 74,3 y 42,9 %, respectivamente (27); entre los factores de riesgo relacionados con este tipo de resistencia se encuentran la exposición previa a este grupo de antibióticos, ser mayor de 50 a 60 años y las anormalidades de las vías urinarias (31). Con respecto a la sensibilidad de E. colial trimetoprim-sulfametoxazol, otro de losantimicrobianos utilizado frecuentemente en pacientes con infección urinaria, se encontró resistencia en 44,8 % de los aislamientos, en tanto que en otros trabajos se ha reportado 57,1 % (27).
El diagnóstico oportuno de las infecciones urinarias causadaspor microorganismos resistentes previene diferentes complicaciones, como la bacteriemia, la cual tiene una incidencia mayor en pacientes con diabetes mellitus en comparación con quienes no lapadecen (26,8 Vs. 15,5 por cada 1.000 personas admitidas en hospitales, respectivamente) (32). De igual forma, la mortalidad, incluso fuera del hospital, es mayor en pacientes diabéticos con este tipo de infección que en los no diabéticos (riesgo relativo, RR=1,38; IC99% 1,23-1,55) (33). El uso empírico de antibióticos no indicados tiene un efecto preocupante en el aumento de la resistenciabacteriana, la mortalidad, la morbilidad, la duración de la hospitalización, el uso de antibióticos de amplio espectro y los costos hospitalarios (34). Es necesario hacer estudios para determinar los factores de riesgo relacionados con la resistencia a cefalosporinas de tercera generación y carbapenémicos en pacientes diabéticos con infección de vías urinarias adquirida en la comunidad, ya que esta es la más frecuente y tiene un alto índice de morbilidad y mortalidad en este grupo de pacientes (1).
Entre las limitaciones del estudio debe mencionarse que inicialmente no fue diseñado con el objetivo de estudiar la infección de vías urinarias de origen comunitario en pacientes diabéticos; además, la información corresponde solamente a tres ciudades deColombia, por lo cual no es posible generalizar los datos a todo el país. Asimismo, el número de muestras fue reducido, y, además, pudo haber sesgos en los antibióticos sometidos a la prueba de E-test para determinar los valores de la concentración inhibitoria mínima en lugar de usar los estándares establecidos por el CSLI.
En conclusión, los resultados de este trabajo llaman la atención sobre la circulación de cepas resistentes a cefalosporinas de tercera generación y productoras de carbapenemasas en las infecciones de las vías urinarias adquiridas en la comunidad en personas diabéticas, e informa sobre la sensibilidad a los antibióticos más utilizados para combatirlas. Asimismo, alerta sobre la necesidad de conocer los factores de riesgo adicionales de este tipo de infección en este grupo específico de pacientes, y la necesidad de la sospecha clínica tempranay el desarrollo de mecanismos que contribuyan a su prevención.















