La periodontitis es una enfermedad crónica que responde a múltiples factores y afecta los tejidos de soporte del diente, con un componente infeccioso importante (1) conformado por una biopelícula de diversas especies (2), lo que hace más complejo su control y tratamiento (3).
Al igual que otras infecciones crónicas, la periodontitis se ha relacionado con la enfermedad cardiovascular (4,5), la cual también se clasifica dentro de las enfermedades causadas por múltiples factores, o complejas, y comparte factores de riesgo como la obesidad, el consumo de tabaco, la diabetes, el estrés y el bajo nivel socioeconómico, entre otros (6); esto dificulta establecer una relación directa de causa y efecto entre las dos enfermedades.
Sin embargo, existen dos puntos importantes de conexión entre las dos. El primero tiene que ver con el microbioma periodontal (7), el cual está conformado principalmente por bacterias anaerobias Gram negativas organizadas en biopelículas, con capacidad de generar bacteriemias y migrar a otros tejidos (5,8,9), donde las toxinas y factores de virulencia, como el lipopolisacárido, dan lugar a un proceso de destrucción del tejido induciendo mecanismos de agregación plaquetaria y liberación de especies reactivas del oxígeno (7). Además, bacterias como Porphyromonas gingivalis pueden migrar a los grandes vasos utilizando los monocitos y los eritrocitos (10) y, una vez allí, sus mecanismos de virulencia inducen un proceso inflamatorio y la secreción de mediadores químicos relacionados con la formación de las placas ateromatosas (11).
El segundo punto tiene que ver con la inflamación (9), la cual es crónica en la periodontitis debido al estímulo sostenido del sistema inmunitario y su falta de acción efectiva frente a las bacterias inmersas en la biopelícula (12); ello hace que las citocinas proinflamatorias, liberadas por células fagocíticas hiperactivadas y poco reguladas, entren al torrente sanguíneo, generen una acción endocrina en el hígado e induzcan la secreción de proteínas de fase aguda, entre ellas, la proteína C reactiva (13,14); esta es una potente opsonina con actividad depuradora, así como marcador importante de la inflamación sistémica y el riesgo cardiovascular, principalmente por su capacidad de actuar en la célula endotelial e inducir la liberación y expresión de moléculas proinflamatorias y propiciadoras de la agregación plaquetaria (15,16).
En varios estudios con diferentes diseños epidemiológicos, se ha encontrado una asociación estadísticamente significativa entre estas dos enfermedades (17); sin embargo, el riesgo relativo de enfermedad cardiovascular en pacientes con enfermedad periodontal es bajo y puede atribuirse a varios factores de confusión que no se han tenido en cuenta en el diseño de los estudios o que han sido ajustados incorrectamente en el análisis estadístico (18).
La presencia de microrganismos patógenos en el periodonto constituye un reto para el tejido local y para el sistema inmunológico, pues predispone al desarrollo de enfermedades en los tejidos de los vasos (13) y las válvulas cardiacas (4).
El objetivo del presente estudio fue describir la microbiota periodontal cultivable de pacientes con enfermedad periodontal y enfermedad en las válvulas cardiacas, así como evaluar la presencia de microorganismos en las de aquellos sometidos a cirugía de reemplazo valvular en una clínica de Cali.
Materiales y métodos
Población y muestra
Se seleccionaron 30 pacientes con diagnóstico de enfermedad cardiovascular atendidos en el Centro Médico Imbanaco de Cali, Colombia, en espera de la cirugía de reemplazo valvular. Cabe resaltar que todos los pacientes incluidos en el estudio, avalado por el Comité de Ética en Investigación del Centro Médico Imbanaco mediante el Acta CEI-109, firmaron previamente el consentimiento informado.
Los pacientes eran mayores de edad, con cinco o más dientes en boca, y no habían recibido tratamiento periodontal o higiene dental profesional en los seis meses anteriores a su inclusión en el estudio.
Toma de muestras y examen clínico periodontal
Los sujetos de la muestra fueron atendidos en el Servicio de Odontología antes de ser sometidos a la cirugía cardiovascular, como parte del protocolo de ambientación de la cavidad oral. Se les hizo un examen clínico odontológico y sondaje periodontal de boca completa a cargo de odontólogos previamente estandarizados con un periodoncista, según los criterios diagnósticos de 1999 de la American Academy of Periodontology (AAP).
La estandarización fue evaluada con el índice kappa de concordancia y arrojó un valor de 87,4 %. Posteriormente, se tomó una muestra subgingival.
Los pacientes fueron diagnosticados por un periodoncista experto, quien analizó los periodontogramas, ajustándose a los criterios diagnósticos de la American Academy of Periodontology de 1999 (19). En el periodontograma, se incluyeron las variables clínicas de pérdida de inserción clínica, sangrado con el sondaje, profundidad en el sondaje y número de dientes perdidos.
Bajo aislamiento relativo del campo operatorio, las muestras se tomaron de las bolsas más profundas (>4 mm), en los pacientes con periodontitis, y del aspecto mesial vestibular de los cuatro primeros molares, en pacientes con gingivitis, utilizando puntas estériles de papel número 40 que se mantuvieron dentro del surco gingival durante un minuto. Posteriormente, se depositaron en un vial con el medio de transporte anaerobio VMGA III (Viability Medium Göteborg Agar) y se llevaron al laboratorio donde se cultivaron inmediatamente.
Cultivos microbiológicos de las muestras subgingivales
Se hicieron cultivos microbiológicos de las muestras subgingivales en agar TSBV y en agar brucella con suplemento de sangre de cordero al 5 %, hemina y menadiona. Para la identificación de P. gingivalis, Prevotella intermedia/nigrescens, P. melaninogenica, Tannerella forsythensis, Eikenella corrodens y Fusobacterium spp., se hicieron cinco diluciones en base 10 a partir del medio VMGA III, se sembraron 100 µl de las diluciones 10-3, 10-4 y 10-5 en agar brucella sangre enriquecido con hemina y menadiona, y se llevaron a incubación a 36 °C en atmósfera de anaerobiosis durante siete días.
Para la recuperación de Aggregatibacter actinomycetemcomitans se utilizaron cajas de agar TSBV incubadas en una atmósfera de CO2 al 5 % durante tres a cinco días.
Para el aislamiento de bacilos entéricos Gram negativos, se utilizó agar MacConkey, y se incubaron en una atmósfera aerobia a 37 °C durante 24 a 48 horas. Para su identificación, se utilizó el sistema comercial Crystal E/NF.
Después de la incubación, se calculó el número total de unidades formadoras de colonias por mililitro (UFC/ml) de cada muestra. El porcentaje relativo de recuperación de cada microorganismo se calculó a partir del total de UFC por mililitro (20).
Toma de muestras valvulares
Durante la cirugía de reemplazo valvular, el cirujano cardiovascular extrajo los especímenes de las válvulas cardiacas aórtica o mitral, y estos se sumergieron en una botella estéril con 50 ml de solución salina y se llevaron inmediatamente al laboratorio donde los explantes se cortaron en finos fragmentos de 1 mm, aproximadamente, en una cabina de flujo laminar en condiciones de esterilidad.
La mitad de la muestra se utilizó para el cultivo microbiológico de los tejidos y la otra mitad se almacenó a -70 °C en tubos Eppendorff rotulados para someterlos a la PCR. Una parte de la muestra de tejido cardiaco se homogeneizó en 4 ml de PBS estéril. A continuación, se adicionaron 2 ml del tejido homogeneizado a un medio bifásico Ruiz Castañeda con suplemento de hemina y menadiona; 1 ml se adicionó en caldo tripticasa de soya, también con suplemento de estos componentes; por último, volúmenes de 100 µl por superficie se sembraron por duplicado en agar TSVB y agar brucella enriquecido (sangre de cordero desfibrinada, hemina y menadiona).
El caldo tripticasa y el agar brucella se incubaron en anaerobiosis, en tanto que el medio Ruiz Castañeda se incubó en condiciones aerobias a 37 °C durante 14 días, y el TSVB, en una atmósfera de CO2 al 5 % durante tres a cinco días. A continuación, se extrajeron alícuotas de 100 µl de cada uno de los dos caldos, se cultivaron por duplicado en TSVB y se incubaron en una atmósfera de CO2 al 5 % durante tres a cinco días, y en agar brucella enriquecido incubado en anaerobiosis a 37 °C durante ocho a 14 días.
Identificación de microorganismos
La identificación de los microorganismos se hizo mediante la observación de características morfológicas con un esteromicroscopio Stemi 2000-C (Zeiss) y, posteriormente, se confirmó utilizando el estuche comercial para la identificación de microorganismos anaerobios RapID ANAII System (tm) (REMEL). Para la identificación de los aislamientos bacterianos obtenidos en los cultivos de tejido valvular, se utilizó la tinción de Gram, la prueba de la catalasa y el estuche comercial RapID ANAII System(tm) (REMEL).
Extracción de ADN de las muestras valvulares
Otra parte de la muestra valvular se utilizó para las pruebas de PCR. Se tomaron 15 mg de tejido previamente fragmentado en condiciones de esterilidad y se sometieron a digestión en solución tampón de digestión proteolítica (Tris HCL 1M, SDS al 20 %, EDTA 0,5M y proteinasa K 20 mg/ml) durante 18 horas a 56 °C.
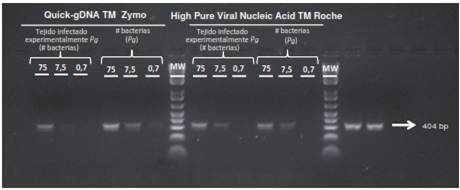
Posteriormente, se extrajo una alícuota y se procesó utilizando el estuche comercial de extracción y purificación de ADN High Pure Viral Nucleic Acid(tm) de Roche, previamente seleccionado y verificado mediante un ensayo de efectividad para la extracción de ADN a partir de un tejido infectado experimentalmente en diferentes concentraciones.
Para evaluar la extracción del ADN, se hizo una prueba de PCR para la detección del gen humano GADPH (figura 1).
Reacción en cadena de la polimerasa
La PCR convencional para la detección del ADN de bacterias periodontales en tejido cardiaco, se practicó en un termociclador Gene Amp PCR systems 9700 (tm) (Applied Biosystems) con el siguiente programa de amplificación: desnaturalización a 95 °C durante 2 minutos, seguida de 36 ciclos a 95 °C durante 30 segundos, a 60 °C durante 1 minuto, a 72 °C durante 1 minuto y una extensión final a 72 °C durante 2 minutos para la detección del ADN bacteriano de P. gingivalis, Tannerella forsythia, Treponema denticola, Campylobacter rectus y E. corrodens.
Para la detección de P. intermedia/nigrescens, A. actinomycetemcomitans y Dialister pneumosintes, se utilizó el siguiente programa: desnaturalización a 95 °C durante 2 minutos, seguida de 36 ciclos a 94 °C durante 30 segundos, a 55 °C durante 1 minuto, a 72 °C durante 2 minutos y una extensión final a 72 °C durante 10 minutos.
Se utilizaron los iniciadores de los ocho microorganismos periodontales patógenos previamente descritos (21), y controles positivos y negativos en cada ensayo. A todas las muestras se les hizo la detección de iniciadores ubicuos para comprobar la presencia de ADN bacteriano.
El producto de amplificación se visualizó en un gel de agarosa al 2 % (Ultrapure Agarose(tm) de Invitro- gen) con SyBRSafe (tm) (DNA gel stain de Invitrogen). Se utilizó un marcador de peso molecular de 100 pb (Invitrogen) para indicar el peso de la banda amplificada.
Análisis estadístico
El análisis estadístico se hizo con el programa estadístico Stata 12(tm) . Inicialmente, se hizo un análisis exploratorio con fines de control de calidad y se verificó la calidad de la información. Posteriormente, se hizo un análisis descriptivo de todas las variables y se construyeron las tablas de frecuencia.
Las variables categóricas se reportaron en frecuencias absolutas y porcentajes. Para las variables numéricas, se verificó la normalidad mediante la prueba de Shapiro-Wilk. Una vez validado este supuesto, se reportaron el promedio y la desviación estándar (DE), y en los otros casos, la mediana, así como el rango (R) o el rango intercuartílico (RI).
Para la comparación de las variables categóricas, se utilizó la prueba de ji al cuadrado o la prueba exacta de Fisher. Para las variables numéricas, se utilizó la prueba no paramétrica U de MannWhitney, ya que la distribución de los datos estaba sesgada. En estos análisis se consideró un valor de p<0,05 para establecer diferencias estadísticamente significativas.
Resultados
En el estudio participaron 30 sujetos (19 hombres y 11 mujeres) sometidos a cirugía cardiovascular para reemplazo de válvula cardiaca, con diagnóstico previo de enfermedad periodontal; su mediana de edad era de 60,5 años (RI=20-77). La mayoría de los sujetos dijeron no consumir alcohol (90 %) ni tabaco (80 %) o drogas alucinógenas (100 %).
Los siguientes eran sus antecedentes patológicos: hipertensión (43,3 %) e insuficiencia de la válvula aórtica (73,1 %) (cuadro 1).
Cuadro 1 Análisis descriptivo de las características sociodemográficas, hábitos de higiene oral, otros hábitos y antecedentes de los pacientes sometidos a cirugía cardiovascular para reemplazo de válvula cardiaca con diagnóstico previo de enfermedad periodontal (N=30)

Las variables clínicas periodontales fueron las siguientes: nivel de pérdida de inserción clínica con una variación entre 0,4 y 4,6 (mediana=1,3; RI=0,7-2,0); la profundidad en el sondaje varió entre 1,4 y 3,8 (mediana=1,9; RI=1,6-2,3); la mediana del número de dientes perdidos fue de 12,5 (RI=5-19) y la del sangrado en el sondaje fue de 7 (RI=2,8-10).
El diagnóstico periodontal más frecuente fue gingivitis (36,7 %), seguido de periodontitis crónica leve localizada (26,7 %), periodontitis crónica moderada localizada (26,7 %) y periodontitis crónica grave localizada (10 %) (cuadro 2).
Cuadro 2 Análisis de variables clínicas periodontales de pacientes sometidos a cirugía cardiovascular para reemplazo de válvula cardiaca con diagnóstico previo de enfermedad periodontal (N=30)

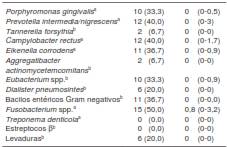
Los patógenos periodontales más frecuentes aislados a partir de las muestras de las bolsas periodontales, fueron Fusobacterium spp. (50 %), P. intermedia/nigrescens (40 %), C. rectus (40 %), E. corrodens (36,7 %), bacilos entéricos Gram negativos (36,7 %), P. gingivalis (33,3 %), y Eubacterium spp. (33,3 %) (cuadro 3).
Cuadro 3 Resultados de cultivos orales de los pacientes con diagnóstico previo de enfermedad periodontal sometidos a cirugía cardiovascular para reemplazo de válvula cardiaca (N=30)
a Prueba de ji al cuadrado
b Prueba exacta de Fisher
Es importante mencionar que los sitios de donde se tomaron las muestras mostraron signos inflamatorios, sangrado en el sondaje, y alteración en la arquitectura y morfología del tejido, así como una mayor profundidad en el sondaje o pérdida de inserción clínica.
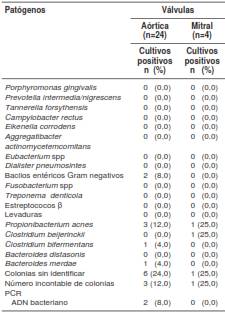
Los agentes patógenos aislados de la válvula cardiaca aórtica fueron principalmente colonias que no fue posible identificar mediante los métodos microbiológicos clásicos (24 %), seguidas de Propionibacterium acnes (12 %), bacilos entéricos Gram negativos (8 %), Bacteroides merdae (4 %) y Clostridium bifermentans (4 %) . En tres válvulas (12 %), se encontró un número incontable de colonias.
Se aislaron agentes patógenos de la válvula cardiaca mitral solo en cuatro pacientes. En uno de los aislamientos se hallaron colonias inidentificables mediante los métodos microbiológicos clásicos, así como una caja con un número incontable de colonias (cuadro 4).
Cuadro 4 Resultados de los cultivos y la PCR de las válvulas cardiacas aórtica y mitral de los pacientes con diagnóstico previo de enfermedad periodontal sometidos a cirugía cardiovascularpara reemplazo de válvula cardiaca
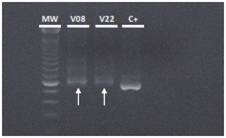
El proceso de extracción del ADN de las válvulas cardiacas se comprobó mediante la detección molecular de un gen conservado humano (GADPH) en todas las muestras procesadas (figura 1). Después de verificar la correcta extracción del ADN, se hicieron las pruebas de PCR para cada muestra, inicialmente, con los iniciadores específicos estandarizados en el laboratorio para cada microorganismo patógeno periodontal, pero dados los resultados negativos, se usaron iniciadores ubicuos con los cuales se detectó ADN bacteriano en la válvula #22 y en la #8 (figura 2).
Discusión
Las enfermedades periodontales, como la gingivitis y la periodontitis crónica, condiciones halladas en el grupo de pacientes incluido en el presente estudio, son inflamaciones compatibles con las infecciones inducidas por microorganismos periodontales patógenos como los identificados mediante el cultivo de las muestras subgingivales mencionados en la sección de resultados, y reportados también por otros autores en estudios previos (22), incluso en la población colombiana (23-25).
Estas infecciones crónicas por microrganismos organizados en biopelículas subgingivales (2,3) constituyen un desafío constante para los pacientes, pues alteran la homeostasis (1) oral y de otros sistemas (13).
En los participantes del estudio se presentaron antecedentes clínicos patológicos (cuadro 1) que podían aumentar la gravedad de la enfermedad periodontal. Además, la infección crónica y la inflamación del periodonto, sumadas a factores como la dieta, el sedentarismo y otros, estimulan el desarrollo y la complicación de condiciones como la diabetes (26,27) y la hipertensión (28), las cuales se contaban entre las condiciones más frecuentes en este grupo de pacientes.
Por otro lado, 73,1 % de los pacientes presentaba insuficiencia de la válvula aórtica, para lo cual la presencia de microorganismos en la cavidad oral es un riesgo que pone en peligro la vida, ya que el cepillado, el uso de seda dental y la masticación facilitan su entrada en la circulación (29) y su migración a diferentes tejidos (13), entre ellos, los vasculares (9,11), incluidos los de las válvulas cardiacas (30). Esto puede aumentar la gravedad de la enfermedad y mantener el estado proinflamatorio. Sin embargo, la mayoría de estudios sobre la presencia de microorganismos periodontales patógenos en muestras cardiovasculares, se ha realizado en ateromas (9,11,31-33),y en los estudios relacionados con válvulas cardiacas, se han reportado principalmente patógenos como Streptococcus mutans (34).
En el presente estudio, se analizaron los especímenes obtenidos de las válvulas aórtica y mitral de pacientes en condiciones asépticas durante la cirugía de reemplazo de válvulas. En los cultivos de tejidos de válvula aórtica se encontraron P. acnes (12 %), bacilos entéricos Gram negativos (8 %), Parabacteroides merdae (4 %) y C. bifermentans (4 %). En los tejidos de válvula mitral se hallaron P.acnes y C. beijerinckii solo en dos pacientes.
Propionibacterium acnes es una bacteria pleomorfa, anaerobia, Gram positiva, que forma parte de la microbiota de la cavidad oral, el intestino, la conjuntiva, el conducto auricular externo y la piel (35-37). La colonización de este microorganismo en tejidos valvulares puede ocurrir durante procedimientos quirúrgicos que facilitan la diseminación desde la piel (38). Esta bacteria tiene la habilidad de formar biopelículas, lo que aumenta su resistencia a diferentes tipos de antimicrobianos, incluso aquellos que se administran antes del procedimiento quirúrgico (39). El hallazgo de este microrganismo en los cultivos de las muestras de válvulas de los participantes en el estudio, bien puede asociarse a su migración mediante los mecanismos mencionados anteriormente, o bien por la contaminación durante la intervención quirúrgica o después de ella. Debe tenerse en cuenta que la endocarditis infecciosa no siempre es la causa de la insuficiencia valvular.
Clostridium bifermentans es un microorganismo que hace parte de la flora intestinal (40), al igual que los bacilos entéricos Gram negativos pertenecientes a la familia Enterobacteriaceae. Se encuentran en todo el tubo digestivo, incluida la cavidad oral de pacientes con periodontitis (22-24), y su colonización posiblemente se facilita por el uso de antimicrobianos locales o sistémicos que alteran la microflora oral. Esto complica el tratamiento, ya que son muy resistentes a los antibióticos utilizados en el tratamiento convencional, además de propiciar las complicaciones sistémicas por su capacidad de entrar en el torrente sanguíneo y migrar a otros tejidos (41).
Su hallazgo en el surco gingival (36,7 %) y en las válvulas (8 %) de los sujetos participantes en este estudio, sugeriría una posible diseminación al endocardio, sobre todo teniendo en cuenta que las muestras orales de los sujetos cuyas válvulas resultaron positivas también fueron positivas para estos bacilos. Sin embargo, es necesario hacer estudios filogenéticos que permitan identificar si estas bacterias están relacionadas y, así, confirmar la hipótesis.
Parabacteroides merdae y C. beijerinckii son bacterias anaerobias aisladas más frecuentemente de heridas contaminadas (42-44) y su hallazgo en las muestras podría deberse a contaminación secundaria.
El tejido de las válvulas también se analizó mediante PCR convencional y no se encontró ADN de bacterias periodontales patógenas, aunque sí se detectó ADN bacteriano en dos de las muestras, lo que podría contradecir los resultados obtenidos en cultivo y en las pruebas moleculares de detección de organismos periodontales patógenos a partir de explantes de ateromas y válvulas cardiacas reportados por Nakano, et al. (30), en Japón en el 2016.
Estos autores detectaron ADN de dichos organismos en 35 válvulas cardiacas mediante análisis de secuenciación (34) y en 2007 detectaron ADN de A. actinomycetemcomitans en tejido valvular mediante PCR convencional (33); en tanto que en 2009 detectaron ADN de estreptococos orales, de A.actinomycetemcomitans y de otros microorganismos periodontales patógenos, como P. gingivalis, P. intermedia/nigrescens, T.denticola, Tannerella forsithya y C. rectus, en bajas proporciones utilizando también PCR convencional (30).
Sin embargo, otros autores como Cairo, et al., reportaron resultados negativos en la detección del ADN de bacterias periodontales mediante PCR, a pesar de que los pacientes presentaban enfermedadperiodontal (45). Radwan, et al., por su parte, evaluaron mediante PCR convencional la capacidad de P. gingivalis para colonizar válvulas cardiacas en una muestra de 30 sujetos con enfermedad periodontal, en 15 de los cuales se detectó ADN de P. gingivalis en bolsas periodontales, pero no en el tejido valvular analizado (46).
Es importante tener en cuenta que la extracción del ADN bacteriano de tejidos es compleja, y que los métodos utilizados para la detección de los microorganismos pueden no ser lo suficientemente sensibles, aunque en el caso de este estudio se constató la veracidad de los resultados y hubo un seguimiento riguroso de la metodología con sus respectivos controles, según se describe en la sección de resultados. La manipulación de la muestra fue supremamente cuidadosa y se mantuvieron las condiciones de esterilidad desde la salida del quirófano hasta el laboratorio. Si bien es cierto que la detección de patógenos en el tejido valvular mediante cultivo microbiológico puede atribuirse a contaminación secundaria, la detección del ADN bacteriano mediante PCR también resultó positiva, lo cual puede deberse a limitaciones de la prueba o de los métodos de extracción del ADN en términos de sensibilidad analítica.
Se recomienda, para futuros estudios, hacer un análisis completo de secuenciación en el tejido de las válvulas o un análisis del metagenoma, con el fin de determinar la presencia o ausencia de ADN bacteriano. Las pruebas filogenéticas para determinar si los patógenos encontrados en las bolsas subgingivales se correlacionan con aquellos aislados de válvulas cardiacas, también pueden ser de utilidad para determinar su posible migración a los tejidos cardiovasculares desde la cavidad oral. Estos estudios aportarían mucho desde el punto de vista clínico, ya que permitirían evaluar la eficacia de los protocolos farmacológicos en los pacientes sometidos a cirugías de reemplazo valvular, así como el cumplimiento riguroso de protocolos de profilaxis antibiótica y de desinfección por parte de odontólogos y periodoncistas en pacientes con antecedentes o factores de riesgo cardiovascular.
En conclusión, la microbiota periodontal de los pacientes sometidos a cirugía de reemplazo valvular que conformaron la muestra de este estudio, estaba conformada por especies Gram negativas organizadas en biopelículas, las cuales inducen estados proinflamatorios y tienen efecto en la condición cardiovascular. Aunque dichas especies, además, tienen la capacidad de migrar a tejidos extraorales, los resultados no evidenciaron una asociación entre los microorganismos periodontales patógenos y el desarrollo de enfermedad valvular; y, si bien algunos cultivos de tejido valvular y de muestras subgingivales fueron positivos para bacilos entéricos Gram-negativos, no es posible asegurar que correspondían a la misma especie u origen filogenético.
Existe la probabilidad de que la presencia de otros microorganismos, como P. acnés, P. merdae, C. beijerinckii y C. bifermentans, se deba a la contaminación en el proceso de extracción y manipulación de las muestras durante los procedimientos quirúrgicos.
Se requieren más estudios que permitan confirmar el papel de este tipo de microrganismos en la enfermedad valvular.