La toxoplasmosis es una parasitosis frecuente, causada por el parásito intracelular obligado Toxoplasma gondii, la cual puede comprometer el sistema nervioso central, el oído y el ojo 1. Su prevalencia es mayor en los países del trópico, como Colombia, donde la seropositividad alcanza el 65 % y se han detectado lesiones inactivas en retina en 6 % de la población 2.
La infección puede adquirirse por la ingestión de ooquistes excretados en las heces de los gatos, por la de quistes que sobreviven en la carne cruda o mal cocida, o por transmisión vertical cuando hay infección materna durante la gestación 3,4. La forma infecciosa, el taquizoíto, puede atravesar la placenta 5,6. La primoinfección materna, especialmente durante el tercer trimestre, se ha asociado con tasas de transmisión vertical superiores a 50 % 6.
En el departamento del Quindío en Colombia se ha reportado una frecuencia 0,6 % de toxoplasmosis congénita y de 36 % de compromiso ocular, en niños infectados durante la gestación 7Las secuelas oftalmológicas y sistémicas de la toxoplasmosis tienen un impacto importante en la salud pública a nivel mundial 1,6.
Uno de los fármacos que se han utilizado para el tratamiento durante el embarazo es la espiramicina, puesto que alcanza concentraciones altas en la placenta, pero no en el líquido amniótico, y su uso es seguro para el feto. Los estudios en que se han evaluado la efectividad y la seguridad de la espiramicina han sido, en su mayoría, de tipo observacional, por lo que sus resultados son difíciles de interpretar o comparar 8.
En el presente estudio, se evaluó el riesgo diferencial para desarrollar toxoplasmosis ocular en una serie de casos de recién nacidos de madres tratadas y no tratadas durante el embarazo.
Materiales y métodos
Se revisaron los registros médicos de los neonatos evaluados en el Servicio de Retinología de la Clínica Universitaria Bolivariana de Medellín, una institución de tercer nivel de complejidad con énfasis en la atención materno-infantil, con 187 camas y tres unidades de atención neonatal especializada.
Los pacientes fueron evaluados en el momento del nacimiento, como parte del protocolo institucional o cuando lo solicitó el Servicio de Neonatología (sospecha clínica, antecedente de madre tratada o presencia de anticuerpos positivos para toxoplasmosis en el neonato). El seguimiento se hizo entre el primero de agosto de 2011 y el 31 de agosto de 2014.
Se incluyeron en el estudio aquellos pacientes cuyas madres tuvieron diagnóstico de toxoplasmosis confirmada serológicamente mediante anticuerpos IgG e IgM durante el embarazo, y aquellos en quienes se hizo diagnóstico clínico o serológico durante el período neonatal.
Las variables estudiadas incluyeron el momento del diagnóstico, la presencia o ausencia de tratamiento y los hallazgos en el examen de fondo de ojo bajo dilatación. El compromiso oftalmológico atribuible a la toxoplasmosis fue evaluado por un especialista en retinología y se definió como la presencia de sinequias posteriores, catarata, vitreítis o lesiones coriorretinianas activas o inactivas en la mácula o la periferia. Se tuvieron en cuenta, además, el peso al nacer, la edad de gestación en el momento del diagnóstico, la presencia de enfermedades concomitantes y los hallazgos en el sistema nervioso central mediante imágenes en el recién nacido. Dependiendo de la edad de gestación en el momento del diagnóstico, en algunos pacientes se utilizó, además, el test de avidez. Es importante aclarar que en ningún caso se practicó amniocentesis para confirmar la infección.
Dado el diseño observacional retrospectivo del estudio, una de sus limitaciones fue que resultó imposible establecer con exactitud el trimestre de adquisición de la infección en algunos pacientes y no se contó con datos de seroconversión.
Todos los datos se tabularon en una base de datos en Microsoft Excel 2011®. En el análisis estadístico, las variables categóricas se expresaron en frecuencias absolutas y relativas, y las variables continuas, en medianas y rangos intercuartílicos. Se estimó la razón de momios (odds ratio, OR) de presentar toxoplasmosis ocular congénita entre los hijos de las madres que recibieron tratamiento durante la gestación y las que no lo recibieron, mediante el programa Epi-Info, versión 6.04, con su respectivo intervalo de confianza (IC) de 95 % y el valor de p de la prueba exacta de Fischer.
Resultados
Durante los tres años de seguimiento, se incluyeron en el estudio 25 neonatos, pero los datos de dos de ellos estaban incompletos, por lo cual fueron excluidos. Veintiún pacientes nacieron de madres con diagnóstico de toxoplasmosis confirmado por serología durante el embarazo; la edad de gestación promedio en el momento del diagnóstico fue de 22 semanas (rango de 4 a 32); en dos casos el diagnóstico se hizo en el momento del parto.
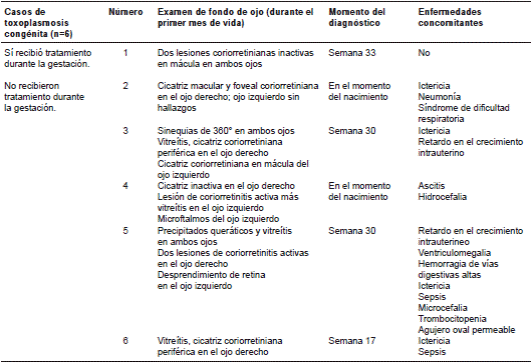
Quince (65 %) pacientes recibieron tratamiento con 3 g al día de espiramicina desde el momento del diagnóstico hasta el final del embarazo. Se encontraron 6 (26 %) casos de toxoplasmosis ocular (cuadro 1), uno (6,6 %) en el grupo que había recibido tratamiento y 5 (62,5 %) en el grupo de quienes no recibieron tratamiento, con una OR para presentar toxoplasmosis ocular congénita de 0,04 (IC95% 0-0,67) y un valor de p en la prueba exacta de Fisher de 0 (cuadro 2).
Cuadro 1 Hallazgos oftalmológicos, enfermedades concomitantes y tiempo de diagnóstico de casos de toxoplasmosis congénita
Cuadro 2 Relación del tratamiento con espiramicina durante la gestación y los hallazgos de toxoplasmosis ocular en el neonato

La mediana del peso de los 12 niños evaluados fue de 2.390 gramos (rango intercuartílico: 2.010 a 3.090 g).
En 14 neonatos se hizo serología para T. gondii, y solo uno (7 %) de ellos presentó un valor positivo de inmunoglobulina M. Este paciente presentó, además, compromiso ocular bilateral grave, con coriorretinitis en un ojo y desprendimiento de retina en el otro. Dos de los 14 (14 %) pacientes evaluados presentaron compromiso del sistema nervioso central asociado a la toxoplasmosis. Los hallazgos incluyeron calcificaciones ependimarias y en los ganglios basales, y en un caso, hidrocefalia secundaria. Ambos pacientes, cuyas madres no recibieron tratamiento durante la gestación y tuvieron un diagnóstico tardío, presentaron toxoplasmosis ocular.
Discusión
La infección por T. gondii es una parasitosis frecuente en el ser humano. El compromiso ocular en la forma congénita es usual y las complicaciones se manifiestan a lo largo de la vida 1,9,10. Aunque se desconoce su prevalencia exacta, se sabe que está ligada a algunos hábitos propios de la población, especialmente el consumo de carne o agua sin tratar 11,12, aunque también influyen otros factores socioeconómicos y las cepas circulantes del parásito 12. Se sabe que es más frecuente en Suramérica, en el Caribe y en el áfrica tropical, y que las cepas circulantes en Suramérica son más agresivas 12. En muchos países, la retinocoroiditis por toxoplasma es la forma más común de uveítis posterior 3. A principios de los años 90, en Estados Unidos se estimó una prevalencia de anticuerpos IgG anti-T.gondii en mujeres embarazadas de 22,5 %, en tanto que en París (67,3 %) y en Ibadan (Nigeria) (78 %) fue mucho más alta 13. En un estudio en el sur de Brasil se informaron seroprevalencias en niños de 10 a 15 años de hasta 98 % 14.
La prevalencia de toxoplasmosis congénita es también difícil de estimar. Entre 2009 y 2010, Gómez-Marín, et al., recogieron muestras de cordón umbilical en 19 centros hospitalarios de Colombia, 61 (0,39 %) de las cuales fueron positivas para IgM y nueve (0,5 %) para IgA 15. En cuanto a los datos sobre la seroprevalencia durante la gestación en nuestro medio, se cuenta con los del estudio de Rosso, et al., quienes evaluaron 955 mujeres gestantes en quienes encontraron una seroprevalencia de IgG de 45,8 % y de IgM de 2,8 % 16. En el estudio se evidenció, además, que la prevalencia aumentaba con la edad y en los estratos sociales menos favorecidos 16. En un estudio brasileño, la tasa de transmisión vertical en mujeres gestantes con riesgo de toxoplasmosis fue de 5,5 % 8.
Dada la alta prevalencia, la agresividad de las cepas locales y el impacto en la salud de los recién nacidos, resulta pertinente la implementación de programas de tamización en los recién nacidos de nuestro país, especialmente porque la mayoría de los casos pueden ser asintomáticos 17. El tratamiento adecuado depende de un diagnóstico acertado y precoz 18. Sin embargo, existe controversia sobre el beneficio de los programas de tamización para la toxoplasmosis congénita en los recién nacidos, sobre todo en países con menor incidencia, pues no se ha podido confirmar suficientemente el beneficio del tratamiento 6,19-23. En países como Canadá, no se aconseja la evaluación de las mujeres asintomáticas con bajo riesgo.
En cuanto al tratamiento, a pesar de que no hay datos provenientes de estudios de asignación aleatoria, algunos grupos están a favor según la gravedad del caso y su epidemiología particular, sobre todo en países con alta incidencia 1,6,20,21,23,24. Quienes defienden la necesidad del tratamiento aducen las complicaciones oculares y sistémicas propias de la enfermedad y se basan en los numerosos reportes observacionales que sugieren que el tratamiento es efectivo.
Avelino, et al., evaluaron una cohorte prospectiva de 246 recién nacidos en Goiânia, Brasil, y encontraron que el riesgo de transmisión era menor en las pacientes tratadas con espiramicina, en tanto que el riesgo de presentar complicaciones neurológicas fue mayor en las no tratadas. Encontraron, además, que la presencia de IgM fetal o IgA en el recién nacido era un factor de riesgo para el mal pronóstico 8. Cortina-Borja, et al., publicaron en el 2010 los resultados de un estudio multicéntrico europeo que incluyó 293 niños a quienes se les hizo seguimiento durante cuatro años; encontraron que el tratamiento prenatal con espiramicina o sulfonamida y pirimetamina redujo el riesgo de secuelas neurológicas graves (incluido el compromiso ocular) 25. Valentini, et al., trataron a 76 madres infectadas con una mezcla de espiramicina, clotrimazol y ácido folínico, y la tasa de transmisión fue tan solo de 2,6 %, y no hubo reacciones secundarias que obligaran a la suspensión del medicamento 26.
La Guía de Atención Integral Basada en la Evidencia del Ministerio de Salud y Protección Social de Colombia y la Guía de Práctica Clínica de la Asociación Colombiana de Infectología recomiendan el tratamiento farmacológico con espiramicina (3 g/día) para la infección confirmada por toxoplasma en la mujer gestante 27,28. Estos y otros reportes sugieren que el tratamiento prenatal es una herramienta útil para disminuir la transmisión de madre a hijo y prevenir complicaciones.
Por otro lado, quienes no aprueban el tratamiento argumentan que no existe evidencia científica sólida que respalde su utilidad. Se trata, sobre todo, de autores europeos o norteamericanos, en cuyos países la epidemiología es diferente a la de los países latinoamericanos. En evaluaciones retrospectivas, como la del grupo de estudio SYROCOT(Systematic Review on Congenital Toxoplasmosis), en la cual se resumió la evidencia de 26 estudios observacionales de cohorte, no se encontró evidencia de que el tratamiento prenatal redujera las manifestaciones clínicas en 550 pacientes tratadas (OR=1,11; IC95% 0,61-2,02), pero sí se reducía la transmisión materno-fetal cuando el tratamiento se iniciaba tres semanas después de la seroconversión, comparado con el iniciado ocho semanas más tarde, o más (OR=0,48; IC95% 0,28-0,80) (p=0,05) 29.
Este estudio constituye un nuevo aporte a la discusión sobre el tratamiento con espiramicina de la toxoplasmosis de la gestación. Los resultados sugieren su efecto protector contra la toxoplasmosis ocular congénita, aunque se requieren estudios de tipo experimental que puedan comprobar dicho beneficio. Por otro lado, se encontró que el compromiso más grave se presentó en niños en quienes el diagnóstico no se pudo hacer durante el período de gestación.
Dado que la epidemiología local es diferente a la de otras latitudes y que la toxoplasmosis congénita es una enfermedad frecuente, detectable y tratable, pero con secuelas graves, es muy importante implementar programas de tamización para el diagnóstico precoz y el tratamiento oportuno, con lo cual se evitarían las complicaciones y secuelas graves en neonatos.














