Dado su poderoso efecto antiinflamatorio, el tratamiento posnatal con corticoides se utilizó ampliamente en la década de los 90 para facilitar la ‘extubación’ y reducir la incidencia de displasia broncopulmonar. Sin embargo, su uso se ha asociado en diversos estudios con efectos adversos a corto y largo plazo, como hipertensión arterial sistémica, hiperglucemia, retraso en el crecimiento, perforación intestinal, hemorragia digestiva, cardiomiopatía hipertrófica, infección y alteraciones en el neurodesarrollo 1-3. Por ello, en el 2002, la Canadian Paediatric Society y la American Academy of Pediatrics recomendaron evitar el uso rutinario de corticoides para la prevención y el tratamiento de la displasia pulmonar 4-8.
Se ha estudiado por separado el efecto de los corticoides en la primera semana de vida y después. Actualmente, el tratamiento precoz (≤7 días de vida) con dexametasona e hidrocortisona no se recomienda para la prevención de la displasia broncopulmonar, ya que los beneficios de este tratamiento no superan los efectos adversos a corto y largo plazo 9-11. Por otra parte, el uso tardío de la dexametasona (>7 días) se reserva solamente para aquellos casos en los que no es posible la suspensión de la asistencia respiratoria mecánica, ocasiones en las que se utiliza siempre la menor dosis durante el menor tiempo posible 12.
Desde que en 1972 se introdujo el uso de corticoides en el periodo prenatal, este se ha asociado con una reducción del riesgo de síndrome de dificultad respiratoria, mortalidad, hemorragia intraventricular, conducto arterial persistente, enterocolitis necrosante y, probablemente, retinopatía del prematuro 13. Con base en la evidencia acumulada, desde 1994 los National Institutes of Health de los Estados Unidos recomiendan la administración de corticoides en el periodo prenatal para todas las pacientes con riesgo de parto prematuro antes de las 34 semanas de gestación. A pesar de ello, algunos autores opinan que no existe suficiente evidencia para recomendar el uso de una o dos dosis de betametasona o dexametasona, o de un esquema único o múltiple. Además, tampoco existe certeza sobre el intervalo óptimo entre las dosis y se desconocen los efectos adversos que el tratamiento pueda tener a largo plazo en el neonato 14.
El objetivo del presente estudio fue analizar el resultado del tratamiento con corticoides en el neurodesarrollo durante los dos primeros años de edad corregida en una cohorte de recién nacidos de muy bajo peso tratados con dichos medicamentos durante el periodo prenatal o el posnatal.
Materiales y métodos
Pacientes
Se llevó a cabo un estudio prospectivo en el que se incluyeron todos los recién nacidos prematuros con un peso en el momento del nacimiento de menos de 1.500 g, hospitalizados en la unidad de cuidados intensivos neonatales del Hospital Clínico San Cecilio de Granada (de tercer nivel), entre el 1° de enero de 2008 y el 31 de diciembre de 2013. Los criterios de exclusión fueron: malformación mayor detectable en el feto o el recién nacido, síndrome genético o alteraciones metabólicas.
Definiciones y variables
Factores perinatales. Se registraron las siguientes variables: edad de la madre, peso al nacer, edad de gestación, categoría de “pequeño para la edad de gestación”, establecida según los parámetros del Estudio Transversal Español de Crecimiento 15, número de días de respiración mecánica invasiva, número de días de administración de oxígeno y de presión positiva continua, corioamnionitis, uso de surfactante, sepsis precoz o tardía, displasia broncopulmonar (establecida según los criterios diagnósticos descritos por Jobe, et al., enel 2001 y validados por la definición de consenso de los National Institutes of Health) 16, grado de retinopatía del prematuro, presencia de conducto arterial persistente, grado de hemorragia intraventricular, leucomalacia periventricular y enterocolitis necrosante.
Corticoides en el periodo prenatal. El esquema utilizado en el hospital consiste en la administración por vía intramuscular de dos dosis de 12 mg de betametasona a la madre, separadas por un intervalo de 24 horas (esquema completo), o 48 a 72 horas antes del parto en mujeres embarazadas de 24 a 34 semanas en quienes se considere probable el parto en el plazo de una semana.
Corticoides en el periodo posnatal. Se usó dexametasona intravenosa en aquellos pacientes con displasia broncopulmonar establecida después de la primera semana de vida, pero más cerca de los 21 días de vida que de la semana, y en quienes no era posible suspender la respiración mecánica, en dosis de 0,075 mg/kg cada 12 horas durante tres días, la cual se redujo progresivamente (0,05 mg/kg cada12 horas durante tres días; 0,025 mg/kg cada 12 horas durante dos días, y 0,01mg/kg cada 12 horas durante dos días) hasta completar 10 días de tratamiento 17. En ningún caso se administraron corticoides inhalados u otro tipo diferente a la dexametasona.
Seguimiento neurológico. Se llevó a cabo en la unidad de atención temprana, a cargo de un equipo compuesto por un neonatólogo, un neuropediatra, un psicólogo, un fisioterapeuta y un trabajador social. Los controles se hicieron a los 2, 6, 9, 12, 18 y 24 meses de edad corregida. Se analizaron las siguientes variables: trastorno motor (trastorno neuromotor leve, diparesia, hemiparesia y tetraparesia); trastorno sensorial auditivo (sordera neurosensorial); trastorno sensorial visual (miopía, pérdida de visión o estrabismo); deficiencia múltiple (deficiencia intelectual profunda asociada a alteraciones motoras más o menos graves o a alteraciones sensoriales o del comportamiento); trastorno de la conducta (autismo o espectro autista) y retraso psicomotor o cognitivo (inmadurez o retraso en el desarrollo, leve, moderado o grave).
Análisis estadístico
Para el análisis estadístico se usó la versión 15.0 del programa SPSS®. Tras realizar el análisis descriptivo de las variables del estudio, se utilizó la prueba t de Student para las variables cuantitativas y el test de ji al cuadrado para las cualitativas. Mediante el análisis de regresión logística multinomial se evaluó la asociación entre las alteraciones en el neurodesarrollo y el uso de corticoides durante el periodo prenatal o el posnatal (variables independientes). Como variables de ajuste, se utilizaron las variables clínicas que, a priori, podían tener más repercusión en los resultados neurológicos del recién nacido (sepsis, conducto arterial persistente, edad de gestación y categoría de “pequeño para la edad de gestación”). Los resultados se expresaron mediante el odds ratio (OR) con su correspondiente intervalo de confianza (IC) del 95 %. Se consideró estadísticamente significativo el valor de p<0,05.
Resultados
Características de los pacientes y tratamiento con corticoides
Durante el periodo de estudio, ingresaron en la unidad de cuidados intensivos neonatales 237 niños prematuros con peso menor o igual a 1.500 g en el momento del nacimiento. Solo hubo un caso de síndrome genético (secuencia de Potter) y no se detectó en este grupo de recién nacidos ninguna alteración metabólica ni malformación grave.
No se obtuvo el consentimiento informado de los padres de 11 de los pacientes, por lo cual el número final de sujetos estudiados, tras excluir al recién nacido con síndrome de Potter, fue de 225. Las madres de la mayoría de los pacientes (83,6 %; n=188) recibieron tratamiento con corticoides durante el periodo prenatal; en 24 % (n=54) de los casos, se administró un esquema incompleto (una dosis de betametasona), mientras que en 59,6 % (n=134) se administró el esquema completo (dos dosis). Por otra parte, solamente 13,3 % (n=30) de los pacientes recibió tratamiento con corticoides durante el periodo posnatal (dexametasona sistémica).
Resultados del tratamiento
En el cuadro 1 se presentan los tres grupos en que se dividió a los pacientes según si habían recibido el tratamiento durante el periodo prenatal o no, y si el esquema había sido completo o incompleto. Los grupos fueron similares en cuanto al peso al nacer y la edad de gestación, siendo algo más inmaduros y más pequeños aquellos que no recibieron el tratamiento en el periodo prenatal, aunque dicha diferencia no tuvo significación estadística (edad de gestación media: 28,4 semanas sin tratamiento en periodo prenatal Vs. 28,5 con esquema incompleto Vs. 28,9 con esquema completo). No se observaron diferencias estadísticamente significativas entre los distintos grupos en cuanto al número de días de administración de oxígeno y con presión positiva continua o respiración mecánica invasiva.
Cuadro 1 Análisis descriptivo de variables en los grupos divididos según si recibieron el esquema completo de corticoides en el periodo prenatal o el incompleto
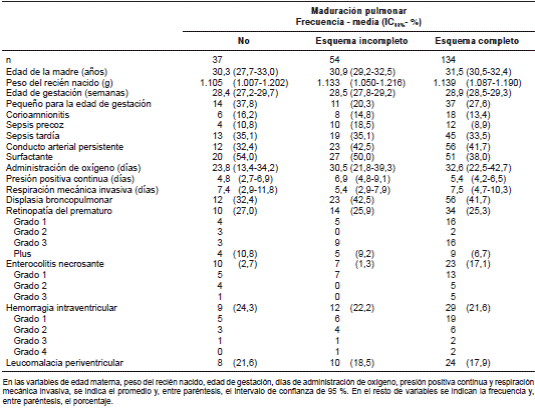
Desde el punto de vista de las infecciones, los pacientes expuestos al tratamiento en el periodo prenatal tuvieron una incidencia de corioamnionitis y de sepsis precoz o tardía similar a la de los no expuestos (13,4 Vs. 16,2; 8,9 Vs. 10,8; 33,5 Vs. 35,1, respectivamente, sin diferencias estadísticamente significativas). Tampoco, se registraron diferencias estadísticamente significativas entre los grupos en cuanto a los casos de retinopatía del prematuro, hemorragia intraventricular, leucomalacia periventricular y enterocolitis necrosante.
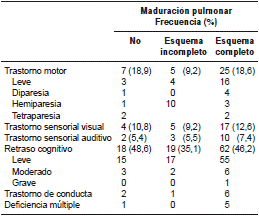
El seguimiento neurológico se llevó a cabo en el 86,2 % (n=194) de los pacientes, ya que 31 de ellos murieron (cuadro 2). No se encontraron diferencias estadísticamente significativas en cuanto a los resultados neurológicos entre los distintos grupos analizados.
Cuadro 2 Resultados neurológicos según si los participantes recibieron esquema completo o incompleto de corticosteroides en el periodo prenatal
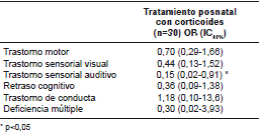
En el cuadro 3 se evidencia que, tras el análisis de regresión logística ajustado, en el cual se utilizaron como variables de ajuste la sepsis, el conducto arterial persistente, la edad de gestación y la categoría de “pequeño para la edad de gestación”, el tratamiento con corticoides en el periodo prenatal no se asoció con un mayor número de trastornos neurológicos en quienes recibieron el tratamiento comparados con quienes no lo recibieron, independientemente de si el esquema era completo o incompleto. En el cuadro 4 se consignaron los resultados en el neurodesarrollo tras el tratamiento con corticosteroides en el periodo posnatal y, con el ajuste por las mismas variables clínicas que aparecen en el cuadro 2, no se evidenciaron diferencias significativas, salvo en el caso del trastorno sensorial auditivo (OR=0,15; p<0,05).
Cuadro 3 Resultados del análisis de regresión logística para los trastornos neurológicos registrados tras recibir tratamiento con corticoides en el periodo prenatal

Discusión
Sin menospreciar el tamaño reducido de la muestra del estudio, los resultados obtenidos no evidenciaron una asociación entre los efectos adversos en el neurodesarrollo y el tratamiento con corticoides en el periodo prenatal o en el posnatal a partir de la semana de vida.
En los resultados presentados en el cuadro 1, llama la atención que aquellos recién nacidos cuyas madres no recibieron tratamiento en el periodo prenatal precisaron un número similar de días de administración de oxígeno, de presión positiva continua y de asistencia respiratotria mecánica, y presentaron una morbilidad parecida por condiciones como la displasia broncopulmonar, el conducto arterial persistente, la hemorragia intraventricular y la retinopatía del prematuro. Una posible explicación sería que, a partir del 2010 y durante los cinco años del estudio, se implantaron nuevas modalidades de asistencia respiratoria con volumen garantizado, y hubo algunas modificaciones en cuanto a la nutrición, el uso del surfactante y la cafeína. Por lo tanto, sería recomendable dividir a los pacientes en dos grupos en función del año de ingreso, para poder valorar mejor estos resultados. Con respecto a la enterocolitis necrosante, también llamó la atención su aumento (17,1 %) en los recién nacidos que recibieron tratamiento para la maduración pulmonar completa, lo cual podría responder al efecto de otras variables como la edad de gestación y el tipo de nutrición, por lo que sería interesante utilizarlas como variables de ajuste para poder sacar conclusiones.
En cuanto al tratamiento con corticoides después de la primera semana de vida, en los artículos de referencia se encontraron discrepancias sobre si la dexametasona produce o no alteraciones en el neurodesarrollo. En el estudio de Stark, et al., al igual que en este, se observó que la incidencia de muerte o de alteraciones en el neurodesarrollo entre los 18 y los 22 meses de edad en una cohorte de recién nacidos con extremo bajo peso, tratados de forma precoz con dexametasona para la prevención de la enfermedad pulmonar crónica, era similar a la del grupo placebo, aunque debe tenerse en cuenta que un porcentaje considerable de pacientes del grupo placebo fue tratado con corticoides en algún momento durante su hospitalización 18.
Por su parte, Cheong, et al., no registraron cambios en la tasa de parálisis cerebral infantil ni en la de discapacidad a los dos años de edad en recién nacidos con extremo bajo peso al nacer, a pesar de las mejoras en la respiración mecánica asistida y de la disminución significativa en el uso de corticoides en el periodo posnatal, entre 1991 y 2005 7. En un ensayo clínico aleatorio y controlado con placebo se evidenció que el tratamiento con dexametasona de los 15 a los 25 días de vida durante 42 días disminuía el riesgo de displasia broncopulmonar en recién nacidos de muy bajo peso y no incrementaba el riesgo combinado de muerte o alteración mayor en el neurodesarrollo 19. Por el contrario, Needelman, et al., comprobaron que la dexametasona se asociaba con resultados adversos en el neurodesarrollo en recién nacidos con muy bajo peso, por lo cual concluyeron que debería emplearse únicamente en neonatos de alto riesgo y durante el menor tiempo posible 20.
Es lógico pensar que cuanto mayor sea la dosis de corticoides, más elevado es el riesgo de presentar un trastorno en el neurodesarrollo. Wilson-Costello, et al., encontraron que cada incremento de 1 mg/kg por dosis de corticoides se asociaba con una reducción de dos puntos en el índice de desarrollo mental y con un aumento del riesgo de parálisis cerebral infantil en una cohorte de recién nacidos con muy bajo peso al nacer evaluados entre los 18 y los 22 meses de edad corregida 21. En otro estudio, Lim, et al., no encontraron diferencias en cuanto a daños en el neurodesarrollo entre el grupo de recién nacidos de muy bajo peso tratados con dexametasona y el grupo de control, aunque en el subgrupo de pacientes tratados con dexametasona las dosis acumuladas de más de 5 mg/kg sí se relacionaron con peores resultados en el neurodesarrollo 22.
Sin embargo, a diferencia de lo que cabría esperar, en la revisión sistemática de Onland, et al., las dosis altas acumuladas de dexametasona, administradas después de la primera semana de vida, disminuyeron el riesgo de displasia bronco-pulmonar, sin incrementar el riesgo de secuelas en el neurodesarrollo en prematuros con respiración mecánica asistida; incluso en aquellos casos en los que el tratamiento se inició entre los 7 y 14 días de vida, el riesgo de muerte o de parálisis cerebral infantil decreció en 6,2 % y el riesgo de un índice de desarrollo mental inferior a -2 desviaciones estándar decreció en 6,6 % por cada incremento en mg/kg de la dosis acumulada de dexametasona 23. En el metaanálisis de Onland, et al., tras comparar las dosis altas de dexametasona (>2,7 mg/kg) con las bajas (≤2,7 mg/kg), se observó que la dosis de dexametasona no afectaba la tasa de muerte y de alteraciones en el neurodesarrollo, aunque las dosis altas eran más efectivas que las bajas para reducir la aparición de displasia broncopulmonar 24.
Debe tenerse en cuenta que, en el presente estudio, las dosis de dexametasona fueron bajas (≤0,075 mg/kg), lo cual puede explicar los resultados obtenidos. Podemos concluir que la información actual es insuficiente para hacer recomendaciones sobre las dosis y el tipo de corticoide más indicado, aunque en el caso de este estudio tuvo interés para el análisis de los resultados 25,26.
Al igual que ocurre con los corticoides en el periodo posnatal, diversos autores han expresado la sospecha de que su administración durante el periodo prenatal también podría asociarse con alteraciones en el neurodesarrollo a largo plazo. Por el contrario, en la revisión sistemática de Sotiriasis, et al., se concluyó que el esquema único de corticoides en el periodo prenatal en mujeres con alto riesgo de parto prematuro parece mejorar los resultados en el neurodesarrollo de los recién nacidos con menos de 34 semanas de gestación 27.
Por otro lado, Miyazaki, et al., encontraron que el tratamiento con corticoides en el periodo prenatal se asoció significativamente con una reducción en la mortalidad durante los tres primeros años de vida en los recién nacidos con muy bajo peso que presentaron corioamnionitis histológica, aunque no hallaron cambios en los resultados del neurodesarrollo en comparación con los no tratados 28. Eriksson, et al., observaron que los prematuros de 24 a 34 semanas cuyas madres habían sido tratadas con corticoides en el periodo prenatal tenían menor riesgo de síndrome de dificultad respiratoria, muerte neonatal tardía, displasia broncopulmonar, retinopatía del prematuro, hemorragia intraventricular y parálisis cerebral infantil, sin que se registrara un aumento del riesgo de alteraciones neurosensoriales a largo plazo, aunque sí observaron un aumento en la tasa de epilepsia en varones 29. Wong, et al.30, evidenciaron que los prematuros de menos de 29 semanas cuyas madres habían sido tratadas con un esquema completo de corticoides en el periodo prenatal presentaban tasas de supervivencia más elevadas y tasas más bajas de hemorragia intraventricular y enterocolitis necrosante, en comparación con los expuestos al esquema incompleto o con quienes no recibieron tratamiento. Estos autores no observaron diferencias significativas en los resultados en el neurodesarrollo en los niños de dos a tres años de edad.
En el estudio de Chawla, et al.31, se observó que el esquema completo de corticoides en el periodo prenatal en una cohorte de recién nacidos con muy bajo peso se asoció con un incremento en la supervivencia sin consecuencias neurológicas de los 18 a los 22 meses de edad, es decir, aquella supervivencia sin parálisis cerebral infantil, ceguera, sordera o retraso cognitivo, en comparación con aquellos no expuestos o que habían recibido el esquema incompleto. En el presente estudio, no se pudieron demostrar diferencias en los resultados en el neurodesarrollo entre el esquema completo y el incompleto.
En otros estudios se ha comparado la betametasona con la dexametasona en el periodo prenatal. En el estudio de Lee, et al.32, se compararon los resultados adversos en el desarrollo neurológico a la edad corregida de 18 a 22 meses en recién nacidos con muy bajo peso al nacer no expuestos a corticoides o expuestos a dexametasona o betametasona en el periodo prenatal. Se evidenció que aquellos expuestos a betametasona tenían mayores probabilidades de un neurodesarrollo normal y menor riesgo de pérdida de audición, en comparación con los no expuestos a corticoides o aquellos que recibieron dexametasona. En la revisión de Cochrane de 2013 33, se evidenció que la dexametasona en el periodo prenatal podía tener algunos beneficios en comparación con la betametasona, tales como menor probabilidad de hemorragia intraventricular y menor tiempo de hospitalización en la unidad de cuidados intensivos neonatales; no obstante, aún no está claro si un corticoide (o esquema) tiene ventajas sobre otro.
La principal debilidad del presente estudio es que se trató de una muestra pequeña, especialmente la del grupo de recién nacidos que recibieron corticoides durante el periodo posnatal (solo 30), por lo cual se requiere mucha prudencia al interpretar los resultados.
Aunque los resultados de este estudio coinciden con lo reportado en otros, sería conveniente ampliar el periodo de seguimiento y el tamaño de la muestra, comparar diversos corticoides entre sí y estudiar otras vías de administración, como por inhalación, antes de adelantar conclusiones definitivas.
Teniendo en cuenta las limitaciones del estudio ya mencionadas, se puede concluir que el tratamiento con corticoides en el periodo prenatal y en el posnatal a partir de la semana de vida, no se asoció con peores resultados en el neurodesarrollo de la cohorte estudiada de recién nacidos de muy bajo peso.