Los mosquitos constituyen uno de los grupos de insectos de mayor importancia médica y veterinaria, pues sirven de vectores de agentes patógenos (1). Aedes aegypti (L) y Culex quinquefasciatus Say son dos de las especies más comunes en los ecosistemas urbanos y están estrechamente asociadas al hombre, quien les ofrece las condiciones adecuadas para su proliferación: refugio, criaderos y alimento.
Aedes aegypti se encuentra en las regiones tropicales y subtropicales del mundo, aunque también en zonas templadas (2). En Argentina, el mosquito es de amplia distribución: desde el norte del país hasta la provincia de Neuquén (3).
Entre los arbovirus presentes en Argentina y transmitidos por A. aegypti, pueden mencionarse los Flavivirus del dengue (DENV), la fiebre amarilla (YFV) y el Zika (ZIKV), y el Alfavirus del chikungunya (CHIKV); estos dos últimos circulan desde 2015 y 2016, respectivamente (4-7).
El dengue se presenta en zonas urbanas y semiurbanas, y en algunos países asiáticos y latinoamericanos; causa la forma grave de la enfermedad e incluso la muerte en menores (8). En el 2015 se notificaron 2.350.000 casos tan solo en la región de las Américas, de los cuales más de 10.200 se diagnosticaron como dengue grave y provocaron 1.181 defunciones. En Argentina, la reaparición del dengue se registra desde 1998. Según los datos epidemiológicos publicados en abril de 2016, en los últimos siete años los casos autóctonos se han incrementado en 70 % (9).
En cuanto a C. quinquefasciatus, este transmite el virus de la encefalitis de Saint Louis (SLEV), el cual se distribuye ampliamente en las Américas, y en Argentina abarca zonas subtropicales y templadas (10). Según los datos de las pruebas serológicas, la especie se ha detectado en provincias del centro y el noroeste, y en el sur hasta la provincia de Río Negro (11). Desde el 2002, se ha registrado su reaparición como agente etiológico de encefalitis en humanos en el cono sur del continente (11,12). En Argentina, el brote más grande ocurrió en la provincia de Córdoba en el 2005, con 48 casos y nueve defunciones. En el 2011 se produjo un brote en la ciudad de San Juan y, posteriormente, se registraron otros brotes en la provincia de Buenos Aires y en provincias del norte y del litoral se detectaron algunos casos aislados (13).
Culex quinquefasciatus también es transmisor del virus del Nilo Occidental (WNV) en Argentina (Bornancini V, Estallo E, Batallán G, Grech M, Visintín A, Frías-Céspedes M, et al. Variables ambientales satelitales y su relación con la abundancia de las especies de mosquitos (Diptera: Culicidae) sanitariamente más importantes de la ciudad de Córdoba, Argentina. IX Jornadas Regionales de Mosquitos. Universidad Nacional del Nordeste. 4 - 5 de septiembre de 2014. Resistencia, Chaco); este virus se aisló por primera vez en nuestro país en el 2006, lo cual correspondió al primer registro en Suramérica (14). Durante el 2006 y el 2007, se detectaron casos humanos de encefalitis en los cuales se confirmó serológicamente el WNV como el agente etiológico (14).
El control de los mosquitos vectores implica el uso excesivo de sustancias químicas que, además del riesgo de toxicidad que supone para el ser humano y los animales, ha provocado la aparición de resistencia, la eliminación de los controladores naturales del vector y la contaminación del entorno (15). Por estas razones, en las últimas décadas se ha trabajado en la búsqueda de nuevos métodos de control que sean más seguros ambientalmente, entre ellos, el uso de agentes biológicos (15).
Los llamados nematodos ‘entomopatógenos’ son parásitos obligados de insectos. Su ciclo biológico incluye la fase de huevo, cuatro estadios juveniles y el adulto. Únicamente los ejemplares juveniles infectivos, que corresponden al tercer estadio larval, se desarrollan fuera del insecto y sobreviven en el medio hasta que localizan un huésped (16,17). La presencia de un solo espécimen juvenil infectivo dentro del huésped causa su muerte en las 48 horas posteriores al contacto mediante la liberación de una bacteria simbionte que transportan en su intestino. Dado su efecto letal, comparable al de un insecticida químico, constituyen una alternativa interesante como agentes de control biológico (16,18).
En Argentina y en otras regiones del mundo, se han llevado a cabo estudios para evaluar la actividad larvicida de los nematodos entomopatógenos contra A. aegypti (19,20) y Culex pipiens (21). En Argentina, las pruebas de parasitismo y capacidad infecciosa se han hecho con distintas especies autóctonas de nematodos y mosquitos (22,23). Se ha encontrado que Steinernema rarum (OLI) es un eficaz agente de control de larvas de A. aegypti (Cagnolo SR, Rivero ME, Almirón WR. Susceptibilidad de larvas de Aedes aegypti (Diptera: Culicidae) al parasitismo por Steinernema rarum (OLI) (Nematoda:Steinernematidae), en condiciones de laboratorio. Nematropica. 2007;37:142. Resúmenes de la XXXIX Reunión Anual de Onta. 29 de octubre-2 de noviembre, Villa Carlos Paz, Córdoba, Argentina); contra C. quinquefasciatus (Cagnolo S, Almirón WR. Susceptibilidad de larvas de Culex quinquefasciatus al parasitismo por Steinernema rarum (Nematoda:Steinernematidae) en condiciones de laboratorio. V Jornadas Regionales sobre Mosquitos. La Plata; 2007), y contra C. apicinus (24). Por su parte, Heterorhabditis bacteriophora N116 parasita larvas de A. aegypti (20). No se han hecho pruebas contra C. quinquefasciatus con ningún espécimen nativo del género Heterorhabditis y, si bien se conoce la sensibilidad de estos mosquitos al parasitismo, en algunos casos se ha observado la melanización del nematodo como reacción de defensa del insecto (20,21).
Aún hay mucho que explorar en este campo si se tienen en cuenta las diferencias intraespecíficas que pueden afectar la capacidad infecciosa de los nematodos entomopatógenos, y que estarían relacionadas con su comportamiento (25), con el insecto y con factores ambientales (26).
En este sentido, los objetivos del presente estudio fueron: 1) determinar y comparar los porcentajes de parasitismo y las DL50 de H. bacteriophora N4 en C. quinquefasciatus y A. aegypti, y 2) constatar el desarrollo y la reproducción de los nematodos dentro de los insectos huéspedes con las diferentes dosis y determinar la aparición de la melanización como reacción inmunitaria de los insectos al parasitismo.
Materiales y métodos
Multiplicación del nematodo y dosis utilizadas
Se utilizó el aislamiento N4 de H. bacteriophora, detectado en el barrio Cerro de las Rosas de Córdoba, provincia de Córdoba, Argentina (Cagnolo SR, Carranza F. Ocurrence of entomopathogenic nematodos in private properties in Córdoba Capital City, Argentina. Nematropica. 2007;37:142. Resúmenes de la XXXIX Reunión Anual de Onta. 29 de octubre-2 de noviembre, Villa Carlos Paz, Córdoba, Argentina). Dicho aislamiento se mantiene en cultivo permanente en la Cátedra de Parasitología de la Facultad de Ciencias Exactas, Físicas y Naturales de la Universidad Nacional de Córdoba.
Para la multiplicación del nematodo, se emplearon técnicas convencionales y, como huéspedes auxiliares, se utilizaron larvas de la polilla de la cera Galleria mellonella (Insecta: Lepidoptera) (27). En los experimentos se usaron especímenes juveniles infectivos que no superaban los 30 días de almacenamiento desde la fecha de aparición del huésped auxiliar.
Obtención de las larvas de mosquitos
Los ejemplares de A. aegypti se obtuvieron del Centro de Investigaciones Entomológicas de Córdoba (CIEC) de la Facultad de Ciencias Exactas, Físicas y Naturales de la Universidad Nacional de Córdoba. La colonia se mantuvo en el laboratorio con las técnicas convencionales (28).
Las hembras se alimentaron semanalmente en una rata Rattus norvegicus, procedimiento aprobado por el Comité Institucional para el Cuidado y Uso de Animales de Laboratorio, CICUAL (Resolución Nº. 571-HCD- 2014, Acta Nº 13- 2016), de la Facultad de Ciencias Exactas, Físicas y Naturales de la Universidad Nacional de Córdoba.
Los ejemplares de C. quinquefasciatus utilizados también provenían del CIEC. En el marco de las actividades del programa de vigilancia de la encefalitis de Saint Louis en Córdoba, se recolectaron larvas de mosquitos en criaderos ubicados en distintos puntos de la ciudad, cuya especie se determinó en el laboratorio. Los ejemplares de C. quinquefasciatus se criaron bajo condiciones similares a las utilizadas para A. aegypti, excepto que las hembras se alimentaron en una codorniz Coturnix coturnix, procedimiento también aprobado por el Comité Institucional para el Cuidado y Uso de Animales de Laboratorio, CICUAL (Resolución Nº 571-HCD- 2014, Acta Nº 13 -2016) de la Facultad de Ciencias Exactas, Físicas y Naturales de la Universidad Nacional de Córdoba.
Experimentos de infección
Las infecciones se llevaron a cabo colocando 30 larvas de mosquito de segundo estadio en bandejas provistas de 80 ml de agua sin cloro y la cantidad adecuada de nematodos en dosis de 0:1, 1:1, 5:1, 15:1, 100:1, 500:1, 750:1 y 1.500:1 especímenes juveniles infectivos por larva de mosquito. Dichas dosis se obtuvieron mediante las técnicas convencionales (27).
Se hicieron cuatro réplicas por dosis en cada especie de mosquito. Las bandejas se mantuvieron a una temperatura entre 25 y 28 °C, con alternancia de 12 horas en los períodos de luz y oscuridad. Las larvas de mosquito se alimentaron diariamente agregando al medio 0,25 mg de hígado en polvo por larva.
Cada 24 horas se hicieron observaciones bajo el estereomicroscopio para registrar la muerte de las larvas de mosquito. El período de observación se extendió hasta el estado de pupa. Las larvas muertas fueron transferidas individualmente a placas de 24 celdas (Falcon Nº 3047) y se siguió su evolución por siete días más, observando la transparencia de la cutícula, con el fin de registrar el desarrollo y la reproducción de los nematodos dentro del insecto huésped. Transcurridos los siete días, se disecaron los insectos muertos en cuyo interior no se observaron nematodos por transparencia para verificar si había parasitismo.
Con cada una de las dosis se registraron el número de larvas parasitadas, los estadios larvales en los que se observó parasitismo, el número total de nematodos en las larvas, el número de nematodos que alcanzaron el estado adulto, y los nematodos ‘melanizados’. Se calculó la dosis letal 50 (DL50) para cada especie de insecto.
Análisis de los datos
Para detectar diferencias significativas en las variables evaluadas, se hizo un análisis de varianza (ANOVA) de un factor. Las medias se compararon mediante la prueba de de diferencia mínima significativa (Least Significant Difference, LSD) de Fisher en cada especie.
Cuando los datos no siguieron una distribución normal, se aplicó una transformación logarítmica (log10 (x+1)). La DL50 se calculó tomando el logaritmo (log10 (x+1)) de las dosis y los valores del análisis probit de las proporciones de mortalidad. Posteriormente, se hizo un análisis de regresión lineal. Los análisis estadísticos se efectuaron con el programa InfoStat, versión 2013 (29).
Resultados
Parasitismo y dosis letal 50 (DL50 ) en larvas de Culex quinquefasciatus y Aedes aegypti
En ambas especies de mosquitos, la mortalidad larval se detectó a las 24 horas del contacto. Los mayores porcentajes de mortalidad en C. quinquefasciatus se observaron entre el cuarto y el quinto día (22 y 24 %), y en A. aegypti, entre el segundo y el tercero (28 y 41 %) (figura 1).

Figura 1 Evolución del parasitismo (± error estándar) en larvas de Culex quinquefasciatus y Aedes aegypti en función de los días de exposición a las diferentes dosis de Heterorhabditis bacteriophora aplicadas
Los valores de parasitismo oscilaron entre 2,5 y 80 % en C. quinquefasciatus y entre 4,2 y 92,5 % en A. aegypti, con las dosis de 1:1 y 1.500:1, respectivamente. En C. quinquefasciatus se registró mortalidad en todas las dosis y, a partir de la dosis de 100:1, los porcentajes superaron el 50%. En A. aegypti no se registró muerte por nematodos con la dosis de 5:1 (figura 2). En ambas especies de mosquitos, los porcentajes de mortalidad se incrementaron a partir de la dosis de 100:1, registrándose diferencias significativas entre esta y las superiores (FC. quinquefasciatus =82,77; gl=7; p<0,0001) (FA. aegypti = 316,22; gl=7; p<0,0001) (figura 2). Los valores de DL50 fueron de 160,8 especímenes juveniles infectivos por larva para C. quinquefasciatus y de 113,6 especímenes juveniles infectivos por larva para A. aegypti (figura 3a y3b).
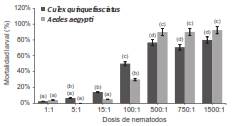
Figura 2 Porcentaje (± error estándar) de mortalidad de larvas de Culex quinquefasciatus y Aedes aegypti en función de las dosis de nematodos aplicadas. Las letras en las barras indican diferencias significativas (p=0,05)
Parasitismo en los diferentes estadios larvales
En las dos especies de mosquitos, los estadios larvales II, III y IV resultaron parasitados por H. bacteriophora N 4 . Independientemente de la dosis aplicada, el tercer estadio presentó los porcentajes más altos de parasitismo, difiriendo significativamente de los estadios restantes (FC. quinquefasciatus = 14,58; gl=2; p<0,0001) y (FA. aegypti =12,58; gl=2; p<0,0001) (cuadro 1).
Desarrollo y reproducción de Heterorhabditis bacteriophora dentro de Culex quinquefasciatus y Aedes aegypti
El porcentaje de larvas parasitadas en las cuales se hallaron nematodos adultos fue mayor en A. aegypti que en C. quinquefasciatus (17 % Vs. 2 %). En esta última especie, solo se observaron nematodos adultos con la dosis de 1.500:1, en tanto que, en A. aegypti, se observaron con todas las dosis superiores a 5:1.
Las disecciones demostraron diferencias en el desarrollo de los nematodos según las dosis. En ambas especies se encontraron individuos adultos con dosis superiores a 5:1, y los valores más altos se registraron a partir de la dosis de 500:1 (FC. quinquefasciatus = 14 , 36 ; gl=7; p<0,0001 ) (FA. aegypti =156,39; gl=7; p<0,0001) (cuadro 2). En C. quinquefasciatus, entre 4 y 6 % de los especímenes juveniles infectivos se desarrollaron a hembras hermafroditas y, en A. aegypti, entre 12 y 61 %.
Cuadro 2 Número promedio (± error estándar) de nematodos adultos*, especímenes juveniles infectivos ‘melanizados’ y número total de nematodos en el interior de larvas de Culex quinquefasciatus y Aedes aegypti con las distintas dosis
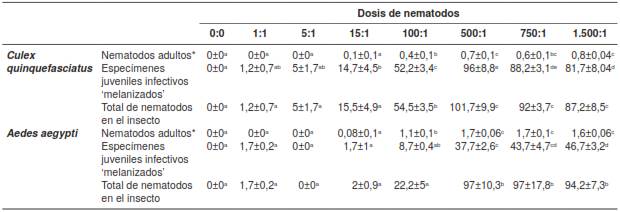
Las letras en superíndice indican diferencias significativas (p<0,05). * log 10 (número de nematodos adultos +1)
Al final del ciclo parasitario, se constató la aparición de nuevos especímenes juveniles infectivos en el cadáver de los dípteros con las dosis de 100:1, 500:1, 750:1 y 1.500:1 en A. aegypti y únicamente con la dosis de 1.500:1 en C. quinquefasciatus (figura 4a).

Figura 4 a. Especímenes juveniles infectivos al final del ciclo parasitario en una larva de mosquito. b. Especímenes juveniles infectivos ‘melanizados’ en el tórax de una larva de mosquito
En ambas especies de mosquitos se registraron casos de reacción inmunitaria evidenciada por la presencia de individuos ‘melanizados’ (figura 4b), pero en todos los casos, incluso cuando el nematodo resultó ‘melanizado’, el huésped murió.
En C. quinquefasciatus, el 84 % de las larvas parasitadas presentó especímenes juveniles infectivos ‘melanizados’ en su interior y los mayores porcentajes se registraron con las dosis de 500:1 y 750:1 (cuadro 2). Se hallaron diferencias significativas entre las dosis (F=74,56; gl=7; p<0,0001). En A. aegypti, el 28 % de las larvas parasitadas mostraron especímenes juveniles infectivos ‘melanizados’, y los mayores porcentajes correspondieron a las dosis de 750:1 y 1.500:1 (cuadro 2). Hubo diferencias significativas entre las dosis (F=87,43; gl=7; p<0,0001).
En las dos especies de mosquitos, además de los especímenes juveniles infectivos ‘melanizados’, se observaron nematodos adultos. Los porcentajes de larvas de mosquitos en esta situación fueron de 14 y 55 % en C. quinquefasciatus y en A. aegypti, respectivamente. Se presentaron diferencias significativas en el número total de nematodos (nematodos adultos + especímenes juveniles infectivos ‘melanizados’) que ingresaron en el insecto según la dosis en C. quinquefasciatus (F=69,34; gl=7; p<0,0001) y en A. aegypti (F=35,95; gl=7; p<0,0001) (cuadro 2). A partir de la dosis de 500:1, se obtuvieron las mayores cantidades de nematodos en ambas especies.
El mayor porcentaje de especímenes juveniles infectivos ‘melanizados’ se registró en el tórax de las larvas de C. quinquefasciatus, lo cual difirió significativamente del resto de las regiones corporales (F=20,37; gl=3; p<0,0001) (figura 5), en tanto que en A. aegypti, los mayores porcentajes se encontraron en el tórax y el abdomen, observándose diferencias significativas entre estas regiones corporales y las demás (F=11,53; gl=3; p<0,0001) (figura 5).
Discusión
Los resultados de este trabajo evidenciaron que C. quinquefasciatus y A. aegypti son sensibles a diferentes dosis de H. bacteriophora N4 en condiciones de laboratorio. La muerte de las larvas ocurrió a partir de las 24 horas del contacto con los nematodos con las tres dosis más altas. La mortalidad larval superó el 70 % en ambos huéspedes y se incrementó con el aumento de la dosis. En A. aegypti, los mayores porcentajes de parasitismo se alcanzaron en menor tiempo.
Los porcentajes de mortalidad obtenidos con C. quinquefasciatus fueron inferiores a los de otro estudio en Egipto con H. bacteriophora (96 %), aunque en aquel se utilizó una dosis menor (300 especímenes juveniles infectivos por larva) a las del presente trabajo (30). En un estudio en Estados Unidos, se obtuvo 100 % de parasitismo en larvas de C. pipiens (21) empleando una dosis muy superior (6.000 especímenes juveniles infectivos por larva) de H. bacteriophora.
En ensayos realizados en Argentina, no se registró parasitismo en C. pipiens ni C. saltanensis con dos aislamientos autóctonos de H. bacteriophora, uno de Río Negro y otro de Río Cuarto, con dosis de 500 y 1.000 especímenes juveniles infectivos por larva, respectivamente (22,23). En otros experimentos con C. quinquefasciatus y Steinernema rarum (OLI) en Córdoba, se observó también un incremento en la mortalidad larval al aumentar la dosis, con un porcentaje mayor (89 %) con las dosis más altas empleadas en este trabajo (Cagnolo S, Almirón WR.
Susceptibilidad de larvas de Culex quinquefasciatus al parasitismo por Steinernema rarum (Nematoda:Steinernematidae) en condiciones de laboratorio.
V Jornadas Regionales sobre Mosquitos. La Plata; 2007) y un porcentaje similar (75 %) en C. apicinus con una dosis menor (400 especímenes juveniles infectivos por larva) (24).
En contraste con los resultados de este trabajo, los valores de mortalidad de C. quinquefasciatus no superaron el 7 % con S. carpocapsae y S. feltiae provenientes de El Cairo en dosis entre 50 y 300 especímenes juveniles infectivos por larva (30). Los resultados en A. aegypti evidenciaron la misma tendencia que los obtenidos con otros aislamientos de H. bacteriophora N116 y S. rarum (OLI) de Córdoba, en los cuales la mortalidad se incrementó con el aumento de la dosis (Cagnolo SR, Rivero ME, Almirón WR. Susceptibilidad de larvas de Aedes aegypti (Diptera: Culicidae) al parasitismo por Steinernema rarum (OLI) (Nematoda: Steinernematidae), en condiciones de laboratorio. Nematropica. 2007;37:142. Resúmenes de la XXXIX Reunión Anual de Onta. 29 de octubre-2 de noviembre, Villa Carlos Paz, Córdoba, Argentina) (20).
Las variaciones en los porcentajes de mortalidad obtenidos con los distintos aislamientos reflejarían diferencias intraespecíficas. Como se sabe, si bien los nematodos entomopatógenos poseen un amplio rango de huéspedes, distintos aislamientos pertenecientes a una misma especie pueden diferenciarse entre sí en cuanto a su capacidad infecciosa, lo cual probablemente estaría relacionado con su comportamiento (25), con la sensibilidad del insecto y con factores ambientales (26).
En este trabajo se obtuvo una DL50 más baja para A. aegypti que la obtenida para C. quinquefasciatus, lo cual indicaría una mayor virulencia de este aislamiento en A. aegypti. Se han obtenido valores de DL50 similares a los de este trabajo para C. quinquefasciatus con los aislamientos de H. bacteriophora (121,5 especímenes juveniles infectivos por larva) y H. indica (141,7 especímenes juveniles infectivos por larva) (30). Por el contrario, se obtuvieron valores inferiores de DL50 con H. bacteriophora (80 especímenes juveniles infectivos por larva) y en larvas de tercer y cuarto estadio con C. pipiens (63 especímenes juveniles infectivos por larva) (21). Por otro lado, la DL50 obtenida en este trabajo para A. aegypti difiere con lo registrado con H. heliothidis (141 especímenes juveniles infectivos por larva) y con S. feltiae (1,26 especímenes juveniles infectivos por larva) en este mismo díptero (19).
La mortalidad de las larvas de mosquitos, independientemente de la dosis, resultó mayor en el tercer estadio de desarrollo en las dos especies de huéspedes. En otros estudios se han obtenido resultados similares (19,20,21,24,30). Por el contrario, en un experimento con S. rarum (OLI), los mayores porcentajes de mortalidad en A. aegypti correspondieron a las larvas de segundo estadio (Cagnolo SR, Rivero ME, Almirón WR. Susceptibilidad de larvas de Aedes aegypti (Diptera: Culicidae) al parasitismo por Steinernema rarum (OLI) (Nematoda: Steinernematidae), en condiciones de laboratorio. Nematropica. 2007;37:142. Resúmenes de la XXXIX Reunión Anual de Onta. 29 de octubre-2 de noviembre, Villa Carlos Paz, Córdoba, Argentina). Las diferencias en la mortalidad según el estadio podrían atribuirse al hecho de que los nematodos son desechados como alimento en los estadios larvales tempranos del mosquito debido a su tamaño; en el caso de las larvas de segundo estadio, se ha sugerido que la pequeña abertura oral que poseen no les permitiría ingerir los nematodos enteros, sino que los triturarían con sus dientes mandibulares, causándoles la muerte (21). Los estadios larvales mayores podrían, por el contrario, ingerir los nematodos sin dañarlos, lo que resultaría en una mayor sensibilidad a la infección (21,31).
El engrosamiento de la pared cuticular en los estadios larvales más jóvenes de los mosquitos es reducido. Los especímenes juveniles infectivos de Heterorhabditis poseen una estructura cefálica que les permite perforar dicha pared, por lo que la penetración a través de la cutícula de los insectos representa una vía adicional de ingreso por las aberturas naturales (32). En este sentido, se ha señalado que los nematodos podrían ingresar en las larvas de segundo estadio por esta vía y provocar la muerte en los estadios posteriores mediante la proliferación de la bacteria simbionte (20).
En la presente investigación se evidenció que los estadios infectivos de H. bacteriophora N4 son capaces de ingresar a la cavidad del cuerpo de las larvas de ambas especies huéspedes y desarrollarse exitosamente, produciendo una nueva generación de especímenes juveniles infectivos. El número de nematodos adultos registrados fue mayor en A. aegypti con todas las dosis. Asimismo, la generación de nuevos especímenes juveniles infectivos al finalizar el ciclo parasitario, se observó a partir de la dosis de 100:1 en A. aegypti y solo en la dosis más alta en C. quinquefasciatus, lo cual coincide con lo registrado en otros trabajos (Cagnolo S, Almirón WR.
Susceptibilidad de larvas de Culex quinquefasciatus al parasitismo por Steinernema rarum (Nematoda:Steinernematidae) en condiciones de laboratorio.V Jornadas Regionales sobre Mosquitos. La Plata; 2007) (20,24).
El mecanismo de melanización fue mucho más fuerte en C. quinquefasciatus, pues la mayoría de los nematodos que ingresaron a las larvas se ‘melanizaron’ con todas las dosis. En ambas especies la reacción defensiva se incrementó a medida que aumentó el número de nematodos que ingresaron en el cuerpo de los dípteros. Esto coincide con lo observado en A. aegypti con H. bacteriophora N116 (20) y con S. rarum (Cagnolo SR, Rivero M, Almirón WR. Respuesta inmunitaria de Aedes aegypti (Diptera: Culicidae) al parasitismo por nematodos entomopatógenos (Nematoda: Steinernematidae). 5º Jornadas Regionales sobre Mosquitos. Facultad de Ciencias Naturales y Museo de La Plata. 4-5 de octubre de 2007. La Plata, Buenos Aires.). En C. quinquefasciatus se observaron resultados similares con S. carpocapsae y S. feltiae, pues la mayoría de los nematodos no pudieron desarrollarse en las larvas del mosquito y fueron ‘melanizados’ (30). Por el contrario, en ensayos realizados en A. aegypti con los nematodos H. heliothidis y S. feltiae, se observó que la reacción de melanización disminuyó al aumentar la cantidad de nematodos en el interior de las larvas (19). En C. quinquefasciatus el mayor porcentaje de especímenes juveniles infectivos ‘melanizados’ se observó en el tórax de las larvas, y en A. aegypti en el tórax y el abdomen, en concordancia con lo registrado con el aislamiento de Heterorhabditis N116 (20). Con S. rarum (OLI), los especímenes juveniles infectivos ‘melanizados’ se observaron principalmente en el abdomen de las larvas de A. aegypti (Peschiutta ML, Cagnolo S, Almirón WR. Respuesta inmune de Aedes aegypti (Diptera: Culicidae) al parasitismo de Heterorhabditis sp. (Nematodo: Heterorhabditidae. V Congreso Argentino de Parasitología. La Plata; 2009).
Los resultados obtenidos en este trabajo demuestran que H. bacteriophora N4 es capaz de matar a las larvas de las dos especies de mosquitos, aunque A. aegypti parecería ser más sensible que C. quinquefasciatus.
Los aislamientos de nematodos se consideran biotipos o razas que, en ocasiones, exhiben características biológicas significativamente diferentes (33), por lo cual se ha sugerido que con agentes autóctonos se lograría un mayor control biológico, dado que están ecológicamente adaptados al ambiente y a las plagas existentes en los ecosistemas donde se aplican (34).
La información obtenida en el presente estudio es importante porque demuestra la gran potencialidad de H. bacteriophora N4 como regulador biológico de larvas de A. aegypti y C. quinquefasciatus y, además, porque los ensayos se hicieron con un aislamiento autóctono, por lo cual sería interesante continuar la evaluación de dicho aislamiento en condiciones de campo, con el fin de determinar su capacidad infecciosa y su persistencia.

















